新人教版高中化学必修一《氧化钠和过氧化钠》教学课件
氧化纳和过氧化钠(课件)高一化学课件

过氧化钠的用途
1.强氧化剂(消毒、杀菌) 2. 常作漂白剂,漂白织物、麦秆、羽毛等。
3. 过氧化钠可在呼吸面具或潜水艇中作为氧气的来源。
呼 吸 面 具ຫໍສະໝຸດ 合提升思考讨论钠长期暴露在空气中会发生什么变化?
Na
O2
银白色
Na2O 变暗
H2O
思考讨论
过氧化钠的化学性质
问题
类比Na与H2O反应的分析方法及Na2O2与H2O反应的化学方程式,分析以 下问题。 (1)将适量Na2O2投入盐酸中,有什么现象。写出相应的化学方程式。
• 有气泡产生
• 2Na2O2+4HCl=4NaCl+2H2O+O2↑ (2)将适量Na2O2投入CuSO4溶液中,有什么现象。写出相应的化学方程式。
过氧化钠的化学性质
过氧化钠的化学性质
Na2O2属于碱性氧化物吗?从氧化还原反应的角度分析, Na2O2是否同 Na2O一样也能与水、CO2反应?产物是否相同?
-1
-2
-2
Na2O2 + H2O = 2NaOH
-1 -2
-2
Na2O2+CO2 =Na2CO3
Na2O2是过氧化物
过氧化钠的化学性质
1. Na2O2与H2O的反应
NaOH
变白色固体
H2O CO2 潮解表面 形成溶液
Na2CO3·10H2O 白色块状固体
风化 Na2CO3
白色粉末 状固体
课堂小结
阴阳离子组成及 个数比
氧元素化合价
物理性质 化 与H2O反应 学 与盐酸反应 性 质 与CO2反应
氧化性、漂白性
2.1.2氧化纳、过氧化钠 高一化学课件 人教版必修第一册

随堂演练
1、下列关于Na2O2的叙述中正确的是( D )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O B.Na2O2与水的反应中,Na2O2只做氧化剂 C.Na2O2属于碱性氧化物 D.Na2O2与CO2或H2O反应后,固体质量都将增大
随堂演练 2.过氧化钠具有强氧化性,可用作漂白剂。向紫色石蕊溶液中
加热钠,会产生过氧化钠:
Na2O2
Na2O
氧化纳、过氧化钠 氧化钠和氧化钙一样,属于碱性氧化物。请预测氧化钠能 与哪些物质发生反应。
碱性氧化物 H2O
碱
Na2O + H2O
2NaOH
酸性氧化物
酸
Na2O + CO2
Na2CO3
Na2O + 2HCl H2O + NaCl
预测过氧化钠与水反应会生成什么物质?
过氧化钠用途
⑴强氧化剂(消毒、杀菌) ⑵常作漂白剂,漂白织物、麦秆、羽毛等。
(3)过氧化钠可在呼吸面具或潜水艇中作为氧气的来源。
呼 吸 面 具
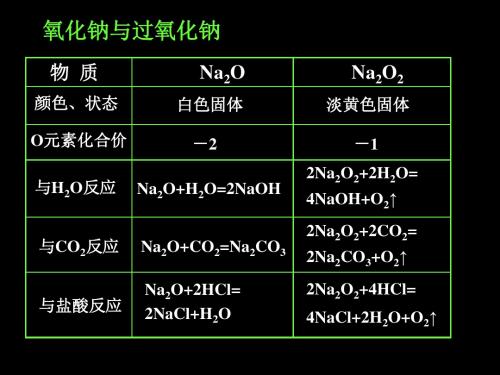
物质 组成结构 类别 颜色状态
小结
氧化钠(Na2O)
过氧化钠(Na2O2)
由Na+和O2-构n(Na+):n(O2-)=2:1由Na+和O2 2-构成n(Na+):n(O2 2)=2:1
加入过量Na2O2粉末振荡,可观察到的现象是( D )
A.溶液仍为紫色 B.最终溶液褪色,而无其他现象 C.溶液最终变蓝色 D.溶液中有气泡产生,溶液最终变为无色
随堂演练
3、对于反应:2Na2O2+2H2O=4NaOH+O2 ↑,下列说法 们
中正确的是( B)
新人教高中化学必修1讲义13 第二章第一节第2讲 氧化钠及过氧化钠

第二章第一节钠及其化合物第2讲氧化钠及过氧化钠【讲】知识点1氧化钠和过氧化钠的性质一、氧化钠和过氧化钠(一)氧化钠的性质1、物理性质:白色固体2、化学性质:碱性氧化物,能与水、酸、酸性氧化物等发生反应(1)氧化钠与水反应:Na2O+H2O===2NaOH(2)氧化钠溶于盐酸:Na2O+2HCl===2NaCl+H2O(3)氧化钠与CO2反应:Na2O+CO2===Na2CO33、用途:制NaOH(二)过氧化钠的性质1、物理性质:淡黄色色固体2、化学性质:Na2O2不是碱性氧化物,但能与水、酸、酸性氧化物等发生反应,具有强氧化性(1)Na2O2与H2O的反应实验结论O2的来源22222223 23、Na2O2的特性——强氧化性:Na2O2中氧元素为—1价,处于中间价态,既有氧化性又有还原性,主要表现较强的氧化性(1)Na2O2与SO2反应:Na2O2+SO2===Na2SO4(2)Na2O2投入Na2SO3溶液中,可将SO32-氧化成SO42-(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀(4)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊(5)Na2O2投入品红溶液中,因其有氧化性,所以有漂白性,可使品红溶液褪色(6)Na2O2能使酚酞试液先变红(产生了碱)后褪色(漂白性),同时产生无色的气泡4、用途:强氧化剂、漂白剂、供氧剂5、Na2O与Na2O2性质比较①Na2O是碱性氧化物,Na2O2是非碱性氧化物(因其与酸反应时除生成盐和水外,还有O2生成)②Na2O2中阴离子是O2-2,阴、阳离子个数比是1∶2而不是1∶1③Na2O2中氧元素的化合价是-1价,Na2O中氧元素的化合价是-2价,Na2O2与水、CO2反应中,Na2O2既是氧化剂又是还原剂,1 mol Na2O2参加反应,转移1 mol的电子【练】1.判断题(1)Na2O与Na2O2均为碱性氧化物()(2)Na2O与Na2O2中的氧元素的化合价不相同,钠元素的化合价相同()(3)Na2O与Na2O2的阴、阳离子个数比均为1∶2()(4)Na2O2与H2O的反应中,H2O是还原剂()答案(1)×(2)√(3)√(4)×2.下面是比较氧化钠和过氧化钠性质异同点的有关叙述,其中错误的是()A.氧化钠和过氧化钠长期置于空气中最终所得固体产物相同B.氧化钠和过氧化钠都能与二氧化碳或水发生化合反应C.氧化钠和过氧化钠与水反应都有氢氧化钠生成D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物答案B3.关于氧化钠和过氧化钠的叙述正确的是()A.氧化钠比过氧化钠稳定B.都能与二氧化碳、水反应产生氧气C.所含氧元素的化合价都为-2价D.阴、阳离子的个数比都为1∶2答案D解析氧化钠能被氧气氧化为过氧化钠,过氧化钠比氧化钠稳定;氧化钠与二氧化碳、水都能反应,但无氧气产生;氧化钠中氧元素的化合价为-2价,过氧化钠中氧元素的化合价为-1价;氧化钠中阴、阳离子分别为O2-、Na+,过氧化钠中阴、阳离子分别为O2-2、Na+,其个数比都为1∶2。
《氧化钠和过氧化钠》【教学PPT课件 高中化学优质课】ppt

2.Na2O与CaO的性质相似,是典型的酸性 氧化物, Na2O与H2O反应的化学方程式是 Na2O+H2O ===2NaOH ,与酸性氧化物 CO2反应的化学方程式是 Na2O+CO2===Na2CO3 ,与盐酸反应的化 学方程式是 Na2O+2HCl===2NaCl+H2O
。
探究点一:Na2O2与H2O的反应
作业:练习册P26
答:这个反应生成氧气,是放热反应, 并且有碱性物质生成。
化学方程式是 2Na2O2+2H2O===4NaOH+O2↑
3.将上述滴入酚酞变红后的溶液震荡,会有什么现象 ?能得出什么结论?(Na2O2在反应中是作还原剂还是氧 化剂)。用双线桥标出Na2O2与H2O反应的电子转移情况 。
答:红色褪去。
Na2O2具有强氧化性,漂白性。 Na2O2的用途:杀菌/消毒,漂白剂。
探究点二:Na2O2与CO2的反应 1.取一小块脱脂棉在石棉网上,再取半药匙过氧 化钠粉末至于脱脂棉上,小心包裹后,向包有过 氧化钠的脱脂棉吹气。有什么现象发生?其反应 原理是什么?说明过氧化钠有什么用途?
答:现象是脱脂棉燃烧。
2Na2O2 + 2CO2 = Na2CO3 + O2 过氧化钠可用于呼吸面具或潜水艇中作为氧气的 来源。用作供氧剂
过氧化钠的功与“过”
可用过氧化钠漂白织物、羽毛、麦秆等。
但有些不法商贩用过氧化钠来处理食品, 2011年4月,长春市工商局查处两家个体牛百叶 加工点。据查,为了使成品肥大、鲜白,在浸泡 时都加入氢氧化钠和过氧化钠的混合物,长期或 过量食用经此混合物浸泡的牛百叶,会引起胃、 肝、肾等疾病,甚至可能致癌。
A.Na2O B.CaO C.Na2O2 D.MgO 2.下列关于Na2O、Na2O2 的比较中正确的是( C ) A.Na2O和Na2O2 都是碱性氧化物 B.Na2O和Na2O2 都是易与水反应的白色固体 C.Na2O和Na2O2 固体中阳离子与阴离子的数目比均为2 :1
2.1.2+氧化纳和过氧化钠+课件+2023-2024学年高一上学期化学人教版(2019)必修第一册

课堂小结
物质 色、态
氧化钠(Na2O) 白色固体
过氧化钠(Na2O2) 淡黄色固体
氧元素化合价
-2
-1
阴、阳离子个数比
1∶2
1∶2
类别
碱性氧化物
过氧化物、不是碱性氧化物
化学性质 稳定性
二者均能与H2O、CO2、HCl反应,但Na2O2有O2产生 Na2O2更稳定
课堂练习
1.判断正误,正确的画“√”,错误的画“×”。
第二章 海水中的重要元素——钠和氯 第一节 钠的化合物
第2课时氧化钠和过氧化钠
学习目标
1.能从物质类别、元素化合价角度认识Na2O、Na2O2、 Na2CO3、NaHCO3的性质,并能书写有关方程式。
2.能利用钠的典型代表物的性质和反应,设计实验进行验 证和探究,并能分析、解释有关实验现象。
3.了解焰色试验的实验操作及应用。
D.都具有强氧化性,都可用作漂白剂
课堂练习 大本53页
D 题点一 氧化钠和过氧化钠的性质
1.下列对于Na2O、Na2O2的比较正确的是(
)
①Na2O和Na2O2都能与水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换
反应生成O2
③Na2O是淡黄色物质,Na2O2是白色物质
【预测】从物质组成和氧化还原反应的角度,预测Na2O2与H2O反应的产物可能?
Na2O2 + H2O
实验2-3(书本37页)
将1~2 mL水滴入盛有1~2 g过 氧化钠固体的试管中,立即把带火 星的木条伸入试管中,检验生成的 气体。用手轻轻触摸试管外壁,有 什么感觉?用pH试纸检验溶液的酸 碱性。
最新人教版高中化学必修一3.2.1《钠的重要化合物》优质课件.ppt

在 Na2O2 与 CO2 或 H2O 的反应中,Na2O2 既作氧化剂又作还原剂,每生 成 1 mol O2 都转移 2 mol 电子。
探究一
探究二
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
当堂检测
ANGTANGJIANCE
2.CO2、H2O 与 Na2O2 反应的先后顺序
A .颜 色
B.水 溶 液的酸碱性
C.氧化性 D.漂白性
解析:Na2O 为白色固体,不具有氧化性和漂白性;Na2O2为淡黄色固体, 具有强氧化性,可用作漂白剂,A、C、D错误;二者均能与水反应生成 NaOH,B
正确。
答 案 :B
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
思维脉络
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
当堂检测
ANGTANGJIANCE
一二三
一、氧化钠和过氧化钠
1 .物 理 性质
氧化钠是白色固体,过氧化钠是淡黄色固体。 2 .化 学 性质 (1)过氧化钠与水反应的实验。
实验操作
实验现象
实验结论
①试管发烫,带火星的木条 复燃;②滴加酚酞后溶液先 变红,然后褪色
探究二
过氧化钠的性质 问题导引
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
当堂检测
ANGTANGJIANCE
1.Na2O 和 Na2O2 都能与水反应生成碱,它们都是碱性氧化物吗?
提示碱性氧化物是指与酸反应只生成盐和 H2O 的氧化物。Na2O 与酸反应生成盐和水,而 Na2O2 与酸反应除生成盐和水外还生成 O2, 如:2Na2O2+4HCl 4NaCl+O2↑+2H2O,所以 Na2O 是碱性氧化物,而 Na2O2 不 是 碱性氧化物,是过氧化物。
新教材2023年高中化学第2章 第1节钠及其化合物第2课时氧化钠和过氧化钠课件新人教版必修第一册

典 例 2019年10月1日,我国举行中华人民共和国成立70周年盛 大阅兵仪式。潜艇兵是我国海军的一个重要兵种,肩负着保卫祖国海 洋、保卫人民的重担。
在潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实 验用品,用如图中的实验装置进行实验,证明过氧化钠可作供氧剂,其 中A是实验室制取CO2的装置。
__吸__收__没__有__反__应__的__C__O_2__
〔素养应用〕下列关于Na2O2的叙述中正确的是
( D)
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只做氧化剂
C.Na2O2属于碱性氧化物
D.Na2O2与CO2或H2O反应后,固体质量都将增大
解析:Na2O2 久置于空气中最终变成 Na2CO3,A 项错误;Na2O2 与
水反应时,Na2O2 既是氧化剂又是还原剂,B 项错误;Na2O2 不属于碱性
氧化物,C 项错误;根据两反应中固体成分的变化:Na2O2—C—O→ 2 Na2CO3、
Na2O2—H—2O→2NaOH 可知,D 项正确。
课堂达标验收
来,则棉花中可能包有
( C)
A.烧碱
B.氧化钾
C.过氧化钠
D.小苏打
要点归纳
课堂素能探究
知识点
过氧化钠和氧化钠的性质 问题探究:Na2O2属于碱性氧化物吗?为什么? 探究提示:不属于。碱性氧化物指能与酸反应生成盐和水的氧化 物,Na2O2与盐酸反应时不仅生成NaCl和水,还会有氧气生成,所以不 属于碱性氧化物。
( AB )
A.Na2O和Na2O2都能与CO2反应,产物不完全相同 B.用钠与空气反应制纯净的Na2O2,空气必须经过固体NaOH处理 后,才能与钠反应
【高中化学】氧化钠与过氧化钠PPT课件
[科学探究]碳酸钠和碳酸氢钠的溶解性及溶液酸碱性
步 骤
①
1gNa2CO3
白色粉末,加水结 块变成晶体放热
1gNaHCO3 细小的白色固体,加水 部分溶解 ,感觉不到 热量变化. 固体量减小 溶液变微红色 加水部分溶解 ,溶解 度较Na2CO3小,碱 性较Na2CO3弱。
② ③ 初步 结论
振荡时间长可溶解 溶液变红 (较深) 加水先变成含结 晶水的晶体,溶 解度较大,碱性 较强。
③2滴酚酞
溶液变微红色
1、不要做刺猬,能不与人结仇就不与人结仇,谁也不跟谁一辈子,有些事情没必要记在心上。 2、相遇总是猝不及防,而离别多是蓄谋已久,总有一些人会慢慢淡出你的生活,你要学会接受而不是怀念。 3、其实每个人都很清楚自己想要什么,但并不是谁都有勇气表达出来。渐渐才知道,心口如一,是一种何等的强大! 4、有些路看起来很近,可是走下去却很远的,缺少耐心的人永远走不到头。人生,一半是现实,一半是梦想。 5、你心里最崇拜谁,不必变成那个人,而是用那个人的精神和方法,去变成你自己。 6、过去的事情就让它过去,一定要放下。学会狠心,学会独立,学会微笑,学会丢弃不值得的感情。 7、成功不是让周围的人都羡慕你,称赞你,而是让周围的人都需要你,离不开你。 8、生活本来很不易,不必事事渴求别人的理解和认同,静静的过自己的生活。心若不动,风又奈何。你若不伤,岁月无恙。 9、命运要你成长的时候,总会安排一些让你不顺心的人或事刺激你。 10、你迷茫的原因往往只有一个,那就是在本该拼命去努力的年纪,想得太多,做得太少。 11、有一些人的出现,就是来给我们开眼的。所以,你一定要禁得起假话,受得住敷衍,忍得住欺骗,忘得了承诺,放得下一切。 12、不要像个落难者,告诉别人你的不幸。逢人只说三分话,不可全抛一片心。 13、人生的路,靠的是自己一步步去走,真正能保护你的,是你自己的选择。而真正能伤害你的,也是一样,自己的选择。 14、不要那么敏感,也不要那么心软,太敏感和太心软的人,肯定过得不快乐,别人随便的一句话,你都要胡思乱想一整天。 15、不要轻易去依赖一个人,它会成为你的习惯,当分别来临,你失去的不是某个人,而是你精神的支柱;无论何时何地,都要学会独立行走 ,它会让你走得更坦然些。 16、在不违背原则的情况下,对别人要宽容,能帮就帮,千万不要把人逼绝了,给人留条后路,懂得从内心欣赏别人,虽然这很多时候很难 。 17、做不了决定的时候,让时间帮你决定。如果还是无法决定,做了再说。宁愿犯错,不留遗憾! 18、不要太高估自己在集体中的力量,因为当你选择离开时,就会发现即使没有你,太阳照常升起。 19、时间不仅让你看透别人,也让你认清自己。很多时候,就是在跌跌拌拌中,我们学会了生活。 20、与其等着别人来爱你,不如自己努力爱自己,对自己好点,因为一辈子不长,对身边的人好点,因为下辈子不一定能够遇见。
第一章第一节第二课时 氧化钠和过氧化钠 课件高一化学人教版(2019)必修第一册

第二章· 海水中的重要元素
网 第一节 钠及其化合物
科 2.1.2 氧化钠和过氧化钠
学习目标
学1.能说出氧化钠和过氧化钠的主要性质的差异 2.能说出过氧化钠在生活、生产中的主要用途
思考与讨论
1.钠在空气中常温和加热条件下分别发生什么反应?说明了什么问题?
常温 4Na+O2==2Na2O
所以氢氧化钠先使酚酞变红, H2O2使酚酞褪色
Na2O2强氧化性的表现
一般来讲,有些物质利用自身
或与其它物质反应的中间产物 的强氧化性,在氧化还原反应 的过程中起到漂白、消毒、杀 菌的作用。
1.向紫色石蕊溶液中加入过量Na2O2粉末, 振荡,正确的叙述是( )
B A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
由Na+和O2-构n(Na+):n(O2-)=2:1
氧元素化合价
-2
过氧化钠(Na2O2)
由Na+和O2 2-构成n(Na+):n(O22- )=2:1
-1
类别 颜色状态 与水反应 与CO2反应 与H+反应 转化关系 用途
碱性氧化物
白色固体
Na2O + H2O 2NaOH Na2O + CO2 Na2CO3
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无 气泡产生
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
Na2O +2H Cl = 2Na Cl + H2O
过氧化钠(Na2O2)
2Na2O2 + 2H2O = 4NaOH + O2↑
【新教材】人教版高中化学必修第一册钠及其化合物教学课件

【 新教材 】人教 版高中 化学必 修第一 册钠及 其化合 物
现象: 钠:黄色
钾:紫色(透过蓝色钴玻璃)
【 新教材 】人教 版高中 化学必 修第一 册钠及 其化合 物
钡黄绿
【 新教材 】人教 版高中 化学必 修第一 册钠及 其化合 物
钠黄
铜绿 钾紫
锶洋红
焰 色 试 验 是是 物元 理素 变的 化性 。质 ,
钙砖红
【 新教材 】人教 版高中 化学必 修第一 册钠及 其化合 物
4Na + O2 = 2Na2O
②金属钠在水中; 2Na + 2H2O = 2NaOH + H2↑
自然界中有大量的氧气和水会与钠反应生成化 合物,所以其在自然界中以化合态形式存在
思考与讨论
(1)、回忆前面做过的实验,描述氧化钠和过氧化 钠的颜色、状态。
氧化钠
过氧化钠
思考与讨论
(2)、氧化钠与水的反应和氧化钙与水的反应类似, 请写出氧化钠与水反应的化学方程式。
(3)向(2)的 试管中加5mL水
(4)向(3)所得 溶液中加1-2滴酚 酞溶液
振荡时间长时 可溶解
溶液变红(较深)
固体量减少 溶液变微红色
初步结论
Na2CO3比NaHCO3易溶于水, 溶液碱性比NaHCO3溶液强。
实验2-5
如图所示,分别加热碳酸 钠和碳酸氢钠,观察现象 ,比较碳酸钠和碳酸氢钠 的热稳定性。
【 新教材 】人教 版高中 化学必 修第一 册钠及 其化合 物
【 新教材 】人教 版高中 化学必 修第一 册钠及 其化合 物 【 新教材 】人教 版高中 化学必 修第一 册钠及 其化合 物
【 新教材 】人教 版高中 化学必 修第一 册钠及 其化合 物
(新教材)高中化学《钠及其化合物》ppt课件人教版1

第一节 钠及其化合物 第2课时
二、钠的几种化合物
1、氧化钠和过氧化钠
温故知新
1.为什么金属钠在自然界中以化合态形式存在?
①金属钠在空气中;
4Na + O2 = 2Na2O
②金属钠在水中; 2Na + 2H2O = 2NaOH + H2↑
自然界中有大量的氧气和水会与钠反应生成化 合物,所以其在自然界中以化合态形式存在
碳酸氢钠
碳酸钠和碳酸氢钠
盐
(1)观察 Na2CO3 和NaHCO3 的外观并进 行描述
碳酸钠 白色粉末 Na2CO3
碳酸氢钠
细小 白色晶体 NaHCO3
俗名:纯碱、苏打
俗名:小苏打
步骤
Na2CO3
NaHCO3
(2)加入几滴水, 并插入温度计,观察
加水结块;温度 加水部分溶解;温 计示数升高 度计示数略有减小
现象: 有气泡产生,放出的气体能使带火星的木条复燃。试管发烫。反应后的溶 液中滴入酚酞先变红后褪色。
既是氧化剂 又是还原剂
失去2e-,化合价升高,被氧化
化学方程式: 2Na2-O1 2+2H2O=4NaO-2H+O0 2↑
有漂白性 得到2e-,化合价降低,被还原
结论: 过氧化钠与水反应放热,生成氧气和氢氧化钠,过氧化钠有漂白 性。
现象: 钠:黄色
钾:紫色(透过蓝色钴玻璃)
钡黄绿 钠黄
铜绿 钾紫
锶洋红
焰 色 试 验 是是 物元 理素 变的 化性 。质 ,
钙砖红
研究与实践
1、了解纯碱的生产历史
2、研究任务
查阅资料,了解路布兰制碱法、索尔维制碱法、 侯氏制碱法的原理
人教版高中化学必修一课件氧化钠和过氧化钠

•
• • • • • • • •
一 钠的重要化合物 1 氧化钠:Na2O (1)颜色、状态:白色固体 (2)化学性质: ①与水反应:Na2O+H2O=2NaOH ②与CO2反应: Na2O+CO2=Na2CO3 ③与酸反应 Na2O+2HCl=2NaCl+H2O △ ④不稳定 2Na2O+O2=2Na2O2
钠起火能否用CO2灭火器灭火?
2Na2O2+2H2O=4NaOH+O2 ↑ 2Na2O2+2CO2=2Na2CO3+O2
(放热、生成O2)
练习:运用氧化还原反应的知识分析以上两个反 • 应。
•
几种金属的焰色:
Li 紫红
Na 黄
K 紫
Ca 砖红
•
Sr 洋红
Ba 黄绿
Cu 绿
钠盐呈黄色、钾盐呈紫色、钙盐呈砖红色、 锶盐呈洋红色、铜盐呈绿色。
•
•
•
•
• 【实验】 • 1.火源最好用喷灯、煤气灯,因酒精灯火焰略带黄 色,喷灯的火焰温度高,而且无色。 • 2.做焰色反应实验前,铂丝(或无锈铁丝)应灼烧 到无色。也可先用盐酸清洗,再灼烧至无色。 • 3.做钾盐的焰色反应实验时,要透过蓝色钴玻璃片 进行观察。蓝色玻璃片能吸收黄光,能排除钠盐的 干扰。没有蓝色钴玻璃片,可用幻灯片涂上蓝色颜 料代替。 • 一些改进实验:(1)用甲醇配制金属盐溶液,装 入喷雾器向火焰处喷射,焰色明显。 • (2)将粉笔先吸足酒精,再点燃,在火焰上进行 焰色反应实验,现象很明显。 • 实验现象:焰色反应的颜色为:钠盐呈黄色、钾盐 呈紫色、钙盐呈砖红色、锶盐呈洋红色、铜盐呈绿 • 色。
•
2、过氧化钠 Na2O2 (1)、颜色、状态:淡黄色,固体 (2)、过氧化钠的化学性质:
氧化钠和过氧化钠课件高一上学期化学人教版2

(2)写出上述魔术的反应的化学方程
式:
是
,还原剂是
移
个电子。
,反应中的氧化剂 ,当有2个H2O分子参加反应时,转
(3)你知道魔术前后固体的质量如何变化吗?
(4)将足量的Na2O2投入酚酞溶液中,现象 是
。 提示:Na2O2与H2O反应生成氢氧化钠,使酚酞溶液变红,但Na2O2具有漂白性,足 量的Na2O2又会使红色褪去 (5)白色的Na2O粉末中若混有少量的Na2O2,检验的方法 是
氧化钠和过氧化钠
学习目标: 1.从物质类别、元素化合价的角度认识氧化钠与过氧化钠的性质,了解 过氧化钠与水和二氧化碳反应在生产、生活中的应用。 2.根据过氧化钠与水、二氧化碳的反应,能分析反应中的质量、体积变 化及电子转移情况,掌握相关的实验设计和分析。
分点突破(一) 氧化钠与过氧化钠
1.Na2O的性质 (1)物理性质: 白 色固体。 (2)化学性质:碱性氧化物,能与水、酸、酸性氧化物等发生化学反应。 写出下列反应的化学方程式:
2Na2O2+2H2O4NaOH+O2↑
Na2O+CO2Na2CO3
2Na2O2+2CO22Na2CO3+O2
Na2O+2H+2Na++H2O 2Na2O2+4H+4Na++2H2O+O2↑
2Na2O+O22Na2O2
1.下列关于氧化钠和过氧化钠的叙述正确的是( )
A.都是白色固体 B.与水反应都能生成氢氧化钠 C.都可在呼吸面具中作为氧气的来源 D.都属于碱性氧化物 解析:B 过氧化钠为淡黄色固体,A错误;过氧化钠与二氧化碳和水反应均生成 氧气,可用于呼吸面具中作为氧气的来源,氧化钠与水反应只生成氢氧化钠,C错 误;氧化钠是碱性氧化物,过氧化钠不是碱性氧化物,D错误。
2.氧化钠和过氧化钠课件高一上学期化学人教版必修第一册

生成条件 常温 点燃 平衡量(mol):8-x 0.5x 1.5x
C. 30℃,4 mL硫酸,3 mL水
D. 30℃,5 mL硫酸,2 mL水
②回收四氯化碳:将碘的四氯化碳溶液置于分液漏斗中;加入适量Na2SO3稀溶液;要使反应充分进行,需要振荡分液漏斗,然后充
实验探究
实验步骤
实验现象
结论
①取少量Na2O2放 入试管中,再滴加 B. 加适量NH4Cl固体可使溶液由a点变到b点
试管壁
反应放热
【【答答适案 案】】量AD 水,观察并用
发热
【详解】A. 没有注明物质的状态,故A错误;
手触摸试管壁。 d.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,溶液浓度偏低,故d选;
1.5;
吸_收__C__O__中__混__有__的_。 反应的CO B. Y形成的离子与W形成的离子的电子数不可能相同
2
HC1 2 A. 所用盐酸的浓度是0.09mol·L-1,NaOH溶液浓度为0.03mol·L─1
D.氮化铝的摩尔质量是41g/mol,故D错误;
(4)为了较准确地测量氧气的体积,除了必须检查整个 已知:常温下,Ka(HF)>Ka(HClO),则酸性:HF>HClO,A、酸性越弱,对应的酸根离子的水解程度越大,所以NaClO的水解
【解析】
大理石 盐酸 【详解】综合分析工艺流程图可知,试剂X只能是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液
(2)装置C中放入的反应物是_____ 和_______。 不反应,所以反应①、过滤后所得溶液乙为NaAlO2溶液,沉淀为Fe2O3;Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为
【课件】氧化钠和过氧化钠(人教版2019必修第一册)

【归纳总结】完成下列表格
化学式 氧元素化合价
色、态 阴、阳离子个数比 是否为碱性氧化物 与水反应的方程式
Na2O _-__2__
白色固体 1∶2
是 Na2O+H2O=2NaOH
Na2O2 _-___1___ 淡黄色固体 1∶2
不是
2Na2O2+2H2O=4NaOH+O2↑
与CO2反应的方程式 Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2
4. 2.1 g平均相对分子质量为7.2的CO和H2组成混合气体与足量O2充分
A 燃烧后立即通入足量的Na2O2中,固体质量增加( )
A.2.1 g B.3.6 g C.7.2 g
D.不可求
① 2CO + O2 = 2CO2
相当于:
2CO2+2Na2O2 = 2Na2CO3+O2 CO+Na2O2=Na2CO3
➢用双线桥表示反应中的电子转移情况 Na2O2既是氧化剂也是还原剂 1个 Na2O2与CO2反应转移 1 个e-? 注意:此反应不在溶液中进行,不能改写成离子方程式
应 用:Na2O2可用于呼吸面具、潜水艇作供氧剂 2Na2O2 + 2CO2 = 2Na2CO3 + O2 2Na2O2 + 2H2O = 4NaOH + O2↑
原 因:2Na2O2+2H2O = 4NaOH+O2↑ 生成NaOH,呈碱性,同时Na2O2又有漂白性。
问题4:
H2↑
Cu(OH)2↓
将金属Na投入CuSO4溶液中,产生大量无色气体,生成蓝色沉淀
2Na+2H2O+CuSO4=Na2SO4+H2↑+Cu(OH)2↓
➢若将Na2O2投入CuSO4溶液中,预计有什么现象?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.用双线桥分析Na2O2与水反应中电子转移的方向和数 目:__________________。氧化剂和还原剂是________, 氧化产物是________,还原产物是________。
【解析】Na2O2与水反应时Na2O2中氧元素的化合价既升 高又降低,同时体现氧化性和还原性。
【解析】选C。Na2O2与水反应时除了生成碱外,还生成 了O2,故Na2O2不属于碱性氧化物,故A项错误;Na2O2是淡 黄色固体,故B项错误;Na2O2与CO2和H2O反应时,CO2、H2O 既不是氧化剂又不是还原剂,Na2O2既作氧化剂又作还原 剂,故C项正确; Na2O反应中无氧气产生,不能作供氧剂, 故D项错误。
【规律方法】 (1)从元素化合价角度分析Na2O2的性质
(2)强氧化性的表现
【母题追问】(1)白色的Na2O粉末中若混有少量的Na2O2, 如何进行检验? 提示:取少量白色粉末于试管中,滴加少量水,若有气体 生成,则说明含有Na2O2。
(2)将一定量的Na2O2、Na2O分别加入滴有酚酞溶液的水 中,二者现象是否相同?
Na2O+2HCl====2NaCl+H2O ③______________________。
【想一想】将氧化钠投入酚酞溶液中会有什么现象?原 因是什么? 提示:变红。氧化钠与水反应生成氢氧化钠,使酚酞变 红。
二、过氧化钠的性质与用途
1.物理性质 过氧化钠是一种_淡__黄__色固体。
2.化学性质 (1)与水反应
第2课时 氧化钠和过氧化钠
一、氧化钠的性质
1.物理性质 颜色:_白__色__;状态:_粉__末__状__固__体__。
2.化学性质
写出序号表示的化学方程式: ①_N_a_2O_+__H_2O_=_=_=_=_2_N_a_O_H_。 ②_N_a_2O_+_C_O_2_=_=_=_=_N_a_2_C_O_3 。
【解析】选B。在Na2O2与H2O的反应中,Na2O2中-1价氧元 素原子之间发生电子转移,Na2O2既是氧化剂又是还原 剂;2个Na2O2参加反应时电子转移的数目为2个;根据原 子守恒,固体增重质量等于参加反应水中氢原子的质量,
(2)与二氧化碳反应(化学方程式): _2_N_a_2_O_2+_2_C_O_2_=_=_=_=_2_N_a_2_C_O_3+_O_2_。
【微思考】 (1)过氧化钠是不是碱性氧化物?为什么? 提示:不是。碱性氧化物和酸反应时只生成盐和水,而 Na2O2与酸反应还有 O2生成。
(2)有一包淡黄色粉末,如何验证其为过氧化钠? 提示:可利用过氧化钠易与水反应生成氧气进行验证。 取少量粉末,滴加少量蒸馏水,观察,有能使带火星的木 条复燃的气体产生则为过氧化钠。
【母题追问】(1)假设该题目中过氧化钠与水反应固体 质量增加了2 g,则反应消耗的水的质量是多少? 提示:由2Na2O2+2H2O====4NaOH+O2↑知,反应前后固体 增加的质量相当于H2O中的H2的质量,故参加反应的水的 质量是18 g。
(2)假设该题目中过氧化钠与水反应消耗H2O分子的个 数为6.02×1023,则转移电子的个数是多少?
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物 B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体 C.Na2O2在和CO2的反应中既是氧化剂又是还原剂 D.Na O 、Na O均可作供氧剂
【解题指南】解答本题需要注意理解以下两个方面: (1)碱性氧化物的定义。 (2)过氧化钠中氧的化合价的特殊性。
【典例2】在深海中作业的潜水员的呼吸面具上,往往 装入一定量的Na2O2,目的是给潜水员提供氧气。
常温常压下二氧化碳和过氧化钠反应后,若固体质量增 加了28 g,反应中消耗的二氧化碳的质量是________g, 生成的碳酸钠的质量是________g。
【解析】由2Na2O2+2CO2====2Na2CO3+O2知反应前后固体 增加的质量相当于CO2中的CO,增加了28 g,即参加反应 的CO2为44 g,生成的Na2CO3为106 g。 答案:44 106
2NaOH
Na2O2 非碱性氧化物 (过氧化物) 燃烧或加热
较稳定
2Na2O2+2H2O==== 4NaOH+O2↑
化学式 与CO2 反应 主要用途
Na2O Na2O+CO2====
Na2CO3 用于制取Na2CO3
Na2O2
2Na2O2+2CO2==== 2Na2CO3+O2
强氧化剂、漂白剂、 供氧剂
某同学设计了一个“滴水点火,水火相容”的魔术实验, 他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱 脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。 请解释脱脂棉能够燃烧的原因。
(1)滴水点火的原理是什么?试写出离子反应方程式。 提示:可燃物燃烧需要满足两个条件:有氧气、温度达 到着火点。因此说明过氧化钠与水反应生成氧气且是 放热反应。离子反应方程式为2Na2O2+2H2O====4Na+ +4OH-+O2↑。
【知识拓展】凡分子组成符合(CO)m·(H2)n的物质,m g 该物质在O2中完全燃烧,将其产物(CO2和水蒸气)全部通 过足量Na2O2后,固体增重为m g。或者是由C、H、O三种 元素组成的物质,只要C、O原子个数比为1∶1,即可满 足上述条件。中学阶段常见的符合这一关系的物质有: ①无机物:H2、CO及H2和CO的混合气体;
(2)如何判断Na2O2与H2O反应所得的气体是氢气还是氧 气?
提示:用排水法收集Na2O2与H2O反应所得的气体,然后利 用检验两种气体的方法检验。若是H2,点燃时会燃烧, 并听到爆鸣声;若是O2,则可以使带火星的木条复燃。
【案例示范】
【典例】下列对于Na2O、Na2O2的比较正确的一项 是( )
转化:2Na2O+O2
2Na2O2
【易错提醒】 (1)Na2O2与H2O、CO2反应中,Na2O2既是氧化剂又是还原 剂。 (2)Na2O2中阴、阳离子个数比是1∶2而不是1∶1。
【思考·讨论】
(1)金属钠着火时,能否用H2O或CO2灭火?为什么? 提示:不能。钠着火生成Na2O2,Na2O2与H2O、CO2均反应 产生O2助燃,应用沙子等与之不反应的物质进行灭火。
①发生反应Ⅰ时,固体增加的质量等于与CO2等个数的 CO的质量。
②发生反应Ⅱ时,固体增加的质量等于与H2O等个数的H2 的质量。
(4)反应的先后角度
一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应, 可视为Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与 H2O(g)发生反应。
②有机物:CH3OH(甲醇)、HCHO(甲醛)、CH3COOH(乙酸)、 C6H12O6(葡萄糖)等。
【思考·讨论】
(1)1个Na2O2与足量H2O或CO2反应转移几个电子? 提示:1个。1个Na2O2与足量H2O或CO2反应时,1个O的化 合价由-1升高到0价,1个O的化合价由-1降低到-2价。
(2)生成的产物加到硫酸铜中有什么现象? 提示:生成蓝色沉淀Cu(OH)2。
知识点二 Na2O2与CO2、H2O反应的四大探究角度 【重点释疑】 1.反应原理 2Na2O2+2CO2====2Na2CO3+O2 Ⅰ 2Na2O2+2H2O====4NaOH+O2↑ Ⅱ
2.探究的四个角度 (1)分子个数角度 无论是CO2或H2O的单一物质还是两者的混合物,通过足 量的Na2O2时,生成O2的个数与CO2或H2O的个数之比均为 1∶2。
提示:不同。将Na2O2加入滴有酚酞溶液的水中观察到有 气体生成,溶液先变为红色后褪色;而Na2O加入滴有酚 酞溶液的水中只观察到溶液变为红色。
【迁移·应用】 1.(2019·湖南高一检测)Na2O2具有强氧化性,可用作漂 白剂。下列有关Na2O2说法正确的是 ( ) A.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成 蓝色 B.过氧化钠沾到红色鲜花上,鲜花无变化
实验 操作
实验 现象
产生 大量 气泡
带火星的木 试管外壁
条复燃
发热
滴加酚酞溶液
先___变__红__后__褪___色_
实验 结论
生成_氧__气__
反应
放__出__
热量
生成碱;Na2O2具有强氧 化性
化学方程式:__2_N_a_2_O_2_+_2_H_2_O_=_=__=_=_4_N_a_O_H_+_O2↑
球中的固体颗粒抖落到试管b的水中,将不会出现的现 象是 ( ) A.气球a变大 B.试管b内有气泡冒出 C.U形管内红色褪去 D.U形管水位d高于c
【解析】选C。反应生成氧气,则气球a变大,故A正确; 反应生成气体,则试管b中有气泡冒出,故B正确;由于浅 红色的水是在U形管中而非试管中,则试管内溶液不变 色,U形管内的红水不褪色,故C错误;产生O2使气球膨胀, 该反应放出大量热量,使集气瓶中空气受热膨胀而出现 U形管中水位d高于c,故D正确。
(2)39 g Na2O2与足量CO2反应生成O2的质量是多少? 提示:8 g。由2Na2O2+2CO2====2Na2CO3+O2知,39 g Na2O2 与足量CO2反应生成O2的质量是8 g。
【案例示范】 【典例1】(2019·龙岩高一检测) 如图所示装置,试管中盛有水,气 球a盛有干燥的固体过氧化钠颗粒, U形管中注有浅红色的水,已知过氧化钠与水反应是放 热的。将气球用橡皮筋紧缚在试管口,实验时将气
(2)电子转移角度
当Na2O2与CO2、H2O反应时,每生成1 个O2,转移2 个电子, 且在反应中Na2O2既是氧化剂又是还原剂,CO2、H2O既不 是氧化剂又不是还原剂。
(3)质量变化角度
