2020高考化学金属及其化合物思维导图
人教高中化学 必修一 第 3章 金属元素及其化合物之间相互转化的框架图
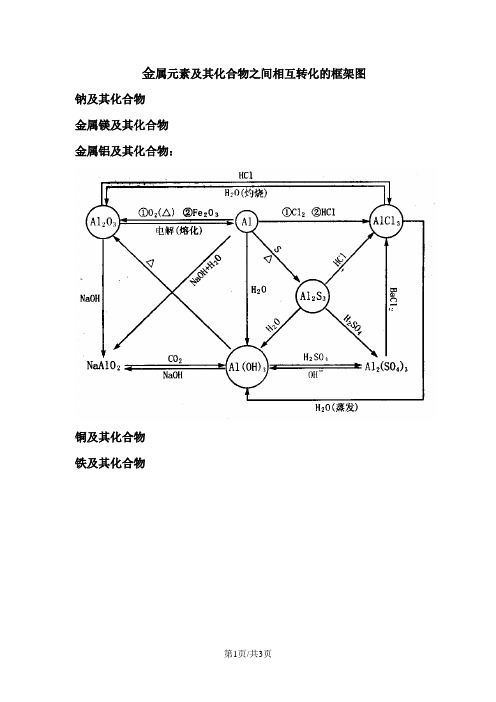
高中化学-金属及其化合物的知识总结归纳框架图

金属及其化合物知识清单一、碱金属1、碱金属性质递变规律结构决定性质,由于碱金属的原子结构具有相似性和递变性,所以其化学性质也具有相似性和递变性。
①相似性:a、都能与氧气等非金属反应b、都能与水反应生成氢氧化物和氢气c、均为强还原剂。
②递变规律(锂→铯)a、与氧气反应越来越剧烈,产物结构越来越复杂b、与水反应剧烈程度依次增强c、还原性依次增强,金属性依次增强2、NaOH的性质①物理性质:俗名苛性钠、火碱、烧碱,是一种白色固体,极易潮解;有强烈的腐蚀性,能腐蚀磨口玻璃瓶,使瓶口与瓶塞粘结。
②化学性质a、与酸碱指示剂作用,使紫色的石蕊溶液变蓝,无色的酚酞变红。
b、与酸性氧化物作用,生成盐和水c、与酸作用,生成盐和水d、与盐作用,生成新碱和新盐。
(要满足复分解反应发生的条件,同时参加反应的碱和盐一般是易溶解的碱和盐)e、与一些单质的反应2Al+2NaOH+2H2O===2NaAlO2+3H2↑Cl2+2NaOH=== NaClO+NaCl+H2OSi+2NaOH+H2O=== Na2SiO3+2H2↑③制法:2NaCl+2H2+H2↑+Cl2↑Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH二、几种重要的金属1、铝及其化合物间的相互转化关系、反应现象及图象分析①向AlCl3溶液中滴加NaOH 溶液直至过量,如图所示。
②现象:白色沉淀逐渐增多达最大值,继续加NaOH溶Al(OH)3 (mol)液沉淀逐渐溶解,直至完全消失。
4nAl3++3OH-=== Al(OH)3Al(OH)3+OH―=== AlO2―+2H2O3n4n NaOH(mol)②向NaOH 溶液中滴加AlCl 3溶液直至过量,如下图所 示。
现象:开始时无沉淀,接着产生沉淀。
达最大值后 不增减。
Al 3++4OH -=== AlO 2―+2H 2O3AlO 2―+Al 3++6H 2O === 4 Al(OH)3↓ ③向NaAlO 2溶液中滴加盐酸直到过量,如图所示。
2023高考化学铝、硅及其化合物 思维导图
硅 是一种亲氧元素,在自然界总是与氧相互结合,自然界无单质硅
硅在元素周期表中位置:第三周期第ⅣA族
集成电路、芯片、半导体材料、硅太阳能电池、光伏电池(光能直接转换为电能)等硅
高纯硅的制备;
二氧化硅
硅及其化合物
(2)新型无机非金属材料
合金:在金属中加热熔合某些金属或非金属,就可以制得具有金属特性的物质,叫做合金
Al元素位于:第三周期第ⅢA族,地壳中含量最多的金属元素(O、Si、Al、Fe),自然界中以化合态存在
铝比铁更耐腐蚀的原因:铝与氧气形成一层致密的氧化铝薄膜
,保护铝不再被氧化,而铁锈(主要成分FeO)疏松吸水
1、
2、
3、
4、Al遇浓硫酸、浓硝酸会钝化,因此,常温下用铝制容器来盛装浓硫酸或浓硝酸
Al的性质
两性氧化物
制备(氯化铝溶液中滴加氨水):
两性氢氧化物
受热分解:
典型工业流程
铝及其化合物
(1)传统无机非金属材料
石英、水晶、玛瑙、沙子的主要成分,用途:做光导纤维
新型陶瓷:碳纳米材料,碳化硅,氧化铝等
白色固体,性质稳定,熔点高,硬度大,可作耐火材料,典型的两性氧化物
6、Al的冶炼:
铝热反应:。
高三化学知识点框架图

高三化学知识点框架图一、基本概念与原理1. 物质的组成- 原子与分子- 元素与化合物- 同位素与同素异形体2. 物质的分类- 纯净物与混合物- 酸碱盐与氧化物3. 化学反应的基本原理- 质量守恒定律- 能量守恒定律- 化学反应的四种类型:合成、分解、置换、还原4. 化学计量- 摩尔概念- 气体定律- 溶液的浓度表示二、无机化学1. 元素周期律与周期表- 元素周期律- 周期表的结构与应用2. 重要元素及其化合物- 主族元素:碱金属、卤素- 过渡元素:铁、铜、锌3. 酸碱与盐- 酸碱理论:阿伦尼乌斯、布朗斯特-劳里 - 酸碱中和反应- 盐的水解平衡4. 氧化还原反应- 氧化还原反应的识别- 氧化数的计算- 电化学原理:伏打电堆、电解三、有机化学1. 有机化合物的基本概念- 有机化合物的特征- 碳的杂化轨道理论2. 烃类化合物- 饱和烃:烷烃、环烷烃- 不饱和烃:烯烃、炔烃- 芳香烃3. 官能团化学- 醇、酚- 醛、酮- 羧酸、酯4. 聚合反应与高分子化合物- 加聚反应与缩聚反应- 塑料、橡胶、纤维四、物理化学1. 热力学- 热力学第一定律- 热力学第二定律- 化学反应的热效应2. 动力学- 反应速率的概念- 反应速率定律- 催化剂的作用3. 平衡化学- 化学平衡常数- 弱电解质的电离平衡- 沉淀溶解平衡4. 分析化学- 定性分析与定量分析- 光谱分析:红外、紫外、核磁共振 - 色谱分析:气相色谱、液相色谱五、实验技能与安全1. 常见化学实验操作- 溶液的配制- 酸碱滴定- 萃取与分液2. 实验安全与事故处理- 实验室安全规则- 化学品的分类与标识- 常见事故的应急处理通过上述框架图的梳理,学生可以系统地掌握高三化学的核心知识点,为高考化学的复习和备考打下坚实的基础。
每个部分都需要深入理解并能够熟练应用,以确保在解决实际问题时能够灵活运用所学知识。
同时,实验技能的培养和安全意识的加强也是化学学习中不可或缺的部分。
高中化学 金属与非金属的思维导图
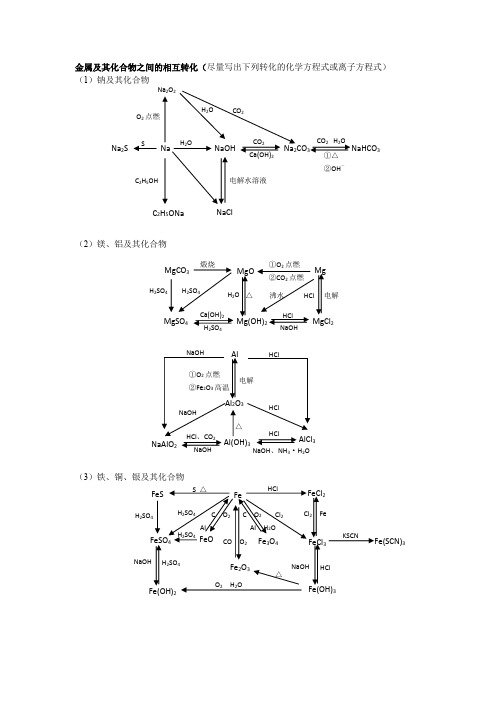
金属及其化合物之间的相互转化(尽量写出下列转化的化学方程式或离子方程式) (1)钠及其化合物(2)镁、铝及其化合物(3)铁、铜、银及其化合物Na Na 2S NaOH Na 2CO 3 NaHCO 3 CO 2 H 2O ①△②OH -CO 2 Ca(OH)2 H 2O SNa 2O 2 H 2O O 2点燃 CO 2C 2H 5ONa NaCl C 2H 5OH 电解水溶液HCl △ Mg MgOMgCO 3 Mg(OH)2 MgCl 2MgSO 4 H 2SO 4 H 2SO 4 H 2SO 4 电解 沸水HClNaOH Ca(OH)2H 2O 煅烧 ①O 2点燃 ②CO 2点燃 Cl 2 Fe FeO H 2SO 4 Cl 2 FeFeCl 2 FeS FeSO 4 Fe 2O 3 FeCl 3Fe(SCN)3 Fe(OH)3 Fe(OH)2 Fe 3O 4 H 2SO 4 H 2SO 4H 2SO 4 HCl NaOH HCl NaOH C O 2 Al H 2O C O 2 AlCO O 2 O 2 H 2O△S △ KSCN Al Al 2O 3 NaAlO 2AlCl 3 Al(OH)3 ①O 2点燃②Fe 2O 3高温电解 NaOH NaOHNaOH NaOH 、NH 3·H 2O HCl HCl HClHCl 、CO 2 △H 2SO 4 △ NaOHFeFe HNO 3Cu H 2SO 4△HNO 3 CuO Cu(OH)2Cu 2OCu(NO 3)2CuSO 4Cu 2S CuSH 2S浓H 2SO 4S 点燃O 2 △CO △ HNO 3 高温 RCHO 水浴加热 AgOHNa 2SS △FeAgAgNO 3Ag 2SAg(NH 3)2OHRCHO 水浴加热Ag 2CO 3AgI AgBr AgClH 2SHNO 3 HNO 3 NH 3·H 2O NH 3·H 2OHCl硅及其化合物之间的相互转化关系氯气及其化合物相互转化关系Cl2PCl 3、PClO 2②点燃NaClAgClNaOH光照3硫及其化合物相互转化关系H3Na SO 4223H 22SO 4O ,燃烧2NaOHO 2BaCl 2H 2O2氮及其化合物相互转化关系NH 4N NO 3243N 23·H 2ONH 4+ OH +H 2,催化剂高温 高压O 2 , 放电2O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O。
金属及其化合物知识点总结思维导图

金属及其化合物知识点总结思维导图【学习目标】1、掌握氧化钠与过氧化钠的性质,了解过氧化钠的用途;2、理解并掌握碳酸钠的物质性质、化学性质及用途;3、了解焰色反应及K、Na的特征焰色。
【重要方程式】【学习内容】一、氧化钠和过氧化钠1、氧化钠(Na2O)(氧元素的化合价-2价)(1)物理性质白色固体,碱性氧化物,与水化合生成NaOH,接触潮湿的空气会变质.(2)化学性质具有碱性氧化物的通性:①与水反应:Na2O + H2O = 2NaOH②与酸性氧化物反应:Na2O + CO2 = Na2CO3③与酸反应:Na2O + 2HCl = 2NaCl + H2O④加热时:Na2O + O2 = 2Na2O22、过氧化钠(Na2O2)(氧元素的化合价为-1价)(1)物理性质淡黄色固体,过氧化物(2)化学性质①与水反应(滴水生火)实验:将水滴入装有少量过氧化钠固体的试管中,立即在试管口放一根带火星的木条,检查产生的气体。
用手轻轻触摸试管外壁,有什么感觉?然后向反应后的溶液中滴加酚酞溶液。
会发生什么?振荡后是什么现象?现象:反应剧烈,产生大量气体,带火星的木条复燃,试管外壁发热,溶液变红,红色褪色。
解释:反应产生O2,反应放出热量,有NaOH生成, Na2O2有漂白性。
方程式:2Na2O2+ 2H2O = 4NaOH + O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑用途:Na2O2具有强氧化性,有漂白作用。
为氧化性漂白、永久性漂白。
②与二氧化碳反应(吹气生火)实验:用长玻璃管向蘸有Na2O2的脱脂棉吹气。
现象:Na2O2与CO2反应放出大量的热,同时产生氧气,导致脱脂棉燃烧。
方程式:2Na2O2+ 2CO2= 2Na2CO3+ O2↑(Na2O2常作供氧剂)用途:利用此反应Na2O2可以用于呼吸面具或潜水艇中作为氧气的来源。
3、氧化钠(Na2O)与过氧化钠(Na2O2)的区别二、碳酸钠和碳酸氢钠【注意】1、向饱和的Na2CO3溶液中通足量的CO2有晶体NaHCO3析出。
金属及其化合物知识点框架图

金属及其化合物知识点框架图(总6页)--本页仅作预览文档封面,使用时请删除本页--1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Na和H2O的反应2Na+2H2O===2Na++2OH-+H2↑②Na和CH3COOH的反应2Na+2CH3COOH===2CH3COO-+2Na++H2↑③Na2O2和H2O的反应2Na2O2+2H2O===4Na++4OH-+O2↑④NaH和水的反应NaH+H2O===Na++OH-+H2↑⑤向NaOH溶液中通入过量CO2OH-+CO2===HCO3-⑥将Na2CO3溶液与石灰乳混合CO32-+Ca(OH)2===CaCO3↓+2OH-⑦向Na2CO3溶液中通入过量CO2CO32-+CO2+H2O===2HCO3-⑧将Na2CO3和Ca(HCO3)2混合CO32-+Ca2+===CaCO3↓⑨将NaHCO3溶液和NaOH溶液等物质的量混合HCO3-+OH-===CO32-+H2O⑩将NaHCO3溶液与澄清石灰水等物质的量混合HCO3-+Ca2++OH-===CaCO3↓+H2O⑪将NaHCO3溶液与少量澄清石灰水混合2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O ⑫向饱和Na2CO3溶液中通入过量CO2气体2Na++CO32-+CO2+H2O===2NaHCO3↓2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式⑬Al和NaOH溶液的反应2Al+2OH-+2H2O===2AlO2-+3H2↑⑭Al(OH)3和NaOH溶液的反应Al(OH)3+OH-===AlO2-+2H2O⑮Al(OH)3和盐酸的反应Al(OH)3+3H+===Al3++3H2O⑯Al2O3和NaOH的反应Al2O3+2OH-===2AlO2-+H2O⑰Al2O3和盐酸的反应Al2O3+6H+===2Al3++3H2O⑱NaAlO2和过量盐酸的反应AlO2-+4H+===Al3++2H2O⑲向NaAlO2溶液中通入过量CO2气体AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-⑳将NaAlO2与NaHCO3混合AlO 2-+HCO 3-+H 2O===Al(OH)3↓+CO 32-○21将NaAlO 2与AlCl 3溶液混合 3AlO 2-+Al 3++6H 2O===4Al(OH)3↓○22向AlCl 3溶液中加入过量NaOH 溶液 Al 3++4OH -===AlO 2-+2H 2O○23向AlCl 3溶液中加入过量氨水 Al 3++3NH 3·H 2O===Al(OH)3↓+3NH 4+○24将AlCl 3溶液与NaHCO 3溶液混合 Al 3++3HCO 3-===Al(OH)3↓+3CO 2↑3.铁及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
