1文件分发回收记录表
YST-QR-01-003-01文件分发回收记录表1
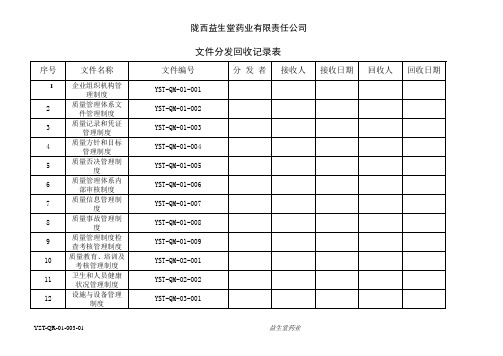
文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期1 企业组织机构管理制度YST-QM-01-0012 质量管理体系文件管理制度YST-QM-01-0023 质量记录和凭证管理制度YST-QM-01-0034 质量方针和目标管理制度YST-QM-01-0045 质量否决管理制度YST-QM-01-0056 质量管理体系内部审核制度YST-QM-01-0067 质量信息管理制度YST-QM-01-0078 质量事故管理制度YST-QM-01-0089 质量管理制度检查考核管理制度YST-QM-01-00910 质量教育、培训及考核管理制度YST-QM-02-00111 卫生和人员健康状况管理制度YST-QM-02-00212 设施与设备管理制度YST-QM-03-001文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期13 验收养护室管理制度YST-QM-03-00214 计量器具管理制度YST-QM-03-00315 计算机管理制度YST-QM-03-00416 首营企业和首营品种审核制度YST-QM-04-00117 药材及其饮片购进管理制度YST-QM-04-00218 进货质量审核管理制度YST-QM-04-00319 质量验收管理制度YST-QM-05-00120 不合格品管理制度YST-QM-05-00221 药品储存管理制度YST-QM-06-00122 药品养护管理制度YST-QM-06-00223 效期药品管理制度YST-QM-06-00324 药品出库复核管理制度YST-QM-07-001文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期25 药品运输管理制度YST-QM-07-00226 销售及售后服务管理制度YST-QM-08-00127 质量查询管理制度YST-QM-08-00228 质量投诉管理制度YST-QM-08-00329 药品退货管理制度YST-QM-08-00430 药品直调管理制度YST-QM-08-00531 用户访问管理制度YST-QM-08-00632 药品不良反应报告管理制度YST-QM-08-00733 质量领导小组职责YST-QD-02-00134 质量管理部质量职责YST-QD-02-00235 业务部质量职责YST-QD-02-00336 办公室质量职责YST-QD-02-004文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期37 总经理质量职责YST-QD-02-00538 质量负责人质量职责YST-QD-02-00639 质量管理部部长质量职责YST-QD-02-00740 业务部部长质量职责YST-QD-02-00841 办公室主任质量组职责YST-QD-02-00942 质量管理员质量职责YST-QD-02-01043 验收员质量职责YST-QD-02-01144 养护员质量职责YST-QD-02-01245 保管员质量职责YST-QD-02-01346 采购员质量职责YST-QD-02-01447 销售员质量职责YST-QD-02-01548 复核员质量职责YST-QD-02-016文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期49 运输员质量职责YST-QD-02-01750 开票员质量职责YST-QD-02-01851 计算机管理员质量职责YST-QD-02-01952 质量管理文件体系操作程序YST-QP-01-00153 质量管理体系内部审核程序YST-QP-01-00254 质量方针目标管理程序YST-QP-01-00355 质量管理制度检查考核程序YST-QP-01-00456 质量信息统计报告程序YST-QP-01-00557 质量事故处理程序YST-QP-01-00658 质量否决操作程序YST-QP-01-00759 记录和凭证管理程序YST-QP-01-00860 人员培训教育管理程序YST-QP-02-001文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期61 设备档案管理程序YST-QP-03-00262 药品购进操作程序YST-QP-04-00163 购进药品退出处理程序YST-QP-04-00264 进货情况质量评审程序YST-QP-04-00365 质量验收操作程序YST-QP-05-00166 质量档案管理程序YST-QP-05-00267 不合格品处理程序YST-QP-05-00368 药品入库储存操作程序YST-QP-06-00169 药品养护操作程序YST-QP-06-00270 中药材中药饮片养护操作方法YST-QP-06-00371 药品出库复核操作程序YST-QP-07-00172 药品运输操作程序YST-QP-07-002文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期73 质量查询处理程序YST-QP-08-00174 客户投诉处理程序YST-QP-08-00275 销后退回药品处理程序YST-QP-08-00376 质量管理文件编制计划表YST-QR-01-00177 质量管理文件审核表YST-QR-01-00278 文件分发回收记录表YST-QR-01-00379 文件变更审批单YST-QR-01-00480 文件销毁表YST-QR-01-00581 文件交接表YST-QR-01-00682 质量方针目标展开图YST-QR-01-00783 质量方针目标实施情况检查表YST-QR-01-00884 内部评审计划表YST-QR-01-009文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期85 质量管理体系内部评审记录YST-QR-01-01086 质量管理体系评审报告YST-QR-01-01187 质量管理制度执行情况检查计划YST-QR-01-01288 质量管理制度实施情况检查记录YST-QR-01-01389 质量管理制度实施情况检查考核YST-QR-01-01490 整改措施表YST-QR-01-01591 质量事故报告记录表YST-QR-01-01692 质量事故分析报告书YST-QR-01-01793 质量信息传递反馈单YST-QR-01-01894 药品质量传递反馈单YST-QR-01-01995 职工年度培训计划表YST-QR-02-00196 职工教育培训签到表YST-QR-02-002文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期97 职工教育培训实施记录YST-QR-02-00398 职工教育培训效果评价表YST-QR-02-00499 职工个人教育培训档案YST-QR-02-005100 职工年度体检计划YST-QR-02-006101 职工个人健康档案YST-QR-02-007102 职工体检情况登记表YST-QR-02-008103 人员招聘表YST-QR-02-009 104 企业员工花名册YST-QR-02-010 105 设施设备档案表YST-QR-03-001 106 设备设施履历表YST-QR-03-002 107 设备使用记录表YST-QR-03-003108 设备设施维护保养记录表YST-QR-03-004文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期109 设施设备维修记录表YST-QR-03-005110 计量器具校验记录表YST-QR-03-006111 购进计划表YST-QR-04-001112 药品购进及收货记录表YST-QR-04-002113 直调药品审批单YST-QR-04-003 114 购销合同YST-QR-04-004 115 到货请验单YST-QR-04-005 116 首营企业审批表YST-QR-04-006 117 首营品种审核表YST-QR-04-007 118 合格供货方档案YST-QR-04-008 119 合格供货方目录YST-QR-04-009120 进货质量年度评审记录YST-QR-04-010文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期121 药品质量验收记录YST-QR-05-001122 直调药品质量验收记录YST-QR-05-002123 销后退回药品质量验收记录YST-QR-05-003124 药品拒收报告单YST-QR-05-004 125 药品验收入库单YST-QR-05-005 126 验货封箱单YST-QR-05-006 127 中药标本台帐YST-QR-05-007 128 中药材标本标签YST-QR-05-008 129 药品质量档案表YST-QR-05-009130 不合格药品检查情况报表YST-QR-05-010131 不合格品登记表YST-QR-05-011132 不合格品报损审批表YST-QR-05-012文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期133 不合格药品销毁记录表YST-QR-05-013134 不合格药品处理情况汇总分析报YST-QR-05-014135 重点养护品种确定表YST-QR-06-001136 药品质量养护记录表YST-QR-06-002137 质量复查通知单YST-QR-06-003 138 药品停售通知YST-QR-06-004139 药品解除停售通知YST-QR-06-005140 药品养护档案YST-QR-06-006 141 药品退货记录表YST-QR-06-007152 库房温湿度记录表YST-QR-06-008143 药品养护情况分析报告表YST-QR-06-009144 近效期药品催销表YST-QR-06-010文件分发回收记录表序号文件名称文件编号分发者接收人接收日期回收人回收日期145 药品出库复核记录表YST-QR-07-001146 药品销售记录表YST-QR-08-001 147 销售客户目录表YST-QR-08-002148 销售客户资质审核表YST-QR-08-003149 药品召回记录YST-QR-08-004150 药品不良反应事件报告表YST-QR-08-005151 质量保证协议书YST-QR-08-006 152 法人委托书YST-QR-08-007 153 顾客接待记录YST-QR-08-008 154 质量查询记录YST-QR-08-009 155 质量投诉记录YST-QR-08-010 156 顾客意见征询书YST-QR-08-011。
JF-AD-001 文件发放回收记录表
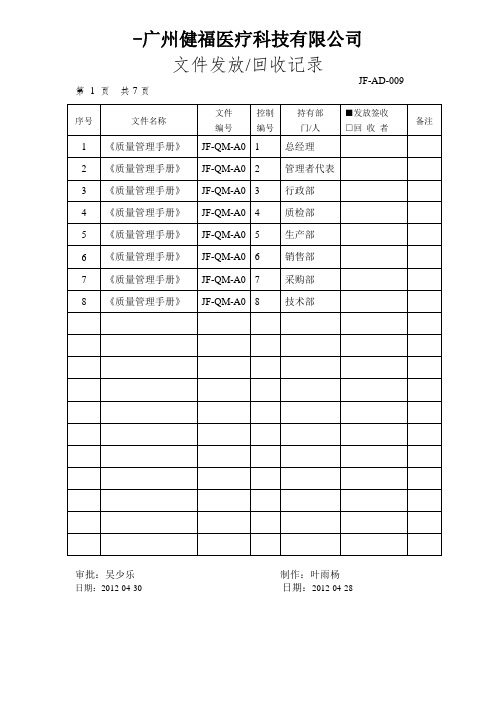
文件发放/回收记录
第7页共7页
序号
文件名称
文件
编号
控制
编号
持有部
门/人
■发放签收
□回收者
备注
1
纯化水质量标准
TS-QS-101-0.0
1
质检部
2
生产工艺规程
TS-PP-001~022
2
生产部
3
十万级净化车间控制规程
SMP-FA-101-0.0
3
生产部
4
岗位操作规程
SOP-PM-201~208
JF-QP-07
7
销售部
8
采购管理控制程序
JF-QP-08
8
采购部
9
供应商管理程序
JF-QP-09
采购部
10
产品生产管理程序
JF-QP-10
生产部
11
产品标识与追溯性控制程序
JF-QP-11
质检部
12
产品防护与交付管理程序
JF-QP-12
仓库
13
监视和测量设备控制程序
JF-QP-13
质检部
14
顾客沟通与反馈控制程序
广州健福医疗科技有限公司
文件发放/回收记录
第页共7页
序号
文件名称
文件
编号
控制
编号
持有部
门/人
■发放签收
□回收者
备注
1
预防措施控制程序
JF-QP-20
1
质检部
2
忠告性通知控制程序
JF-QP-21
2
总经理
3
不良事件监测报告控制程序
JF-QP-22
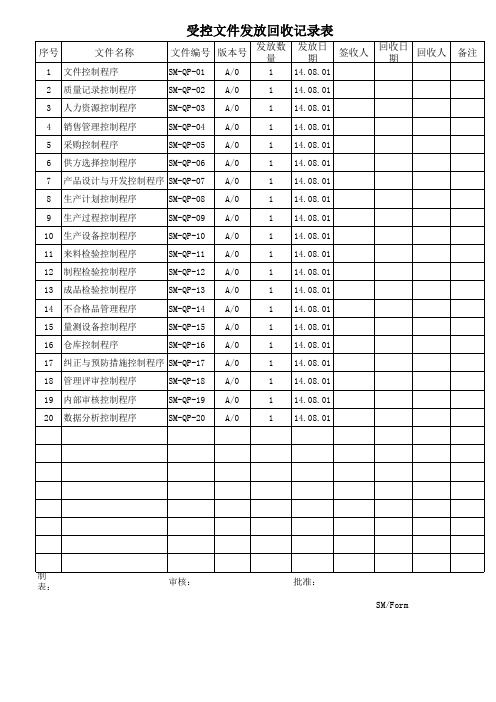
受控文件发放记录表
SM-QP-18 A/0
1 14.08.01
19 内部审核控制程序
SM-QP-19 A/0
1 14.08.01
20 数据分析控制程序
SM-QP-20 A/0
1 14.08.01
制 表:
审核:
批准:
SM/Form
序号
文件名称
1 文件控制程序
受控文件发放回收记录表
文件编号 版本号
发放数 量
发放日 期
签收人
回收日 期
回收人
备注
SM-QP-01 A/0
1 14.08.01
2 质量记录控制程序
SM-QP-02 A/0
1 14.08.01
3 人力资源控制程序
SM-QP-03 A9 生产过程控制程序
SM-QP-09 A/0
1 14.08.01
10 生产设备控制程序
SM-QP-10 A/0
1 14.08.01
11 来料检验控制程序
SM-QP-11 A/0
1 14.08.01
12 制程检验控制程序
SM-QP-12 A/0
1 14.08.01
13 成品检验控制程序
SM-QP-13 A/0
SM-QP-04 A/0
1 14.08.01
5 采购控制程序
SM-QP-05 A/0
1 14.08.01
6 供方选择控制程序
SM-QP-06 A/0
1 14.08.01
7 产品设计与开发控制程序 SM-QP-07 A/0
1 14.08.01
8 生产计划控制程序
SM-QP-08 A/0
1 14.08.01
1 14.08.01
14 不合格品管理程序
【优质】记录文件表格

编号:D02-4.2受控文件清单编号:D03-4.2文件审批表编号:D04-4.2文件修改申请编号:D05-4.2编号:D06-4.2编号:D07-4.2技术标准登记表编号:D09-4.2质量记录清单编号:D10-4.2质量策划实施情况检查表编号:D11-5.4管理评审计划编号:D12-5.6管理评审通知单编号:D13-5.6管理评审报告编号:D14-5.6编号:D15-6.2编号:D16-6.2年度培训计划编号:D17-6.2职工花名册编号:D18-6.2设施管理卡编号:D19-6.3 序号:生产设施一览表编号:D20-6.3设施报废单编号:D21-6.3 序号:产品要求评审表编号:D22-7.2□初次审核□修订(原评审表号:)序号:定单确认表编号:D23-7.2 序号:供方评定记录表编号:D24-7.4 序号:合格供方名录编号:D25-7.4采购计划编号:D26-7.4 序号:采购要求单编号:D27-7.4 序号:采购单编号:D28-7.4 序号:领料单物料标识卡编号:D30-7.5 序号:物资发放卡顾客财产问题反馈表编号:D32-7.5 序号:编号:D33-7.6 序号:编号:D34-7.6计量校准计划编号:D35-7.6顾客满意度查表编号:D36-8.2 序号:编号:D37-8.2编号:D38-8.2 序号:审核组组长:组员:日期:第页共页1、审核目的:2、审核依据:GB/T 19001-2000 idt ISO 9001:20003、审核覆盖产品:4、审核时间:年月日至年月日首次会议时间:月日时分末次会议时间:月日时分5、现场审核期间请被审核方有关人员参加下列活动:首、末次会议:最高管理者或其代表及与审核有关的管理人员参加。
审核活动:按审核日程安排,被审核方有关人员在本岗位。
6、审核安排:内审检查表编号:D39-8.2 共页第页审核员:不合格报告编号:D40-8.2 序号:内部体系审核报告(可另附纸叙述)编号:D41-8.2 序号:内审首、末次会议签到表编号:D42-8.2 时间:地点:不合格项分布表编号:D43-8.2 序号:进货验证记录。
文件记录管理乌龟图
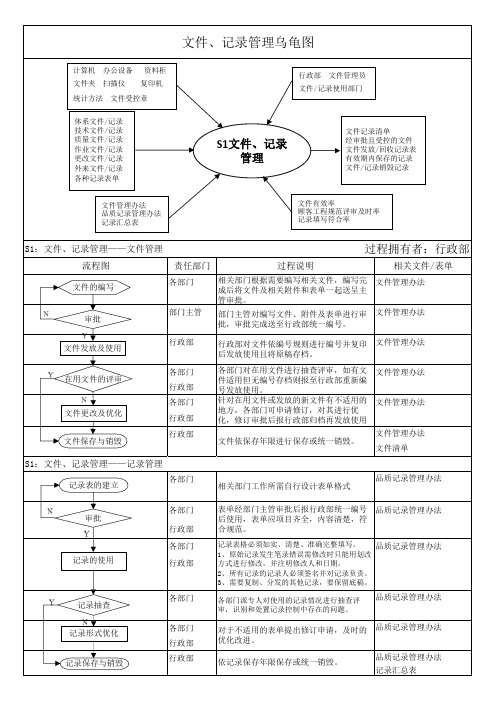
责任部门各部门部门主管行政部各部门行政部各部门行政部行政部各部门各部门行政部各部门行政部各部门各部门行政部行政部各部门派专人对使用的记录情况进行抽查评审,识别和处置记录控制中存在的问题。
相关部门工作所需自行设计表单格式表单经部门主管审批后报行政部统一编号后使用,表单应项目齐全,内容清楚,符合规范。
对于不适用的表单提出修订申请,及时的优化改进。
依记录保存年限保存或统一销毁。
记录表格必须如实、清楚、准确完整填写。
1、原始记录发生笔录错误需修改时只能用划改方式进行修改,并注明修改人和日期。
2、所有记录的记录人必须签名并对记录负责。
3、需要复制、分发的其他记录,要保留底稿。
品质记录管理办法品质记录管理办法品质记录管理办法记录汇总表文件、记录管理乌龟图相关部门根据需要编写相关文件,编写完成后将文件及相关附件和表单一起送呈主管审批。
部门主管对编写文件、附件及表单进行审批,审批完成送至行政部统一编号。
行政部对文件依编号规则进行编号并复印后发放使用且将原稿存档。
各部门对在用文件进行抽查评审,如有文件适用但无编号存档则报至行政部重新编号发放使用。
品质记录管理办法S1:文件、记录管理——记录管理品质记录管理办法品质记录管理办法文件管理办法文件清单针对在用文件或发放的新文件有不适用的地方,各部门可申请修订,对其进行优化,修订审批后报行政部归档再发放使用文件依保存年限进行保存或统一销毁。
文件管理办法文件管理办法文件管理办法文件管理办法文件管理办法S1:文件、记录管理——文件管理过程拥有者:行政部流程图过程说明相关文件/表单S1文件、记录管理计算机 办公设备 资料柜文件夹 扫描仪 复印机统计方法 文件受控章 体系文件/记录 技术文件/记录 质量文件/记录 作业文件/记录 更改文件/记录 外来文件/记录 各种记录表单行政部 文件管理员文件/记录使用部门文件有效率顾客工程规范评审及时率 记录填写符合率文件管理办法 品质记录管理办法 记录汇总表文件记录清单经审批且受控的文件 文件发放/回收记录表 有效期内保存的记录 文件/记录销毁记录审批 文件发放及使用文件更改及优化 在用文件的评审文件保存与销毁审批记录的使用记录形式优化记录抽查 记录保存与销毁记录表的建立文件的编写。
文件回收记录表

)(
)( □ 综合管理部
)(
)( □ 业务部签名
)(
) □ 运作部签名
)
序 号
文件编号
1
2
3
4
5
6
文 件
文件名称
XXXX物流发展有限公司 文件回收记录表
版本
生效 日期
回收 日期
数 量
□ 业总务经总理监签签名 □名 □ 财务部签名
供应链发展
□部 □ 业总务经总理监签签名 □名 □ 财务部签名
供应链发展
□部 □ 总经理签名
业务总监签
□名 □ 供财应务链部发签展名 □部 □ 总经理签名
)( □ 文控中心签名
)( □ 商务部签名
) □ 仓储部签名
XX WL-QR-ZH-006 A0
(
营运总监签
(
)( □ 名
)(
)( □ 综合管理部
)(Βιβλιοθήκη )( □ 业务部签名)(
)(
□ 运作部签名
营运总监签
)(
)( □ 名
)(
)( □ 综合管理部
)(
)( □ 业务部签名
)(
)(
□ 运作部签名
营运总监签
)(
)( □ 商务部签名
)(
□ 仓储部签名
总经理助理签
)( □ 名
)( □ 文控中心签名
)( □ 商务部签名
)(
□ 仓储部签名
总经理助理签
)( □ 名
)( □ 文控中心签名
)( □ 商务部签名
)( □ 总仓经储理部助签理名签 )( □ 名
)( □ 文控中心签名
)( □ 商务部签名
)( □ 总仓经储理部助签理名签 )( □ 名
文件发放、回收记录已填2013

质量健康安全环境Quality Health Safety Environment
受控文件清单
发行版本:I
修改码:0
受控号:
编制:付洪梅 2013年 4月20 日
审核:李子高2013年4月20 日
批准:李子江2013年4月20日2013-04-20发布2013-04-20实施大庆金盛隆建筑安装工程有限公司发布
受控文件清单
编码:JL/4.2.3-03 编号:
保存部门: 技质部保存期限:3 年
受控文件清单
编码:JL/4.2.3-03 编号:
保存部门: 技质部保存期限: 3 年
文件发放、回收记录
保存部门:技质部保存期限:3 年
保存部门:技质部保存期限: 3 年
保存部门:技质部保存期限: 3 年
保存部门:技质部保存期限: 3 年
保存部门:技质部保存期限: 3 年
保存部门:技质部保存期限:3 年
保存部门:技质部保存期限: 3 年
保存部门:技质部保存期限:3 年
保存部门:技质部保存期限:3 年
保存部门:技质部保存期限:年。
CX12-04成文信息发放与回收记录表
无缝钢管尺寸。外形。重量及允许偏差
GB/T17395-2998
9
化工设备、管道防腐蚀工程施工及验收规范
HGJ229-91
10
11
12
2016.10.16
6
程序文件
KT/QEO-CX—01∽28
7
管理制度
KT /ZY -2016
8
应急预案汇编
9
管理手册
KT/QEO-SC-01-2016
2016.10.16
10
程序文件
KT/QEO-CX—01∽28
11
管理制度
KT /ZY -2016
12
应急预案汇编
成文信息发放与回收记录表
编号:JL-CX12-04
序号
文件名称
文件编号
接收部门
分发序号
接收人/日期
回收记录
1
中华人民共和国合同法研发部来自2016.10.162
计量法
3
安全生产法
4
质量管理体系要求
ISO19001:2015
5
环境管理体系要求
ISO14001:2015
6
职业健康安全管理体系要求
GB/T28001-2011
7
衬里钢壳设计技术规定
HG/T20678-2000
成文信息发放与回收记录表
编号:JL-CX12-04
序号
文件名称
文件编号
接收部门
分发序号
接收人/日期
回收记录
1
管理手册
KT/QEO-SC-01-2016
办
公
室
2016.10.16
2
程序文件
KT/QEO-CX—01∽28
ISO9000认证-文件控制程序

文件控制程序编号:XT-02-7.5-00011、目的对企业质量、环境和安全管理体系所要求的文件进行控制,确保质量、环境和安全管理体系运行各场所使用有效的版本文件。
2、适用范围本程序适用于质量、环境和安全管理体系各类文件的管理和控制(包括外来文件)。
3、职责3.1综合管理部负责组织管理手册、程序文件及相关文件和资料的编写、编号、登记发放、回收、销毁、原稿的保存及做好相关记录并负责修改和及时更新、标识。
3.2生产技术部负责外来图纸、标准的收集、控制和管理,综合管理部负责相关法律法规的收集、控制和管理。
3.3生产技术部负责操作规程,作业指导书等技术性文件和相关管理文件的编写。
3.4管理体系负责人负责管理手册、程序文件的审核,总经理批准;生产技术部负责技术文件的编制、审核、批准。
3.5安环部负责环境、安全管理文件的编写。
4、工作程序4.1文件的分类4.1.1管理手册4.1.2程序文件4.1.3第三层次文件:包括技术文件(产品标准、图纸)、工艺文件、操作规程、质量、环境和安全管理规定、外来文件及适用的法律法规和其他要求等。
4.1.4记录:按《记录控制程序》控制。
4.2文件编号4.2.1企业代号:XT(泰山瑞豹拼音首字母)表示。
4.2.2文件类别代号:管理手册“01”,程序文件为“02”,第三层次文件为“03”,记录为“04”,体系运行之前的外来文件和技术性文件、记录编号引用原编号登记控制。
程序文件代号后加标准条款号。
如:XT (企业代号)-02(程序代号)-4.2.3(标准条款号)-0001(文件序号)。
4.2.3文件的顺序号,在标准条款号或以四位数字代替的文件名称后加0001、0002……以此类推。
例:XT —03(第三层次文件代号)—0701(文件名称)—0001(文件序号)。
同一名称的表单有多种不同内容格式时,在文件顺序号后面加A1、A2…来表示。
4.3文件的编制与审批4.3.1在管理体系负责人的领导下,管理手册由综合管理部组织编写,管理体系负责人审核,总经理批准发布。
质量管理体系文件管理制度

文件目录质量管理体系文件管理制度质量管理体系文件操作规程文件发放(回收)登记表文件销毁申请表5. 10文件的发放及回收:质量管理部负责文件的发放及回收,质量管理体系文件在发放时应填写《文件发放(回收)登记表》,对于修改及废止的文件及时回收,发放、回收记录由质量管理部负责控制和管理;5.11已废止的文件或者失效的文件除留档备查外,不得在工作现场出现,质量管理部负责文件的销毁工作,销毁文件申请人须填写《销毁文件申请表》经批准后对文件进行销毁,销毁人做好《销毁文件登记表》。
5. 12质量管理体系文件的控制规定:5. 12. 1确保文件的合法性和有效性,文件发布前应得到批准;12. 2确保符合有关法律法规及规章;5.12.3各类文件应标明其类别编码,并明确其适用范围;5. 12. 4对记录文件的控制,应确保其完整、准确、有效;应当保证各岗位获得与其工作内容相对应的必要文件,并严格按照规定开展工作。
5. 13质量管理体系文件的执行规定:5. 13. 1质量管理制度、操作规程、岗位职责下发后,质量管理部门应组织各部门负责人和相关岗位人员学习,并与文件执行日期统一执行,质量管理部门负责指导和监督。
5. 13. 2各项质量工作的记录凭证应真实、完整、规范。
XXXXX文件发放(回收)登记表编号:XXXXX 公司文件销毁申请表编号:销毁原因: 申请人:日期:文件保管部门意见:签名:日期:质量副总意见:签名:日期:总经理意见:签名: 日期:1.目的:规范质量管理体系文件的编制/审核/分发/修订,确保文件的有效性和适宜性。
2.依据:根据《药品管理法》及其实施条例、《药品经营质量管理规范》等法律法规制定本制度。
3.范围:适用于本企业质量管理体系文件的管理。
4.职责:4.1质量管理部负责文件编制计划、审核、收发、管理、保管、销毁及文件执行情况的监督;2公司各部门负责人负责本部门文件的起草及本部门文件的保管;5.内容:5.1质量管理体系文件是指一切涉及药品经营质量管理的书面标准和实施过程中的记录结果组成的、贯穿药品质量管理全过程的系列文件。
