苏教版 高中化学必修一常见方程式 最好版本
高一化学方程式大全苏教版

Al2(SO4)3+ 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4
41、氢氧化铝与盐酸反应:
Al(OH)3+ 3HCl = AlCl3+ 3H2O
42、氢氧化铝与氢氧化钠溶液反应:
Al(OH)3+ NaOH = NaAlO2+ 2H2O
43、氢氧化铝加热分解:2Al(OH)3△Al2O3+ 3H2O
Na2SiO3+ CO2+ H2O = Na2CO3+ H2SiO3↓
63、Si + 2F2= SiF4
64、Si + 2NaOH + H2O = Na2SiO3+2H2↑
65、硅单质的实验室制法:
粗硅的制取:SiO2+ 2C高温Si + 2CO
粗硅转变为纯硅:Si(粗) + 2Cl2△SiCl4
SiCl4+ 2H2高温Si(纯)+ 4HCl
87、浓硝酸与铜反应:
Cu + 4HNO3(浓) = Cu(NO3)2+ 2H2O + 2NO2↑
88、稀硝酸与铜反应:
3Cu + 8HNO3(稀)△3Cu(NO3)2+ 4H2O + 2NO↑
89、浓硝酸和木炭反应:
C + 4HNO3(浓)△CO2↑+ 4NO2↑ + 2H2O
90、4HNO3光照4NO2+O2+ 2H2O
19、NaBr + AgNO3====AgBr + NaNO3
20、NaI+ AgNO3====AgI + NaNO3
苏教版高中化学必修1化学方程式大全

苏教版化学必修1化学方程式总结1、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 2、铁及其化合物的转化关系 ① Fe 3O 4+4CO △ 3Fe +4CO 2 ※② 3Fe +4H 2O(g) Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2OFe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⒁ 2O 3 A l (O H )3 KAl(SO 4)22AlCl 3 ④ ⑤ ⑥⑦⑧ ⑨⑩⑾※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3 3、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 4、硫及其化合物的转化关系①S +O 2 点燃SO 2 ②2H 2S +SO 2=3S +2H 2O ※③SO 2+O 2 催化剂加热 2SO 3NaCl Na NaOH NaHCO Na 2Na 2① ② ③ ⑤⑾ ⑿ ⒁ ⒂④① S 4 ②④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2 △2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓)△CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClO6、氮及其化合物的转化关系 ※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦⑧ ⑨ ⑩ ① ⑨ ⑧⑦ ⑥ N 2 NH 3 NH 4Cl NO NO HNO 3 ② ③ 点燃或光照 光照光照 高温或放电 光照※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
苏教版《必修1》化学方程式汇总(精选版)

1) 2KClO32KCl+3O 2↑2) 2H2O 22H 2O+O 2↑3) 2KMnO 4K 2MnO 4+MnO 2+O 2↑4) NH 4HCO 3NH 3↑+H 2O+CO 2↑5) NH 4Cl+NaOH =NaCl+NH 3·H 2O(不加热一般得到NH 3·H 2O ,加热得NH 3)6) (NH 4)2SO 4+2NaOH =MnO 2Na 2SO 4+2NH 3·H 2O7) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O8) NH 4Cl+NaOH NaCl+NH 3↑+H 2O (遇湿润的红色石蕊试纸变蓝色)9) (NH 4)2SO 4+2NaOHNa 2SO 4+2NH 3↑+2H 2O10) NH 4NO 3+NaOHNaNO 3+NH 3↑+H 2O铵离子 的检验11) NH 4Cl+AgNO 3=AgCl ↓+ NH 4NO 3 (氯离子检验先加AgNO 3后加稀HNO 3)12) (NH 4)SO 4+BaCl 2=BaSO 4↓+2NH 4Cl (硫酸根检验先加稀HCl 无现象再加BaCl 2)专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物 1) 2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑(阳极产生氯气,阴极产生氢气和OH -)2) MnO 2+4HCl (浓) MnCl 2+Cl 2↑+2H 2O (用饱和NaCl点燃通电除HCl ,浓硫酸除H 2O )3) 2Fe+3Cl 2 2FeCl 3 (棕褐色的烟,产物只能生成+3价的Fe)4)Cu+Cl 2 CuCl 2 (棕黄色的烟) 5)2Al+3Cl 2 2AlCl 3 6)2Na+Cl 2 =2NaCl (白烟) 7)H 2+Cl 2 2HCl (苍白色火焰) 8)Cl 2+H 2O HCl+HClO (Cl 2只有少量的与水反应,大量的Cl 2以分子形式存在于水溶液中,所以氯水呈黄绿色)(离子方程式HClO 不能拆开) 9)2HClO 2HCl+O 2↑ 10)Cl 2+2NaOH =点燃点燃 点燃 光照NaCl+NaClO+H2O(Cl2尾气吸收)11)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(工业生产漂粉精)主要成分CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2漂白原理12) Ca(ClO)2+2HCl=CaCl2+2HClO13) Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO如表示漂白粉失效,方程式有两个,后一个是HClO见光再分解14) Cl2+2NaBr=2NaCl+Br215) Cl2+2KI=2KCl+I2(可用淀粉碘化钾溶液检验Cl2)16) Br2+2KI=2KBr+I2(氧化性Cl2﹥Br2﹥I2 还原性I—﹥Br—﹥Cl—)17) NaBr+AgNO3=AgBr↓+ NaNO3(淡黄色沉淀)18) KI+AgNO3=AgI↓+ KNO3(黄色沉淀可检验I—)第二单元钠、镁及其化合物1) 2Na+2H2O=2NaOH+H2↑(熔成小球,浮在水面,四处游动,嘶嘶作响,酚酞变红)2) 4Na+O 2=2Na 2O (白色固体)(Na 2O 在空气中加热可转化为Na 2O 2)3) 2Na+O 2Na 2O 2 (淡黄色固体)4) 2Na+Cl 2=2NaCl(白烟)5) 2Na+S =Na 2S (研磨爆炸)6) 4Na+TiCl 4 Ti+4NaCl (熔融情况下Na 可冶炼贵重金属,在溶液中不能)点燃 700~800通电7) 2NaCl2Na+Cl2↑8) Na2O+H2O=2NaOH9) 2Na2O2+2H2O=4NaOH+O2↑(Na2O2既是氧化剂,又是还原剂)2Na2O2+4HCl=4NaCl+2H2 O+O2↑(Na2O是碱性氧化物,Na2O2不是碱性氧化物)相当于增加1mol H2的质量10) Na2O+CO2=Na2CO311) 2Na2O2+2CO2=2Na 2CO 3+O 2↑(Na 2O 2是供氧剂,又具强氧化性,有漂白性)相当于增加1mol CO 的质量12) Na 2CO3+2HCl =2NaCl+H 2O+CO 2↑13) CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑(CaCl 2或BaCl 2溶液中通入CO 2无CaCO 3或BaCO 3沉淀生成,原因弱酸一般..不制强酸) 14) NaHCO 3+ HCl =NaCl+H 2O+CO 2↑(比Na 2CO 3和盐酸反应剧烈)15) 2NaHCO 3Na 2CO 3+H 2O+CO 2↑ (NaHCO 3强酸制 弱酸固体转化为Na2CO3用Δ)16) NaHCO3+NaOH=Na2CO3+H2O (NaHCO3溶液转化为Na2CO3可加入NaOH)17) CO2+H2O+Na2CO3=2NaHCO3(CO2中混有HCl不用饱和碳酸钠,而用碳酸氢钠)18) CO2+2NaOH=Na2CO3+H2O(少量CO2)CO2+NaOH=NaHCO3(足量CO2)19) CH 3COOH+NaOH =CH 3COONa+H 2O20) 2CH 3COOH+Na 2CO 3=2CH 3COONa+H 2O+CO 2↑21) CH 3COOH CH 3COO -+H +(弱电解质电离符号是可逆的,用表示)常见的弱酸有H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、CH 3COOH 、H 3PO 4(中强)、HCN (极弱)、H 2SiO 3(不溶) 常见的强酸有H 2SO 4、HNO 3、HCl 、HBr 、HI22) CaCO 3CaO+ CO 2↑ 23) 2O =Ca(OH)224) Ca(OH)2+MgCl 2=Mg(OH)2↓+CaCl 2高温 镁的提取25) Mg(OH)2+2HCl =MgCl 2-+2H 2O26) MgCl 2Mg+Cl 2↑(MgO 熔点高,工业上用电解MgCl 2)27) 3Mg+N 2Mg 3N 2 28) 2Mg+CO 22MgO+C (金属单质置换出非金属单质典型反应)29)* Mg+2H 2O Mg(OH)2+H 2↑ 专题3 从矿物到基础材料第一单元 从铝土矿到铝合金1) Al 2O 3+2NaOH =2NaAlO 2+H 2O2) NaAlO 2+2H 2O+CO 2(过量)=从铝 土矿 中提 取铝 点燃通电点燃Al(OH)3↓+NaHCO 33) 2Al(OH)3 Al 2O 3 +3H 2O 4) 2Al 2O 34Al+3O 2↑ (只能用电解Al 2O 3,而AlCl 3不行)5) 2Al+6HCl= 2AlCl 3+3H 2↑6) 2Al+2NaOH+2H 2O= 2NaAlO 2+3H 2↑Al 与冷的浓硫酸、冷的浓硝酸钝 7) 2Al+Fe 2O 3 Al 2O 3+2Fe 利用铝热反应还可以把其它过渡元素从它们的氧化物(如MnO 2、Fe 3O 4、Cr 2O 3、V 2O 5等)中还原出来8) Al(OH)3+3HCl =AlCl 3+3H 2O 通电Al 是两性元素高温 Al(OH)3是两性元素9) Al(OH)3+NaOH =NaAlO 2+2H 2O10) AlCl 3+3NaOH =Al(OH)3↓+3NaCl11) Al(OH)3+NaOH =NaAlO 2+2H 2O12)* AlCl 3+4NaOH (过量)=NaAlO 2+3NaCl+2H 2O13) 制备氢氧化铝:(1)从铝盐制备最好用氨水: Al 3++3NH 3·H 2O===Al(OH)3↓+3NH 4+AlCl 3中 逐滴加入NaOH 溶 液至过量(2)从偏铝酸盐最好通CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(足量CO2)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(少量CO2)*(3)从铝盐和偏铝酸盐制备:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2- +Al3+ +6H2O=4Al(OH)3↓15) 明矾净水原理:明矾溶于水后完全电离:KAl(SO4)2===K++Al3++2SO42-铝离子与水反应生成:Al(OH)3胶体:Al3++3H2O===Al(OH)3(胶体)+3H+16)侯氏制碱:NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(可用于工业制备小苏打,苏打)一、物质的分离和提纯二、溶液的配置步骤(1)计算:(2)称量(量取):(3) 溶解(稀释):并冷却到室温;(4) 转移:(5)洗涤:(6)定容:(7)摇匀:(8)装瓶。
苏教版必修1化学方程式

1、硫酸根离子的检验: BaCl 2 + Na 2SO 4 = BaSO 4↓+ 2NaCl2、碳酸根离子的检验: CaCl 2 + Na 2CO 3 = CaCO 3↓ + 2NaCl3、碳酸钠与盐酸反应: Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑4、木炭还原氧化铜: 2CuO + C c C02↑ +2Cu 5、铁片与硫酸铜溶液反应: Fe + CuSO 4 = FeSO 4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl 2 + Na 2CO 3 = CaCO 3↓+ 2N aCl 二:钠及其化合物的反应方程式:1、钠在空气中燃烧:2Na + O 2 Na2O 2 , 2、钠与氧气反应:4Na + O 2 = 2Na 2O3、钠与水反应:2Na + 2H 2O = 2NaOH + H 2↑4、氧化钠与水的反应:Na 2O + H 2O = 2NaOH ,5、氧化钠与二氧化碳的反应:2NaOH +CO 2 = 2Na 2CO 3 + 2H 2O6、过氧化钠与水反应:2Na 2O 2 + 2H 2O = 4NaOH + O 2↑7、过氧化钠与二氧化碳反应:2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 28、碳酸氢钠对热不稳定:2NaHCO 3 Na 2CO 3 + H 2O + CO 29、碳酸氢钠与氢氧化钠反应:NaHCO 3 + NaOH = Na 2CO 3 + H 2O10、碳酸钠与二氧化碳的反应: Na 2CO 3 + CO 2 + H 2O = 2NaHCO 311、碳酸钠与盐酸的反应:Na 2CO 3 + 2HCl = 2NaCl + H 2ONa 2CO 3 + HCl = NaHCO 3 + NaCl三:铝及其化合物的反应方程式:1、铝在空气中燃烧:4Al+3O 2 2Al2O 3 2、铝与盐酸反应:2Al + 6HCl = 2AlCl 3 + 3H 2↑3、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑4、氧化铝与盐酸反应:Al 2O 3 + 6HCl = 2AlCl 3 + 3H 2O5、氧化铝与氢氧化钠溶液反应:Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O6、实室制取氢氧化铝:Al 2(SO 4)3 + 6NH 3·H 2O = 2Al(OH)3↓ + 3(NH 3)2SO 47、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl 3 + 3H 2O8、 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO 2 + 2H 2O9、氢氧化铝加热分解:2Al(OH)3 Al 2O 3 + 3H 2O10、偏铝酸钠与二氧化碳的反应:NaAlO 2 + CO 2 + H 2O = Al(OH)3↓ + NaHCO 3高温 ∆ ∆ 点燃 ∆11、偏铝酸钠与铝盐反应:3NaAlO 2 + AlCl 3 + 6H 2O = 4Al(OH)3↓ + 3NaCl12、偏铝酸盐与少量的盐酸反应:NaAlO2 + H2O + HCl = Al(OH)3↓ + NaCl 四:铁及其化合物的反应方程式:1、 铁与水蒸气反应:3Fe + 4H 2O(g) Fe 3O 4 + 4H 2↑2、 氧化铁与盐酸反应:Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O3、 Fe(OH)3胶体的制备:FeCl 3(饱和)+3H 2O Fe(OH)3(胶体)+3HCl4、 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl5、 硫酸亚铁与氢氧化钠溶液反应:FeSO 4 + 2NaOH = Fe(OH)2↓+ Na 2SO 46、 氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H 2O + O 2 = 4Fe(OH)37、 氢氧化铁加热分解:2Fe(OH)3 Fe 2O 3 + 3H 2O↑8、 三氯化铁溶液与铁粉反应:2FeCl 3 + Fe = 3FeCl 29、 氯化亚铁中通入氯气:2FeCl 2 + Cl 2 = 2FeCl 310、 铁离子的特征反应: Fe 3+ +SCN -= Fe(SCN)3 (血红色)五:硅及其化合物反应的化学方程式:1.硅单质与氟反应:Si + 2F 2 =SiF 42.硅单质与氧气的反应:Si + O 2 SiO2 3.硅单质与氢氟酸反应:Si + 4HF = SiF4 ↑+ 2H2↑4.硅单质与强碱反应:Si + 2NaOH + H 2O = Na 2SiO 3 + 2H 2↑5.二氧化硅与氧化钙高温反应:SiO 2 + CaO CaSiO 36.二氧化硅与氢氟酸反应:SiO 2 + 4HF = SiF 4 + 2H 2O7.二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O8.粗硅的提纯:SiO 2 + 2C Si(粗硅)+ 2CO 、Si + 2Cl 2 sSiCl 4SiCl 4 + 2H 2 Si + 4HCl9、硅酸钠与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H 2SiO 3↓10、往硅酸钠溶液中通入二氧化碳:Na 2SiO 3 + CO 2 + H 2O = Na 2CO 3 + H 2SiO 3↓11、玻璃成分的制备:Na 2CO 3 + SiO 2 n Na 2SiO 3 + CO 2↑CaCO 3 + SiO 2 CaSiO 3 + CO 2↑∆ ∆∆ ∆ 高温 ∆ ∆ ∆ 高温 高温 ∆六:氯气及其化合物的化学方程式1、氯气与金属铁反应:2Fe + 3Cl 2 2FeCl 32、氯气与金属铜反应:Cu + Cl 2 CuCl 23、氯气与金属钠反应:2Na + Cl 2 2NaCl4、氯气与氢气的反应:H 2 + Cl 2 22HCl , H 2 + Cl 2 2HCl(爆炸)5、氯气与水反应:Cl 2 + H 2O = HCl + HClO6、次氯酸光照分解:2HClO 2HCl + O 2↑7、氯气与氢氧化钠溶液反应:Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Br2,I2亦可)8、氯气与消石灰反应:2Cl 2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O9、盐酸与硝酸银溶液反应:HCl + AgNO 3 = AgCl↓ + HNO 310、漂白粉长期置露在空气中:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO11、氯气的置换反应:Cl 2 + 2NaX = 2NaCl + X 2( X=Br ,I)12、溴的置换反应: Br 2 + 2NaI = 2NaBr + I 213、氟与水的反应:2F 2 + 2H 2O = 4HF + O 2七:硫及其化合物反应的化学方程式1、硫与氧气反应:S + O 2 SO2 2、二氧化硫与氧气反应:2SO2 + O2 2SO3 (可逆反应)3、二氧化硫与水反应:SO 2 + H 2O ≒ H 2SO 34、三氧化硫与水反应:SO 3 + H 2O = H 2SO 45、SO 2 + CaO CaSO 36、SO 2 + 2NaOH = Na 2SO 3 + H 2O7、SO 2 + Ca(OH)2 = CaSO 3↓ + H 2O8、SO 2 + Cl 2 + 2H 2O = 2HCl + H 2SO 49、SO 2 + 2H 2S = 3S + 2H 2O10、浓硫酸与铜反应:Cu + 2H 2SO 4(浓) CuSO 4 + 2H 2O + SO 2↑11、浓硫酸与木炭反应:C + 2H 2SO 4(浓) CO 2 ↑+ 2SO 2↑ + 2H 2O点燃 点燃 点燃 点燃 光照 光照 点燃 催化剂/∆ 高温 ∆ ∆八:氮及其化合物的反应方程式:1、氮气与氧气在放电下反应:N 2 + O 2 2NO2、一氧化氮与氧气反应:2NO + O 2 = 2NO 23、二氧化氮与水反应:3NO 2 + H 2O = 2HNO 3 + NO4、一氧化氮与水反应:4NO + 3O 2 + 2H 2O = 4HNO 35、二氧化氮与水的反应:4NO 2 + O 2 + 2H 2O = 4HNO 36、浓硝酸与铜反应:Cu + 4HNO 3(浓) = Cu(NO 3)2 + 2H 2O + 2NO 2↑7、稀硝酸与铜反应:3Cu + 8HNO 3(稀)= 3Cu(NO 3)2 + 4H 2O + 2NO↑8、氨水受热分解:NH 3·H 2O NH 3↑ + H 2O9、氨气的合成:N 2 + 3H 2 2NH 3 10、氨气与氯化氢反应:NH 3 + HCl = NH 4Cl11、氨气与氧气的反应:4NH 3 + 502 4NO +6H 2O12、氯化铵受热分解:NH 4Cl NH 3↑ + HCl↑13、碳酸氢氨受热分解:NH 4HCO 3 NH 3↑ + H 2O↑ + CO 2↑14、硝酸铵与氢氧化钠反应:NH 4NO 3 + NaOH NH3↑ + NaNO 3 + H 2O 15、 氨气的实验室制取:2NH 4Cl + Ca(OH)2 CaCl 2 + 2H 2O + 2NH 3↑16、硫酸铵与氢氧化钠反应:(NH 4)2SO 4 + 2NaOH 2NH 3↑ + Na 2SO 4 + 2H 2O17、 NO 、NO 2的回收:NO 2 + NO + 2NaOH = 2NaNO 2 + H 2O 放电或高温 ∆ ∆ ∆ ∆ ∆ ∆ 催化剂高温高压 催化剂/∆。
苏教版化学必修一化学方程式总结word版

一、复分解反应(非氧化还原反应)1、酸性氧化物与碱反应生成盐和水①.二氧化硅与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O②.三氧化硫与Ca(OH)2溶液反应:SO3+Ca(OH)2=CaSO4+H2O2、碱性氧化物与酸反应生成盐和水①.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O②.氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O3、两性氧化物与酸反应生成盐和水Al2O3与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O4、两性氧化物与碱反应生成盐和水Al2O3与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O5、酸性氧化物的特殊反应二氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O6、碱与酸反应生成盐和水①.Al(OH)3与盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O7、盐与酸反应生成新盐和新酸①.硅酸钠与盐酸反应:Na2SiO3+2HCl=2NaCl+H2SiO3↓②.漂白粉长期置露在空气中:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO8、盐水解生成新酸和新碱Fe(OH)3胶体的制备:FeCl3+3H2O加热Fe(OH)3(胶体)+3HCl9、两性氢氧化物与碱反应生成盐和水Al(OH)3与氢氧化钠溶液反应:Al(OH)3+NaOH=NaAlO2+2H2O10、盐与碱反应生成新盐和新碱①.实验室制取氢氧化铝(铝盐溶液加氨水):Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4②.氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH=3NaCl+Fe(OH)3↓(红褐色)③.硫酸亚铁与氢氧化钠溶液反应:FeSO4+2NaOH=Na2SO4+Fe(OH)2↓(白色)④.硝酸铵与氢氧化钠反应:NH4NO3+NaOH加热NH3↑+NaNO3+H2O⑤.氨气的实验室制取法:2NH4Cl+Ca(OH)2加热CaCl2+2H2O+2NH3↑⑥.硫酸铵与氢氧化钠反应:(NH4)2SO4+2NaOH加热2NH3↑+Na2SO4+2H2O二、置换反应(氧化还反应)1、还原性非金属单质与氧化物反应置换金属单质碳还原氧化铜:2CuO+C高温2Cu+CO2↑2、金属单质置换出还原性非金属单质①.金属与水的反应:铁与水蒸气反应:3Fe+4H2O(g)加热Fe3O4+4H2↑钠与水反应:2Na+2H2O=2NaOH+H2↑②.金属与酸的反应:Al与盐酸反应:2Al +6HCl=2AlCl3+3H2↑③.两性金属与碱溶液的反应:Al与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑三、属于氧化还原反应的化合反应1、金属与氧气发生的氧化反应①.常温下钠与氧气反应:4Na+O2=2Na2O(白色)②.钠在空气中燃烧:2Na+O2加热Na2O2(淡黄色)③.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4(黑色)2、非金属单质与氧气的氧化反应①.硫的燃烧S+O2点燃SO2②.氮气与氧气在放电下反应:N2+O2放电2NO3、低价非金属氧化物与氧气的氧化反应①.二氧化硫与氧气反应:2SO2+O2催化剂加热2SO3②.一氧化氮与氧气反应:2NO+O2=2NO24、非金属氢化物与氧气的反应氨的催化氧化:4NH3+5O2催化剂△4NO+6H2O5、低价碱的氧化反应氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2=4Fe(OH)36、单质与氯气发生的氧化反应①.氯气与金属反应:铁与氯气反应产生棕色烟2Fe+3Cl2点燃2FeCl3铜与氯气反应产生棕黄色烟Cu+Cl2点燃CuCl2钠在氯气中燃烧有白烟2Na+Cl2点燃2NaCl②.氯气与非金属反应:氢气在氯气中燃烧产生苍白色火焰有白雾H2+Cl2加热2HCl ③.氯气与氯化亚铁反应生成氯化铁2FeCl2+Cl2=2FeCl37、高价铁盐的还原反应FeCl3溶液与铁粉反应:2FeCl3+Fe=3FeCl28、非金属与氢气的化合反应合成氨反应:N2+3H2催化剂高温高压2NH3四、不属于氧化还原反应的化合反应1、酸性氧化物与碱性氧化物反应生成含氧酸盐①.二氧化硅与氧化钙高温反应生成硅酸钙SiO2+CaO高温CaSiO3②.三氧化硫与氧化钙反应生成硫酸钙SO3+CaO=CaSO42、酸性氧化物与水反应生成含氧酸①.二氧化硫与水反应生成亚硫酸SO2+H2OH2SO3②.三氧化硫与水反应生成硫酸SO3+H2O=H2SO43、氨气与水的化合反应氨气溶于水生成氨水:NH3+H2O=NH3•H2O4、氨气与酸的化合反应氨气与氯化氢反应生成氯化铵:NH3+HCl=NH4Cl五、属于氧化还原反应的分解反应次氯酸光照分解:2HClO光照2HCl+O2↑六、不属于氧化还原反应的分解反应1、铵盐受热分解①氯化铵受热分解:NH4Cl加热NH3↑+HCl↑②.碳酸氢氨受热分解:NH4HCO3加热NH3↑+H2O↑+CO2↑2、氨水受热分解氨水受热分解:NH3•H2O加热NH3↑+H2O3、不溶性碱受热分解①.氢氧化铁加热分解生成氧化铁和水:2Fe(OH)3加热3H2O+Fe2O3②.氢氧化铝加热分解生成氧化铝和水:2Al(OH)3加热Al2O3+3H2O七、不属于基本类型的氧化还原反应1、过氧化钠氯气二氧化氮的歧化反应①.过氧化钠与水反应生成氢氧化钠和氧气2Na2O2+2H2O=4NaOH+O2↑②.过氧化钠与二氧化碳反应生成碳酸钠和氧气2Na2O2+2CO2=2Na2CO3+O2③.③.氯气与水反应生成盐酸和次氯酸:Cl2+H2O=HCl+HClO④.氯气与氢氧化钠溶液反应生成氯化纳和次氯酸钠:Cl2+2NaOH=NaCl+NaClO+H2O⑤.氯气与消石灰反应制漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O⑥.二氧化氮与水反应生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO2、氧化性酸的还原反应①.浓硫酸与碳发生的还原反应C+2H2SO4(浓)加热CO2↑+2SO2↑+2H2O②.浓硫酸与铜发生的还原反应Cu+2H2SO4(浓)加热CuSO4+2H2O+SO2↑③.浓硝酸与铜发生的还原反应:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑④.稀硝酸与铜发生的还原反应:3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑3、还原性酸的氧化反应氯气的实验室制法:MnO2+4HCl(浓)加热MnCl2+Cl2↑+H2O4、高价金属化合物的还原反应:FeCl3溶液与铜反应:2FeCl3+Cu=2FeCl2+CuCl2Welcome To Download !!!欢迎您的下载,资料仅供参考!。
苏教版《必修》化学方程式汇总(精选版)

苏教版《必修1》化学方程式与要点汇总专题1 化学家眼中的物质世界1) 2KClO 32KCl+3O 2↑2) 2H 2O 22H 2O+O 2↑3) 2KMnO 4K 2MnO 4+MnO 2+O 2↑ 4) NH 4HCO 3NH 3↑+H 2O+CO 2↑5) NH 4Cl+NaOH =NaCl+NH 3·H 2O(不加热一般得到NH 3·H 2O ,加热得NH 3) 6) (NH 4)2SO 4+2NaOH =Na 2SO 4+2NH 3·H 2O 7) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O8) NH 4Cl+NaOH NaCl+NH 3↑+H 2O (遇湿润的红色石蕊试纸变蓝色) 9) (NH 4)2SO 4+2NaOH Na 2SO 4+2NH 3↑+2H 2O10) NH 4NO 3+NaOH NaNO 3+NH 3↑+H 2O11) NH 4Cl+AgNO 3=AgCl ↓+ NH 4NO 3(氯离子检验先加AgNO 3后加稀HNO 3)12) (NH 4)SO 4+BaCl 2=BaSO 4↓+2NH 4Cl (硫酸根检验先加稀HCl 无现象再加BaCl 2)专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物1) 2NaCl+2H 2O2NaOH+H 2↑+Cl 2↑(阳极产生氯气,阴极产生氢气和OH -)2) MnO 2+4HCl (浓) MnCl 2+Cl 2↑+2H 2O (用饱和NaCl 除HCl ,浓硫酸除H 2O )3) 2Fe+3Cl 2 2FeCl 3(棕褐色的烟,产物只能生成+3价的Fe) 4) Cu+Cl 2 CuCl 2 (棕黄色的烟)5) 2Al+3Cl 2 2AlCl 36) 2Na+Cl 2 =2NaCl (白烟)7) H 2+Cl 2 2HCl (苍白色火焰) 8) Cl 2+H 2O HCl+HClO (Cl 2只有少量的与水反应,大量的Cl 2以分子形式存在于水溶液中,所以氯水呈黄绿色)(离子方程式HClO 不能拆开)9) 2HClO 2HCl+O 2↑10) Cl 2+2NaOH =NaCl+NaClO+H 2O (Cl 2尾气吸收)11)2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O (工业生产漂粉精)主要成分CaCl 2和 Ca(ClO)2,有效成分是Ca(ClO)2 12) Ca(ClO)2+2HCl =CaCl 2+2HClO13) Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO如表示漂白粉失效,方程式有两个,后一个是HClO 见光再分解 14) Cl 2+2NaBr =2NaCl+Br 215) Cl 2+2KI =2KCl+I 2(可用淀粉碘化钾溶液检验Cl 2)点燃点燃 点燃点燃铵离子 的检验 通电MnO 2光照漂白原理16) Br 2+2KI =2KBr+I 2(氧化性Cl 2﹥Br 2﹥I 2 还原性I —﹥Br —﹥Cl —) 17) NaBr+AgNO 3=AgBr ↓+ NaNO 3(淡黄色沉淀)18) KI+AgNO 3=AgI ↓+ KNO 3(黄色沉淀可检验I —)第二单元 钠、镁及其化合物1) 2Na+2H 2O =2NaOH+H 2↑(熔成小球,浮在水面,四处游动,嘶嘶作响,酚酞变红) 2) 4Na+O 2=2Na 2O (白色固体)(Na 2O 在空气中加热可转化为Na 2O 2) 3) 2Na+O 2Na 2O 2(淡黄色固体) 4) 2Na+Cl 2=2NaCl (白烟) 5) 2Na+S =Na 2S (研磨爆炸)6) 4Na+TiCl 4 Ti+4NaCl (熔融情况下Na 可冶炼贵重金属,在溶液中不能)7) 2NaCl 2Na+Cl 2↑ 8)Na 2O+H 2O =2NaOH9) 2Na 2O 2+2H 2O =4NaOH +O 2↑(Na 2O 2既是氧化剂,又是还原剂)2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑(Na 2O 是碱性氧化物,Na 2O 2不是碱性氧化物)相当于增加1mol H 2的质量 10)Na 2O+CO 2=Na 2CO 311) 2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑(Na 2O 2是供氧剂,又具强氧化性,有漂白性)相当于增加1mol CO 的质量12)Na 2CO 3+2HCl =2NaCl+H 2O+CO 2↑13)CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑(CaCl 2或BaCl 2溶液中通入CO 2无CaCO 3或BaCO 3沉淀生成,原因弱酸一般..不制强酸) 14) NaHCO 3+ HCl =NaCl+H 2O+CO 2↑(比Na 2CO 3和盐酸反应剧烈)15) 2NaHCO 3Na 2CO 3+H 2O+CO 2↑ (NaHCO 3固体转化为Na 2CO 3用Δ)16) NaHCO 3+NaOH =Na 2CO 3+H 2O (NaHCO 3溶液转化为Na 2CO 3可加入NaOH ) 17) CO 2 +H 2O+Na 2CO 3=2NaHCO 3(CO 2中混有HCl 不用饱和碳酸钠,而用碳酸氢钠) 18) CO 2+2NaOH =Na 2CO 3+H 2O (少量CO 2)CO 2+NaOH =NaHCO 3(足量CO 2) 19) CH 3COOH+NaOH =CH 3COONa+H 2O20) 2CH 3COOH+Na 2CO 3=2CH 3COONa+H 2O+CO 2↑ 21) CH 3COOH CH 3COO -+H +(弱电解质电离符号是可逆的,用表示)常见的弱酸有H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、CH 3COOH 、H 3PO 4(中强)、HCN (极弱)、H 2SiO 3(不溶)常见的强酸有H 2SO 4、HNO 3、HCl 、HBr 、HI22) CaCO 3CaO+ CO 2↑23) CaO+H 2O =Ca(OH)224) Ca(OH)2+MgCl 2=Mg(OH)2↓+CaCl 2 25) Mg(OH)2+2HCl =MgCl 2+2H 2O 26) MgCl 2Mg+Cl 2↑(MgO 熔点高,工业上用电解MgCl 2)27) 3Mg+N 2Mg 3N 2点燃 强酸制 弱酸 点燃700~800℃通电通电点燃高温 镁的提取28) 2Mg+CO 22MgO+C (金属单质置换出非金属单质典型反应) 29)* Mg+2H 2OMg(OH)2+H 2↑专题3 从矿物到基础材料第一单元 从铝土矿到铝合金1) Al 2O 3+2NaOH =2NaAlO 2+H 2O 2) NaAlO 2+2H 2O+CO 2(过量)=Al(OH)3↓+NaHCO 3 3)2Al(OH)3 Al 2O 3 +3H 2O4) 2Al 2O 34Al+3O 2↑(只能用电解Al 2O 3,而AlCl 3不行)5)2Al+6HCl= 2AlCl 3+3H 2↑6) 2Al+2NaOH+2H 2O= 2NaAlO 2+3H 2↑Al 与冷的浓硫酸、冷的浓硝酸钝7) 2Al+Fe 2O 3 Al 2O 3+2Fe 利用铝热反应还可以把其它过渡元素从它们的氧化物(如MnO 2、Fe 3O 4、Cr 2O 3、V 2O 5等)中还原出来 8) Al(OH)3+3HCl =AlCl 3+3H 2O9) Al(OH)3+NaOH =NaAlO 2+2H 2O 10)AlCl 3+3NaOH =Al(OH)3↓+3NaCl11) Al(OH)3+NaOH =NaAlO 2+2H 2O 12)* AlCl 3+4NaOH (过量)=NaAlO 2+3NaCl+2H 2O 13) 制备氢氧化铝:(1)从铝盐制备最好用氨水: Al 3++3NH 3·H 2O===Al(OH)3↓+3NH 4+(2)从偏铝酸盐最好通CO 2:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-(足量CO 2)2AlO 2-+CO 2+3H 2O=2Al(OH)3↓+CO 32-(少量CO 2)*(3)从铝盐和偏铝酸盐制备:3NaAlO 2+AlCl 3+6H 2O=4Al(OH)3↓+3NaCl3AlO 2- +Al 3+ +6H 2O=4Al(OH)3↓15) 明矾净水原理 :明矾溶于水后完全电离:KAl(SO 4)2===K ++Al 3++2SO 42-铝离子与水反应生成:Al(OH)3胶体:Al 3++3H 2O===Al(OH)3(胶体)+3H +16)侯氏制碱:NH 3+NaCl+H 2O+CO 2===NaHCO 3+NH 4Cl (可用于工业制备小苏打,苏打) 分离提纯方法适用范围实例 过滤 固体与液体不互溶的混合物 粗盐的提纯结晶与重结晶 混合物中各成分在溶剂中溶解度不同,包括蒸发溶剂结晶和降温结晶 分离NaCl 和KNO 3的混合物 蒸馏(分馏)①难挥发的固体杂质在液体中形成的混合物②互溶液体沸点有明显差异蒸馏水、石油的分馏CCl 4(沸点76.75℃)和甲苯(沸点110.6℃)混合物的分离 层析 被吸附能力不同的物质的分离 红、蓝墨水混合物中的不同色的分离分液两种互不混溶的液体混合物CCl 4和水的分离通电从铝 土矿 中提 取铝Al 是两性元素高温AlCl 3中 逐滴加入NaOH 溶 液至过量Al(OH)3是两性元素二、溶液的配置步骤(1)计算:(2)称量(量取): (3) 溶解(稀释):并冷却到室温; (4)转移: (5) 洗涤:(6)定容:(7)摇匀:(8)装瓶。
苏教版高中化学《必修1》化学方程式汇总

苏教版《必修1》化学方程式汇总专题1 化学家眼中的物质世界1 2KClO32KCl+3O2↑2 2H 2O 22H 2O+O2↑3 2KMnO4K 2MnO 4+MnO2+O2↑4 NH 4HCO3NH 3↑+H2O+CO2↑5 NH 4Cl+NaOH=NaCl+NH3·H 2O6 (NH4 2SO 4+2NaOH=Na 2SO 4+2NH3·H 2O7 NH 4NO 3+NaOH=NaNO 3+NH3·H 2O8 NH 4Cl+NaOHNaCl+NH3↑+H2O9 (NH4 2SO 4+2NaOHNa 2SO 4+2NH3↑+2H2O10 NH 4NO 3+NaOHNaNO 3+NH3↑+H2O11 NH 4Cl+AgNO3=AgCl ↓+ NH4NO 312 (NH4SO 4+BaCl2=BaSO 4↓+2NH4Cl专题2 从海水中获得的化学物质第一单元氯、溴、碘及其化合物1 2NaCl+2H2O 2NaOH+H2↑+Cl2↑2 MnO 2+4HCl(浓MnCl 2+Cl2↑+2H2O3 2Fe+3Cl2 2FeCl 3 (棕褐色的烟4 Cu+Cl2 CuCl 2 (棕黄色的烟5 2Al+3Cl2 2AlCl 36 2Na+Cl2 =2NaCl (白烟7 H 2+Cl2 2HCl (苍白色火焰8 Cl 2+H2O HCl+HClO (Cl 2只有少量的与水反应,大量的Cl 2以分子形式存在于水溶液中,所以氯水呈黄绿色9 2HClO 2HCl+O2↑10 Cl 2+2NaOH=NaCl+NaClO+H2O11 2Cl 2+2Ca(OH2=CaCl 2+Ca(ClO2+2H2O (工业生产漂粉精12 Ca(ClO2+2HCl=CaCl 2+2HClO13 Ca(ClO2+H2O+CO2=CaCO 3↓+2HClO14 Cl 2+2NaBr=2NaCl+Br215 Cl 2+2KI=2KCl+I216 Br 2+2KI=2KBr+I217* 2F 2+2H2O =4HF+O218 NaBr+AgNO3=AgBr ↓+ NaNO319 KI+AgNO3=AgI ↓+ KNO3点燃点燃点燃点燃铵离子的检验通电 MnO 2 光照漂白原理第二单元钠、镁及其化合物1 2Na+2H2O =2NaOH+H2↑2 4Na+O2=2Na 2O3 2Na+O2Na 2O 24 2Na+Cl2=2NaCl (白烟5 2Na+S=Na 2S (研磨爆炸6 4Na+TiCl4 Ti+4NaCl7 2NaCl 2Na+Cl2↑8 Na 2O+H2O =2NaOH9 2Na 2O 2+2H2O =4NaOH +O2↑10 Na 2O+CO2=Na 2CO 311 2Na 2O 2+2CO2=2Na 2CO 3+O2↑12 Na 2CO 3+2HCl=2NaCl+H2O+CO2↑ 13 CaCO 3+2HCl=CaCl 2+H2O+CO2↑ CaCl 2或BaCl 2溶液中通入CO 2无CaCO 3或 BaCO 3沉淀生成,原因弱酸一般..不制强酸14 NaHCO 3+ HCl=NaCl+H2O+CO2↑(比Na 2CO 3和盐酸反应剧烈15 2NaHCO3Na 2CO 3+H2O+CO2↑16 NaHCO 3+NaOH=Na 2CO 3+H2O17 CO 2 +H2O+Na2CO 3=2NaHCO 318 CO 2+2NaOH=Na 2CO 3+H2O19 CH 3COOH+NaOH=CH 3COONa+H2O20 2CH 3COOH+Na2CO 3=2CH 3COONa+H2O+CO2↑21 CH 3COOH CH 3COO -+H+常见的弱酸有H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、 CH 3COOH 、H 3PO 4(中强、HCN (极弱、H 2SiO 3(不溶常见的强酸有H 2SO 4、HNO 3、HCl 、HBr 、HI22 CaCO 3CaO+ CO2↑23 CaO+H2O =Ca(OH2 24 Ca(OH2+MgCl2=Mg(OH2↓+CaCl2 25 Mg(OH2+2HCl=MgCl 2+2H2O 26 MgCl 2Mg+Cl2↑27 3Mg+N2Mg 3N 228 2Mg+CO22MgO+C29* Mg+2H2O Mg(OH2+H2↑ 专题3 从矿物到基础材料第一单元从铝土矿到铝合金1 Al 2O 3+2NaOH=2NaAlO 2+H2O2 NaAlO 2+2H2O+CO2(过量=Al(OH3↓+NaHCO3 3 2Al(OH3 Al 2O 3 +3H2O4 2Al 2O 34Al+3O2↑通电从铝土矿中提取铝点燃强酸制弱酸点燃 700~800℃通电通电点燃高温镁的提取5 2Al+6HCl= 2AlCl3+3H2↑6 2Al+2NaOH+2H2O= 2NaAlO2+3H2↑Al 与冷的浓硫酸、冷的浓硝酸钝化7 2Al+Fe2O3 Al 2O 3+2Fe 利用铝热反应还可以把其它过渡元素从它们的氧化物(如MnO 2、Fe 3O 4、Cr 2O 3、 V 2O 5等中还原出来8 Al(OH3+3HCl=AlCl 3+3H2O 9 Al(OH3+NaOH=NaAlO 2+2H2O 10 AlCl3+3NaOH=Al(OH3↓+3NaCl 11 Al(OH3+NaOH=NaAlO 2+2H2O 12* AlCl3+4NaOH(过量=NaAlO 2+3NaCl+2H2O 13* 2NaAlO 2+3H2O+CO2(少量=2Al(OH3↓+ Na2CO 314* AlCl 3+ 3NaAlO2+6H2O =4Al(OH3↓+3NaCl15 KAl(SO4 2=K ++Al3++2SO42- (电离方程式16 Al 3++3H2O Al(OH3(胶体+3H+ (水解方程式第二单元铁、铜的获取及应用1 H 2、CO 、Al 、C 都可以把铁从化合物(FeO 、Fe 3O 4、Fe 2O 3 中还原出来2 CaCO 3CaO+ CO2↑3 SiO 2+CaO CaSiO 34 Fe+SFeS5 2Cu+SCu 2S6 2Fe+3Cl22FeCl 37 Cu+Cl2CuCl 28 FeSO 4+2NaOH=Fe(OH2↓+Na2SO 49* 4Fe(OH2+O2+2H2O =4Fe(OH3白色沉淀迅速变成灰绿色最后变成红褐色10 FeCl 3+3KSCN=3KCl+Fe(SCN3Fe 3++3SCN-=Fe(SCN311 2FeCl 2+Cl2=2FeCl 312 2FeBr 2+Br2=2FeBr 32Fe 2++X2=2Fe 3++2X- (X=Cl、Br13* 2Fe 3++2I -=2Fe 2++I2 (离子方程式14 2FeCl 3+Fe=2FeCl 315 2FeCl 3+Cu=2FeCl 2+CuCl2Al 是两性元素高温高温高温炼铁中的造渣反应点燃点燃AlCl 3中逐滴加入NaOH 溶液至过量Al(OH3是两性元素第三单元含硅矿物与信息材料1 Na 2SiO 3+2HCl=2NaCl+H2SiO 3↓2 Na 2SiO 3+CO2+H2O =Na 2CO 3+H2SiO 3↓3 2NaOH+H2SiO 3=Na 2SiO 3+2H2O4 H 2SiO3SiO 2+H2O (SiO 2与水不反应5 SiO 2+CaOCaSiO 36 SiO 2+2NaOH=Na 2SiO 3+H2O7 SiO 2+4HF=SiF 4↑+2H2O (用于雕刻玻璃氢氟酸与玻璃反应因此氢氟酸保存在塑料瓶中8* SiO 2+CaCO3CaSiO 3+CO2↑9* SiO 2+ Na2CO 3Na 2SiO 3+CO2↑10 SiO 2+2CSi+2CO↑ (工业制粗硅11 Si+2Cl2SiCl 412 SiCl 4+2H2Si+4HCl13 Si+2NaOH+H2O =Na 2SiO 3+2H2↑14* Si+4HF=SiF 4↑+2H2↑15 Si+O2SiO 2 专题4 硫、氮和可持续发展第一单元含硫化合物的性质和应用1 SO 2+H2O H 2SO 32 SO 2+2NaOH=Na 2SO 3+H2O3 2SO 2+O22SO 34 SO 3+H2O =H 2SO 45* SO 2+X 2+2H2O =H 2SO 4+2HX (X=Cl、Br 、I6* Na 2SO 3+H2SO 4(浓=Na 2SO 4+H2O+SO2↑(实验室制取SO 27 2H 2SO 3+O2=2H 2SO 4 (亚硫酸变质8 2Na 2SO 3+O2=2Na 2SO 4 (Na 2SO 3溶液变质9 2CaSO 3+O2=2CaSO 410* SO 2+2NaHCO3=Na 2SO 3+ H2O +2CO2(除CO 2中SO 2用饱和的NaHCO 3溶液11 Na 2SO 3+BaCl2=BaSO 3↓+2NaCl12 Na 2SO 3+2HCl=2NaCl+H2O+SO2↑13 NaHSO 3+HCl=NaCl+H2O+SO2↑14 Cu+2H2SO 4(浓CuSO 4+ SO2↑+2H2O15 C+2H2SO 4(浓CO 2↑+2SO2↑+2H2O16* 4FeS 2+11O22Fe 2O 3+ 8SO2↑17* H 2S + H2SO 4(浓=S ↓+SO2↑+ 2H2O18* 2H 2S +SO2=3S + 2H2O (若在溶液中进行的S 打↓19 FeS+H2SO 4(稀=FeSO 4+H2S ↑(实验室制取H 2S 用稀硫酸或稀盐酸20 FeS+2HCl(稀=FeCl 2+H2S ↑21 S+ H2H 2SSi 不与硫酸、硝酸反应,SiO 2不与酸(除氢氟酸)反应强酸制弱酸高温粗硅的提纯高温高温催化剂高温高温高温22S+ Fe FeS23S+ 2Cu Cu 2S24 S+ Hg=HgS25* 3S+6KOH2K 2S+K2SO 3+3H2O第二单元生产生活中的含氮化合物1 N2 +3 H2 2NH 3 (工业合成氨2 N 2+O22NO3 2NO+O2=2NO 2 (红棕色气体4 3NO 2+H2O =2HNO 3+NO5 NH 3+H2O NH 3·H 2O(大量NH 3已转化为一水合氨,一水合氨只有少量电离6 NH 3+HCl=NH 4Cl (大量白烟7 4NH 3+ 5O24NO+6H2O(氨的催化氧化,工业制硝酸的基础8 NH 3·H 2O NH 3↑+H2O9 NH 3·H 2O+HCl=NH 4Cl+H2O10 2NH 3·H 2O+H2SO 4=(NH4 2SO 4+2H2O 11 NH 3·H 2O+HNO3=NH 4NO 3+H2O 12 2NH 3·H 2O+MgCl2=Mg(OH2↓+2NH4Cl13 3NH 3·H 2O+AlCl3=Al(OH3↓+3NH4ClAlCl 3溶液中滴入过量的氨水白色沉淀不溶解14 NH 4Cl NH 3↑+HCl↑15 (NH4 2CO 32NH 3↑+H2O+CO2↑16 2NH 4Cl+Ca(OH2CaCl 2+2NH3↑+H2O(实验室制氨气NH 3与CaCl 2、CuSO 4、浓硫酸都反应,所以干燥NH 3不用CaCl 2、CuSO 4、浓硫酸而用碱石灰17 NH 4NO 3+NaOH=NaNO 3+NH3·H 2O18 4HNO 3 4NO 2↑+O2↑+2H2O19 Cu+4HNO3(浓=Cu(NO3 2+2NO2↑+2H2O 20 3Cu+8HNO3(稀=3Cu(NO3 2+2N O↑+4H2O Fe 、Al 遇冷的浓硝酸、或冷的浓硫酸钝化21 C+4HNO3(浓=4NO 2↑+CO2↑+2H2O22 HNO 3(常见强氧化剂与某些还原性物质[如H 2S 、BaSO 3、HI 、HBr 、Fe 2+、S 2-、SO 32-、 I -、Br -(常见强还原剂)等] 发生氧化还原反应高温、高压催化剂放电碱的通性催化剂光照。
最新整理苏教版高中化学《必修》化学方程式汇总复习课程

苏教版《必修1》化学方程式汇总专题1 化学家眼中的物质世界1) 2KClO 32KCl+3O 2↑2) 2H 2O 22H 2O+O 2↑3) 2KMnO 4K 2MnO 4+MnO 2+O 2↑ 4) NH 4HCO 3NH 3↑+H 2O+CO 2↑ 5) NH 4Cl+NaOH =NaCl+NH 3·H 2O6) (NH 4)2SO 4+2NaOH =Na 2SO 4+2NH 3·H 2O 7) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O8) NH 4Cl+NaOH NaCl+NH 3↑+H 2O 9) (NH 4)2SO 4+2NaOH Na 2SO 4+2NH 3↑+2H 2O10) NH 4NO 3+NaOH NaNO 3+NH 3↑+H 2O 11) NH 4Cl+AgNO 3=AgCl ↓+ NH 4NO 3 12) (NH 4)SO 4+BaCl 2=BaSO 4↓+2NH 4Cl专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物1) 2NaCl+2H 2O2NaOH+H 2↑+Cl 2↑2) MnO 2+4HCl (浓) MnCl 2+Cl 2↑+2H 2O3) 2Fe+3Cl 2 2FeCl 3 (棕褐色的烟) 4) Cu+Cl 2 CuCl 2 (棕黄色的烟)5) 2Al+3Cl 2 2AlCl 36) 2Na+Cl 2 =2NaCl (白烟)7) H 2+Cl 2 2HCl (苍白色火焰) 8) Cl 2+H 2O HCl+HClO (Cl 2只有少量的与水反应,大量的Cl 2以分子形式存在于水溶液中,所以氯水呈黄绿色)9) 2HClO 2HCl+O 2↑10) Cl 2+2NaOH =NaCl+NaClO+H 2O11) 2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O (工业生产漂粉精) 12) Ca(ClO)2+2HCl =CaCl 2+2HClO13) Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO 14) Cl 2+2NaBr =2NaCl+Br 2 15) Cl 2+2KI =2KCl+I 2 16) Br 2+2KI =2KBr+I 2 17)* 2F 2+2H 2O =4HF+O 218) NaBr+AgNO 3=AgBr ↓+ NaNO 3 19) KI+AgNO 3=AgI ↓+ KNO 3点燃点燃 点燃点燃 铵离子 的检验通电MnO 2光照漂白原理第二单元 钠、镁及其化合物1) 2Na+2H 2O =2NaOH+H 2↑ 2) 4Na+O 2=2Na 2O 3) 2Na+O 2Na 2O 24) 2Na+Cl 2=2NaCl (白烟) 5) 2Na+S =Na 2S (研磨爆炸)6) 4Na+TiCl 4 Ti+4NaCl7) 2NaCl 2Na+Cl 2↑ 8) Na 2O+H 2O =2NaOH9) 2Na 2O 2+2H 2O =4NaOH +O 2↑ 10) Na 2O+CO 2=Na 2CO 311) 2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑12) Na 2CO 3+2HCl =2NaCl+H 2O+CO 2↑ 13) CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑CaCl 2或BaCl 2溶液中通入CO 2无CaCO 3或 BaCO 3沉淀生成,原因弱酸一般..不制强酸 14) NaHCO 3+ HCl =NaCl+H 2O+CO 2↑(比Na 2CO 3和盐酸反应剧烈)15) 2NaHCO 3Na 2CO 3+H 2O+CO 2↑ 16) NaHCO 3+NaOH =Na 2CO 3+H 2O 17) CO 2 +H 2O+Na 2CO 3=2NaHCO 3 18) CO 2+2NaOH =Na 2CO 3+H 2O19) CH 3COOH+NaOH =CH 3COONa+H 2O20) 2CH 3COOH+Na 2CO 3=2CH 3COONa+H 2O+CO 2↑ 21) CH 3COOH CH 3COO -+H +常见的弱酸有H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、 CH 3COOH 、H 3PO 4(中强)、HCN (极弱)、H 2SiO 3(不溶) 常见的强酸有H 2SO 4、HNO 3、HCl 、HBr 、HI22) CaCO 3CaO+ CO 2↑ 23) CaO+H 2O =Ca(OH)224) Ca(OH)2+MgCl 2=Mg(OH)2↓+CaCl 2 25) Mg(OH)2+2HCl =MgCl 2+2H 2O26) MgCl 2Mg+Cl 2↑27) 3Mg+N 2Mg 3N 228) 2Mg+CO 22MgO+C 29)* Mg+2H 2OMg(OH)2+H 2↑专题3 从矿物到基础材料第一单元 从铝土矿到铝合金1) Al 2O 3+2NaOH =2NaAlO 2+H 2O2) NaAlO 2+2H 2O+CO 2(过量)=Al(OH)3↓+NaHCO 3 3) 2Al(OH)3 Al 2O 3 +3H 2O 4) 2Al 2O 34Al+3O 2↑通电从铝 土矿 中提 取铝点燃 强酸制弱酸点燃700~800℃通电通电点燃高温镁的提取5) 2Al+6HCl= 2AlCl 3+3H 2↑6) 2Al+2NaOH+2H 2O= 2NaAlO 2+3H 2↑Al 与冷的浓硫酸、冷的浓硝酸钝化7) 2Al+Fe 2O 3Al 2O 3+2Fe 利用铝热反应还可以把其它过渡元素从它们的氧化物(如MnO 2、Fe 3O 4、Cr 2O 3、V 2O 5等)中还原出来8) Al(OH)3+3HCl =AlCl 3+3H 2O9) Al(OH)3+NaOH =NaAlO 2+2H 2O 10) AlCl 3+3NaOH =Al(OH)3↓+3NaCl 11) Al(OH)3+NaOH =NaAlO 2+2H 2O 12)* AlCl 3+4NaOH (过量)=NaAlO 2+3NaCl+2H 2O 13)* 2NaAlO 2+3H 2O+CO 2(少量) =2Al(OH)3↓+ Na 2CO 3 14)* AlCl 3+ 3NaAlO 2+6H 2O =4Al(OH)3↓+3NaCl15) KAl(SO 4)2=K ++Al 3++2SO 42- (电离方程式) 16) Al 3++3H 2O Al(OH)3(胶体)+3H + (水解方程式)第二单元 铁、铜的获取及应用1) H 2、CO 、Al 、C 都可以把铁从化合物(FeO 、Fe 3O 4、Fe 2O 3)中还原出来 2) CaCO 3CaO+ CO 2↑3) SiO 2+CaO CaSiO 3 4) Fe+S FeS 5) 2Cu+S Cu 2S6) 2Fe+3Cl 22FeCl 3 7) Cu+Cl 2CuCl 28) FeSO 4+2NaOH=Fe(OH)2↓+Na 2SO 4 9)* 4Fe(OH)2+O 2+2H 2O =4Fe(OH)3白色沉淀迅速变成灰绿色最后变成红褐色10) FeCl 3+3KSCN =3KCl+Fe(SCN)3Fe 3++3SCN -=Fe(SCN)311) 2FeCl 2+Cl 2=2FeCl 312) 2FeBr 2+Br 2=2FeBr 32Fe 2++X 2=2Fe 3++2X - (X=Cl 、Br ) 13)* 2Fe 3++2I -=2Fe 2++I 2 (离子方程式) 14) 2FeCl 3+Fe =2FeCl 315) 2FeCl 3+Cu =2FeCl 2+CuCl 2Al 是两性元素高温高温高温炼铁中的造渣反应点燃点燃 AlCl 3中 逐滴加入NaOH 溶 液至过量 Al(OH)3是两性元素第三单元 含硅矿物与信息材料1) Na 2SiO 3+2HCl =2NaCl+H 2SiO 3↓2) Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓ 3) 2NaOH+H 2SiO 3=Na 2SiO 3+2H 2O4) H 2SiO 3SiO 2+H 2O (SiO 2与水不反应)5) SiO 2+CaO CaSiO 36) SiO 2+2NaOH =Na 2SiO 3+H 2O7) SiO 2+4HF =SiF 4↑+2H 2O (用于雕刻玻璃)氢氟酸与玻璃反应因此氢氟酸保存在塑料瓶中 8)* SiO 2+CaCO 3CaSiO 3+CO 2↑9)* SiO 2+ Na 2CO 3Na 2SiO 3+CO 2↑10) SiO 2+2C Si+2CO ↑ (工业制粗硅) 11) Si+2Cl 2SiCl 412) SiCl 4+2H 2Si+4HCl13) Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑ 14)* Si+4HF =SiF 4↑+2H 2↑ 15) Si+O 2SiO 2专题4 硫、氮和可持续发展第一单元 含硫化合物的性质和应用1) SO 2+H 2O H 2SO 32) SO 2+2NaOH =Na 2SO 3+H 2O 3) 2SO 2+O 22SO 34) SO 3+H 2O =H 2SO 45)* SO 2+X 2+2H 2O =H 2SO 4+2HX (X=Cl 、Br 、I ) 6)* Na 2SO 3+H 2SO 4(浓)=Na 2SO 4+H 2O+SO 2↑(实验室制取SO 2) 7) 2H 2SO 3+O 2=2H 2SO 4 (亚硫酸变质) 8) 2Na 2SO 3+O 2=2Na 2SO 4 (Na 2SO 3溶液变质) 9) 2CaSO 3+O 2=2CaSO 410)* SO 2+2NaHCO 3=Na 2SO 3+ H 2O +2CO 2(除CO 2中SO 2用饱和的NaHCO 3溶液) 11) Na 2SO 3+BaCl 2=BaSO 3↓+2NaCl 12) Na 2SO 3+2HCl =2NaCl+H 2O+SO 2↑ 13) NaHSO 3+HCl =NaCl+H 2O+SO 2↑14) Cu+2H 2SO 4(浓)CuSO 4+ SO 2↑+2H 2O 15) C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O16)* 4FeS 2+11O 22Fe 2O 3+ 8SO 2↑17)* H 2S + H 2SO 4(浓)=S ↓+SO 2↑+ 2H 2O18)* 2H 2S +SO 2=3S + 2H 2O (若在溶液中进行的S 打↓) 19) FeS+H 2SO 4(稀)=FeSO 4+H 2S ↑(实验室制取H 2S 用稀硫酸或稀盐酸)20) FeS+2HCl (稀)=FeCl 2+H 2S ↑ 21) S+ H 2 H 2SSi 不与硫酸、硝酸反应,SiO 2不与酸(除氢氟酸)反应强酸制 弱酸高温粗硅的提纯 高温高温催化剂高温高温高温22) S+ Fe FeS 23) S+ 2Cu Cu 2S 24) S+ Hg =HgS 25)* 3S+6KOH2K 2S+K 2SO 3+3H 2O第二单元 生产生活中的含氮化合物1) N 2 + 3 H 22NH 3 (工业合成氨)2) N 2+O 22NO3) 2NO+O 2=2NO 2 (红棕色气体) 4) 3NO 2+H 2O =2HNO 3+NO 5) NH 3+H 2O NH 3·H 2O(大量NH 3已转化为一水合氨,一水合氨只有少量电离)6) NH 3+HCl =NH 4Cl (大量白烟)7) 4NH 3+ 5O 24NO+6H 2O(氨的催化氧化,工业制硝酸的基础)8) NH 3·H 2O NH 3↑+H 2O 9) NH 3·H 2O+HCl =NH 4Cl+H 2O10) 2NH 3·H 2O+H 2SO 4=(NH 4)2SO 4+2H 2O 11) NH 3·H 2O+HNO 3=NH 4NO 3+H 2O12) 2NH 3·H 2O+MgCl 2=Mg(OH)2↓+2NH 4Cl 13) 3NH 3·H 2O+AlCl 3=Al(OH)3↓+3NH 4ClAlCl 3溶液中滴入过量的氨水白色沉淀不溶解14) NH 4Cl NH 3↑+HCl ↑ 15) (NH 4)2CO 32NH 3↑+H 2O+CO 2↑ 16) 2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+H 2O(实验室制氨气)NH 3与CaCl 2、CuSO 4、浓硫酸都反应,所以干燥NH 3不用CaCl 2、CuSO 4、浓硫酸而用碱石灰17) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O 18) 4HNO 3 4NO 2↑+O 2↑+2H 2O19) Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 20) 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O Fe 、Al 遇冷的浓硝酸、或冷的浓硫酸钝化 21) C+4HNO 3(浓)=4NO 2↑+CO 2↑+2H 2O 22) HNO 3(常见强氧化剂)与某些还原性物质[如H 2S 、BaSO 3、HI 、HBr 、Fe 2+、S 2-、SO 32-、 I -、Br -(常见强还原剂)等] 发生氧化还原反应高温、高压 催化剂放电碱 的 通 性催化剂光照。
高一上学期化学方程式汇总【必修一(苏教版)】

高一上学期化学方程式汇总【必修一】(一)氯气1.氯气的生产原理(电解饱和食盐水)2222NaCl +2H O 2NaOH H Cl +↑+↑通电2.实验室制氯气22224()2MnO HCl MnCl Cl H O ++↑+浓3.氯气与(非)金属反应222322232Na Cl NaClCu Cl CuClFe Cl FeCl +++点燃点燃点燃 ()2222/22H Cl HClHClO O HCl+↑+点燃/光照苍白色火焰爆炸光照4.尾气处理:222NaOH Cl NaCl NaClO H O +=++5.工业制漂白粉:222222()()2Cl Ca OH CaCl Ca ClO H O +=++6.漂白粉原理(变质):222322()2()22Ca ClO CO H O CaCO HClO Ca ClO HCl CaCl HClO++=++=+或(二)卤素——氟、氯、溴、碘2.卤素的化学性质 ①与水反应2222H O Cl HClO HCl H O Br HBrO HBr ++++和②卤素间的置换反应2222222222222()22()22()Cl NaBr NaCl Cl Br Cl KI KCl I Cl I Br KI KBr I Br I +=+>+=+>+=+>③卤素的检验333333aCl Cl +a ()aBr Br +a ()aI I +a ()N AgNO Ag N NO N AgNO Ag N NO N AgNO Ag N NO +=↓+=↓+=↓白色沉淀浅黄色沉淀,用于制感光材料、胶片黄色沉淀,用于人工降雨 (三)金属钠1.钠的化学性质(易失电子,强还原性)222222242()()2();Na O Na O Na O Na O Na Cl NaCl Na S Na S+=+++①白色;②2点燃淡黄色③2点燃白烟④2点燃2.钠的制备222NaCl Na Cl +通电3.钠在空气中的反应222222322322322242221010()22Na O Na O Na O H O NaOHNaOH CO Na CO H O Na CO H O Na CO H O Na H O NaOH H •+=+=+=+=++=+↑①;②③;④风化,化学变化⑤2(浮、熔、游、消、变)4.钠与盐溶液反应422422323222()333()3Na CuSO H O Na SO Cu OH H Na FeCl H O NaCl Fe OH H ++=+↓+↑++=+↓+↑①②5.钠与熔融的盐反应4700~80044Na TiCl Ti NaCl ++℃(四)碳酸钠的性质与应用1.一些基本反应2323232323223323222322322()2;22;222;Na CO Ca OH CaCO NaOH Na CO CaCl CaCO NaCl Na CO CO H O NaHCO NaHCO Na CO CO H O Na CO HCl NaCl H O CO NaHCO HCl NaCl H O CO +=↓++=↓+++=+++=++↑+=++↑;;2.互滴法鉴别碳酸钠和碳酸氢钠233322()Na CO HCl NaHCO NaCl NaHCO HCl NaCl H O CO +=++=++↑不足;3.碳酸氢钠与碱反应()()32322332322()21()11NaHCO Ca OH CaCO H O Na CO NaHCO Ca OH CaCO H O NaOH +=↓+++=↓++2::4.侯式制碱法32234323222NaCl NH CO H O NaHCO NH Cl NaHCO Na CO CO H O+++=+++①②(五)金属镁1.镁的提取32222222222222222();()();()2;66HCl CaCO CaO CO CaO H O Ca OH MgCl Ca OH CaCl Mg OH Mg OH HCl MgCl H O MgCl H O MgCl H O MgCl Mg Cl •+↑+=+=+↓+=+++↑气氛;;通电 2.镁的化学性质:2232322232222236()22()Mg O MgO Mg N Mg N Mg N H O Mg OH NH Mg CO MgO C Mg H O Mg OH H +++=↓+↑+++↓+↑点燃(黑色固体);点燃(白色固体);;点燃;(六)金属铝1.铝的提取32322322Al(OH)Al O +3H O ; 2Al O 4Al+3O ↑通电2.铝的化学性质()2324242232222233Al O +3H SO =Al SO 3H O ; Al O +2NaOH=2NaAlO H O NaAlO +CO H O=Al(OH)NaHCO +++↓+332343323222323AlCl +3NH H O=Al(OH)3NH Cl ; Al(OH)+3HCl=AlCl 3H O Al(OH)+NaOH=NaAlO 2H O 2Al+Fe O 2Fe+Al O •↓+++;高温322222Al+6H=AlCl +3H 2Al+2NaOH 2H O=2NaAlO +3H ↑+↑;3.明矾的净水作用+3+2-3++42423KAl(SO )K +Al 2SO Al 3H O=Al(OH)()+3H =++和胶体(七)金属铁、铜1.铁的冶炼(高炉炼铁)222232233233C+O CO CO +C 2CO 3CO+Fe O 2Fe+3CO CaCO CaO+CO CaO+SiO2CaSiO CaCO +SiO2CO CaSiO ↑⇔↑+原料:(两石一炭)铁矿石、石灰石、焦炭还原剂形成:点燃;还原铁矿石:高温炉渣形成:高温;高温高温2.铁的化学性质23423Fe+4H O Fe O +4H ↑高温 ……略电解。
新苏教版 高一化学必修第一册基础知识和方程式

1.碱性氧化物:与酸反应生成盐和水(碱性氧化物一定是金属氧化物)CaO+ 2HCl = CaCl2 + H2O2.酸性氧化物:与碱反应生成盐和水CO2 + Ca(OH)2 = CaCO3+ H2O3.四种基本反应类型与氧化还原反应的关系4.①②③(第③个公式仅适用于气体,且在标准状况下,Vm约为22.4L/mol)④5.分散质粒子直径分散系小于10-9m 溶液10-9m~~~ 10-7m 胶体大于10-7m 浊液三者本质区别:分散质粒子直径大小不同实验室可用丁达尔效应区分胶体和溶液6.电解质:在水溶液或熔融状态下能导电的化合物。
酸、碱、盐、金属氧化物、水非电解质:无论是在水溶液中,还是在熔融状态下,均以分子形式存在,因而不能导电的化合物。
非金属氧化物,葡萄糖、油脂、酒精、蔗糖等部分有机化合物注:CO2、S02、SO3、NH3等水溶液能导电,是因为与水反应生成的H2CO3、H2SO3、H2SO4、NH3·H2O是电解质导电,而CO2、S02、SO3、NH3本身不导电,属于非电解质。
7.NH4+检验:加强碱,加热,用湿润的红色石蕊试纸靠近试管口①刺激性气味的气体;②试纸变蓝NH4Cl +NaOH = NH3+ NaCl+H2ONH4+ + OH—= NH3+H2O8.Cl—的检验:加硝酸酸化的AgNO3溶液,产生白色沉淀NH4Cl + AgNO3 = NH4NO3 + AgClKCl + AgNO3 = KNO3 + AgClCl—+ Ag+ = AgCl置换氧化还原复分解9. SO42-的检验:先加稀盐酸,再加BaCl2液,产生白色沉淀(NH4)2SO4 + BaCl2=2NH4Cl + BaSO4K2SO4 + BaCl2=2KCl + BaSO4SO42-+ Ba2+ = BaSO410. 溶液的配置:①计算:n=c V ,m= n M ,使用V时,注意容量瓶的规格②称量③溶解:冷却到室温④转移和洗涤:玻璃棒引流⑤定容:需要胶头滴管11.质量数= 质子数+ 中子数 A = Z + N12.工业制氯气:电解饱和食盐水(氯碱工业)2NaCl+2H2O=====通电2NaOH+Cl2↑+H2↑2Cl-+2H2O=====通电Cl2↑+H2↑+2OH-与电源负极相连的铁棒极,滴加酚酞溶液变红13.实验室制氯气:4HCl(浓)+MnO2 =====△MnCl2+2H2O+Cl2↑4H++2Cl-+MnO2 =====△Mn2++2H2O+Cl2↑若MnO2过量,HCl(浓)不能完全被消耗,因为随着反应的进行,浓HCl的浓度逐渐减小,转化为稀HCl之后,MnO2不再发生反应。
高一上学期化学方程式汇总【必修一(苏教版)】
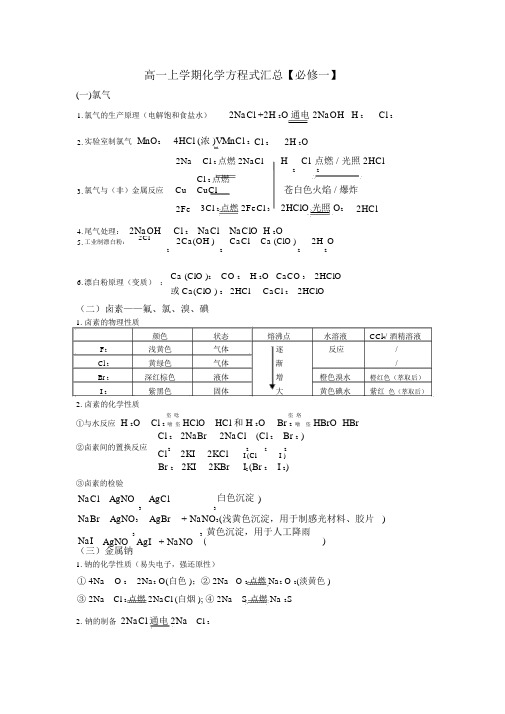
高一上学期化学方程式汇总【必修一】(一)氯气1. 氯气的生产原理(电解饱和食盐水)2NaCl +2H 2O 通电 2NaOH H 2 Cl 22. 实验室制氯气 MnO 24HCl (浓 )VMnCl 2 Cl 22H 2O2NaCl 2点燃 2NaClH2 Cl 点燃 / 光照 2HCl23. 氯气与(非)金属反应CuCl 2点燃 CuCl苍白色火焰 / 爆炸2Fe 3Cl 2点燃 2FeCl 3 2HClO 光照O 22HCl4. 尾气处理: 2NaOHCl 2 NaCl NaClO H 2O5. 工业制漂白粉: 2Cl22Ca(OH )2 CaClCa (ClO )22H O26. 漂白粉原理(变质) :Ca (ClO )2 CO 2 H 2O CaCO 3 2HClO或 Ca(ClO ) 2 2HClCaCl 22HClO(二)卤素——氟、氯、溴、碘1. 卤素的物理性质颜色状态 熔沸点水溶液 CCl 4/ 酒精溶液F 2 浅黄色 气体 逐 反应/ Cl 2 黄绿色 气体 渐/Br 2 深红棕色 液体 增 橙色溴水 橙红色(萃取后)I 2紫黑色固体大黄色碘水紫红 色(萃取后)2. 卤素的化学性质①与水反应 H 2O垐 唸HCl 和 H 2O垐 垎Cl 2 噲 垐 HClO Br 2 噲 垐 HBrO HBrCl 2 2NaBr 2NaCl (Cl 2 Br 2 ) ②卤素间的置换反应Cl 2 2KI2KCl 22 2I (ClI )Br 2 2KI2KBrI 2 (Br 2 I 2)③卤素的检验NaCl AgNOAgCl白色沉淀 )33NaBr AgNO 3AgBr+ NaNO 3(浅黄色沉淀,用于制感光材料、胶片 )NaI 3 3 ( 黄色沉淀,用于人工降雨) AgNO AgI + NaNO (三)金属钠 1. 钠的化学性质(易失电子,强还原性)① 4Na O 2 2Na 2 O(白色 );② 2Na O 2点燃 Na 2 O 2(淡黄色 )③ 2Na Cl 2点燃 2NaCl (白烟 ); ④ 2Na S 点燃 Na 2S2. 钠的制备 2NaCl 通电 2Na Cl 2① 4Na O;② Na O H O2NaOH2 2 22③ 2NaOHCO 2 2 3 H 2;3. 钠在空气中的反应Na CO O Na CO 10H O Na CO 10H )④ 风化,化学变化2 3 ? 2 2 3 2⑤2 2 2NaOH H 2 (浮、熔、游、消、变)Na 2H O①2 Na CuSO 4 2H 2O Na 2SO 4 Cu(OH )2 H 24. 钠与盐溶液反应FeCl 3 3H 2O3NaClFe(OH )33H 2②3Na5. 钠与熔融的盐反应 4NaTiCl 4700 ~ 800℃ Ti 4NaCl(四)碳酸钠的性质与应用Na 2CO 3 C a(OH )2 CaCO 3 2NaOH ; Na 2CO 3 C aCl 2 CaCO 3 2NaCl ;Na CO 3 C O 2 H 2 O 2NaHCO ;231. 一些基本反应V2NaHCOCOH O323 22 ; Na 2CO3 2HCl 2NaCl H 2O CO 2 ;NaHCO 3HClNaClH 2O CO 22.互滴法鉴别碳酸钠和碳酸氢钠Na 2CO 3 HCl (不足 ) NaHCO3NaCl ; NaHCO 3 HClNaCl H 2OCO 22NaHCO Ca(OH )CaCO2H ONa CO 2:3.碳酸氢钠与碱反应323223NaHCO Ca (OH )CaCO H O NaOH:32 32① N aCl NH 3 CO 2 H 2O NaHCO 3 NH 4Cl4.侯式制碱法②2NaHCO 3VNa 2CO 3 CO 2 H 2O(五)金属镁1. 镁的提取CaCO VCOCaO HO Ca(OH ) ;32;22MgCl 2 Ca (OH ) 2CaCl 2Mg (OH ) 2 ; Mg (OH )2 2HCl MgCl 2 H 2O;MgCl 2 ? 6H 2O HCl 气氛 MgCl 26H 2O ; MgCl 2通电 Mg Cl 2Mg O 2点燃 2MgO (黑色固体);3Mg N 2点燃 Mg 3 N (2白色固体);2. 镁的化学性质: Mg 3N 2 6H 2O Mg (OH ) 2NH 3 ;Mg CO 2点燃 2MgO C ; Mg 2H 2OVMg (OH )2H 2(六)金属铝1. 铝的提取2Al(OH) 3VAl 2 O 3 +3H 2O ; 2Al 2 O 3通电 4Al+3O 2冰晶石 NaOH 溶液CO 2Na 3AlF 6过滤熔融 铝土矿过滤 NaAlO 2Al(OH) 3 灼烧电解Al 2O 3溶液溶液Al2.铝的化学性质Al 2O 3+3H 2SO 4=Al 2 SO 4 3H 2O ; Al 2O 3+2NaOH=2NaAlO 2 H 2ONaAlO +CO 2H O=Al(OH) 3NaHCO 322AlCl +3NH 3? H O=Al(OH) 3 3NH Cl ; Al(OH) 3+3HCl=AlCl3 3H O3242Al(OH) 3+NaOH=NaAlO2 2H O ;2Al+Fe O 高温 2Fe+Al O322322Al+6H=AlCl 3+3H 2 ;2Al+2NaOH2H 2 O=2NaAlO 2+3H 23. 明矾的净水作用+3+2-3++KAl(SO 4)2 K +Al 2SO 4 和 Al 3H 2O=Al(OH) 3(胶体 )+3H(七)金属铁、铜1. 铁的冶炼(高炉炼铁)原料:(两石一炭)铁矿石、石灰石、焦炭 还原剂形成: C+O 2点燃 CO 2;CO 2+CV2CO还原铁矿石:3CO+Fe 2O 3高温 2Fe+3CO 2炉渣形成: CaCO 3 高温CaO+CO 2 ;CaO+SiO2高温CaSiO 3CaCO 3 +SiO2高温 CO 2 CaSiO 32. 铁的化学性质 3Fe+4H2O 高温 Fe O +4H2略3 4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(AlO2-+H2O +H+=Al(OH)3↓)
铁的性质:2Fe +3Cl2===2FeCl3
Fe + S == FeS3Fe +2O2点燃Fe3O4
3Fe + 4H2O(g)高温Fe3O4+4H2
Fe +2HCl = FeCl2+ H2↑
2HClO == O2↑+ 2HCl(不稳定性)
氯水成分:Cl2、H2O、HClO、H+、Cl-ClO-、OH-
氯气制漂白粉(氯气与碱的反应)
Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+ Ca(OH )2==CaCl2+ Ca(ClO)2+ 2H2O
使用:Ca(ClO)2+CO2+H2O = CaCO3+2HClO
氧化钠与过氧化钠:
①Na2O+H2O 2NaOH;
2Na2O2+2H2O 4NaOH+O2↑
②Na2O+CO2 Na2CO3;
2Na2O2+2CO2 2Na2CO3+O2
镁的性质:Mg+Cl2 MgCl2;
2Mg+O2 2MgO;
3Mg+N2 Mg3N2;
2Mg+CO2 2MgO+C;
镁的提取:MgCl2+Ca(OH)2 Mg(OH)2↓+CaCl2
高温
钝化:在常温下,铝与浓硝酸、浓硫酸钝化
铝热反应:2Al + Fe2O3=== 2Fe + A l2O3
(还能与FeO、Fe3O4、 V2O5 、Cr2O3、MnO2反应)
铝的制取:2Al2O3=======4Al+ 3O2↑
Al2O3的化学性质(两性氧化物)
与酸的反应:Al2O3+ 6HCl == 2AlCl3+ 3H2O
(Al3++3OH—=Al(OH)3↓)
A l(OH)3+ NaOH = NaAlO2+ 2H2O
(A l(OH)3+ OH—= AlO2—+ 2H2O)
偏铝酸钠的性质:(与强酸反应过量时,沉淀会溶解)
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(AlO2-+2H2O +CO2=Al(OH)3↓+HCO3—)
Mg(OHl2+6H2O↑(了解)
MgCl2(融熔) Mg+Cl2↑
铝的性质:2Al + 6HCl = 2AlCl3+ 3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2Al+2OH-+2H2O =2AlO2-+3H2↑)
溴、碘提取:
2KBr+Cl2=2KCl+Br2(Cl2+2Br-== 2Cl-+ Br2)
2KI +Cl2=2KCl+I2
2KI+Br2=2KBr+I2
检验溴、碘NaBr + AgNO3=AgBr↓ + NaNO3
NaI + AgNO3=AgI↓+ NaNO3
钠的性质:4Na+O2 2Na2O(白色)
高中化学必修1常见方程式(专题2--专题3)
氯气的制取:
1.电解氯化钠溶液制氯气(工业上的方法)
2NaCl + 2H2O ==== 2NaOH + H2↑+ Cl2↑
(2Cl-+2H2O电解Cl2↑+H2↑+2OH-)
2.浓盐酸制氯气(实验室的方法)
MnO2+4HCl(浓) ==MnCl2+Cl2↑+2H2O
SiO2+ 2NaOH = Na2SiO3+ H2O
SiO2+ CaO高温CaSiO3
硅单质的实验室制法:
粗硅的制取:SiO2+ 2C高温电炉Si + 2CO
(石英砂(焦碳)(粗硅)
Si(粗)+ 2Cl2△SiCl4
SiCl4+ 2H2高温Si(纯)+ 4HCl
注:离子方程式只给出部分,不要死记硬背,要求自己掌握离子方程式的书写方法。
2Na+O2 Na2O2(淡黄色)
2Na+2H2O 2NaOH+H2↑
(2Na+2H2O=2Na++2OH-+H2↑)
2NaCl(融熔) 2Na+Cl2↑
碳酸钠和碳酸氢钠:
①相互转化Na2CO3+CO2+H2O 2NaHCO3
2NaHCO3 Na2CO3+CO2↑+H2O
②与碱反应:NaHCO3+NaOH Na2CO3+H2O
Fe + CuSO4= FeSO4+ Cu(2Fe3++Cu=2Fe2++Cu2+)
Fe3+(黄色)的检验:①Fe3++ 3SCN—= Fe(SCN)3
Fe2+(浅绿色)的检验:
①Fe2++2OH- Fe(OH)2↓(白色)
②4Fe(OH)2+O2+2H2O 4Fe(OH)3(红褐色)
Fe、Fe2+、Fe3+之间的“三角”转化(氧化还原反应)
③与盐酸反应
Na2CO3+2HCl 2NaCl+CO2↑+H2O(两步)
NaHCO3+HCl NaCl+CO2↑+H2O(更快)
③还能与某些盐发生复分解反应(略)
补充:钠与盐溶液反应先与水反应
例如:与硫酸铜溶液
2Na+2H2O 2NaOH+H2↑
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
(Al2O3+ 6H+=2 Al3++ 3H2O)
与碱的反应:Al2O3+ 2NaOH == 2NaAlO2+ H2O(Al2O3+ 2OH-=2 AlO2-+H2O)
氢氧化铝(两性氢氧化物)
与酸的反应:Al(OH)3+ 3HCl = AlCl3+ 3H2O
(Al(OH)3+ 3H+= Al3++ 3H2O)
(MnO2+4H++2Cl—==Mn2++Cl2↑+2H2O)
氯气的化学性质:
氯气的燃烧:Cu + Cl2===CuCl2棕黄色烟
2Na + Cl2===2 Na Cl;白烟
Fe+ Cl2=== FeCl3棕褐色烟
Cl2+H2===2HCl苍白色火焰或爆炸
氯气与水反应(氯水)
Cl2+H2O ==HCl+HClO
含铁化合物常见反应
2FeCl3+ Fe = 3FeCl2(2Fe3++ Fe=3Fe2+)
2FeCl2+ Cl2= 2FeCl3(2Fe2++Cl2=2Fe3++2 Cl-
FeCl3+ 3NaOH = Fe(OH)3↓ + 3NaCl
(Fe3++ 3OH—= Fe(OH)3↓)
2Fe(OH)3==== Fe2O3+ 3H2O
与碱的反应:A l(OH)3+ NaOH = NaAlO2+ 2H2O
(A l(OH)3+ OH—= AlO2—+ 2H2O)
氢氧化铝的制取:(①优于②)
①AlCl3 +3NH3.H2O=Al(OH)3↓+NH4Cl
(A13++3NH3•H2O= Al(OH)3↓+3NH4+)
②AlCl3+3NaOH=Al(OH)3↓+3NaCl
Fe2O3+ 3CO高温2Fe + 3CO2
Fe2O3+ 6HCl = 2FeCl3+ 3H2O
(Fe2O3+ 6H+= 2Fe3++ 3H2O)
硅及其化合物
Si + 2F2= SiF4
Si+4HF = SiF4↑+2H2↑
Si + 2NaOH + H2O = Na2SiO3+2H2↑
SiO2+ 4HF = SiF4+ 2H2O
