中考化学考前考点梳理第五单元化学方程式课件
合集下载
初中九年级化学中考总复习第5单元化学方程式课件PPT

后 ):
甲组图示
乙组图示
第一部分 教材同步复习
16
产生气泡,天平指针偏向右边 ,甲组药品混 (1) 甲组能观察到的实验现象为 ______________________________ 碳酸钠和稀盐酸反应生成的二氧化 合 前 、 后 质 量 关 系 为 m > m 后 , 请 解 释 原 因 _______________________________
第一部分 教材同步复习
4
3.质量守恒定律的应用
元素 组成。 (1)利用质量守恒定律推断物质的_______ 化学式 。 (2)确定物质的__________ (3)利用质量守恒定律推断反应物或生成物的质量及化学反应类型。 (4)运用质量守恒定律解释实际现象中的质量变化。
(5)配平化学方程式。
4.质量守恒定律的验证详见【重点实验突破】
(1)设:根据题意,设未知数。
(2)写:正确书写有关反应的化学方程式。 (3)找:找出已知、待求量的质量关系。
(4)列:列比例式,求解。
(5)答:简要的写出答案。
第一部分 教材同步复习来自113.几种题型(1)已知某一反应物或生成物的质量,计算恰好完全反应时,另一种反应物或生
成物的质量。 (2)含杂质(杂质不参加反应)的反应物或生成物质量的计算。 (3)化学式、溶液中溶质的质量分数的综合计算。 【注意】(1)化学方程式所表示的是纯净物之间的质量关系,当涉及不纯物质的
第一部分 教材同步复习
14
3.有气体参加或生成的实验装置要求 如果所选择的化学反应中有气体参加或生成,则应在密闭容器中进行。 实验装置改进:
第一部分 教材同步复习
15
【例】如图是甲、乙两组同学分别设计的质量守恒定律的两个验证实验。请根
甲组图示
乙组图示
第一部分 教材同步复习
16
产生气泡,天平指针偏向右边 ,甲组药品混 (1) 甲组能观察到的实验现象为 ______________________________ 碳酸钠和稀盐酸反应生成的二氧化 合 前 、 后 质 量 关 系 为 m > m 后 , 请 解 释 原 因 _______________________________
第一部分 教材同步复习
4
3.质量守恒定律的应用
元素 组成。 (1)利用质量守恒定律推断物质的_______ 化学式 。 (2)确定物质的__________ (3)利用质量守恒定律推断反应物或生成物的质量及化学反应类型。 (4)运用质量守恒定律解释实际现象中的质量变化。
(5)配平化学方程式。
4.质量守恒定律的验证详见【重点实验突破】
(1)设:根据题意,设未知数。
(2)写:正确书写有关反应的化学方程式。 (3)找:找出已知、待求量的质量关系。
(4)列:列比例式,求解。
(5)答:简要的写出答案。
第一部分 教材同步复习来自113.几种题型(1)已知某一反应物或生成物的质量,计算恰好完全反应时,另一种反应物或生
成物的质量。 (2)含杂质(杂质不参加反应)的反应物或生成物质量的计算。 (3)化学式、溶液中溶质的质量分数的综合计算。 【注意】(1)化学方程式所表示的是纯净物之间的质量关系,当涉及不纯物质的
第一部分 教材同步复习
14
3.有气体参加或生成的实验装置要求 如果所选择的化学反应中有气体参加或生成,则应在密闭容器中进行。 实验装置改进:
第一部分 教材同步复习
15
【例】如图是甲、乙两组同学分别设计的质量守恒定律的两个验证实验。请根
人教版九年级上册化学 第五单元 化学方程式复习课件(共43张PPT)
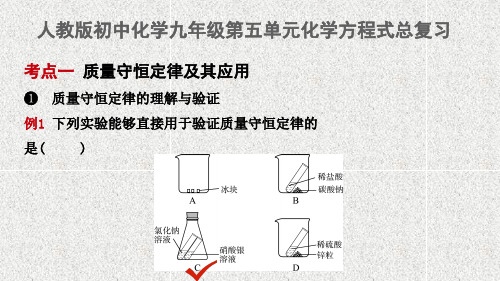
人教版初中化学九年级第五单元化学方程式总复习
考点一 质量守恒定律及其应用
❶ 质量守恒定律的理解与验证
例1 下列实验能够直接用于验证质量守恒定律的
是(
)
【思路解析】 首先质量守恒定律的适用范围是化学反应,其次在设计有 气体参加或生成的实验时需要在密闭容器中进行。
❷ 运用质量守恒定律推断物质化学式
例2 钛和钛合金被认为是21世纪的重要金属材料,在冶炼金属钛时会发生
【思路解析】 先明确坐标曲线中横纵坐标代表的量,其次明确曲线的三 点——起点、拐点、终点,以及平台所代表的意义。结合由题干以及坐标 曲线获得的信息,根据化学方程式中的质量关系解答。
随堂练习
6.某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量。他们 准确称量两份质量各为10.0 g的铁粉样品,分别进行如图操作:
【思路解析】 通过某反应的化学方程式可得到的信息有反应条件,反应 物、生成物各物质间的质量关系,反应体系中微观粒子的数量关系,反应 类型,元素化合价的变化;无法获得的信息有反应速率,反应过程中的能 量变化。
❷ 化学方程式的书写
例6 下列化学方程式书写正确的是( )
A.2NaOH+CuSO4===Cu(OH)2↓+NaSO4
考点二 化学方程式
❶ 化学方程式的意义
例5 镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件 ②反应速率 ③反应物、生成物
各物质间的质量关系 ④反应的微观过程 ⑤反应过程中的能量变化 ⑥
反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是(
)
A.①③④ B.②③⑤ C.①③⑥ D.②④⑥
原子。
(1)该化学反应中,发生变化的是 反应的两种分子的个数比为 。
考点一 质量守恒定律及其应用
❶ 质量守恒定律的理解与验证
例1 下列实验能够直接用于验证质量守恒定律的
是(
)
【思路解析】 首先质量守恒定律的适用范围是化学反应,其次在设计有 气体参加或生成的实验时需要在密闭容器中进行。
❷ 运用质量守恒定律推断物质化学式
例2 钛和钛合金被认为是21世纪的重要金属材料,在冶炼金属钛时会发生
【思路解析】 先明确坐标曲线中横纵坐标代表的量,其次明确曲线的三 点——起点、拐点、终点,以及平台所代表的意义。结合由题干以及坐标 曲线获得的信息,根据化学方程式中的质量关系解答。
随堂练习
6.某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量。他们 准确称量两份质量各为10.0 g的铁粉样品,分别进行如图操作:
【思路解析】 通过某反应的化学方程式可得到的信息有反应条件,反应 物、生成物各物质间的质量关系,反应体系中微观粒子的数量关系,反应 类型,元素化合价的变化;无法获得的信息有反应速率,反应过程中的能 量变化。
❷ 化学方程式的书写
例6 下列化学方程式书写正确的是( )
A.2NaOH+CuSO4===Cu(OH)2↓+NaSO4
考点二 化学方程式
❶ 化学方程式的意义
例5 镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件 ②反应速率 ③反应物、生成物
各物质间的质量关系 ④反应的微观过程 ⑤反应过程中的能量变化 ⑥
反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是(
)
A.①③④ B.②③⑤ C.①③⑥ D.②④⑥
原子。
(1)该化学反应中,发生变化的是 反应的两种分子的个数比为 。
人教版九年级化学上册第五单元 化学方程式 复习课件(共15张)

课后作业
解:(1)根据质量守恒定律可得,生成O2的质量为:30g-20.4g=9.6g (2)设混合物中氯酸钾的质量为x。
2KClO3
=M=nO=2
△
2KCl+3O2↑
245
96
X
9.6g
245/96=x/9.6g
x=24.5g
(3)二氧化锰的质量为:30g-24.5g=5.5g
答:(1)生成氧气的质量为9.6g;
2Mg +O2
2MgO
48 : 32 : 80
知识点3 化学方程式的计算
利用化学方程式计算的过程: 设——根据题意设未知量(设未知数时,不带单位) 写——正确写出反应的化学方程式 算——算出已知物和待求物之间的质量关系,并代入 列——列出比例式 解——求解(计算结果要带单位) 答——简明地作答
知识点3 化学方程式的计算
【例】小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取 12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体 的重复操作(杂质不参加反应),记录数据如下:
操作次数
第1次 第2次 第3次 第4次
剩余固体质量(g) 10.8 9.6 8.1 8.1
试计算:
(1)完全反应后生成二氧化碳的质量是 4.4 g。
部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液
的质量为86.6克,则原混合气体中碳元素和氧元素的质量比为( A )
A.9:16
B.1:2
C.3:8
D.17:8
课后作业
3.小红将30g氯酸钾和二氧化锰的固体混合物加热制取氧气,待反应完全后,将 试管冷却、称量,得到固体的总质量为20.4g,请计算: (1)生成氧气的质量是多少? (2)原混合物中氯酸钾的质量是多少? (3)混合物中二氧化锰的质量是多少?(写出计算过程)
2022中考化学第5单元化学方程式精讲本ppt课件

(2)某同学按图B装置对质量守恒定律进行实验探究,反应前天平 平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量, 观察到反应后天平不平衡,该反应_遵__守____(填“遵守”或“不遵守”) 质量守恒定律,反应后天平不平衡的原因是__反__应__生__成__的__二__氧___ _化___碳__逸__出__装__置__________________________________________。 (3) 由 质 量 守 恒 定 律 可 知 , 化 学 反 应 前 后 , 一 定 不 变 的 是 __①__②__⑤___(填序号)。 ①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素 种类 ⑥物质种类 (4)验证质量守恒定律时,当有气体参加或生成的反应,应在 ___密__封__装__置____条件下进行实验。
5.(2021,天津)写出下列反应的化学方程式。 (1)硫在氧气中燃烧__S_+__O__2_=点_=_=燃_=_=__S_O__2 ___; (2)锌与稀硫酸反应__Z_n_+__H__2S_O__4_=_=_=_Z_n_S_O__4_+__H_2_↑___________;
(3)过氧化氢溶液在二氧化锰催化下分解制取氧气 __2_H_2_O_2_=M_=_n=_O=_=_2 _2_H__2O__+__O_2_↑_______________________________。
A.甲的化学式为SiH4 B.反应中乙和丁的分子个数比为1∶2 C.丙是由离子构成
-1 D.丁中氯元素的化合价为_______价
4.(2021,哈尔滨)下列有关叙述和对应的化学方程式均正确的 是( B ) A.用含氢氧化镁的药物治疗胃酸过多症:
MgOH+HCl===MgCl2+H2O B.正常雨水显酸:CO2+H2O===H2CO3 C.比较铜和银的金属活动性:Ag+Cu(NO3)2===Cu+AgNO3 D.乙醇燃烧:C2H5OH+O2===CO2+H2O
人教版九年级化学上册:第五单元《化学方程式》复习课件(共12张PPT)

地接受。 自 信 也 是 在 社会立 足所必 需的。 开始放 假的时 候,知道 要打暑 假工时 ,自己就害怕了
,这 都 是 自 悲 的心态 在捣蛋 。 感 觉 困 难 挺 多的,自 己
A.生成的丙与丁的分子个数比为1∶1 B.乙的相对分子质量为32 C.两种生成物均为化合物 D.甲中氮、氢原子个数比为1∶3
应用:解释现象、推断元素、确定化学式、辅助 计算等
2.化生__成__物__和__反__应__条__件__ 表示各物质的_质__量__比___
微观:表示各物质的____微__粒__个__数__比____
化学方程式 书写 原则:以_客__观__事__实___为基础;遵守_质__量__守__恒__定__律___ 步骤:写→配→注
(3)现要制得830 kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?
2.(关注化学模型)如图是某反应的微观示意图。请回答下列问题。
(1)B框中的物质属于_②___(填序号)。 ①化合物 ②单质 ③氧化物 (2)此反应的化学方程式为______2_H_2S_+__3_O_2___点_燃___2_S_O_2_+__2_H_2O_____。 (3)此图说明化学反应前后发生改变的粒子是__分___子___。
易错点2 微观示意图
2.(北京中考)氨催化氧化是制硝酸的主要反应之一。该反应前后分子 种类变化的微观示意图如下。下列说法不正确的是( A )
寒 假 实 践 体 会_9 寒假实践报告 常 听 一 些 同 龄的打 工族说 ,出去打 工是怎 样怎样 的辛苦 。百闻 不如一 试。对此,我也 想 亲 身 经 历 一次,所 以,我和 另一舍 友便以 一个打 工者的 身份,以 增加 社会经 验,提高 实 践 能 力 ,丰 富暑假 生活为 宗旨而 去找工 作。这 次的社 会实践 收获可 不少。 顶 着 烈 日 找 了几天 的工作 ,见过的 单位不 少,不是 已经招 满就是 回去等消息。经过坎 坷 的 寻 职 路 ,终于在 一家大 型超市 某得一 职——服 务员 。虽然 很辛苦 ,很不好受,可这 些 经 历 在 书 上是没 得学的 。 善 于 与 他 人 沟通,是 作为服 务员所 必须进 行的一 项工作 。经过 一段时 间的寻 找工作 让 我 认 识 更 多的人 。如何 与别人 沟通好 ,这门技 术是需 要长期 的练习 。以前 工作的 机 会 少 之 又 少,即便 是去年 暑假在 医院的 实践也 是很少 与病人 接触,这使我与别人对 话 时 不 会 应 变,会使 谈话时 有冷场 ,这也是 很尴尬 的。在 百汇超 市工作 时,因 为是服 务 员 ,与 别 人 谈话的 时间变 多了,此 时,不 得不学 着与顾 客沟通 ,使顾客 接受你 的意见 和 建 议 。 与 同事间 的沟通 也同样 重要。 别人给 我意见 ,我就得 认真听 取,耐心、虚心
,这 都 是 自 悲 的心态 在捣蛋 。 感 觉 困 难 挺 多的,自 己
A.生成的丙与丁的分子个数比为1∶1 B.乙的相对分子质量为32 C.两种生成物均为化合物 D.甲中氮、氢原子个数比为1∶3
应用:解释现象、推断元素、确定化学式、辅助 计算等
2.化生__成__物__和__反__应__条__件__ 表示各物质的_质__量__比___
微观:表示各物质的____微__粒__个__数__比____
化学方程式 书写 原则:以_客__观__事__实___为基础;遵守_质__量__守__恒__定__律___ 步骤:写→配→注
(3)现要制得830 kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?
2.(关注化学模型)如图是某反应的微观示意图。请回答下列问题。
(1)B框中的物质属于_②___(填序号)。 ①化合物 ②单质 ③氧化物 (2)此反应的化学方程式为______2_H_2S_+__3_O_2___点_燃___2_S_O_2_+__2_H_2O_____。 (3)此图说明化学反应前后发生改变的粒子是__分___子___。
易错点2 微观示意图
2.(北京中考)氨催化氧化是制硝酸的主要反应之一。该反应前后分子 种类变化的微观示意图如下。下列说法不正确的是( A )
寒 假 实 践 体 会_9 寒假实践报告 常 听 一 些 同 龄的打 工族说 ,出去打 工是怎 样怎样 的辛苦 。百闻 不如一 试。对此,我也 想 亲 身 经 历 一次,所 以,我和 另一舍 友便以 一个打 工者的 身份,以 增加 社会经 验,提高 实 践 能 力 ,丰 富暑假 生活为 宗旨而 去找工 作。这 次的社 会实践 收获可 不少。 顶 着 烈 日 找 了几天 的工作 ,见过的 单位不 少,不是 已经招 满就是 回去等消息。经过坎 坷 的 寻 职 路 ,终于在 一家大 型超市 某得一 职——服 务员 。虽然 很辛苦 ,很不好受,可这 些 经 历 在 书 上是没 得学的 。 善 于 与 他 人 沟通,是 作为服 务员所 必须进 行的一 项工作 。经过 一段时 间的寻 找工作 让 我 认 识 更 多的人 。如何 与别人 沟通好 ,这门技 术是需 要长期 的练习 。以前 工作的 机 会 少 之 又 少,即便 是去年 暑假在 医院的 实践也 是很少 与病人 接触,这使我与别人对 话 时 不 会 应 变,会使 谈话时 有冷场 ,这也是 很尴尬 的。在 百汇超 市工作 时,因 为是服 务 员 ,与 别 人 谈话的 时间变 多了,此 时,不 得不学 着与顾 客沟通 ,使顾客 接受你 的意见 和 建 议 。 与 同事间 的沟通 也同样 重要。 别人给 我意见 ,我就得 认真听 取,耐心、虚心
(人教版)化学九年级复习:第5单元《化学方程式》ppt课件
(6)解题过程要规范。
3.化学方程式计算中常用的关系式。 纯物质的质量 (1)物质的纯度(质量分数)= ×100%=1- 不纯物质的质量
杂质的质量分数。
(2)气体的质量=密度 × 体积。
(3)溶液的质量=密度 × 体积;溶液中溶质的质量=密度
× 体积 × 溶质质量分数。
已分解的物质的质量 (4)物质分解百分率= × 100%。 未分解时该物质的总质量
第五单元
化学方程式
一、质量守恒定律 1.内容。 参加化学反应的各物质的质量总和,等于反应后生成的各 物质的质量总和。这个规律叫做质量守恒定律。 注意:①质量守恒定律只适用于化学变化,不适用于物理 变化。
②不参加反应的物质质量与不是生成物的物质质量不能计
入“质量总和”中。 ③要考虑空气中的物质是否参加反应或生成物(如气体)有 无遗漏。
[例2]在密闭容器中有甲、乙、丙、丁四种物质,在一定的 条件下充分反应,测得反应前后各物质的质量分数如下图所示, 下列说法正确的是( )。
A.丁一定是化合物 B.丙一定是这个反应的催化剂 C.该反应可能是碳酸钙的分解 D.参加反应的甲的质量一定等于生成的丁和乙的质量之和
剖析:本题可分析甲~丁四种物质反应前后各物质的质量 分数,确定是反应物还是生成物,据此结合题意进行分析判断 即可。 答案:D
[例 1]运载火箭的主要燃料是偏二甲肼(用 R 表示),其反 应的化学方程式为: R+2N2O4===3N2+4H2O+2CO2 ,则偏 二甲肼的化学式是( )。
A.C2H8N2
B.N2H4
C.CH4
D.C6H7N
剖析:根据质量守恒定律的微观解释,化学反应中原子种 类、个数守恒。化学方程式右边有6N、8H、8O、2C,左边有 4N、8O,则R 中必有2N、8H、2C,因此 R 为C2H8N2 。 答案:A
九年级化学上册第五单元化学方程式阶段专题复习课件新版新人教版

九年级化学上册第五单元化学方程 式阶段专题复习课件新版新人教版
【典例】(2012·泉州中考)氮化铝(AlN)被广泛应用于电子工 业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反 应制得:Al2O3+N2+3C====2AlN+3CO,现欲制备13.3吨氮化铝, 需要参加反应的氮气质量为多少? 【解析】此为一道根据化学方程式计算的题目,根据化学方 程式的计算步骤,找N2与AlN的质量关系,根据化学方程式中 各物质的质量比不变,由AlN的质量可求N2的质量。
式1.内容 参加化学反应的各物质的质量总和,等于反应后生成的各物 质的质量总和。 2.对质量守恒定律的理解,可以归纳为“三个守恒” (1)宏观上元素守恒:元素种类、质量不变。 (2)微观上原子守恒:原子种类、数目、质量不变。 (3)质量上质量守恒:物质总质量不变。
式阶段专题复习课件新版新人教版
答案:(1)H2O (2)可能 1∶2(或2∶1) 化合反应 (3)<(或小于) 生成物氧化镁部分以白烟的形式逸散(或扩 散)到空气中
九年级化学上册第五单元化学方程 式阶段专题复习课件新版新人教版
考点 2 化学方程式的意义及其书写 1.定义 用化学式表示化学反应的式子。 2.意义 (1)质的方面:表示反应物、生成物和反应条件。
第五单元 阶段专题复习
九年级化学上册第五单元化学方程 式阶段专题复习课件新版新人教版
结合本单元内容,分析下图各知识之间的层级关系,并将图中 空白处答案填写在空白处
答案:①__质_量__总__和__ ②__种_类__ ③_数__目__ ④_质__量__ ⑤_质__量__比__ ⑥_个__数__比__ ⑦_客__观__事__实__ ⑧_质__量__守__恒__定__律__ 九年级化学上册第五单元⑨化学_质方__程量__比__
【典例】(2012·泉州中考)氮化铝(AlN)被广泛应用于电子工 业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反 应制得:Al2O3+N2+3C====2AlN+3CO,现欲制备13.3吨氮化铝, 需要参加反应的氮气质量为多少? 【解析】此为一道根据化学方程式计算的题目,根据化学方 程式的计算步骤,找N2与AlN的质量关系,根据化学方程式中 各物质的质量比不变,由AlN的质量可求N2的质量。
式1.内容 参加化学反应的各物质的质量总和,等于反应后生成的各物 质的质量总和。 2.对质量守恒定律的理解,可以归纳为“三个守恒” (1)宏观上元素守恒:元素种类、质量不变。 (2)微观上原子守恒:原子种类、数目、质量不变。 (3)质量上质量守恒:物质总质量不变。
式阶段专题复习课件新版新人教版
答案:(1)H2O (2)可能 1∶2(或2∶1) 化合反应 (3)<(或小于) 生成物氧化镁部分以白烟的形式逸散(或扩 散)到空气中
九年级化学上册第五单元化学方程 式阶段专题复习课件新版新人教版
考点 2 化学方程式的意义及其书写 1.定义 用化学式表示化学反应的式子。 2.意义 (1)质的方面:表示反应物、生成物和反应条件。
第五单元 阶段专题复习
九年级化学上册第五单元化学方程 式阶段专题复习课件新版新人教版
结合本单元内容,分析下图各知识之间的层级关系,并将图中 空白处答案填写在空白处
答案:①__质_量__总__和__ ②__种_类__ ③_数__目__ ④_质__量__ ⑤_质__量__比__ ⑥_个__数__比__ ⑦_客__观__事__实__ ⑧_质__量__守__恒__定__律__ 九年级化学上册第五单元⑨化学_质方__程量__比__
人教版九年级化学上第5单元《化学方程式》ppt复习课件

二、化学方程式
3、如何正确书写化学方程式
1、书写原则:①以客观事实为依据 ——————— 遵守质量守恒定律 ②——————— 写 配 注 2、书写步骤:①——、②——、③—— 表示反应物、生成物和反应条件 3、涵 义:① ————————
表示反应物、生成物之间的质量比 ②————————
4、 读
4
知识点2:质量守恒定律的原因
练一练
3、某物质在纯氧气中完全燃烧后生成了二氧化碳 C 和水,则关于该物质的组成的说法正确的是—— A、一定含有碳、氢、氧三种元素。 B、一定含 有碳、氧元素。 C 、一定含碳、氢元素。 D、无法确定 4、某化合物X完全燃烧的化学方程式为 X+ A O2→CO2+H2O﹙未配平﹚则X不可能是—— A、CO B、CH4 C、CH3OH D、C2H5OH
一、我们因梦想而伟大,所有的成功者都是大梦想家:在冬夜的火堆旁,在阴天的雨雾中,梦想着未来。有些人让梦想悄然绝灭,有些人则细心培育维护,直到它安然度过困境,迎来光明和希望,而光明和希望 总是降临在那些真心相信梦想一定会成真的人身上。——威尔逊
二、梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远得不到宁静,直到这些梦想成为事实才止;像种子在地下一样,一定要萌芽滋长,伸出地面来,寻找阳光。——林语堂 三、多少事,从来急;天地转,光阴迫。一万年太久,只争朝夕。——毛泽东 四、拥有梦想的人是值得尊敬的,也让人羡慕。当大多数人碌碌而为为现实奔忙的时候,坚持下去,不用害怕与众不同,你该有怎么样的人生,是该你亲自去撰写的。加油!让我们一起捍卫最初的梦想。——柳岩 五、一个人要实现自己的梦想,最重要的是要具备以下两个条件:勇气和行动。——俞敏洪 六、将相本无主,男儿当自强。——汪洙 七、我们活着不能与草木同腐,不能醉生梦死,枉度人生,要有所作为。——方志敏 八、当我真心在追寻著我的梦想时,每一天都是缤纷的,因为我知道每一个小时都是在实现梦想的一部分。——佚名 九、很多时候,我们富了口袋,但穷了脑袋;我们有梦想,但缺少了思想。——佚名 十、你想成为幸福的人吗?但愿你首先学会吃得起苦。——屠格涅夫 十一、一个人的理想越崇高,生活越纯洁。——伏尼契 十二、世之初应该立即抓住第一次的战斗机会。——司汤达 十三、哪里有天才,我是把别人喝咖啡的工夫都用在工作上的。──鲁迅 十四、信仰,是人们所必须的。什麽也不信的人不会有幸福。——雨果 十五、对一个有毅力的人来说,无事不可为。——海伍德 十六、有梦者事竟成。——沃特 十七、梦想只要能持久,就能成为现实。我们不就是生活在梦想中的吗?——丁尼生 十八、梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远得不到宁静,直到这些梦想成为事实。——林语堂 十九、要想成就伟业,除了梦想,必须行动。——佚名 二十、忘掉今天的人将被明天忘掉。──歌德 二十一、梦境总是现实的反面。——伟格利 二十二、世界上最快乐的事,莫过于为理想而奋斗。——苏格拉底 二十三、“梦想”是一个多么“虚无缥缈不切实际”的词啊。在很多人的眼里,梦想只是白日做梦,可是,如果你不曾真切的拥有过梦想,你就不会理解梦想的珍贵。——柳岩 二十四、生命是以时间为单位的,浪费别人的时间等于谋财害命,浪费自己的时间,等于慢性自杀。——鲁迅 二十五、梦是心灵的思想,是我们的秘密真情。——杜鲁门· 卡波特 二十六、坚强的信念能赢得强者的心,并使他们变得更坚强。——白哲特 二十七、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 二十八、青少年是一个美好而又是一去不可再得的时期,是将来一切光明和幸福的开端。——加里宁 二十九、梦想家命长,实干家寿短。——约· 奥赖利 三十、青年时准备好材料,想造一座通向月亮的桥,或者在地上造二所宫殿或庙宇。活到中年,终于决定搭一个棚。——佚名 三十一、在这个并非尽善尽美的世界上,勤奋会得到报偿,而游手好闲则要受到惩罚。——毛姆 三十二、在科学上没有平坦的大道,只有不畏劳苦,沿着陡峭山路攀登的人,才有希望达到光辉的顶点。——马克思 三十三、在劳力上劳心,是一切发明之母。事事在劳力上劳心,变可得事物之真理。——陶行知 三十四、一年之计在于春,一日之计在于晨。——萧绛 三十五、没有一颗心会因为追求梦想而受伤,当你真心想要某样东西时,整个宇宙都会联合起来帮你完成。——佚名 三十六、梦想不抛弃苦心追求的人,只要不停止追求,你们会沐浴在梦想的光辉之中。——佚名 三十七、一块砖没有什么用,一堆砖也没有什么用,如果你心中没有一个造房子的梦想,拥有天下所有的砖头也是一堆废物;但如果只有造房子的梦想,而没有砖头,梦想也没法实现。——俞敏洪 三十八、如意算盘,不一定符合事实。——奥地利 三十九、志向不过是记忆的奴隶,生气勃勃地降生,但却很难成长。——莎士比亚 四十、如果失去梦想,人类将会怎样?——热豆腐 四十一、无论哪个时代,青年的特点总是怀抱着各种理想和幻想。这并不是什么毛病,而是一种宝贵的品质。——佚名 四十二、梦想绝不是梦,两者之间的差别通常都有一段非常值得人们深思的距离。——古龙 四十三、梦想家的缺点是害怕命运。——斯· 菲利普斯 四十四、从工作里爱了生命,就是通彻了生命最深的秘密。——纪伯伦 四十五、穷人并不是指身无分文的人,而是指没有梦想的人。——佚名 四十六、不要怀有渺小的梦想,它们无法打动人心。——歌德 四十七、人生最苦痛的是梦醒了无路可走。做梦的人是幸福的;倘没有看出可以走的路,最要紧的是不要去惊醒他。——鲁迅 四十八、浪费别人的时间是谋财害命,浪费自己的时间是慢性自杀。──列宁 四十九、意志薄弱的人不可能真诚。——拉罗什科 五十、梦想绝不是梦,两者之间的差别通常都有一段非常值得人们深思的距离。——古龙 五十一、得其志,虽死犹生,不得其志,虽生犹死。——无名氏 五十二、所虑时光疾,常怀紧迫情,蹒跚行步慢,落后最宜鞭。——董必武 五十三、梦想只要能持久,就能成为现实。我们不就是生活在梦想中的吗?——丁尼生 五十四、很难说什么是办不到的事情,因为昨天的梦想,可以是今天的希望,并且还可以成为明天的现实。——佚名 五十五、要用你的梦想引领你的一生,要用感恩真诚助人圆梦的心态引领你的一生,要用执著无惧乐观的态度来引领你的人生。——李开复 五十六、人类也需要梦想者,这种人醉心于一种事业的大公无私的发展,因而不能注意自身的物质利益。——居里夫人 五十七、一个人的理想越崇高,生活越纯洁。——伏尼契 五十八、梦想一旦被付诸行动,就会变得神圣。——阿· 安· 普罗克特 五十九、一个人追求的目标越高,他的才力就发展得越快,对社会就越有益。——高尔基 六十、青春是人生最快乐的时光,但这种快乐往往完全是因为它充满着希望,而不是因为得到了什么或逃避了什么。——佚名 六十一、生命里最重要的事情是要有个远大的目标,并借助才能与坚毅来完成它。——歌德 六十二、没有大胆的猜测就作不出伟大的发现。──牛顿 六十三、梦想,是一个目标,是让自己活下去的原动力,是让自己开心的原因。——佚名 六十四、人生太短,要干的事太多,我要争分夺秒。——爱迪生 六十五、一路上我都会发现从未想像过的东西,如果当初我没有勇气去尝试看来几乎不可能的事,如今我就还只是个牧羊人而已。——《牧羊少年的奇幻之旅》 六十六、一个人越敢于担当大任,他的意气就是越风发。——班生 六十七、贫穷是一切艺术职业的母亲。——托里安诺 六十八、莫道桑榆晚,为霞尚满天。——刘禹锡 六十九、一切活动家都是梦想家。——詹· 哈尼克 七十、如果一个人不知道他要驶向哪个码头,那么任何风都不会是顺风。——小塞涅卡 七十一、人性最可怜的就是:我们总是梦想着天边的一座奇妙的玫瑰园,而不去欣赏今天就开在我们窗口的玫瑰。——佚名 七十二、一个人如果已经把自己完全投入于权力和仇恨中,你怎么能期望他还有梦?——古龙 七十三、一个人有钱没钱不一定,但如果这个人没有了梦想,这个人穷定了。——佚名 七十四、平凡朴实的梦想,我们用那唯一的坚持信念去支撑那梦想。——佚名 七十五、最初所拥有的只是梦想,以及毫无根据的自信而已。但是,所有的一切就从这里出发。——孙正义 七十六、看见一个年轻人丧失了美好的希望和理想,看见那块他透过它来观察人们行为和感情的粉红色轻纱在他面前撕掉,那真是伤心啊!——莱蒙托夫 �
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五单元 化学方程式
考点梳理
自主测试
一
二
三
四
一、质量守恒定律 1.定义 参加化学反应的各物质的质量总和,等于反应后生成的各物质的 质量总和。 2.理解 (1)定律是针对化学变化而言的,不能用于解释物理变化中的质 量守恒。 (2)定律中“参加反应的各物质质量”是指实际参加了化学反应 的质量,未参加反应的质量不能计算在内。 (3)从微观角度分析,“质量守恒”的原因是:化学反应前后,原子 的种类、数目、质量都没有改变。
考点梳理
自主测试
一
二
三
四
三、化学反应的类型 1.根据反应物、生成物的种类和数目分为四种基本类型
反应 反应特点 类型 化合 A+B+„„ 反应 即“多变一” AB
举例 ①2CO+O2 ②CO2+H2O ①2KMnO4 ②CaCO3 2CO2 H2CO3 K2MnO4+MnO2+O2↑ CaO+CO2↑
考点梳理
自主测试
一
二
三
四
6.配平化学方程式 (1)依据。 左右两边各元素的原子个数相等,即质量守恒。 (2)方法。 ①观察法:对于一些简单的化学方程式,可直接观察左右两边各 物质的化学式,在相应物质的化学式前配上适当的化学计量数,使 之相等即可。 ②最小公倍数法:选择在反应式两边各出现过一次,且原子个数 相差较多的元素作为突破口,求出反应物与生成物中该元素原子个 数的最小公倍数,再推出各化学式前的化学计量数。
考点梳理
自主测试
一
考点梳理
自主测试
一
二
三
四
注意(1)化学方程式必须尊重客观事实。 (2)在配平过程中不得更改化学式中的小角码,只能更改化学式前 的化学计量数。 (3)配平后不要忘记标明反应条件,缺少条件的化学反应一般是不 能发生的;在标出生成物的状态时要注意:如果反应物和生成物中 都有气体,气体生成物就不注“↑”号。同样,溶液中的反应如果反 应物和生成物中都有固体,固体生成物也不注“↓”号。
考点梳理
自主测试
1
2
3
4
5
6
7
8
1.下列有关对质量守恒定律的理解,正确的是( ) A.将5 g铁和5 g铜混合加热后,物质的总质量为10 g,遵循质量守恒 定律 B.化学反应前后分子的总数一定不会发生变化 C.5 g硫和5 g氧气完全反应后,生成物质量为10 g D.镁条燃烧后质量增加,不遵循质量守恒定律 答案:C
宏观上:表示反应物和生成物之间的 (2)量的方面 质量之比 微观上:表示反应物和生成物之间的 粒子数目比
考点梳理
自主测试
一
二
三
四
3.读法(以4P+5O2 2P2O5为例) (1)质的方面 磷和氧气在点燃的条件下反应生成五氧化二磷。 (2)量的方面 ①每124份质量的磷和160份质量的氧气完全反应生成284份质 量的五氧化二磷。 ②每4个磷原子和5个氧气分子完全反应生成2个五氧化二磷分 子。 4.书写原则 (1)必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在 的物质和化学反应。 (2)要遵守质量守恒定律,等号两边的各原子的种类与数目必须相 等。
考点梳理
自主测试
1
2
3
4
5
6
7
8
3.科研人员研发了一种以甲醇为原料的新型手机电池,其容量为锂 电池的10倍,可连续使用一个月才充一次电,其电池反应原理为 2CH3OH+3X+4NaOH 2Na2CO3+6H2O,其中X的化学式为 ( ) A.O2 B.CO C.CO2 D.H2 答案:A
考点梳理
考点梳理
自主测试
1
2
3
4
5
6
7
8
2.在下列各项中,化学反应前后肯定没有发生改变的是 ( ) ①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量 ⑤物质的种类 ⑥原子的种类 A.①③④⑤ B.①③④⑥ C.①④⑥ D.①②③⑤ 解析:根据化学反应的实质可知,反应前后原子种类、数目、质量 没有变化,故物质总质量不变,元素种类不变。而化学变化是产生 新物质的变化,因此物质种类一定改变,分子个数可能改变。 答案:B
自主测试
一
二
三
四
四、根据化学方程式进行的有关计算 1.计算依据:化学方程式中各物质之间的质量关系。 2.计算的步骤:“设、写、找、列、求、答”,即:第一,设出未知数; 第二,写出正确的化学方程式;第三,找出已知量和未知量的质量关 系;第四,列出正确的比例式;第五,求出未知数;第六,写出简明答案。 为了便于记忆,化学方程式的计算可编成如下口诀: 一解二设最后答,化学方程式不能错; 准确找到质量比,纯量代入不掺假; 所有单位须一致,列式计算解决它。 3.基本题型:第一,有关纯净物的化学方程式的计算;第二,含杂质 物质(杂质不参加反应)的计算;第三,溶液中的有关化学方程式的计 算;第四,过量计算;第五,无数据(或缺数据)计算;第六,有关图像及数 据分析题。
自主测试
1
2
3
4
5
6
7
8
4.下列化学方程式书写正确的是( ) A.Fe2O3+4HCl 2FeCl 2+3H2O B.CuSO4+2NaOH Cu(OH)2↓+Na2SO4
C.3Fe+2O2 Fe3O4 D.2KNO3+CaCl 2 2KCl+Ca(NO3)2
考点梳理
自主测试
一
二
三
四
2.根据在化学反应中得、失氧分类
反应类 型 氧化反 应 还原反 应
反应特点
举例
①2H2+O2 一般指物质与氧气发生 2H2O 的反应 ②CH4+2O2
CO2+2H2O
含氧物质中的氧被夺去 ①H2+CuO H2O+Cu 的反应 ②3CO+Fe 2O3 2Fe+3CO2
考点梳理
分解 AB A+B+„„ 反应 即“一变多” AC+B 置换 A+BC 反应 即“一换一”
①C+2CuO 2Cu+CO2↑ ②Fe+CuSO4 FeSO4+Cu 复分 ①NaOH+HCl NaCl+H2O AB+CD AD+CB 解反 ②Na2CO3+Ca(OH)2 即“交换成分” CaCO3↓+2NaOH 应
考点梳理
自主测试
一
二
三
四
3.应用 (1)解释反应前后物质的质量变化及用质量差确定某一物质的质 量。 (2)推断反应物或生成物的化学式。 (3)确定物质的组成元素。 (4)进行各物质间量的计算。
考点梳理
自主测试
一
二
三
四
二、化学方程式 1.定义 用化学式来表示化学反应的式子。 2.意义 (1)质的方面:表明反应物和生成物及反应条件。
考点梳理
自主测试
一
二
三
四
一、质量守恒定律 1.定义 参加化学反应的各物质的质量总和,等于反应后生成的各物质的 质量总和。 2.理解 (1)定律是针对化学变化而言的,不能用于解释物理变化中的质 量守恒。 (2)定律中“参加反应的各物质质量”是指实际参加了化学反应 的质量,未参加反应的质量不能计算在内。 (3)从微观角度分析,“质量守恒”的原因是:化学反应前后,原子 的种类、数目、质量都没有改变。
考点梳理
自主测试
一
二
三
四
三、化学反应的类型 1.根据反应物、生成物的种类和数目分为四种基本类型
反应 反应特点 类型 化合 A+B+„„ 反应 即“多变一” AB
举例 ①2CO+O2 ②CO2+H2O ①2KMnO4 ②CaCO3 2CO2 H2CO3 K2MnO4+MnO2+O2↑ CaO+CO2↑
考点梳理
自主测试
一
二
三
四
6.配平化学方程式 (1)依据。 左右两边各元素的原子个数相等,即质量守恒。 (2)方法。 ①观察法:对于一些简单的化学方程式,可直接观察左右两边各 物质的化学式,在相应物质的化学式前配上适当的化学计量数,使 之相等即可。 ②最小公倍数法:选择在反应式两边各出现过一次,且原子个数 相差较多的元素作为突破口,求出反应物与生成物中该元素原子个 数的最小公倍数,再推出各化学式前的化学计量数。
考点梳理
自主测试
一
考点梳理
自主测试
一
二
三
四
注意(1)化学方程式必须尊重客观事实。 (2)在配平过程中不得更改化学式中的小角码,只能更改化学式前 的化学计量数。 (3)配平后不要忘记标明反应条件,缺少条件的化学反应一般是不 能发生的;在标出生成物的状态时要注意:如果反应物和生成物中 都有气体,气体生成物就不注“↑”号。同样,溶液中的反应如果反 应物和生成物中都有固体,固体生成物也不注“↓”号。
考点梳理
自主测试
1
2
3
4
5
6
7
8
1.下列有关对质量守恒定律的理解,正确的是( ) A.将5 g铁和5 g铜混合加热后,物质的总质量为10 g,遵循质量守恒 定律 B.化学反应前后分子的总数一定不会发生变化 C.5 g硫和5 g氧气完全反应后,生成物质量为10 g D.镁条燃烧后质量增加,不遵循质量守恒定律 答案:C
宏观上:表示反应物和生成物之间的 (2)量的方面 质量之比 微观上:表示反应物和生成物之间的 粒子数目比
考点梳理
自主测试
一
二
三
四
3.读法(以4P+5O2 2P2O5为例) (1)质的方面 磷和氧气在点燃的条件下反应生成五氧化二磷。 (2)量的方面 ①每124份质量的磷和160份质量的氧气完全反应生成284份质 量的五氧化二磷。 ②每4个磷原子和5个氧气分子完全反应生成2个五氧化二磷分 子。 4.书写原则 (1)必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在 的物质和化学反应。 (2)要遵守质量守恒定律,等号两边的各原子的种类与数目必须相 等。
考点梳理
自主测试
1
2
3
4
5
6
7
8
3.科研人员研发了一种以甲醇为原料的新型手机电池,其容量为锂 电池的10倍,可连续使用一个月才充一次电,其电池反应原理为 2CH3OH+3X+4NaOH 2Na2CO3+6H2O,其中X的化学式为 ( ) A.O2 B.CO C.CO2 D.H2 答案:A
考点梳理
考点梳理
自主测试
1
2
3
4
5
6
7
8
2.在下列各项中,化学反应前后肯定没有发生改变的是 ( ) ①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量 ⑤物质的种类 ⑥原子的种类 A.①③④⑤ B.①③④⑥ C.①④⑥ D.①②③⑤ 解析:根据化学反应的实质可知,反应前后原子种类、数目、质量 没有变化,故物质总质量不变,元素种类不变。而化学变化是产生 新物质的变化,因此物质种类一定改变,分子个数可能改变。 答案:B
自主测试
一
二
三
四
四、根据化学方程式进行的有关计算 1.计算依据:化学方程式中各物质之间的质量关系。 2.计算的步骤:“设、写、找、列、求、答”,即:第一,设出未知数; 第二,写出正确的化学方程式;第三,找出已知量和未知量的质量关 系;第四,列出正确的比例式;第五,求出未知数;第六,写出简明答案。 为了便于记忆,化学方程式的计算可编成如下口诀: 一解二设最后答,化学方程式不能错; 准确找到质量比,纯量代入不掺假; 所有单位须一致,列式计算解决它。 3.基本题型:第一,有关纯净物的化学方程式的计算;第二,含杂质 物质(杂质不参加反应)的计算;第三,溶液中的有关化学方程式的计 算;第四,过量计算;第五,无数据(或缺数据)计算;第六,有关图像及数 据分析题。
自主测试
1
2
3
4
5
6
7
8
4.下列化学方程式书写正确的是( ) A.Fe2O3+4HCl 2FeCl 2+3H2O B.CuSO4+2NaOH Cu(OH)2↓+Na2SO4
C.3Fe+2O2 Fe3O4 D.2KNO3+CaCl 2 2KCl+Ca(NO3)2
考点梳理
自主测试
一
二
三
四
2.根据在化学反应中得、失氧分类
反应类 型 氧化反 应 还原反 应
反应特点
举例
①2H2+O2 一般指物质与氧气发生 2H2O 的反应 ②CH4+2O2
CO2+2H2O
含氧物质中的氧被夺去 ①H2+CuO H2O+Cu 的反应 ②3CO+Fe 2O3 2Fe+3CO2
考点梳理
分解 AB A+B+„„ 反应 即“一变多” AC+B 置换 A+BC 反应 即“一换一”
①C+2CuO 2Cu+CO2↑ ②Fe+CuSO4 FeSO4+Cu 复分 ①NaOH+HCl NaCl+H2O AB+CD AD+CB 解反 ②Na2CO3+Ca(OH)2 即“交换成分” CaCO3↓+2NaOH 应
考点梳理
自主测试
一
二
三
四
3.应用 (1)解释反应前后物质的质量变化及用质量差确定某一物质的质 量。 (2)推断反应物或生成物的化学式。 (3)确定物质的组成元素。 (4)进行各物质间量的计算。
考点梳理
自主测试
一
二
三
四
二、化学方程式 1.定义 用化学式来表示化学反应的式子。 2.意义 (1)质的方面:表明反应物和生成物及反应条件。
