化学方程式总汇
化学方程式汇总(46个)
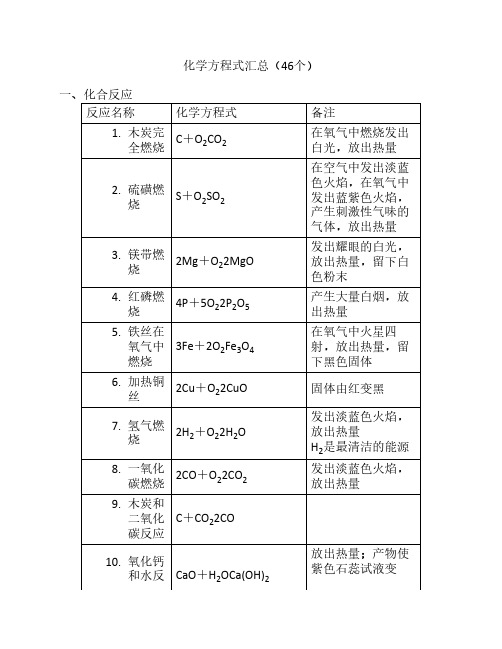
化学方程式汇总(46个)一、化合反应反应名称化学方程式备注1. 木炭完全燃烧C+O2CO2在氧气中燃烧发出白光,放出热量2. 硫磺燃烧S+O2SO2在空气中发出淡蓝色火焰,在氧气中发出蓝紫色火焰,产生刺激性气味的气体,放出热量3. 镁带燃烧2Mg+O22MgO发出耀眼的白光,放出热量,留下白色粉末4. 红磷燃烧4P+5O22P2O5产生大量白烟,放出热量5. 铁丝在氧气中燃烧3Fe+2O2Fe3O4在氧气中火星四射,放出热量,留下黑色固体6. 加热铜丝2Cu+O22CuO固体由红变黑7. 氢气燃烧2H2+O22H2O发出淡蓝色火焰,放出热量H2是最清洁的能源8. 一氧化碳燃烧2CO+O22CO2发出淡蓝色火焰,放出热量9. 木炭和二氧化碳反应C+CO22CO10. 氧化钙和水反CaO+H2OCa(OH)2放出热量;产物使紫色石蕊试液变应蓝,使无色酚酞试液变红11. 二氧化碳和水反应CO2+H2OH2CO3产物使紫色石蕊试液变红12. 硫酸铜粉末和水反应CuSO4+5H2OCuSO4·5H2O白色粉末变成蓝色晶体,放出热量CuSO4粉末用于检验物质是否含有水二、分解反应反应名称化学方程式备注13. 碳酸受热分解H2CO3H2O+CO2↑H2CO3不稳定14. 电解水2H2O2H2↑+O2↑正负极都产生气泡,负极产生的气体体积是正极产生气体的2倍负氢正氧,氢二氧一;工业上生产H215. 高温煅烧大理石或石灰石CaCO3CaO+CO2↑工业上生产CaO16. 过氧化氢在二氧化锰的催化作用下分解2H2O22H2O+O2↑产生大量气泡,放出热量实验室制取O217. 加热氯酸钾和二氧化锰的混合物2KClO32KCl+3O2↑实验室制取O218. 加热硫酸铜晶体CuSO4·5H2OCuSO4+5H2O蓝色晶体变成白色粉末,试管口产生无色液体三、置换反应反应名称化学方程式备注19. 木炭还原氧化铜C+2CuO2Cu+CO2↑产生红色固体20. 氢气还原氧化铜H2+CuOCu+H2O产生红色固体,试管口产生无色液体H2有还原性,用于冶炼金属21. 镁带在二氧化碳中燃烧2Mg+CO22MgO+C产生黑色和白色固体22. 锌粒和稀盐酸反应Zn+2HClZnCl2+H2↑实验室制取H223. 锌粒和稀硫酸反应Zn+H2SO4ZnSO4+H2↑实验室制取H224. 铁钉和稀盐酸反应Fe+2HClFeCl2+H2↑Fe元素从0价变成+2价25. 铁钉和稀硫酸Fe+H2SO4FeSO4+H2↑26. 铁丝和硫酸铜溶液反应Fe+CuSO4FeSO4+Cu铁丝表面产生红色固体27. 铜丝和硝酸银溶液反应Cu+2AgNO3Cu(NO3)2+2Ag铜丝表面产生银白色固体四、复分解反应反应名称化学方程式备注28. 氢氧化镁治疗胃“泛酸”Mg(OH)2+2HClMgCl2+2H2O29. 大理石或石灰石和稀盐酸反应CaCO3+2HClCaCl2+H2O+CO2↑实验室制取CO230. 硝酸银溶液和稀盐酸反应AgNO3+HClAgCl↓+HNO3产生白色沉淀31. 氯化钡溶液和稀硫酸反应BaCl2+H2SO4BaSO4↓+2HCl产生白色沉淀32. 硫酸铜溶液和氢氧化钠溶液反应CuSO4+2NaOHCu(OH)2↓+Na2SO4产生蓝色沉淀33. 氯化铁溶液和氢氧化钠溶液FeCl3+3NaOHFe(OH)3↓+3NaCl产生红褐色沉淀34. 碳酸钠溶液和石灰水反应Na2CO3+Ca(OH)2CaCO3↓+2NaOH35. 硫酸铜溶液和熟石灰制取农药波尔多液CuSO4+Ca(OH)2Cu(OH)2↓+CaSO436. 碳酸钠溶液和足量盐酸反应Na2CO3+2HCl2NaCl+H2O+CO2↑37. 氯化钠溶液和硝酸银溶液反应NaCl+AgNO3AgCl↓+NaNO3AgCl不溶于HNO338. 硫酸钠溶液和氯化钡溶液反应Na2SO4+BaCl2BaSO4↓+2NaClBaSO4不溶于HNO3五、其他反应反应名称化学方程式备注39. 甲烷燃烧CH4+2O2CO2+2H2O产生淡蓝色火焰40. 少量二氧化碳通入石灰水CO2+Ca(OH)2CaCO3↓+H2O产生白色沉淀;石灰水在空气中变质;石灰水用于检验CO241. 少量二氧NaOH在空气中变化碳和氢氧化钠溶液反应CO2+2NaOHNa2CO3+H2O质;NaOH溶液用于吸收CO242. 氢氧化钠溶液吸收二氧化硫SO2+2NaOHNa2SO3+H2ONa2SO3名称是亚硫酸钠43. 一氧化碳还原氧化铜CO+CuOCu+CO2产生红色固体尾气需要燃烧处理,防止CO污染空气44. 一氧化碳还原氧化铁3CO+Fe2O32Fe+3CO2工业炼铁的主要反应45. 盐酸除铁锈Fe2O3+6HCl2FeCl3+3H2O溶液变成棕黄色46. 硫酸溶解氧化铜固体CuO+H2SO4CuSO4+H2O溶液变成蓝色*固体小颗粒分散到气体中形成烟;小液滴分散到气体中形成雾。
化学方程式及化学表达式

1、磷+氧气→点燃→五氧化二磷【P+O2→△→P2O5】(4P+5O2=△=2P2O5)2、碳+氧气→点燃→二氧化碳【C+ O2→△→CO2】(C+ O2=△=CO2)3、硫+氧气→点燃→二氧化硫【S+ O2→△→SO2】(S+O2=△=SO2)4、铁+氧气→点燃→四氧化三铁【Fe+O2→△→Fe3O4】(3Fe+2O2=△=Fe3O4)5、过氧化氢→二氧化锰→水+氧气【H2O2→MnO2→2 H2O+ O2】(2H2O2=MnO2=2 H2O+ O2↑)6、氯酸钾→二氧化锰∕加热→氯化钾+氧气【KClO3→MnO2∕△→KCl+ O2 】(2KClO3=MnO2∕△=2KCl+ 3O2↑)7、高锰酸钾→加热→锰酸钾+二氧化锰+氧气【KMnO4→△→K2MnO4+MnO2+ O2】(2KMnO4→△→K2MnO4+MnO2+ O2↑)8、水→通电→氢气+氧气【H2O→通电→H2 +O2】(2H2O=通电=2H2↑+O2↑)9、氢气+氯气→点燃→氯化氢【H2+Cl2→△→HCl】(H2+Cl2=△=2HCl)10、氧化汞→加热→汞+氧气【HgO→△→Hg+ O2】(2HgO=△=2Hg+ O2↑)11、氢气+氧气→点燃→水【H2 +O2→△→H2O】(H2 +O2=△=2H2O)12、铁+硫酸铜→→铜+硫酸亚铁【Fe+CuSO4→→Cu+FeSO4】(Fe+CuSO4==Cu+FeSO4)13、碳酸钠+盐酸→→氯化钠+二氧化碳+水【Na2CO3+HCl→→NaCl+CO2+H2O】(Na2CO3+2HCl==2NaCl+CO2↑+H2O)14、镁+氧气→点燃→氧化镁【Mg+ O2→△→MgO】(2Mg+ O2=△=2MgO)15、氧化铜+氢气→加热→铜+水【CuO+H2→△→Cu+ H2O】(CuO+H2=△=Cu+ H2O)16、碳酸钙→高温→氧化钙+二氧化碳【CaCO3→高温→CaO+CO2】(CaCO3=高温=CaO+CO2↑)17、铝+氧气→点燃→氧化铝【Al+O2→△→Al2O3】(4Al+3O2=△=2Al2O3)18、石蜡+氧气→点燃→二氧化碳+水【C2H4+ O2→△→CO2+H2O】(C2H4+3O2=△=2CO2+2H2O)19、氢氧化钠+硫酸铜→→氢氧化铜+硫酸钠【NaOH+CuSO4→→Cu(OH)2↓+Na2SO4】(2NaOH+CuSO4==Cu(OH)2↓+Na2SO4)20、氧化铁+氢气→高温→铁+水【Fe2O3+H2→高温→Fe+H2O】(Fe2O3+3H2=高温=2Fe+3H2O)21、氧化铁+一氧化碳→高温→铁+二氧化碳【Fe2O3+CO→高温→Fe+CO2】(Fe2O3+3CO=高温=2Fe+3CO2)22、甲烷+氧气→点燃→二氧化碳+水【CH4+O2→△→CO2+H2O】(CH4+2O2=△=CO2+2H2O)23、锌+硫酸→→硫酸锌+氢气【Zn+H2SO4→→ZnSO4+H2】(Zn+H2SO4==ZnSO4+H2↑)24、锌+盐酸→→氢气+氯化锌【Zn+HCl→→H2+ZnCl2】(Zn+2HCl==H2↑+ZnCl2)25、碳+氧气→点燃→一氧化碳【C+ O2→△→CO】(2C+ O2=△=2CO)26、氧化铜+碳→高温→铜+二氧化碳【CuO+C→高温→Cu+CO2】(2CuO+C→高温→2Cu+CO2↑)27、氧化铁+碳→高温→铁+二氧化碳【CuO+C→高温→Cu+CO2】(CuO+C高温Cu+CO2)28、碳酸钙+盐酸→→氯化钙+碳酸【CaCO3+HCl→→CaCl2+H2CO3】(CaCO3+2HCl==CaCl2+H2CO3)29、碳酸→→二氧化碳+水【H2CO3→→CO2+H2O】(H2CO3==CO2↑+H2O)30、{碳酸钙+盐酸→→氯化钙+二氧化碳+水【CaCO3+HCl→→CaCl2+CO2+H2O】(CaCO3+2HCl==CaCl2+CO2↑+H2O)}31、二氧化碳+水→→碳酸【CO2+H2O→→H2CO3】(CO2+H2O==H2CO3)32、二氧化碳+氢氧化钙→→碳酸钙+水【CO2+Ca(OH)2→→CaCO3+H2O】(CO2+Ca(OH)2==CaCO3↓+H2O)33、一氧化碳+氧气→点燃→二氧化碳【CO+O2→△→CO2】(CO+O2=△=CO2)34、氧化铜+一氧化碳→加热→铜+二氧化碳【CuO+CO→△→Cu+CO2】(CuO+CO=△=Cu+CO2)35、乙醇+氧气→点燃→二氧化碳+水【C2H5OH+O2→△→CO2+H2O】(C2H5OH+3O2=△=2CO2+3H2O)。
化学方程式大全汇总

化学方程式大全汇总
1、水的化学方程式:H2O(水)=H+(氢离子)+OH-(氧离子)
2、氧气的化学方程式:O2(氧气)=2O-(氧离子)
3、二氧化碳的化学方程式:CO2(二氧化碳)=C(碳)+2O-(氧离子)
4、氢氧化钠的化学方程式:NaOH(氢氧化钠)=Na+(钠离子)+OH-(氧离子)
5、硫酸的化学方程式:H2SO4(硫酸)=2H+(氢离子)+SO4-(硫酸
离子)
6、乙醇的化学方程式:CH3CH2OH(乙醇)=C2H5(乙烷)+OH-(氧离子)
7、氯气的化学方程式:Cl2(氯气)=2Cl-(氯离子)
8、醋酸的化学方程式:CH3COOH(醋酸)=C2H4O2(乙酸)+H+(氢离子)
9、硝酸的化学方程式:HNO3(硝酸)=H+(氢离子)+NO3-(硝酸离子)
10、硫酸铵的化学方程式:NH4HSO4(硫酸铵)=NH4+(铵离子)
+HSO4-(硫酸离子)
11、硅酸钠的化学方程式:Na2SiO3(硅酸钠)=Na2+(钠离子)
+SiO3-(硅酸离子)
12、硝酸钾的化学方程式:KNO3(硝酸钾)=K+(钾离子)+NO3-(硝
酸离子)
13、钙氢氧化物的化学方程式:Ca(OH)2(钙氢氧化物)=Ca2+(钙离子)+2OH-(氧离子)。
初中常见50个化学方程式

初中常见50个化学方程式1、2H₂+ O₂→2H₂O(氢气与氧气生成水)2、2Na + Cl₂→2NaCl(钠与氯气生成氯化钠)3CH₄+ 2O₂→CO₂+ 2H₂O(甲烷燃烧生成二氧化碳和水)4、CaCO₃→CaO + CO₂(碳酸钙分解生成氧化钙和二氧化碳)5、HCl + NaOH →NaCl + H₂O(盐酸与氢氧化钠中和生成氯化钠和水)6、Fe + S →FeS(铁与硫化合生成硫化铁)7、2H₂O →2H₂+ O₂(水分解生成氢气和氧气)8、CuSO₄+ Zn →ZnSO₄+ Cu(硫酸铜与锌反应生成硫酸锌和铜)9、C₃H₈+ 5O₂→3CO₂+ 4H₂O(丙烷燃烧生成二氧化碳和水)10、2AgNO₃+ Cu →2Ag + Cu(NO₃)₂(硝酸银与铜反应生成银和硝酸铜)11、2Na + 2H₂O →2NaOH + H₂(钠与水反应生成氢氧化钠和氢气)12、Fe + CuSO₄→FeSO₄+ Cu(铁与硫酸铜反应生成硫酸亚铁和铜)13、H₂SO₄+ 2NaOH →Na₂SO₄+ 2H₂O(硫酸与氢氧化钠中和生成硫酸钠和水)14、Zn + 2HCl →ZnCl₂+ H₂(锌与盐酸反应生成氯化锌和氢气)15、Ca(OH)₂+ 2HCl →CaCl₂+ 2H₂O(氢氧化钙与盐酸反应生成氯化钙和水)16、2Mg + O₂→2MgO(镁与氧气反应生成氧化镁)17、C + O₂→CO₂(碳与氧气反应生成二氧化碳)18、2Al + 6HCl →2AlCl₃+ 3H₂(铝与盐酸反应生成氯化铝和氢气)19、2NaHCO₃→Na₂CO₃+ CO₂+ H₂O(碱式碳酸氢钠分解生成碳酸钠、二氧化碳和水)20、2K + 2H₂O →2KOH + H₂(钾与水反应生成氢氧化钾和氢气)21、2HCl + Ca(OH)₂→CaCl₂+ 2H₂O(盐酸与氢氧化钙反应生成氯化钙和水)22、2Na + 2H₂O →2NaOH + H₂(钠与水反应生成氢氧化钠和氢气)23、CH₃COOH + NaHCO₃→CH₃COONa + CO₂+ H₂O(醋酸与碱式碳酸氢钠反应生成乙酸钠、二氧化碳和水)24、H₂O + CO₂→H₂CO₃(二氧化碳溶解在水中生成碳酸)25、CuO + H₂→Cu + H₂O(氧化亚铜与氢气反应生成铜和水)26、2HgO →2Hg + O₂(氧化汞分解生成汞和氧气)27、4Fe + 3O₂→2Fe₂O₃(铁与氧气反应生成氧化铁)28、2H₂O₂→2H₂O + O₂(过氧化氢分解生成水和氧气)29、Ca + 2H₂O →Ca(OH)₂+ H₂(钙与水反应生成氢氧化钙和氢气)30、2AgNO₃+ Na₂S →Ag₂S + 2NaNO₃(硝酸银与硫化钠反应生成硫化银和硝酸钠)31、Al + Cl₂→AlCl₃(铝与氯气反应生成氯化铝)32、C₃H₈+ 5O₂→3CO₂+ 4H₂O(丙烷燃烧生成二氧化碳和水)33、2HNO₃+ Ba(OH)₂→Ba(NO₃)₂+ 2H₂O(硝酸与氢氧化钡反应生成硝酸钡和水)34、Zn + H₂SO₄→ZnSO₄+ H₂(锌与硫酸反应生成硫酸锌和氢气)35、2Mg + 2HCl →MgCl₂+ H₂(镁与盐酸反应生成氯化镁和氢气)36、2C₄H₁₀+ 13O₂→8CO₂+ 10H₂O(戊烷燃烧生成二氧化碳和水)37、Na₂O + H₂O →2NaOH(氧化钠与水反应生成氢氧化钠)38、CaO + H₂O →Ca(OH)₂(氧化钙与水反应生成氢氧化钙)39、2Fe + 3Cl₂→2FeCl₃(铁与氯气反应生成氯化铁)40、NH₃+ HCl →NH₄Cl(氨气与盐酸反应生成氯化铵)41、Mg + 2H₂O →Mg(OH)₂+ H₂(镁与水反应生成氢氧化镁和氢气)42、C₂H₅OH + O₂→CO₂+ H₂O(乙醇燃烧生成二氧化碳和水)43、2Ag + S →Ag₂S(银与硫反应生成硫化银)44、2Al + 3CuCl₂→2AlCl₃+ 3Cu(铝与氯化亚铜反应生成氯化铝和铜)45、2NH₄NO₃→2N₂+ 4H₂O + O₂(硝酸铵分解生成氮气、水和氧气)46、KClO₃→KCl + O₂(高氯酸钾分解生成氯化钾和氧气)47、C₆H₁₂O₆→2C₂H₅OH + 2CO₂(葡萄糖发酵生成乙醇和二氧化碳)48、Ca + 2HCl →CaCl₂+ H₂(钙与盐酸反应生成氯化钙和氢气)49、2H₂O + O₂→2H₂O₂(水和氧气反应生成过氧化氢)50、4NH₃+ 5O₂→4NO + 6H₂O(氨气与氧气反应生成一氧化氮和水)。
化学方程式汇总

总目录一、无机化学方程式二、热化学方程式三、有机反应方程式四、离子方程式五、电极方程式-----------------------------------------------------------------------------------------分目录表一、无机化学方程式 (6)A (6)Ag (6)Al (6)Al (6)Al2O3、Al(OH)3 (7)铝盐 (7)As (7)B (7)Ba (7)Be (8)Br (8)C (8)C (8)C (8)CO (9)CO2 (9)Ca (10)Cl (10)Cu (10)F (11)F2 (11)Fe (11)Fe (11)FeO (12)Fe2O3 (12)Fe3O4 (12)Fe(OH)2、Fe(OH)3 (12)FeCl2 (12)FeCl3 (12)FeS (13)其它Fe化合物 (13)H (13)H2 (13)Hg (13)HF (14)HCl (14)HBr (14)HI (14)H2O (14)H2O2 (15)H2S (15)H2CO3 (15)HClO (15)HNO3 (15)H3PO4 (16)H2SO3 (17)H2SO4 (17)I (18)K (18)K (18)K2O、K2O2 (18)KOH (19)K2CO3 (19)KHCO3 (19)KClO3 (19)KI (19)KAl(SO4)2 (19)KMnO4 (20)KSCN (20)KH (20)L (20)Li (20)Li2O (20)LiOH (20)Li2CO3 (21)LiHCO3 (21)M (21)Mg (21)MgO (21)Mg(OH)2 (21)MgCO3 (22)Mg(HCO3)2 (22)MgSO4 (22)MnO2 (22)N (22)N2 (22)NO、NO2、N2O5 (22)NH3 (23)NH4HCO3、(NH4)2CO3 (23)NH4Cl (24)NH4NO3 (24)(NH4)2SO3、(NH4)2SO4 (24)Na、Na2O、Na2O2 (24)NaH (25)NaOH (25)NaAlO2 (25)NaCl、NaClO、NaBr、NaI (26)Na2CO3、NaHCO3 (26)NaNO3、NaNO2 (26)Na3PO4、NaH2PO4、Na2HPO4 (27)Na2S、NaHS (27)Na2SO4、Na2SO3、Na2S2O3 (27)Na2SiO3 (27)C6H5ONa (27)O (28)O2 (28)O3 (28)P (29)P (29)P2O3、P2O5 (29)Pb、PbO2 (29)铅盐 (29)R (30)S (30)S (30)SO2 (30)SO3 (31)Si (31)SiO2 (31)Z (32)Zn (32)ZnO (32)Zn(OH)2 (32)二、热化学方程式 (33)B (33)C (33)H (33)N (34)P (34)S (34)三、有机反应方程式 (35)(一)、烷烃 (35)(二)、烯烃 (35)(三)、炔烃 (35)(四)、芳香烃 (35)(五)、石油 (36)(六)、卤代烃 (36)(七)、醇类 (36)(八)、酚类 (37)(九)、醛类 (37)(十)、羧酸 (37)(十一)、糖类 (38)(十二)、油脂 (38)(十三)、氨基酸 (39)四、离子反应方程式 (39)A (39)Al (39)Ag (40)As (41)B (41)Ba (41)Br (41)C (41)C (41)Ca (42)Cl (42)CN (43)Cr (43)Cu (43)CxHyOz (43)F (44)F2 (44)Fe (44)H (45)H+ (45)H2O (45)H2O2 (45)H2CO3系列 (46)H3PO4系列 (46)H2S系列 (47)H2SO3系列 (47)I (47)L (48)M (48)Mg (48)Mn (48)N (49)Na (49)NN3系列 (49)NO2-、NO3- (49)O (49)P (50)S (50)S (50)Si (51)Z (51)五、电极反应方程式 (52)(一)、原电池电极反应方程式 (52)1.Cu─H2SO4─Zn原电池 (52)2.Cu─FeCl3─C原电池 (52)3.钢铁在潮湿的空气中发生吸氧腐蚀 (52)4.氢氧燃料电池(中性介质) (52)5.氢氧燃料电池(酸性介质) (53)6.氢氧燃料电池(碱性介质) (53)7.铅蓄电池(放电) (53)8.Al─NaOH─Mg原电池 (53)9.CH4燃料电池(碱性介质) (53)10.熔融碳酸盐燃料电池 (53)11.银锌纽扣电池(碱性介质) (54)(二)、电解电极反应方程式 (54)1.电解CuCl2溶液 (54)2.电解精炼铜 (54)3.电镀铜 (54)4.电解饱和食盐水 (54)5.电解HCl溶液 (55)6.电解NaOH溶液 (55)7.电解H2SO4溶液 (55)8.电解KNO3溶液 (55)9.电解CuSO4溶液 (55)10.电解AgNO3溶液 (55)11.铅蓄电池充电 (56)正文部分一、无机化学方程式AAgAg+2HNO3(浓)→AgNO3+NO2↑+H2O2AgCl→2Ag+Cl2↑(见光或受热)AgNO3+NaCl→AgCl↓+NaNO3AgNO3+NaBr→AgBr↓+NaNO3 AgNO3+NaI→AgI↓+NaNO32AgNO3+H2S→Ag2S↓+2HNO3Ag3PO4+3HNO3→H3PO4+3AgNO3AlAlAl+3O2点燃2Al2O3(纯氧) 2Al+3S △Al2S3 2Al+3Cl2△2AlCl34Al(固)+3O2(气)→2Al2O3(固)+3349.3 kJ·mol-14Al+3MnO2高温2Al2O3+3Mn 2Al+Cr2O3高温Al2O3+2Cr2Al+Fe2O3高温Al2O3+2Fe 2Al+3FeO △Al2O3+3Fe2Al + 6HCl → 2AlCl3 + 3H2↑ 2Al+3H2SO4→Al2(SO4)3+3H2↑2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2OAl+4HNO3(稀)→Al(NO3)3+NO↑+2H2O (Al、Fe在冷、浓的H2SO4、HNO3中钝化) 2Al+2NaOH+2H2O→2NaAlO2+3H2↑Al2O3、Al(OH)3Al2O3+3H2SO4→Al2(SO4)3+3H2O (Al2O3是两性氧化物) Al2O3+2NaOH→2NaAlO2+H2O2Al(OH)3△Al2O3+3H2OAl(OH)3+3HCl→AlCl3+3H2O 2Al(OH)3+3H2SO4→Al2(SO4)3+6H2O Al(OH)3+NaOH→NaAlO2+2H2O铝盐AlCl3+3NaOH→A l(O H)3↓+3NaClAlCl3+3NH3·H2O→Al(OH)3↓+3NH4Cl2AlCl3+3Na2CO3+3H2O→2Al(OH)3↓+3CO2↑+6NaClAlCl3+3NaHCO3→Al(OH)3↓+3CO2↑AlCl3+3NaAlO2+ 6H2O→4Al(OH)3↓AlCl3+4NaOH→Na[Al(OH)4]+3NaClAl2(SO4)3+3Na2S+ 6H2O→2Al(OH)3↓+3H2S↑Al4C3+12H2O→4Al(OH)3↓+3CH4↑AsAs2O3+6Zn+12HCl→2AsH3↑+6ZnCl2+3H2O3As2S3+28HNO3(稀)+4H2O→6H3AsO4+9H2SO4+28NO↑As2S3+28HNO3(浓)→2H3AsO4+3H2SO4+28NO2↑+8H2OBBaBa(OH)2+CO2→BaCO3↓+H2O Ba(OH)2+2CO2(过量)→Ba(HCO3)2Ba(OH)2+H2SO4→BaSO4↓+2H2O 3Ba(OH)2+2H3PO3→Ba3(PO4)2↓+6H2O BaCl2+H2SO4→BaSO4↓+2HCl BaCl2+Na2SO4→BaSO4↓+2NaClBaCO3+2HCl→BaCl2+CO2↑+H2O BaCO3+2HNO3→Ba(NO3)2+CO2↑+H2OBaO2+H2SO4(稀)→BaSO4↓+H2O2)BeBe+2HCl→BaCl2+H2↑ Be+2NaOH→ Na2BO2+H2↑BeCl2+2NaOH→Be(OH)2↓+2H2OBe(OH)2+2HCl→BeCl2+2H2O Be(OH)2+2NaOH→Na2BO2+2H2O BrBr2+H2△2HBr Br2+Fe→FeBr3Br2+2FeBr2→2FeBr3 Br2+NaI→NaBr+I2 Br2+HI→HBr+I2 Br2+H2O→HBr+HBrOBr2+NaOH→NaBr+NaBrO + H2OBr2+SO2 +2H2O→H2SO4 +2HBrBr2+H2S→S↓ +2HBr2Br2+3Na2CO3+H2O→2NaHCO3+2NaBrO+2NaBr+CO2↑CCCC+2F2→CF4C+2Cl2→CCl42C+O2(少量)点燃2COC+O2(足量)点燃CO2C+CO2△2COC+H2O高温CO+H2(生成水煤气)2C+SiO2△Si+2CO(制得粗硅)C+Si △siC(金刚砂) C +2S△CS23C+CaO 电炉CaC2+CO↑3C+SiO2电炉SiC+2CO↑C+2H2SO4(浓)△CO2↑+2SO2↑+2H2OC +4HNO3(浓)△CO2↑+4NO2↑+2H2OCO2CO+O2点燃2CO2CO+CuO △Cu+CO23CO+Fe2O3△2Fe+3CO2CO+H2O催化剂△CO2+H2CO2CO2+2Mg点燃2MgO+CCO2+H2O→H2CO3CO2+2NaOH(过量)→Na2CO3+H2OCO2(过量)+NaOH→NaHCO3CO2+Ca(OH)2(过量)→CaCO3↓+H2O2CO2(过量)+Ca(OH)2→Ca(HCO3)2CO2+2NaAlO2+3H2O→2Al(OH)3↓+Na2CO3CO2+C6H5ONa+H2O→C6H5OH+NaHCO3CO2+Na2O→Na2CO32CO2+2Na2O2→2Na2CO3+O2CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl(侯氏制碱法)CaCaO+H 2O →Ca(OH)2 CaO+SiO 2 高温 CaSiO 32Ca(OH)2+2Cl 2→CaCl 2+Ca(ClO)2+2H 2O Ca(OH)2 +SO 3→CaSO 4+H 2O CaCO 3+2HNO 3→Ca(NO 3)2+H 2O+CO 2↑(用HNO 3和浓H 2SO 4不能制备H 2S 、HI 、HBr 、(SO 2)等还原性气体)CaCO 3+SiO 2 高温 CaSiO 3+CO 2↑CaF 2+H 2SO 4(浓)→CaSO 4+2HF ↑Ca 3(PO 4)2+3H 2SO 4(浓)→3CaSO 4+2H 3PO 4 Ca 3(PO 4)2+2H 2SO 4(浓)→2CaSO 4+Ca(H 2PO 4)2 Ca 3(PO 4)2+4H 3PO 4→3Ca(H 2PO 4)2(重钙)CaH 2+2H 2O →Ca(OH)2+2H 2↑ClCl 2 +H 2 →2HCl (光照或点燃) Cl 2 +2Na2NaCl3Cl 2 +2P2PCl 3 Cl 2 +PCl 3 PCl 5 3Cl 2 +2Fe 2FeCl 3 Cl 2+Cu CuCl 2Cl 2 +2FeCl 2 →2FeCl 3 2Cl 2+2NaBr →2NaCl+Br 2Cl 2 + 2KI →2KCl + I 2 * 5Cl 2+I 2+6H 2O →2HIO 3+10HCl Cl 2 +Na 2S →2NaCl+S ↓ Cl 2 +H 2S →2HCl+S ↓Cl 2+SO 2 +2H 2O →H 2SO 4 +2HCl Cl 2+H 2SO 3+ H 2O →H 2SO 4+2HCl Cl 2+H 2O →HCl +HClO Cl 2 +H 2O 2 →2HCl+O 2Cl 2+2NaOH →NaCl+NaClO+H 2O 2Cl 2+2Ca(OH)2→CaCl 2+Ca(ClO)2+2H 2O 3Cl 2 +6KOH(热、浓)→5KCl+KClO 3+3H 2OCu2Cu +O 2 △ 2CuO 2Cu +S △Cu 2S Cu+ Cl 2 CuCl 23CuO+2NH3△3Cu+N2+3H2OCuO+2HCl→CuCl2+H2O CuO+H2SO4→CuSO4+H2OCu(OH)2+2HCl→CuCl2+2H2O Cu(OH)2+H2SO4→CuSO4+2H2OCu(OH)2△CuO + H2OCuCl2+H2S→CuS↓+2HCl CuCl2+2NaOH→Cu(OH)2↓+2NaClCuSO4+H2S→CuS↓+H2SO4 CuSO4+2NaOH→Cu(OH)2↓+Na2SO4 CuSO4+Ba(OH)2→Cu(OH)2↓+BaSO4↓FF2F2 + H2→ 2HF 2F2 + 2H2O → 4HF + O2FeFe2Fe + 3Cl2点燃2FeCl3 3Fe + 2O2点燃Fe3O4Fe +S △FeS 2Fe+3Br2→2FeBr3Fe+I2△FeI2 Fe+S△FeS3Fe+4H2O(g)高温Fe3O4+4H2 Fe+2HCl→FeCl2+H2↑Fe+CuCl2→FeCl2+Cu Fe+SnCl4→FeCl2+SnCl2 Fe + H2S→FeS+H2↑2Fe +6H2SO4(浓)→Fe2(SO4)3+3SO2↑+6H2OFe +H2SO4(稀)→FeSO4+H2↑Fe +6HNO3→Fe(NO3)3+3NO2↑+3H2OFe +4HNO3→Fe(NO3)3+NO↑+2H2O8Fe +30HNO3→8Fe(NO3)3+3N2O↑+15H2O 10Fe +36HNO3→10Fe(NO3)3+3N2↑+18H2O 8Fe +30HNO3→8Fe(NO3)3+3NH4NO3+9H2O Fe(Al) +H2SO4(浓)室温下钝化Fe+(CH3COO)2Cu→Cu+(CH3COO)2Fe FeO3FeO + 2Al △Al2O3+3Fe 6FeO+O2△2Fe3O4FeO+4HNO3→Fe(NO3)3+NO2↑+2H2O Fe2O3Fe2O3 +2Al高温Al2O3+2Fe Fe2O3 +3CO △2Fe+3CO2Fe2O3+3H2→2Fe+3H2O (制还原铁粉) Fe2O3+6HCl→2FeCl3+3H2O Fe3O4Fe3O4+4H2△3Fe+4H2O Fe3O4+8HCl(浓)△FeCl2+2FeCl3+4H2OFe(OH)2、Fe(OH)34Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3 2Fe(OH)3△Fe2O3+3H2OFeCl22FeCl2 + Cl2→2FeCl3 FeCl2+Mg→Fe+MgCl2FeCl32FeCl3+Fe→3FeCl2 2FeCl3+Cu→2FeCl2+CuCl2(用于雕刻铜线路版) 2FeCl3+H2SO3+H2O→H2SO4+2FeCl2+2HCl2FeCl3+Zn→2FeCl2+ZnCl2 2FeCl3+H2S→2FeCl2+2HCl+S↓2FeCl3+2KI→2FeCl2+2KCl+I2FeCl3+3NH3·H2O→Fe(OH)3↓+3NH4Cl2FeCl3+3Na2CO3+3H2O→2Fe(OH)3↓+3CO2↑+6NaClFeCl3+3NaHCO3→Fe(OH)3↓+3CO2↑2FeCl3+SO2+2H2O→2FeCl2+H2SO4+2HCl BaCl2+H2SO4→BaSO4↓+2HCl FeCl3 + 3KSCN → Fe(SCN)3 + 3KClFeSFeS + 2HCl → FeCl2 + H2S↑ FeS + H2SO4→ FeSO4 + H2S↑4FeS2 + 11O2→ 2Fe2O2 + 8SO2其它Fe化合物Fe2(SO4)3+2Ag→FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应HH2H2 +F2→ 2HF (冷暗处爆炸)H2+Cl2→2HCl (光照或点燃)3H2+N2催化剂高温高压2NH3 H2+S△H2S6H2+P4△4PH3 2H2+SiCl4△Si(纯)+4HClH2+2Na→2NaH3H2+Fe2O3→2Fe+3H2O (制还原铁粉)4H2+Fe3O4△3Fe+4H2O 2H2 +SiO2△Si+2H2OHg3Hg + 8HNO3(稀) → 3Hg(NO3)2 + 2NO2↑+ 4H2OHg + 4HNO3(浓) → Hg(NO3)2 + 2NO2↑+ 2H2OHF4HF+SiO2→SiF4+2H2OHCl6HCl +2Al→2AlCl3+3H2↑ 2HCl +Fe→FeCl2+H2↑4HCl(浓)+MnO2△MnCl2+Cl2+2H2O 4HCl(g)+O2△2Cl2+2H2O16HCl+2KMnO4→2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7→2KCl+2CrCl3+3Cl2+7H2O HCl +NH3→NH4Cl(白烟)2HCl +FeO→FeCl2+3H2O 6HCl +Fe2O3→2FeCl3+3H2O8HCl(浓) +Fe3O4△FeCl2+2FeCl3+4H2O HCl +Na3PO4→Na2HPO4+NaClHCl +Na2HPO4→NaH2PO4+NaCl HCl +NaH2PO4→H3PO4+NaCl HCl +Na2CO3→NaHCO3+NaCl HCl +NaHCO3→NaCl+H2O+CO2 HBrHBr + NaOH → NaBr + H2O2HBr + Cl2→ 2HCl + Br2HI2HI △H2+I22HI + Cl2→ 2HCl + I2 HI + NaOH → NaI + H2O H2O2F2 +2H2O→4HF+O2 Cl2+H2O→HCl+HClO2Na+2H2O→2NaOH+H2↑ Mg+2H2O→Mg(OH)2+H2↑3Fe+4H2O(g)高温Fe3O4+4H2 2H2O电解2H2↑+O2SO2+H2O→H2SO3 SO3+H2O→H2SO43NO2+H2O→2HNO3+NO N2O5+H2O→2HNO3P2O5+H2O(冷)→2HPO3 P2O5+3H2O(热)→2H3PO4CO2+H2O→H2CO3H2O22H2O2→2H2O+O2↑ H2O2 + Cl2→2HCl+O25H2O2 + 2KMnO4 + 6HCl →2MnCl2 + 2KCl + 5O2↑+ 8H2OH2SH2S + Cl2→2HCl+S↓ H2S + Mg→MgS+H22H2S+3O2(足量)→2SO2+2H2O 2H2S+O2(少量)→2S+2H2O2H2S+SO2→3S+2H2O H2S+H2SO4(浓)→S↓+SO2+2H2OH2S △H2+S 3H2S+2HNO3(稀)→3S↓+2NO+4H2O5H2S+2KMnO4+3H2SO4→2MnSO4+K2SO4+5S+8H2O* 3H2S+K2Cr2O7+4H2SO4→Cr2(SO4)3+K2SO4+3S+7H2O* H2S+4Na2O2+2H2O→Na2SO4+6NaOHH2S+Fe→FeS+H2↑ H2S+CuCl2→CuS↓+2HCl H2S+2AgNO3→Ag2S↓+2HNO3 H2S+HgCl2→HgS↓+2HClH2S+Pb(NO3)2→PbS↓+2HNO3 H2S +4NO2→4NO+SO3+H2OH2CO3H2CO3→CO2↑+H2OHClOHClO→HCl + O2↑HNO33HNO3+Ag3PO4→H3PO4+3AgNO3Al+4HNO3(稀)→Al(NO3)3+NO↑+2H2O3As2S3+28HNO3+4H2O→6H3AsO4+9H2SO4+28NO↑4HNO3(浓)+C △CO2↑+4NO2↑+2H2O2HNO3+CaCO3→Ca(NO3)2+H2O+CO2↑6HNO3+Fe→Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe→Fe(NO3)3+NO↑+2H2O30HNO3+8Fe→8Fe(NO3)3+3N2O↑+15H2O36HNO3+10Fe→10Fe(NO3)3+3N2↑+18H2O30HNO3+8Fe→8Fe(NO3)3+3NH4NO3+9H2OFeO+4HNO3→Fe(NO3)3+NO2↑+2H2O3H2S+2HNO3(稀)→3S↓+2NO+4H2O4HNO3→4NO2+O2+2H2O(见光或受热分解)NH3+HNO3→NH4NO3(白烟)(用HNO3和浓H2SO4不能制备H2S、HI、HBr、(SO2) 3Na2S+8HNO3(稀)→6NaNO3+2NO+3S↓+4H2O3Na2SO3+2HNO3(稀)→3Na2SO4+2NO↑+H2O* 5HNO3(浓)+P→H3PO4+5NO2↑+H2OP4+20HNO3(浓)→4H3PO4+20NO2+4H2OS+6HNO3(浓)→H2SO4+6NO2↑+2H2O3S+4 HNO3(稀)→3SO2↑+4NO↑+2H2O* S +6HNO3(浓)→H2SO4+6NO2↑+2H2OH3PO44H3PO4+Ca3(PO4)2→3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr→NaH2PO4+HBrH3PO4(浓)+NaI→NaH2PO4+HIH2SO3H2SO3+X2+H2O→H2SO4+2HX(X表示Cl2、Br2、I2)2H2SO3+O2→2H2SO4H2SO3+H2O2→H2SO4+H2O5H2SO3+2KMnO4→2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O→H2SO4+2FeCl2+2HClH2SO3→H2O+SO22H2SO3+2H2S→3S↓+2H2OH2SO4Zn +H2SO4→ZnSO4+H2↑Fe +H2SO4→FeSO4+H2↑Mg+H2SO4→MgSO4+H2↑2Al+3H2SO4→Al2(SO4)3+3H2↑2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2O2NH3+H2SO4→(NH4)2SO42Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2OH2S+H2SO4(浓)→S↓+SO2+2H2OP2O5+3H2SO4(浓)→2H3PO4+3SO3 BaO2+H2SO4(稀)→BaSO4+H2O2) Na2O2+H2SO4(冷、稀)→Na2SO4+H2O2 MgO+H2SO4→MgSO4+H2OAl2O3+3H2SO4→Al2(SO4)3+3H2O2H2SO4(浓)+C △CO2↑ +2SO2↑+2H2O2H2SO4(浓)+S→3SO2↑+2H2OH2SO4(浓)+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe→Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu △CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr △SO2+Br2+2H2OH2SO4(浓)+2HI △SO2+I2+2H2OH2SO4(浓) +CaF2→CaSO4+2HF↑H2SO4(浓)+NaCl △NaHSO4+HCl↑H2SO4(浓) +2NaCl Na2SO4+2HClH2SO4(浓)+NaNO3△NaHSO4+HNO3↑(微热)3H2SO4(浓)+Ca3(PO4)2→3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2→2CaSO4+ C a(H2PO4)2 II2 + H2 2HII2 +Fe FeI2I2 + 2NaOH → NaI + NaIO +H2OKKK + O2△KO22K + 2H2O → 2KOH + H2↑K2O、K2O2K2O + H2O → 2KOHK2O + CO2→ K2CO32K2O2 + 2CO2→ K2CO3 +O2 2K2O2 + 2H2O → 4KOH +O22KOH +CO2→ K2CO3 +H2OKOH +CO2→ KHCO3K2CO3K2CO3 +2HCl → 2KCl + CO2↑+ H2O K2CO3 +CaCl2→ CaCO3↓+ 2KCK2CO3 +2AgNO3→ Ag2CO3↓+ 2KNO3 KHCO3KHCO3 +HCl → KCl + CO2↑+ H2O2KHCO3△K2CO3 + CO2↑+ H2OKClO32KClO3△2KCl + 3O2↑KClO3 +6HCl → KCl +3Cl2↑ + 3H2OKI2KI + Cl2→ 2KCl + I2KI + AgNO3→ AgI↓+ KNO3KAl(SO4)22KAl(SO4)2 + 6NaOH → K2SO4 +3Na2SO4 + 2Al(OH)3↓2KAl(SO4)2 + 3Ba(OH)2→ K2SO4 + 3BaSO4↓+ 2Al(OH)3↓KAl(SO4)2 + 2Ba(OH)2→ KAlO2 +2BaSO4↓2KMnO4△K2MnO4 + MnO2 + O2↑2KMnO4 +16HCl → 2KCl + 2MnCl2 +5Cl2↑ + 8H2O2KMnO4 + 5H2O2 + 6HCl → 2KCl + 2MnCl2 +5O2↑ + 8H2O KSCN3KSCN + FeCl3→ Fe(SCN)3 + 3KClKHKH + H2O → KOH + H2↑LLiLi + O2△Li2O2Li + 2H2O → 2LiOH + H2↑Li2OLi2O + CO2→ Li2CO3Li2O + H2O → 2LiOH LiOH2LiOH +CO2→ Li2CO3↓ +H2O LiOH +CO2→ LiHCO3Li2CO3 +2HCl → 2LiCl + CO2↑+ H2O LiHCO3LiHCO3 +HCl → LiCl + CO2↑+ H2O2LiHCO3△Li2CO3 + CO2↑+ H2OMMg2Mg+O2点燃2MgO Mg + 2H2O → 2Mg(OH)2↓ + H2↑Mg + Cl2点燃MgCl2 2Mg +CO2点燃2MgO+CMg + S → MgS Mg + Br2→ MgBr2Mg +2HCl → MgCl2 + H2↑ Mg + H2SO4→ MgSO4 + H2↑2Mg+TiCl4(熔融)→Ti+2MgCl2 Mg+2RbCl(熔融)→MgCl2+2RbMgOMgO + 2HCl → MgCl2 +H2OMgO + H2O → Mg(OH)2↓Mg(OH)2Mg(OH)2 + 2HCl → MgCl2 +2H2OMgCO 3 +2HCl → 2MgCl 2 + CO 2↑+ H 2O MgCO 3 +2H 2O △Mg(OH)2↓+ CO 2↑MgCO 3△CO 2↑+ MgOMg(HCO 3)2Mg(HCO 3)2 + 2HCl → MgCl 2 + 2CO 2↑+ 2H 2O 2Mg(HCO 3)2△Mg(OH)2↓ + CO 2↑+ H 2OMgSO 4MgSO 4 + Ba(OH)2 → Mg(OH)2↓ + BaSO 4↓ MgSO 4 + 2NaOH → Mg(OH)2↓ + Na 2SO 4↓MnO 2MnO 2 + 4HCl(浓)△MnCl 2 + Cl 2↑+ 2H 2ONN 2N 2+3H 2催化剂 高温高压2NH 3 N 2+O 2 2NON 2+3Mg点燃Mg 3N 2 N 2+6Na →2Na 3NNO 、NO 2、N 2O 52NO+O 2→2NO 2NO+NO2+2NaOH→2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)6NO+4NH3催化剂△5N2+6H2ONO2+2KI+H2O→NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2) 4NO2+H2S→4NO+SO3+H2ONO2 + SO2→SO3+NO3NO2+H2O→2HNO3+NON2O5+H2O→2HNO3NH32NH3+3CuO △3Cu+N2+3H2O2NH3+3Cl2→N2+6HCl8NH3+3Cl2→N2+6NH4Cl4NH3+3O2(纯氧)点燃2N2+6H2O4NH3+5O2催化剂△4NO+6H2O4NH3+6NO催化剂△5N2+6HO(用氨清除NO)NH3+HCl→NH4Cl(白烟)NH3+HNO3→NH4NO3(白烟)2NH3+H2SO4→(NH4)2SO4NH3+NaCl+H2O+CO2→NaHCO3↓+NH4Cl(侯氏制碱法) 2NH3+SO2+H2O→(NH4)2SO3NH3·H2O △NH3↑+H2ONH3 + H2O NH3·H2O NH4+ + OH-NH4HCO3、(NH4)2CO3NH4HCO3→NH3+H2O+CO2(NH4)2CO3→2NH3↑+H2O+CO2↑NH4ClNH4Cl→NH3+HCl2NH4Cl + Ca(OH)2△CaCl2 + NH3↑ + H2ONH4Cl + NaOH △NaCl + NH3↑ + H2ONH4Cl + NaOH → NaCl + NH3·H2O NH4NO3NH4 NO3 + NaOH → Na NO3 + NH3·H2ONH4 NO3 + NaOH △Na NO3 + NH3↑ + H2O5NH4NO32HNO3 + 4N2↑ + 9H2O (NH4)2SO3、(NH4)2SO4(NH4)2SO3+SO2+H2O→2NH4HSO3(NH4)2SO4+ 2NaOH →Na2SO4 + 2 NH3·H2O(NH4)2SO4+ 2NaOH △Na2SO4 + 2NH3↑ + 2H2ONa、Na2O、Na2O24Na+O2→2Na2O 2Na+O2点燃Na2O2 Cl2 +2Na点燃2NaCl2Na+S→Na2S(爆炸) 2Na+2H2O→2NaOH+H2↑ 2Na+H2△2NaH2Na+2NH3→2NaNH2+H2 4Na+TiCl4(熔融)→4NaCl+TiNa2O+H2O→2NaOH 2Na2O+O2△2Na2O2 Na2O+SO3→Na2SO4Na2O+CO2→Na2CO3 Na2O+2HCl→2NaCl+H2ONa2O2+2Na→2Na2O(此反应用于制备Na2O)2Na2O2+2H2O→4NaOH+O2↑(此反应分两步Na2O2+2H2O→2NaOH+H2O2;2H2O2→2H2O+O2↑。
化学方程式大全

一.物质与氧气的反应:1单质与氧气的反应:1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2加热2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气中空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分燃烧:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO2化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2OH2CO3加热2CuO+H2O+CO2↑15.加热氯酸钾有少量的二氧化锰:2KClO3====2KCl+3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17.碳酸不稳定而分解:H2CO3===H2O+CO2↑18.高温煅烧石灰石:CaCO3高温CaO+CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2+CuO加热Cu+H2O20.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑21.焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑22.焦炭还原四氧化三铁:2C+Fe3O4高温3Fe+2CO2↑23.一氧化碳还原氧化铜:CO+CuO加热Cu+CO224.一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO+Fe3O4高温3Fe+4CO2四.单质、氧化物、酸、碱、盐的相互关系1金属单质+酸--------盐+氢气置换反应26.锌和稀硫酸反应:Zn+H2SO4===ZnSO4+H2↑27.铁和稀硫酸反应:Fe+H2SO4===FeSO4+H2↑28.镁和稀硫酸反应:Mg+H2SO4===MgSO4+H2↑29.铝和稀硫酸反应:2Al+3H2SO4===Al2SO43+3H2↑30.锌和稀盐酸反应:Zn+2HCl===ZnCl2+H2↑31.铁和稀盐酸反应:Fe+2HCl===FeCl2+H2↑32.镁和稀盐酸反应:Mg+2HCl===MgCl2+H2↑33.铝和稀盐酸反应:2Al+6HCl===2AlCl3+3H2↑2金属单质+盐溶液-------另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu35.锌和硫酸铜溶液反应:Zn+CuSO4===ZnSO4+Cu36.铜和硝酸汞溶液反应:Cu+HgNO32===CuNO32+Hg3碱性氧化物+酸--------盐+水37.氧化铁和稀盐酸反应:Fe2O3+6HCl===2FeCl3+3H2O38.氧化铁和稀硫酸反应:Fe2O3+3H2SO4===Fe2SO43+3H2O39.氧化铜和稀盐酸反应:CuO+2HCl====CuCl2+H2O40.氧化铜和稀硫酸反应:CuO+H2SO4====CuSO4+H2O41.氧化镁和稀硫酸反应:MgO+H2SO4====MgSO4+H2O42.氧化钙和稀盐酸反应:CaO+2HCl====CaCl2+H2O4酸性氧化物+碱--------盐+水43.苛性钠暴露在空气中变质:2NaOH+CO2====Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH+SO2====Na2SO3+H2O 45.苛性钠吸收三氧化硫气体:2NaOH+SO3====Na2SO4+H2O 46.消石灰放在空气中变质:CaOH2+CO2====CaCO3↓+H2O 47.消石灰吸收二氧化硫:CaOH2+SO2====CaSO3↓+H2O5酸+碱--------盐+水48.盐酸和烧碱起反应:HCl+NaOH====NaCl+H2O49.盐酸和氢氧化钾反应:HCl+KOH====KCl+H2O50.盐酸和氢氧化铜反应:2HCl+CuOH2====CuCl2+2H2O51.盐酸和氢氧化钙反应:2HCl+CaOH2====CaCl2+2H2O52.盐酸和氢氧化铁反应:3HCl+FeOH3====FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+AlOH3====AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH====Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH====K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+CuOH2====CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2FeOH3====Fe2SO43+6H2O58.硝酸和烧碱反应:HNO3+NaOH====NaNO3+H2O6酸+盐--------另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl===CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应:MgCO3+2HCl===MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3===AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2====BaSO4↓+2HCl7碱+盐--------另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4====CuOH2↓+Na2SO4 66.氢氧化钠与氯化铁:3NaOH+FeCl3====FeOH3↓+3NaCl 67.氢氧化钠与氯化镁:2NaOH+MgCl2====MgOH2↓+2NaCl68.氢氧化钠与氯化铜:2NaOH+CuCl2====CuOH2↓+2NaCl69.氢氧化钙与碳酸钠:CaOH2+Na2CO3===CaCO3↓+2NaOH8盐+盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3====AgCl↓+NaNO3 71.硫酸钠和氯化钡:Na2SO4+BaCl2====BaSO4↓+2NaCl 五.其它反应:72.生石灰溶于水:CaO+H2O===CaOH274.氧化钠溶于水:Na2O+H2O====2NaOH76.硫酸铜晶体受热分解:CuSO4·5H2O加热CuSO4+5H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O====CuSO4·5H2O锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑21、铁和盐酸:Fe+2HCl=FeCl2+H2↑22、铁和稀硫酸:Fe+H2SO4=FeSO4+H2↑23、氢气还原氧化铜:H2+CuO=△=Cu+H2O24、木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑25、碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑26、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO427、铜和硝酸汞溶液:Cu+HgNO32=Hg+CuNO3228、氢气还原氧化铁:3H2+Fe2O3=△=2Fe+2H2O29、铝和稀硫酸:2Al+3H2SO4=Al2SO43+3H2↑30、钠和水反应:2Na+2H2O=2NaOH+H2↑四复分解反应31、大理石和稀盐酸实验室制CO2:CaCO3+2HCl=CaCl2+H2O+CO2↑32、氢氧化钠和硫酸铜:2NaOH+CuSO4=CuOH2↓+Na2SO433、碳酸钠和盐酸灭火器原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑34、碳酸钾草木灰和盐酸:K2CO3+2HCl=2KCl+H2O+CO2↑35、盐酸和氢氧化钠中和反应:HCl+NaOH=NaCl+H2O36、硫酸和氢氧化钠溶液:H2SO4+2NaOH=Na2SO4+2H2O37、硫酸与氯化钡溶液:H2SO4+BaCl2=BaSO4↓+2HCl38、盐酸与硝酸银溶液:HCl+AgNO3=AgCl↓白+HNO339、氢氧化钠和氯化铁溶液:3NaOH+FeCl3=FeOH3↓红褐色+3NaCl40、碳酸钡和稀硝酸:BaCO3+2HNO3=BaNO32+CO2↑+H2O41、硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2Na Cl42、氯化钠和硝酸银:NaCl+AgNO3=AgCl↓+NaNO343、碳酸钠和石灰水:Na2CO3+CaOH2=CaCO3↓+2NaOH44、氢氧化铝和盐酸:AlOH3+3HCl=AlCl3+3H2O45、硝酸铵和氢氧化钠:NH4NO3+NaOH=△=NaNO3+H2O+NH3↑46、氢氧化铁和硫酸:2FeOH3+3H2SO4=Fe2SO4347、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O48、氧化铜和硫酸:CuO+H2SO4=CuSO4+H2O五其他:49、二氧化碳使澄清石灰水变浑浊:CO2+CaOH2=CaCO3↓+H2O50、二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+H2O51、用氢氧化钠溶液吸收二氧化硫:SO2+2NaOH=Na2SO3+H2O52、一氧化碳还原氧化铜:CO+CuO=△=Cu+CO253、一氧化碳还原氧化铁炼铁:3CO+Fe2O3=高温=2Fe+3CO254、甲烷在空气中燃烧:CH4+2O2=点燃=CO2+2H2O55、乙醇在空气中燃烧:C2H5OH+3O2=点燃=2CO2+3H2O56、甲醇在空气中燃烧:2CH3OH+3O2=点燃=2CO2+4H2OⅡ、金属活动性顺序表:KCaNaMgAlZnFeSnPbHCuHgAgPtAu———————————————————————→金属活动性由强逐渐减弱小结:1、只有排在H前面的金属才能置换出酸里的氢2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来二、溶液的酸碱度——pH石蕊试液红紫蓝—————————————————————————————酚酞试液无无红01234567891011121314│└—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┘←————————————中性——————————————→六、金属1金属与氧气反应:40.镁在空气中燃烧:2Mg+O2点燃2MgO41.铁在氧气中燃烧:3Fe+2O2点燃Fe3O442.铜在空气中受热:2Cu+O2加热2CuO43.铝在空气中形成氧化膜:4Al+3O2=2Al2O32金属单质+酸--------盐+氢气置换反应44.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑45.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑46.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑47.铝和稀硫酸2Al+3H2SO4=Al2SO43+3H2↑48.锌和稀盐酸Zn+2HCl==ZnCl2+H2↑49.铁和稀盐酸Fe+2HCl==FeCl2+H2↑50.镁和稀盐酸Mg+2HCl==MgCl2+H2↑51.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑3金属单质+盐溶液-------新金属+新盐52.铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu53.锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu54.铜和硝酸汞溶液反应:Cu+HgNO32==CuNO32+Hg3金属铁的治炼原理:55.3CO+2Fe2O3高温4Fe+3CO2↑七、酸、碱、盐1、酸的化学性质1酸+金属--------盐+氢气见上2酸+金属氧化物--------盐+水56.氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O57.氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2SO43+3H2O58.氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O59.氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O3酸+碱--------盐+水中和反应60.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O61.盐酸和氢氧化钙反应:2HCl+CaOH2==CaCl2+2H2O62.氢氧化铝药物治疗胃酸过多:3HCl+AlOH3==AlCl3+3H2O63.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O4酸+盐--------另一种酸+另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑65.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑67.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl 2、碱的化学性质1碱+非金属氧化物--------盐+水68.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 69.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 70.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 71.消石灰放在空气中变质:CaOH2+CO2==CaCO3↓+H2O 72.消石灰吸收二氧化硫:CaOH2+SO2==CaSO3↓+H2O2碱+酸--------盐+水中和反应,方程式见上3碱+盐--------另一种碱+另一种盐73.氢氧化钙与碳酸钠:CaOH2+Na2CO3==CaCO3↓+2NaOH1盐溶液+金属单质-------另一种金属+另一种盐74.铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu2盐+酸--------另一种酸+另一种盐75.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑。
化学方程式大全汇总

化学方程式大全汇总一. 物质与氧气的反应:<1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO<2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑14.加热碱式碳酸铜:Cu2<OH)2CO3 加热 2CuO + H2O + CO2↑15.加热氯酸钾<有少量的二氧化锰):2KClO3 ==== 2KCl +3O2 ↑16.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑17.碳酸不稳定而分解:H2CO3 === H2O + CO2↑18.高温煅烧石灰石:CaCO3 高温 CaO + CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20.木炭还原氧化铜:C+ 2CuO高温 2Cu + CO2↑21.焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224.一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系<1)金属单质 +酸 -------- 盐+氢气<置换反应)26.锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27.铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28.镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29.铝和稀硫酸2Al +3H2SO4 = Al2<SO4)3 +3H2↑30.锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31.铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32.镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33.铝和稀盐酸2Al + 6HCl== 2AlCl3 + 3H2↑<2)金属单质 + 盐<溶液) ------- 另一种金属 + 另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液反应:Cu + Hg<NO3)2 === Cu<NO3)2 + Hg<3)碱性氧化物 +酸 -------- 盐 +水37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2<SO4)3 + 3H2O39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O<4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 +H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 +H2O46.消石灰放在空气中变质:Ca<OH)2 + CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca<OH)2 + SO2 ==== CaSO3 ↓+ H2O<5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu<OH)2 ==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca<OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe<OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al<OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu<OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe<OH)3====Fe2<SO4)3 + 6H2OPw4n1h9WSob5E2RGbCAP58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O<6)酸 + 盐 -------- 另一种酸 +另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl<7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu<OH)2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe<OH)3↓ +3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg<OH)2↓ +2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu<OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca<OH)2 + Na2CO3 === CaCO3↓+2NaOH<8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca<OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:Cu SO4·5H2O加热CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2SAT2化学词汇大全2018-08-26 09:33:03 紫铭教育Part 1 foundation chemistry 基础化学Chapter 1acid 酸apparatus 仪器,装置aqueous solution 水溶液arrangement of electrons 电子排列assumption 假设atom 原子<化学变化中的最小粒子)atomic mass 原子量atomic number 原子序数atomic radius 原子半径atomic structure 原子结构be composed of 由……组成bombardment 撞击boundary 界限cathode rays 阴极射线cathode-ray oscilloscope (C.R.O> 阴极电子示波器ceramic 陶器制品charge-clouds 电子云charge-to-mass ratio(e/m> 质荷比<质谱分析时样品质量的测量以质量与其离子电荷之比表示)chemical behaviour 化学行为chemical property 化学性质<物质在化学变化中表现出来的性质)clockwise 顺时针方向的compound 化合物<由不同元素组成的纯净物)configuration 构型copper 铜correspond to 相似corrosive 腐蚀d-block elements d 区元素deflect 使偏向,使转向derive from 源于deuterium 氘diffuse mixture 扩散混合物distance effect 距离效应distil 蒸馏distinguish 区别distribution 分布doubly charged(2+> ion 正二价离子dye 染料effect of electric current in solutions 电流在溶液里的影响electrical charge 电荷electrical field 电场electrically neutral atom 电中性原子electricity 电electrolysis 电解electron 电子<负电荷粒子,电量等于4.77×10-10绝对静电单位)electron shielding 电子屏蔽element 元素<具有相同核电荷数即荷内质子数的一类原子的总称)emission spectrum 发射光谱<根据发射光源和激发能量方式所产生的特征电磁波谱)energy level 能态,能级<稳态能量,有相同主量数的电子壳层)fertiliser 肥料first ionisation energy 一级电离能fluorescent screen 荧光屏fluoride 氟化物fuel 燃料fundamental substance 基础物质fuzzy 模糊的galaxy 星系,银河gas 气体gaseous state 气态gravity 重力GroupⅠ第一族Heisenberg’s uncertainty principle 海森堡测不准原理hydrofluoric acid 氢氟酸identical 同一的,相等的in terms of 根据,在……方面innermost 最内的,最深的interaction 相互作用internal structure 内部结构interpret 解释investigate 研究,调查ionisation energy 电离能<从原子或分子中移走一个电子至无穷远处所需的能量,以电子伏特eV表示)ionise 电离isotope 同位素<原子里具有相同的质子数和不同的中子数的同一元素的原子互称同位素)J.J. Thomson’s e/m experiment 汤姆森质何比实验Latin 拉丁lepton 轻粒子liquid 液体magnet 磁铁magnetic field 磁场Maltese Cross 马耳他十字marble 大理石mass number 质量数matter 物质metal foil 金箔meteorite 陨星microbe 微生物,细菌Millikan’s ‘oil-drop’ ecperiment 密立根油滴实验model-building 模型建筑mole 摩尔<表示一个系统的物质的量的单位,该系统中所包含的基本单元数与12g碳12即12C的原子数目相等,每摩尔物质含有阿佛加德罗常数个微粒)molecule 分子<保持物质的化学性质的最小粒子)narrow beam 狭窄的光线negative electrode<cathode)阴极negligible 可以忽略的neutron 中子nitrate 硝酸盐noble gas 稀有气体normal pressures 常压nuclear charge <原子)核电荷nuclear model for atoms 原子核模型nuclear reaction 核反应nucleus <pl.nuclei)核Orbital 轨道paraffin wax 石蜡particle 微粒,粒子Pauli exclusion principle 保里不相容原理<每个原子轨道至多只能容纳两个电子;而且,这两个电子自旋方向必须相反)Periodic Table 周期表physical property 物理性质<物质不需要发生化学变化就表现出来的性质,如颜色、状态、气味、熔沸点、密度等)plastics 塑料plum-pudding 李子布丁positive charge 正电荷<带有质子的物质,用丝绸摩擦玻璃棒,在棒上会产生正电荷)positive electrode (anode> 阳极positively charged particle (ion> 离子potential difference 电位prediction 预言principal quantum number 主量子数<标示轨道电子的波函数,包括轨道角动量和自旋量子数,电子的能级和距原子核的平均距离主要取决于主量子数)probe 探测,探究protium 氕proton 质子quantum <pl. quanta)量子<一个电子转移到原子的下一层轨道时发出的有限辐射能单位)quantum mechanics 量子力学Quantum Theory 量子理论quark 夸克<组成基本粒子的更小的粒子)radioactive source 放射源repel 排斥repulsion 斥力respectively 分别地rung 梯级scattering effect 散射作用Schr?dinger equation 薛定谔<波动)方程<一偏微分方程,描述基本粒子波动性)scintillation 火花shell 电子壳层shielding effect 屏蔽效应simpler substance 单质<指由同种元素组成的纯净物)solid 固体sphere 球spin 自旋stable state 稳态sub-atomic particle 原子内的粒子subset 子集,小团体successive ionisation energy 逐级电离能symbol 符号symmetry 对称the lowest-energy orbitals 最低能量轨道transition elements 过渡元素tritium 氚X-ray X 射线α-particles α粒子,即alpha-particle<带有两个质子和中子的粒子,即氦原子核,对物质的穿透力较强,流速约为光速的1/10)α-ray α射线β-particles β粒子β-ray β射线γ-patticles γ粒子γ-rayγ射线Chapter 2abbreviation 缩写absorption 吸收abundance 丰度accelerate 加速alloy 合金alter 改变atmospheric pressure 大气压Avogadro’s constant 阿佛加德罗常数<12g12C含有的原子数,约为6.02×1023)azide 叠氮化物balance chemical equation 配平化学方程式balance ionic equation 配平离子方程式benzene 苯blast furnace 高炉bromide 溴化物bulk 体积burette 滴定管butane 丁烷carbon dioxide 二氧化碳carbon monoxide 一氧化碳carbonate 碳酸盐collide with 冲突combustion analysis 燃烧分析concentration 浓度conical flask 锥形瓶convert 转化covalent bonds 共价键<原子间通过共用电子对形成的化学键)decimal place 小数位deposit 沉淀物detonator 炸药dioxide 二氧化物dissolve 溶解dropwise 逐滴地electric current 电流empirical formulae 实验式,经验式<只表示化合物中原子间最简单比例关系,非分子式,而为成分式)end-point 终点enthalpy 焓<热力学状态函数,单位质量的热含量,恒压下系统改变状态时增加的热含量等于内能与体系体积与压力乘积之和)equation 方程式ethanoic acid 乙酸filament 灯丝formula <pl. formulae)化学式<用元素符号来表示物质组成的式子)granule 颗粒Group Ⅰ- the alkali metal 第一族,碱金属Group Ⅱ-the alkaline earth metal 第二族,碱土金属Group Ⅲ- 第三族Group Ⅳ-Carbonic Group 碳族Group Ⅴ-Nitric Group 氮族Group Ⅵ-Oxygenic Group 氧族Group Ⅶ, the halogens 第七主族,卤族hexane 己烷horizontal axis 横坐标hydrocarbon 碳氢化合物,烃hydrochloric acid 盐酸hydrogen peroxide 过氧化氢hydroxide 氢氧化物hypothesis 假设indicator 指示剂inspect 检查,查看iodide 碘化物ionic compound 离子型化合物<电负性相差大的两种元素相互作用,发生电子转移,变为正、负离子,正、负离子结合形成离子型化合物)iron oxide 氧化铁low pressure 低压mass spectrometer 质谱仪methane 甲烷mixture 混合物<由两种或多种物质混合而成的,这些物质相互间没有发生反应,混合物里各物质都保持原来的性质)molar mass 摩尔质量<1摩尔物质的质量)molarity 摩尔浓度,也叫物质的量浓度<以1升即1立方分M 溶液里含有多少摩溶质来表示溶液组成的物理量)molecular formulae 分子式<根据元素分析和分子量表示的化学式)monoxide 一氧化物negative ion (=anion> 阴离子neutralise 中和nitric acid 硝酸non-metal 非金属octane 辛烷organic compound 有机化合物oxidation state 氧化态oxide 氧化物peroxide 过氧化物phosphate 磷酸盐pipette 移液管positive ion (=cation> 阳离子precipitation reaction 沉淀反应reactant 反应物reaction 反应reagent 试剂,反应物redox reaction 氧化还原反应relative atomic mass 相对原子质量<以碳12原子的质量的1/12约1.66×10-27kg作为标准,其他原子的质量跟它比较所得的值)relative formula mass 相对式量relative isotopic mass 相对同位素质量relative molecular mass 相对分子质量<化学式中各原子的相对原子质量的总和)room temperature 室温singly charged 单核stoichiometric ratio 化学计量比stoichiometry 化学计量法sulphate 硫酸盐sulphide 硫化物sulphite 亚硫酸盐sulphuric acid 硫酸temperature 温度thermite 铝热剂,灼热剂titration 滴定法<将已知浓度的标准溶液加到被测溶液中,直到反应完成,借以测定其浓度)vaporize 汽化vertical axis 纵坐标vice versa 反之亦然volume 体积weld 焊接Chapter 3adjacent molecule 相邻的分子amide 酰胺(含-CONH2基>ammonia 氨atmosphere 大气层atomic orbital 原子轨道attractive force 吸引力biochemical compound 生化化合物boiling point 沸点bond angle 键角(与同一原子连接的两个键之间的角度> bond enthalpybond length 键长(分子中两个原子核间的平衡距离> bonding pair 成键电子对brine 盐水brittle 脆的building-block(=monomer unit> 单体(聚合物中最简单的重复结构单元>catalyst 催化剂<能改变反应速度而它本身的组成和质量在反应前后保持不变的物质)chemical bonding 化学键<分子或晶体中,原子或离子之间直接的、主要的和强烈的相互作用称为化学键)chemical bonding and structure 化学键及结构chloride 氯化物cleavage 裂开condense 浓缩conduct electricity 导电covalent compound 共价化合物crystal 晶体crystal lattice 晶格crystal plane 晶体平面crystalline solid 晶状固体cyclohexane 环己胺dative covalent bond=coordinate bond 配位键decomposition 离解density 密度dipole-dipole force 取向力dot-and-cross diagram 电子式,点叉式double bond 双键double helix 双螺旋ductile 可塑性,易变形的,可延展的electric dipole 电偶极子<一对相距极近,符号相反、数值相等的电荷所形成的体系)electrical insulator 电绝缘体electrical transformer 变压器electronegativity 电负性<原子或基团吸引并持留价电子的能力)electron-pair 电子对electron-pair repulsion theory 电子对互斥理论<是利用中心原子周圍電子的排斥理論來預測的分子及離子(去除金屬部分>的形狀)electrostatic attraction 静电吸引<引力)emerald 翡翠enthalpy change of vaporization 蒸发焓ethane 乙烷ethanol 乙醇,又叫酒精evaporation 蒸发fabric 布,fibre 纤维fibrous 纤维状的formation of ions 离子的形成gaseous state 气态gemstone 宝石graphite 石墨haemoglobin 血红蛋白hard 硬的high-density poly(ethene> 高密度聚乙烯hydrated ion 水合离子<与水结合而成,如H3O+)hydrogen bond 氢键(氢键是由于与电负性极强的元素如氟、氧等相结合的氢原子和另一分子中电负性极强的原子间所产生的引力而形成>insoluble 不溶instantaneous dipole-induced dipole forces 诱导力intermediate character 两性intermolecular force 分子间作用力(又称van der Waals’force 范德华力>interval 间隙ionic bonding 离子键<由原子得失电子后,生成的正负离子之间,靠静电作用而形成的化学键)ionic crystal 离子晶体<离子间通过离子键结合而成的晶体)ionic lattice 离子晶格jewellery 珠宝kinetic theory of matter 物质运动论(所有物质的分子处于恒动状态>liquid state 液态lone-pairs 孤对电子low-density poly(ethene> 低密度聚乙烯LP-LP repulsion> LP-BP repulsion> BP-BP repulsion 孤电子对—故电子对斥力>孤电子对—成键电子对斥力>成键电子对—成键电子对斥力lubricant 润滑剂magnetise 磁化malleable 有延展性的melting point 熔点metal complex 金属络合物<由金属离子与电子给予体结合而成)metallic bonding 金属键(通过自由运动的价电子将金属原子连结起来的键>metallic element 金属元素mineral 矿物质mobile electron 流动电子molecular orbital 分子轨道molten 熔化non-contuctor 非导体non-linear molecule 非直线分子non-metallic element 非金属元素non-polar molecule 非极性分子non-stick properties 不黏性nylon 尼龙,聚酰胺纤维octahedron 八面体oppositely charged electron 电性相反的电极oppositely charged ion 电性相反的离子outer-shell electron 外层电子oxonium ion(=hydronium ion> 水合氢离子polar molecule 极性分子polarisation of ions 离子极化<在阴阳离子自身电场作用下,产生诱导偶极,而导致离子的极化,即离子的正负电荷重心不再重合,电子云发生变形,致使物质在结构和性质上发生相应的变化)polarized 极化poly 聚乙烯poly(ester> chain 聚酯链polychlorinated biphenyls (PCBs> 多氯联<二)苯polymer 聚合物,高分子polymer chain 聚合物链protein 蛋白质quartz 石英relative bond strength 相对键能repulsion 斥力ruby 红宝石sapphire 蓝宝石semi-precious stone 亚宝石single bond 单键slippery 光滑sodium chloride 氯化钠solid state 固态solubility 溶解度<物质在溶剂中达到饱和时的溶解程度)soluble 可溶sparingly soluble 难溶sublimation 升华(固体不经液态直接转变为气态>sublime 升华(固体不经液态直接转变为气态>sucrose 蔗糖surface tension 表面张力(由于表面层下面的分子与表面层下面的分子间的分子吸引,液体表面收缩成最小表面的趋向> symmetrical distribution 对称分布tensile strength 抗拉强度tetrahedral molecule 四面体分子tetrahedron 四面体the δ+ and δ-charges δ+ 和δ-电荷three-dimensional arrangement 三维排列triangular pyramidal molecule 三角锥形分子trichloromethane 三氯甲烷trigonal planar molecule 三角锥形分子triple bond 三键unit cell 晶胞vapour pressure (蒸汽压>viscosity 黏度(流体流动阻力的表示,为液体中黏合力和内聚力的综合效果>volatility 挥发性washing-up liquidwater is peculiar 水是特殊的weapon 武器δbond δ键δorbital δ轨道π bond π键π orbital π轨道Chapter 4 and 5antacid tablet 解酸的药片atomic radii(=atomic radius> 原子半径barium meal 钡餐Blocks of elements in the Periodic Table 周期表中元素的分区brick red 砖红色bricklaying 砌砖,泥水业brilliant whitish flame 明亮的白色火焰bubble 泡camera lenses 照相机镜头cement 水泥chalk 白垩chemical species 化学物种clay 黏土,泥土cliff 悬崖cloudy white precipitate 浑浊的白色沉淀covalent radius 共价半径covered with a layer of its oxide 覆盖一层氧化物薄膜crucible 坩埚crumble 粉碎d-block d区diatomic molecule 双原子分子dilute 稀释disulphur dichloride 二氯化二硫dolomite 白云石electronegative 带负电的,负电性的electropositive 带正电的,正电性的evolution <气体)散出exothermic reaction 放热反应f-block f区filtration 过滤firework 焰火flare 照明弹good conductivity of heat and electricity 良好的导电导热性gypsum 石膏hydrogencarbonate 碳酸氢盐incendiary bomb 燃烧弹indigestion remedy 消化不良的治疗lanthanide and actinide elements 镧系和锕系元素<周期表中,ⅧB族有32种元素,包括钪、钇、镧和锕,其中镧这一格代表15种镧系元素[Z=51~71],锕这一格代表15种锕系元素 [Z=89~103])Law of Octaves 八行周期律<当元素按原子量增加的顺序排列成以八个为一组时,则上下每组对应元素有相似的性质)Law of Triadslime 石灰lime water 石灰<水溶液)limelight 灰光灯limestone 石灰石liquid phase 液相magnesium ribbon 镁条marine invertebrate 海里的无脊椎动物Mendeleev’s periodic table 门捷列夫周期表<按原子序数递增顺序排列成行,并将元素性质相同者置于各行之下,由此形成18列,各列元素的化合价按正规顺序变化)metal hydride 金属氢化物metallic radius 金属半径molten slag 熔渣monatomic ion 一价离子mortar 灰浆negative oxidation state 负化合价opaque 不透,不传导oxidation 氧化oxidation number (abbreviated ox. no.> 氧化数<某元素一个原子的荷电数,这种荷电数由假设把每个键中的电子指定给电负性更大的原子而求得)oxidation state 氧化态oxidising agent 氧化剂<得到电子的物质)p-block p区periodic patterns 周期律periodicity 周期性photographic flash bulb 感光photosynthesis 光合作用pitchblende 沥青铀矿plaster 石膏plaster of Pairs 熟石膏positive oxidation state 正化合价quicklime 生石灰reactivity 活动性reciprocal 倒数redox system 氧化还原体系reducing agent 还原剂<逝去电子的物质)reduction 还原refractory material 难熔物质rotary kiln 回转窑<炉)saturated solution 饱和溶液s-block s区scum 浮垢sedimentary rock 沉积岩siemens per metre (S m-1> 西门子/M<西门子是电导实用单位,亦称姆欧,欧姆的倒数)single atom 单原子slaked lime 石灰<固)solid phase 固相suspension 悬浮液the outmost electrons 最外层电子the rising parts of the curve 曲线的上升部分the trend is uneven 趋势是不规则的thermal decomposition 热<分)解toxic 有毒的tracer bullet 示踪子弹trough 曲线上的最小值valency 化合价vapour phase 气相vigorous 剧烈的Chapter 6a cream precipitate M黄色沉淀aerosol propellant 气溶胶喷射剂ammonia solution 氨水anomalous properties 异常的性质antiseptic抗菌剂,防腐剂apparent 透明的bacteria 细菌bleach 漂白bromine is a dark red liquid giving off a dense red vapour 溴是深红色液体,会挥发浓的红色溴蒸气capture an electron 捕获一个电子CFCS(chlorofluorocarbons> 含氯氟烃chlorine is greenish yellow gas 氯是黄绿色气体contamination 污染covalent diatomic molecule 共价双原子分子cyclohexane 环己烷dichloromethane 二氯甲烷displacement reaction 置换反应<由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应:1.非金属取代—电负性强者取代弱者;2.金属取代—金属性强者取代弱者)disproportionation reaction 歧化反应<又叫自身氧化还原反应,在歧化反应中同一种元素的一部分原子[或离子]被氧化,另一部分原子[或离子]被还原)electron affinity 电子亲合势<原子保持其离子电荷的亲合势)fire extinguisher 灭火器flammable 易燃的fluoride controversyfluorine is pale yellow gas 氟是淡黄绿色气体foaming agent 起泡剂germicide 杀菌剂halate 次卤酸根离子halide 卤化物halogen 卤族元素,简称卤素hydrated halide ion 水合卤素离子inert 惰性的iodine in alcohol 碘酒iodine is a shiny, grey-black crystalline solid which sublimes to a purple vapour 碘是有光泽的灰黑色晶体,会升华变成紫色碘蒸气liver damage 肝脏损伤Lubricant 滑润剂non-flammable 不易燃的organic solvent 有机溶剂organo-chlorine 有机氯ozone layer 臭氧层poisonous 有毒的PTFE (polytetrafluoroethene> 聚四氟乙烯PVC 聚氯乙烯refrigerant 制冷剂solvent 溶剂thyroid problem 甲状腺问题volatility 挥发性water purification 水质净化waterproof clothing 防水布Part 2 Chains and Rings 链和环Chapter 71,2-dichloroethene 1,2-二氯乙烯2,2,3-trimethylbutane 2,2,3-三甲基丁烷2,2,4-trimethypentane (iso-octane> 2,2,4-三甲基戊烷2-bromobutane 2-溴丁烷2-hydroxybenzoic acid 2-对羟基苯甲酸2-methylpentan-3-one 2-甲基3-戊酮3-ethylpent-2-ene 3-乙基烯acid-base reaction 酸碱反应activation energy 活化能<分子开始反应所需最低能量,为活化分子能量与所有分子平均能量差)addition 加成alanine 丙氨酸alcohol 醇aldehyde 醛aliphatic alcohol 脂肪醇aliphatic aldehyde 脂肪醛aliphatic compounds 脂肪族化合物alkene 烯烃alkyl 烷基allotrope 同素异形体amine 胺amino acid 氨基酸ammonium cyanate 氰化铵anhydrous salt 无水盐anti-bumping stone 沸石aqueous layer 水层arene 芳烃aromatic compounds 芳香族化合物<分子里含有一个或多个苯环的化合物)aspirin 阿司匹林atoms can rotate freely about a carbon-carbon single bond 原子可绕碳-碳单键自由旋转ball-and-stick model 球棍模型benzene ring 苯环branched-chain 支链buchner flask 布氏烧瓶,抽滤瓶buchner funnel 布氏漏斗<常用于真空抽滤疏松沉淀)buckminsterfullerenebut-2-ene 2-丙稀butan1-ol (=CH3CH2CH2CH2OH> 1-丁醇butanoic acid 丁酸cage 壳体,支架calculation of percentage yields 回收率的计算capillary electrophoresis apparatus 毛细管电泳仪carbanion 负<阴)碳离子carbocation 正<阳)碳离子carboxylic acid 羧酸Compact 致密的condenser 冷凝器convection currents 对流气流<由温差推动)criteria for checking purity 检测纯度的标准cyclic hydrocarbon 环烃<碳原子间相互连接成环状)cyclobutane 环丁烷decane 癸烷displayed formula (=full structural formula> distillation 蒸馏法eicosane 二十烷electric heating mantle 电热炉electrophile 亲电子试剂electrophilic addition 亲电子加成electrophilic substitution 亲电子取代elimination 消去equilibrium 平衡ester 酯ethanoic anhydride 酐ethanol (=CH3CH2OH> 乙醇ethyl- 乙基ethylamine 乙胺Ethylbenzene 乙基苯free redical 自由基free-radical substitution 自由基取代functional group 官能团gas-liquid chromatography 气液色谱法general formulageodesic domes 地圆学说geometric (or cis-trans> isomer 几何异构体<顺式-反式)grooved cork 具孔塞ground glass cone-and-socket joint 磨口玻璃锥管接合处ground glass socket 磨口玻璃管halogenoalkane 卤代烃heptane 庚烷heterolytic fission 异裂<共价键断裂产生两个相反电荷的离子)high-performance liquid chromatography 高效液相色谱法homologous series 同系物homolytic fission 均裂<共价键断裂产生两个自由基)hydrolysis 水解hydroxy-<=-OH)羟基hyphen 连字符immiscible liquid 不溶混液体impurity 杂质intermolecular hydrogen bond 分子间氢键Isomerism 同分异构现象ketone 酮kinetic energy 动能Kjeldahl 克耶达liquid circulates 液体循环melting point tube containing sample 装有样品的熔点测定管methanol (=CH3OH> 甲醇methoxymethane 甲氧基甲烷methyl<-CH3)甲基Methylpropane 甲基丙烷molecular formulanomenclature 系统命名法nonane 壬烷nucleophile 亲核试剂nucleophilic addition 亲核加成nucleophilic substitution 亲核取代organic chemistry 有机化学paper chromatography 纸层析法paraffin oil 石蜡油pentan-3-one 3-戊酮pentane 戊烷phenyl ring(-C6H5> 苯基phenylalanine 苯基丙氨酸phosphoric acid 磷酸preliminary calculation 预算propan-1-ol (=CH3CH2CH2OH> 1-丙醇propan-2-ol 2-丙醇propanal 丙醛propane 丙烷propylamine 丙胺pumice 浮石reaction mechanism 反应机制reaction pathway 反应途径recrystallisation 重结晶redistilling 重蒸馏Reflux 回流rubber ring 橡胶圈rubber seal 橡胶塞separating funnel 分液漏斗side-chain 侧链skeletal formula 骨架skeletonspectroscopic technique 光谱技术stereoisomerism 立体异构体stoppered flask 已塞紧的烧瓶stright-chain 直链structural formulastructural isomer 同分异构体<化合物具有相同的分子式,但具有不同结构)substitution 取代synthesis 合成the maximum mass of product 最大产量the neck of the reaction flask 烧瓶瓶颈thermometer 温度计thermostatically controlled heating mantle 恒温控制加热炉Thiele tube 蒂埃尔均热管thin-layer chromatography 薄层层析法three-dimensional formulaultraviolet (UV> 紫外线vacuum filtration 真空抽滤,真空过滤vinegar 醋visible spectroscopy 可见光voltage 电压water bath 水浴wavelength 波长Chapter 82,2,4-trimethyolpentane 2,2,4-三甲基戊烷2-methylpentane 戊烷adhesive 粘合剂alkane 烃alternatives to fossil fuels 化石燃料的代替品anaerobic decay 厌氧分解bimetallic catalyst 双金属催化剂biofuels 生物燃料bitumen 沥青burn off 燃尽carbon coke 焦炭carcinogenic aldehyde methanal 致癌的醛甲烷化catalytic cracking 催化裂化<由重质组分催化裂解为轻质组分)cellulose 纤维素chemical cell 化学电池CO2 emissions CO2 的排放coal 煤condensation 冷凝corrode 腐蚀cracking 裂化crude oil 原油cycloalkane 环烃cylinder 汽缸,圆筒diesel 柴油drastic action 剧烈反应efficient combustion 有效燃烧feedstock 给料ferment 发酵fission 裂变flow rate 流速Fluid 流体fluidised bed 流化床fossil 化石fraction 分馏物fractional distillation 分馏fractional distillation column 分馏塔fusion <核)聚变gasoline 汽油generate electricity 发电geothermal: hot rocks 地热:热岩greenhouse effect 温室效应hydrocarbons: fuels 碳氢化合物:燃料hydroelectricity 水电,水力发电inhalation 吸入isomerisation 异构化kerosene 煤油lead-acid battery 铅酸蓄电池lubricating oil 润滑油megawatt 兆瓦,即106瓦naphtha 粗汽油natural gas 天然气non-renewable resource 不可再生资源nuclear fuels 核燃料oil refinery 炼油厂oscillating motion 振动overflow pipe 溢流管oxidation product 氧化产物oxidiser 氧化剂petrol 汽油photovoltaic cell 阻挡层光电池plant 植物rapeseed 油菜籽raw material 原料recycle 重复利用reforming 重整regeneration chamber 燃烧室residue 废料,残渣seething mixture 沸腾的混合物separate into layers 分层sieve 滤网solar panels 太阳能<电池)板spherical tank 球形罐spillage 溢出steady state 稳态sunflower oil 葵花油sunlight: solar heating and photovoltaics 阳光:太阳热和太阳电池tarmac 停机坪thermal energy 热能transfer of energy to the surroundings 把能量转移到四周tray <分馏塔的)板turbine 涡轮waste products 废品weir 坝,堰zeolite 沸石Chapter 92,2-dimethylpropane 2,2-二甲基丙烷CH3· (methyl> free radical甲基自由基chain reaction 链锁反应combustion in air 在空气中燃烧complete combustion in an excess of air 在过量空气中完全燃烧concentrated sulphuric acid 浓硫酸dodecane 十二烷hydrocarbons: alknes 碳氢化合物:烃in poorly ventilated rooms 在通风不足的房间initiation step 初级过程mechanism 机理overlap 重叠photochemical reaction 光化学反应<原子、分子、自由基或离子由吸收一个具有一定频率的光子而成为激发态所引起的反应)photodissociation 光解作用<分子通过吸收一个光子的电磁能分裂出一个或多个原子)propagation step 增殖过程saturated hydrocarbon 饱和烃termination step 终止过程tetrachloromethane 四氯甲烷undecane 十一烷unsaturated hydrocarbon 不饱和烃waxy solid 蜡状固体Chapter 102-methylbuta-1,3-diene 2-甲基-1,3-二丙稀addition polymerisation 加聚反应<由大量小分子<单体)相继加成为大分子量化合物或聚合物)antifreeze 防冻剂bark 树皮cis-trans isomerism 顺-反式同分异构现象decolourise 褪色dibromo- 二溴diene 二烯electron-richelectrophilic addition 亲电加成ethane-1,2-diol 乙烷-乙二醇gas scrubber 气体洗涤器gutta-percha 杜仲胶,古塔胶hard margarine 硬植物油horny 角状的,粗硬的hydrocarbons: alkenes 碳氢化合物:烯烃industrial methylated spirits 工业甲基化酒精inelastic 无弹力的isoprene 异戊<间)二烯latex 橡浆,树乳monomer 单体<见chapter 3 building-block)multiple bond 重键<不饱和化合物中双键和三键的总称)natural rubber 天然橡胶nickel catalyst 镍催化剂non-biodegradable 不可生物降解optic nerve 视觉神经percha treepollutant 污染物poly(chloroethene> 聚氯乙烯poly(phenylethene> 聚苯乙烯polymerisation 聚合反应polyunsaturated 多个不饱和的propene is bubbled through a solution of bromine 把丙稀通入溴水中repeat unit 重复单元retinal 视网膜steam 蒸汽styrene 苯乙烯systematic name 系统命名traditionally vinyl chloride 氯乙烯triethyl- 三乙基Ziegler-Natta catalyst 齐格勒-纳塔催化剂<由两种金属化合物反应而成,用于烯烃、双烯烃等聚合,生成聚乙烯、聚丙烯)planar molecule 平面分子Chapter 11acidified aqueous potassium dichromate 酸化二氯溶液acyl chloride (acylation> 酰基氯,氯化某酰<酰化作用)adulteration 搀杂alkoxide ion<=RO-)烷氧离子anaerobic process 厌氧过程ceramic wool soaked in ethanol 陶瓷羊毛colvescorresponding alcohol 相应的醇dehydration 脱水deterrent 灭菌剂enzyme 酶ethanoate 醋酸盐ethoxide ion 乙氧基离子fermentation 发酵foul taste 恶臭fruity odour 水果香味gentle heating 微热glucose 葡萄糖infrared spectrum 红外光谱<分子只能吸收与其振动、转动频率相一致的红外线而形成特征光谱)litmus paper 石蕊试纸<检查酸碱性用)metabolism 新陈代谢miscibility with water 与水的互溶性phenolphthanlein incicator 酚酞指示剂pore 孔porous ceramic surface 多孔的陶瓷表面primary alcohol 伯醇reverse reaction 逆发应secondary alcohol 仲醇simplified equation 简化方程式tertiary alcohol 叔醇wavenumber 波数yeast 酵母菌Chapter 12aerosol propellant 气溶胶火箭燃料anti-inflammatory medicine 消炎药aqueous ethanolic silver nitrate 乙醇硝酸银溶液blowing agent 发泡剂bromochlorodifluoromethane (BCF> 溴氯二氟甲烷<灭火剂)circuit board 电路板combustible materiall 可燃物degreasing agent 除油剂electrical insulation 电绝缘材料halogenoalkanes 卤代烃ibuprofen 布洛芬,异丁苯丙酸<解热镇痛药)ozone ‘hole’臭氧层空洞primary halogenoalkane 伯卤代烃rheumatoid arthritis 类风湿关节炎second halogenoalkane 仲卤代烃silver halide precipitate 卤化银沉淀stratosphere 平流层tertiary halogenoalkane 叔卤代烃the classification of halogenoalkanes 卤代烃的分类Part 3Chapter 13beaker 烧杯bond breaking 断键bond making 成键Chapter 13 enthalpy change 焓变。
完整版)化学方程式大全

完整版)化学方程式大全物质与氧气的反应:以下是一些常见的单质和化合物与氧气的反应:1.镁在空气中燃烧:2Mg + O2 → 2MgO2.铁在氧气中燃烧:3Fe + 2O2 → Fe3O43.铜在空气中受热:2Cu + O2 (加热) → 2CuO4.铝在空气中燃烧:4Al + 3O2 → 2Al2O35.氢气在空气中燃烧:2H2 + O2 → 2H2O6.红磷在空气中燃烧:4P + 5O2 → 2P2O57.硫粉在空气中燃烧:S + O2 → SO28.碳在氧气中充分燃烧:C + O2 → CO29.碳在氧气中不充分燃烧:2C + O2 → 2CO几个分解反应:以下是一些常见的物质的分解反应:13.水在直流电的作用下分解:2H2O (通电) → 2H2↑+ O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3 (加热) → 2CuO +H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3 → 2KCl + 3O2↑16.加热高锰酸钾:2KMnO4 (加热) → K2MnO4 + MnO2 + O2↑17.碳酸不稳定而分解:H2CO3 → H2O + CO2↑18.高温煅烧石灰石:CaCO3 (高温) → CaO + CO2↑几个氧化还原反应:以下是一些常见的氧化还原反应:19.氢气还原氧化铜:H2 + CuO (加热) → Cu + H2O20.木炭还原氧化铜:C + 2CuO (高温) → 2Cu + CO2↑21.焦炭还原氧化铁:3C + 2Fe2O3 (高温) → 4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C + Fe3O4 (高温) → 3Fe +2CO2↑23.一氧化碳还原氧化铜:CO + CuO (加热) → Cu + CO224.一氧化碳还原氧化铁:3CO + Fe2O3 (高温) → 2Fe +3CO225.一氧化碳还原四氧化三铁:4CO + Fe3O4 (高温) → 3Fe + 4CO2单质、氧化物、酸、碱、盐的相互关系:以下是一些单质、氧化物、酸、碱、盐之间的反应:26.锌和稀硫酸反应:Zn + H2SO4 → ZnSO4 + H2↑27.铁和稀硫酸反应:Fe + H2SO4 → FeSO4 + H2↑在这些反应中,金属单质和酸反应会产生盐和氢气的置换反应。
初三常用化学方程式 100个

初三常用化学方程式1.氢气与氧气发生化合反应:2H2 + O2 → 2H2O2.镁与氧气发生化合反应:2Mg + O2 → 2MgO3.铁与氧气发生化合反应:3Fe + 2O2 → Fe3O44.碳与氧气发生化合反应:C + O2 → CO25.一氧化碳与氧气发生化合反应:2CO + O2 → 2CO26.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O7.乙醇在空气中燃烧:C2H5OH + 3O2 → 2CO2 + 3H2O8.氢氧化钠与稀硫酸发生中和反应:NaOH + H2SO4 → Na2SO4 +H2O9.氢氧化钙与稀盐酸发生中和反应:Ca(OH)2 + 2HCl → CaCl2 +2H2O10.二氧化碳与氢氧化钠反应:CO2 + 2NaOH → Na2CO3 + H2O11.氢氧化钠与二氧化碳反应:2NaOH + CO2 → Na2CO3 + H2O12.氢氧化钙与碳酸钠反应:Ca(OH)2 + Na2CO3 → CaCO3↓ +2NaOH13.碳酸钙高温分解:CaCO3 → CaO + CO2↑14.氧化钙与水反应:CaO + H2O → Ca(OH)215.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO416.氯化铁与氢氧化钠反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl17.氯化钡与硫酸钠反应:BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl18.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO319.硫酸与氯化钡反应:H2SO4 + BaCl2 → BaSO4↓ + 2HCl20.硫酸与氢氧化钠反应:H2SO4 + 2NaOH → Na2SO4 + 2H2O21.氧化铁与盐酸反应:Fe2O3 + 6HCl → 2FeCl3 + 3H2O22.氧化铜与硫酸反应:CuO + H2SO4 → CuSO4 + H2O23.氢氧化钠与稀硫酸反应:2NaOH + H2SO4 → Na2SO4 + 2H2O24.氢氧化钙与稀盐酸反应:Ca(OH)2 + 2HCl → CaCl2 + 2H2O25.氢氧化钠与二氧化碳反应:2NaOH + CO2 → Na2CO3 + H2O26.氢氧化钙与碳酸钠反应:Ca(OH)2 + Na2CO3 → CaCO3↓ +2NaOH27.氢氧化钠与氯化铁反应:3NaOH + FeCl3 → Fe(OH)3↓ + 3NaCl28.硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3 → Fe2(SO4)3 + 6H2O29.硝酸银与稀盐酸反应:AgNO3 + HCl → AgCl↓ + HNO330.硝酸银与稀氯化钠反应:AgNO3 + NaCl → AgCl↓ + NaNO331.锌与稀硫酸反应:Zn + H2SO4 → ZnSO4 + H2↑32.镁与稀盐酸反应:Mg + 2HCl → MgCl2 + H2↑33.铝与稀硫酸反应:2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑34.铁与稀盐酸反应:Fe + 2HCl → FeCl2 + H2↑35.铜与硝酸银反应:Cu + 2AgNO3 → Cu(NO3)2 + 2Ag36.铁与硫酸铜反应:Fe + CuSO4 → FeSO4 + Cu37.氧化钙与水反应:CaO + H2O → Ca(OH)238.二氧化碳与氢氧化钠反应:CO2 + 2NaOH → Na2CO3 + H2O39.二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 → CaCO3↓ + H2O40.二氧化碳与水反应:CO2 + H2O → H2CO341.氢气还原氧化铜:H2 + CuO → Cu + H2O42.碳还原氧化铜:C + 2CuO → 2Cu + CO2↑43.一氧化碳还原氧化铜:CO + CuO → Cu + CO244.碳还原氧化铁:3C + 2Fe2O3 → 4Fe + 3CO2↑45.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO246.碳酸钙与稀盐酸反应:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑47.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑48.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl → NaCl + H2O + CO2↑49.硫酸与碳酸钠反应:H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2↑50.硫酸与碳酸氢钠反应:H2SO4 + NaHCO3 → Na2SO4 + H2O + CO2↑51.氨气与氯化氢反应:NH3 + HCl → NH4Cl52.氢氧化钠与稀硫酸反应:2NaOH + H2SO4 → Na2SO4 + 2H2O53.氢氧化钠与氯化铵反应:NaOH + NH4Cl → NaCl + NH3↑ + H2O54.碳酸氢钠受热分解:2NaHCO3 → Na2CO3 + CO2↑ + H2O55.碳酸氢铵受热分解:NH4HCO3 → NH3↑ + CO2↑ + H2O56.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO357.硫酸与碳酸钠反应:H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2O58.硫酸与碳酸氢钠反应:H2SO4 + NaHCO3 → Na2SO4 + CO2↑ +H2O59.硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3 → Fe2(SO4)3 + 6H2O60.硝酸与氢氧化铁反应:3HNO3 + Fe(OH)3 → Fe(NO3)3 + 3H2O61.氧化铁与氢气反应:Fe2O3 + 3H2 → 2Fe + 3H2O62.氧化铁与一氧化碳反应:Fe2O3 + 3CO → 2Fe + 3CO263.氧化铜与氢气反应:CuO + H2 → Cu + H2O64.氧化铜与一氧化碳反应:CuO + CO → Cu + CO265.氧化钙与水反应:CaO + H2O → Ca(OH)266.二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 → CaCO3↓ + H2O67.二氧化硫与水反应:SO2 + H2O → H2SO368.二氧化硫与氢氧化钠反应:SO2 + 2NaOH → Na2SO3 + H2O69.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO270.一氧化碳还原四氧化三铁:4CO + Fe3O4 → 3Fe + 4CO271.一氧化碳还原氧化铜:CO + CuO → Cu + CO272.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O73.水在直流电的作用下电解:2H2O → 2H2↑ + O2↑74.石灰石与稀盐酸反应:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑75.小苏打受热分解:2NaHCO3 → Na2CO3 + CO2↑ + H2O76.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑77.双氧水在二氧化锰催化下分解:H2O2 → H2O + O2↑78.氯酸钾在二氧化锰催化下分解:KClO3 → KCl + O2↑79.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO480.氯化铁与氢氧化钠反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl81.硝酸铵受热分解:NH4NO3 → N2O↑ + 2H2O82.硝酸钾受热分解:KNO3 → KNO2↑ + O2↑83.碳酸氢铵受热分解:NH4HCO3 → NH3↑ + CO2↑ + H2O84.氢氧化钠与稀硫酸反应:NaOH + H2SO4 → Na2SO4 + 2H2O85.硫酸与氢氧化铜反应:H2SO4 + Cu(OH)2 → CuSO4 + 2H2O86.硫酸与氢氧化铁反应:Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 3H2O87.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO388.盐酸与碳酸钠反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑89.氯化钡与稀硫酸反应:BaCl2 + H2SO4 → BaSO4↓ + 2HCl90.硝酸与氢氧化钠反应:HNO3 + NaOH → NaNO3 + H2O91.氯化铵受热分解:NH4Cl → NH3↑ + HCl↑92.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl → NaCl + H2O + CO2↑93.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO494.硝酸银与氯化钠反应:AgNO3 + NaCl → AgCl↓ + NaNO395.一氧化碳还原氧化亚铁:FeO + CO → Fe + CO296.一氧化碳还原氧化银:Ag2O + CO → 2Ag + CO297.二氧化碳与氢氧化钡反应:CO2 + Ba(OH)2 → BaCO3↓ + H2O98.二氧化硫与氢氧化钾反应:SO2 + 2KOH → K2SO3 + H2O99.一氧化氮与氧气反应:NO + O2 → NO2100.二氧化氮与水反应:NO2 + H2O → HNO3。
高中化学方程式大全(最最完整版)

优质解答1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3•H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2¬:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2F e2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液: Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应: 2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸: Zn+2H+=Z n2++H2↑63、锌与醋酸: Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、氯化铁溶液加入碘化钾溶液: 2Fe3++2I-=2Fe2++I266、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸: Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸: Fe2O3+6H+=2Fe3++3H2O70、氧化铁溶于氢碘酸溶液: Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H2O Fe(OH)3+3H+72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、向溴化亚铁溶液通入少量氯气: 2Fe2++Cl2=2Fe3++2Cl-74、向碘化亚铁溶液通入足量氯气: 2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、向碘化亚铁溶液通入少量氯气: 2I-+Cl2=I2+2Cl-76、碘化钾溶液中加入氯水: 2I-+Cl2=I2+2Cl-77、碘化钾溶液中加入过量氯水: I-+3Cl2+3H2O=6H++IO3-+6Cl-78、溴化钠溶液中加入氯水: 2Br-+Cl2=Br2+2Cl-79、亚硫酸溶液中加入氯水: H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、亚硫酸溶液中加入氯化铁: H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、亚硫酸溶液中加入双氧水: H2SO3++H2O2=2H++H2O+SO42-82、氯气通入水中: Cl2+H2O=H++Cl-+HClO83、氯气通入碳酸氢钠溶液中: Cl2+HCO3=Cl-+CO2+HClO84、亚硫酸钠溶液中加入溴水: SO32-+H2O+Br2=SO42-+Br-+2H+85、亚硫酸钠溶液中加入双氧水: SO32-+H2O2=SO42-+2H2O86、二氧化硫通入溴水中: SO2+Br2+2H2O=4H++2Br-+SO42-87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、单质铜与稀硝酸反应: 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、单质铜与浓硝酸反应: Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、铜片插入硝酸银溶液: 2Ag++Cu=2Ag+Cu2+92、用氨水吸收少量SO2: SO2+2NH3+H2O=2NH4++SO32-93、用氨水吸收过量的SO¬2 : SO2+NH3+H2O=NH4++HSO3-94、稀硝酸中通入SO2: 3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、浓硝酸中通入SO2: SO2+2NO3-=SO42-+2NO2↑96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- NH3↑+H2O97、向次氯酸钙溶液中通入SO2: Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、用碳酸钠溶液吸收过量SO2: CO32-+H2O+2SO2=CO2↑+2HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、电解饱和食盐水: 2Cl-+2H2O 2OH-+H2↑+Cl2↑102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+103、电解氯化铜溶液: Cu2++2Cl- Cu↓+Cl2↑104、电解熔融氯化钠: 2Na++2Cl-(熔融) 2Na+Cl2↑105、电解熔融氧化铝: 4Al3+ +6O2- 4Al+3O2↑106、二氧化锰与浓盐酸共热: MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3-110、次氯酸钠溶液中加入浓盐酸: ClO-+Cl-+2H+=Cl2↑+H2O111、氯酸钾与浓盐酸: ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O113、NO2溶于水: 3NO2+H2O=2H++NO3-+NO↑114、NO2通入亚硫酸钠溶液: SO32-+NO2=SO42-+NO↑115、硫化钠的第一步水 S2-+H2O HSO3-+OH-116、碳酸钠的第一步水 CO32-+H2O HCO3-+OH-117、氯化钡溶液与硫酸反应: Ba2++SO42-=BaSO4↓118、硫溶于热的氢氧化钠溶液: 3S+6OH-=2S2-+SO32-+3H2O119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH 120、醋酸与氢氧化钾溶液反应: CH3COOH+OH-=CH3COO-+H2O121、醋酸与氨水反应:CH3COOH+NH3•H2O=CH3COO-+NH4++2H2O122、苯酚溶于氢氧化钠溶液: C6H5OH+OH-=C6H5O-+H2O123、苯酚与氯化铁溶液反应: 6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+ 124、苯酚钠溶于醋酸溶液: C6H5O-+CH3COOH=C6H5OH+CH3COO-125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-127、碳酸钙跟甲酸反应:CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO-128、甲酸钠跟盐酸反应: HCOO-+H+=HCOOH129、小苏打溶液与甲酸溶液反应:HCOOH+HCO3-=CO2↑+H2O+HCOO-130、Na2C2O4溶液中加入酸性高锰酸钾溶液:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O131、酸性高锰酸钾溶液与双氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O 132、酸性氯化亚铁溶液与双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O133、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ 134、乙烯通入酸性高锰酸钾溶液生成CO2:5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O135、乙酸乙酯与氢氧化钠溶液:CH3COOCH2CH3+OH-=CH3COO-+HOCH2CH3 136、硬脂酸甘油酯与氢氧化钠溶液:(C17H35COO)3(C3H5O3)+3OH-=3C17H35COO-+CH2(OH)CH(OH)CH2OH 137、氯乙烷在氢氧化钠溶液中水CH3CH2Cl+OH-=CH3CH2OH+Cl-138、硝酸银溶液中滴入少量氨水:Ag++NH3•H2O=AgOH↓+NH4+139、硝酸银溶液中滴加氨水至过量:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O 140、葡萄糖发生银镜反应:CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]++2OH-=CH2(OH)(CHOH)4COO-+NH4++3NH3+H2O+2Ag↓141、硫酸铜溶液中加入氢氧化钠溶液:Cu2++2OH-=Cu(OH)2↓142、硫酸铜溶液中加入少量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+143、硫酸铜溶液中加入过量氨水:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O 144、硫酸锌溶液中加入少量氨水:Zn2++2NH3•H2O=Zn(OH)2↓+2NH4+145、硫酸锌溶液中加入过量氨水:Zn2++4NH3•H2O=[Zn(NH3)4]2++4H2O第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓)82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+ 86、NaCl 2BaSO SO Na BaCl 4422+↓→+ 87、NaCl 2BaCO CO Na BaCl 3322+↓→+ 88、↑++→+2223CO O H BaCl HCl 2BaCO 89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na 91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃 101、S Na S Na 22−−→−+研磨 102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2 106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+ 108、O H NaCl 2HCl 2O Na 22+→+ 109、↑++→+2222O O H 2NaCl 4HCl 4O Na 110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+ 117、NaCl 2CaCO CaCl CO Na 3232+↓→+ 118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)( 119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃 122、22KO O K −−→−+点燃 123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素)124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
(完整版)化学方程式大全

一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg + O2 点燃2MgO2.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43.铜在空气中受热:2Cu + O2 加热2CuO4.铝在空气中燃烧:4Al + 3O2 点燃2Al2O35.氢气中空气中燃烧:2H2 + O2 点燃2H2O6.红磷在空气中燃烧:4P + 5O2 点燃2P2O57.硫粉在空气中燃烧:S + O2 点燃SO28.碳在氧气中充分燃烧:C + O2 点燃CO29.碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14.加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17.碳酸不稳定而分解:H2CO3 === H2O + CO2↑18.高温煅烧石灰石:CaCO3高温CaO + CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO 加热Cu + H2O20.木炭还原氧化铜:C+ 2CuO高温2Cu + CO2↑21.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224.一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26.锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑27.铁和稀硫酸反应:Fe + H2SO4 === FeSO4 + H2↑28.镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑29.铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑30.锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑31.铁和稀盐酸反应:Fe + 2HCl === FeCl2 + H2↑32.镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑33.铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O (5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH76. 硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑21、铁和盐酸:Fe+2HCl=FeCl2+H2↑22、铁和稀硫酸:Fe+H2SO4= FeSO4+H2↑23、氢气还原氧化铜:H2+CuO=△=Cu+H2O24、木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑25、碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑26、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO427、铜和硝酸汞溶液:Cu+Hg (NO3)2=Hg+Cu(NO3)228、氢气还原氧化铁:3H2+Fe2O3=△=2Fe+2H2O29、铝和稀硫酸:2Al+3H2SO4=Al2 (SO4)3+3H2↑30、钠和水反应:2Na+2H2O=2NaOH+H2↑(四)复分解反应31、大理石和稀盐酸(实验室制CO2):CaCO3+ 2HCl=CaCl2+H2O+CO2↑32、氢氧化钠和硫酸铜:2NaOH+CuSO4=Cu(OH)2↓+Na2SO433、碳酸钠和盐酸(灭火器原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑34、碳酸钾(草木灰)和盐酸:K2CO3+2HCl=2KCl+H2O+CO2↑35、盐酸和氢氧化钠(中和反应):HCl+NaOH=NaCl+H2O36、硫酸和氢氧化钠溶液:H2SO4+2NaOH=Na2SO4+2H2O37、硫酸与氯化钡溶液:H2SO4+BaCl2=BaSO4↓+2HCl38、盐酸与硝酸银溶液:HCl+AgNO3=AgCl↓(白)+HNO339、氢氧化钠和氯化铁溶液:3NaOH+FeCl3=Fe(OH)3↓(红褐色)+3NaCl40、碳酸钡和稀硝酸:BaCO3+2HNO3=Ba(NO3)2+ CO2↑+H2O41、硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2NaCl42、氯化钠和硝酸银:NaCl+AgNO3=AgCl↓+ NaNO343、碳酸钠和石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH44、氢氧化铝和盐酸:Al(OH)3+3HCl=AlCl3 +3H2O45、硝酸铵和氢氧化钠:NH4NO3+NaOH=△=NaNO3+H2O+NH3↑46、氢氧化铁和硫酸:2Fe(OH)3+3H2SO4=Fe2 (SO4)347、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O48、氧化铜和硫酸:CuO+H2SO4=CuSO4+H2O(五)其他:49、二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O50、二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+ H2O51、用氢氧化钠溶液吸收二氧化硫:SO2+2NaOH=Na2SO3+H2O52、一氧化碳还原氧化铜:CO+CuO=△=Cu+CO253、一氧化碳还原氧化铁(炼铁):3CO+Fe2O3=高温=2Fe+3CO254、甲烷在空气中燃烧:CH4+2O2=点燃=CO2+2H2O55、乙醇在空气中燃烧:C2H5OH+3O2=点燃=2CO2+3H2O56、甲醇在空气中燃烧:2CH3OH+3O2=点燃=2CO2+4H2OⅡ、金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au———————————————————————→金属活动性由强逐渐减弱小结:1、只有排在H前面的金属才能置换出酸里的氢2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来二、溶液的酸碱度——pH石蕊试液红紫蓝—————————————————————————————酚酞试无红0 1 2 3 4 5 6 7 8 9 10 11 12 1314│└—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┘←————————————中性——————————————→六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O442. 铜在空气中受热:2Cu + O2 加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑。
中学化学方程式集合

中学化学方程式集合无机化学一、非金属单质(F2、Cl2、 O2、S、N2、P、C、Si(1)、氧化性F2 + H2= 2HF (冷暗处爆炸F2 +Xe(过量=XeF2(产物为白色2F2(过量+Xe=XeF4(产物为白色nF2 +2M=2MFn (表示大部分金属2F2 +2H2O=4HF+O2F2 +2NaX=2NaX+Cl2(熔融,不能是溶液2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积===2ClF3F2 (过量+Cl2===2ClF37F2(过量+I2 ===2IF7Cl2 +H2=2HCl (光照或点燃3Cl2 +2P 点燃2PCl3Cl2 +PCl3△PCl5Cl2 +2Na 点燃2NaCl3Cl2 +2Fe 点燃2FeCl3Cl2 +2FeCl2=2FeCl3Cl2+Cu 点燃CuCl22Cl2+2NaBr=2NaCl+Br2Cl2 +2NaI =2NaCl+I2* 5Cl2+I2+6H2O=2HIO3+10HCl Cl2 +Na2S=2NaCl+S↓Cl2 +H2S=2HCl+S↓Cl2+SO2 +2H2O=H2SO4 +2HCl Cl2 +H2O2=2HCl+O22O2 +3Fe 点燃Fe3O4O2+K △KO2S+H2△H2S2S+C △CS2S+Fe △FeSS+2Cu △Cu2S3S+2Al △Al2S3S+Zn △ZnSN2+3H2催化剂高温高压2NH3N2+3Mg △Mg3N2N2+6Na=2Na3N2+3Ca===Ca3N2 N2+3Ba===Ba3N2N2+6K===2K3NN2+6Rb===2Rb3N P+3Na===Na3P2P+3Zn===Zn3P2P4+6H2△4PH3(2)、还原性S+O2点燃SO2S+6HNO3(浓=H2SO4+6NO2↑+2H2O3S+4 HNO3(稀=3SO2↑+4NO↑+2H2O N2+O2=2NO(放电4P+5O2点燃P4O10(常写成P2O52P+3X2=2PX3 (X表示F2、Cl2、Br2 PX3+X2=PX5P4+20HNO3(浓=4H3PO4+20NO2+4H2O C+2F2=CF4C+2Cl2=CCl42C+O2(少量点燃2COC+O2(足量点燃CO2C+CO2△2COC+H2O 高温CO+H2(生成水煤气2C+SiO2△Si+2CO(制得粗硅Si(粗+2Cl2△SiCl4(SiCl4+2H2△Si(纯+4HClSi(粉+O2△SiO2Si+C △SiC(金刚砂Si+2NaOH+H2O=Na2SiO3+2H2↑(3)、歧化Cl2+H2O=HCl+HClO(加酸抑制歧化、加碱或光照促进歧化Cl2+2NaOH=NaCl+NaClO+H2O3Cl2+6NaOH=5NaCl+NaClO3+3H2O2Cl2+2Ca(OH2=CaCl2+Ca(ClO2+2H2O 3Cl2+6KOH(热、浓=5KCl+KClO3+3H2O3S+6NaOH △2Na2S+Na2SO3+3H2O* 4P+3KOH(浓+3H2O=PH3+3KH2PO2* 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO43C+CaO 电炉CaC2+CO↑3C+SiO2电炉SiC+2CO↑二、金属单质(Na、Mg、Al、Fe(1)、还原性2Na+H2=2NaH 4Na+O2=2Na2O2Na2O+O2△2Na2O22Na+O2=Na2O22Na+S=Na2S(爆炸2Na+2H2O=2NaOH+H2↑2Na+2NH3=2NaNH2+H2 4Na+TiCl4(熔融=4NaCl+Ti Mg+Cl2=MgCl2Mg+Br2=MgBr22Mg+O2点燃2MgOMg+S=MgSMg+2H2O=Mg(OH2+H2↑2Mg+TiCl4(熔融=Ti+2MgCl2 Mg+2RbCl(熔融=MgCl2+2Rb2Mg+CO2点燃2MgO+C2Mg+SiO2点燃2MgO+SiMg+H2S=MgS+H2Mg+H2SO4=MgSO4+H2↑2Al+3Cl2△2AlCl34Al+3O2点燃2Al2O3(钝化* 4Al(Hg+3O2+2xH2O=2(Al2O3.xH2O+4Hg4Al+3MnO2高温2Al2O3+3Mn2Al+Cr2O3高温Al2O3+2Cr2Al+Fe2O3高温Al2O3+2Fe2Al+3FeO △Al2O3+3Fe2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO43+3H2↑2Al+6H2SO4(浓△Al2(SO43+3SO2↑+6H2O(Al、Fe、C在冷、浓的H2SO4、HNO3中钝化Al+4HNO3(稀=Al(NO33+NO↑+2H2O2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Fe+3Br2=2FeBr3Fe+I2△FeI2Fe+S △FeS3Fe+4H2O(g 高温Fe3O4+4H2Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+Cu Fe+SnCl4=FeCl2+SnCl2(铁在酸性环境下、不能把四氯化锡完全还原为单质锡 Fe+SnCl2=FeCl2+Sn三、非金属氢化物(HF、HCl、H2O、H2S、NH3(1)、还原性4HCl(浓+MnO2△MnCl2+Cl2+2H2O4HCl(g+O2△2Cl2+2H2O16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O * 14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2O 2H2O+2F2=4HF+O22H2S+3O2(足量=2SO2+2H2O2H2S+O2(少量=2S+2H2O2H2S+SO2=3S+2H2OH2S+H2SO4(浓=S↓+SO2+2H2O3H2S+2HNO3(稀=3S↓+2NO+4H2O5H2S+2KMnO4+3H2SO4=2MnSO4+K2SO4+5S+8H2O* 3H2S+K2Cr2O7+4H2SO4=Cr2(SO43+K2SO4+3S+7H2O * H2S+4Na2O2+2H2O=Na2SO4+6NaOH2NH3+3CuO △3Cu+N2+3H2O2NH3+3Cl2=N2+6HCl8NH3+3Cl2=N2+6NH4Cl4NH3+3O2(纯氧点燃2N2+6H2O4NH3+5O2催化剂△4NO+6H2O4NH3+6NO 催化剂△5N2+6HO(用氨清除NONaH+H2O=NaOH+H2* 4NaH+TiCl4=Ti+4NaCl+2H2 CaH2+2H2O=Ca(OH2+2H2↑(2)、酸性4HF+SiO2=SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量2HF+CaCl2=CaF2↓+2HClH2S+Fe=FeS+H2↑H2S+CuCl2=CuS↓+2HClH2S+2AgNO3=Ag2S↓+2HNO3H2S+HgCl2=HgS↓+2HClH2S+Pb(NO32=PbS↓+2HNO3H2S+FeCl2=不反应2NH3+2Na=2NaNH2+H2(NaNH2+H2O=NaOH+NH3(3)、碱性NH3+HCl=NH4Cl(白烟NH3+HNO3=NH4NO3(白烟2NH3+H2SO4=(NH42SO4NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl(侯氏制碱法(此反应用于工业制备小苏打、苏打(4、不稳定性2HI △H2+I22H2O 电解2H2↑+O2↑2H2O2=2H2O+O2↑H2S △H2+S四、非金属氧化物(1、低价态的还原性2SO2+O2△2SO32SO2+O2+2H2O=2H2SO4(这是SO2在大气中缓慢发生的环境化学反应SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HI* SO2+NO2=SO3+NO2NO+O2=2NO2NO+NO2+2NaOH=2NaNO2+H2O(用于制硝酸工业中吸收尾气中的NO和NO22CO+O2点燃2CO2CO+CuO △Cu+CO23CO+Fe2O3△2Fe+3CO2CO+H2O 催化剂△CO2+H2(2、氧化性SO2+2H2S=3S+2H2O* SO3+2KI=K2SO3+I2NO2+2KI+H2O=NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2* 4NO2+H2S=4NO+SO3+H2O2Mg + CO2点燃2MgO+C(CO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾* SiO2+2H2△Si+2H2O* SiO2+2Mg △2MgO+Si(3、与水的作用SO2+H2O=H2SO3SO3+H2O=H2SO43NO2+H2O=2HNO3+NON2O5+H2O=2HNO3P2O5+H2O(冷=2HPO3P2O5+3H2O(热=2H3PO4(P2O5极易吸水、可作气体干燥剂* P2O5+3H2SO4(浓=2H3PO4+3SO3CO2+H2O=H2CO3(4、与碱性物质的作用SO2+2NH3+H2O=(NH42SO3SO2+ (NH42SO3+H2O=2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2、再用H2SO4处理 2NH4HSO3+H2SO4=(NH42SO4+2H2O+2SO2↑生成的硫酸铵作化肥、SO2循环作原料气SO2+Ca(OH2=CaSO3↓+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别SO3+MgO=MgSO4SO3+Ca(OH2=CaSO4+H2OCO2+2NaOH(过量=Na2CO3+H2OCO2(过量+NaOH=NaHCO3CO2+Ca(OH2(过量=CaCO3↓+H2O2CO2(过量+Ca(OH2=Ca(HCO32CO2+2NaAlO2+3H2O=2Al(OH3↓+Na2CO3 CO2+C6H5ONa+H2O=C6H5OH+NaHCO3SiO2+CaO 高温CaSiO3SiO2+2NaOH=Na2SiO3+H2O (常温下强碱缓慢腐蚀玻璃SiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑五、金属氧化物(1、低价态的还原性6FeO+O2△2Fe3O4FeO+4HNO3=Fe(NO33+NO2↑+2H2O (2、氧化性Na2O2+2Na=2Na2O(此反应用于制备Na2OMgO、Al2O3几乎没有氧化性、很难被还原为Mg、Al. 一般通过电解熔融态的MgCl2和Al2O3制Mg和Al. Fe2O3+3H2=2Fe+3H2O (制还原铁粉Fe3O4+4H2△3Fe+4H2O(3、与水的作用Na2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2↑(此反应分两步Na2O2+2H2O=2NaOH+H2O2 ;2H2O2=2H2O+O2↑. H2O2的制备可利用类似的反应BaO2+H2SO4(稀=BaSO4+H2O2MgO+H2O=Mg(OH2 (缓慢反应(4、与酸性物质的作用Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O2Na2O2+2CO2=2Na2CO3+O2Na2O2+H2SO4(冷、稀=Na2SO4+H2O2 MgO+SO3=MgSO4MgO+H2SO4=MgSO4+H2OAl2O3+3H2SO4=Al2(SO43+3H2O(Al2O3是两性氧化物Al2O3+2NaOH=2NaAlO2+H2OFeO+2HCl=FeCl2+3H2OFe2O3+6HCl=2FeCl3+3H2OFe3O4+8HCl(浓△FeCl2+2FeCl3+4H2O六、含氧酸(1、氧化性* 4HClO3+3H2S=3H2SO4+4HCl * HClO3+HI=HIO3+HCl* 3HClO+HI=HIO3+3HClHClO+H2SO3=H2SO4+HClHClO+H2O2=HCl+H2O+O2↑(氧化性HClO>HClO2>HClO3>HClO4、但浓、热的HClO4氧化性很强2H2SO4(浓+C △CO2 ↑ +2SO2↑+2H2O2H2SO4(浓+S=3SO2↑+2H2OH2SO4(浓、 HNO3(浓+Fe(Al 室温或冷的条件下钝化6H2SO4(浓+2Fe=Fe2(SO43+3SO2↑+6H2O2H2SO4(浓+Cu △CuSO4+SO2↑+2H2OH2SO4(浓+2HBr △SO2+Br2+2H2OH2SO4(浓+2HI △SO2+I2+2H2OH2SO4(稀+Fe=FeSO4+H2↑2H2SO3+2H2S=3S↓+2H2O4HNO3(浓+C △CO2↑+4NO2↑+2H2O* 6HNO3(浓+S=H2SO4+6NO2↑+2H2O* 5HNO3(浓+P=H3PO4+5NO2↑+H2O6HNO3+Fe=Fe(NO33+3NO2↑+3H2O4HNO3+Fe=Fe(NO33+NO↑+2H2O30HNO3+8Fe=8Fe(NO33+3N2O↑+15H2O36HNO3+10Fe=10Fe(NO33+3N2↑+18H2O30HNO3+8Fe=8Fe(NO33+3NH4NO3+9H2O(2、还原性H2SO3+X2+H2O=H2SO4+2HX (X表示Cl2、Br2、I2 2H2SO3+O2=2H2SO4 H2SO3+H2O2=H2SO4+H2O 5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2O H2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl(3、酸性H2SO4(浓 +CaF2=CaSO4+2HF↑H2SO4(浓+NaCl △NaHSO4+HC l↑H2SO4(浓+2NaClNa2SO4+2HClH2SO4(浓+NaNO3△NaHSO4+HNO3↑(微热3H2SO4(浓+Ca3(PO42=3CaSO4+2H3PO42H2SO4(浓+Ca3(PO42=2CaSO4+Ca(H2PO423HNO3+Ag3PO4=H3PO4+3AgNO32HNO3+CaCO3=Ca(NO32+H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S、HI、HBr、(SO2 等还原性气体4H3PO4+Ca3(PO42=3Ca(H2PO42(重钙H3PO4(浓+NaBr=NaH2PO4+HBrH3PO4(浓+NaI=NaH2PO4+HI(4、不稳定性2HClO=2HCl+O2↑(见光或受热分解4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解H2SO3=H2O+SO2 H2CO3=H2O+CO2H4SiO4=H2SiO3+H2O七、碱(1、低价态的还原性4Fe(OH2+O2+2H2O=4Fe(OH3(2、与酸性物质的作用2NaOH+SO2(少量=Na2SO3+H2ONaOH+SO2(足量=NaHSO32NaOH+SiO2=Na2SiO3+H2O2NaOH+Al2O3=2NaAlO2+H2O2NaOH+Cl2=NaCl+NaClO+H2ONaOH+HCl=NaCl+H2ONaOH+H2S(足量=NaHS+H2O2NaOH+H2S(少量=Na2S+2H2O 3NaOH+AlCl3=Al(OH3↓+3NaCl NaOH+Al(OH3=NaAlO2+2H2ONaOH+NH4Cl △NaCl+NH3↑+H2OMg(OH2+2NH4Cl=MgCl2+2NH3+H2O Al(OH3+NH4Cl 不溶解(3、不稳定性Mg(OH2△MgO+H2O2Al(OH3△Al2O3+3H2O2Fe(OH3△Fe2O3+3H2OCu(OH2△CuO+H2O八、盐(1、氧化性2FeCl3+Fe=3FeCl2 2FeCl3+Cu=2FeCl2+CuCl2 (用于雕刻铜线路版2FeCl3+Zn=2FeCl2+ZnCl2Fe2(SO43+2Ag=FeSO4+Ag2SO4(较难反应Fe(NO33+Ag 不反应2FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2KI=2FeCl2+2KCl+I2FeCl2+Mg=Fe+MgCl2(2、还原性2FeCl2+Cl2=2FeCl33Na2S+8HNO3(稀=6NaNO3+2NO+3S↓+4H2O3Na2SO3+2HNO3(稀=3Na2SO4+2NO↑+H2O2Na2SO3+O2=2Na2SO4(3、与碱性物质的作用MgCl2+2NH3·H2O=Mg(OH2↓+NH4ClAlCl3+3NH3·H2O=Al(OH3↓+3NH4ClFeCl3+3NH3·H2O=Fe(OH3↓+3NH4Cl(4、与酸性物质的作用Na3PO4+HCl=Na2HPO4+NaClNa2HPO4+HCl=NaH2PO4+NaClNaH2PO4+HCl=H3PO4+NaClNa2CO3+HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2Al(OH3↓+3CO2↑+6NaCl 3Na2CO3+2FeCl3+3H2O=2Fe(OH3↓+3CO2↑+6NaCl 3NaHCO3+AlCl3=Al(OH3↓+3CO2↑3NaHCO3+FeCl3=Fe(OH3↓+3CO2↑3Na2S+Al2(SO43+6H2O=2Al(OH3↓+3H2S↑3NaAlO2+AlCl3+6H2O=4Al(OH3↓(5、不稳定性Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2ONH4Cl=NH3+HClNH4HCO3=NH3+H2O+CO22KNO3=2KNO2+O22Cu(NO32△2CuO+4NO2↑+O2↑2KMnO4△K2MnO4+MnO2+O2↑2KClO3△2KCl+3O2↑2NaHCO3△Na2CO3+H2O+CO2↑Ca(HCO32△CaCO3+H2O+CO2↑CaCO3高温CaO+CO2↑ MgCO3高温MgO+CO2↑九、其他方程式1、 AlCl3 + 4NaOH = NaAlO2 + 3NaCl +2H2O2、Al4C3 + 12H2O =4Al(OH3↓ + 3CH4↑(碳化物氮化物的水解3、3K2MnO4 + 2CO2 = 2KMnO4 + MnO2↓+ 2K2CO34、AgNO3 + NaCl =AgCl↓ + NaNO32AgCl=2Ag + Cl2↑(见光或受热5、2Br2 + 3Na2CO3 + H2O = 2NaHCO3+ 2NaBrO + 2NaBr + CO2↑Br2 + NaHCO3 = NaBr + HBrO + CO2↑6、2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl BaCl2 + H2SO4 =BaSO4↓ + 2HCl7、Ca(H2PO42 + 2Ca(OH2 =Ca3(PO42↓ + 4H2O8、4KO2 + 2CO2 = 2K2CO3 + 3O29、SOCl2 + H2O = 2HCl + SO2↑10、HIO + HCl = ICl + H2OHIO + NaOH = NaIO + H2O11、NH2Cl + H2O = NH3 + HClO12、Cu2(OH2CO3 + 4CH3COOH =2(CH3COO2Cu + CO2↑+ 3H2O(CH3COO2Cu + Fe = Cu + (CH3COO2Fe13、6NO + 4NH3催化剂△ 5N2 + 6H2O14、3BrF3 + 5H2O = 9HF + HBrO3 + O2↑+ Br215、As2O3 + 6Zn + 12HCl = 2AsH3 ↑ + 6ZnCl2 + 3H2O16、3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO↑17、Na2SO3 + SO2 + H2O = 2NaHSO32NaHSO3△Na2SO3 + SO2↑ + H2O18、P2O5 + 2NaOH = 2NaPO3 + H2OP2O5 + 6NaOH = 2Na3PO3 + 3H2O19、3Na2S + As2S5= 2Na3AsS4Na2S + SnS2= Na2SnS320、(CN2 + 2H2S →21、(SCN2 + 2NaOH = NaSCN + NaSCNO + H2O22、HCl + KOH = KCl + H2O2HI + PbO = PbI2 + H2O23、P4(固 + 5O2(气= P4O10(固 + 4Q kJ24、S(固 + O2(气= SO2(气 + 296 kJ25、2H2(气 + O2(气= 2H2O(液 + 511.9 kJ26、C2H6O(液 + 3O2(气= 2CO2 + 3H2O(液 + 2Q27、4Al(固 + 3O2(气= 2Al2O3(固 + 3349.3 kJ28、3Fe2+ + NO3― + 4H+= 3Fe3+ + NO↑ + 2H2O29、2S2― + SO32― +6H+=3S↓ + 3H2O30、SiO32― + 2NH4+= H2SiO3↓ + 2NH331、3H2O2 + 2CrO2― + 2OH―= 2CrO42― + 4H2O32、Al3+ + 2SO42― + 2Ba2+ + 4OH―=2BaSO4 ↓ + AlO2― + 2H2O33、Fe2O3 + 6H+ +2I―= 2Fe2+ + I2 + 3H2O34、Al3+ + 3HCO3―= Al(OH3↓+ 3CO2↑35、2H+ + [Ag(NH32]+= Ag+ + 2NH4+36、HS― + OH―= S2― + H2O37、AsO43― + 2I― + 2H+= AsO33― + I2 + H2O38、Cr2O72― + 6Fe2+ + 14H+= 2Cr3+ + 6Fe3+ + 7H2O39、2I― + Cl2= 2Cl― + I2I2 + SO2 + 2H2O = SO42― + 2I― + 4H+SO42― + Ba2+= BaSO4↓40、2I― + 2ClO― + 4H+= I2 + Cl2↑ + 2H2OI2 + SO32― + H2O = SO42― + 2H+ + 2I―41、2Fe2+ + 4Br― + 3Cl2= 2Fe3+ + 2Br2 + 6Cl―42、2MnO4― + 5H2O2 + 6H+= 2Mn2+ + 8H2O + 5O2↑43、3S2― + 16BrO3― + 24OH―=15SO42― + 16Br― + 12H2O44、3Ca2+ + 6H2PO4― + 12OH―=Ca3(PO42 ↓ + 12H2O + 4PO43―45、4H+ + NO3― + 3Fe2+= 3Fe3+ + NO↑ + 2H2OFe3+ + SCN―= [Fe(SCN]2+46、2Na + 2H2O = 2Na+ + 2OH― + H2↑Fe2+ + 2OH―= Fe(OH2↓4Fe(OH2 + O2 + 2H2O = 4Fe(OH347、S2O32― + 2H+=S↓ + SO2 + H2O48、KAl(SO42== K+ + Al3+ + 2SO42―49、NaHSO4= Na+ + HSO4―50、NH4HS = NH4+ + HS―51、对KCl溶液,阳极:2Cl - 2e = Cl2↑阴极:2H + 2e = H2↑对CuSO4溶液,阳极:4OH - 4e = 2H2O + O2↑阴极:2Cu2+ + 4e = 2Cu52、负极:2H2– 4e = 4H+正极:O2 + 2H2O + 4e = 4OH―53、负极:2Zn – 4e = 2Zn2+正极:O2 + 2H2O + 4e = 4OH― 4OH― + 4H+= H2O54、负极:Zn – 2e = Zn2+正极: Ag2O + H2O + 2e = 2Ag + 2OH―2NaCl + 2H2O 电解2NaOH + H2↑+ Cl2↑2NO + O2 = 2NO22H2O22H2O + O2↑十.化合反应1、镁在空气中燃烧:2Mg + O2 点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃2H2O5、红磷在空气中燃烧:4P + 5O2 点燃2P2O56、硫粉在空气中燃烧: S + O2 点燃SO27、碳在氧气中充分燃烧:C + O2 点燃CO28、碳在氧气中不充分燃烧:2C + O2 点燃2CO9、二氧化碳通过灼热碳层: C + CO2 高温2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 电解2H2↑+ O2↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO +CO2↑十一.置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 +H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO △Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高高温2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑十二.其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH2↓+ Na2SO429、甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO △Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH2 + CO2==== CaCO3↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl ===2NaCl + H2O + CO2↑十三. 物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O22MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O2△2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O6. 红磷在空气中燃烧:4P + 5O2点燃2P2O57. 硫粉在空气中燃烧: S + O2点燃SO28. 碳在氧气中充分燃烧:C + O2点燃CO29. 碳在氧气中不充分燃烧:2C + O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 电解2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH2CO3△2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2↑16. 加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3高温CaO + CO2↑十四.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO △Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO △Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2十五.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO43 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO32 === Cu(NO32 + Hg (3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO43 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH2 + SO2 ==== CaSO3 ↓+ H2O (5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH3==== Fe2(SO43 +6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O +CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH2↓ +Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH2 + Na2CO3 === CaCO3↓+ 2NaOH 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl十六.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O △CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O十七.化学方程式反应现象应用2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 △2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4△K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgO △2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O 电解2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH2CO3△2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3△NH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4==ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4==FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgS O4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO43+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 △2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 △3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2△W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 △Mo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C 高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 △CO2↑+ H2O 石蕊红色褪去Ca(OH2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁 CaCO3+H2O+CO2 = Ca(HCO32 白色沉淀逐渐溶解 溶洞的形成,石头的风化Ca(HCO32△CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成2NaHCO3 △Na2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头CaCO3高温CaO+ CO2↑ 工业制备二氧化碳和生石灰有机化学反应方程式: 1、甲烷的主要化学性质 (1)氧化反应 CH 4(g+2O 2(g CO 2(g+2H 2O(l(2)取代反应2、乙烯的乙烯的主要化学性质(1)氧化反应:C 2H4+3O 2 2CO 2+2H 2O(2)加成反应乙烯还可以和氢气、氯化氢、水等发生加成反应。
化学方程式共14个

方程式共14个.化合反应:1. 红磷在空气中燃烧生成五氧化二磷:4P + 5O2= 2P2O5冒大量的白烟,生成白色固体,放出热量2. 硫粉在氧气中燃烧生成二氧化硫:S + O2= SO2明亮蓝紫色的火焰,生成刺激性气味的气体3. 碳在氧气中燃烧生成二氧化碳:C + O2= CO2燃烧更旺,白光,产生无色无味使石灰水变浑浊的气体4. 镁在空气中燃烧生成氧化镁:2Mg + O2= 2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟5. 氢气中空气中燃烧生成水:2H2 + O2= 2H2O发出淡蓝色的火焰,放出热量,有水雾生成6. 铁在氧气中燃烧四氧化三铁:3Fe + 2O2 =Fe3O4剧烈燃烧,火星四射,生成黑色固体.分解反应:7. 加热高锰酸钾生成锰酸钾、二氧化锰和氧气:2KMnO4= K2MnO4 + MnO2 + O2↑8. 加热氯酸钾生成氯化钾和氧气:2KClO3= 2KCl + 3O2 ↑9. 实验室用双氧水制氧气:2H2O2= 2H2O+ O2↑10. 水在直流电的作用下分解:2H2O 通电= 2H2↑+ O2 ↑.置换反应:11.锌和稀硫酸生成硫酸锌和氢气:Zn + H2SO4 = ZnSO4 + H2↑12.铁和硫酸铜生成硫酸亚铁和铜:Fe+CuSO4==FeSO4+Cu.复分解反应:13.碳酸钠与浓盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑白色粉末消失,无色无味气体产生14.硫酸铜与氢氧化钠生成氢氧化铜和硫酸钠:CuSO4+2NaOH==Cu(OH)2 ↓+Na2SO4蓝色溶液变成蓝色沉淀二.概念:1、化学是一门研究物质的组成、结构、性质以及变化规律的以实验为基础自然科学。
2、化学变化和物理变化的根本区别是:有没有新物质的生成。
化学变化中伴随发生一些如放热、发光、变色、放出气体、生成沉淀等现象。
3、物理性质——状态、气味、熔点、沸点、硬度、密度、延展性、溶解性、挥发性、导电性、吸附性等。
史上最全的化学方程式转给需要的同学们!

史上最全的化学方程式转给需要的同学们!非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H)氧化性F2+H2==2HF==(阴暗处爆炸)F2+Xe(过量)==XeF22F2(过量)+Xe==XeF4==(XeF4是强氧化剂,能将Mn2+氧化为MnO4–)nF2+2M==2MFn(M表示大部分金属)2F2+2H2O==4HF+O2==(水是还原剂)2F2+2NaOH==2NaF+OF2+H2OF2+2NaCl==2NaF+Cl2F2+2NaBr==2NaF+Br2F2+2NaI==2NaF+I27F2(过量)+I2==2IF7F2+Cl2(等体积)==2ClF==(ClF属于类卤素:ClF+H2O==HF+HClO==)3F2(过量)+Cl2==2ClF3==(ClF3+3H2O==3HF+HClO3==)Cl2+H2==2HCl==(将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)3Cl2+2P==2PCl3==Cl2+PCl3==PCl5==Cl2+2Na==2NaCl 3Cl2+2Fe==2FeCl3==Cl2+Cu==CuCl2Cl2+2FeCl2==2FeCl3==(在水溶液中:Cl2+2Fe2+==2Fe3++3Cl==)Cl2+2NaBr==2NaCl+Br2==Cl2+2Br===2Cl==+Br2Cl2+2KI==2KCl+I2==Cl2+2I===2Cl==+I23Cl2(过量)+2KI+3H2O==6HCl+KIO33Cl2+I–+3H2O=6H++6Cl–+IO3–5Cl2+I2+6H2O==2HIO3+10HCl5Cl2+I2+6H2O=10Cl–+IO3–+12H+Cl2+Na2S==2NaCl+S↓==Cl2+S2–=2Cl–+S↓Cl2+H2S==2HCl+S↓==(水溶液中:Cl2+H2S=2H++2Cl–+S↓Cl2+SO2+2H2O==H2SO4+2HClCl2+SO2+2H2O=4H++SO42–+2Cl–Cl2+H2O2==2HCl+O2==Cl2+H2O2=2H++Cl–+O22O2+3Fe==Fe3O4==O2+K==KO2S+H2==H2S==2S+C==CS2==S+Zn==ZnSS+Fe==FeS==(既能由单质制取,又能由离子制取)S+2Cu==Cu2S==(只能由单质制取,不能由离子制取)3S+2Al==Al2S3==(只能由单质制取,不能由离子制取)N2+3H2==2NH3==N2+3Mg==Mg3N2==N2+3Ca==Ca3 N2N2+3Ba==Ba3N2==N2+6Na==2Na3N==N2+6K==2K3N N2+6Rb==2Rb3N==N2+2Al==2AlNP4+6H2==4PH3==P+3Na==Na3P==2P+3Zn==Zn3P2H2+2Li==2LiH还原性S+O2==SO2S+H2SO4(浓)==3SO2↑+2H2OS+6HNO3(浓)==H2SO4+6NO2↑+2H2OS+4H++6NO3-==6NO2↑+2H2O+H2SO43S+4HNO3(稀)==3SO2+4NO↑+2H2O3S+4H++4==3SO2+4NO↑+2H2ON2+O2==2NO4P+5O2==P4O10(常写成P2O5)2P+3X2==2PX3(X表示F2,Cl2,Br2)PX3+X2==PX5P4+20HNO3(浓)==4H3PO4+20NO2↑+4H2OC+2F2==CF4C+2Cl2==CCl4C+O2(足量)==CO22C+O2(少量)==2COC+CO2==2COC+H2O==CO+H2(生成水煤气)2C+SiO2==Si+2CO(制得粗硅)Si(粗)+2Cl2==SiCl4(SiCl4+2H2==Si(纯)+4HCl)Si(粉)+O2==SiO2Si+C==SiC(金刚砂)Si+2N aOH+H2O==Na2SiO3+2H2↑==(Si+2OH==+H2O== =+2H2↑)歧化反应Cl2+H2O==HCl+HClO(加碱或光照促进歧化:==(Cl2+H2O==H++Cl–+HClO)Cl2+2NaOH==NaCl+NaClO+H2O==(Cl2+2OH–=Cl–+ClO–+H2O)Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O==(Cl2+2OH–=Cl–+ClO–+H2O)3Cl2+6KOH(浓)==5KCl+KClO3+3H2O==(3Cl2+6OH–==5Cl–+ClO3–+3H2O)3S+6NaOH==2Na2S+Na2SO3+3H2O==(3S+6OH–==2S2–+SO32–+3H2O)4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2==(4P+3OH–+3H2O==PH3↑+3H2PO2–)11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO43C+CaO==CaC2+CO↑3C+SiO2==SiC+2CO↑金属单质(Na,Mg,Al,Fe,Cu)的还原性2Na+H2==2NaH==4Na+O2==2Na2O==2Na2O+O2==2N a2O22Na+O2==Na2O2==2Na+S==Na2S(爆炸)2Na+2H2O==2NaOH+H2↑==2Na+2H2O=2Na++2OH―+H 2↑2Na+2NH3==2NaNH2+H2↑==2Na+2NH3=2Na++2NH2―+ H2↑4Na+TiCl4==4NaCl+Ti==Mg+Cl2==MgCl2==Mg+Br2== MgBr22Mg+O2==2MgO==Mg+S==MgS2Cu+S==Cu2S==(Cu2S只能由单质制备)Mg+2H2O==Mg(OH)2+H2↑2Mg+TiCl4==Ti+2MgCl2==Mg+2RbCl==MgCl2+2Rb2Mg+CO2==2MgO+C==2Mg+SiO2==2MgO+SiMg+H2S==MgS+H2Mg+H2SO4==MgSO4+H2↑==(Mg+2H+=Mg2++H2↑)2Al+3Cl2==2AlCl34Al+3O2==2Al2O3==(常温生成致密氧化膜而钝化,在氧气中燃烧)4Al(Hg)+3O2+2xH2O==2(Al2O3.xH2O)+4Hg(铝汞齐)4Al+3MnO2==2Al2O3+3Mn==2Al+Cr2O3==Al2O3+2Cr= =(铝热反应)2Al+Fe2O3==Al2O3+2Fe==2Al+3FeO==Al2O3+3Fe2Al+6HCl==2AlCl3+3H2↑==2Al+6H+=2Al3++3H2↑2Al+3H2SO4==Al2(SO4)3+3H2↑==2Al+6H+=2Al3++3H2↑2Al+6H2SO4(浓)==Al2(SO4)3+3SO2+6H2O==(Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO3(稀)==Al(NO3)3+NO↑+2H2O==Al+4H++NO3–=Al3++NO↑+2H2O2Al+2NaOH+2H2O==2NaAlO2+3H2↑==2Al+2OH–+2H2O=2AlO2–+3H2↑2Fe+3Br2==2FeBr3==3Fe+2O2==Fe3O4==2Fe+O2==2Fe O==(炼钢过程)Fe+I2==FeI2Fe+S==FeS==(FeS既能由单质制备,又能由离子制备)3Fe+4H2O(g)==Fe3O4+4H2↑Fe+2HCl==FeCl2+H2↑==Fe+2H+=Fe2++H2↑Fe+CuCl2==FeCl2+Cu==Fe+Cu2+=Fe2++Cu↓Fe+SnCl4==FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡还原为单质锡Fe+SnCl2==FeCl2+Sn↓==Fe+Sn2+=Fe2++Sn↓非金属氢化物(HF,HCl,H2O,H2S,NH3)==金属氢化物(NaH)还原性4HCl(浓)+MnO2==MnCl2+Cl2↑+2H2O4H++2Cl–+MnO2==Mn2++Cl2↑+2H2O4HCl(浓)+PbO2==PbCl2+Cl2↑+2H2O4H++2Cl–+PbO2==Pb2++Cl2↑+2H2O4HCl(g)+O2==2Cl2+2H2O16HCl+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O16==H++10Cl-+2MnO4–=2Mn2++5Cl2↑+8H2O6HCl+KClO3==KCl+3Cl2↑+3H2O6H++5Cl–+ClO3–=3Cl2↑+3H2O14HCl+K2Cr2O7==2KCl+2CrCl3+3Cl2↑+7H2O14H++6Cl–+Cr2O72–=2Cr3++5Cl2↑+7H2O2H2O+2F2==4HF+O22HCl+F2=2HF+Cl2==(F2气与HCl、HBr、HI、H2S、NH3气体不能共存)2HBr+Cl2=2HCl+Br2==(Cl2气与HBr、HI、H2S、NH3气体不能共存)2H2S+3O2(足量)==2SO2+2H2O==2H2S+O2(少量)==2S↓+2H2O2H2S+SO2==3S↓+2H2O==H2S+H2SO4(浓)==S↓+SO2↑+2 H2O3H2S+2HNO3(稀)==3S↓+2NO↑+4H2O3H2S+2H++2NO3–=3S↓+2NO↑+4H2O5H2S+2KMnO4+3H2SO4==2MnSO4+K2SO4+5S↓+8H2O5H2S+2MnO4–+6H+=2Mn2++5S↓+8H2O3H2S+K2Cr2O7+4H2SO4==Cr2(SO4)3+K2SO4+3S↓+7H2O 3H2S+Cr2O72–+8H+==2Cr3++3S↓+7H2OH2S+4Na2O2+2H2O==Na2SO4+6NaOHH2S+4Na2O2+2H2O=8Na++==+2NH3+3CuO==3Cu+N2+3H2O2NH3+3Cl2==N2+6HCl==8NH3+3Cl2==N2+6NH4ClNH3+NaNO2+HCl==NaCl+N2↑+2H2ONH3+NO2–+H+=N2↑+2H2O4NH3+3O2(纯氧)==2N2+6H2O==4NH3+5O2==4NO+6H2O4NH3+6NO==5N2+6H2O==(用氨清除NO)NaH+H2O==NaOH+H2↑==(生氢剂)NaH+H2O=Na++OH–+H2↑4NaH+TiCl4==Ti+4NaCl+2H2↑==CaH2+2H2O=Ca(OH)2↓+ 2H2↑酸性4HF+SiO2==SiF4+2H2O(可测定矿样或钢样中SiO2的含量,玻璃雕刻)4HF+Si==SiF4+2H2↑2HF+CaCl2==CaF2+2HCl==H2S+Fe==FeS↓+H2↑H2S+CuCl2==CuS↓+2HCl==(弱酸制强酸的典型反应)H2S+Cu2+=CuS↓+2H+H2S+2AgNO3==Ag2S↓+2HNO3H2S+2Ag+=Ag2S↓+2H+H2S+HgCl2==HgS↓+2HClH2S+Hg2+=HgS↓+2H+H2S+Pb(NO3)2==PbS↓+2HNO3==(铅试纸检验空气中H2S) H2S+Pb2+=PbS↓+2H+H2S+2Ag==Ag2S+H2↑(银器在空气中变黑的原因)2NH3(液)+2Na==2NaNH2+H2↑==(NaNH2+H2O==NaOH +NH3↑)NH3的碱性NH3+HX==NH4X==(X:F、Cl、Br、I、S)NH3+HNO3==NH4NO3==NH3+H+=NH4+2NH3+H2SO4==(NH4)2SO4==NH3+H+=NH4+NH3+NaCl+H2O+CO2==NaHCO3+NH4Cl(侯德榜制碱:用于工业制备小苏打,苏打)NH3+H2S==NH4HS==NH3+H2S=NH4++HS-不稳定性2HF==H2+F2==2HCl==H2+Cl2==2H2O==2H2+O22H2O2==2H2O+O2==H2S==H2+S==2NH3==N2+3H22HI==H2+I2非金属氧化物(SO3、SO2、N2O、NO、N2O3、NO2、N2O4、N2O5、CO、CO2、SiO2、P2O3、P2O5、Cl2O、Cl2O3、Cl2O5、Cl2O7、ClO2)低价态的还原性:(SO2、CO、NO)2SO2+O2+2H2O==2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)2SO2+O2==2SO3==SO2+NO2==SO3+NOSO2+Cl2+2H2O==H2SO4+2HCl==Cl2+SO2+2H2O=4H++ SO42–+2Cl–SO2+Br2+2H2O==H2SO4+2HBr==Br2+SO2+2H2O=4H++ SO42–+2Br–SO2+I2+2H2O==H2SO4+2HI==I2+SO2+2H2O=4H++SO4 2–+2I–2NO+O2==2NO2NO+NO2+2NaOH==2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)NO+NO2+2OH–=2NO2–2CO+O2==2CO2==CO+CuO==Cu+CO23CO+Fe2O3==2Fe+3CO2==CO+H2O==CO2+H2氧化性SO2+2H2S==3S+2H2OSO3+2KI==K2SO3+I2NO2+2KI+H2O==NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S==4NO+SO3+H2O2NO2+Cu==4CuO+N2==N2O+Zn==ZnO+N2CO2+2Mg==2MgO+C==(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2==Si+2H2O==SiO2+2Mg==2MgO+Si与水的作用SO2+H2O==H2SO3SO3+H2O==H2SO4==SO3+H2O=2H++SO42–3NO2+H2O==2HNO3+NO==(NO2不是硝酸的酸酐)N2O5+H2O==2HNO3==N2O5+H2O=2H++2NO3–P2O5+H2O(冷水)==2HPO3P2O5+3H2O(热水)==2H3PO4==(P2O5较易吸水,可作气体干燥剂)P2O5+3H2SO4(浓)==2H3PO4+3SO3CO2+H2O==H2CO3Cl2O+H2O==2HClOCl2O7+H2O==2HClO4==Cl2O7+H2O=2H++2ClO4–与碱性物质的作用SO2+2NH3+H2O==(NH4)2SO3SO2+(NH4)2SO3+H2O==2NH4HSO32NH4HSO3+H2SO4==(NH4)2SO4+2H2O+2SO2↑(硫酸工业尾气处理)SO2+Ca(OH)2==CaSO3↓+H2O==(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO==MgSO4SO3+Ca(OH)2==CaSO4↓+H2OCO2+NH3+H2O==NH4HCO3CO2+2NH3(过量)+H2O==(NH4)2CO3==(NH4)2CO3==(NH2)2CO+2H2O CO2+2NH3==(NH2)2CO+H2O==(工业制取尿素)CO2+2NaOH(过量)==Na2CO3+H2O==2OH-+CO2=CO32–+H2OCO2(过量)+NaOH==NaHCO3==OH-+CO2=HCO3–CO2+Ca(OH)2(过量)==CaCO3+H2O==Ca2++2==+CO2=CaCO3↓+H2O 2CO2(过量)+Ca(OH)2==Ca(HCO3)2==OH―+CO2=HCO3–CO2+CaCO3+H2O==Ca(HCO3)2==CO2+CaCO3+H2O=Ca 2++2HCO3–CO2(不足)+2NaAlO2+3H2O==2Al(OH)3↓+Na2CO3CO2+3H2O+AlO2–=Al(OH)3↓+CO32–CO2(足)+NaAlO2+2H2O==Al(OH)3↓+NaHCO3CO2+2H2O+AlO2–=Al(OH)3↓+HCO3–CO2+C6H5ONa+H2O==C6H5OH↓+NaHCO3CO2+C6H5O―+H2O=C6H5OH↓+HCO3–SiO2+CaO==CaSiO3==(炼钢造渣)SiO2+2NaOH==Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3==Na2SiO3+CO2==(制取玻璃)SiO2+CaCO3==CaSiO3+CO2==(制取玻璃)2NO2+2NaOH==NaNO2+NaNO3+H2O2NO2+2OH―=NO3–+NO2―+H2ONO+NO2+2NaOH==2NaNO2+H2O==(制取硝酸工业尾气吸收)NO+NO2+2OH―=2NO2–+H2O金属氧化物低价态的还原性6FeO+O2==2Fe3O4FeO+4HNO3==Fe(NO3)3+NO2+2H2OFeO+4H++NO3―=Fe3++NO2↑+2H2O氧化性Na2O2+2Na==2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.Fe2O3+3H2==2Fe+3H2O(制还原铁粉)Fe3O4+4H2==3Fe+4H2O==CuO+H2==Cu+H2O2Fe3O4+16HI==6FeI2+8H2O+2I22Fe3O4+16H++4I―=6Fe2++8H2O+2I2Fe2O3+Fe==3FeO==(炼钢过程中加入废钢作氧化剂)FeO+C==Fe+CO==(高温炼钢调节C含量)2FeO+Si==2Fe+SiO2==(高温炼钢调节Si含量)与水的作用Na2O+H2O==2NaOHNa2O+H2O=2Na++2OH–2Na2O2+2H2O==4NaOH+O2↑2Na2O2+2H2O=4Na++4OH–+O2↑(此反应分两步:Na2O2+2H2O==2NaOH+H2O2;2H2O2==2H2O+O2==H2O 2的制备可利用类似的反应:BaO2+H2SO4(稀)==BaSO4+H2O2) MgO+H2O==Mg(OH)2(缓慢反应)与酸性物质的作用Na2O+SO3==Na2SO4==Na2O+CO2==Na2CO3==MgO+S O3==MgSO4Na2O+2HCl==2NaCl+H2ONa2O+2H+=2Na++H2O2Na2O2+2CO2==2Na2CO3+O2↑Na2O2+H2SO4(冷,稀)==Na2SO4+H2O2MgO+H2SO4==MgSO4+H2OMgO+2H+=Mg2++H2OAl2O3+3H2SO4==Al2(SO4)3+3H2OAl2O3+6H+=2Al3++3H2OAl2O3+2NaOH==2NaAlO2+H2O==(Al2O3两性氧化物)Al2O3+2OH―=2AlO2―+H2OFeO+2HCl==FeCl2+H2OFeO+2H+=Fe2++H2OFe2O3+6HCl==2FeCl3+3H2OFe·2O3+6H+=2Fe3++3H2OFe3O4+8HCl==FeCl2+2FeCl3+4H2OFe·3O4+8H+=2Fe3++Fe2++4H2O含氧酸氧化性4HClO3+3H2S==3H2SO4+4HClClO3–+3H2S=6H++SO42–+Cl–HClO3+HI==HIO3+HClClO3–+I–=IO3–+Cl–3HClO+HI==HIO3+3HCl3HClO+I-=IO3–+3H++Cl–HClO+H2SO3==H2SO4+HClHClO+H2SO3=3H++SO42–+Cl–HClO+H2O2==HCl+H2O+O2↑HClO+H2O2=H++Cl–+H2O+O2↑(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C==CO2↑+2SO2↑+2H2O2H2SO4(浓)+S==3SO2↑+2H2OH2SO4+Fe(Al)室温下钝化==6H2SO4(浓)+2Fe==Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu==CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr==SO2↑+Br2+2H2O==(不能用浓硫酸与NaBr制取HBr)H2SO4(浓)+2HI==SO2↑+I2+2H2O==(不能用浓硫酸与NaI制取HI)H2SO4(稀)+Fe==FeSO4+H2↑2H++Fe=Fe2++H2↑H2SO3+2H2S==3S↓+3H2O4HNO3(浓)+C==CO2↑+4NO2↑+2H2O6HNO3(浓)+S==H2SO4+6NO2↑+2H2O5HNO3(浓)+P==H3PO4+5NO2↑+H2O5HNO3(稀)+3P==3H3PO4+5NO↑5H++5NO3-+3P+2H2O==3H3PO4+5NO↑6HNO3(浓足)+Fe==Fe(NO3)3+3NO2↑+3H2O4HNO3(浓)+Fe(足)==Fe(NO3)2+NO2↑+2H2O(先得Fe3+,在Fe过量时再生成Fe2+的盐)4HNO3(稀足)+Fe==F e(NO3)3+NO↑+2H2O4H++NO3-+Fe=Fe3++NO↑+2H2O30HNO3+8Fe==8Fe(NO3)3+3N2O↑+15H2O30==H++6NO3–+8Fe=8Fe3++3N2O↑+15H2O36HNO3+10Fe==10Fe(NO3)3+3N2↑+18H2O36H++6NO3–+10Fe=8Fe3++3N2↑+18H2O30HNO3+8Fe==8Fe(NO3)3+3NH4NO3+9H2O30==H++3NO3–+8Fe=8Fe3++3NH4++9H2O4Zn+10HNO3(稀)==4Zn(NO3)2+N2O↑+5H2O4Zn+10H++2NO3–=4Zn2++N2O↑+5H2O4Zn+10HNO3(稀)==4Zn(NO3)2+NH4NO3+3H2O4Zn+10H++NO3–=4Zn2++NH4++5H2O还原性H2SO3+X2+H2O==H2SO4+2HX==(X表示Cl2,Br2,I2)H2SO3+X2+H2O=4H++SO42-+X–2H2SO3+O2==2H2SO42H2SO3+O2=4H++SO42-H2SO3+H2O2==H2SO4+H2OH2SO3+H2O2=2H++SO42–+H2O5H2SO3+2KMnO4==2MnSO4+K2SO4+2H2SO4+3H2O5H2SO3+2MnO4–=2Mn2++4H++3SO42–+3H2OH2SO3+2FeCl3+H2O==H2SO4+2FeCl2+2HClH2SO3+2Fe3++H2O=4H++2Fe2+==+SO42–酸性H2SO4(浓)+CaF2==CaSO4+2HF↑==(不挥发性酸制取挥发性酸) H2SO4(浓)+NaCl==NaHSO4+HCl↑==(不挥发性酸制取挥发性酸)H2SO4(浓)+2NaCl==Na2SO4+2HCl↑==(不挥发性酸制取挥发性酸)H2SO4(浓)+NaNO3==NaHSO4+HNO3↑==(不挥发性酸制取挥发性酸)3H2SO4(浓)+Ca3(PO4)2==3CaSO4+2H3PO4==(强酸制弱酸酸)2H2SO4(浓)+Ca3(PO4)2==2CaSO4+Ca(H2PO4)2==(工业制磷肥)3HNO3+Ag3PO4==H3PO4+3AgNO33H++Ag3PO4=H3PO4+3Ag+2HNO3+CaCO3==Ca(NO3)2+H2O+CO2↑2H++CaCO3=Ca2++H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S,HI,HBr,==SO2等还原性气体)4H3PO4+Ca3(PO4)2==3Ca(H2PO4)2==(重钙)H3PO4(浓)+NaBr==NaH2PO4+HBr↑==(不挥发性酸制取挥发性酸,磷酸是非氧化性酸)H3PO4(浓)+NaI==NaH2PO4+HI↑不稳定性2HClO==2HCl+O2↑(保存在棕色瓶中)4HNO3==4NO2↑+O2↑+2H2O==(保存在棕色瓶中)H2SO3==H2O+SO2↑==(在加热或酸性条件下分解)H2CO3==H2O+CO2↑==(在加热或酸性条件下分解)H4SiO4==H2SiO3+H2O==H2SiO3==SiO2↓+H2OH2S2O3==H2O+S↓+SO2↑(在加热或酸性条件下分解)碱低价态的还原性4Fe(OH)2+O2+2H2O==4Fe(OH)3与酸性物质的作用2NaOH+SO2(少量)==Na2SO3+H2OOH–+SO2=SO32–+H2ONaOH+SO2(足)==NaHSO3OH-+SO2(足)=HSO3–2NaOH+SiO2==Na2SiO3+H2OOH-+SiO2=SiO32–+H2O2NaOH+Al2O3==2NaAlO2+H2O2OH-+Al2O3=2AlO2–+H2O2KOH+Cl2==KCl+KClO+H2OCl2+2OH–=Cl–+ClO–+H2ONaOH+HCl==NaCl+H2OH++OH===H2ONaOH+H2S(足)==NaHS+H2OOH–+H2S=HS–+H2O2NaOH+H2S(少量)==Na2S+2H2O2OH–+H2S=S2–+2H2O3NaOH+AlCl3==Al(OH)3↓+3NaCl3OH–+Al3+=Al(OH)3↓NaOH+Al(OH)3==NaAlO2+2H2O==(AlCl3和Al(OH)3哪个酸性强?)OH–+Al(OH)3=AlO2–+2H2OCa(OH)2+2NH4Cl==2CaCl2+2NH3↑+2H2O==(实验室制NH3)NaOH+NH4Cl==NaCl+NH3↑+H2OMg(OH)2+2NH4Cl==MgCl2+2NH3·H2O==(Al(O H)3+NH4C l不溶解)Ba(OH)2+H2SO4==BaSO4↓+2H2O2H++2OH–+Ba2++SO42–=BaSO4↓2H2O不稳定性Mg(OH)2==MgO+H2O==2Al(OH)3==Al2O3+3H2O2Fe(OH)3==Fe2O3+3H2O==Cu(OH)2==CuO+H2O==2Ag OH==Ag2O+H2O盐氧化性:(在水溶液中)2FeCl3+Fe==3FeCl2==2Fe3++Fe=3Fe2+2FeCl3+Cu==2FeCl2+CuCl2==(用于雕刻铜线路版)==2Fe3++Cu=2Fe2++Cu2+2FeCl3+Zn(少量)==2FeCl2+ZnCl2==2Fe3++Zn=2Fe2++Zn2+FeCl3+Ag==FeCl2+AgCl↓==2Fe3++Cl-+2Ag=2Fe2++2AgCl↓Fe2(SO4)3+2Ag==FeSO4+Ag2SO4↓==(较难反应)==Fe(NO3)3+Ag不反应2FeCl3+H2S==2FeCl2+2HCl+S↓==2Fe3++H2S=2Fe2++2H ++S↓2FeCl3+2KI==2FeCl2+2KCl+I2==2Fe3++2I-=2Fe2++I2FeCl2+Mg==Fe+MgCl2==Fe2++Mg=Fe+Mg2+NaNO2+NH4Cl==NaCl+N2↑+2H2O==(实验室制氮气)==NH4++NO2-=N2↑+2H2O还原性2FeCl2+3Cl2==2FeCl3==(在水溶液中不需加热)2Fe2++3Cl2=2Fe3++6Cl-3Na2S+8HNO3(稀)==6NaNO3+2NO↑+3S+4H2O3S2-+8H++2NO3-=2NO↑+3S+4H2O3Na2SO3+2HNO3(稀)==3Na2SO4+2NO↑+H2O3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O2Na2SO3+O2==2Na2SO4==(Na2SO3在空气中易变质)Na2SO3+S==Na2S2O3Na2S+Cl2==2NaCl+S↓(在水溶液中)==S2-+Cl2=2Cl-+S↓与碱性物质的作用Ca(OH)2+CuSO4==Cu(OH)2↓+CaSO4↓==(波尔多液)MgCl2+2NH3·H2O==Mg(OH)2↓+2NH4ClMg2++2NH3·H2O=Mg(OH)2↓+2NH4+AlCl3+3NH3·H2O==Al(OH)3↓+3NH4ClAl3++3NH3·H2O=Al(OH)2↓+3NH4+FeCl3+3NH3·H2O==Fe(OH)3↓+3NH4ClFe3++3NH3·H2O=Fe(OH)3↓+3NH4+CuSO4+2NH3·H2O(不足)==Cu(OH)2↓+(NH4)2SO4Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+Cu(OH)2+4NH3·H2O=C u(NH3)4(OH)2+4H2OCu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O==铜氨溶液CuSO4+4NH3·H2O(足)==Cu(NH3)4SO4+4H2O==总方程式Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O==铜氨溶液AgNO3+NH3·H2O==AgOH↓+NH4NO3==2AgOH=Ag2O(灰黑色)+H2OAg2O+4NH3·H2O=2[Ag(NH3)2]++2OH-+3H2O==银氨溶液AgNO3+2NH3·H2O==Ag(N H3)2NO3+2H2OAg++2NH3·H2O=[Ag(NH3)2]++2H2O==总方程式ZnSO4+2NH3·H2O(不足)==Zn(OH)2↓+(NH4)2SO4Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+Zn(OH)2+4NH3·H2O=Zn(NH3)4(OH)2+4H2OZnSO4+4NH3·H2O(足)==Zn(NH3)4SO4+4H2OZn2++4NH3·H2O=[Zn(NH3)4]2++4H2O==总方程式与酸性物质的作用:强酸制弱酸,或不挥发性酸制挥发性酸Na3PO4+2HCl==Na2HPO4+2NaCl==PO43-+2H+=H2PO4- Na2HPO4+HCl==NaH2PO4+NaCl==HPO42-+H+=H2PO4- NaH2PO4+HCl==H3PO4+NaCl==H2PO4-+H+=H3PO4Na2CO3+HCl==NaHCO3+NaCl==CO32-+H+=HCO3-NaHCO3+HCl==NaCl+H2O+CO2↑==HCO3-+H+=CO2↑+H2O3Na2CO3+2AlCl3+3H2O==2Al(OH)3↓+3CO2↑+6NaC l==(物质之间的双水解反应)3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑3Na2CO3+2FeCl3+3H2O==2Fe(OH)3↓+3CO2+6NaCl==(物质之间的双水解反应)3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑3NaHCO3+AlCl3==Al(OH)3↓+3CO2↑==(物质之间的双水解反应)3HCO3-+Al3+=2Al(OH)3↓+3CO2↑3NaHCO3+FeCl3==Fe(OH)3↓+3CO2↑==(物质之间的双水解反应)3HCO3-+Fe3+=2Fe(OH)3↓+3CO2↑3Na2S+Al2(SO4)3+6H2O==2Al(OH)3↓+3H2S↑==(物质之间的双水解反应)3S2-+2Al3++3H2O=2Al(OH)3↓+3H2S↑3NaAlO2+AlCl3+6H2O==4Al(OH)3↓+3NaCl==(物质之间的双水解反应)3AlO2-+Al3++6H2O=4Al(OH)3↓3NaAlO2+FeCl3+6H2O==3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O=3Al(O H)3↓+Fe(OH)3↓NaAlO2+NH4Cl+2H2O==Al(OH)3↓+NH3·H2O+NaClAlO2-+NH4++2H2O=Al(OH)3↓+NH3·H2ONa2CO3+H2O+CO2==2NaHCO3CO32-+H2O+CO2=2HCO3-Na2CO3+H2O+2SO2==2NaHSO3+CO2↑==(1:2)CO32-+H2O+2SO2=2HSO3-+CO2↑2Na2CO3(足)+H2O+SO2==Na2SO3+2NaHCO3==(CO2中的SO2不能用Na2CO3洗气)2CO32-+H2O+SO2=SO32-+2HCO3-==(2:1)Na2CO3+SO2==Na2SO3+CO2==(1:1)CO32-+SO2=SO32-+CO2NaHCO3+SO2==NaHSO3+CO2==(CO2中的SO2可能用NaHCO3洗气)2HCO3-+SO2=2HSO3-+CO22NaHCO3+SO2==Na2SO3+2CO2+H2O2HCO3-+SO2=SO32-+2CO2+H2ONa2SiO3+2HCl==H2SiO3↓+NaCl==或Na2SiO3+2HCl+H2O==H4SiO4↓+2NaClSiO32-+2H+=H2SiO3↓==或SiO32-+2H++H2O=H4SiO4↓Na2SiO3+CO2+2H2O==H2SiO3↓+Na2CO3SiO32-+CO2+2H2O=H4SiO4↓+CO32-盐与盐复分解反应Na2SO4+BaCl2==BaSO4↓+2NaCl(沉淀不溶于盐酸、硝酸)SO32-+Ba2+=BaSO4↓Na2SO3+BaCl2==BaSO3↓+2NaCl==(沉淀溶于盐酸,在硝酸中生成新的沉淀,沉淀不消失)SO32-+Ba2+=BaSO3↓Na2CO3+BaCl2==BaCO3↓+2NaCl(沉淀溶于盐酸、沉淀消失) CO32-+Ba2+=BaCO3↓Na2CO3+CaCl2==CaCO3↓+2NaCl==(NaHCO3不反应)CO32-+Ca2+=CaCO3↓AgNO3+NaCl==AgCl↓+NaNO3==Ag++Cl-=AgCl↓AgNO3+NaBr==AgBr↓+NaNO3==Ag++Br-=AgBr↓AgNO3+KI==AgCl↓+KNO3==Ag++I-=AgI↓3AgNO3+Na3PO4==Ag3PO4↓+3NaNO3==3Ag++PO43-=Ag3PO4↓CuSO4+Na2S==CuS↓+Na2SO4==Cu2++S2-=CuS↓FeCl3+3KSCN==Fe(SCN)3+3KClFe3++3SCN-=Fe(SCN)3==(血红色,用于Fe3+的特性检验)不稳定性Na2S2O3+H2SO4==Na2SO4+S↓+SO2↑+H2OS2O32-+2H+=S↓+SO2↑+H2ONH4Cl==NH3↑+HCl↑NH4I==NH3↑+HI↑==2HI==H2+I2NH4I==NH3↑+H2↑+I2↑NH4HCO3==NH3↑+H2O+CO2↑2KNO3==2KNO2+O2↑2Cu(NO3)3==2CuO+4NO2↑+O2↑2AgNO3==2Ag+2NO2↑+O2↑(保存在棕色瓶中)5NH4NO3==4N2↑+2HNO3+9H2O10NH4NO3==8N2↑+4NO2↑+O2↑+20H2O↑(硝酸铵爆炸反应) 2KMnO4==K2MnO4+MnO2+O2↑2KClO3==2KCl+3O2↑2NaHCO3==Na2CO3+H2O+CO2↑Ca(HCO3)2==CaCO3+H2O+CO2↑CaCO3==CaO+CO2↑==MgCO3==MgO+CO2↑水解反应单水解--可逆水解NH4Cl+H2O==NH3·H2O+HCl==NH4++H2O==H++NH3·H2OFeCl3+3H2O==Fe(OH)3+3HCl==Fe3++3H2O==Fe(OH)3+3 H+AlCl3+3H2O==Al(OH)3+3HCl==Al3++3H2O==Al(OH)3+3 H+CuSO4+2H2O==Cu(OH)2+H2SO4==(金属活动顺序表中Mg2+以后的阳离子均水解)NaHCO3+H2O==H2CO3+NaOH==(NaHSO4不水解,NaHSO3电离大于水解)Na2CO3+H2O==NaHCO3+NaOH==CO32-+H2O==HCO3-+OH–NaHCO3+H2O==H2CO3+NaOH(第一步远远大于第二步,二步不能叠加)Na2SO3+H2O==NaHSO3+NaOH==SO32-+H2O==HSO3-+OH–NaHSO3+H2O==H2SO3+NaOH(第一步远远大于第二步,二步不能叠加)HSO3-+H2O==H2SO3+OH-Na2S+H2O==NaHS+NaOH==S2-+H2O==HS-+OH–NaHS+H2O==H2S+NaOH(第一步远远大于第二步,二步不能叠加)HS-+H2O==H2S+OH-Na3PO4+H2O==Na2HPO4+NaOH==PO43-+H2O==HPO42-+OH–Na2HPO4+H2O==NaH2PO4+NaOH==HPO42-+H2O==H2PO4-+OH–NaH2PO4+H2O==H3PO4+NaOH==H2PO4-+H2O==H3PO4+OH–CH3COONa+H2O==CH3COOH+NaOH==CH3COO-+H2O==CH3COOH+OH–C6H5ONa+H2O==C6H5OH+NaOH==C6H5O-+H2O==C6H5OH+OH–双水解CH3COONH4+H2O==CH3COOH+NH3·H2ONH4F+H2O==HF+NH3·H2OAl2S3+6H2O==Al(OH)3↓+H2S↑==(隔较空气,密封保存)Mg3N2+6H2O==Mg(OH)2↓+NH3↑(隔较空气,密封保存)Na3P+3H2O==3NaOH+PH3↑(隔较空气,密封保存)Zn3P2+6H2O==Zn(OH)2↓+PH3↑(Zn3P2一种老鼠药,PH3剧毒神经毒剂)CaC2+2H2O==Ca(OH)3↓+C2H2↑(隔较空气,密封保存)C2H5ONa+H2O==C2H5OH+NaOH电解及电较方程式电解质溶液在惰性电较条件下,或阴较是较活泼金属电较,阳较是惰性电较条件下的电解2NaCl+2H2O==2NaOH+H2↑+Cl2↑(-)2H2O+2e-==H2↑+2OH-==或==2H++2e-==H2↑(+)2Cl==--2e-==Cl2↑2Cl-+2H2O==2OH-+H2↑+Cl2↑CuCl2==Cu+Cl2↑(-)Cu2++2e-==Cu↓(+)2Cl-==-2e-==Cl2↑Cu2++2Cl-==Cu↓+Cl2↑2CuSO4+2H2O==2Cu↓+O2↑+2H2SO4(-)2Cu2+==+==4e-==2Cu↓(+)2H2O==-==4e-==O2↑+4H+==或:4OH-==-4e-==O2↑+2H2O==4H2O==4H++4OH-2Cu2++2H2O==2Cu↓+O2↑+4H+2H2O==2H2↑+O2↑(-)==4H++4e-==2H2↑(+)4OH-==-4e-==O2↑+2H2O中性电解==4H2O==4H++4OH-2H2O==H2↑+O2↑酸性水解:(-)==4H++4e-==2H2↑(+)2H2O-4e-==O2↑+4H+==4OH-==-4e-==O2↑+2H2O2H2O==H2↑+O2↑碱性水解:(-)==4H2O+4e-==2H2↑+4OH-==或:4H++4e-==2H2↑(+)4OH--4e-==O2↑+2H2O2H2O==H2↑+O2↑电镀:镀件作阴较,被镀金属作阳较,被镀金属的含氧酸盐作电解质溶液镀铜:CuSO4电镀液镀件(-)==Cu2++2e-==Cu↓纯铜(+)==Cu–2e-==Cu2+镀锌:ZnSO4电镀液镀件(-)==Zn2++2e-==Zn↓纯锌(+)==Zn–2e-==Zn2+镀银:AgNO3电镀液镀件(-)==Ag++e-==Ag↓纯银(+)==Ag–e-==Ag+镀镍:NiSO4电镀液镀件(-)==Ni2++2e-==Ni↓纯镍(+)==Ni–2e-==Ni2+熔融状态下的电解2NaCl(熔融)==2Na+Cl2↑(-)2Na++2e-==2Na(+)2Cl--4e-==Cl2↑2Na++2Cl-(熔融)==2Na+Cl2↑2Al2O3(熔融)==4Al+2O2↑(-)4Al3++12e–==4Al(+)6O2-==-12e-==3O2↑4Al3+==+6O2-==4Al+3O2↑NaHF2(熔融)==H2↑+F2↑(-)2H++2e–==H2↑(+)2F-==-2e-==F2↑2HF==H2↑+F2↑。
20个化学方程式

4×31 :5×32 :
7.C + O2 点燃
12
: 32
:
8.2H2 +O2 点燃
SO2
64
2P2O5
2×142
CO2
44
2H2O
2×2 :32
:
2×18
9.2H2O —通—电 — 2H2↑ +O2 ↑
2×36
:
2×2
:32
10.2KClO3 MnO2 加热 2×122.5 :
2KCl+ 3O2↑
1.2Mg+O2 点燃 2MgO 2.3Fe+2O2 点燃 Fe3O4
3.2Cu+O2 △ 2CuO
4.4Al+3O2
2Al2O3
5.S + O2 点燃 SO2
6.4P+5O2 点燃 7.C + O2 点燃 8.2H2 +O2 点燃
2P2O5 CO2 2H2O
9.2H2O —通—电 — 2H2↑ +O2 ↑
Hale Waihona Puke 11、高锰酸钾加热生成氧气,锰酸钾,二氧化锰; 12、过氧化氢在二氧化锰作催化剂的条件下生成氧气和水; 13、锌与稀硫酸反应,生成硫酸锌和氢气。 14、锌和稀盐酸反应,生成氯化锌和氢气。 15、氢气和氧化铜在加热条件下,生成铜和水。 16、硫酸铜溶液与氢氧化钠溶液,生成硫酸钠和氢氧化铜
沉淀。 17、甲烷与氧气在点燃条件下,生成二氧化碳和水。 18、乙醇与氧气在点燃条件下,生成二氧化碳和水。 19、铁与硫酸铜溶液,生成硫酸亚铁和铜。 20、二氧化碳与澄清石灰水,生成碳酸钙沉淀和水。
1.2Mg+O2 点燃 2MgO
2×24 : 32
【化学】高中化学方程式大全

【化学】高中化学方程式大全方程式: -1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ +2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl +H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+2NaCl7、钠在空气中燃烧:2Na + O2 △ Na2O2钠与氧气反应:4Na + O2 = 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3+ O210、钠与水反应:2Na + 2H2O = 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) = Fe3O4 + 4H2↑ (高温)12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O =2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O = Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 +3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2+ H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH =Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH =Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 =4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 △ Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O =2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 +3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH =NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3+ H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O =Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl +H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2 点燃 2FeCl333、氯气与金属铜反应:Cu + Cl2 点燃 CuCl234、氯气与金属钠反应:2Na + Cl2 点燃 2NaCl35、氯气与水反应:Cl2 + H2O = HCl + HClO36、次氯酸光照分解:2HClO 光照 2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl +NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 +Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ +HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 =CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O ≈ H2SO342、氮气与氧气在放电下反应:N2 + O2 放电 2NO43、一氧化氮与氧气反应:2NO + O2 = 2NO2 -44、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO -45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂 2SO3 -46、三氧化硫与水反应:SO3 + H2O = H2SO4 -47、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑ -48、浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2O -49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑ -50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑ -51、氨水受热分解:NH3·H2O △ NH3↑ + H2O -52、氨气与氯化氢反应:NH3 + HCl = NH4Cl -53、氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑ -54、碳酸氢氨受热分解:NH4HCO3 △ NH3↑ + H2O↑ +CO2↑ -55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ +NaNO3 + H2O -56、氨气的实验室制取:2NH4Cl + Ca(OH)2 △ CaCl2 +2H2O + 2NH3↑ -57、氯气与氢气反应:Cl2 + H2 点燃 2HCl -58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O -59、SO2 + CaO = CaSO3 -60、SO2 + 2NaOH = Na2SO3 + H2O -61、SO2 + Ca(OH)2 = CaSO3↓ + H2O -62、SO2 + Cl2 + 2H2O = 2HCl + H2SO4 -63、SO2 + 2H2S = 3S + 2H2O -64、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O -65、Si + 2F 2 = SiF4 -66、Si + 2NaOH + H2O = NaSiO3 +2H2↑ -67、硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO (石英沙)(焦碳)(粗硅) --粗硅转变为纯硅:Si(粗)+ 2Cl2 △ SiCl4 --SiCl4 + 2H2 高温 Si(纯)+ 4HCl ---化合反应 -1、镁在空气中燃烧:2Mg + O2 点燃 2MgO -2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4 -3、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3 -4、氢气在空气中燃烧:2H2 + O2 点燃 2H2O -5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5 -6、硫粉在空气中燃烧: S + O2 点燃 SO2 -7、碳在氧气中充分燃烧:C + O2 点燃 CO2 -8、碳在氧气中不充分燃烧:2C + O2 点燃 2CO -9、二氧化碳通过灼热碳层: C + CO2 高温 2CO -10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2 -11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O ===H2CO3 -12、生石灰溶于水:CaO + H2O === Ca(OH)2 -13、无水硫酸铜作干燥剂:CuSO4 + 5H2O ====CuSO4?5H2O -14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl --分解反应 -15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑ -16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑ -17、水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑ -18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑ -19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑ --置换反应 -20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu -21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4+ H2↑ -22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑ -23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O -24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ -25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O -26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO -27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑ --其他 -28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 ==Cu(OH)2↓ + Na2SO4 –29、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O -30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O -31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2 -32、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2 -33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2==== CaCO3 ↓+ H2O -34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ====Na2CO3 + H2O -35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 + H2O + CO2↑ -36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl=== 2NaCl + H2O + CO2↑ --一.物质与氧气的反应: -(1)单质与氧气的反应: -1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO -2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4 -3. 铜在空气中受热:2Cu + O2 加热 2CuO -4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3 -5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O -6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5 -7. 硫粉在空气中燃烧: S + O2 点燃 SO2 -8. 碳在氧气中充分燃烧:C + O2 点燃 CO2 -9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO -(2)化合物与氧气的反应: -10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2 -11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O -12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O -二.几个分解反应: -13. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑ -14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑ -15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl +3O2 ↑ -16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑ -17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑ -18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑ -三.几个氧化还原反应: -19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O -20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ -21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑ -22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑ -23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2 -24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2 -25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2 -四.单质、氧化物、酸、碱、盐的相互关系 -(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应) -26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑ -27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑ -28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑ -29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑ -30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑ -31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑ -32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑ -33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑ -(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐 -34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu -35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu -36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2+ Hg -(3)碱性氧化物 +酸 -------- 盐 + 水 -37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 +3H2O -38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 ===Fe2(SO4)3 + 3H2O -39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O-40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 +H2O -41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 +H2O -42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O-(4)酸性氧化物 +碱 -------- 盐 + 水 -43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3+ H2O -44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3+ H2O -45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4+ H2O -46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O -47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+H2O -(5)酸 + 碱 -------- 盐 + 水 -48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O -49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O -50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2+ 2H2O -51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 +2H2O -52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 +3H2O -53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ====AlCl3 + 3H2O -54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 +2H2O -55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 +2H2O -56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4+ 2H2O -57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3====Fe2(SO4)3 + 6H2O -58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O -(6)酸 + 盐 -------- 另一种酸 +另一种盐 -59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 +H2O + CO2↑ -60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl +H2O + CO2↑ -61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 +H2O + CO2↑ -62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ +HNO3 -63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 +H2O + CO2↑ -64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl -(7)碱 + 盐 -------- 另一种碱 +另一种盐 -65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+ Na2SO4 -66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl -67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+ 2NaCl -68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl -69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+2NaOH -(8)盐 + 盐 ----- 两种新盐 -70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓+ NaNO3 -71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ +2NaCl -五.其它反应: -72.二氧化碳溶解于水:CO2 + H2O === H2CO3 -73.生石灰溶于水:CaO + H2O === Ca(OH)2 -74.氧化钠溶于水:Na2O + H2O ==== 2NaOH -75.三氧化硫溶于水:SO3 + H2O ==== H2SO4 -76.硫酸铜晶体受热分解:CuSO4?5H2O 加热 CuSO4 + 5H2O -77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ====CuSO4?5H2 --化学方程式反应现象应用 -2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹 -2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验 -2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体 -4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体 -3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3 -C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊 -S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 -2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料 -4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量 -CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧 -2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属 -2KClO3MnO2 Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气-2KMnO4Δ K2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气 -2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验 -2H2O通电2H2↑+O2↑水通电分解为氢气和氧气电解水 -Cu2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热 -NH4HCO3ΔNH3↑+ H2O +CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失 -Zn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气 -Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解-Mg+H2SO4 =MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解-2Al+3H2SO4=Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解 -Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性 -Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性 -WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性 -MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性 -2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、 -H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸 -CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验 -2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因 -2C O+O2点燃2CO2 蓝色火焰煤气燃烧 -C + CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属 -2Fe2O3+3C 高温4Fe+ 3CO2↑冶炼金属 -Fe3O4+2C高温3Fe + 2CO2↑冶炼金属 -C + CO2 高温2CO -CO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性 -H2CO3 ΔCO2↑+ H2O 石蕊红色褪去 -Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁 -CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化 -Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成 -2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头 -CaCO3 高温 CaO+ CO2↑工业制备二氧化碳和生石灰 -CaCO3+2HCl=CaCl2+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢 -Na2CO3+H2SO4=Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理 -Na2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理 -MgCO3+2HCl=MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体 -CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属 -Fe2O3+3CO高温 2Fe+3CO2 冶炼金属原理 -Fe3O4+4CO高温 3Fe+4CO2 冶炼金属原理 -WO3+3CO高温 W+3CO2 冶炼金属原理 -CH3COOH+NaOH=CH3COONa+H2O -2CH3OH+3O2点燃2CO2+4H2O -C2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧 -Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜 -Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2 -Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银 -Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜 -Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈 -Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解 -Na2O+2HCl=2NaCl+H2O 白色固体溶解 -CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色 -ZnO+2HCl=ZnCl2+ H2O 白色固体溶解 -MgO+2HCl=MgCl2+ H2O 白色固体溶解 -CaO+2HCl=CaCl2+ H2O 白色固体溶解 -NaOH+HCl=NaCl+ H2O 白色固体溶解 -Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解 -Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解 -Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多 -Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色-Ca(OH)2+2HCl=CaCl2+2H2O -HCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理 -Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈 -Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解 -CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色 -ZnO+H2SO4=ZnSO4+H2O 白色固体溶解 -MgO+H2SO4=MgSO4+H2O 白色固体溶解 -2NaOH+H2SO4=Na2SO4+2H2O -Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解 -Ca(OH)2+H2SO4=CaSO4+2H2O -Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解 -2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解 -2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色 -Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理 -BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理 -Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理 -Na2O+2HNO3=2NaNO3+H2O 白色固体溶解 -CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色 -ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解 -MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解 -CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解 -NaOH+HNO3=NaNO3+ H2O -Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解 -Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解 -Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解 -Ca(OH)2+2HNO3=Ca(NO3)2+2H2O -Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色 -3NaOH + H3PO4=3H2O + Na3PO4 -3NH3+H3PO4=(NH4)3PO4 -2NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、 -2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2) -FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成 -AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成 -MgCl2+2NaOH = Mg(OH)2↓+2NaCl -CuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成 -CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆 -Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用 -Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱 -Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成 -Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成 -CuSO4+5H2O= CuSO4?H2O 蓝色晶体变为白色粉末 -CuSO4?H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水 -AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子 -BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子 -CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成 -MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓有白色沉淀生成 -CaCO3+2HCl=CaCl2+H2O+CO2 ↑ -MgCO3+2HCl= MgCl2+H2O+ CO2 ↑ -NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子 -NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体-一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl 五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O。
高一化学方程式全集

甲烷燃烧CH4+2O2→CO2+2H2O<条件为点燃>甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解.CH4→C+2H2〔条件为高温高压,催化剂〕甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl〔条件都为光照. 〕实验室制甲烷CH3COONa+NaOH→N a2CO3+CH4〔条件是CaO 加热〕乙烯燃烧CH2=CH2+3O2→2CO2+2H2O<条件为点燃〕乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH〔条件为催化剂〕乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 〔条件为催化剂〕乙烯聚合nC H2=CH2→-[-CH2-CH2-]n- 〔条件为催化剂〕氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- 〔条件为催化剂〕实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O〔条件为加热,浓H2SO4〕乙炔燃烧C2H2+3O2→2CO2+H2O〔条件为点燃〕乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6〔条件为催化剂〕实验室制乙炔CaC2+2H2O→Ca<OH>2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式.CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca〔OH〕2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O〔条件为点燃〕苯和液溴的取代C6H6+Br2→C6H5Br+HBr〔条件为溴化铁〕苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O〔条件为浓硫酸〕苯和氢气C6H6+3H2→C6H12〔条件为催化剂〕乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O〔条件为点燃〕乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O〔条件为催化剂〕〔这是总方程式〕乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O〔条件为浓硫酸 170摄氏度〕两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O <条件为催化剂浓硫酸 140摄氏度>乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→<CH3COO>2Mg+H2乙酸和氧化钙2CH3COOH+CaO→<CH3CH2〕2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜HCHO+4Cu<OH>2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CHO+2Cu→Cu2O<沉淀>+CH3COOH+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH<条件为催化剂或加温〕烯烃是指含有C=C键的碳氢化合物.属于不饱和烃.烯烃分子通式为CnH2n,非极性分子,不溶或微溶于水.容易发生加成、聚合、氧化反应等.乙烯的物理性质通常情况下,无色稍有气味的气体,密度略小比空气,难溶于水,易溶于四氯化碳等有机溶剂.1> 氧化反应:①常温下极易被氧化剂氧化.如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去,由此可用鉴别乙烯.②易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟.2> 加成反应:有机物分子中双键<或三键>两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应.3> 聚合反应:2.乙烯的实验室制法<1>反应原理:CH3CH2OH===CH2=CH2↑+H2O〔条件为加热,浓H2SO4〕<2>发生装置:选用"液液加热制气体〞的反应装置.<3>收集方法:排水集气法.<4>注意事项:①反应液中乙醇与浓硫酸的体积比为1∶3.②在圆底烧瓶中加少量碎瓷片,目的是防止反应混合物在受热时暴沸.③温度计水银球应插在液面下,以准确测定反应液温度.加热时要使温度迅速提高到170℃,以减少乙醚生成的机会.2 高中化学所有有机物的反应方程式④在制取乙烯的反应中,浓硫酸不但是催化剂、吸水剂,也是氧化剂,在反应过程中易将乙醇氧化,最后生成CO2、CO、C等<因此试管中液体变黑>,而硫酸本身被还原成SO2.SO2能使溴水或KMnO4溶液褪色.因此,在做乙烯的性质实验前,可以将气体通过NaOH溶液以洗涤除去SO2,得到较纯净的乙烯.乙炔又称电石气.结构简式HC≡CH,是最简单的炔烃.化学式C2H2分子结构:分子为直线形的非极性分子.无色、无味、易燃的气体,微溶于水,易溶于乙醇、丙酮等有机溶剂.化学性质很活泼,能起加成、氧化、聚合与金属取代等反应.能使高锰酸钾溶液的紫色褪去.乙炔的实验室制法:Ca C2+2H2O→Ca<OH>2+C2H2↑化学性质:〔1〕氧化反应:a.可燃性:2C2H2+5O2 → 4CO2+2H2O现象:火焰明亮、带浓烟 .b.被KMnO4氧化:能使紫色酸性高锰酸钾溶液褪色.〔2〕加成反应:可以跟Br2、H2、HX等多种物质发生加成反应.现象:溴水褪色或Br2的CCl4溶液褪色与H2的加成CH≡CH+H2→ CH2=CH2与H2的加成两步反应:C2H2+H2→C2H4C2H2+2H2→C2H6〔条件为催化剂〕氯乙烯用于制聚氯乙烯C2H2+HCl→C2H3Cl nCH2=CHCl→=-[-CH2-CHCl-]n- 〔条件为催化剂〕〔3〕由于乙炔与乙烯都是不饱和烃,所以化学性质基本相似.金属取代反应:将乙炔通入溶有金属钠的液氨里有氢气放出.乙炔与银氨溶液反应,产生白色乙炔银沉淀.1、卤化烃:官能团,卤原子在碱的溶液中发生"水解反应〞,生成醇在碱的醇溶液中发生"消去反应〞,得到不饱和烃2、醇:官能团,醇羟基能与钠反应,产生氢气能发生消去得到不饱和烃〔与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去〕能与羧酸发生酯化反应能被催化氧化成醛〔伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化〕3、醛:官能团,醛基能与银氨溶液发生银镜反应能与新制的氢氧化铜溶液反应生成红色沉淀能被氧化成羧酸能被加氢还原成醇4、酚,官能团,酚羟基具有酸性能钠反应得到氢气酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基能与羧酸发生酯化5、羧酸,官能团,羧基具有酸性〔一般酸性强于碳酸〕能与钠反应得到氢气不能被还原成醛〔注意是"不能〞〕能与醇发生酯化反应6、酯,官能团,酯基能发生水解得到酸和醇物质的制取:实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4〔条件是CaO 加热〕实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O〔条件为加热,浓H2SO4〕实验室制乙炔CaC2+2H2O→Ca<OH>2+C2H2↑工业制取乙醇:C2H4+H20→CH3CH2OH〔条件为催化剂〕乙醛的制取乙炔水化法:C2H2+H2O→C2H4O<条件为催化剂,加热加压>乙烯氧化法:2 CH2=CH2+O2→2CH3CHO<条件为催化剂,加热>乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O〔条件为催化剂,加热〕乙酸的制取乙醛氧化为乙酸:2CH3CHO+O2→2CH3COOH<条件为催化剂和加温〕加聚反应:乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- 〔条件为催化剂〕氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- 〔条件为催化剂〕氧化反应:甲烷燃烧CH4+2O2→CO2+2H2O<条件为点燃>乙烯燃烧CH2=CH2+3O2→2CO2+2H2O<条件为点燃〕乙炔燃烧C2H2+3O2→2CO2+H2O〔条件为点燃〕苯燃烧2C6H6+15O2→12CO2+6H2O〔条件为点燃〕乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O〔条件为点燃〕乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O〔条件为催化剂〕乙醛的催化氧化:CH3CH O+O2→2CH3COOH <条件为催化剂加热>取代反应:有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应.甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl〔条件都为光照.〕苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O〔条件为浓硫酸〕苯与苯的同系物与卤素单质、浓硝酸等的取代.如:酚与浓溴水的取代.如:烷烃与卤素单质在光照下的取代.如:酯化反应.酸和醇在浓硫酸作用下生成酯和水的反应,其实质是羧基与羟基生成酯基和水的反应.如:水解反应.水分子中的-OH或-H取代有机化合物中的原子或原子团的反应叫水解反应.①卤代烃水解生成醇.如:②酯水解生成羧酸〔羧酸盐〕和醇.如:乙酸乙酯的水解:CH3COOC2H5+H2O→CH3COOH+C2H5OH<条件为无机酸式碱>加成反应.不饱和的碳原子跟其他原子或原子团结合生成别的有机物的反应.乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH〔条件为催化剂〕乙烯和氯化氢CH2=H2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 〔条件为催化剂〕乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4---------C2H2+2H2→C2H6〔条件为催化剂〕苯和氢气C6H6+3H2→C6H12〔条件为催化剂〕消去反应.有机分子中脱去一个小分子〔水、卤化氢等〕,而生成不饱和〔含碳碳双键或碳碳三键〕化合物的反应.乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O〔条件为浓硫酸 170摄氏度〕两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O <条件为催化剂浓硫酸 140摄氏度>。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学方程式总汇
高一化学化学反应总结(2008年12月)
1、钠在空气中燃烧(黄色的火焰)2Na +O2
Na 2O2
钠块在空气中变暗4Na+O2=2Na2O
2、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2H2O +H2↑
2Na +2H2O =2Na++2OH -+H2 ↑
3、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)
2Na2O2+2H2O =4NaOH +O2↑
2Na2O2+2H2O =4Na++4OH -+O2↑碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH
4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:
2Na2O2+2CO2=2Na2CO3+O2
5、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液
Na2CO3+2HCl =2NaCl +H2O+CO2↑
CO32-+2H+=H2O +CO2↑
②纯碱溶液中滴加盐酸,至过量
Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑
HCO3-+H+=H2O +CO2↑
6、小苏打受热分解2NaHCO3△Na2CO3+H2O +CO2 ↑
7、氯气的性质:
铜丝在氯气中剧烈燃烧(棕色烟)
Cu +Cl2点燃CuCl2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)
Cl2+2FeCl2=2FeCl3
8、2Na+Cl2点燃2NaCl
9、铁在氯气中剧烈燃烧2Fe +3Cl2点燃3FeCl3
10、氢气在氯气中燃烧(苍白色火焰)H2+Cl2点燃2HCl
11、氯气溶于水(新制氯水中含H + 、Cl -、
ClO -、OH -、Cl 2、HClO 、H 2O )
Cl 2 + H 2O = HCl + HClO
Cl 2 + H 2O = H + + Cl - + HClO
12、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)
2HClO 2HCl + O 2↑
13、工业制漂白粉的原理及漂白粉的失效
2Ca(OH)2 + 2Cl 2 =Ca(ClO)2 + CaCl 2
+ 2H 2O
2Ca(OH)2 +2Cl 2 =2Ca 2++2ClO -+2Cl -+2H 2O
Ca(ClO)2+CO 2+H 2O =CaCO 3↓+2HClO
2HClO 2HCl + O 2↑
Ca 2++2ClO -
+ CO 2 + H 2O =CaCO 3↓+ 2HClO 14、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶)
MnO 2 +4HCl(浓)
MnCl 2+Cl 2↑+2H 2O MnO 2 +4H ++2Cl -Mn 2+
+Cl 2↑+2H 2O 15、新制氯水注入盛溴化钠溶液的试管中
Cl 2 + 2NaBr = Br 2 + 2NaCl Cl 2 + 2Br - = Br 2 + 2Cl -
光照 光照
16、铁与氧气加热反应3Fe+2O 2Fe3O4
17、工业制单质硅(碳在高温下还原二氧化硅)SiO2+2C 高温Si +2CO↑
18、二氧化硅与氢氧化钠反应
SiO2+2NaOH =Na2SiO3+H2O
SiO2+2OH -=SiO32-+H2O
19. 铝箔在氧气中剧烈燃烧
4Al +3O2点燃2Al2O3
20. 铝片与稀盐酸反应
2Al +6HCl =2AlCl3+3H2↑
2Al +6H+=2Al3++3H2↑
21. 铝与氢氧化钠溶液反应
2Al+2NaOH +2H2O =2NaAlO2+3H2↑
2Al +2OH -+2H2O =2AlO2-+3H2↑
22. 铝与三氧化二铁高温下反应(铝热反应)2Al +Fe2O3高温2Fe +Al2O3
23. 氧化铝溶于氢氧化钠溶液
Al 2O3+2NaOH 2NaAlO2+H2O
Al2O3+2OH -=2AlO2-+H2O
24. 硫酸铝溶液中滴过量氨水
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+(NH4)2SO4
Al3++3 NH3·H2O =Al(OH)3↓+3NH4+
25. ①氢氧化铝溶液中加盐酸
Al(OH)3+3HCl =AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
②Al(OH)3与NaOH溶液反应
Al(OH)3+NaOH NaAlO2+2 H2O
Al(OH)3+OH-=AlO2-+2 H2O
26、2Al(OH)3Al2O3+ 3H2O
27. 高温下铁与水反应3Fe +4H2O(g) 高温Fe3O4+4H2
28. 铁与盐酸反应
Fe +2HCl =FeCl2+H2↑
Fe +2H+=Fe2++H2↑
29. 氧化铁溶于盐酸中
Fe2O3+6HCl =2FeCl3+3H2O
Fe2O3+6H+=2Fe3++3H2O
30. 氯化铁中滴入氢氧化钠溶液(红褐色沉淀)
FeCl3+3NaOH =Fe(OH)3↓+3NaCl
Fe3++3OH -=Fe(OH)3↓
31. 氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)
4Fe (OH)2+O2+2H2O =4Fe (OH)3 32. 氯化亚铁溶液中通入氯气
2FeCl2+Cl2=2FeCl3
2 Fe2++Cl2=2 Fe3++2Cl-
33. 氯化铁溶液中加入铁粉
2FeCl3+Fe =3FeCl2
2Fe3++Fe =3Fe2+
34. 用KSCN检验的存在离子方程式Fe3++3SCN-= Fe (SCN)3
35、硅酸钠与盐酸反应:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
SiO3 2—+ 2H+= H2SiO3↓
36、往硅酸钠溶液中通入二氧化碳:
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3
SiO32—+ CO2 + H2O = CO32—+ H2SiO3↓
37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O
Cl2 + 2OH—= Cl—+ ClO—+ H2O
38、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 ↑+ 2H2O
39、SiO2+ Na2CO3高温Na2SiO3 + CO2↑
SiO2+ CaCO3高温CaSiO3 + CO2↑。
