高中化学人教版必修1课件:3.2几种重要的金属化合物(4)
合集下载
课件_人教版化学必修一几种重要的金属化合物-PPT课件_优秀版

水发生化学反应均得物质D的溶液;A跟水反应还有O2生
成,B跟水反应还有H2生成,C跟水发生的是化合反应。
A①、加A热使为CuS_O4_•5HN_2O_a失_2水_O_2__,B为___N_a_____,
练习:写出过氧化钠与盐酸反应的化学方程式:
C为___N_a__O___,D为___N_a_O__H__。 2 氧化铜呈黑色,可作为制造铜盐的原料;
2Na + O2 = Na2O2 Fe(OH)2+ 2HCl= FeCl2 + 2H2O
结论: Al2O3是一种两性氧化物
坩埚中进行的是( 生成氢氧化镁和氢氧化铝沉淀,然后氢氧
2Na2O2 + 2CO2 = 2Na2CO3 + O2
)C
怎样以AlCl3溶液为原料制取Al(OH)3?
A、加热使CuSO •5H O失水 有关铝三角的基本图象:
MgO
Fe2O3
CuO
氧化物 固体的颜色 水溶性
MgO Fe2O3 CuO
白色 红棕色 黑色
不溶 不溶 不溶
归纳:1、多数金属氧化物不溶于水,只有少数 金属氧化物能与水反应,生成可溶或微溶的碱。
2、一般情况下,碱若可溶。则对应的氧化 物可与水反应生成对应的碱。
氧化物 与酸反应化学方程式 溶液颜色
④由B变为D的化学方程式是: Fe2O3+6HCl=2FeCl3+3H2O
2Na + O2 = Na2O2
用原脱理脂 :_棉Al包3_+住+_3一O2_H些N-_过=_A氧al(_化OH+钠_)粉3_2末_,H_放_2在O_石棉_网=_上2_,N_向_脱a_脂O_H__+__H__2_↑_______ 。
人教版高中化学必修一全册课件(共414张PPT)

体最好不要超过容积的
1 3
,要使试管倾斜一定角
度(约45°)。加热时切不可让试管口朝着自己或
有人的方向。
三、常用危险化学品的分类及标志 1.常用危险化学品的分类
第1类 第2类 第3类 第4类 第5类 第6类 第7类 第8类
爆炸品 压缩气体和液化气体
易燃液体 易燃固体、自燃物品和遇湿易燃物品
氧化剂和有机过氧化物 有毒品
放射性物品 腐蚀品
2.一些常用危险化学品的标志
名师解惑
一、实验安全及防护 1.防爆炸 (1)点燃可燃性气体前先要检验气体的纯度。 (2)在用H2或CO还原CuO时,应先通入H2或CO,在装置 尾部收集气体并检验纯度,若尾部气体已纯,说明装置中的 空气已排尽,这时才可对装置加热。 说明:可燃性气体主要有H2、CO、CH4等。
标签。装有浓H2SO4的瓶上应贴( )
解析 选项中的四种标志是常用危险化学品的标志。浓 H2SO4是一种强腐蚀性液体,只有B项符合题意。
答案 B 跟踪练习3 下列试剂的保存方法中正确的是( ) A.浓硫酸难挥发,可以敞口放置 B.铜片放在细口瓶中 C.浓硝酸保存在无色广口瓶中 D.酒精可以密封在无色试剂瓶中 答案 D
4.加热盛固体的试管,管口应向下倾斜并与桌面成20°, 这样有利于水滴流出,可避免水滴回流到管内而使其炸裂。
5.用启普发生器制气体时,加入固体的量不宜过多,以
不超过容器中间球体积的
1 3
为宜,否则,固体反应剧烈,酸液
很容易从导管冲出。
典例导析
知识点1:实验安全与意外事故的处理方法 例1. 下列做法中存在安全隐患的是( ) A.氢气还原氧化铜的实验中,先加热氧化铜后通氢气 B.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼 睛 C.配制浓硫酸与酒精的混合液时,将所需浓硫酸沿烧 杯壁缓慢倒入盛有一定体积的酒精的烧杯中,并用玻璃棒不 断搅拌 D.用烧瓶加热液体时,投入几片碎瓷片 解析 氢气(或一氧化碳)等易燃、易爆性气体还原氧化 铜实验中,应先通氢气(或一氧化碳)排净装置中的空气,防 止发生爆炸,所以A存在安全隐患。 答案 A
人教版化学必修一3.2几种重要的金属化合物(共28张ppt)

HCl CO32- + 2H+=CO2↑+H2O
NaOH
不反应
HCO3- + H+ = CO2↑+H2O HCO3- + OH- =CO32-+H2O
BaCl2
CO32- +Ba2+ = BaCO3↓
CO2 Na2CO3+H2O+CO2=2NaHCO3
不反应 不反应转化 Na2CO3源自CO2 + H2O
化合价降低,得到2e-,被还原
原理:2Na2O2+2H2O = 4NaOH+O2↑ ① 2NaOH +CO2 =Na2CO3+H2O ②X2
2Na2O2+2CO2=2Na2CO3 +O2
应用:呼吸面具或潜艇中的供氧剂。
思考.潜艇在海底
航行时,工作人员 呼出的二氧化碳到 哪里去了?
呼吸面具的 使用原理?
(1)固体: 加热 (2)溶液: NaOH NaHCO3
1、有哪些方法鉴别Na2CO3、NaHCO3 ?
2、如何除去NaHCO3溶液中混有的Na2CO3 ?
3、如何除去Na2CO3固体中混有的NaHCO3?
3、焰色反应 (1)定义: 金属或它们的化合物在灼烧
时都会使火焰呈现特殊的颜色
实验3-6:金属的焰色反应
主要用途
供氧剂、强氧化剂、漂白剂
二、钠的两种盐
Na2CO3和NaHCO3
碳酸钠(Na2CO3)俗名纯碱,也叫苏打, 碳酸氢钠(NaHCO3)俗名小苏打。
(1) Na2CO3和NaHCO3在水中的溶解性
步骤
样品外观 ①加1m L水
1g Na2CO3
【全国百强校】海南华侨中学人教版高中化学必修1课件:3.2 几种重要的金属化合物(共31张PPT)

名称 化学式 水溶性 属性 与酸反应 与碱反应
氧化铜
氧化铁
氧化镁
氧化铝
氧化钠 过氧化钠
海南侨中
一、金属的氧化物
⒈主要物理性质
名称 化学式 颜色状态 水溶性
氧化铜 氧化铁 氧化镁 氧化铝 氧化钠 过氧化钠
CuO Fe2O3 MgO Al2O3 Na2O Na2O2
黑色固体 红棕色粉末 白色固体 白色固体 白色粉末 淡黄色固体
Al3+ → Al(OH)3 (胶体)
⑷铜盐(阅读教材P62的资料卡片)
海南侨中
三、盐
4.焰色反应 某些金属或它们的化合物在灼烧时使火焰呈
现特殊的颜色,叫焰色反应 演示实验(3-6) 实验步骤:
灼烧 → 蘸取试剂 → 灼烧 → 观察 → 酸洗 → 灼烧
海南侨中
三、盐
4.焰色反应
某些金属或它们的化合物在灼烧时使火焰呈 现特殊的颜色,叫焰色反应
Fe+Fe3+→Fe2+ Fe2++Cl2→Fe3+
讨论:
若向溶液中加入锌粒,如何反应?
海南侨中
⑶Fe3+ 、Fe2+的性质
Fe2+ 既有氧化性又有还原性
加还原剂
加还原剂
加氧化剂
Fe 只有还原性
加还原剂
Fe3+ 只有氧化性
海南侨中
⑶Fe3+ 、Al3+的净水原理(教材P62的实践活动)
Fe3+ → Fe(OH)3 (胶体)
Na2O2 过氧化物
色、态
白色固体
淡黄色固体
稳定性 不稳定,能氧化成Na2O2
比Na2O稳定
与水 反应 Na2O + H2O = 2NaOH
氧化铜
氧化铁
氧化镁
氧化铝
氧化钠 过氧化钠
海南侨中
一、金属的氧化物
⒈主要物理性质
名称 化学式 颜色状态 水溶性
氧化铜 氧化铁 氧化镁 氧化铝 氧化钠 过氧化钠
CuO Fe2O3 MgO Al2O3 Na2O Na2O2
黑色固体 红棕色粉末 白色固体 白色固体 白色粉末 淡黄色固体
Al3+ → Al(OH)3 (胶体)
⑷铜盐(阅读教材P62的资料卡片)
海南侨中
三、盐
4.焰色反应 某些金属或它们的化合物在灼烧时使火焰呈
现特殊的颜色,叫焰色反应 演示实验(3-6) 实验步骤:
灼烧 → 蘸取试剂 → 灼烧 → 观察 → 酸洗 → 灼烧
海南侨中
三、盐
4.焰色反应
某些金属或它们的化合物在灼烧时使火焰呈 现特殊的颜色,叫焰色反应
Fe+Fe3+→Fe2+ Fe2++Cl2→Fe3+
讨论:
若向溶液中加入锌粒,如何反应?
海南侨中
⑶Fe3+ 、Fe2+的性质
Fe2+ 既有氧化性又有还原性
加还原剂
加还原剂
加氧化剂
Fe 只有还原性
加还原剂
Fe3+ 只有氧化性
海南侨中
⑶Fe3+ 、Al3+的净水原理(教材P62的实践活动)
Fe3+ → Fe(OH)3 (胶体)
Na2O2 过氧化物
色、态
白色固体
淡黄色固体
稳定性 不稳定,能氧化成Na2O2
比Na2O稳定
与水 反应 Na2O + H2O = 2NaOH
高一化学必修1:3.2 几种重要的金属化合物精品PPT课件

D、相对分子质量:Na2CO3<NaHCO3
苏氏三兄弟
小苏打
碳酸氢钠
NaHCO3
苏打(纯碱) 碳酸钠
Na2CO3
大苏打(海波) 硫代硫酸钠 Na2S2O3
我们都知道大型晚会或节日时人们 喜欢用烟花来庆祝,大家知道为什么 烟花会具有那么多的颜色么?
3、焰色反应
1、很多金属(单质)或其化合物灼烧时使火焰 呈现特殊的颜色——焰色反应。
紫红色 黄色 紫色 绿色 紫色 砖红色 洋红色 黄绿色
结论:每种金属都有自己的焰色反应
讨论:焰色反应是金属或它们的 化合物的化学性质吗?
应用: 化学实验中用于鉴别某些离子
的存在。
第二课时
铝是地壳中含量最多的 金属元素,但是人们发现铝却比 较晚,原因是铝的化学性质很活 泼,在自然界中主要以化合态存 在,今天我们就来学习一下铝的 几种重要化合物。
2、NaHCO3
加水部分溶 解,碱性弱。
思考:
1、在Na2CO3饱和溶液中通入CO2后有沉淀析出, 原因是什么?
[解析] 1、将CO2通入Na2CO3溶液中,发生如下反应:
Na2CO3+H2O+CO2=2NaHCO3 2、生成的NaHCO3的溶解度比Na2CO3的溶解度小。
思考: 通过滴加酚酞的对 比实验,能说明一 个什么问题?
(HCl)
Na2O+2HCl=2NaCl+H2O
与酸性氧 化物反应
(CO2)
CaO+CO2= CaCO3
Na2O+CO2= Na2CO3
碳酸钠和碳酸氢钠
碳酸钠
碳酸氢钠
化学式
Na2CO3
NaHCO3
俗 名 纯碱或苏打 小苏打
最新人教版高中化学必修一3.2.1《钠的重要化合物》优质课件.ppt

在 Na2O2 与 CO2 或 H2O 的反应中,Na2O2 既作氧化剂又作还原剂,每生 成 1 mol O2 都转移 2 mol 电子。
探究一
探究二
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
当堂检测
ANGTANGJIANCE
2.CO2、H2O 与 Na2O2 反应的先后顺序
A .颜 色
B.水 溶 液的酸碱性
C.氧化性 D.漂白性
解析:Na2O 为白色固体,不具有氧化性和漂白性;Na2O2为淡黄色固体, 具有强氧化性,可用作漂白剂,A、C、D错误;二者均能与水反应生成 NaOH,B
正确。
答 案 :B
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
思维脉络
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
当堂检测
ANGTANGJIANCE
一二三
一、氧化钠和过氧化钠
1 .物 理 性质
氧化钠是白色固体,过氧化钠是淡黄色固体。 2 .化 学 性质 (1)过氧化钠与水反应的实验。
实验操作
实验现象
实验结论
①试管发烫,带火星的木条 复燃;②滴加酚酞后溶液先 变红,然后褪色
探究二
过氧化钠的性质 问题导引
首页
X Z D 新知导学 INZHIDAOXUE
重难探究
HONGNANTANJIU
当堂检测
ANGTANGJIANCE
1.Na2O 和 Na2O2 都能与水反应生成碱,它们都是碱性氧化物吗?
提示碱性氧化物是指与酸反应只生成盐和 H2O 的氧化物。Na2O 与酸反应生成盐和水,而 Na2O2 与酸反应除生成盐和水外还生成 O2, 如:2Na2O2+4HCl 4NaCl+O2↑+2H2O,所以 Na2O 是碱性氧化物,而 Na2O2 不 是 碱性氧化物,是过氧化物。
人教版化学《几种重要的金属化合物》优质课件

人教化学必修1第三章第2节几种重要 的金属 化合物( 共40张 PPT)
人教化学必修1第三章第2节几种重要 的金属 化合物( 共40张 PPT)
请思考:
大家知道节日燃放的五彩缤纷 的烟花是怎么来的吗?
人教化学必修1第三章第2节几种重要 的金属 化合物( 共40张 PPT)
人教化学必修1第三章第2节几种重要 的金属 化合物( 共40张 PPT)
Na2O + H2O = 2NaOH
目录
【实验3-5】
把水滴入盛有少量过氧化钠固体的试管中, 立即把带火星的木条放在试管口,检验生成的 气体。用手轻轻摸一摸试管外壁,有什么感觉? 然后向反应后的溶液滴入酚酞溶液,有什么现 象发生?
现象:产生大量气泡;带火星的木条复燃;试管 发热;溶液颜色变红。
-1
人教化学必修1第三章第2节几种重要 的金属 化合物( 共40张 PPT)
Na2CO3和NaHCO3的热稳定性
现象 发生反应的化学方程式 结论
Na2CO3
澄清的石灰 水不变浑浊
────
NaHCO3
澄清的石灰 水变浑浊
∆ 2NaHCO3=Na2CO3+H2O+CO2↑
受热不 分解
受热易 分解
3、Na2CO3和NaHCO3与盐酸的反应 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CO32- + 2H+ = H2O + CO2↑ NaHCO3 + HCl = NaCl + H2O + CO2↑ (反应较快)
HCO3- + H+ = H2O + CO2↑
人教化学必修1第三章第2节几种重要 的金属 化合物( 共40张 PPT)
【人教版】化学必修一几种重要的金属化合物 (优秀课件-PPT)

FeO
Fe3O4
Fe2O3
氧化亚铁 四氧化三铁 氧化铁
无
磁性氧化铁 铁红
黑色粉末 黑色晶体 红棕色粉末
难溶于水 难溶于水 难溶于水
+2
+2、+3
+3ห้องสมุดไป่ตู้
FeO+2H+= Fe2++H2O ——
—— ——
Fe2O3+6H+= 2Fe3++3H2O 油漆和涂料 炼铁原料
2、铁的氢氧化物 【人教版】化学必修一几种重要的金属化合物 (优秀课件-PPT)优秀课件(实用教材)
全反应后,溶液中的Fe3+和Fe2+浓度相等,
则已反应的Fe3+和未反应Fe3+的物质的量
之比是
( )A
A、2∶3
B、3∶2
C、1∶2
D、1∶1
【人教版】化学必修一几种重要的金 属化合 物 (优秀课件-PPT)优秀课件(实用教材)
启示2:Fe2+的检验方法
Fe2+的检验方法:1.加入NaOH溶液,生成 灰白色沉淀迅速变成灰绿色,最后变成 红褐色 2.先加入KSCN溶液,无现象,再加 入氯水,溶液呈血红色.
【人教版】化学必修一几种重要的金 属化合 物 (优秀课件-PPT)优秀课件(实用教材)
【人教版】化学必修一几种重要的金 属化合 物 (优秀课件-PPT)优秀课件(实用教材)
3、将铁屑溶于过量盐酸后,再加入下列
物质,会有三价铁 生成的是( B、C)
A、硫酸
B、氯水
C、硝酸锌 D、氯化铜
【人教版】化学必修一几种重要的金 属化合 物 (优秀课件-PPT)优秀课件(实用教材)
人教版化学必修一几种重要的金属化合物铁的重要化合物优秀ppt课件

金属铜也能将Fe3+还原:
人教版化学必修一3几.2种几重种要重的要金的属金化属合化物合铁物的-重--要-铁化的合重物要优化秀合p物pt (课共件13 张PPT)
2FeCl3 + Cu == 2FeCl2+CuCl2 (氧化剂)(还原剂)
人教版化学必修一3几.2种几重种要重的要金的属金化属合化物合铁物的-重--要-铁化的合重物要优化秀合p物pt (课共件13 张PPT)想一想Fra bibliotek议一议:
为了能较长时间观察到Fe(OH)2白色沉淀的 生成,请提出改进方案。
反应物: 1. 用新配置的FeSO4溶液 2. 用 不 含 O2 的 蒸 馏 水 配 制 的 NaOH 溶
液 (除去蒸馏水中溶解的O2常采用煮沸的方 法反)应环境:
(1)生成白色Fe(OH)2沉淀的操作可采用长滴管 吸取不含O2的NaOH溶液,插入FeSO4溶液液面 下,再挤出NaOH溶液。 (2)用植物油将反应体系与空气隔离.
不溶
Fe3O4+8H+=Fe2++ 2Fe3++4H2O
铁的氧化物的用途
Ⅰ.作为冶炼金属的原料,如 赤铁矿
高温
Fe2O3+3CO ═ 2 Fe+3CO2
Ⅱ.氧化铁常用于制造红色油漆 和涂料 Ⅲ、特制的磁性氧化铁可做录 音磁带和电信器材。
人教版化学必修一3几.2种几重种要重的要金的属金化属合化物合铁物的-重--要-铁化的合重物要优化秀合p物pt (课共件13 张PPT)
人教版化学必修一3几.2种几重种要重的要金的属金化属合化物合铁物的-重--要-铁化的合重物要优化秀合p物pt (课共件13 张PPT)
人教版化学必修一3几.2种几重种要重的要金的属金化属合化物合铁物的-重--要-铁化的合重物要优化秀合p物pt (课共件13 张PPT)
新教材人教版高中化学必修第一册 全册精品教学课件(共1079页)

3.分散系及其分类
(1)分散系的定义 分 散 系 : 将 __一__种__(或__多__种__)_ 物 质 以 粒 子 形 式 分 散 到 __另__一__种__(或__多__种__)___物质里所形成的体系,称为分散系。
(2)分散系的组成 分散系中被__分__散__成__粒__子___的物质叫做___分__散__质______,另一 种物质叫做___分__散__剂______。
(6)直径介于 1~100 nm 之间的粒子称为胶体( ) (7)氢氧化铁胶体为无色透明的液体,能产生丁达尔效应( ) (8)丁达尔效应可用来鉴定溶液与胶体( )
[答案] (1)× (2)√ (3)× (4)× (5)× (6)× (7)× (8)√
2.清晨,阳光射入密林中的现象如图。请分析其中的道理, 然后完成下列问题。
(2)研究对象 ①同素异形体是指单质,不是指化合物。 ②互为同素异形体的不同单质是由同一种元素组成的,构成 它们的原子的核电荷数相同。 (3)同素异形体的“同”“异”的含义 ①“同”——指元素相同; ②“异”——指形成单质不同,结构不同,性质有差异。 (4)同素异形体的“结构决定性质” ①同素异形体的结构不同,性质存在差异。 ②物理性质不同,化学性质有的相似,有的相差较大。
(3)胶体的性质
1.判断正误(正确的打“√”,错误的打“×”) (1)互为同素异形体的物质的性质完全相同( ) (2)碳酸钾是钾盐,也是碳酸盐( ) (3)根据组成元素的差异,可以把物质分为纯净物和混合物( ) (4)CuSO4·5H2O 是混合物( ) (5)蔗糖溶液、淀粉溶液属于溶液,云、雾、烟属于胶体( )
(2)Fe(OH)3 胶体的制备
△ 制备原理:___F_e_C__l3_+__3_H_2_O_=__=_=_=_=_F_e_(O__H_)_3_(胶__体__)_+__3_H_C__l ____ 具体操作:往烧杯中注入 25 mL 蒸馏水,将烧杯中的蒸馏水 加热至沸腾,向沸水中逐滴加入 5~6 滴___饱__和___F_e_C_l_3 溶__液_____, 继续煮沸至溶液呈____红__褐__色___________,停止加热。
几种重要的金属化合物PPT(人教版)必修一PPT(64页)

热稳定性
碳酸钠
碳酸氢钠
NaHCO3比Na2CO3快
CO32-+2H+=H2O+CO2↑ HCO3-+H+=H2O+CO2↑
热稳定性:Na2CO3>NaHCO3
Page 19
3.焰火反应 很多金属或它们的化合物在灼烧时都会使火焰呈现 特殊的颜色,这在化学上叫做焰色反应。
哪一个是钠的火焰? 在观察钠在燃烧时,发现火焰呈黄色。
生产白色絮状沉淀迅 速变成灰绿色,最后 变成红褐色。
离子 方程式
Fe3++3OH-=Fe(OH)3↓
Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
Page 34
Fe(OH)3
Fe(OH)2的变化过程
Page 35
铁的氢氧化物与酸的反应 氢氧化亚铁与酸的反应离子方程式: Fe(OH)2+2H+=Fe2++2H2O 氢氧化铁与酸的反应离子方程式: Fe(OH)3+3H+=Fe3++3H2O
Page 11
几 种重要 的金属 化合物P PT(人 教版)必 修一PP T(64页 )
颜色状态 氧元素价态 生成条件 与水反应 与CO2反应
特性
氧化钠与过氧化钠的比较
Na2O
Na2O2
白色固体
淡黄色固体
-2价
-1价
常温
加热
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3
碱性氧化物
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
碳酸钠
碳酸氢钠
NaHCO3比Na2CO3快
CO32-+2H+=H2O+CO2↑ HCO3-+H+=H2O+CO2↑
热稳定性:Na2CO3>NaHCO3
Page 19
3.焰火反应 很多金属或它们的化合物在灼烧时都会使火焰呈现 特殊的颜色,这在化学上叫做焰色反应。
哪一个是钠的火焰? 在观察钠在燃烧时,发现火焰呈黄色。
生产白色絮状沉淀迅 速变成灰绿色,最后 变成红褐色。
离子 方程式
Fe3++3OH-=Fe(OH)3↓
Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
Page 34
Fe(OH)3
Fe(OH)2的变化过程
Page 35
铁的氢氧化物与酸的反应 氢氧化亚铁与酸的反应离子方程式: Fe(OH)2+2H+=Fe2++2H2O 氢氧化铁与酸的反应离子方程式: Fe(OH)3+3H+=Fe3++3H2O
Page 11
几 种重要 的金属 化合物P PT(人 教版)必 修一PP T(64页 )
颜色状态 氧元素价态 生成条件 与水反应 与CO2反应
特性
氧化钠与过氧化钠的比较
Na2O
Na2O2
白色固体
淡黄色固体
-2价
-1价
常温
加热
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3
碱性氧化物
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
高中化学必修1 第三章 第二节 几种重要的金属化合物

②加10mL水 ③加2滴酚酞
初步结论
@皮皮课件
10
1.1
钠的重要化合 物
1.2
碳酸钠和碳酸氢钠
科学探究2
碳酸钠和碳酸氢钠的热稳定性:
@皮皮课件
11
1.1
钠的重要化合 物
1.2
碳酸钠和碳酸氢钠
科学探究2
物质 现象
碳酸钠和碳酸氢钠的热稳定性:
发生反应的化学方 程式 ------------------------------2NaHCO3 = Na2CO3 + H2O + CO2 结论
过氧化钠可以与水反应,生成氢氧化钠和氧气:
2Na2O2 + 2H2O = 4NaOH + O2
过氧化钠还能与二氧化碳反应生成碳酸钠和氧气:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
@皮皮课件
5
1.1
钠的重要化合 物
1.1
氧化钠和过氧化钠
实验
过氧化钠和水反应:
• 实验:将水滴入盛有少量过氧化钠固体的试管中,立即
科学探究1
步骤
碳酸钠和碳酸氢钠的性质:
Na2CO3 NaHCO3
①加1mL水
白色粉末,加水 细小白色粉末, 结块,变成晶体; 加水部分溶解, 放热 感觉不到热量变 化
振荡时间长时 可溶解 溶液颜色变红 (较深) 加水先变成含结 晶水的晶体,溶 液碱性比NaHCO3 强 固体量减少 溶液变微红色 加水部分溶解, 溶液碱性比 Na2CO3弱
却比较晚,这是由于铝很活泼,从铝的化合物中提炼铝单质
比较困难。铝的许多化合物在人类的生产和生活中具有重要 的作用。
@皮皮课件
【人教版】化学必修几种重要的金属化合物课件ppt-课件

CO2
【人教版】化学必修几种重要的金属 化合物 课件ppt -课件 优秀课 件(实 用教材 )
我的表格 (二)
Na2CO3和NaHCO3比较
俗名 颜色、状态
水溶性 碱性 与盐酸反应 加热反应
Na2CO3
NaHCO3
【人教版】化学必修几种重要的金属 化合物 课件ppt -课件 优秀课 件(实 用教材 )
碳酸钠和碳酸氢钠比较(二)
Na2CO3 + 2HCl =2NaCl + H2O +CO2
H2O CO2 NaCl
Na2CO3 NaHCO3
【人教版】化学必修几种重要的金属 化合物 课件ppt -课件 优秀课 件(实 用教材 )
NaHCO3 + HCl = NaCl + H2O +CO2
H2O CO2 NaCl
【人教版】化学必修几种重要的金属 化合物 课件ppt -课件 优秀课 件(实 用教材 )
q i discovery---
我的探究
碳酸氢钠的分解
NaHCO3
产物
H2O
Na2CO3
2NaHCO3 = Na 2CO3 +H 2O +CO2
【人教版】化学必修几种重要的金属 化合物 课件ppt -课件 优秀课 件(实 用教材 )
碱性较强
物理性质 外观状 态
水溶性 碱性
NaHCO3 小苏打 白色粉末
能溶 碱性较弱
【人教版】化学必修几种重要的金属 化合物 课件ppt -课件 优秀课 件(实 用教材 )
【人教版】化学必修几种重要的金属 化合物 课件ppt -课件 优秀课 件(实 用教材 )
q i discovery---
人教版高中化学必修一几种重要的金属化合物优秀教材PPT

NaOH KOH Ba(OH)2
NaOH=Na++OH可溶性强碱 KOH =K++OH-
Ba(OH)2 =Ba2++2OH-
Ca(OH)2
Fe(OH)3 Cu(OH)2 Al(OH)3 Mg(OH)2 等
微溶性强碱 Ca(OH)2 =Ca2++2OH多为难溶性弱碱
实验3-6
FeCl3溶液
加入NaOH溶液 离子方程式 Fe+3OH-=Fe(OH)3↓
△ 2Fe(OH)3 ====Fe2O3+3H2O 难溶性碱受热易分解为对应的碱性氧化物和水。
△ 2Al(OH)3 ====Al2O3+3H2O
实验3-7
继续加氨水至过量,沉淀不溶,说明Al(OH)3不 溶于氨水。
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4 白色胶状沉淀
以上金属氧化物与酸反应的产物有什么共同 特征?
能与酸反应生成盐和水的氧化物叫做 碱性氧化物
CO2+2NaOH=Na2CO3+H2O
能与碱反应生成盐和水的氧化物叫做酸 性氧化物
Al2O3+6HCl=2AlCl3+3H2O
离子反应方程式
Al2O3+6H+=2Al3++3H2O
Al2O3+2NaOH=2NaAlO2+H2O Al2O3+OH-=AlO2-+H2O
第三章 金属及其化合物
第二节 几种重要的金属化合物
一、氧化物
自然界中的金属有很多是以含金属氧化物的矿 物的形式存在的
铝土矿(Al2O3)
人教版化学必修一几种重要的金属化合物教学课件1

否
-1 2Na+O2=Δ=Na2O2
2Na2O2+2H2O==4NaOH+O2 ↑
2Na2O2+2CO2==2Na2CO3+O2
与酸反应 Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+O2↑+2H2O
稳定性
不稳定
稳定
Δ
2Na2O+O2===2Na2O2
人教版化学必修一几种重要的金属化 合物2
B.该物质一定含钠元素
C.该物质一定是金属钠
D.该物质中一定含钠离子
人教版化学必修一几种重要的金属化 合物2
铝是地壳中含
量最多的金属元素, 它占地壳总质量的 7.73%,比铁几乎 多1倍,是铜的近 千倍。
…… 逐渐成为继铁
之后又一对人类发 展产生重大影响的 金属。
:
铝制餐具的兴与衰
铝的 物理性质
人教版化学必修一几种重要的金属化 合物2
下列关于Na2O和Na2O2的叙述正确的是 A.都是白色固体 B.都是碱性氧化物 C.都能和水反应形成强碱溶液 D.都是强氧化剂
( C)
人教版化学必修一几种重要的金属化 合物2
2、向紫色石蕊试液中加入过量的 Na2O2粉末,振荡,观察到的现象 是( )
A.溶液仍为紫色 B.溶液变为蓝色 C.最终溶液褪色,而无其它现象 D.溶液有气泡产生,溶液最终变 为无色
二、碳酸钠和碳酸氢钠的性质
碳酸钠俗名纯碱,也叫苏打。 碳酸氢钠俗名小苏打。 在水中的电离方程式:
Na2CO3 2Na CO32
NaHCO3 Na HCO3
科学探究
碳酸钠和 碳酸氢钠 的性质
1.Na2CO3和NaHCO3的溶解性和碱性
-1 2Na+O2=Δ=Na2O2
2Na2O2+2H2O==4NaOH+O2 ↑
2Na2O2+2CO2==2Na2CO3+O2
与酸反应 Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+O2↑+2H2O
稳定性
不稳定
稳定
Δ
2Na2O+O2===2Na2O2
人教版化学必修一几种重要的金属化 合物2
B.该物质一定含钠元素
C.该物质一定是金属钠
D.该物质中一定含钠离子
人教版化学必修一几种重要的金属化 合物2
铝是地壳中含
量最多的金属元素, 它占地壳总质量的 7.73%,比铁几乎 多1倍,是铜的近 千倍。
…… 逐渐成为继铁
之后又一对人类发 展产生重大影响的 金属。
:
铝制餐具的兴与衰
铝的 物理性质
人教版化学必修一几种重要的金属化 合物2
下列关于Na2O和Na2O2的叙述正确的是 A.都是白色固体 B.都是碱性氧化物 C.都能和水反应形成强碱溶液 D.都是强氧化剂
( C)
人教版化学必修一几种重要的金属化 合物2
2、向紫色石蕊试液中加入过量的 Na2O2粉末,振荡,观察到的现象 是( )
A.溶液仍为紫色 B.溶液变为蓝色 C.最终溶液褪色,而无其它现象 D.溶液有气泡产生,溶液最终变 为无色
二、碳酸钠和碳酸氢钠的性质
碳酸钠俗名纯碱,也叫苏打。 碳酸氢钠俗名小苏打。 在水中的电离方程式:
Na2CO3 2Na CO32
NaHCO3 Na HCO3
科学探究
碳酸钠和 碳酸氢钠 的性质
1.Na2CO3和NaHCO3的溶解性和碱性
人教版高中化学必修一教案-3.2几种重要的金属化合物4
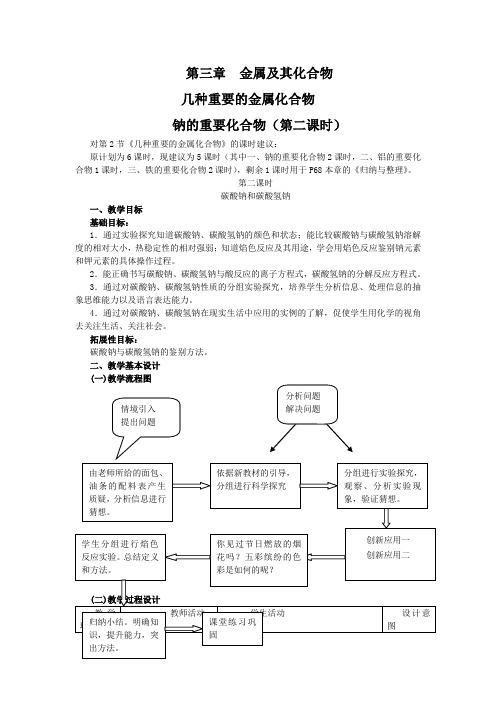
第三章金属及其化合物
几种重要的金属化合物
钠的重要化合物(第二课时)
对第2节《几种重要的金属化合物》的课时建议:
原计划为6课时,现建议为5课时(其中一、钠的重要化合物2课时,二、铝的重要化合物1课时,三、铁的重要化合物2课时),剩余1课时用于P68本章的《归纳与整理》。
第二课时
碳酸钠和碳酸氢钠
一、教学目标
基础目标:
1.通过实验探究知道碳酸钠、碳酸氢钠的颜色和状态;能比较碳酸钠与碳酸氢钠溶解度的相对大小,热稳定性的相对强弱;知道焰色反应及其用途,学会用焰色反应鉴别钠元素和钾元素的具体操作过程。
2.能正确书写碳酸钠、碳酸氢钠与酸反应的离子方程式,碳酸氢钠的分解反应方程式。
3.通过对碳酸钠、碳酸氢钠性质的分组实验探究,培养学生分析信息、处理信息的抽象思维能力以及语言表达能力。
4.通过对碳酸钠、碳酸氢钠在现实生活中应用的实例的了解,促使学生用化学的视角去关注生活、关注社会。
拓展性目标:
碳酸钠与碳酸氢钠的鉴别方法。
二、教学基本设计
(一)教学流程图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
白色固体,难溶于水,熔点很高。 用途:冶炼金属铝的原料,也是一种比较好的耐火材料。 (2)化学性质: Al2O3 + 6HCl = 2AlCl3 + 3H2O
学.科.网
Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O
讨论2:实验室用氯化铝溶液和偏铝酸钠溶液 制取Al(OH)3 有哪些方法?并加以评价。
Al3+ 适量NaOH 白色沉淀 过量NaOH 沉淀溶解 AlO2Al3++3OH- =Al(OH)3↓ 白色沉淀 过量氨水 过量盐酸 AlO2- 适量盐酸 白色沉淀 AlO2-+ H+ + H2O=Al(OH)3↓ Al3+ 适量氨水 沉淀不溶解 沉淀溶解 Al3+
(2)氢氧化铝的两性 [实验3-8] Al(OH)3 + 3H+ ==== Al3+ + 3H2O Al(OH)3 + OH- ==== AlO2- + 2H2O
既能和酸又能和碱反应形成盐和水的氢氧化物
叫做两性氢氧化物。
思考:为什么常用氨水与硫酸铝溶液反应制取氢氧化铝, 而不用氢 氧化钠溶液呢?
(3)不稳定性:氢氧化铝不稳定,受热易分解。 ∆ 2Al(OH)3 ==== Al2O3+3H2O
课后作业
1. 复习本节学习内容; 2. 《乐学》P48 知识点一、知识点二(典例)
Zx.xk
3. 《乐学》P50 随堂练习1、2、3、4、5题 4. 活页P31 1、2、3、4、6题
A. Mg(Al2O3) C.Fe(Al) B.MgCl2(AlCl3) D.Fe2O3(Al2O3)
)
练习2:已知单质A、B、C和甲、乙、丙、丁四种化合物有如图 的转化关系,C为密度最小的气体,甲是一种高熔点的物质,丙 常温下是一种液体。
Z.x.x. K
根据以上转化关系回答: (1)写出下列物质的化学式:A______;B____;乙______。 (2)A原子的原子结构示意图为___________。 (3)写出下列变化的方程式: ①A与NaOH溶液反应的化学方程式_______________。 ②甲与NaOH溶液反应的离子方程式________________。
AlO2- 适量CO2
过量CO2 白色沉淀 沉淀不溶解 AlO2-+2H2O+CO2=Al(OH)3↓+ HCO3AlO2-+ HCO3- + H2O=Al(OH)3↓+ CO32-
总式:2AlO2-+3H2O+CO2=2Al(OH)3↓+ CO32Al(OH)3溶于强酸、强碱,不溶于H2CO3和氨水
(4)氢氧化铝的用途
① 氢氧化铝是白色胶状沉淀,它能凝聚水中的悬浮物, 并能吸附色素。 ② Al(OH)3是一种医用的胃酸中和剂。
阅读:硫酸铝钾
――复盐
明矾晶体 KAl(SO4)2•12H2O]
KAl(SO4)2 = K+ + Al3+ + 2SO42-
练习1:不能用NaOH溶液除去括号中杂质的是(
Al2O3 + 2NaOH = 2NaAlO2 + H2O
既能和酸又能和碱反应形成盐和水的氧化物
叫做两性氧化物。Al2O3是一种两性氧化物。 (3)制法 2Al(OH)3 = Al2O3 +3H2O
2、氢氧化铝
(1)制备 [实验3-7]
向铝盐溶液中加入氨水
Al3+ + 3NH 3· H2O === Al(OH)3 + 3NH4+
讨论1:铝元素的常见存在形式间的转化关系:
Al3+ + 3OH- = Al(OH)3 Al3+ + 4OH- = AlO2- + 2H2O Al(OH)3 + OH- = AlO2- + 2H2O
Al
Al3+ Al2O3
AlO2
Al(OH)3
AlO2-+ H+ + H2O=Al(OH)3↓ Al(OH)3 + 3H+ = Al3+ + 3H2O AlO2-+4H+ =Al3+ + 2H2O
学.科.网
Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O
讨论2:实验室用氯化铝溶液和偏铝酸钠溶液 制取Al(OH)3 有哪些方法?并加以评价。
Al3+ 适量NaOH 白色沉淀 过量NaOH 沉淀溶解 AlO2Al3++3OH- =Al(OH)3↓ 白色沉淀 过量氨水 过量盐酸 AlO2- 适量盐酸 白色沉淀 AlO2-+ H+ + H2O=Al(OH)3↓ Al3+ 适量氨水 沉淀不溶解 沉淀溶解 Al3+
(2)氢氧化铝的两性 [实验3-8] Al(OH)3 + 3H+ ==== Al3+ + 3H2O Al(OH)3 + OH- ==== AlO2- + 2H2O
既能和酸又能和碱反应形成盐和水的氢氧化物
叫做两性氢氧化物。
思考:为什么常用氨水与硫酸铝溶液反应制取氢氧化铝, 而不用氢 氧化钠溶液呢?
(3)不稳定性:氢氧化铝不稳定,受热易分解。 ∆ 2Al(OH)3 ==== Al2O3+3H2O
课后作业
1. 复习本节学习内容; 2. 《乐学》P48 知识点一、知识点二(典例)
Zx.xk
3. 《乐学》P50 随堂练习1、2、3、4、5题 4. 活页P31 1、2、3、4、6题
A. Mg(Al2O3) C.Fe(Al) B.MgCl2(AlCl3) D.Fe2O3(Al2O3)
)
练习2:已知单质A、B、C和甲、乙、丙、丁四种化合物有如图 的转化关系,C为密度最小的气体,甲是一种高熔点的物质,丙 常温下是一种液体。
Z.x.x. K
根据以上转化关系回答: (1)写出下列物质的化学式:A______;B____;乙______。 (2)A原子的原子结构示意图为___________。 (3)写出下列变化的方程式: ①A与NaOH溶液反应的化学方程式_______________。 ②甲与NaOH溶液反应的离子方程式________________。
AlO2- 适量CO2
过量CO2 白色沉淀 沉淀不溶解 AlO2-+2H2O+CO2=Al(OH)3↓+ HCO3AlO2-+ HCO3- + H2O=Al(OH)3↓+ CO32-
总式:2AlO2-+3H2O+CO2=2Al(OH)3↓+ CO32Al(OH)3溶于强酸、强碱,不溶于H2CO3和氨水
(4)氢氧化铝的用途
① 氢氧化铝是白色胶状沉淀,它能凝聚水中的悬浮物, 并能吸附色素。 ② Al(OH)3是一种医用的胃酸中和剂。
阅读:硫酸铝钾
――复盐
明矾晶体 KAl(SO4)2•12H2O]
KAl(SO4)2 = K+ + Al3+ + 2SO42-
练习1:不能用NaOH溶液除去括号中杂质的是(
Al2O3 + 2NaOH = 2NaAlO2 + H2O
既能和酸又能和碱反应形成盐和水的氧化物
叫做两性氧化物。Al2O3是一种两性氧化物。 (3)制法 2Al(OH)3 = Al2O3 +3H2O
2、氢氧化铝
(1)制备 [实验3-7]
向铝盐溶液中加入氨水
Al3+ + 3NH 3· H2O === Al(OH)3 + 3NH4+
讨论1:铝元素的常见存在形式间的转化关系:
Al3+ + 3OH- = Al(OH)3 Al3+ + 4OH- = AlO2- + 2H2O Al(OH)3 + OH- = AlO2- + 2H2O
Al
Al3+ Al2O3
AlO2
Al(OH)3
AlO2-+ H+ + H2O=Al(OH)3↓ Al(OH)3 + 3H+ = Al3+ + 3H2O AlO2-+4H+ =Al3+ + 2H2O
