广大复习资料之工程热力学第三章思考题答案
工程热力学第三章答案

能量守恒定律,表述为系统能量的变化等于传入和传出系统的热 量与外界对系统所做的功的和。
热力学第二定律
熵增加原理,表述为封闭系统的熵永不减少,总是向着熵增加的 方向发展。
热力过程和热力循环的分类
热力过程
在热力学中,将系统从某一初始状态出发,经过某一过程到达另一终态的过程称为热力过程。根据过程中是否发 生相变,可以将热力过程分为等温过程、等压过程、绝热过程和多变过程等。
热力循环
将热能转换为机械能的循环过程,通常由若干个热力过程组成。常见的热力循环有朗肯循环、布雷顿循环和斯特 林循环等。
02
热力学第一定律的应用
等温过程、绝热过程和多方过程的能量转换关系
80%
等温过程
等温过程中,系统与外界交换的 热量全部用于改变系统的内能, 没有其他形式的能量转换。
100%
绝热过程
工程热力学第三章答案
目
CONTENCT
录
• 热力学基本概念 • 热力学第一定律的应用 • 热力学第二定律的应用 • 热力学第三定律的应用 • 热力学在工程实践中的应用案例
01
热力学基本概念
温度、压力、体积和熵的定义
01
02
03
04
温度
压力
体积
熵
表示物体热度的物理量,是物 体分子热运动的宏观表现。常 用的温度单位有摄氏度(℃)、 华氏度(℉)和开尔文(K)。
05
热力学在工程实践中的应用案例
汽车发动机的热力循环分析
总结词
汽车发动机的热力循环分析是热力学在 工程实践中的重要应用,通过对发动机 工作过程中的热量流动和能量转换进行 分析,优化发动机性能和提高燃油效率 。
VS
工程热力学思考题答案

工程热力学思考题及答案第一章基本概念1.闭口系与外界无物质交换,系统内质量保持恒定,那么系统内质量保持恒定的热力系一定是闭口系统吗?答:不一定。
稳定流动开口系统内质量也可以保持恒定。
2.有人认为,开口系统中系统与外界有物质交换,而物质又与能量不可分割,所以开口系统不可能是绝热系。
对不对,为什么?答:这种说法是不对的。
工质在越过边界时,其热力学能也越过了边界。
但热力学能不是热量,只要系统和外界没有热量的交换就是绝热系。
3.平衡状态与稳定状态有何区别和联系,平衡状态与均匀状态有何区别和联系?答:只有在没有外界影响的条件下,工质的状态不随时间变化,这种状态称之为平衡状态。
稳定状态只要其工质的状态不随时间变化,就称之为稳定状态,不考虑是否在外界的影响下,这是它们的本质区别。
平衡状态并非稳定状态之必要条件。
物系内部各处的性质均匀一致的状态为均匀状态。
平衡状态不一定为均匀状态,均匀并非系统处于平衡状态之必要条件。
4.假如容器中气体的压力没有改变,试问安装在该容器上的压力表的读数会改变吗?绝对压力计算公式p = p b+p e(p >p b),p v=p b−p (p b<p)中,当地大气压是否必定是环境大气压?答:压力表的读数可能会改变,根据压力仪表所处的环境压力的改变而改变。
当地大气压不一定是环境大气压。
环境大气压是指压力仪表所处的环境的压力。
5.温度计测温的基本原理是什么?答:温度计随物体的冷热程度不同有显著的变化。
6.经验温标的缺点是什么?为什么?答:任何一种经验温标不能作为度量温度的标准。
由于经验温标依赖于测温物质的性质,当选用不同测温物质的温度计、采用不同的物理量作为温度的标志来测量温度时,除选定为基准点的温度,其他温度的测定值可能有微小的差异。
7.促使系统状态变化的原因是什么?答:系统内部各部分之间的传热和位移或系统与外界之间的热量的交换与功的交换都是促使系统状态变化。
8.(1)将容器分成两部分,一部分装气体,一部分抽成真空,中间是隔板。
工程热力学课后思考题及答案

⼯程热⼒学课后思考题及答案第⼀章思考题1、如果容器中⽓体压⼒保持不变,那么压⼒表的读数⼀定也保持不变,对吗?答:不对。
因为压⼒表的读书取决于容器中⽓体的压⼒和压⼒表所处环境的⼤⽓压⼒两个因素。
因此即使容器中的⽓体压⼒保持不变,当⼤⽓压⼒变化时,压⼒表的读数也会随之变化,⽽不能保持不变。
2、“平衡”和“均匀”有什么区别和联系答:平衡(状态)值的是热⼒系在没有外界作⽤(意即热⼒、系与外界没有能、质交换,但不排除有恒定的外场如重⼒场作⽤)的情况下,宏观性质不随时间变化,即热⼒系在没有外界作⽤时的时间特征-与时间⽆关。
所以两者是不同的。
如对⽓-液两相平衡的状态,尽管⽓-液两相的温度,压⼒都相同,但两者的密度差别很⼤,是⾮均匀系。
反之,均匀系也不⼀定处于平衡态。
但是在某些特殊情况下,“平衡”与“均匀”⼜可能是统⼀的。
如对于处于平衡状态下的单相流体(⽓体或者液体)如果忽略重⼒的影响,⼜没有其他外场(电、磁场等)作⽤,那么内部各处的各种性质都是均匀⼀致的。
3、“平衡”和“过程”是⽭盾的还是统⼀的?答:“平衡”意味着宏观静⽌,⽆变化,⽽“过程”意味着变化运动,意味着平衡被破坏,所以⼆者是有⽭盾的。
对⼀个热⼒系来说,或是平衡,静⽌不动,或是运动,变化,⼆者必居其⼀。
但是⼆者也有结合点,内部平衡过程恰恰将这两个⽭盾的东西有条件地统⼀在⼀起了。
这个条件就是:在内部平衡过程中,当外界对热⼒系的作⽤缓慢得⾜以使热⼒系内部能量及时恢复不断被破坏的平衡。
4、“过程量”和“状态量”有什么不同?答:状态量是热⼒状态的单值函数,其数学特性是点函数,状态量的微分可以改成全微分,这个全微分的循环积分恒为零;⽽过程量不是热⼒状态的单值函数,即使在初、终态完全相同的情况下,过程量的⼤⼩与其中间经历的具体路径有关,过程量的微分不能写成全微分。
因此它的循环积分不是零⽽是⼀个确定的数值。
习题1-1 ⼀⽴⽅形刚性容器,每边长 1 m ,将其中⽓体的压⼒抽⾄ 1000 Pa ,问其真空度为多少毫⽶汞柱?容器每⾯受⼒多少⽜顿?已知⼤⽓压⼒为 0.1MPa 。
清华大学工程热力学思考题答案

一个常数? 答: 根据定压比热容和定容比热容的定义,以及理想气体状态方程可 以推导出,(见课本79页)。可见,两者之差为常数。
第二章 思考题参考答案
1. 工质膨胀时是否必须对工质加热?工质边膨胀边放热可能否? 工质边被压缩边入热量可以否?工质吸热后内能一定增加? 对工质加热,其温度反而降低,有否可能?
答:由闭口系统热力学第一定律关系式: 规定吸热,对外做功。
(1) 不一定;工质膨胀对外做功,,由于可以使,因此可能出现,即 对外放热;
态量。而这里所指的比热容并不是在以上特定过程下的比热容,因此仅
可以表示成为:。可见,这里所指的比热容是由两个参数决定的,且是
与过程有关的量。
7. 理想气体的内能和焓为零的起点是以它的压力值、还是以它的
温度值、还是压力和温度一起来规定的?
答:由于理想气体的内能和焓仅为温度的单值函数,与压力无关,因此
理想气体的内能和焓为零的起点是以它的温度值(热力学温度值)来规
1.进行任何热力分析是否都要选取热力系统? 答:是。热力分析首先应明确研究对象,根据所研究的问题人为地划定 一个或多个任意几何面所围成的空间,目的是确定空间内物质的总和。 2.引入热力平衡态解决了热力分析中的什么问题? 答:若系统处于热力平衡状态,对于整个系统就可以用一组统一的并具 有确定数值的状态参数来描述其状态,使得热力分析大为简化。 3.平衡态与稳定态的联系与差别。不受外界影响的系统稳定态是否是 平衡态? 答:平衡态和稳定态具有相同的外在表现,即系统状态参数不随时间变 化;两者的差别在于平衡态的本质是不平衡势差为零,而稳定态允许不 平衡势差的存在,如稳定导热。可见,平衡必稳定;反之,稳定未必平 衡。 根据平衡态的定义,不受外界影响的系统,其稳定态就是平衡态。 在不受外界影响(重力场除外)的条件下,如果系统的状态参数不随时 间变化,则该系统所处的状态称为平衡状态。 4.表压力或真空度为什么不能当作工质的压力?工质的压力不变化, 测量它的压力表或真空表的读数是否会变化? 答:由于表压力和真空度都是相对压力,而只有绝对压力才是工质的压 力。表压力与真空度与绝对压力的关系为: 其中为测量当地的大气压力。
工程热力学思考题及答案

工程热力学思考题及答案第一章基本概念1.闭口系与外界无物质交换,系统内质量保持恒定,那么系统内质量保持恒定的热力系一定是闭口系统吗?答:不一定。
稳定流动开口系统内质量也可以保持恒定。
2.有人认为,开口系统中系统与外界有物质交换,而物质又与能量不可分割,所以开口系统不可能是绝热系。
对不对,为什么?答:这种说法是不对的。
工质在越过边界时,其热力学能也越过了边界。
但热力学能不是热量,只要系统和外界没有热量的交换就是绝热系。
3.平衡状态与稳定状态有何区别和联系,平衡状态与均匀状态有何区别和联系?答:只有在没有外界影响的条件下,工质的状态不随时间变化,这种状态称之为平衡状态。
稳定状态只要其工质的状态不随时间变化,就称之为稳定状态,不考虑是否在外界的影响下,这是它们的本质区别。
平衡状态并非稳定状态之必要条件。
物系内部各处的性质均匀一致的状态为均匀状态。
平衡状态不一定为均匀状态,均匀并非系统处于平衡状态之必要条件。
4.假如容器中气体的压力没有改变,试问安装在该容器上的压力表的读数会改变吗?绝对压力计算公式p = p b+p e(p >p b),p v=p b−p (p b<p)中,当地大气压是否必定是环境大气压?答:压力表的读数可能会改变,根据压力仪表所处的环境压力的改变而改变。
当地大气压不一定是环境大气压。
环境大气压是指压力仪表所处的环境的压力。
5.温度计测温的基本原理是什么?答:温度计随物体的冷热程度不同有显著的变化。
6.经验温标的缺点是什么?为什么?答:任何一种经验温标不能作为度量温度的标准。
由于经验温标依赖于测温物质的性质,当选用不同测温物质的温度计、采用不同的物理量作为温度的标志来测量温度时,除选定为基准点的温度,其他温度的测定值可能有微小的差异。
7.促使系统状态变化的原因是什么?答:系统内部各部分之间的传热和位移或系统与外界之间的热量的交换与功的交换都是促使系统状态变化。
8.(1)将容器分成两部分,一部分装气体,一部分抽成真空,中间是隔板。
工程热力学思考题答案,第三章

工程热力学思考题答案,第三章TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-第三章理想气体的性质1.怎样正确看待“理想气体”这个概念在进行实际计算是如何决定是否可采用理想气体的一些公式答:理想气体:分子为不占体积的弹性质点,除碰撞外分子间无作用力。
理想气体是实际气体在低压高温时的抽象,是一种实际并不存在的假想气体。
判断所使用气体是否为理想气体(1)依据气体所处的状态(如:气体的密度是否足够小)估计作为理想气体处理时可能引起的误差;(2)应考虑计算所要求的精度。
若为理想气体则可使用理想气体的公式。
2.气体的摩尔体积是否因气体的种类而异是否因所处状态不同而异任何气体在任意状态下摩尔体积是否都是 0.022414m 3 /mol答:气体的摩尔体积在同温同压下的情况下不会因气体的种类而异;但因所处状态不同而变化。
只有在标准状态下摩尔体积为 0.022414m 3 /mol 3.摩尔气体常数 R 值是否随气体的种类不同或状态不同而异?答:摩尔气体常数不因气体的种类及状态的不同而变化。
4.如果某种工质的状态方程式为pv =R g T,那么这种工质的比热容、热力学能、焓都仅仅是温度的函数吗?答:一种气体满足理想气体状态方程则为理想气体,那么其比热容、热力学能、焓都仅仅是温度的函数。
5.对于一种确定的理想气体,()p v C C -是否等于定值?p v C C 是否为定值?在不同温度下()p v C C -、pv C C 是否总是同一定值?答:对于确定的理想气体在同一温度下()p v C C -为定值,pv C C 为定值。
在不同温度下()p v C C -为定值,pv C C 不是定值。
6.麦耶公式p v g C C R -=是否适用于理想气体混合物是否适用于实际气体答:迈耶公式的推导用到理想气体方程,因此适用于理想气体混合物不适合实际气体。
7.气体有两个独立的参数,u(或 h)可以表示为 p 和 v 的函数,即(,)u u f p v =。
工程热力学-课后思考题答案

第一章基本概念与定义1.答:不一定。
稳定流动开口系统内质量也可以保持恒定2.答:这种说法是不对的。
工质在越过边界时,其热力学能也越过了边界。
但热力学能不是热量,只要系统和外界没有热量地交换就是绝热系。
3.答:只有在没有外界影响的条件下,工质的状态不随时间变化,这种状态称之为平衡状态。
稳定状态只要其工质的状态不随时间变化,就称之为稳定状态,不考虑是否在外界的影响下,这是他们的本质区别。
平衡状态并非稳定状态之必要条件。
物系内部各处的性质均匀一致的状态为均匀状态。
平衡状态不一定为均匀状态,均匀并非系统处于平衡状态之必要条件。
4.答:压力表的读数可能会改变,根据压力仪表所处的环境压力的改变而改变。
当地大气压不一定是环境大气压。
环境大气压是指压力仪表所处的环境的压力。
5.答:温度计随物体的冷热程度不同有显著的变化。
6.答:任何一种经验温标不能作为度量温度的标准。
由于经验温标依赖于测温物质的性质,当选用不同测温物质的温度计、采用不同的物理量作为温度的标志来测量温度时,除选定为基准点的温度,其他温度的测定值可能有微小的差异。
7.答:系统内部各部分之间的传热和位移或系统与外界之间的热量的交换与功的交换都是促使系统状态变化的原因。
8.答:(1)第一种情况如图1-1(a),不作功(2)第二种情况如图1-1(b),作功(3)第一种情况为不可逆过程不可以在p-v图上表示出来,第二种情况为可逆过程可以在p-v图上表示出来。
9.答:经历一个不可逆过程后系统可以恢复为原来状态。
系统和外界整个系统不能恢复原来状态。
10.答:系统经历一可逆正向循环及其逆向可逆循环后,系统恢复到原来状态,外界没有变化;若存在不可逆因素,系统恢复到原状态,外界产生变化。
11.答:不一定。
主要看输出功的主要作用是什么,排斥大气功是否有用。
第二章 热力学第一定律1.答:将隔板抽去,根据热力学第一定律w u q +∆=其中0,0==w q 所以容器中空气的热力学能不变。
工程热力学第3章习题答案

可得
p1V1 p0V0
=
T1 T0
,
0.1×106 ×V1
1.01325×105 × 20000 ×10
=
273.15 +150 273.15
,得
V1
= 87.204m3/s
3600
由
π 4
D2
×c
= V1 ,可得烟囱出口处的内径
( ) 可得 p1 = T1 , ( ) p2 T2
0.1×106 − 60×103 0.1×106 − 90×T2
,得 T2
=
93.29K
需要将气体冷却到−179.86℃
3-5 某活塞式压气机向容积为 10m3 的储气箱中冲入压缩空气。压气机每分钟从压力为 p0=0.1MPa、温度 t0=20℃的大气中吸入 0.5m3 的空气。冲气前储气箱压力表的读数为 0.1MPa, 温度=20℃。问需要多长时间才能使储气箱压力表的读数提高到 0.5MPa,温度上升到 40℃?
T1
T1
根据题意,已知每分钟抽出空气的体积流量为 qV = 0.2m3/min
假设抽气时间为τ分钟,根据已知条件可得 p1V1 = p2 (V1 + qVτ )
质量流量为 qm
=
p2qV RgT1
=
0.1×106 × 5× 0.2
287 × 293.15× (5 + 0.2τ ) kg/min
∫ 因此需要抽气时间的计算为公式
或V = mv = 3× 0.0561 = 0.168m3
3-2 在煤气表上读得煤气的消耗量为 600m3。若在煤气消耗其间,煤气表压力平均值为 0.5 kPa,温度平均为 18℃,当地大气压力为=0.1MPa。设煤气可以按理想气体处理。试计算:
广大复习资料之工程热力学第三章思考题答案

第三章思考题3-1门窗紧闭的房间内有一台电冰箱正在运行,若敞开冰箱的大门就有一股凉气扑面,感到凉爽。
于是有人就想通过敞开冰箱大门达到降低室内温度的目的,你认为这种想法可行吗?解:按题意,以门窗禁闭的房间为分析对象,可看成绝热的闭口系统,与外界无热量交换,Q =0,如图3.1所示,当安置在系统内部的电冰箱运转时,将有电功输入系统,根据热力学规定:W <0,由热力学第一定律W U Q +∆=可知,0>∆U ,即系统的热力学能增加,也就是房间内空气的热力学能增加。
由于空气可视为理想气体,其热力学能是温度的单值函数。
热力学能增加温度也增加,可见此种想法不但不能达到降温目的,反而使室内温度有所升高。
3-2既然敞开冰箱大门不能降温,为什么在门窗紧闭的房间内安装空调器后却能使温度降低呢?解:仍以门窗紧闭的房间为对象。
由于空调器安置在窗上,通过边界向环境大气散热,这时闭口系统并不绝热,而且向外界放热,由于Q<0,虽然空调器工作时依旧有电功W 输入系统,仍然W<0,但按闭口系统能量方程:W Q U -=∆,此时虽然Q 与W 都是负的,但W Q >,所以∆U<0。
可见室内空气热力学能将减少,相应地空气温度将降低。
3-6 下列各式,适用于何种条件?(说明系统、工质、过程)1)δq=du+ δw ;适用于闭口系统、任何工质、任何过程2)δq=du+ pdv ;适用于闭口系统、任何工质、可逆过程3)δq=c v dT+ pdv ;适用于闭口系统、理想气体、任何过程4)δq=dh ;适用于开口系统、任何工质、稳态稳流定压过程5)δq=c p dT- vdp 适用于开口系统、理想气体、可逆过程3-8对工质加热,其温度反而降低,有否可能?答:有可能,如果工质是理想气体,则由热力学第一定律Q=ΔU+W 。
理想气体吸热,则Q>0,降温则ΔT<0,对于理想气体,热力学能是温度的单值函数,因此,ΔU <0。
工程热力学思考题答案,第三章

第三章 理想气体的性质1.怎样正确看待“理想气体”这个概念在进行实际计算是如何决定是否可采用理想气体的一些公式答:理想气体:分子为不占体积的弹性质点,除碰撞外分子间无作用力。
理想气体是实际气体在低压高温时的抽象,是一种实际并不存在的假想气体。
判断所使用气体是否为理想气体(1)依据气体所处的状态(如:气体的密度是否足够小)估计作为理想气体处理时可能引起的误差;(2)应考虑计算所要求的精度。
若为理想气体则可使用理想气体的公式。
2.气体的摩尔体积是否因气体的种类而异是否因所处状态不同而异任何气体在任意状态下摩尔体积是否都是 0.022414m 3 /mol答:气体的摩尔体积在同温同压下的情况下不会因气体的种类而异;但因所处状态不同而变化。
只有在标准状态下摩尔体积为 0.022414m 3 /mol3.摩尔气体常数 R 值是否随气体的种类不同或状态不同而异 答:摩尔气体常数不因气体的种类及状态的不同而变化。
4.如果某种工质的状态方程式为pv =R g T ,那么这种工质的比热容、热力学能、焓都仅仅是温度的函数吗答:一种气体满足理想气体状态方程则为理想气体,那么其比热容、热力学能、焓都仅仅是温度的函数。
5.对于一种确定的理想气体,()p v C C 是否等于定值pv C C 是否为定值在不同温度下()p v C C -、pv C C 是否总是同一定值答:对于确定的理想气体在同一温度下()p v C C -为定值,pv C C 为定值。
在不同温度下()p v C C -为定值,pv C C 不是定值。
6.麦耶公式p v g C C R -=是否适用于理想气体混合物是否适用于实际气体答:迈耶公式的推导用到理想气体方程,因此适用于理想气体混合物不适合实际气体。
7.气体有两个独立的参数,u(或 h)可以表示为 p 和 v 的函数,即(,)u u f p v =。
但又曾得出结论,理想气体的热力学能、焓、熵只取决于温度,这两点是否矛盾为什么答:不矛盾。
工程热力学第三章课后答案

第三章 气体和蒸气的性质3−1 已知氮气的摩尔质量328.110 kg/mol M −=×,求: (1)2N 的气体常数g R ;(2)标准状态下2N 的比体积v 0和密度ρ0; (3)标准状态31m 2N 的质量m 0;(4)0.1MPa p =、500C t =D 时2N 的比体积v 和密度ρ; (5)上述状态下的摩尔体积m V 。
解:(1)通用气体常数8.3145J/(mol K)R =⋅,查附表23N 28.0110kg/mol M −=×。
22g,N 3N8.3145J/(mol K)0.297kJ/(kg K)28.0110kg/molR R M −⋅===⋅×(2)1mol 氮气标准状态时体积为22233m,N N N 22.410m /mol V M v −==×,故标准状态下2233m,N 3N 322.410m /mol 0.8m /kg28.0110kg/molV v M −−×===×223N 3N111.25kg/m 0.8m /kgv ρ===(3)标准状态下31m 气体的质量即为密度ρ,即0 1.25kg m =。
(4)由理想气体状态方程式g pv R T=g 36297J/(kg K)(500273)K2.296m /kg0.110Pa R T v p ⋅×+===×33110.4356kg/m 2.296m /kgv ρ===(5)2223333m,N N N 28.0110kg/mol 2.296m /kg 64.2910m /mol V M v −−==××=×3-2 压力表测得储气罐中丙烷38C H 的压力为4.4MPa ,丙烷的温度为120℃,问这时比体积多大?若要储气罐存1 000kg 这种状态的丙烷,问储气罐的体积需多大?解:由附表查得383C H 44.0910kg/mol M −=×3838g,C H 3C H8.3145J/(mol K)189J/(kg K)44.0910kg/molR R M −⋅===⋅×由理想气体状态方程式g pv R T=g 36189J/(kg K)(120273)K0.01688m /kg4.410PaR T v p⋅×+===×331000kg 0.01688m /kg 16.88m V mv ==×=或由理想气体状态方程g pV mR T=g 361000kg 189J/(kg K)(120273)K16.88m 4.410PamR T V p×⋅×+===×3−3 供热系统矩形风管的边长为100mm ×175mm ,40℃、102kPa 的空气在管内流动,其体积流量是0.018 5m 3/s ,求空气流速和质量流量。
工程热力学第三章答案

1、已知某气体的分子量为29,求:(1)气体常数;(2)标准状态 下的比体积及千摩尔容积;(3)在P = 0.1MPa,20℃时的比体积及 千摩尔容积。
解: (1)气体常数 R
R Rm 8.314 0.287 kJ/(kgK) M 29
(2)标准状态下的比体积及千摩尔容积 因为气体处于标准状态,所以 p = 101.325kPa,T = 273K,又因为 p RT
506.2 0.444 p 120 (1.004 ln 0.287 ln ) 673 p 506.2 0.556 p 150 ((1.004 ln 0.287 ln ) 373 p 64.9 kJ/(kg h)
8、一绝热刚性容器被隔板分成A、B两部分。A中有压力为0.3MPa、温度为200℃的氮 气,容 积为0.6m3;B中有压力为1MPa、温度为20℃的氧气,容积为1.3m3.现抽去隔板, 两种气体均匀混合。若比热容视为定值,求:(1)混合气体的温度;(2)混合气体的压 力;(3)混合过程各气体的熵变和总熵变。
3、某储罐容器为3m3,内有空气,压力指示为0.3MPa,温度计读数为15℃,现由压缩机每
分钟从压力为0.1MPa,温度为12℃的大气中吸入0.2m3的空气,经压缩后送入储罐,问经多长 时间可使储罐内气体压力升高到1MPa、温度升到50℃?
解:由题意知:
因为:
pV NRmT N
pV RmT
RT 0.287 273 0.773 m3 /kg p 101.325
3 V mv 29 0.773 22.4 m /kmol 千摩尔容积:
1、已知某气体的分子量为29,求:(1)气体常数;(2)标准状态 下的比体积及千摩尔容积;(3)在P = 0.1MPa,20℃时的比体积及 千摩尔容积。
工程热力学与传热学第三章作业参考答案
“山水之乐”的具体化。3.第三段同样是写“乐”,但却是写的游人之乐,作者是如何写游人之乐的?明确:“滁人游”,前呼后应,扶老携幼,自由自在,热闹非凡;“太守宴”,溪深鱼肥,泉香酒洌,美味佳肴,应有尽有;“众宾欢”,投壶下棋,觥筹交错,说说笑笑,无拘无束。如此勾画了游人之乐。4.作者为什么要在第三段写游人之乐?明确:写滁人之游,
贯穿全篇,却有两个句子别出深意,不单单是在写乐,而是另有所指,表达出另外一种情绪,请你找出这两个句子,说说这种情绪是什么。明确:醉翁之意不在酒,在乎山水之间也。醉能同其乐,醒能述以文者,太守也。这种情绪是作者遭贬谪后的抑郁,作者并未在文中袒露胸怀,只含蓄地说:“醉能同其乐,醒能述以文者,太守也。”此句与醉翁亭的名称、“醉翁之
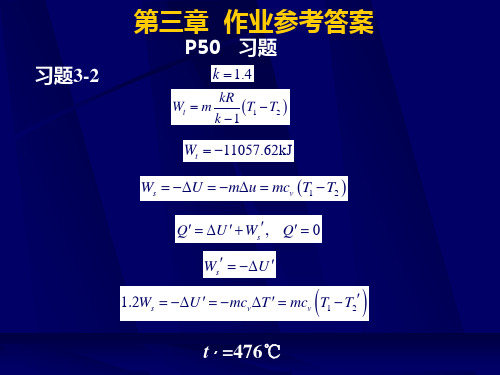
p50习题习题3214476p50习题习题33lnlnp50习题习题351331可逆绝热过程2自由膨胀lnln576kjkmcmr理想气体定值比热及比热比单原子双原子多原子摩尔定容比热ckjkmolk摩尔定压比热ckjkmolk比热比k16714129当计算精度要求不高或气体处于较低温度范围常采用定值比热忽略比热与温度的关系
Ws U mu mcv T1 T2 1746.3kJ
S 0
(2)自由膨胀
Ws 0 Q 0, U 0 T2 T1 340K
S
mcv
ln T2 T1
mR ln
v2 v1
5.76kJ/K
当计算精度要求不高,或气体处于较低温度 范围,常采用定值比热,忽略比热与温度的关系。 不同气体在标准状态下均为22.4m3,不同气体只 要其原子数相同则其摩尔定值比热相等。
江西)人,因吉州原属庐陵郡,因此他又以“庐陵欧阳修”自居。谥号文忠,世称欧阳文忠公。北宋政治家、文学家、史学家,与韩愈、柳宗元、王安石、苏洵、苏轼、苏辙、曾巩合称“唐宋八大家”。后人又将其与韩愈、柳宗元和苏轼合称“千古文章四大家”。
工程热力学思考题及答案

工程热力学思考题及答案第一章基本概念1.闭口系与外界无物质交换,系统内质量保持恒定,那么系统内质量保持恒定的热力系一定是闭口系统吗?答:不一定。
稳定流动开口系统内质量也可以保持恒定。
2.有人认为,开口系统中系统与外界有物质交换,而物质又与能量不可分割,所以开口系统不可能是绝热系。
对不对,为什么?答:这种说法是不对的。
工质在越过边界时,其热力学能也越过了边界。
但热力学能不是热量,只要系统和外界没有热量的交换就是绝热系。
3.平衡状态与稳定状态有何区别和联系,平衡状态与均匀状态有何区别和联系?答:只有在没有外界影响的条件下,工质的状态不随时间变化,这种状态称之为平衡状态。
稳定状态只要其工质的状态不随时间变化,就称之为稳定状态,不考虑是否在外界的影响下,这是它们的本质区别。
平衡状态并非稳定状态之必要条件。
物系内部各处的性质均匀一致的状态为均匀状态。
平衡状态不一定为均匀状态,均匀并非系统处于平衡状态之必要条件。
4.假如容器中气体的压力没有改变,试问安装在该容器上的压力表的读数会改变吗?绝对压力计算公式p = p b+p e(p >p b),p v=p b−p (p b<p)中,当地大气压是否必定是环境大气压?答:压力表的读数可能会改变,根据压力仪表所处的环境压力的改变而改变。
当地大气压不一定是环境大气压。
环境大气压是指压力仪表所处的环境的压力。
5.温度计测温的基本原理是什么?答:温度计随物体的冷热程度不同有显著的变化。
6.经验温标的缺点是什么?为什么?答:任何一种经验温标不能作为度量温度的标准。
由于经验温标依赖于测温物质的性质,当选用不同测温物质的温度计、采用不同的物理量作为温度的标志来测量温度时,除选定为基准点的温度,其他温度的测定值可能有微小的差异。
7.促使系统状态变化的原因是什么?答:系统内部各部分之间的传热和位移或系统与外界之间的热量的交换与功的交换都是促使系统状态变化。
8.(1)将容器分成两部分,一部分装气体,一部分抽成真空,中间是隔板。
工程热力学第三章习题参考答案

第三章 热力学第一定律 习题参考答案思考题3-1门窗紧闭的房间……答:按题意,以房间(空气+冰箱)为对象,可看成绝热闭口系统,与外界无热量交换,Q=0电冰箱运转时,有电功输入,即W 为负值,按闭口系统能量方程:WU +Δ=0 或即热力学能增加,温度上升。
0>−=ΔW U 3-6 下列各式,适用于何种条件? 答:答案列于下表公式适用条件w du q δδ+= 闭口系统,任何工质,任何过程,不论可逆与不可逆 pdv du q +=δ 闭口系统,任何工质,可逆过程 pdv dT c q v +=δ闭口系统,理想气体,可逆过程dh q =δ 闭口系统,定压过程; 或开口系统与环境无技术功交换。
vdp dT c q v −=δ开口系统,理想气体,稳态稳流,可逆过程3-10 说明以下结论是否正确: (提示:采用推理原则,否定原则) ⑴ 气体吸热后一定膨胀,热力学能一定增加。
答:错误,如等容过程吸热后不膨胀;如不是等容过程吸热后热力学能也不一定增加,当对外净输出功量大于吸热量时,则热力学能不增加。
⑵ 气体膨胀一定对外作功。
答:错误,如气体向真空膨胀则不作功,另外气体膨胀对外作膨胀功的充要条件是:气体膨胀和要有功的传递和接受机构。
⑶ 气体压缩时,一定消耗外功。
答:错误,如处于冷却过程的简单可压缩系统,则会自发收缩(相当于被压缩),并不消耗外功。
⑷ 应设法利用烟气离开锅炉时带走的热量。
答:错误不应说设法利用烟气离开锅炉时带走的热量。
因为热量是过程量,不发生则不存在。
应该说设法利用烟气离开锅炉时带走的热能(或热焓)。
习 题3-1 已知:min 202000/400===time N hkJ q 人人求:?=ΔU 解:依题意可将礼堂看作绝热系统,思路:1、如何选取系统?2、如何建立能量方程? ⑴ 依题意,选取礼堂空气为系统,人看作环境,依热力学第一定律,建立能量方程:kJ time N q Q U W W Q U 51067.2602020004000×=××=⋅⋅==Δ∴=−=Δ人Q⑵ 如选“人+空气”作系统, 依据热力学第一定律:W Q U −=Δ0,0,0=Δ∴==U Q W Q如何解释空气温度升高:该系统包括“人+空气”两个子系统 ,人散热给空气,热力学能降低,空气吸热,能内升高,二者热力学能代数和为零。
工程热力学思考题及答案

⼯程热⼒学思考题及答案⼯程热⼒学思考题及答案第⼀章基本概念1.闭⼝系与外界⽆物质交换,系统内质量保持恒定,那么系统内质量保持恒定得热⼒系⼀定就是闭⼝系统吗?答:不⼀定。
稳定流动开⼝系统内质量也可以保持恒定。
2.有⼈认为,开⼝系统中系统与外界有物质交换,⽽物质⼜与能量不可分割,所以开⼝系统不可能就是绝热系。
对不对,为什么?答:这种说法就是不对得。
⼯质在越过边界时,其热⼒学能也越过了边界。
但热⼒学能不就是热量,只要系统与外界没有热量得交换就就是绝热系。
3.平衡状态与稳定状态有何区别与联系,平衡状态与均匀状态有何区别与联系?答:只有在没有外界影响得条件下,⼯质得状态不随时间变化,这种状态称之为平衡状态。
稳定状态只要其⼯质得状态不随时间变化,就称之为稳定状态,不考虑就是否在外界得影响下,这就是它们得本质区别。
平衡状态并⾮稳定状态之必要条件。
物系内部各处得性质均匀⼀致得状态为均匀状态。
平衡状态不⼀定为均匀状态,均匀并⾮系统处于平衡状态之必要条件。
4.假如容器中⽓体得压⼒没有改变,试问安装在该容器上得压⼒表得读数会改变吗?绝对压⼒计算公式p= p b+pe(p>p b),p v=p b?p (p b答:压⼒表得读数可能会改变,根据压⼒仪表所处得环境压⼒得改变⽽改变。
当地⼤⽓压不⼀定就是环境⼤⽓压。
环境⼤⽓压就是指压⼒仪表所处得环境得压⼒。
5.温度计测温得基本原理就是什么?答:温度计随物体得冷热程度不同有显著得变化。
6.经验温标得缺点就是什么?为什么?答:任何⼀种经验温标不能作为度量温度得标准。
由于经验温标依赖于测温物质得性质,当选⽤不同测温物质得温度计、采⽤不同得物理量作为温度得标志来测量温度时,除选定为基准点得温度,其她温度得测定值可能有微⼩得差异。
7.促使系统状态变化得原因就是什么?答:系统内部各部分之间得传热与位移或系统与外界之间得热量得交换与功得交换都就是促使系统状态变化。
8.(1)将容器分成两部分,⼀部分装⽓体,⼀部分抽成真空,中间就是隔板。
经典:工程热力学第三章答案

(3)在 p = 0.1MPa,20℃时的比体积及千摩尔容积 因为 p = 0.1MPa = 100 kPa,T = 20℃ = 293K
pv RT
v RT 0.287 293 0.841 m3 /kg
p
100
千摩尔容积: V mv 29 0.841 24.39 m3 /kmol 。
m mA mB 120 150 270 kg/h
xA
mA m
120 270
0.444
因为气体处于标准状态,所以 p = 101.325kPa,T = 273K,又因为 p RT
RT 0.287 273 0.773 m3 /kg
p 101.325
千摩尔容积: V mv 29 0.773 222.4 m3 /kmol
1、已知某气体的分子量为29,求:(1)气体常数;(2)标准状态 下的比体积及千摩尔容积;(3)在P = 0.1MPa,20℃时的比体积及 千摩尔容积。
u cv (T2 T1) 由附表3查得空气的比定压热容:
cv 0.716 kJ/(kg K)
所以
u 0.716 (600 300) 214.8 kJ/kg
② 空气熵的变化:
因为
s
cp
ln T2 T1
R ln
p2 p1
又因为空气是定压加热的,所以
故
p1
p2
ln
p2 p1
0
s
cp
ln
T2 T1
kJ/kg
6
(3).按比热容经验公式计算 查附表2知:
cp.m 28.15 1.967 103T 4.801106T 2 1.966 109T 3
空气分子量M = 29,则
q h 600 cp.m dT
工程热力学思考题及答案

工程热力学思考题及答案第一章基本概念1.闭口系与外界无物质交换,系统内质量保持恒定,那么系统内质量保持恒定的热力系一定是闭口系统吗?答:不一定。
稳定流动开口系统内质量也可以保持恒定。
2.有人认为,开口系统中系统与外界有物质交换,而物质又与能量不可分割,所以开口系统不可能是绝热系。
对不对,为什么?答:这种说法是不对的。
工质在越过边界时,其热力学能也越过了边界。
但热力学能不是热量,只要系统和外界没有热量的交换就是绝热系。
3.平衡状态与稳定状态有何区别和联系,平衡状态与均匀状态有何区别和联系?答:只有在没有外界影响的条件下,工质的状态不随时间变化,这种状态称之为平衡状态。
稳定状态只要其工质的状态不随时间变化,就称之为稳定状态,不考虑是否在外界的影响下,这是它们的本质区别。
平衡状态并非稳定状态之必要条件。
物系内部各处的性质均匀一致的状态为均匀状态。
平衡状态不一定为均匀状态,均匀并非系统处于平衡状态之必要条件。
4.假如容器中气体的压力没有改变,试问安装在该容器上的压力表的读数会改变吗?绝对压力计算公式p = p b+p e(p >p b),p v=p b−p (p b<p)中,当地大气压是否必定是环境大气压?答:压力表的读数可能会改变,根据压力仪表所处的环境压力的改变而改变。
当地大气压不一定是环境大气压。
环境大气压是指压力仪表所处的环境的压力。
5.温度计测温的基本原理是什么?答:温度计随物体的冷热程度不同有显著的变化。
6.经验温标的缺点是什么?为什么?答:任何一种经验温标不能作为度量温度的标准。
由于经验温标依赖于测温物质的性质,当选用不同测温物质的温度计、采用不同的物理量作为温度的标志来测量温度时,除选定为基准点的温度,其他温度的测定值可能有微小的差异。
7.促使系统状态变化的原因是什么?答:系统内部各部分之间的传热和位移或系统与外界之间的热量的交换与功的交换都是促使系统状态变化。
8.(1)将容器分成两部分,一部分装气体,一部分抽成真空,中间是隔板。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3-1门窗紧闭的房间内有一台电冰箱正在运行,若敞开冰箱的大门就有一股凉气扑面,感到凉爽。
于是有人就想通过敞开冰箱大门达到降低室内温度的目的,你认为这种想法可行吗? 解:按题意,以门窗禁闭的房间为分析对象,可看成绝热的闭口系统,与外界无热量交换,Q =0,如图所示,当安置在系统内部的电冰箱运转时,将有电功输入系统,根据热力学规定:W <0,由热力学第一定律W U Q +∆=可知,0>∆U ,即系统的热力学能增加,也就是房间内空气的热力学能增加。
由于空气可视为理想气体,其热力学能是温度的单值函数。
热力学能增加温度也增加,可见此种想法不但不能达到降温目的,反而使室内温度有所升高。
3-2既然敞开冰箱大门不能降温,为什么在门窗紧闭的房间内安装空调器后却能使温度降低呢?
解:仍以门窗紧闭的房间为对象。
由于空调器安置在窗上,通过边界向环境大气散热,这时闭口系统并不绝热,而且向外界放热,由于Q<0,虽然空调器工作时依旧有电功W 输入系统,仍然W<0,但按闭口系统能量方程:W Q U -=∆,此时虽然Q 与W 都是负的,但W Q >,所以∆U<0。
可见室内空气热力学能将减少,相应地空气温度将降低。
3-6 下列各式,适用于何种条件?(说明系统、工质、过程)
1)q=du+ w ;适用于闭口系统、任何工质、任何过程 2)q=du+ pdv ;适用于闭口系统、任何工质、可逆过程
3)q=c v dT+ pdv ;适用于闭口系统、理想气体、任何过程
4)q=dh ;适用于开口系统、任何工质、稳态稳流定压过程
5)q=c p dT- vdp 适用于开口系统、理想气体、可逆过程
3-8 对工质加热,其温度反而降低,有否可能?
答:有可能,如果工质是理想气体,则由热力学第一定律Q=ΔU+W。
理想气体吸热,则Q>0,降温则ΔT<0,对于理想气体,热力学能是温度的单值函数,因此,ΔU <0。
在此过程中,当气体对外作功,W>0,且气体对外作功大于热力学能降低的量,则该过程遵循热力学第一定律,因此,理想气体能进行吸热而降温的过程。
3-9 “任何没有容积变化的过程就一定不对外做功“这种说法对吗?说明理由。
答:这种说法不正确。
系统与外界传递的功不仅仅是容积功,还有轴功等形式,因此,系统经历没有容积变化的过程也可以对外界做功。
3-10 说明以下论断是否正确:
1)气体吸热后一定膨胀,热力学能一定增加;
答:不正确。
由热力学第一定律Q=ΔU+W,气体吸热,Q>0,可能使热力学能增加,也可能膨胀做功。
2)气体膨胀时一定对外做功;
答:不正确。
自由膨胀就不对外做功。
容积变化是做膨胀功的必要条件,不是充分条件。
3)气体压缩时一定消耗外功;
答:不正确。
气体冷却时容积缩小但是不用消耗外功。
4)应设法利用烟气离开锅炉时带走的热量。
答:不正确。
热量是过程量,应该是“应设法利用烟气离开锅炉时带走的热能。
”。
