化药原药构成
化药4类申报资料清单
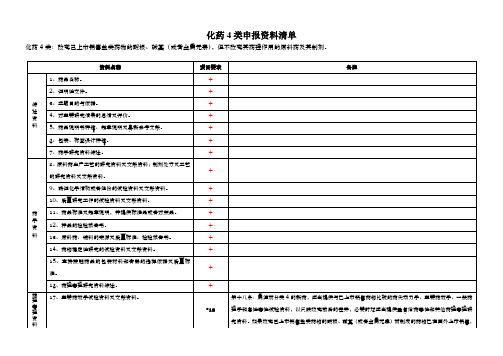
化药4类:改变己上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
资料名称
项目要求
备注
综述资料
1、药品名称。
+
2、证明性文件。
+
3、立题目的与依据。
+
4、对主要研究结果的总结及评价。
+
5、药品说明书样稿、起草说明及最新参考文献。
+
6、包装、标签设计样稿。
+
14、药物稳定性研究的试验资料及文献资料。
+
15、直接接触药品的包装材料和容器的选择依据及质量标准。
+
16、药理毒理研究资料综述。
+
药理毒理资料注册分类4的新药,应当提供与已上市销售药物比较的药代动力学、主要药效学、一般药理学和急性毒性试验资料,以反映改变前后的差异,必要时还应当提供重复给药毒性和其他药理毒理研究资料。如果改变己上市销售盐类药物的酸根、碱基(或者金属元素)而制成的药物已在国外上市销售,则按注册分类3的申报资料要求办理。
18、一般药理学研究的试验资料及文献资料。
*18
19、急性毒性试验资料及文献资料。
*18
20、长期毒性试验资料及文献资料。
*18
21、过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激牲、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献资料。
*19
第十九条:局部用药除按所属注册分类及项目报送相应资料外,应当报送资料项目21,必要时应当进行局部吸收试验。
23、致突变试验资料及文献资料。
±
可以用文献资料代替试验资料
24、生殖毒性试验资料及文献资料。
±
可以用文献资料代替试验资料
化学药物原料药制备工艺

IV类:药品
还包括药品中间体
精品医学ppt
211
药品主控文件内容
I类活性原料药(公开和保密部分)
原料药
题目
申办者的(“公开”) “保密”部
部分
分
+
+
3.2.S.1一般信息(名称、结构、性
+
质)
3.2.S.2生产
+
+
3.2.S.2.1生产商
+
3.2.S.2.2生产工艺及质量控制描述 流程图和简要描述
精品医学ppt
204
《药品注册管理办法》第九十五条:“申请 进口药品制剂,…… 原料药和辅料尚未取得 国家食品药品监督管理局批准的,则应当报 送有关生产工艺、质量指标和检验方法等规 范的研究资料。”
精品医学ppt
205
❖ 附件2规定----
申请制剂的,应提供原料药的合法来源证 明文件,包括:
---原料药的批准证明文件 ---药品质量标准 ---检验报告 ---原料药生产企业的三证(营业执照、《药品生 产许可证》、《药品生产质量管理规范》认证证书) --- 销售发票 --- 供货协议
精品医学ppt
209
国外(欧美、加拿大等)--· 一般无批准文号,随制剂管理申报
- 制剂厂自产的原料药:与制剂资料一并申报 - 制剂厂外购的原料药:采用药品主卷(DMF, Drug Master File)模式
· 欧洲药典收载的原料药,审评通过后有批准文号 --“欧洲药典适用性证书”(Certificate of Suitability to Monographs of the European Pharmacopoeia,COS,或称CEP)
关于农药原药中的水分、灰分、不溶物以及颗粒物、酸碱度和溶剂

理论 上讲 , 几 乎 所 有 的 农 药 原 药 都 会 合 有 一 定 量 的水 分。 水 分 可 以 由生 产 过程 中所 用 各 种 原 料 携 带 而来 , 可 以是 反 应 副产 物 , 可 以 是 作 为 反 应 介质 或 原 料 而 有 意 加 入 的 水 , 还 可 以是 原 药 产 品 在 操 作 和 储 存 过 程 中 从 空气 中 吸入 或 裹 带 的 水
通用 的水分 测定 方法主 要有 ( 1 ) 热干燥法 : 包 括 常 压 干燥 法 真 空
干燥 法 ( 有 的样 品加热 分解 时用 )j 红 外 线 干 燥 法 真 空 器干 燥 法 ( 干
工和使用的影 响 ( 如 颗粒 物可 能 堵 塞喷头 ) 。 后 面这 些 内 容 则 更 多 是 属 于 物 理 性 质 的。 所 以 原 药 质量 标 准大体 包 括 产 品组 成 “ 和 物理 性质 ” 两 个 部 分 的 内 容。 这 在 F A O / WH O
同材 料或物料 ( 如食 品、土壤、化
表 1 0 I P A C手 册 中所 载 农 药 样 品 水 分 测 定 方 法
卡尔费休法 (MT 3 0)
样 品溶解在甲醇中 , 用已知水当量的标准的卡尔费休试剂滴定。
D e a n和 S t a r k 方法 (MT 3 0 2)
分。当然不 同的原药含水量是不同
的 ,比如 易 吸潮 的原 药 含 水 量 可 能 会 比 较 高 。水 分 对 于 原 药 的 影 响 也
于农药产品中的水分测定。 可以根
据 样 品 特 性 和方 法 的 适 用 范 围选 择 使用。可惜 的是 , C J C在 介 绍 方 法 是 在 很 多 时候 没 有 明 确 说 明方 法 的适用范围 , 需 要 使 用者 依 据 经 验 和 可行性 酌情 选用 。
化学药物(原料药和制剂)稳定性研究技术指导原则

化学药物(原料药和制剂)稳定性研究技术指导原则一、概述原料药或制剂的稳定性是指其保持物理、化学、生物学和微生物学特性的能力。
稳定性研究是基于对原料药或制剂及其生产工艺的系统研究和理解,通过设计试验获得原料药或制剂的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此为药品的处方、工艺、包装、贮藏条件和复验期/有效期的确定提供支持性信息。
稳定性研究始于药品研发的初期,并贯穿于药品研发的整个过程。
本指导原则为原料药和制剂稳定性研究的一般性原则,其主要适用于新原料药、新制剂及仿制原料药、仿制制剂的上市申请(NDA/ANDA,New Drug Application/Abbreviated New Drug Application),其他如创新药(NCE,New Chemical Entity)的临床申请(IND,Investigational New Drug Application)、上市后变更(Variation Application)申请等的稳定性研究,应遵循药物研发的规律,参照创新药不同临床阶段质量控制研究、上市后变更研究技术指导原则的具体要求进行。
本指导原则是基于目前认知的考虑,其他方法如经证明合理也可采用。
二、稳定性研究的基本思路(一)稳定性研究的内容及试验设计稳定性研究是原料药或制剂质量控制研究的重要组成部分,其是通过设计一系列的试验来揭示原料药和制剂的稳定性特征。
稳定性试验通常包括强制条件试验、加速试验和长期试验等。
强制条件试验主要是考察原料药或制剂对光、湿、热、酸、碱、氧化等的稳定性,了解其对光、湿、热、酸、碱、氧化等的敏感性,主要的降解途径及降解产物,并据此进一步验证所用分析方法的可行性、确定加速试验的放臵条件及为选择合适的包装材料提供参考。
加速试验是考察原料药或制剂在高于长期贮藏温度和湿度条件下的稳定性,为处方工艺设计、偏离实际贮藏条件其是否依旧能保持质量稳定提供依据,并根据试验结果确定是否需要进行中间条件下的稳定性试验及确定长期试验的放臵条件。
化药分类和所做临床试验
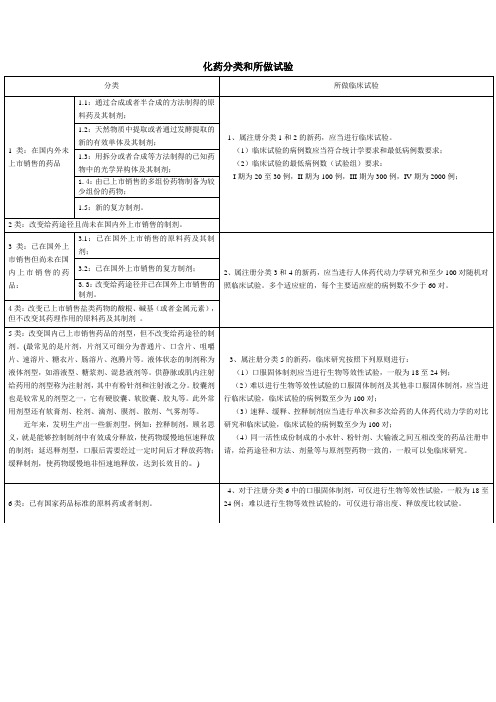
化药分类和所做试验分类所做临床试验1类:在国内外未上市销售的药品1.1:通过合成或者半合成的方法制得的原料药及其制剂;1、属注册分类1和2的新药,应当进行临床试验。
(1)临床试验的病例数应当符合统计学要求和最低病例数要求;(2)临床试验的最低病例数(试验组)要求:I期为20至30例,II期为100例,III期为300例,IV期为2000例;1.2:天然物质中提取或者通过发酵提取的新的有效单体及其制剂;1.3:用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;1.4:由已上市销售的多组份药物制备为较少组份的药物;1.5:新的复方制剂。
2类:改变给药途径且尚未在国内外上市销售的制剂。
3类:已在国外上市销售但尚未在国内上市销售的药品:3.1:已在国外上市销售的原料药及其制剂;2、属注册分类3和4的新药,应当进行人体药代动力学研究和至少100对随机对照临床试验。
多个适应症的,每个主要适应症的病例数不少于60对。
3.2:已在国外上市销售的复方制剂;3.3:改变给药途径并已在国外上市销售的制剂。
4类:改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5类:改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
(最常见的是片剂,片剂又可细分为普通片、口含片、咀嚼片、速溶片、糖衣片、肠溶片、泡腾片等。
液体状态的制剂称为液体剂型,如溶液型、糖浆剂、混悬液剂等。
供静脉或肌内注射给药用的剂型称为注射剂,其中有粉针剂和注射液之分。
胶囊剂也是较常见的剂型之一,它有硬胶囊、软胶囊、胶丸等。
此外常用剂型还有软膏剂、栓剂、滴剂、膜剂、散剂、气雾剂等。
近年来,发明生产出一些新剂型,例如:控释制剂,顾名思义,就是能够控制制剂中有效成分释放,使药物缓慢地恒速释放的制剂;延迟释剂型,口服后需要经过一定时间后才释放药物;缓释制剂,使药物缓慢地非恒速地释放,达到长效目的。
)3、属注册分类5的新药,临床研究按照下列原则进行:(1)口服固体制剂应当进行生物等效性试验,一般为18至24例;(2)难以进行生物等效性试验的口服固体制剂及其他非口服固体制剂,应当进行临床试验,临床试验的病例数至少为100对;(3)速释、缓释、控释制剂应当进行单次和多次给药的人体药代动力学的对比研究和临床试验,临床试验的病例数至少为100对;(4)同一活性成份制成的小水针、粉针剂、大输液之间互相改变的药品注册申请,给药途径和方法、剂量等与原剂型药物一致的,一般可以免临床研究。
化学原料药定义

化学原料药定义
化学原料药是指用于制造药品的化学物质,它们是制药过程中的主要原材料。
化学原料药的质量和纯度对最终药品的质量和效果具有决定性的影响。
与之相对的是天然药物,天然药物是从植物、动物或矿物等天然来源中提取的药物成分。
化学原料药可以分为有机化学原料药和无机化学原料药两大类。
有机化学原料药是指通过有机合成的方法制备的药物原料,通常是从天然物质中经过多个步骤的反应合成而来。
无机化学原料药则是指通过无机合成的方法制备的药物原料,无机合成通常指的是使用无机化学反应产生特定物质。
化学原料药的制备过程通常包括合成、提取、纯化等步骤。
合成是指通过化学反应合成所需的化学物质,这需要控制反应条件、催化剂的选择以及反应物的纯度等因素。
提取是指从天然植物、动物或矿物中提取所需的化学物质,通常是通过溶剂萃取或其他分离技术实现的。
纯化则是指对提取或合成的物质进行纯度提高的过程,常用的纯化方法包括结晶、过滤、蒸馏等。
化学原料药的质量要求非常严格,包括纯度、杂质含量、晶型、结晶度等指标。
高纯度的化学原料药可以提高药品的纯度和药效,减少副作用和毒性。
化学原料药的生产一般需要依据药品质量标准制定相应的合成工艺和质量控制规范,并经过严格的质量检验。
化学原料药是现代药物生产的关键环节,它们的研发和生产对于保障药品质量、提高药效以及降低成本具有重要意义。
随着化学合成技术和分析技术的不断发展,化学原料药的质量和纯度得到了大幅提升。
针对某些特定疾病,通过合理设计、优化合成和改进生产工艺,可以制备更高效的化学原料药,为临床治疗提供更好的选择。
原药的概念

原药的概念原药又称为原料药,是指制药工业生产药物所必需的原始物质,是制药过程中的基础。
原药可以是动物、植物、矿物或化学合成的物质,具有药理活性。
它是合成或提取药物时的起始物质,经过一系列的物理或化学处理后,可以得到最终的药物制剂。
从化学角度来说,原药是指一种或多种具有特定药理活性的化学物质。
这些化学物质可以是从动植物中提取得到的天然产物,也可以是化学合成的化合物。
无论是天然产物还是化学合成的物质,只要具有一定的药理活性,并能通过一定的制备工艺制备成药物,就可以称为原药。
原药可以分为天然药和人工合成药两大类。
天然药是指直接来源于动植物的物质,如青蒿素、鸦片等。
这些天然药物具有较为复杂的化学结构,通常需要经过提取、分离、纯化等多个步骤才能得到。
人工合成药是指由人工合成的化学物质,如阿司匹林、维生素C等。
这些人工合成的药物可以通过化学反应从简单的起始物质合成得到,具有较为简单和明确的化学结构。
原药的质量与纯度对最终制剂的药效具有重要影响。
较低纯度的原药可能含有其他的杂质,这些杂质可能对人体健康产生不良影响,或者影响药物的稳定性和药效。
因此,在制备药物制剂时,必须确保原药的纯度和质量符合制药工艺要求。
原药的生产通常需要依赖于农业、化工、生物技术等多学科的知识和技术。
在药物的研发和生产过程中,需要对原药进行多种研究和分析,以确保原药的质量和安全性。
研究人员需要深入了解原药的化学性质、结构活性关系、药代动力学等方面的知识,以指导原药的选择和药物的合成制备。
随着科学技术的不断发展,原药的制备技术也在不断更新。
传统的原药提取和分离方法有时效率较低、成本较高,并且难以实现大规模生产。
因此,研究人员不断探索新的原药制备技术,如基因工程、化学反应工程等,以提高原药的产量和纯度。
总之,原药作为制药工业的基础,是药物制剂的关键组成部分。
它们可以来自于动植物、矿物或化学合成,具有药理活性。
原药的质量和纯度对最终药物的质量和疗效具有重要影响。
化学药物原料药制备工艺

Module 4
4.1 M4目录
编号系统
1.0 区域管理信息 1.1 M1目录或总目录
Module 1 1.0 2.1 Module 2 2.2 2.4 2.3 2.6 Module 3 Module 4 非临床研究 报告 2.7 Module 5 临床研究 报告 2.5
2.1 CTD目录 (Mod 2,3,4,5) 2.2 引言 2.3 质量概述 2.4 非临床研究回顾 2.5 临床研究回顾 2.6 非临床研究的文字及表格总结
---检验报告 ---原料药生产企业的三证(营业执照、《药品生 产许可证》、《药品生产质量管理规范》认证证书) --- 销售发票 --- 供货协议
《化学药品技术标准》规定
---
基于该规定,对存在以下情况的注册申请 将不予批准:
a.单独申请注册药物制剂,提供原料药虚假 证明性文件的;申报生产时,原料药如系通过赠送 途径获得而未能提供该原料药合法来源证明和供货 协议的; b.单独申请注册药物制剂,在药品注册过程 中,所用原料药的批准文号已被废止的,或原料药 生产企业已被吊销《药品生产许可证》的;
国内原料药药学资料的要求
· 资料7:药学综述资料
· · · · · · · 资料8:制备工艺的试验及文献资料 资料9:结构确证的试验及文献资料 资料10:质量研究的试验及文献资料 资料11:质量标准及起草说明 资料12:样品的检验报告 资料14:稳定性研究的试验及文献资料 资料15:内包材的选择依据及质标
2001年8月,ICH(人用药品注册技术要求国际 协调会)发行文件M4Q Common Technical Document (通用技术文件) 目的:为如何组织递交给药政管理部门的申 请文件提供了一个通用技术文件格式
化学药品的相关知识点总结

化学药品的相关知识点总结化学药品的分类根据其作用方式和化学结构,化学药品通常可以分为以下几类:1. 生化药物:生化药物是通过调节生物体内的生化过程来达到治疗目的的药物。
例如,激素类药物、酶类药物等都属于生化药物。
2. 化学合成药物:化学合成药物是通过化学合成方法合成的药物,它们通常是合成有机分子化合物。
比如常见的头孢菌素类、抗生素类、抗癌药等都属于化学合成药物。
3. 天然药物:天然药物是来源于动植物的天然产物,它们通常是一些具有特定生物活性的化合物。
比如阿司匹林、金霉素等都属于天然药物。
4. 合成生物制剂:这是一类由生物技术合成的药物,通常使用基因工程技术将结构基因插入其他细胞中合成,这类药物包括重组蛋白类药物、基因治疗药物等。
化学药品的作用机制化学药品的作用机制是指药物在人体内的作用方式和生物学效应。
不同的药物有不同的作用机制,常见的作用机制包括:1. 拮抗作用:一些化学药品通过拮抗某些生物体内活性物质的作用来达到治疗目的。
例如,β-受体阻滞剂通过拮抗β-受体而起到降压作用。
2. 拮抗作用:一些药物通过拮抗受体或途径的作用来产生生物学效应。
例如,受体拮抗剂通过阻断神经递质的合成和释放而产生镇痛作用。
3. 激动作用:一些化学药品通过激动某些受体或途径来产生生物学效应。
例如,激动胰岛素受体的药物能够促进葡萄糖的吸收从而降低血糖。
4. 阻断作用:一些药物通过阻断某些代谢途径或生物合成途径来产生生物学效应。
例如,抗生素通过阻断微生物生物合成途径达到抑制微生物生长的作用。
化学药品的副作用和安全性化学药品的副作用是指在治疗疾病的过程中产生的不良反应。
药物的副作用通常是由于药物的作用机制、药物的代谢途径以及个体的差异等因素引起的。
常见的化学药品副作用包括:1. 肝肾毒性:一些化学药品在肝脏或肾脏中代谢失衡引起毒性反应,例如一些抗生素、抗癌药等。
2. 神经毒性:一些化学药品能够引起神经系统的毒性反应,例如一些抗癫痫药、镇痛药等。
农药生产准入条件中华人民共和国工业和信息化部

农药生产准入条件(征求意见稿)一、企业注册资金要求从事农药生产必须具备一定的注册资金。
其注册资金按《农药生产类型分类规定》(见附件1)分别要求如下:(一)从事一级农药生产中的第(一)类生产的企业,注册资金不低于3000万元;(二)从事一级农药生产中的第(二)、(三)类生产的企业,注册资金不低于2000万元;(三)从事二级农药生产中的第(一)类、第(二)类中气雾剂类生产的企业,注册资金不低于1000万元;(四)从事上述﹙一﹚、﹙二﹚、﹙三﹚款以外的其他农药生产的企业,注册资金不低于500万元。
二、布局要求(一)区域布局应提供申报核准产品实施场所的区域位置图,以及该工业聚集区设立的批准文件,并符合下列要求:1.新开办的一级农药生产企业,须建设于符合区域发展规划、经省级以上部门批准并通过区域环境影响评价的工业聚集区内;2.新开办的二级农药生产企业,须设于交通便利、物流快捷、信息畅通的区域,但要远离人群聚集区;3.现有农药生产的企业搬迁,也应按生产级别分别遵循上述第1或2条的要求。
(二)工厂布局应提供申报核准的企业总平面图,企业总平面图要标明生产车间以及原料和产品仓库、消防、三废处理以及公用工程等附属设施位置,并符合下列要求:1.总图布置(1)应符合生产工艺流程的要求,各生产环节联系良好,物料输送合理、有序;(2)水、电、汽、冷及其他公用工程设施应尽量靠近负荷中心,仓储区与生产区及公用工程配套设施相对独立;(3)厂区应分设人流和物流通道,仓库、堆场等宜靠近物流口;外来运输工具不得穿行生产区域;(4)若厂区条件允许,宜采用矩形街区布置方式;(5)危险性大的生产车间或装置,应布置在厂区边缘或厂区下风向,并远离人群聚集区,同时做到高风险区域和低风险区域分开;(6)罐区、易燃液体装卸站台等,应远离各类明火源,并建防雷击设施和安全围堰。
(7)危险车间、危险仓库和罐区要保证消防车双向到达;仓储区不同危险类别的物品应分开,其中液体贮槽应用围堰加以防护。
化药1类申报资料清单

化药1类:未在国内外上市销售的药品:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由己上市销售的多组份药物制备为较少组份的药物;
(5)新的复方制剂;
+
25、致癌试验资料及文献资料。
*8
第八条:对于临床预期连续用药6个月以上(含6个月)或治疗慢性复发性疾病而需经常间歇使用的药物,均应提供致癌性试验或文献资料:对于下列情况的药物,需根据其适应症和作用特点等因素报送致癌试验或文献资料:(1)新药或其代谢产物的结构与己知致癌物质的结构相似的;(2)在长期毒性试验中发现有细胞毒作用或者对某些脏器、组织细胞生长有异常促进作用的;(3)致突变试验结果为阳性的。
26、依赖性试验资料及文献资料。
*9
第九条:作用于中枢神经系统的新药,如镇痛药、抑
制药、兴奋药以及人体对其化学结构具有依赖性倾向
的新药,应当报送药物依赖性试验资料。
27、非临床药代动力学试验资料及文献资料。
+
临床资料
28、国内外相关的临床试验资料综述。
+
29、临床试验计划与研究方案。
+
30、临床研究者手册。
+
31、知情同意书样稿、伦理委员会批准件。
+
32、临床试验报告。
+
(6)己在国内上市销售的制剂增加国内外均未批准的新适应症。
资料名称
项目要求
备注
综述资料
1、药品名称。
+
2、证明性文件。
+
3、立题目的与依据。
+
4、对主要研究结果的总结及评价。
我国生化药的现状和发展趋势

ATP-2Na注射液
利巴韦林胶囊
注射用ATP-2Na
利巴韦林颗粒
肌苷
利巴韦林滴眼液
肌苷口服溶液
利巴韦林滴鼻液
肌苷片 肌苷注射液 肌苷胶囊 更昔洛韦 更昔洛韦氯化钠注射液 注射用更昔洛韦 利巴韦林
利巴韦林口服液 利巴韦林片 利巴韦林含片
注射用利巴韦林
利巴韦林氯化钠注射液 利巴韦林葡萄糖注射液 泛昔洛韦 泛昔洛韦片 泛昔洛韦胶囊 阿昔洛韦 阿昔洛韦片 阿昔洛韦乳膏 阿昔洛韦咀嚼片
甘露聚糖 甘露聚糖口服溶液 甘露聚糖片 甘露聚糖注射液 甘露聚糖胶囊 银杏蜜环口服溶液 盐酸氨基葡萄糖 云芝胞内糖肽 云芝胞内糖肽口服溶液 云芝胞内糖肽片 香菇菌多糖 香菇菌多糖片 云芝胞内糖肽胶囊
2021/8/2
26
脂(国家标准)
大豆磷脂粉 卵磷脂 卵磷脂片 角鲨烯 角鲨烯胶丸 多烯酸乙酯 多烯酸乙酯胶丸 蛹油α-亚麻酸乙酯 蛹油α-亚麻酸乙酯胶丸
4.多肽, 7%
3.酶与辅酶, 17%
1.aa及其衍生物 3.酶与辅酶 5.多糖 7.其它 2021/8/2
2.蛋白 4.多肽 6.核苷酸及其衍生物
19
氨基酸及其衍生物(国家标准)
乙酰半胱氨酸(供滴眼剂用) 乙酰半胱氨酸滴眼液 乙酰谷酰胺 乙酰谷酰胺注射液 门冬氨酸钾镁片 小儿盐酸赖氨酸颗粒 谷丙甘氨酸胶囊 复方谷氨酰胺肠溶胶囊 复方亮氨酸颗粒(3AA) 复方盐酸赖氨酸片 复方氨基酸注射液(6AA) 复方氨基酸注射液(17AA-1)
2021/8/2
23
多肽(国家标准第十六册)
脑蛋白水解物注射液 肌氨肽苷注射液 小牛血去蛋白提取物注射液 骨肽注射液 转移因子溶液 转移因子口服溶液 转移因子注射液 转移因子胶囊 注射用转移因子 氨碘肽注射液 胸腺肽溶液
化学合成原料药中起始原料的相关要求

医药化工化 工 设 计 通 讯Pharmaceutical and ChemicalChemical Engineering Design Communications·208·第46卷第5期2020年5月1 研究背景药品注册全球统一化的发展推动着世界各国药品注册的统一,欧、美等国的药品管理机构发起ICH 组织,ICH 组织针对药品研发的指导原则进行了多次协调沟通,并初步起草了药品研发指导原则:2000年《Q7原料药GMP 指南》、2012年《Q11原料药研发与生产》。
其中Q11原料药研发与生产中对起始原料要求进行了初步规范。
起始原料要求的规范不仅确保了原料药品研发的安全性,同时也使原料药品研发质量得到有效的控制。
起始原料基本要求的规范为我国仿制药品的研发奠定了良好的基础,推动着我国国内制药企业的进一步发展。
2 我国起始原料选择在化学药品注册环节中存在的问题在原料药品制备的环节中起始原料作为基础,对最终的药品质量有直接影响,涉及到制药企业的药品生产安全,但是我国的起始原料指导原则中并未明确指出企业在制药的过程中如何选择起始原料,而中小型的化工制药企业通过生产加工与原料药品相关的中间体,售卖给原料药品生产制造企业,存在部分原料药品生产企业为了提升药品生产利润,应用中间体进行原料药品的生产,虽然这一方式缩短了原料药品的合成路线,相应地降低了生产成本,但是原料药品的生产质量和安全性并不能够得到保证。
3 我国起始原料选择与ICH 原则对比我国起始原料选择ICH Q11要求对比见表1。
表1 ICH Q11要求与中国发挥及指导原则的对比ICH Q11要求中国法规及指导原则内容与要求原料药品最终生产质量及生产出来的原料药品是否存在安全风险《化学药物原料制备和结构确证研究的技术指导原则》起始原料和原料药品的影响因素进行综合考虑,并确定一个科学合理的合成路线除成盐、游离外的原料,如化学转化步骤不完整,则不可以作为原料药品的起始原料。
药物 分类 化药 生物药

药物分类化药生物药
药物可以根据其来源、性质和用途进行多种分类。
其中,常见
的分类包括化学药物和生物药物。
化学药物是指通过化学合成或半合成方法制备的药物,其分子
结构和成分是通过化学手段确定的。
化学药物通常包括小分子化合物,如阿司匹林、青霉素等。
这些药物通常具有明确的化学结构,
可以通过化学合成的方法进行生产,并且在药理学和药代动力学方
面有着较为清晰的研究基础。
生物药物是通过生物技术手段生产的药物,包括蛋白质药物、
多肽类药物、抗体药物等。
生物药物通常是从生物体内提取或利用
重组DNA技术在生物系统中生产的,具有较为复杂的结构和多样性。
生物药物的生产过程包括基因克隆、表达、纯化等步骤,因此生产
工艺较为复杂。
此外,药物还可以根据其用途进行分类,包括抗生素、抗癌药物、抗病毒药物等。
根据作用机制也可以进行分类,比如抗凝血药物、抗抑郁药物等。
总的来说,药物的分类是多方面的,涉及到化学结构、生产工艺、药理学特性以及临床应用等多个方面,这些分类对于指导药物的研发、生产和临床应用都具有重要的意义。
希望这些信息能够帮助你更全面地了解药物分类。
原料药定义

原料药定义一、前言原料药是制药过程中不可或缺的重要组成部分,它是指作为制造药品的基础材料,通过化学或生物合成等技术手段获得的物质。
原料药的质量和纯度直接影响到最终制成的药品质量和疗效。
因此,对于原料药的定义、分类、生产和质量控制等方面都需要进行深入研究。
二、定义原料药是指作为制造药品的基础材料,通过化学或生物合成等技术手段获得的物质。
它是制备最终药品必须经过的中间体或活性成分。
原料药通常需要经过多个步骤才能得到最终产品,并且在每个步骤中都需要进行严格的控制以确保产品质量。
三、分类1. 化学合成原料药:指通过有机合成方法获得的化学物质,包括单一结构和复杂结构化合物。
2. 生物发酵原料药:指通过微生物发酵法获得的天然产物或其衍生物,包括抗生素、激素、酶类等。
3. 天然提取物原料药:指通过天然植物、动物或微生物等来源提取的化学成分,包括生物碱、黄酮类、萜类化合物等。
4. 辅料原料药:指作为制备药品过程中必须使用的辅助材料,如溶剂、催化剂、稳定剂等。
四、生产原料药的生产通常需要经过以下几个步骤:1. 原料采购:根据药品制剂设计方案,选择符合质量标准的原材料,并进行采购。
2. 原材料检验:对采购来的原材料进行外观检查、性状检查和质量检测等多项测试,确保其符合要求。
3. 原材料处理:对原材料进行粉碎、干燥等处理,以便后续工艺步骤的实施。
4. 合成或发酵:按照工艺流程将原材料进行化学合成或微生物发酵反应,得到所需的中间体或活性成分。
5. 分离纯化:通过色谱层析、结晶等技术手段将目标化合物从反应混合物中分离出来,并进行纯化处理。
6. 检测质量:对分离纯化后的目标化合物进行多项质量检测,确保其符合药品制剂设计要求。
7. 包装出货:将生产好的原料药进行包装,并按照订单要求出货。
五、质量控制原料药的质量控制是制药过程中至关重要的一环。
主要包括以下几个方面:1. 原材料选择:选择符合规定标准的原材料,如纯度、杂质含量等。
原料药化工合成知识

原料药化⼯合成知识第⼀章原料药1. 概念:原料药是指⽤于制剂⽣产的活性物质,是加⼯成制剂的主要成份,⼀般由化学合成、DNA重组技术、发酵、酶反应或从天然物质提取⽽成。
2. 分类:原料药分为⾮⽆菌原料药和⽆菌原料药。
3. l 质量标准中有⽆菌检查项⽬的原料药为⽆菌原料药。
4. l ⽆菌原料⽤常⽤于注射剂,通常可直接分装成注射剂。
5. l 注射原料药不⼀定是⽆菌原料药。
6. 3. 原料药的⽣产包括以下⼏种类型:7. l 化学合成:⼤多数的原料药是合成得到的,如磺胺嘧啶。
8. l 提取:如从猪肠提取的肝素,从软⾻提取的软⾻素。
9. l 发酵:多数的抗⽣素都是来源于发酵过程,例如青霉素、链霉素等。
10. l 多种⼯艺组合:如半合成抗⽣素、甾体、激素等。
11. 4. 原料药与制剂的区别12. l 复杂:原料药的⽣产往往包含复杂的化学变化和⽣物变化过程。
13. l 副产物:⽣产过程往往会产⽣副产物。
14. l 纯化、精制:由于产⽣副产物,因此需要纯化和精制的过程。
15. l 单元操作:原料药的⽣产过程是基于⼀个个的化学单元反应,以及⼀个个的单元化⼯操作进⾏的。
16. l 化学结构变化:⼀般来讲,在制剂⽣产过程中,物料很少有化学结构的变化,但在原料药⽣产过程中,物料的化学结构变化是经常发⽣的。
17. 5. 原料药质量的关键因素影响原料药质量、安全性和有效性的关键因素有:原料药的杂质⽔平(有关物质、残留有机溶剂、⽆机杂质)、相关理化性质(晶形、粒度等)、原料药的稳定性和可能的污染和交叉污染。
第⼆章原料药合成⼯艺1. 典型的合成⼯艺路线图图⼀典型的合成⼯艺路线第三章精制、⼲燥、包装⼯艺流程及环境区域划分⽰意图图三⾮⽆菌原料药的精制、⼲燥、包装⼯艺流程及环境区域划分⽰意图第四章常⽤设备原料药的常⽤设备主要有发酵罐、反应罐、萃取及浸取设备、结晶设备、离⼼过滤设备和⼲燥设备等。
反应罐在制药⾏业特别是合成药物的⽣产,使⽤⼤量的化学反应装置。
化学原料药分类

化学原料药分类化学原料药分类有机化学原料药•有机化学原料药是以有机化合物为主要成分的药物。
根据其分子结构和药理作用,可以进一步细分为以下几类:–碱类化学原料药:如吗啡、阿托品等,具有镇痛、兴奋中枢神经系统等作用。
–酸类化学原料药:如阿司匹林、维生素C等,具有消炎、抗氧化等作用。
–脂类化学原料药:如胆固醇、脂肪酸等,作为生物体内重要的组成部分,可参与脂类代谢和调节生理功能。
–醇类化学原料药:如乙醇、甘露醇等,具有抗菌、镇痛、保湿等作用。
无机化学原料药•无机化学原料药是以无机化合物为主要成分的药物。
根据其化学性质和药理作用,可以细分为以下几类:–金属离子类化学原料药:如铁剂、锌盐等,可用于治疗贫血、补充微量元素等。
–酸类化学原料药:如盐酸、硫酸等,常用于制备其他药物或作为调节酸碱平衡的药物。
–氧化物类化学原料药:如硝酸银、过氧化氢等,具有抗菌、消毒等作用。
天然化学原料药•天然化学原料药是以天然物质为主要成分的药物。
根据其来源和化学特性,可以细分为以下几类:–植物提取物:如中药材、植物精油等,具有多种药理活性成分,广泛用于中药制剂和保健品中。
–动物提取物:如胰岛素、血清蛋白等,常用于治疗糖尿病、免疫相关疾病等。
–微生物代谢产物:如青霉素、链霉素等,广泛用于抗菌药物中。
生物化学原料药•生物化学原料药是以生物制造的化合物为主要成分的药物。
根据其生源和制备方式,可以细分为以下几类:–重组蛋白类化学原料药:如重组人胰岛素、重组人生长激素等,通过基因工程技术在生物体内制造。
–抗体类化学原料药:如单克隆抗体、重组抗体等,可用于治疗肿瘤、免疫相关疾病等。
–基因治疗类化学原料药:如基因修复疗法中使用的基因载体等,用于治疗遗传性疾病。
总结化学原料药是一类广泛应用于医药领域的药物。
根据其化学性质和来源特点,可以将化学原料药分为有机化学原料药、无机化学原料药、天然化学原料药以及生物化学原料药。
不同类别的化学原料药在药理作用和临床应用上有所差别,但都发挥着重要的药物效应,为临床治疗提供了有效的药物选择。
原料药的分类

原料药的分类
原料药指的是制药工业中从自然界中提取或合成出来的可以制成药品的基础化合物,是药品制造的关键性物质。
原料药的分类可以从多个维度进行,本文将从作用、来源和制造方法三个维度来进行分类介绍。
一、按作用分类
1. 治疗用原料药:指能够直接或间接治疗某种疾病的原料药。
例如对于感冒,治疗用的原料药有银翘片、板蓝根等。
2. 辅助用原料药:指非治疗性的原料药,主要用于药品的质量、稳定性等方面。
例如,辅助用原料药分为填充剂、分散剂、溶解剂等等。
3. 调味用原料药:指具有调味作用的原料药,用于提高口感和嗅觉效果。
例如,薄荷油、柠檬酸等都属于调味用原料药。
二、按来源分类
1. 动物性原料药:指从动物体内提取的原料药,例如胰岛素等。
2. 植物性原料药:指从植物中提取的原料药,例如柿子树、莲花、枸杞等。
3. 化学合成原料药:指通过化学合成而得到的原料药,例如阿司匹林等。
三、按制造方法分类
1. 天然产物原料药:指来源于天然界的原料药,例如钙卡宾、四环素等。
2. 半合成原料药:指源于天然产物,但在生产过程中通过半合成方法得到的原料药,例如头孢菌素等。
3. 全合成原料药:完全不依赖自然产物,以化学合成的方式生产的原料药,例如酮康唑等。
以上是原料药的按类划分的介绍。
通过分类分析,可以让我们更好地了解原料药的性质和特点,有助于我们更准确地选用原料药,并在制药过程中进行正确的搭配和使用。
同时,也提醒我们注意原料药的安全使用和管理,在严格控制质量的同时更加注重改进生产技术和环境保护工作,以切实维护人民群众的健康和生命安全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
际存在形式表示,同时标注有效部分和配对反离子含量。
含相关杂质的产品应规定其最高含量,以质量分数表示。
●
5.4其他限制性组分含量
含安全剂、稳定剂、增效剂等其他限制性组分的产品,其含量应由标明含量和允许波动范围组成, 允许波动范围参照化学农药制剂要求。
●
5.5酸度、碱度或pH范围
酸度或碱度以硫酸或氢氧化钠质量分数表示,不考虑其实际存在形式。
●
(2)若有效成分以某种盐(如草甘膦钠盐)的形式存在时,还应给出相应衍生物的识别资料。
2.生产工艺 2.1原材料描述
参与反应的化合物和主要溶剂化学名称、美国化学文摘登录号(CAS号)、技术规格、来源等。
●
2.2化学反应方程式
2.3生产工艺说明
按照实际生产作业单元依次描述。
2.4生产工艺流程图
2.5生产装置工艺流程图及描述
●
7.产品安全数据单
●
8.参考资料等
应说明出处。
●
产品 化学 ①
1.有效成分和安全剂、稳定剂 、增效剂等其他限制性组分的 识别
(1)有效成分和安全剂、稳定剂、增效剂等其他限制性组分的通用名称、国际标准化组织(ISO) 批准的名称和其他国际组织及国家通用名称、化学名称、美国化学文摘登录号(CAS号)、国际农 药分析协作委员会(CIPAC)数字代码、开发号、分子式、结构式、异构体组成、相对分子质量或分 子质量范围(注明计算所用国际相对原子质量表的发布时间);
注:“●”表示需要提供,“✖”表示不需要提供,“◐”表示杀鼠剂不需要提供。
资料 分类
1.申请表
项目
按农业部发布的申请表填写。
释义与说明
A
B
C
●
2.申请人证明文件
(1)农药生产企业提交加盖公章的生产许可证、工商营业执照、统一社会信用代码等复印件;
(2)新农药研制者申请农药登记的说明; (3)境外企业的身份证明文件、有关国家和地区登记与使用情况说明、在中国境内设立办事机构
准确描述产品的颜色、物态、气味等。
● ● ● ● ●
✖
●
●
● ● ●
5.2有效成分含量 5.3相关杂质含量
(1)原药应规定有效成分最低含量(以质量分数表示),不设分级,一般不得小于90%பைடு நூலகம்通常取5
批次有代表性的样品,测定其有效成分含量,计算平均值和标准偏差,根据所得结果,确定有效成
分最低含量,并提供所用的统计方法;
按照《农药登记原药全组分分析试验指南》规定执行。根据生产工艺情况推断,原药(母药)中如 可能存在以下杂质,包括但不限于:苯胺和取代苯胺类,硫酸二甲酯类,二氯联苯三氯乙烷 (DDT)类,乙撑硫脲(ETU)和丙烯硫脲(PTU)类,卤代二苯并二噁英类,卤代二苯并呋喃类, 肼和取代肼类,亚硝胺类,有机磷酸酯氧化物类,四乙基硫代二磷酸盐(治螟磷)类,有机磷酸酯 和氨基甲酸酯的亚砜和砜化物类,氯化偶氮苯类,甲基异氰酸酯类,多氯代联苯(PCBs)和六氯苯 (HCB)类,苯酚类。全组分分析试验应对可能存在的这些杂质进行定性定量分析。 从化学理论、原材料、生产工艺等方面对分析检测到的和推测可能存在的杂质的形成原因进行分析 。 规定原药的最低含量、母药的标明含量和杂质的最高含量。对限量的建立依据需提供统计学说明。
●
或代理机构的说明及营业执照。
一般 3.申请人声明
申请资料真实合法的声明。
●
资料 4.产品概述
包括产地、产品化学、毒理学、环境影响、风险评估资料摘要以及境外登记情况等资料。
●
5.标签和说明书
按照《农药标签和说明书管理办法》制作的标签和说明书样张。
●
6.其他与登记相关的证明材料
(1)在其他国家或地区已有的产品化学、毒理学、环境影响资料或综合查询报告等; (2)新农药有效成分命名依据。
农药原药(母药)登记资料要求释义与明细表
1 化学农药原药(母药)
1.A类:新农药原药(母药),包括曾经获得农药登记,但没有有效状态产品登记的农药,以及新农药登记6年保护期内,未取得首家授权的; 登记 2.B类:相同原药(母药),包括6年保护期内取得首家授权的原药; 种类 3.C类:非相同原药(母药)。
(2)母药含量由标明含量和允许波动范围组成,标明含量通常取5批次有代表性的样品检测结果的
平均值,允许波动范围参照制剂要求;
●
(3)有效成分存在异构体时,若通用名称对其进行了定义,则不需要在控制项目中重复规定异构
体比例;若通用名称未对申请登记的混合物进行定义,则需规定异构体比例;
(4)若有效成分以某种盐(如草甘膦钠盐、铜制剂等)的形式存在时,产品名称、质量分数以实
●
(2)根据化合物特点,按照《农药理化性质测定试验导则》规定,提供相关理化性质的检测报告
或查询资料,测定理化性质所用样品有效成分的含量一般不低于98%。
3.2原药(母药)理化性质
4.全组分分析
4.1全组分分析试验报告
4.2杂质形成分析 4.3有效成分含量及杂质限量 5.产品质量规格 5.1外观
(1)包括:外观(颜色、物态、气味)、熔点/熔程、沸点、稳定性(热、金属和金属离子)、爆 炸性、燃烧性、氧化/还原性、对包装材料腐蚀性、比旋光度等; (2)根据化合物特点,按照《农药理化性质测定试验导则》规定,提供相关理化性质检测报告, 如原药含量不低于98%,可引用有效成分理化性质数据。
2.6生产过程中质量控制措施描 述
3.理化性质
3.1有效成分理化性质
(1)包括:外观(颜色、物态、气味)、熔点/熔程、沸点、水中溶解度、有机溶剂(极性、非极
性、芳香族)中溶解度、密度、正辛醇/水分配系数(适用非极性有机物)、饱和蒸气压(不适用
盐类化合物)、水中电离常数(适用弱酸、弱碱化合物)、水解、水中光解、紫外/可见光吸收、 比旋光度等;
●
6.2有效成分、相关杂质和安全 剂、稳定剂、增效剂等其他限 制性组分的检测方法和方法确 认
(1)检测方法:应提供完整的检测方法,检测方法通常包括方法提要、原理、样品信息、标样信 息、仪器、试剂、溶液配制、操作条件、测定步骤、结果计算、统计方法、允许差等内容; (2)方法确认:按照《农药产品质量分析方法确认指南》规定执行。
●
5.6不溶物
规定最大允许量,以质量分数(%)表示。
●
5.7水分或加热减量
规定最大允许量,以质量分数(%)表示。
●
6.与产品质量控制项目相对应
的检测方法和方法确认
6.1产品中有效成分的鉴别试验 至少应用一种试验方法对有效成分进行鉴别。采用化学法鉴别时,至少应提供2种鉴别试验方法。
方法②
当有效成分以某种盐的形式存在,鉴别试验方法应能鉴别盐的种类。
