CM_FM_002 研究中心启动访视报告 v3
CM_FM_037 研究中心超温报告 v1

研究中心超温报告 / CM_FM_037Site Temperature Excursion Report Form第1.0版,2016年12月01日1 / 51. 目的Purpose :研究中心发生的试验药物(包括对照药)和辅助药物的超温,需使用此表格报告超温。
This form is used by the site to report temperature excursions that occur at the site for investigational product (including comparators) and auxiliary medicinal products.2. 研究中心需采取的措施 Site Required Actions: 当研究中心发生超温,需立即采取以下措施:Once a temperature excursion has been identified at the site, the following actions are taken immediately:1) 不能使用受影响的药物。
在得到最后的处理决定前,超温药物需在满足储存温度条件下分开保存。
Do not use the affected investigational product. The investigational product must be stored separately in an appropriate location met required temperature pending the final disposition decision. 2) 如果使用交互式应答系统,联系管理员在系统里将受影响的药物隔离。
If using an interactive response technology (IRT) system, contact the appropriate helpdesk to quarantine investigational product in the system. 3) 将完成的表格发送监查员并抄送项目经理. 监查员或项目经理转给申办方或指定人员。
CM_TP_025 研究中心启动访视(SIV)确认函 v1

昆拓信诚医药研发(北京)有限公司Kun Tuo Medical Research and Development (Beijing) Co., Ltd.研究中心启动访视(SIV)确认函 / CM_TP_025Study S ite Initiation Visit Confirmation Letter方案编号:申办者:主要研究者:中心编号:第1.0版,2017年06月01日此文件为昆拓信诚医药研发(北京)有限公司版权所有,禁止任何形式未经授权的使用、披露或复制。
1 / 1研究中心启动访视(SIV)确认函注意:红色的文字是填写建议,请在提交表格时删除。
尊敬的XXX< 主要研究者姓名 >医生/教授/主任(选择最合适的称谓):首先感谢您对<插入申办方名称>申办的<插入研究方案名称>的支持。
本项目的临床监查工作由昆拓信诚医药研发(北京)有限公司负责,也感谢您对我们工作的支持。
通过前期的初步沟通,我们希望能与您和您的研究团队共同完成该研究的启动工作,因此我和<其他昆拓员工/申办方员工>计划于<XX年X月X日><时间>对拜访贵中心,完成“研究中心启动访视”工作。
本次启动访视培训部分预计将需要X小时时间。
请参考附件中启动访视培训日程。
本次培训的目的是梳理研究流程,包括介绍研究方案、试验用药品、研究文件、GCP--研究者职责、监查员访视/稽查计划等,请参考启动会的访视日程。
XXXX根据具体研究添加内容。
为了该研究能够顺利地开展,包括您在内,所有参与研究的人员能出席启动会是非常重要的。
这些人员包括:主要研究者、助理研究者、药品保管人员、研究护士、研究协调员以及需要完成研究特定的评估或流程的人员。
我们建议您和您的研究团队成员参加研究中心启动培训的整个过程。
除此之外,我还需要拜访贵中心的研究设施,例如实验室、试验用药品、生物标本和研究物资的储存设施(可根据项目具体情况添加)。
0 药物临床试验系统GCP (复旦大学附属儿科医院)(1)

01 产品概述产品基本信息⚫以药物临床试验信息化为主线、受试者用药安全为驱动,将GCP 审批流程、试验过程、归档管理等进行有序整合,提高药物临床试验的工作效率。
符合规范⚫结合国家相关标准和规范要求对产品做了相应改造和处理,完全遵循相关标准和规范。
资源共享⚫建立数字化的试验过程信息存档,实现医院业务系统和GCP 系统的数据共享,减少重复工作量。
智能支持⚫内置符合CTCAE4.03标准的不良事件知识库,若发生不良事件提供提醒功能,并且能够自动判定生成AE 记录。
质控管理⚫提供完整的质控审批流程,及时对项目过程中出现的问题进行整改,保障试验过程的规范性和受试者的安全。
高度集成患者主索引临床数据中心医院业务系统CPOEEMRHISRISLISPACS……临床试验平台项目管理立项信息人员授权项目配置方案计划试验数据分析全流程管理受试者管理筛选/入组时间轴管理计划医嘱执行ICF 项目质控不良事件随访数据标准机构质控PK 管理药房管理经费管理CDISC 标准CTCAEICH 医学术语集配置管理CRF 配置中英文对照日志管理试验疗效评估HR MDMP立项审批Project MangerG过程管理GCPM数据管理MedRisA分析服务DataAnalyzer 项目审批•配置项目立项相关表单•CRA、研究医生或PI提交及补充材料•机构办、伦理委员会、财务、PI完成审批临床试验模块•项目配置、方案配置、•受试者管理、PK管理、经费管理、质控管理临床试验数据处理•面向GCP项目中的数据管理需求•病历数据采集、标准化处理、CRF表单、数据上传与归档、阶段小结、分中心小结、总结等..数据的高级应用•受试者数据分析•费用统计分析•……CRO、CRA机构办公室伦理委员会PI、研究者财务PI研究者CRC机构办专业组PI研究者CRCCRAPI研究者机构办CRA申办方按照机构办配置的各项内容提交材料系统首页→立项申请→提交资料(补)审批人登录系统后,在审查项目中能够查看待审查的内容,“同意”则进入下一审批流程。
结核培养与药敏试验

结核分枝杆菌固体培养操作流程
1
痰标本中加入 1-2倍体积 4%NaOH
2
涡旋振荡 1分钟
3
室温静置 15分钟
第3天、7天、此后每周 观察一次直至第九周, 记录菌落生长和污染
6
分别接种0.1ml
置37C温
前处理液至2
箱培养 只酸性罗氏培养基斜面
5
4
结核分枝杆菌固体培养操作流程 操作
痰标本
1-2倍 4% NaOH
No. of sputa tested n=41
n=41 n=36
培 100 养 80 阳 性 60 比 40 例
20
0
90
81
100
100
100
90
81 90
73
100
90
100
94
81
63
77
29
4C
10
25C
25
15
25-30C
0
0
3
7
14
21
28
标本保存时间(0,3,7,14,21,28天) Kim SJ, et al, 1986
特点:全自动、全封闭、快速、样本量 大 原理:分枝杆菌对NaOH的耐受性;分 枝杆菌在液体培养基生长更快,添加了 丰富的营养物质;分枝杆菌生长耗氧, 荧光增强,仪器自动探测荧光的变化。 试剂组成:MGIT培养管、MGIT生长 添加剂、PANTA杂菌抑制剂、SIRE药 敏试剂。 标本适用范围:除血液标本以外的所有 标本
结核分枝杆菌药敏试验-比例法
• 抗结核药物效价的计算:
效价 =纯度×活性成分×(1-水份含量) 实例:KM纯度99%,水分3.3%,活性成分69.6%
一项国际多中心Ⅲ期临床试验

2011肿瘤分子诊断及分子靶向治疗回 顾与展望
❖ 5.舒尼替尼联合厄洛替尼不能提高晚期复发 NSCLC患者OS
2011肿瘤分子诊断及分子靶向治疗回 顾与展望
❖ 6.一项Ⅲ期临床研究入组了960名非小细胞癌 患者,均接受过一种或两种化疗方案的治疗, 随机分到舒尼替尼+厄洛替尼组和安慰剂+厄 洛替尼组,主要终点为OS,共734名患者达 标,经分析两组间PFS差异显著(15.5个月 vs8.7个月,P=0.0023),但OS无显著差异 (9.0个月vs8.5个月,P=0.1388)。 (ESMO摘要号LBA6).
2011肿瘤分子诊断及分子靶向治疗回 顾与展望
❖ 9.培美曲塞作为二线治疗能提高NSCLC患 者OS.
2011肿瘤分子诊断及分子靶向治疗回 顾与展望
❖ 一项多中心的Ⅲ期临床研究,入组464名晚期 NSCLC患者,接受顺铂+吉西他滨治疗4周期一线 治疗后无疾病进展,随机分到观察组(n=155)、 吉西他滨组(n=154)和厄洛替尼组(n=155)。 试验结果表明,对比观察组,吉西他滨组和厄洛替 尼组的PFS均有所提高(1.5个月vs3.8个月vs2.9个 月)。患者疾病进展后各组部分患者接受培美曲塞 二线治疗,接受治疗比例为(观:76℅;吉:60℅; 厄63℅)。三组中不接受培美曲塞治疗的患者间OS 无显著差异;而接受治疗的患者中,吉西他滨组和 厄洛替尼组的OS较观察组显著改善,但不良反应发 生率也随之升高。(ESMO摘要号370PD)
2011肿瘤分子诊断及分子靶向治疗回 顾与展望
❖ 20.贝伐珠单抗联合一线化疗可延长MBC患 者的PFS
2011肿瘤分子诊断及分子靶向治疗回 顾与展望
❖ 一项对于E2100、AVADO和RIBBON-1研究 中的2447例MBC患者进行的荟萃分析显示, 在MBC一线化疗方案(以紫杉醇类、蒽环类 或卡培他滨为基础方案)中加入贝伐珠单抗 可使患者PFS显著改善,但中位OS改善并不 显著,(ASCO1005)
全国艾滋病检测技术规范(2015年修订版)

附件1全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS(2015年修订版)中国疾病预防控制中心二○一五年十二月全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS(2015年修订版)中国疾病预防控制中心二○一五年十二月前言艾滋病在我国的流行已数十年,随着感染者和临床病人的不断增加、感染人群的变化,艾滋病检测工作量逐渐加大,对监测和检测的需求也不断增加,承担艾滋病检测的实验室已遍及全国各级医疗、疾病预防控制、采供血、妇幼保健机构,出入境检验检疫、军队等各个系统。
为了尽早发现HIV感染者和艾滋病病人,及早提供咨询、治疗,同时为适应基层艾滋病检测工作需求,在新的形势下,根据《关于艾滋病抗病毒治疗管理工作的意见》、《中国预防与控制艾滋病中长期规划(1998—2010年)》、《中国遏制与防治艾滋病十二五行动计划的通知(国办发[2012]4号)》、“四免一关怀”等国家艾滋病防治重要方针政策和十三五防治工作重点,在广泛征求各省、市疾病预防控制机构和医疗机构意见的基础上,在中华人民共和国卫生和计划生育委员会艾滋病专家及省级专家的参与下,中国疾病预防控制中心性病艾滋病预防控制中心对《全国艾滋病检测技术规范(2009年版)》进行修改、增补和完善,制定出《全国艾滋病检测技术规范(2015年版)》(以下简称《规范》),使其既能满足目前艾滋病检测工作的实际需求,又能体现检测技术的发展。
本次《规范》修订工作立足于我国目前检测状况,结合发达国家使用的指南,主要对以下几个方面内容进行了修改、增补和完善:(1)完善了不同的检测策略,并将其整合为独立的一章;(2)增加了HIV-1新发感染检测一章;(3)新增补充试验概念,其内容包括抗体确证试验(WB,RIBA/LIA等)和核酸试验(定性和定量试验);(4)增加了第4代试剂(抗原抗体联合检测试剂)的检测流程;(5)增加核酸检测流程;(6)完善了检测报告。
临床试验项目标准操作规程(SOP)

临床试验项目标准操作规程临床研究流程图文件编码:起草人:审核人:执行日期:批准人:Ⅰ. 目的:建立临床试验的流程图,临床试验的SOP按此图制定。
Ⅱ. 范围:适用于所有临床试验SOP。
Ⅲ. 规程临床研究流程图Ⅰ. 目的:为使项目管理人员有所参考,提高项目管理质量和效率,特撰写此总纲。
Ⅱ. 范围:医学部。
Ⅲ. 规程1、项目管理的定义:项目的管理者,在有限的资源约束下,运用系统的观点、方法和理论,对项目涉及的全部工作进行有效地管理。
即对项目的全过程进行计划、组织、指挥、协调、控制和评价,以实现项目的目标。
2、项目管理的内容包括以下9个部分:1、项目范围管理是为了实现项目的目标,对项目的工作内容进行控制的管理过程。
它包括范围的界定,范围的规划,范围的调整等。
2、项目时间管理是为了确保项目最终的按时完成的一系列管理过程。
它包括具体活动的界定,如:活动排序、时间估计、进度安排及时间控制等项工作。
3、项目成本管理是为了保证完成项目的实际成本、费用不超过预算成本、费用的管理过程。
它包括资源的配置,成本、费用的预算以及费用的控制等项工作。
4、项目质量管理是为了确保项目达到客户所规定的质量要求所实施的一系列管理过程。
它包括质量规划,质量控制和质量保证等。
5、项目人力资源管理是为了保证所有项目关系人的能力和积极性都得到最有效地发挥和利用所做的一系列管理措施。
它包括组织的规划、团队的建设、人员的选聘和项目的班子建设等一系列工作。
6、项目沟通管理是为了确保项目的信息的合理收集和传输所需要实施的一系列措施,它包括沟通规划,信息传输和进度报告等。
7、项目风险管理涉及项目可能遇到各种不确定因素。
它包括风险识别,风险量化,制订对策和风险控制等。
8、项目采购管理是为了从项目实施组织之外获得所需资源或服务所采取的一系列管理措施。
它包括采购计划,采购与征购,资源的选择以及合同的管理等项目工作。
9、项目集成管理是指为确保项目各项工作能够有机地协调和配合所展开的综合性和全局性的项目管理工作和过程。
临床试验中的协同访视(CO-V)

什么是协同访视首先要明确的是,协同访视是属于项目质量把控中的QC范畴,由Operation Team 的人实施的,如CO/PM,另外也可以是由监查员的直线经理LM或其委托人等进行实施。
(我们下面会说到为什么会有委托人的情况)协同访视的目的可以分中心质控和带教培训来侧重:对中心质控:评估及发掘项目的中心质量问题,评估中心的状况、方案、SOP、GCP依从性和违背/潜在的风险;跟进还没解决的重要的问题,当然这些问题可能是CRA发现,也有可能是申办方稽查发现的,在CRA层面解决有困难,那么CO-V就协助CRA处理或促进项目进展,优化沟通渠道等。
对CRA带教培训:评估CRA的工作质量、控制人员因素的风险;怎么决定CO-V的选点CO-V的选点和临床试验稽查点的选择有点类似,但也有其灵活性和特点,基本也可以归为对人的带教培训和对中心质量把控这两个维度的风险评估来决定,是否要在监查员或该中心开展协同访视。
在人的层面,多数以CRA等人的performance作为考虑的因素,例如CRA是否没经验(从CV可看到)、各方面反映该中心的人员的表现是否糟糕(从MVR、PD/SAE上报情况、EDC的填写情况等)、或者CRA之前没进行过一些特定的阶段,比如之前没进行过启动/关中心/常规监查等,需要进行带教或考察,另外情况就是常规的coach或考核,也会通过协同访视去达到想要的目标。
在中心的层面,如果中心存在入组过快或过慢、通过不限于监查、稽查、沟通投诉等各种渠道收集到的问题的严重性、频繁的人员交接、中心的进展或安全性上报有异于其他中心或项目总体等情况,也是作为评估是否进行CO-V的考虑因素。
另外如果中心被选定进行稽查或inspection,也常常会进行CO-V,当然递交审评前的质控现在一般通过自查的形式进行。
另外,如果CRA有工作反馈消极,MVR 质量差空洞无物、EDC严重不及时、经常提出问题寻求指导未果后不了了之等情况,PM应该有所警惕。
低剂量普通肝素用于ECMO辅助支持患者抗凝治疗的系统评价

•临床评价-低剂量普通肝素用于ECMO辅助支持患者抗凝治疗的系统评价黄晓嫡,赵红卫,马永成,杜鹏强,倪铭,王爱凤(阜外华中心血管病医院药学部,河南郑州450000)[摘要]目的:系统评价低剂量普通肝素(UFH)用于体外膜肺氧合(ECMO)辅助支持患者的抗凝治疗。
方法:计算机检索PubMed、EMbase、Cochrane Library、CNKI、维普、万方和CBM数据库,纳入低剂量UFH用于ECMO辅助支持患者抗凝的回顾性队列研究。
根据NOS量表对纳入研究的质量进行评价。
采用RevMan5.3软件进行Meta分析。
结果:共计纳入5篇文献,包括469例患者,试验组(UFH低剂量)215例,对照组(UFH常规剂量)254例。
NOS评分为7~9分。
Meta分析结果显示,试验组和对照组的ECMO血管插管部位出血发生率分别为15.22%和40.74%,胃肠出血发生率分别为7.32%和14.62%,差异均有统计学意义(P<0.05);与对照组相比,试验组的压缩红细胞(PRBC)平均输注单位显著减少(P<0.01)o两组的手术部位出血、肺出血、颅内出血、血栓形成、ECMO撤机以及在院死亡率均无统计学差异(P>0.05)□结论:对于ECMO辅助支持患者,UFH调低剂量可减少ECMO血管插管部位和胃肠等部分出血事件,降低PRBC平均输注单位。
且尚无证据表明,调低UFH剂量会增加患者的血栓形成,延缓ECMO撤机,甚至提高在院死亡率。
受纳入研究质量及数量的限制,研究结果仍需更多大样本、高质量的研究加以验证。
[关键词]普通肝素;低剂量;体外膜肺氧合;抗凝;系统评价[中图分类号]R973+.2[文献标识码]A[文章编号]1672-8157(2020)06-0355-05Systematic review of the anticoagulant regimen of low-dose unfractioned heparin for patients on ECMOHUANG Xiao-jing,ZHAO Hong-wei,MA Yong-cheng,DU Peng-qiang,NI Ming,WANG A.i-feng(pepartment of Pharmacy,Fuwai Central China Cardiovascular Hospital,Zhengzhou450000,China)[ABSTRACT]Objective:To systematically review the anticoagulant regimen of low-dose unfractioned heparin(UFH)for patients on extracorporeal membrane oxygenation(ECMO).Methods:Databases including PubMed,EMbase,Cochrane Library, CNKI,VH\Wanfang and CBMdisc were searched for retrospective cohort studies about low-dose UFH used for patients on ECMO. Newcastle-Ottawa Scale(NOS)was used to evaluate the quality of the included studies.Meta-analysis was conducted by RevMan 5.3software.Results:A total of5cohort studies with a NOS score of7-9and469patients were included.There were215patients in experimental group(low-dose of UFH)and254patients in control group(routine dose of UFH).Results of meta-analysis showed that the rates of ECMO cannula site bleeding in experimental group and control group were15.22%and40.74%respectively,rates of gastrointestmal bleeding in the two groups were7.32%and14.62%respectively.There were significant dififerences between them(P <0.05).Compared with the control group,mean transfusion units of packed red blood cell(PRBC)markedly declined(P<0.01) in experimental group.Meanwhile,there were no statistical differences in rates of surgical site bleeding,pulmonary bleeding,cerebral bleeding,thrombosis,weaning of ECMO and in-hospital mortality between the two groups(P>0.05).Conclusion:For the patients on ECMO,low-dose UFH might help reduce the rates of cannula site bleeding,gastrointestinal bleeding,mean transfusion units of PRBC and had no influences on thrombosis,weaning of ECMO and the in-hospital mortality,which should be further proved by more studies with high quality due to the limitation of the quality and quantity of cohort studies involved in this study.[KEY WORDS]Unfractioned heparin;Low dose;Extracorporeal membrane oxygenation;Anticoagulation;Systematic review体外膜肺氧合(extracorporeal membrane[基金项目]吴阶平医学基金会临床药学专项基金(3206750190904)[通信作者]王爱凤,女,主任药师,研究方向:医院药学。
研究中心启动访视流程图

启动访视遗留问题 跟进
启动访视遗留问题 跟进
进行启动访视
• 启动访视确认函、跟进 函、
• 启动访视报告 • 启动会会议签到表 • 研究者 CV、GCP 及执业证
书 • 试验室资质证书及正常值
范围 • 相关设备检验证书 • 分工授权表等
1.签署中心访视登记表 2.启动访视当天需组织研究 者启动会议,对研究者进行 以下内容的培训(但不限 于):
• 研究程序 • 研究产品 • 安全性问题 • GCP:研究者职责 • 讨论监查的程序及频
率,申办方或第三方 稽查/视察计划及流 程 • 其他(如适用) 3.请研究者完成分工授权表 4.收集试验相关信息及资料 (如适用)
档的收集及归档资料目录及程 序。
• 申请药物 • 启动前药品管理培训 • 申请试验相关物资 • 试验相关设备申请 • 收集相关质检证明 • 收集实验室资质及正常值范围 • 研究者文件夹准备 • 收集研究者 CV、GCP 及执业
证书 • 启动会资料准备(方案、
PPT,签到表等)
研究中心启动访视流程图
获得组长单位批准
完成国家局备案
组长单位
பைடு நூலகம்
分中心 完成分中心伦理备案
试验中心所在省局备案
完成协议签署 与 PI 商定启动时间
启动会准备
• 了解机构对于启动的要求 • 参会人员 • 会议地点 • 沟通确认研究组成员名单 • 沟通确认分工授权
发送启动访视批 准表给到 PM
发送启动访视确认函
资料归档
报告定稿
完成启动访视报告 发送项目经理审核
PM 启动前完成
• 完成项目管理计划、监查计 划;
• 研究产品已准备妥当; • 已确认第三方的服务单位及相
一例MMC标准访视下胰岛素抵抗患者的个案护理

一例MMC标准访视下胰岛素抵抗患者的个案护理标准化代谢性疾病管理中心(Metabolic Management Center)MMC即国家标准化代谢性疾病管理中心,是由中国工程院院士宁光发起,由国家代谢性疾病临床医学研究中心/上海内分泌代谢病研究所负责管理,在全国管理内建设推广代谢性疾病标准化管理体系,秉承“一个中心、一个标准、一站式服务”的原则.(1)MMC患者随访: 是指从初次访视、 3个月访视、 6个月访视,直至最终访视,研究者应按照随访要求,包括基本信息、病史采集、不良事件评估、用药改变、实验室检查、辅助检查,对患者进行随访.(2)2020年,本区域中心运用标准化访视,成功降低了一例患者胰岛素抵抗的现象,现将护理体会报告如下。
1 病例介绍患者,男性别:男年龄:55岁文化程度:大专工作状况:职员。
于2020.6.8上午MMC门诊就诊,主诉:血糖升高8年,胰岛素注射治疗1年但血糖控制不佳,舌苔厚,白腻,脉弦细。
门诊查体:身高:166cm 体重:74Kg 体重指数:26 。
专科检查:内脏脂肪面积:110厘米²,空腹胰岛素:4.63μIU/mL,餐后2小时胰岛素:16.6μIU/mL。
空腹血糖:9.27mmol/L,餐后2小时血糖:12.97mmol/L;糖化血红蛋白:8.6%,空腹C肽:1.88ng/ml,餐后2小时C肽:4.26ng/ml。
患者诊断2型糖尿病,高脂血症,肥胖。
护士通过MMC问卷调查评估后得出:患者饮食控制欠佳,缺乏运动,低血糖知识缺乏,胰岛素注射不规范,护士给予了相应的健康指导及干预措施并通过MMC进行标准化阶段性随访。
1年后,患者胰岛素抵抗明显减弱,嘱患者定期门诊复查。
2 护理与随访2.1 饮食护理2.1.1 根据患者的身高体重计算出患者的饮食总热量:(身高-105)乘以25Kcal=1525Kcal(3),其中:碳水化合物146g占总热量45%;蛋白质61g占总热量31.7%;脂肪46g占总热量10%。
SSV中心筛选报告模板

SSV中心筛选报告模板中心筛选访视,又叫SSV(Site selection visit) 或 PSV(Pre- study Visit),一般是CRA到研究中心第一次正式的拜访。
为了评估研究中心是否符合项目的要求,以便选择正确的中心。
筛选访视相当于对研究中心的全面评估,稍有不到位,可能会影响到后面的研究开展。
对CRA来说,需要在有限的时间内向研究团队介绍方案的实施,收集研究中心意向、研究团队信息、中心流程等并完成报告,不是一件容易的事情。
有时候,甚至只给CRA 1-2天的时间熟悉方案、准备材料,就要和研究者预约时间去做选点,非常考验CRA的能力。
【Step1 】中心筛选前的流程及准备工作在选点前,一般会先远程对研究中心进行可行性调研,有些公司会有专门的「可行性调研专员」完成,也有的是CRA自己完成这部分工作。
流程包括:联系PI(主要研究者)→简单介绍方案→收集研究者签署的保密协议→向研究者发送项目相关文件(方案、研究者手册等)→初步确定PI意向并远程收集项目问卷(一般包含入组潜力、研究团队、中心原始数据/药物管理/合同签署/伦理审批流程等,如选点前项目问卷无法收回,有些项目组也会要求SSV现场收回)→将收集的信息反馈给项目组,等待项目组评估并批准SSV。
项目组批准后,就可以着手准备onsite SSV了。
准备工作:完成SSV培训:包括方案、研究者手册、选点报告的guideline、SSV的PPT;研究的基本信息一定要熟记在心,这些研究者很可能会问道,如时间节点(什么时间开始、什么时间结束、入组期多久等)、是global项目还是仅在中国开展、是否多中心、全国一共入组多少例、组长单位是哪家、牵头PI是哪位等。
与研究中心预约访视:如果项目组没有要求一定在当周完成,一般我会预约下一周的访视,一方面避免临时拜访PI,另一方面也给自己留点准备时间。
请PI预留30分钟-1小时,并且告知PI也会拜访一下Sub-I和研究护士,以便了解更多信息。
CM_FM_029 器械研究中心筛选访视报告 v2
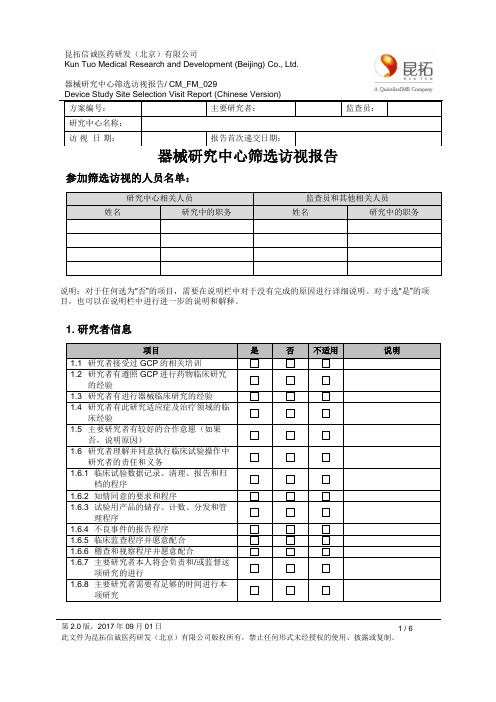
器械研究中心筛选访视报告/ CM_FM_029方案编号:主要研究者:监查员:研究中心名称:访视日期:报告首次递交日期:器械研究中心筛选访视报告参加筛选访视的人员名单:研究中心相关人员监查员和其他相关人员姓名研究中的职务姓名研究中的职务说明:对于任何选为“否”的项目,需要在说明栏中对于没有完成的原因进行详细说明。
对于选“是”的项目,也可以在说明栏中进行进一步的说明和解释。
1. 研究者信息项目是否不适用说明1.1 研究者接受过GCP的相关培训1.2 研究者有遵照GCP进行药物临床研究的经验1.3 研究者有进行器械临床研究的经验1.4 研究者有此研究适应症及治疗领域的临床经验1.5 主要研究者有较好的合作意愿(如果否,说明原因)1.6 研究者理解并同意执行临床试验操作中研究者的责任和义务1.6.1 临床试验数据记录、清理、报告和归档的程序1.6.2 知情同意的要求和程序1.6.3 试验用产品的储存、计数、分发和管理程序1.6.4 不良事件的报告程序1.6.5 临床监查程序并愿意配合1.6.6 稽查和视察程序并愿意配合1.6.7 主要研究者本人将会负责和/或监督这项研究的进行1.6.8 主要研究者需要有足够的时间进行本项研究第2.0版,2017年09月01日 1 / 6器械研究中心筛选访视报告/ CM_FM_029第2.0版,2017年09月01日6 / 6方案编号: 主要研究者:监查员:访 视 日 期:报告首次递交日期:1.6.9 主要研究者能安排/授权足够的有资质的人员进行本研究备注:2. 研究相关信息是否就以下信息与研究者和研究中心相关人员讨论是 否 不适用说明2.1 试验用产品信息(IB 研究者手册或产品说明书或指南) 版本:_____________ 日期:_____________ 2.2 研究方案或方案摘要 版本:_____________ 日期:_____________ 2.3 知情同意2.4 中心实验室2.5 电子数据收集系统(EDC )(如适用) 2.6 试验用产品的存储、分发、维护和/或校准流程2.7 其它研究特殊信息,请说明_______________________________备注:3. 伦理委员会信息项目是否说明3.1 伦理委员会会议召开的频率3.2 伦理委员会收费标准3.3 伦理委员会提交文件的时限要求 会议召开前 周 3.4 获得伦理批准文件的时间会议结束后 周 3.5 可以召开加急会议如果是,加急会议收费标准 3.6 愿意接受中心伦理3.7 伦理委员会有其他特殊要求器械研究中心筛选访视报告/ CM_FM_029方案编号:主要研究者:监查员:访视日期:报告首次递交日期:备注:4. 研究中心信息项目是否不适用说明4.1 研究中心为CFDA认证的药物临床试验机构4.2 认证专业涵盖本研究方案的适应症4.3 该认证专业接受过申办方的稽查/监查部门的视察4.4 研究中心的试验用产品储存条件满足方案要求4.5 研究中心实验室满足方案要求4.6 可以查阅患者病历(如果否,请说明)如选择是则表明原始记录可以满足下列要求:监查员可以查阅研究中心关于受试者在本研究中的入选合格性及其参与临床研究/随访相关的所有原始数据。
《fm临床报告》

研究设计
• 福达华(FLU): 25-30mg/m2 /d, i.v. d1-3 • 环磷酰胺(CTX): 300mg/m2/d, iv. d1-3 or • 米托蒽醌(MTN): 8 mg/m2 i.v. d1
每28天重复,共4-6个疗程; 地塞米松和利妥昔单抗可联合应用。
编辑课件
入组标准
› 年龄16~75岁; › ECOG评分≤2分; › 非霍奇金氏淋巴瘤,病理诊断为B细胞慢性淋巴细胞白血
编辑课件
Ma et al, British Journal of Heamatology, 124,754-761
FMD:出色的完全缓解率
病 完全缓解(%) p值 部分缓解 p值 总缓解(%) p值
例
(%)
所有病例 95 48 (50.5%)
17 (18%)
65 (68.5%)
初治
55 33 (60%)
编辑课件
研究目的
评价FC/FM方案一线或二线治疗惰性淋巴瘤的 :
• 有效性:参照NCCN的NHL疗效评价标准 • 安全性:参照WHO不良反应分级标准
编辑课件
研究设计
❖前瞻性、 多中心、开放性研究 ❖ 北方20家医院 ❖90例病例入组: (2004、8-2005、5)
目前39例可评价疗效和安全性
编辑课件
福达华在惰性淋巴瘤中的 应用经验分享
编辑课件
惰性淋巴瘤的主要类型
B细胞
慢性淋巴细胞白血病/小淋巴 细胞淋巴瘤(CLL/SLL)
滤泡性淋巴瘤(FL)(小细 胞和混合型/I-II级)
淋巴浆细胞淋巴瘤(LPL) 边缘带淋巴瘤(MZL)
T细胞
菌样霉菌病/赛塞里(Sezary) 综合征(MF/SS)
血管回声跟踪技术评价晚期妊娠颈动脉弹性的改变

血管回声跟踪技术评价晚期妊娠颈动脉弹性的改变
张智慧;杨梦玲
【期刊名称】《山西医药杂志》
【年(卷),期】2010(039)011
【总页数】2页(P510-511)
【作者】张智慧;杨梦玲
【作者单位】山西医科大学第二医院,030001;山西医科大学第二医院,030001【正文语种】中文
【相关文献】
1.血管回声跟踪技术评价多发性骨髓瘤患者颈动脉弹性改变 [J], 牛宏珍;郭瑞君
2.血管回声跟踪技术在评价类风湿关节炎患者颈动脉弹性中的应用 [J], 郭迎春;孟令茜;高志云;马星;刘文瑞;杨漪;彭肖
3.血管回声跟踪技术评价正常晚期妊娠妇女颈动脉弹性的改变 [J], 张智慧;杨梦玲;王雷
4.血管回声跟踪技术评价健康孕妇妊娠晚期颈动脉弹性的改变 [J], 王军;韩月婷;李兆芳
5.血管回声跟踪技术评价绝经后骨质疏松症患者颈动脉弹性功能 [J], 王富玲;郭丽苹;甘田;段丽红;尹丽
因版权原因,仅展示原文概要,查看原文内容请购买。
我科学家发现导致乳腺癌耐药的新标志物

我科学家发现导致乳腺癌耐药的新标志物
佚名
【期刊名称】《中国医药生物技术》
【年(卷),期】2011(6)4
【摘要】军事医学科学院蛋白质组学国家重点实验室张学敏课题组与解放军总医院韦立新课题组联合攻关,在乳腺癌内分泌治疗的耐药机制研究中取得重大成果,发现炎症调控分子CUEDC2在乳腺癌细胞中过量表达导致了乳腺癌患者对内分泌治疗产生耐药,并深入揭示了CUEDC2诱发耐药的全新分子机制,对于指导临床治疗具有重要意义。
周涛、潘欣和邰艳红作为共同第一作者的研究论文5月16日在国际权威学术期刊《自然医学》在线发表并将于近期正式刊出。
【总页数】1页(P290-290)
【关键词】乳腺癌患者;耐药机制;新标志物;科学家;国家重点实验室;军事医学科学院;内分泌治疗;解放军总医院
【正文语种】中文
【中图分类】R737.9
【相关文献】
1.英美科学家称脐血有助于预测过敏/科学家发现导致孕妇疟疾高发的原因/乳腺癌每年递增3%专家称手术不必"一刀切"/股骨头坏死治疗在我国取得重大突破/我国研制的抗艾中药进入Ⅱ期试验/肝细胞移植手术获得成功 [J],
2.科学家发现导致乳腺癌的绝大多数相关基因突变 [J], 张坛
3.科学家发现导致乳腺癌细胞扩散基因 [J], 无
4.科学家发现导致乳腺癌扩散基因 [J],
5.耐药机制是乳腺癌治疗一个亟待解决的难题我科学家发现导致乳腺癌耐药的新标志物 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
CM_FM_031 器械研究中心启动访视报告 v2

器械研究中心启动访视报告/ CM_FM_031
第2.0版,2017年09月01日
1 / 7
器械研究中心启动访视报告
参加中心启动访视的人员名单:
说明:对于任何选为“否”的项目,需要在说明栏中对于没有完成的原因进行详细说明。
对于选“是”的项目,也可以在说明栏中进行进一步的说明和解释。
1. 研究者培训
1.1 试验方案相关培训
方案版本: _______________日期:_______________
器械研究中心启动访视报告/ CM_FM_031
第2.0版,2017年09月01日
4 / 7
1.2 试验用产品相关培训
1.3 研究者职责相关培训
器械研究中心启动访视报告/ CM_FM_031
第2.0版,2017年09月01日
4 / 7
1.4 监查及稽查/视察相关培训
1.5 文件管理相关培训
1.6 特殊试验程序相关培训
2. 受试者的招募计划
器械研究中心启动访视报告/ CM_FM_031
3. 试验设备和物资
第2.0版,2017年09月01日4 / 7
器械研究中心启动访视报告/ CM_FM_031
第2.0版,2017年09月01日
4 / 7
4. 研究者文件夹
器械研究中心启动访视报告/ CM_FM_031
第2.0版,2017年09月01日
4 / 7
5. 监查员小结
有 无
6. 待解决问题表
6.1 已解决的问题
6.2 需后续跟进/解决的问题
器械研究中心启动访视报告/ CM_FM_031
第2.0版,2017年09月01日
4 / 7
签名栏。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
研究中心启动访视报告/ CM_FM_002
第3.0版,2017年06月01日
1 / 7
研究中心启动访视报告
参加中心启动访视的人员名单:
说明:对于任何选为“否”的项目,需要在说明栏中对于没有完成的原因进行详细说明。
对于选“是”的项目,也可以在说明栏中进行进一步的说明和解释。
1. 研究者培训
1.1 试验方案相关培训
方案版本: _______________日期:_______________
研究中心启动访视报告/ CM_FM_002
第3.0版,2017年06月01日
2 / 7
1.2 试验用药品/产品相关培训
1.3 研究人员的相关培训以及主要研究者的监管
研究中心启动访视报告/ CM_FM_002
第3.0版,2017年06月01日
3 / 7
1.4 监查及稽查/视察相关培训
1.5 文件管理相关培训
1.6 特殊试验程序相关培训
2. 受试者的招募计划
研究中心启动访视报告/ CM_FM_002
第3.0版,2017年06月01日 4 / 7
研究中心启动访视报告/ CM_FM_002
第3.0版,2017年06月01日
5 / 7
3. 试验用药品/产品,设备和物资
4. 研究者文件夹
研究中心启动访视报告/ CM_FM_002
第3.0版,2017年06月01日
6 / 7
5. 监查员小结
有 无
6. 待解决问题表
6.1 已解决的问题
6.2 需后续跟进/解决的问题
研究中心启动访视报告/ CM_FM_002
第3.0版,2017年06月01日
7 / 7
签名栏。
