八年级科学下册第二章化学元素种类与元素符号
八年级科学元素和元素符号精选课件PPT

稀有气体元素分布在元素周 期表的最后一纵行。
推测:元素的性质,新元素等。
2 . 作用: 查找:元素符号,相对原子质量等。
推测:元素的性质,新元素等。
解析
周期 (7个)
族 (16个)
短周期
第一周期 第二周期
第三周期 第四周期
长周期
第五周期
第六周期
不完全周期
第七周期
—— 2 种 —— 8 种 —— 8 种 —— 18 种
—— 18 种 —— 32 种
—— 26 种
主族
共 7 个主族,包括短周期和长周期元素
副族
共 7 个副族,只包括在长周期中
第VIII族 0族
包括第8、9、10 纵行 稀有气体元素
原子序数:
元素周期表按元素原子核电荷数 递增的顺序给元素编的号。原子 序数与原子核电荷数在数值上相 同。
元素周期表
57La 58 59 60 61 62 63 64 65 66 67 68 69 70 71Lu 镧 Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb 镥 89Ac 90 91 92 93 94 95 96 97 98 99 100 101 102 103Lr 锕 Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No 铹
②这种元素的一个原子
例如:“H”
①表示氢元素
②表示一个氢原子
例如:“Fe” ①表示铁元素 ②表示一个铁原子
3 素与原子的区别
概念 区别
使用 范围 联系
举例
元素
原子
具有相同的核点荷数(即核内 是化学变化中的最小粒子。 质子)的一类原子的总称。
浙教版科学八年级下册 第二章4-5节元素和元素周期表(含答案)

浙教版8年级下册第二章第4-5节元素与元素周期表一、元素种类和分布1.元素观是化学的重要观念之一,下列有关元素的说法中错误的是()A.元素是具有相同核电荷数的一类原子的总称B.同种元素的原子核内质子数与中子数一定相等C.在物质发生化学变化时,原子的种类不变,元素也不会改变D.在元素周期表中,元素的原子序数与该元素原子核电荷数在数值上相同2.市场上有“含铁酱油”、“高钙牛奶”等商品,这里的“铁、钙”指的是()A.元素B.原子C.单质D.分子3.某矿石样本含有如图所示的四种元素,该矿石中可能含有的物质是()A.CaCl2B.SiO2C.H2OD.Fe2O34.下列说法错误的是()A.人类已知的元素有110多种B.一氧化碳由氧和碳两种元素组成C.在已知元素中,非金属元素占大多数D.金属铁和非金属硫都属于单质5.元素中文名称大多数都是使用形声造字法,根据元素名称的汉字可判断金属元素、非金属元素。
下列各组元素属于非金属元素的一组是()A.汞、铁、铝、锕B.氪、铹、镧、碘C.溴、氟、砷、碲D.汞、溴、砹、氡6.下列说法正确的是()①地壳中最多的金属元素是铝,也就是金属铝②人体中只含有非金属元素,没有金属元素③人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关④地壳中非金属元素的总含量大于金属元素,种类少于金属元素A.①③④B.②③④C.③④D.①②7.如图是地壳中各元素的含量(质量分数)图,据此判断下列说法正确的是()A.含量最多的元素是非金属元素B.含量最多的元素是金属元素C.铁的元素符号为FED.由图可知,各元素在地壳中的含量相差不大8.按下列要求填写元素符号。
(1)空气中含量最多的元素是________。
(2)人体中含量最多的元素是________。
(3)地壳中含量最多的金属元素是________。
(4)海水中含量最多的金属元素是________。
9.根据如图所示的A、B、C三幅元素含量示意图,试推测元素分布领域,将图下字母序号填写在相应位置。
2020春浙教版八年级科学下册课件-第2章-2.5.1 元素符号

照此规定,第104号元素的拉丁文名称按照“un+nil+ quad+ium(词缀)”应为“Unnilquadium”,其元素符号 规 定 为 “Unq” , 第 105 号 元 素 的 拉 丁 文 名 称 为 “Unnilpentium”,元素符号为“Unp”,依此类推,请 分别给下列元素命名。 (1)第111号元素的元素符号为__U__u_u___。 (2)元素符号Une对应的是第___1_0_9___号元素。
镁__M__g____; 钠___N_a____; Al___铝_____; O___氧_____。
2.用元素符号表示下列内容。 (1)5个镁原子___5_M__g__________。 (2)氧元素____O________________。 (3)n个钠原子__n_N__a___________。 (4)1个氯原子__C__l ____________。
第2章 微粒的模型与符号
第5节 表示元素的符号 第1课时 元素符号
提示:点击 进入习题
答案显示
1 S;Si;Mg;Ca;K;Na;碳;氮;铝;磷;氦;氧
2 (1)5Mg (2)O (3)nNa (4)Cl
3 ①铁元素;②一个铁原子;③铁这种物质 ①氢元素; ②一个氢原子
4C
5D
6C
7A
8B
9A
10 A
7.下列符号中,既表示一个原子,又表示一种元素,还 能表示一种物质的是( A ) A.He B.N2 C.H D.2O2
【点拨】氦是由原子直接构成的物质。
8.下列符号所表示的元素中全部是金属元素的是( B )
A.O C H Cl B.Al Fe Zn Hg
C.H P Si K
D.S Mg N Ar
2.5表示元素的符号浙教版八年级科学下册课件

小结: 一、元素符号的表示方法:
用该元素的拉丁文的第一个大写字母来表示,若有重复则取 前两个字母,第二个小写
二、元素符号的意义: (1)(宏观)表示一种元素 (2)(微观)表示这种元素的一个原子 (3)(宏观)由原子直接构成的物质,还可以表示这种物质
如何将这些元素排列起来呢?
表示元素的符号
元素周期表
Oxygenium
O
H2和2H中数字“2”的意义相同吗?
氮 查阅P171元素周期表,将P54表2-5填写完整
Nitrogenium
N
碳
Carbonium
C
元素符号
如果有多种元素的拉丁文第一个大写字母是相同的,怎么办?
中文名称 碳 铜
拉丁文 Carbonium Cuprum
2.若有复,则取前两个字母,第二个小写。
门捷列夫的元素周期表
2.结构特点
元素周期表按元素原子核电荷数递增的顺序给元素编号,原子 序数与原子核电荷数在数值上相同。
7个横行,每一横行叫一个周期,共7个周期。 18个列,每纵行叫做族。同族各元素的化学性质相似。
2.结构特点
金属元素主要分布在元素周期表的左边。 非金属元素主要分布在元素周期表的右边。 稀有气体元素分布在元素周期表的最后一族。
用该元素的拉丁文的第一个大写字母来表示,如H。
钙
锰
铁
铜锌
金
银
H2中2表示一个氢分子由2个氢原子构成。
核电荷数 H2和2H中数字“2”的意义相同吗?
(2)推测元素的性质,推测1新6元素等1。7 18 19
20
25
26
29 30
79
47
镁铝硅磷
12 13 14 15
八年级下科学元素符号(一览表)复习

八年级下科学元素符号(一览表)复习氢-H-1; 氦-He-2; 锂-Li-3;铍-Be-4; 硼-B-5; 碳-C-6;氮-N-7; 氧-O-8; 氟-F-9;氖-Ne-10; 钠-Na-11; 镁-Mg-12;铝-Al-13; 硅-Si-14; 磷-P-15;硫-S-16; 氯-Cl-17; 氩-Ar-18;钾-K-19; 钙-Ca-20; 锰-Mn-25;铁-Fe-26; 铜-Cu-29; 锌-Zn-30;金-Au-79; 银-Ag-47; 碘-I-53;钡-Ba-56; 汞-Hg-80; 铅-Pb-82;【关于元素符号和化合价的顺口溜】一价钾钠氯氢银二价氧钙钡镁锌三铝四铁五硅磷二三铁,二四碳二四六硫都齐全铜汞二价最常见*以下的元素符号及相对原子质量必须记住*1 H 氢 1.00792 He 氦 4.00263 Li 锂 6.9414 Be 铍 9.01225 B 硼 10.8116 C 碳 12.0117 N 氮 14.0078 O 氧 15.999 9 F氟 18.99810 Ne 氖 20.17 11 Na 钠 22.9898 12 Mg 镁 24.30513 Al 铝 26.982 14 Si硅 28.085 15 P 磷 30.97416 S 硫 32.06 17 Cl 氯35.453 18 Ar 氩 39.9419 K 钾 39.098 20 Ca 钙 40.08*元素符号*Mn 锰 Fe 铁 Cu铜 Zn 锌 I碘 Au金 Hg汞 Pb铅2、化合价钾 K +1 氯 Cl +1,+5,+7钠 Na +1 氧 O -2银 Ag +1 硫 S -2,+4,+6钙 Ca +2 碳 C +2,+4镁 Mg +2 硅 Si +4钡 Ba +2 氮 N -3,+2,+4,+5锌 Zn +2 磷 P -3,+3,+5铜 Cu +1,+2 铁 Fe +2,+3,铝 Al +3 氟 F -1锰 Mn +2,+4,+6,+7 氢 H +1 (带2个单位的负电荷),-2价碳酸根 --CO3磷酸根 --PO(带3个单位的负电荷),-3价4(带1个单位的负电荷),-1价硝酸根 --NO3硫酸根 --SO(带2个单位的负电荷),-2价4(带1个单位的负电荷),-1价氯酸根 --ClO3氢氧根–OH (带1个单位的负电荷), -1价(带1个单位的正电荷),+1价铵根 --NH4。
浙教版科学八年级下册复习课:元素元素符号及物质符号课件
二、元素的分布(P51)
1、地壳中元素:O Si Al Fe
2、人体中元素:O C H 3、海水中元素: O H Cl Na Mg
海洋是个资源宝库
4、有机物中元素: C H O
5、人造元素:是通过核反应制得的。
6、放射性元素:对人体有害, 但利用放射性可以检查和治疗一些疾病, 如“放疗”治癌症、用 X 射线检查肺部等 也可以用于灭菌和消毒,如辐照食品。
常见的带电原子团
离子的名称 离子的符号
氢氧根离 子硫酸根离子
硝酸根离子 碳酸根离子
碳酸氢根离子 铵根离子
亚硫酸根离子 磷酸根离子
OH-
SO42-
NO3CO32HCO3-
NH4+
SO32PO43-
离子所带的电荷数
-1 -2 -1 -2 -1 +1 -2 -3
常见元素的化合价
金属 元素
元素 符号
常见的 化合价
5、元素符号周围数字的意义
数字位置
数字的意义
实际例子
元素符号 前面
表示单独的微粒的 个数
2H表示2个氢 原子
元素符号 表示每个分子(原子 H2中2表示一个氢分 右 下 角 团)中某原子的个数 子由2个氢原子构成
元素符号 右上角
表示离子所 带的电荷数
Ca2+中2表示钙离子 带两个单位正电荷
元素符号 上方
六、离子符号(P61)
1、离子符号的写法 2、原子团
七、化合价(P61-62)
1、化合价的概念 2、化合价的表示方法
3、化合价数值 4、化合价的一般规律
5、化合价的应用
(1)已知一种元素化合价,求另一种元素的化合价 (2)根据元素化合价写化合物的化学式 (3)检查化学式的正误
科学八(下)化学部分最基础最重要必背知识点
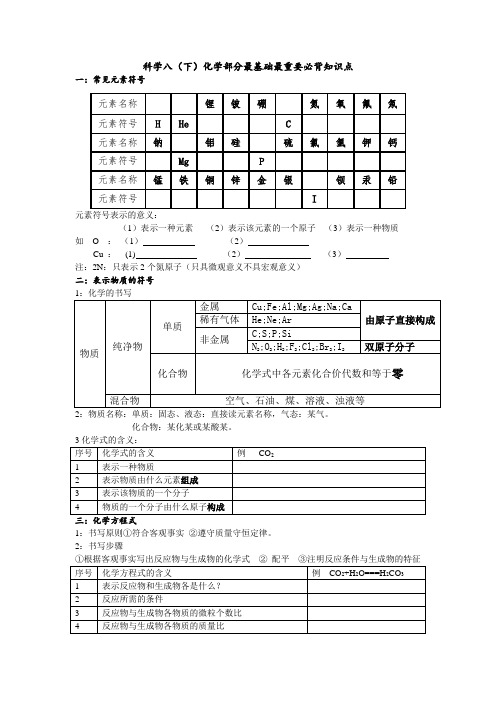
3化学式的含义:
序号
化学式的含义
例CO2
1
表示一种物质
2
表示物质由什么元素组成
3
表示该物质的一个分子
4
物质的一个分子由什么原子构成
三:化学方程式
1:书写原则①符合客观事实②遵守质量守恒定律。
2:书写步骤
①根据客观事实写出反应物与生成物的化学式②配平③注明反应条件与生成物的特征
离子名称
符号
化合价
离子名称
符号
化合价
离子名称
符号
化合价
铵根
碳酸根
高锰酸根
氢氧根
亚硫酸根
锰酸根
硝酸根
硫酸根
氯酸根
碳酸氢根
磷酸根
五:化学式书写练习
一、单质:
氦气
氖气
磷
银
钠
铝
氩气
镁
金刚石
石墨
碘
氯气
氧气
金
钾
氢气
足球烯
C60
铁
铜
硫
氮气
硅
锌
臭氧
二、氧化物:
水
五氧化二磷
氧化铁
二氧化硫
氧化镁
氧化亚铁
三氧化硫
氧化钙
四氧化三铁
氯化铁
硫酸铁
硫酸铜
硝酸银
氯化银
硫酸银
硝酸铵
氯化铵
硫酸铵
碳酸钾
碳酸钠
碳酸钡
碳酸钙
高锰酸钾
碳酸铵
锰酸钾
氯酸钾
序号
化学方程式的含义
例CO2+H2O===H2CO3
1
表示反应物和生成物各是什么?
浙教版科学八年级下册第二章第五节-表示元素的符号 练习(有答案)

表示元素的符号1.元素符号:国际上统一用文的第一个大写字母来表示元素,当两种元素的第一个字母相同时,则再附上一个小写字母作为该元索符号,以示区别。
如铜的元素符号为Cu。
2.常见的元素符号:①金属元素:钾、钙、钠、镁、铝、锌、铁、锡、铅、铜、汞、银、铂、金、钡、锰、锂、铍。
②非金属元素:碳、硅、硫、磷、氢、氧、氮、氟、氯、溴、碘。
③稀有气体:氦、氖、氩。
3.元素符号的含义:既有宏观的含义,又有微观的意义。
①表示;②表示;③由原子直接构成的物质,元素符号还表示物质。
4项目元素原子离子分子概念具有相同的同一类原子的总称化学变化中的最小微粒带电的原子或原子团保持物质的一种微粒涵义只分种类不论个数既可表示种类又可表示个数在化学反应中元素的种类不变原子不可分,但原子可以转变为离子。
阴离子失电子得电子原子失电子得电子阳离子可分为原子组成物质物质金属单质:Mg等稀有气体:He等少数非金属单质:C、S等离子化合物:NaCl等……非金属单质:O2、H2等……5.元素周期表是按从小到大有序排列起来的,它共有个横行,个纵列。
每一个横行叫做一个,每一个纵列叫做一个(其中8、9、10 三个纵列共同组成一个族)。
根据元素所在周期表中的位置,我们可以知道该元素原子的质子数(核电荷散)、核外电子数,元素的化学性质,等等。
6.元素周期表的每一周期从左到右按元素→元素→元素顺序排列。
每一族元素具有相似的,每一周期中相同。
7.元素周期表足学习和研究科学的重要工具。
元素周期表的排列可以告诉我们:元素单质的物理状态;元素是人工合成的还是自然存在的;元素是金属、非金属还是稀有气体。
元素周期表中的每一格都包含了特定的信息,如右图中,92表示,U表示,红色是表示该元素是,铀是。
题型一元素符号1.化学用语是学习化学的重要工具,是国际通用的化学语言。
下列符号表示两个氧原子的是()A.O B.2O C.O2D.O2-2.“2N”表示的意义是()A.表示两个氮元素B.表示两种氮元素C.表示两个氮原子D既表示两个氮元素,又表示两个氮原子题型二元素周期表1.镁有“国防金属”的美誉。
科学八下第二章知识点 (1)

第二章知识要点第一节模型、符号的建立与作用第二节物质的微观粒子模型1、构成物质的微粒有分子、原子、离子分子构成的物质:水是由水分子构成、氧气是由氧分子构成、二氧化碳是由二氧化碳分子构成,还有甲烷、二氧化硫、一氧化碳、氯气、氢气、氮气、过氧化氢等原子构成的物质:铁是由铁原子构成、石墨是由碳原子构成,还有:金属单质(如:铁、钠等)、稀有气体单质(如:氦气、氖气、氩气等),部分固态非金属单质(如:碳、磷、硫、硅等)。
离子构成的物质:食盐是由氯离子和钠离子构成,还有硫酸、盐酸、氢氧化钙溶液等2、分子由原子构成,分子的种类由原子的种类和数目决定。
如水分子是由氧原子和氢原子构成、氧分子是由氧原子构成3、由分子构成的物质,分子是保持物质化学性质的最小微粒;在化学变化中原子不能再分,原子是化学变化中的最小微粒。
分子与原子的主要区别是:在化学变化中,分子可分,而原子不可分。
在化学变化中,分子种类发生变化,而原子种类和原子数目没有发生变化。
4、水的三态变化:水分子本身没有发生变化,只是分子之间的距离发生了变化,所以是物理变化水的电解:水分子分解成了氧原子和氢原子,氧原子和氢原子重新组合成氧分子和氢分子,分子本身发生了变化,所以是化学变化5、分子和原子都有一定的质量和体积。
原子半径一般在10-10米,1 个碳原子的质量约为1.993×10-26千克。
第三节原子结构的模型1、原子结构模型的发展历史:汤姆森、卢瑟福、玻尔等2、原子结构质子:每一个质子带一个单位的正电荷原子核(带正电)原子(带正电)中子(不带电)核外电子(带负电):每个电子带一个单位的负电荷说明:(1)原子核和核外的电子所带的电荷总数相等,电性相反,整个原子不显电性(2)核电荷数(原子序数) = 质子数 = 核外电子数(注:原子核所带的电荷数为核电荷数。
(3)相对原子质量=质子数+中子数(4)中子数可以为零,如氢原子(5)质子和中子又是由更小的微粒夸克构成(6)原子的质量集中在原子核上,电子的质量可忽略不计。
八年级科学下册第二章第5节表示元素的符号教案浙教版

1教学目标
1。认识常见的元素符号,掌握元素符号所表示的意义;2。初步认识元素周期表,并通过元素周期表了解元素的排列与性质;3。通过学习元素周期表,初步体会学习科学需要严谨,细致的科学态度和勇于发现和创新的精神。
2学情分析
“表示元素的符号”是浙教版八年级科学下册第二章第五节的教学内容,除第四节“组成物质的元素”外,前三节均与元素符号没什么联系,在七年级和八年级上学期三个学期的教学内容安排中均没有任何铺垫,学生可以说对元素符号是零认识,为此,这节的教学内容分成了以“元素符号”和“元素周期表"为中心的两课时。元素符号的认识是否到位将直接决定第六、第七节的教学能否顺利进行,是“表示物质的符号”和“根据元素符号表示的量"能否后续教学的基础。
元素符号
3.讨论H元素符号表示的意义
4.讨论Fe元素符号表示的意义
5.讨论:2H 、H2、H2O中数字“2”所表示的意义
三、合作提升
1。下列元素符号书写正确的( )
A.MN B. CA C. mg D. Zn
2.“2N”表示的意义是( )
A.表示两个氮元素 B.表示两种氮元素
C.表示两个氮原子 D、既表示两个氮元素,又表示两个氮原子
氖_________汞_______铜_________氧__________锌_______氮________
4、元素符号表示的意义:表示____________;还表示________________________。
二、合作探究
1.改正下列错误的元素名称或符号
炭 锰 钙 镁 氯 钠 氖
C MN CA Ma CL na HE
3.下列各组元素中,元素符号的小写字母相同的一组是( )
【精品讲义】浙教版 科学 8年级下册 2.5.2 表示元素的符号——元素周期表(学生版)

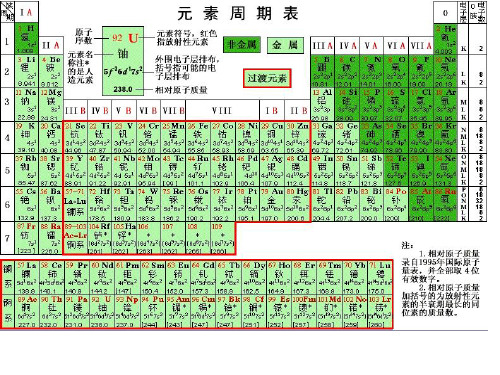
浙教版八年级下科学同步学习精讲精练第2章微粒的模型与符号2.5-2表示元素的符号——元素周期表目录 (1) (2) (3) (5) (7)元素周期表根据元素的原子结构和性质,把现在已知的110多种元素按原子序数(核电荷数)科学有序地排列起来,得到的表叫作元素周期表。
1.编排结构(1)横行(周期)元素周期表每一横行代表一个周期,共有7个横行,表示7个周期,同一周期从左到右,原子的质子数逐渐增加。
每个周期开头的是金属元素(第一周期除外),靠近尾部的是非金属元素,结尾的是稀有元素,这正是“周期性”的具体表现。
(2)纵列(族)元素周期表每一个纵列叫作一个族,共有18个纵列,16个族(其中第8、9、10三个纵列共同组成一个族)。
同族元素的化学性质相似。
(3)每一格在元素周期表中,每一种元素均占据一格,每一格均包括元素的原子序数、元素符号、元素名称、相对原子质量等内容。
其中,对于原子而言,原子序数=核电荷数=质子数=核外电子数。
(4)从元素周期表中可获得的信息①从元素周期表的排列可知元素单质的物理状态;元素是人工合成的还是自然存在的;元素是金属、非金属还是稀有气体等。
②根据元素所处的位置可知该元素原子的质子数(核电荷数)核外电子数、元素的化学性质等。
2.元素周期表的意义(1)它是学习和研究化学的重要工具,为寻找新元素提供理论依据。
(2)由于元素周期表中位置越靠近的元素性质越相似,启发人们在元素周期表的一定区域内寻找新物质(如半导体材料、农药、催化剂等)。
元素周期律的理解元素周期表中,每周期(除第一周期外)开头的是金属元素,靠近尾部的是非金属元素,结尾的是稀有气体元素。
1~4主族以金属元素为主,副族全部是金属元素,5~7主族以非金属元素为主,0族全部是稀有气体元素。
说明自然界各元素间存在着元素性质等方面的周期性变化。
我们可以根据这种周期性变化掌握元素的性质。
如判断元素的活动性:同一周期中越靠左金属性越强,从左到右非金属性逐渐增强;同一主族中越向下金属性越强,所以金属活动性Na>Mg>Al,K>Na。
浙教版(科学)八年级下表示元素的符号课件
核电荷数 11 12 13 14 15 16 17 18 19 20 元素名称 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙
元素符号 Na Mg Al Si P S Cl Ar K Ca
核电荷数 25 26 29 30 79 47 53 56 80 82 元素名称 锰 铁 铜 锌 金 银 碘 钡 汞 铅
符号Cu的意义有哪些?
1.(宏观)表示铜元素
2. (微观)表示一个铜原子 3. (宏观)表示金属铜(这种物质)
说说以下符号的意义:
O
表示氧元素 表示一个氧原子
2OLeabharlann 表示2个氧原子Fe 表示铁元素 3Fe 表示3个铁原子 表示一个铁原子 表示金属铁
已知的元 素有110 多种
科学 有序 排列
元素周 期表
2、结构特点
7个横行,每一横行叫做一个周期,一共有7个周期。
18个列,每纵行叫做族。同族各元素的化学性质类似。
金属元素主要散布在元素周期表的左边。 非金属元素主要散布在元素周期表的右边。 稀有气体元素散布在元素周期表的最后一族。 原子序数:元素周期表按元素原子核电荷数递增的顺序给元素编的号. 原子序数与原子核电荷数在数值上相同。
氧元素 Oxygenium
元素符号是国际上统一采用的符 号,通常用该元素拉丁文的第一 个字母(大写)来表示。
例:氧元素 Oxygenium
O
碳元素
Carbon
C
H
氢元素 Hydrogrn
思考:
❖ 钙元素的拉丁文为“Calcium”,钙元素的元素 符号应是什么?
❖
Ca
❖ 当两个元素的第一个字母相同时,可写上该元 素名称的第二个字母(小写)以示区分.
初二下学期科学各化学元素简介

氖气是一种无色的稀有气体,把它放电时呈橙 红色。氖最常用在霓红灯之中。空气中含有少 量氖。
Back
名称:钠(Sodium) 符号:Na 原子序数:11 金属元素 组成的常见物质:钠 相对原子质量:23
钠是一种金属元素,质地柔软,钠也是人体肌 肉组织和神经组织中的重要成分之一。
Back
名称:镁(Magnesium) 符号:Mg 原子序数:12 金属元素 组成的常见物质:镁 相对原子质量:24
氩,是稀有气体中在空气中含量最多的一个, 化学性极不活泼,但是已制得其化合物——氟 氩化氢。
Back
名称:钾(Potassium) 符号:K 原子序数:19 金属元素 组成的常见物质:钾 相对原子质量:39
钾是一种银白色的软质金属,熔点低,性质很 活泼。钾元素以盐的形式广泛的分布于陆地和 海洋中,钾也是人体肌肉组织和神经组织中的 重要成分之一。 Back
镁是一种银白色的轻质碱土金属,化学性质活 泼,镁元素在自然界广泛分布,是人体的必需 元素之一。
Back
名称:铝(Aluminum) 符号:Al 原子序数:13 金属元素 组成的常见物质:铝 相对原子质量:27
铝是银白色轻金属。有延展性。常制成棒状、 片状、箔状、粉状、带状和丝状。
Back
名称:硅(Silicon) 符号:Si 原子序数:14 非金属元素 组成的常见物质:二氧化硅 相对原子质量:28 硅是极为常见的一种元素,然而它极少以单质 的形式在自然界出现,而是以复杂的硅酸盐或 二氧化硅的形式,广泛存在于岩石、砂砾、尘 土之中。在地壳中,它是第二丰富的元素,构 成地壳总质量的26.4%,仅次于第一位的氧( 49.4%)。 Back
名称:钙(Calcium) 符号:Ca 原子序数:20 金属元素 组成的常见物质:钙 相对原子质量:40
初二下科学必须掌握的元素符号

初二下科学必须掌握的元素符号、化学式、离子化合价口诀:钾钠银氢+1价,氟氯溴碘-1价,默一遍初二阶段要掌握的化学方程式:氧气的实验室制法:①双氧水在二氧化锰的催化下分解:②高锰酸钾受热分解:③氯酸钾受热并在二氧化锰的催化下分解:二氧化碳的实验室制法:二氧化碳的工业制法:检验二氧化碳:水电解:氢气在氧气中点燃:红磷在空气中燃烧:木炭燃烧:硫磺燃烧:镁带燃烧:铁丝在氧气中燃烧:铁生锈:氢氧化钠与硫酸铜反应生成蓝色絮状沉淀:硫酸铜晶体受热分解:光合作用:呼吸作用:答案——初二下科学必须掌握的元素符号、化学化合价口诀:钾钠银氢+1价,氟氯溴碘-1价,默一遍2H2O2=2H2O+O2↑MnO2氧气的实验室制法:2KMnO4=K2MnO4+MnO2+O2↑△双氧水在二氧化锰的催化下分解:②2KClO3=2KCl+3O2↑△MnO2高锰酸钾受热分解:③高温CaCO3=CaO+CO2↑CaCO3 + 2HCl =CaCl2 + H2O + CO2↑Ca(OH)2 + CO2 =CaCO3↓+ H2O2H2O =2H2↑+ O2↑通直流电点燃2H2 +O2=2H2O点燃4P +5O2=2P2O5点燃C +O2=CO2点燃S +O2=SO2点燃2Mg +O2=2MgO3Fe +2O2=Fe3O42NaOH + H2SO4=Na2SO4 + Cu(OH)2↓4Fe +3O2=2Fe2O3△Cu SO4 ·5H2O =CuSO4 + 5H2O6CO2 + 6H2O → C6H12O6 +6O2叶绿体光C6H12O6 +6O2→ 6CO2 + 6H2O + 能量酶O2=2O2 O +O2=O3。
浙教版八年级科学下册课件 第二章 第5节 表示元素的符号

典例2 如图是元素周期表中的一格,依据图中的信息判断下列说法,错误的是( )
B
A.该元素原子的质子数为14B.该元素属于金属元素C.该元素一个原子的原子核外有14个电子D.该元素的元素符号为
角度2 元素符号表示的意义
典例4 如图是镆元素的信息,下列有关说法错误的是( )
B
A.镆属于金属元素B.一个镆原子的原子核内有115个中子C.“ ”表示镆这种物质、镆元素、1个镆原子D.“ ”表示3个镆原子
[解析] 镆的原子序数是115,则其原子核内质子数是115,但中子数不一定是115。
知识点1 元素符号重点
1.元素符号的表示及书写
2.常见元素的元素符号
元素名称
氢
氦
锂
铍
硼
碳
氮
氧
氟
氖
钠
镁
铝
硅
磷
核电荷数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
元素符号
B
C
元素名称
硫
氯
氩
钾
钙
锰
铁
铜
锌
银
碘
钡
金
汞
铅
核电荷数
16
17
18
19
20
25
26
[解析] 根据元素名称可知该元素是非金属元素。
题型1 元素符号
角度1 元素符号的书写
典例3 对下表内错误的元素名称或符号进行改正:
元素符号化学式

八年级科学下册化学部分考试内容
请大家一定每天用十分钟时间记一记背一背!
一、常见元素符号及名称
氢H 氦He 锂Li 铍Be 硼B;
碳C 氮N 氧O 氟F 氖Ne
钠Na 镁Mg 铝Al 硅Si 磷P;
硫S 氯Cl 氩Ar 钾K 钙Ca
锰Mn 铁Fe 铜Cu 锌Zn 金Au;
银Ag 碘I 钡Ba 汞Hg 铅Pb
【注】元素名称中“气”部首的,常温下单质是气态非金属;“石”部首的,常温下单质是固态非金属;“钅”为部首,单质是金属(汞也是金属)。
二、常见元素化合价
1
氢钾钠银正一价,氟氯溴碘负一价,钙镁钡锌正二价,通常氧是负二价;
+1、+2铜,+2、+3铁,+3铝+4硅+5价磷(读一、二铜、二三铁,三铝四硅五价磷)。
(一般规律:氢+1 价,氧—2价;金属元素总是正价。
)
2、化合法则:单质的化合价为零。
化合物中所有元素化合价的代数和为零。
3、根据化合价正确书写化学式:
2
5-
+
O
P,化学式是P2O5
4、标出元素的化合价:如:
Fe(单质);
2
3
6-
+
O
S
三、常见物质名称及化学式:
1、化合物化学式读写法则:先读后写,先写后读。
(即:在物质名称中先读的,在化学式中其元素符号就后写。
)
2。
元素符号化合价化学式化学方程式等基础知识

八年级科学基础知识复习目标:巩固元素符号、化合价、化学式、化学方程式等基础知识。
复习内容:一、元素符号:书写规范:第一个字母大写,第二个字母小写。
常见元素的元素符号:非金属元素:氢H 氧O 氮N 氯Cl 碳C 硫S 磷P 硅Si金属元素:钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 铜Cu 汞Hg 银Ag 锰Mn 钡Ba 二、化合价:常见元素的化合价:氢钾钠银+1价,钙镁钡锌+2价,1、2铜汞2、3铁,铝为+3-2氧。
硫负为2负1氯,元素变价切莫怪。
常见原子集团的化合价三、化学式0。
书写原则:真实、化合价代数和为Cu 氧气O单质:氢气H氮气锌P 磷硫C 碳S 氯气ClN Zn 铁Fe 铜2 2 2 2化合物:1、根据名称书写化学式:CClO SO二氧化硫OFeP五氧化二磷四氧化三铁四氯化碳二氧化碳CO44 35 2 2 22、根据化合价书写化学式:氧化钠NaO 氧化钾KO 氧化铜CuO 氧化钙CaO 氧化亚铁FeO 氧化铁FeO 氧化铝AlO3 22232氯化钠NaCl 氯化亚铁FeCl氯化铁FeCl硫化钠NaS 硫化锌ZnS2 3 2硫酸钠NaSO 硫酸锌ZnSO硫酸亚铁FeSO 硫酸铁Fe(SO)碳酸钠NaCO碳酸钙CaCO3 424 223 4 4 3 硝酸钠NaNO硝酸银AgNO硝酸铜Cu(NO) 磷酸钙Ca(PO) 23 343 2 3氢氧化钾KOH 氢氧化铜Cu(OH)氢氧化铁Fe(OH)3 2硝酸铵NHNO硫酸铵(NH)SO碳酸氢铵NHHCO3 442443四、化学方程式书写原则:真实、质量守恒1、化合反应:点燃点燃CO C + O 2H + O 2H O 2 222 2点燃点燃+ 5O S + O2PO4P SO 5 2 2 2 2点燃HCOCO FeO 3Fe + 2O + HO 3 2 2 223 42、分解反应:通电二氧化锰HO + O↑O 2H 2H↑+ O↑O2H2 22 2 222CO ↑+ HOHCO 23 22KMnO + 2KMnO MnO+ O↑ 4 42 22二氧化锰2KCl 2KClO + 3O↑3 23、其它:CaCO↓+ CO + Ca(OH)HO 2322点燃CO + CH+ 2O2HO22 4 2五、符号周围数字的含义(一)、符号(化学式、元素符号、离子符号)前面的数字只表示粒子(分子、原子、离子)的个数。
八年级科学下册第二章化学元素种类与元素符号分析

教师学生姓名上课日期17-2-2 学科科学年级八年级教材版本浙教版学案主题元素符号的认识课时数量(全程或具体时间)第(2)课时授课时段13:00-15:00教学目标教学内容元素及表示的意义个性化学习问题解决1、知道组成人体、地球的主要元素2、元素周期表的认识3、组成物质的原则重、难点化学重要引入教学过程第4节:组成物质的元素【知识梳理】1.元素的种类和分类人类已知的化学元素有110多种,其中有些是人造元素。
根据性质的类似,初步把元素分类金属元素和非金属元素(含有稀有元素)2.物质的简单分类(1)混合物:由多种物质组成的,如一杯糖水。
(2)纯净物:由一种物质组成的,如一杯水。
(3)单质:由同种元素组成的纯净物,如一瓶氧气。
(4)化合物:由不同种元素组成的纯净物,如一瓶二氧化碳气体。
(5)氧化物:由两种元素组成的化合物,其中一种是氧元素,如二氧化碳气体。
3.元素在自然界中的分布元素在自然界中分布是不均匀的。
下列是地壳、空气、人体、海中主要元素按质量分数排列顺序:(1)地壳中:O%>Si%>Al%>Fe%>Ca%(2)空气中:N%>O%(3)人体中:O%>C%>H%(4)海水中:O%>H%>Cl%4.物质、元素、分子、原子间的关系单质(同种元素)稀有气体金属单质非金属单质化合物(多种元素)氧化物其它根据组成物质根据组成物质的种类混合物(多种物质)纯净物(一种物质) 元素的种类宏观概念,只讲种类,不讲个数.微观概念,即讲种类,又讲个数.元素物质原子分子(构成)(构成)(构成)同一类原子【疑难辨析】例题1:经实验测定,某物质只含有一种元素,下列推断中正确的是()A.该物质一定是纯净物B.该物质一定是单质C.该物质一定是混合物D.该物质一定不是化合物例题2:下列关于物质组成的说法正确的是()A.二氧化碳是一个碳原子、两个氧原子组成的B.每一个二氧化碳分子是由一个碳原子、两个氧原子构成的C.二氧化碳是由一个碳元素、两个氧元素构成的D.二氧化碳是由碳元素和氧元素组成的【基础练习】1.我们把由组成的纯净物称为单质,由组成的纯净物称为化合物。
2.5表示元素的符号—浙教版八年级科学下册课件2

门捷列夫发现元素周期表对我们的启示
很久以来,科学家一直在寻找 各种元素之间相似和差异的规 律。俄罗斯化学家门捷列夫 (1834 ~ 1907)认为:“自然 界不可能是混乱无秩序的。自 然界中一定存在着一种基本规 律,它可以说明所有元素之间 的差异和相同之处。
正是在这种思想的指导下,1869 年他对当时已知的 63种元素的相 对原子质量和物理性质(熔点、 密度等)进行了比较。
5、元素符号周围数字的意义
1.下列元素符号书写正确的----------------( D )
A.MN
B. CA
C. mg
D. Zn
2.下列各组元素中,元素符号的小写字母相同
的一组是---------------------------------------( C )
A.钠、镁、铝
B.氮、氖、汞
元素周期表中的每一格所包含的信息有哪些?
原子序数 (质子数)
元素名称
元素符号 (红色指放射性元素)
相对原子质量
结合元素周期表,对“同位素”这个名词你 有进一步的理解了吗? 占有同一位置
3、元素周期表的作用 元素周期表是学习和研究科学的重要工具。
(1)查找:元素符号,质子数,相对原子质量。
(2)判断:元素单质的物理状态,元素分类。 元素是人工合成还是自然存在的; 元素是金属、非金属还是稀有气体。
用元素符号来表示各种不同的元素有什么好处?
2、元素符号的写法
A、通常用该元素拉丁文的第一个字母的大写来表示。
元素名称
拉丁文
元素符号
氢
Hydrogenium
H
氧
Oxygenium
O
氮
Nitrogenium
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教师学生姓名上课日期17-2-2 学科科学年级八年级教材版本浙教版学案主题元素符号的认识课时数量(全程或具体时间)第(2)课时授课时段13:00-15:00教学目标教学内容元素及表示的意义个性化学习问题解决1、知道组成人体、地球的主要元素2、元素周期表的认识3、组成物质的原则重、难点化学重要引入教学过程第4节:组成物质的元素【知识梳理】1.元素的种类和分类人类已知的化学元素有110多种,其中有些是人造元素。
根据性质的类似,初步把元素分类金属元素和非金属元素(含有稀有元素)2.物质的简单分类(1)混合物:由多种物质组成的,如一杯糖水。
(2)纯净物:由一种物质组成的,如一杯水。
(3)单质:由同种元素组成的纯净物,如一瓶氧气。
(4)化合物:由不同种元素组成的纯净物,如一瓶二氧化碳气体。
(5)氧化物:由两种元素组成的化合物,其中一种是氧元素,如二氧化碳气体。
3.元素在自然界中的分布元素在自然界中分布是不均匀的。
下列是地壳、空气、人体、海中主要元素按质量分数排列顺序:(1)地壳中:O%>Si%>Al%>Fe%>Ca%(2)空气中:N%>O%(3)人体中:O%>C%>H%(4)海水中:O%>H%>Cl%4.物质、元素、分子、原子间的关系单质(同种元素)稀有气体金属单质非金属单质化合物(多种元素)氧化物其它根据组成物质根据组成物质的种类混合物(多种物质)纯净物(一种物质) 元素的种类宏观概念,只讲种类,不讲个数.微观概念,即讲种类,又讲个数.元素物质原子分子(构成)(构成)(构成)同一类原子【疑难辨析】例题1:经实验测定,某物质只含有一种元素,下列推断中正确的是()A.该物质一定是纯净物B.该物质一定是单质C.该物质一定是混合物D.该物质一定不是化合物例题2:下列关于物质组成的说法正确的是()A.二氧化碳是一个碳原子、两个氧原子组成的B.每一个二氧化碳分子是由一个碳原子、两个氧原子构成的C.二氧化碳是由一个碳元素、两个氧元素构成的D.二氧化碳是由碳元素和氧元素组成的【基础练习】1.我们把由组成的纯净物称为单质,由组成的纯净物称为化合物。
2.人们通常把元素分为和两大类,稀有元素(氦、氖、氩等)属于。
3.地壳中含量最多的元素是,地壳中含量最多的金属元素是,空气中含量最多的元素是,人体中含量最多的元素是,海水中含量最多的元素是。
4.将右列与左列对应的字母填入括号。
(1)纯净物 A.由同种元素组成(2)混合物 B.由不同种分子构成(3)化合物 C.由一种物质组成(4)单质 D.分子中含有不同元素的原子(5)氧化物 E.由两种元素组成,其中一种是氧元素(1)--()(2)--()(3)--()(4)--()(5)--()5.日常生活常接触到“含氟牙膏”、“高钙牛奶”、“碘盐”、“富硒茶叶”、“加铁酱油”等用品,这里的氟、钙、碘、硒、铁指的是…………………()A.单质B.原子C.离子D.元素6.下列概念中,前者从属于后者的是()A.化合物,纯净物B.单质,化合物C.化合物,单质D.化合物,混合物7.关于水的组成,下列说法正确的是()A.水是由氢气和氧气组成的B.水是由氢分子和氧分子组成的C.水是由氢元素和氧元素组成的D.水是由两个氢元素和一个氧原子组成的8.如下图所示,图中“○”和“●”分别表示两种质子数不同的原子,其中表示化合物的是…()【提高练习】9.1臭氧(O3)主要分布在离地面10~50km的高空,它能吸收大部分紫外线,保护地球上的生物。
臭氧属于……………………………………()A.混合物B.化合物C.单质D.稀有气体图1-32(第8题图)10.右图是某葡萄糖酸锌口服液的标签。
标签上的含锌6.5mg是指锌…………………………………() A.单质B.元素C.分子D.原子11.某物质经测定只含有一种元素,则关于该物质说法正确的是……………………………………() A.一定是纯净物B.一定是混合物C.一定不是化合物D.一定是一种单质12.下列关于二氧化碳组成的说法中,正确的是…………………………………()A.二氧化碳由两个氧元素和一个碳元素组成B.二氧化碳由两个氧原子和一个碳原子构成C.二氧化碳由碳元素和氧元素组成D.二氧化碳分子由氧分子和碳原子组成13.下列物质中,属于金属单质的是,属于非金属单质的是,属于稀有气体单质的是,属于混合物的是,属于化合物的是。
(填序号)①盐水②液氧③洁净的空气④铜丝⑤冰水混合物⑥二氧化碳⑦氖气14.如图所示,““●”表示氮原子,“O”表示氧原子。
表示单质的图是,表示化合物的图是,表示混合物的图是。
第5节:表示元素的符号(1)【知识梳理】1.元素符号:国际上统一用来表示元素的一种特定的化学符号。
通常用某元素拉丁文名称2.元素符号的读法和写法:(1)拉丁文名称的汉语意思。
(2)只有一个字母的元素称号必须用大写,若有两个字母则第二个字母用小写。
3.元素称号所表示的意义:(1)表示一种元素(宏观)。
(2)表示这种元素的1个原子(微观)。
(3)若由原子直接构成物质,该元素符号还表示该种物质(宏观)。
(4)如元素符号前面加上大于1的系数,就只能表示该原子的个数,只有微观意义。
【思考解答】钙元素的拉丁文为“Calcium”,钙元素的元素符号应是什么?因为第一个字母为“C”的很多,为区别不同元素应再写上第二个小写字母,所以钙的元素符号为××牌口服液主要成分:葡萄糖酸锌化学式:C12H22O14Zn含锌量:每支口服液含锌6.5mg图1-33(第10题图)图1-34(第14题图)“Ca”。
【疑难辨析】例题:下列符号中,既表示一个原子,又表示一种元素,还表示一种物质的是()A.CaB.2HC.HD.2Ca【基础练习】1.下列元素符号书写错误的是……()A.氩 ArB.钙 CuC.氟 FD.锌 Zn2.下列各组元素符号,都是表示金属元素的是…………………………………()A.C、Cu、CaB.S、Fe、PC.K、Mg、BaD.K、Na、He3.碳和铜的拉丁文的第一个字母都是C,而碳的元素符号是C,铜的元素符号是Cu,产生这一现象的原因是……………()A.碳和铜的拉丁文的就是C和CuB.它们拉丁文的第一个字母都是CC.铜的拉丁文的第二个字母是u,为防止和碳的符号混淆,用两个字母Cu作符号D.碳的拉丁文没有第二个字母4.下列元素归类不同于其他三种元素的一项是…………………………………()A.Li Na KB. F Cl BrC.He Ne ArD.O Fe H5.下列元素名称书写错误的是……()A.钙B.锰C.氧D.炭6.根据元素符号排列的规律,在下列空格上填上适当的元素符号:(1)Be、B、C、、O、F(2)He、、Ar、Kr、Xe7.下列元素名称或符号书写上有错误,请改正:(1)猛MN ;(2)钙CA ;(3)绿CL ;(4)镁Ma ;(5)钠Ne ;(6)汞HG 。
8.下列符号中,既表示一种元素,又能表示该元素的一个原子,还能表示该元素组成的单质的是………………………()A .N2B.3Fe C.Al D.H9.说出下列符号各表示什么意义?(1)2N ;(2)Fe ;(3)K ;(4)3Ca 。
10.农夫山泉饮用天然水是我省的著名商品,一位外国游客看到标签上贴有如图所示的标志。
请你在图中将矿物含量以元素符号的形式写出,以便外国游客明白。
图1—35(第10题图)【提高练习】11.下列符号中,不具有宏观意义,只具有微观意义的是………………………()A.2HB.SC.ND.Mg12.如图所示中“O”和“●”分别表示氢原子和氧原子,其中粒子可用4H表示的是……………………………………()13.请用两种不同的方法,将下列10种元素和元素符号进行分类:H;He;C;N;O;S;Mg;Cu;Al;Cl.(1)把元素进行分类:①;②。
分类依据:。
(2)把元素进行分类:①;②。
分类依据:。
14.1977年8月,国际化学无机化学会做出一项决议:从104号元素以后,不再以人名、国名来命名,一律采用新元素的原子序数(即核电荷数)的拉丁文缩写命名。
即:nil=0,un=1,bi=2,ri=3,quad=4,pent=4,nex=6,sept=7,oct=8,enn=9。
照上述规定办法,第104号元素的拉丁文名称按“un+nil+quad+ium(词缀)”,应为“unnilquadium”其元素符号为Unq;第105号元素的拉丁文名称为Unnilpentium,元素符号为Unp。
其余依次类推。
请你分别给下列元素命名;(1)109号元素,拉丁文名称,元素符号。
(2)111号元素,拉丁文名称,元素符号。
第5节:表示元素的符号(2)【知识梳理】1.元素周期表中的基本概念(1)元素周期表:“行”称为“周期”,“列”称为“族”。
(2)原子序数:科学家把元素原子核的质子数定义为元素的原子序数。
2.元素周期表的结构特点:由来科学家根据元素的原子结构和性质,按原子序数(数值上等于核电荷数)科学有序地排列起来所得到的。
结构横行(周期)元素周期表共有7个横行(即7个周期),每个周期开头是金属元素(第一周期除外),靠近尾部是非金属元素,结尾是稀有气体元素,体现了“周期性”。
纵行(族)元素周期表共有18纵行,划分为16个族,其中8、9、10三个纵行共同组成一个族,其余15个纵行各成一族。
图1—36(第12题图)(续表)【疑难辨析】例题:学习了元素周期表后,小强提出了以下四个观点:(1)元素周期表是根据元素的相对原子质量的大小顺序排列的。
(2)元素的种类是有限的,只有元素周期表中的一百多种。
(3)元素周期表能更方便地为我们寻找新物质提供依据。
(4)元素周期表中每个纵行叫一族,共有18族。
以上观点中,你认为不正确的是____,理由是__________。
【基础练习】1.目前使用的元素周期表中,元素的排列是根据………………………………( ) A.相对原子质量 B.它们与氧结合的能力 C.原子序数D.它们的原子核内中子的质量2.元素周期表是学习化学的重要工具,下图是元素周期表中的一格,下面从该图获取的信息中,正确的是……………………………………( ) A.该元素的原子序数为52 B.该元素属于非金属元素C.该元素在地壳中的含量为52.00% D .该元素的原子核外有24个电子3.下列各元素中,化学性质最为接近的是……………………………………( ) A.F 与Cl B.Na 和Mg C.C 与O D.Al 和S4.观察元素周期表,回答下列问题:(1)元素周期表有 个横行,横行称为 ;有 个纵行,纵行称为 。
(2)元素的原子序数在数值上与 相同。
