磷脂测定试剂盒(氧化酶法)产品技术要求baiding
脂类多项校准品产品技术要求shijiwode

脂类多项校准品适用范围:与本公司生产的试剂盒配套使用,用于载脂蛋白AⅠ(apoAⅠ)、载脂蛋白B(apoB)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、游离脂肪酸(NEFA)、磷脂(PLIP)六项定量检测系统的校准。
1.1包装规格1.0mL×1;1.0mL×5;1.0mL×10。
1.2 主要组成成分人血清基质单水平冻干型校准品,约含0.33‰防腐剂和人源脂类组分。
脂类成分及靶值范围如下:校准品靶值批特异,详见靶值单。
2.1 外观白色至淡黄色冻干物,复溶后为淡黄色至橙黄色液体,试剂盒外观整洁,文字符号标识清晰。
2.2 均一性2.2.1瓶内均一性测值变异系数(CV)不大于10%。
2.2.2批内瓶间差测值变异系数(CV)不大于10%。
2.3准确度2.3.1与本公司生产的试剂盒配套使用,测定标准物质(GBW09194),载脂蛋白AⅠ项目的相对偏差不超过±15%;2.3.2与本公司生产的试剂盒配套使用,测定标准物质(GBW09194),载脂蛋白B、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇项目的相对偏差不超过±10%;2.3.3使用北京华宇亿康生物工程技术有限公司的游离脂肪酸测定试剂盒进行比对试验,在[0.1,2.0] mmol/L的测试范围内,用线性回归方法计算两组结果的相关系数(r)及每个浓度点的偏差,所得相关系数(r)不小于0.975,在[0.1,0.6)mmol/L范围内,绝对偏差不超过±0.09mmol/L;在[0.6,2.0] mmol/L范围内,相对偏差不超过±15%;2.3.4使用北京利德曼生化股份有限公司的磷脂测定试剂盒进行比对试验,在[0.5,12]mmol/L的测试范围内,用线性回归方法计算两组结果的相关系数(r)及每个浓度点的偏差,所得相关系数(r)不小于0.975,在[0.5,4)mmol/L范围内,绝对偏差不超过±0.6mmol/L;在[4,12]mmol/L范围内,相对偏差不超过±15%。
葡萄糖测定试剂盒(葡萄糖氧化酶法)产品技术要求baiding

葡萄糖测定试剂盒(葡萄糖氧化酶法)
适用范围:本试剂用于体外定量测定人血清中的葡萄糖含量。
1.1型号规格
产品组成
2.1 外观
2.1.1 试剂为淡粉红色透明液体,无混浊,无未溶解物。
2.1.2 校准品为无色透明液体,无混浊,无未溶解物。
2.1.3 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度
A≤0.15(光径1.0cm,500nm±20nm波长)。
2.4 分析灵敏度
测定1mmol/L 被测物,吸光度变化在0.05~0.08范围内。
2.5 线性区间
2.5.1 [0.1,28]mmol/L([1.8,500] mmol/L)。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2[0.1,1]mmol/L范围内,线性绝对偏差应不超过±0.1mmol/L;(1,28]mmol/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤5.0%。
2.6.2 批间差
批间相对极差≤6.0%。
2.7 准确度
相对偏差在±10%范围内(测试国家标准物质GBW(E)090544/GBW(E)090545 /GBW(E)090546)。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
脂蛋白相关磷脂酶A2测定试剂盒(免疫比浊法)产品技术要求baiding

脂蛋白相关磷脂酶A2测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中脂蛋白相关磷脂酶A2的含量。
1.1 包装规格校准品(选配):5×0.5mL;质控品(选配):水平1:1×0.5mL,水平2:1×0.5mL。
1.2 主要组成成分注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色到淡黄色液体,无可见不溶物。
2.1.2试剂2:无色到白色液体。
2.1.3校准品:无色至淡黄色液体,无可见不溶物。
2.1.4质控品:无色至淡黄色液体,无可见不溶物。
2.1.5包装外观:外观整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 空白吸光度空白吸光度≤1.8。
2.4 分析灵敏度样本浓度为165μg/L时,吸光度差值应≥0.008。
2.5 线性在[10,800] μg/L的范围内,线性相关系数r≥0.990。
测试浓度在[10,200] μg/L时;绝对偏差应不超过±20μg/L;测试浓度在(200,800] μg/L 时,相对偏差应不超过±10%。
2.6 精密度2.6.1 重复性用高、低2个浓度的样本进行测试,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2 批间差用3个不同批次的试剂盒分别测试样本,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度回收率应在85%-115%范围内。
2.8 校准品/质控品瓶内重复性校准品/质控品瓶内重复性(CV)应不大于10%。
2.9 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准品溯源至柏定公司内部工作校准品,并与已上市产品比对赋值。
2.10 质控品赋值有效性测试结果在质控范围内。
2.11 稳定性2.11.1 效期稳定性试剂盒在2℃~8℃密封避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1、2.7、2.8和2.10的要求。
磷脂测定试剂盒(氧化酶法)产品技术要求北检

磷脂测定试剂盒(氧化酶法)适用范围:本产品用于体外定量测定人血清中磷脂的含量。
1.1 规格具体产品规格见下表:1.2 组成成分试剂1:PIPES 50mmol/L 磷脂酶D 0.44KU/L DAOS 1mmol/L 抗坏血酸酶 0.6KU/L试剂2:PIPES 50mmol/L 4-氨基安替比林 0.74mmol/L过氧化物酶 16KU/L胆碱氧化酶 7KU/L2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色澄清透明液体;2.1.3 试剂2:无色澄清透明液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白吸光度在主波长600nm、副波长700nm、37℃条件下,试剂空白吸光度小于0.7。
2.4 线性2.4.1 线性范围[1.0,12.9]mmol/L,相关系数r>0.990。
2.4.2 线性偏差(4.0,12.9]mmol/L线性范围内,相对偏差不超过±10%;[1.0,4.0]mmol/L线性范围内,绝对偏差不超过±0.8mmol/L。
2.5 分析灵敏度检测浓度为4.0mmol/L的样本时,吸光度变化不小于0.26。
2.6 重复性测试高、中、低浓度的新鲜人血清样本或质控品,重复测试10次,高值:CV≤10%;中值:CV≤12%;低值:CV≤15%。
2.7 批间差用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R≤10%。
2.8 准确度回收率在90%~110%范围内。
2.9 稳定性原包装试剂2~8℃避光储存,有效期12个月。
效期后1个月内产品,检测结果应符合2.3、2.4和2.8的要求。
高密度脂蛋白胆固醇测定试剂盒(直接法-过氧化氢酶清除法)产品技术要求baiding

高密度脂蛋白胆固醇测定试剂盒(直接法-过氧化氢酶清除法)适用范围:本试剂用于体外定量测定人血清中高密度脂蛋白胆固醇的含量。
1.1 包装规格产品组成:2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为淡黄褐色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色或浅黄色冻干粉,溶解后为无色或黄色液体,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 含水量校准品冻干粉含水量≤3%。
2.4 试剂空白吸光度A≤0.080(光径1.0cm,600nm±20nm 波长)。
2.5 分析灵敏度测定1.0mmol/L样本,吸光度变化在0.04~0.08范围内。
2.6 线性区间2.6.1 [0.20,2.50]mmol/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.6.2 [0.2,0.8] mmol/L范围内,线性绝对偏差应不超过±0.08 mmol /L;(0.8,2.5] mmol /L范围内,线性相对偏差应不超过±10%。
2.7 精密度2.7.1 重复性变异系数CV≤4.0%。
2.7.2 批内瓶间差试剂盒内校准品瓶间差CV≤4%。
2.7.3 批间差批间差≤6.0%。
2.8 准确度相对偏差在±10%范围内(测试国际参考物质SRM 1951b(NIST))。
2.9 稳定性2.9.1 校准品冻干粉复溶后在2℃~8℃避光保存稳定7天,测定结果应符合2.8要求。
2.9.2 原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.4、2.5、2.6、2.7.1和2.8要求。
1,5-脱水-D-山梨醇测定试剂盒(吡喃糖氧化酶法)产品技术要求baiding
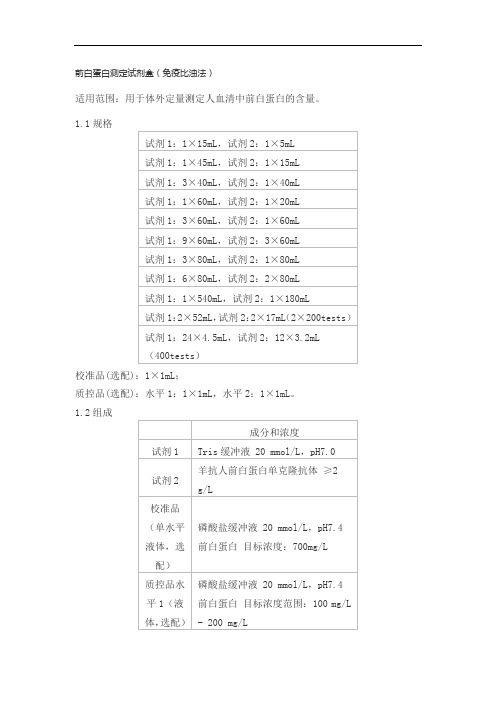
前白蛋白测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中前白蛋白的含量。
1.1规格校准品(选配):1×1mL;质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2组成注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色液体,无浑浊,无不溶物。
2.1.2试剂2:无色至淡黄色液体,无浑浊,无不溶物。
2.1.3校准品:无色至淡黄色液体。
2.1.4质控品:无色至淡黄色液体。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度试剂试剂空白吸光度≤0.5。
2.4 分析灵敏度样本浓度为50 mg/L时,△A≥0.015。
2.5 线性区间在[70,600] mg/L范围内,线性相关系数r≥0.990;测定浓度在[70,150] mg/L时,绝对偏差不超过±15 mg/L,测定浓度在(150,600] mg/L时,相对偏差不超过±10%。
2.6 精密度2.6.1 批內精密度用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7准确度测试国家标准物质GBW(E)090619,测试值与靶值的相对偏差应不大于10%。
2.8 质控品赋值有效性测试结果在质控范围内。
2.9 瓶内均匀性校准品和质控品瓶内均匀性(CV)应不大于10%。
2.10 量值溯源校准品量值溯源至国家标准物质GBW(E)090619。
2.11 稳定性2.11.1校准品开瓶稳定性校准品开瓶后2℃~8℃避光保存可稳定3天。
稳定期过后4小时内进行测试,测试结果与靶值的相对偏差不超过±10%。
2.11.2质控品开瓶稳定性质控品开瓶后2℃~8℃避光保存可稳定3天。
磷脂测定试剂盒(胆碱氧化酶法)产品技术要求huayu

磷脂测定试剂盒(胆碱氧化酶法)适用范围:用于体外定量测定人血清中磷脂的含量。
1.1 产品型号/规格试剂1:1×32 ml,试剂2:1×8 ml ;试剂1:1×40 ml,试剂2:1×10 ml;试剂1:2×40 ml,试剂2:2×10 ml;试剂1:2×40 ml,试剂2:1×20 ml;试剂1:4×40 ml,试剂2:4×10 ml;试剂1:8×40 ml,试剂2:8×10 ml;试剂1:2×60 ml,试剂2:2×15 ml;试剂1:8×60 ml,试剂2:6×20 ml;试剂1:1×80 ml,试剂2:1×20 ml;试剂1:2×80 ml,试剂2:2×20 ml;试剂1:4×80 ml,试剂2:4×20 ml;试剂1:4×16 ml,试剂2:4×4 ml ;试剂1:6×16 ml,试剂2:6×4 ml ;试剂1:8×16 ml,试剂2:8×4 ml ;试剂1:16×16 ml,试剂2:16×4 ml。
校准品:1 ml/瓶×1瓶(选配)1.2 主要组成成分试剂1:缓冲液50 mmol/L磷脂酶D 0.45 U/mlN-乙基-N-(2-羟-3-磺丙基)-3、5-二甲氧基苯胺钠盐(DAOS) 1 mmol/L抗坏血酸酶0.5 U/mlProclin-300 0.1%试剂2:缓冲液50 mmol/L4-氨基安替比林0.75 mmol/L过氧化物酶15 U/ml胆碱氧化酶7 U/mlProclin-300 0.1%校准品(选配):Tris缓冲液100 mmol/LProclin-300 0.5‰磷脂目标浓度 2.10mmol/L注:校准品浓度具有批差异性,具体浓度见校准品瓶签。
脂蛋白相关磷脂酶A2测定试剂盒 (酶法)产品技术要求haomai

脂蛋白相关磷脂酶A2测定试剂盒(酶法)适用范围:本试剂用于体外定量测定人血清中脂蛋白磷脂酶A2[Lp-PLA2]的浓度。
1.1包装规格1.2主要组成成分本试剂由试剂1(R1)、试剂2(R2)和试剂3(R3)组成试剂1(R1):Tris缓冲液PH7.6 100mmol/L乙二胺四乙酸二钠(EDTA) 20mmol/LProclin300防腐剂 0.1%试剂2(R2):柠檬酸 PH2.7 100mmol/ LProclin300防腐剂 0.1%试剂3(R3):乙醇90%1-肉豆蔻-2-(4-硝基苯基琥珀酰基) 100mmol/L-sn-并三基-3-磷酸胆碱2.1 外观试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰;R1试剂应为无色澄清液体,R2试剂应为无色澄清液体,R3试剂应为无色或淡黄色澄清液体。
液体试剂不得有沉淀和絮状物。
2.2 净含量用通用量具测量,液体试剂的净含量应不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在404nm处测定试剂空白吸光度,应≤1.8A。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.02A。
2.4 分析灵敏度测试500U/L的被测物时,吸光度变化(ΔA)应不低于0.01A。
2.5 准确性参照EP9-A2的方法,用比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990;每个浓度点在[50,160)U/L范围内绝对偏差不超过±16U/L;[160,1600] U/L范围内相对偏差不超过±10%。
2.6 重复性用三个水平的样本检测,检测结果批内变异系数(CV)应不超过7%。
2.7 线性2.7.1在[50,1600] U/L范围内,线性相关系数r应不低于0.990;2.7.2 在[50,160) U/L范围内绝对偏差不超过±16U/L;[160,1600] U/L范围内相对偏差不超过±10%。
乳酸测定试剂盒(乳酸氧化酶法)产品技术要求baiding

乳酸测定试剂盒(乳酸氧化酶法)适用范围:用于体外定量测定人血清中乳酸的含量。
1.1规格
1.2组成:
2.1 外观
2.1.1试剂:无色至淡红色溶液,无混浊,无不溶物。
2.1.2包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量
液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度
试剂空白吸光度≤1.000。
2.4 分析灵敏度
浓度为5.0 mmol/L时,△A≥0.100。
2.5 线性区间
在[0.5,15] mmol/L范围内,线性相关系数r≥0.990,测试浓度在[0.5,3]mmol/L时,绝对偏差不超过±0.3 mmol/L,测试浓度在(3,15] mmol/L时,相对偏差不超过±10%。
2.6 精密度
2.6.1 批內精密度
用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于6%。
2.6.2批间差
用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于8%。
2.7 准确度
回收率在85%-115%范围内。
2.8 稳定性
原包装试剂盒,在2℃~8℃避光保存条件下有效期为12个月,有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1和2.7的要求。
腺苷脱氨酶测定试剂盒(过氧化物酶法)产品技术要求baiding

腺苷脱氨酶测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中腺苷脱氨酶的活性。
1.1规格校准品(选配):1×0.5mL。
1.2主要组成成分校准品靶值批特异,详见瓶标签。
2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无可见不溶物。
2.1.2 试剂2为白色或微黄色胶乳液体。
2.1.3 校准品应为白色或浅黄色粉末。
2.1.4 标签内容清晰,字迹不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度A≤0.5(光径1.0cm,500nm±20nm波长)。
2.3.2 试剂空白吸光度变化率ΔA/min≤0.020/min。
2.4 分析灵敏度测定60U/L的样本,吸光度变化率在0.006/min~0.060/min区间内。
2.5 线性2.5.1 [1,200]U/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.9900。
2.5.2 [1,20]U/L区间内,绝对偏差应不超过2U/L;(20,200]U/L区间内,相对偏差应不超过±10%。
2.6 精密度2.6.1 批内精密度用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于5%。
2.6.2 批内瓶间差校准品批内瓶间差CV≤5%。
2.6.3 批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于6%。
2.7 准确度相对偏差在±10%范围内(测试国际参考物质(BCR-647))。
2.8 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源至国际参考物质BCR-647。
2.9 稳定性2.9.1 校准品冻干粉复溶后在2℃~8℃避光保存稳定30天,测定结果应符合4.6.2和2.7要求。
2.9.2 原装试剂盒2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.3、2.4、2.5、2.6.1、2.6.2和2.7要求。
胰岛素测定试剂盒(免疫比浊法)产品技术要求baiding

胰岛素测定试剂盒(免疫比浊法)适用范围:
用于体外定量测定人血清或人血浆中胰岛素的含量。
1.1规格
1.2主要组成成分
2.1 外观
2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为白色胶乳液体。
2.1.3 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度
A≤2.0(波长600nm,光径1cm)
2.4 分析灵敏度
测定30μU/mL的胰岛素样本,吸光度变化在0.010~0.300区间内。
2.5 线性
2.5.1 [1.5,100.0]μU/mL(37℃)。
在规定的线性区间内,测定值与样本浓度值的相关系数(r)应不低于0.9900。
2.5.2 [1.5,20.0]μU/mL区间内,线性偏差应不超过±2.0μU/mL;(20.0,100.0]μU/mL区间内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 批内精密度
用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于5%。
2.6.2 批间差
用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于6%。
2.7 准确度
相对偏差在±10%范围内(测定国家标准物质150519)。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后两个月内测定结果应应符合2.3、2.4、2.5、2.6.1、2.7要求。
脂蛋白相关磷脂酶A2(Lp-PLA2)测定试剂盒(速率法)产品技术要求beiaotaikang
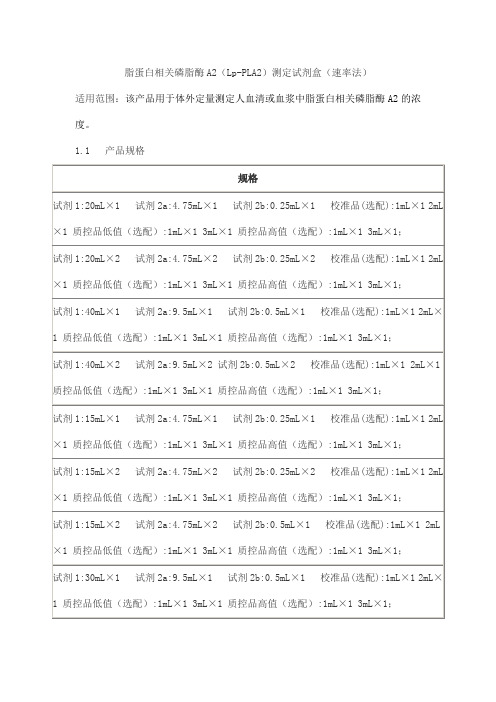
脂蛋白相关磷脂酶A2(Lp-PLA2)测定试剂盒(速率法)适用范围:该产品用于体外定量测定人血清或血浆中脂蛋白相关磷脂酶A2的浓度。
1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:磷酸盐缓冲液(pH=7.6)50mmol/L乙二胺四乙酸(EDTA)2mmol/L试剂2a:缓冲液pH2.7 100mmol/L试剂2b:1-肉豆蔻酰-2-(4-硝基苯基琥珀酰基)-sn-丙三基-3-磷酸胆碱50mmol/L1.2.2校准品的组成校准品为液体,校准品组成是在磷酸盐缓冲液中加入含一定浓度的脂蛋白相关磷脂酶A2纯品。
1个水平校准品目标浓度为900U/L,浓度有批特异性,具体定值详见瓶签。
1.2.3质控品的组成两水平液体质控品,在牛血清(20g/L)中加入脂蛋白相关磷脂酶A2纯品。
靶值范围分别为:(200~600) U/L、(600~1200)U/L。
2.1 外观试剂 1 为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂 2a 为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂 2b为无色至淡黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品:无色至淡黄色澄清液体;质控品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白2.3.1试剂空白吸光度试剂空白吸光度应≤1.000;2.3.2试剂空白吸光度变化率空白吸光度变化率(ΔA/min)应≤0.01。
2.4 分析灵敏度测定分析灵敏度:浓度为800U/L时,吸光度变化应≥0.01。
2.5 试剂测定线性测试血清样本,测试血清样本,试剂线性在[50,1600]U/L范围内,线性相关系数(r)应不小于0.990;测定结果在[50,500]U/L时绝对偏差不超过±75U/L;在(500,1600]U/L范围内的相对偏差不超过±15%。
2.6 重复性试剂盒测试项目重复性 CV≤10%。
2.7 批间差不同批号之间测定结果的相对极差应≤15%。
脂蛋白(a)测定试剂盒(免疫比浊法)产品技术要求baiding
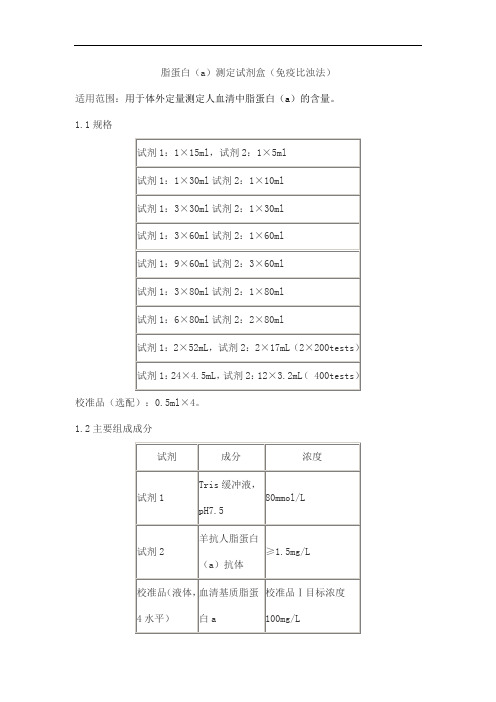
脂蛋白(a)测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中脂蛋白(a)的含量。
1.1规格校准品(选配):0.5ml×4。
1.2主要组成成分校准品靶值批特异,详见瓶标签。
2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为无色透明液体,无混浊,无未溶解物。
2.1.3 校准品为淡黄色液体,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度A≤0.05(光径1.0cm,340nm波长)。
2.4 分析灵敏度测定150mg/L的样本,吸光度变化在0.012~0.075区间内。
2.5 线性2.5.1 [15,500]mg/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.9900。
2.5.2 [15,150]mg/L区间内,绝对偏差应不超过20mg/L;(150,500]mg/L区间内,相对偏差应不超过±10%。
2.6 精密度2.6.1 批内精密度用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于5%。
2.6.2 批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于6%。
2.7 准确度相对偏差在±10%范围内(测试国际参考物质SRM 2B (IFCC))。
2.8 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源至国际参考物质IFCC/SRM 2B。
2.9 稳定性2.9.1 校准品2℃~8℃保存,有效期为12个月,有效期满后2个月内测定结果应符合2.7要求。
2.9.2 原装试剂盒2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.3、2.4、2.5、2.6.1和2.7要求。
磷脂测定试剂盒(胆碱氧化酶法)产品技术要求北京九强生物

磷脂测定试剂盒(胆碱氧化酶法)适用范围:用于体外定量测定人血清或血浆中磷脂的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品、质控品赋值有差异,具体赋值详见靶值单。
2.1 外观试剂1为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;试剂2为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量液体试剂的净含量应不少于标称量。
2.3 试剂空白吸光度试剂空白:A600nm下测定空白吸光度应≤0.500。
2.4 准确度回收试验:在人血清样本中加入一定体积的纯品溶液,进行测定,回收率应在(100±15)%范围内。
2.5 分析灵敏度样本浓度为3 mmol/L时,其吸光度变化在0.1000~1.000之间。
2.6 线性区间在[0.1,12.9] mmol/L区间内,线性相关系数r≥0.990,在[0.1,6.0] mmol/L 区间内测定的绝对偏差应不超过±0.60mmol/L,在(6.0,12.9]区间内测定的相对偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性使用高、低不同浓度的样本重复测定10次,其测定值的变异系数(CV%)应不大于5%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于15%。
2.8 瓶间精密度校准品、质控品的瓶间精密度应≤10%。
2.9 质控品赋值有效性使用质控品进行测定,所得结果应在质控范围内。
2.10 稳定性2.10.1 试剂稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1、2.9的要求。
磷脂(PLIP)测定试剂盒(胆碱氧化酶法)产品技术要求lideman

磷脂(PLIP)测定试剂盒(胆碱氧化酶法)适用范围:本产品用于体外定量测定人血清或血浆中磷脂的含量。
1.1规格试剂1(R1):2×60mL,试剂2(R2):2×15mL;试剂1(R1):2×400mL,试剂2(R2):2×100mL;试剂1(R1):2×60mL,试剂2(R2):2×20mL;试剂1(R1):2×60mL,试剂2(R2):2×12mL;试剂1(R1):1×20mL,试剂2(R2):1×6mL。
校准品(选配):1×5mL。
1.2组成1.2.1试剂组成试剂1(R1)(以下简称R1),试剂2(R2)(以下简称R2)。
表1 试剂组成1.2.2校准品的组成:单水平的冻干校准品,在牛血清基质中添加磷脂,稳定剂<0.1%;定值范围:(2-6)mmol/L。
2.1 外观液体双试剂: R1(缓冲液):无色液体, R2(启动液):无色液体。
校准品:冻干品,溶解后呈无色至淡黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、600nm波长、1cm光径条件下,用去离子(或生理盐水)水作为样品加入试剂测试时,试剂空白吸光度<0.7 ABS。
2.4 分析灵敏度浓度为4mmol/L时,吸光度变化范围为(0.26-0.65)。
2.5 线性范围在(0-12.9]mmol/L线性范围内,线性相关系数r2≥0.996。
在(6.0-12.9]mmol/L 范围内的相对偏差≤10%;测定结果(0-6]mmol/L时绝对偏差≤0.6mmol/L。
2.6 精密度试剂盒测试项目精密度 CV< 6%。
2.7 批间差不同批号之间测定结果的相对极差应< 6%。
2.8 准确度回收试验:回收率80%-120%。
2.9 瓶间重复性(均一性)校准品瓶间重复性CV<5%。
2.10稳定性2.10.1效期稳定性原包装试剂(含校准品),在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其试剂空白、分析灵敏度、线性范围、精密度、准确度和瓶间重复性应分别符合2.3、2.4、2.5、2.6、2.8、2.9的要求。
磷脂(PLIP)测定试剂盒(胆碱氧化酶法)产品技术要求百奥泰康

磷脂(PLIP)测定试剂盒(胆碱氧化酶法)适用范围:该产品用于体外定量测定人血清或血浆中磷脂浓度。
1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:缓冲液 50mmol/L磷脂酶D 0.50U/mLDAOS 1mmol/L抗坏血酸氧化酶 0.6U/mL试剂2:缓冲液 50mmol/L4-氨基安替比林 0.74mmol/L过氧化物酶 16U/mL胆碱氧化酶 7.0U/mL。
1.2.2 校准品的组成单水平的冻干校准品,在牛血清(50g/L)基质中添加磷脂(4mmol/L),稳定剂<0.1%;定值范围:(2-6)mmol/L。
1.2.3质控品的组成单水平的冻干校准品,在牛血清(50g/L)基质中添加磷脂(3.5mmol/L),稳定剂<0.1%;定值范围:(2-6)mmol/L。
2.1 外观液体双试剂:试剂1:无色至淡黄色液体,试剂2:无色至淡黄色液体。
校准品:冻干品,溶解后呈无色至淡黄色液体。
质控品:冻干品,溶解后呈无色至淡黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度试剂空白吸光度≤0.7 。
2.4 分析灵敏度浓度为4mmol/L时,吸光度变化应≥0.26。
2.5 线性在(0,12.9]mmol/L线性范围内,线性相关系数r ≥0.995。
在(0,6.0]mmol/L时绝对范围内偏差不超过0.6mmol/L;在(6.0,12.9]mmol/L范围内的相对偏差不超过±10%。
2.6 精密度试剂盒测试项目精密度 CV≤6%。
2.7 批间差不同批号之间测定结果的相对极差应≤10%。
2.8 准确度回收试验:回收率90%-110%。
2.9 瓶间重复性(均一性)校准品、质控品瓶间重复性CV≤5%2.10 质控品赋值有效性测定值在质控靶值范围内。
2.11校准品溯源性要求根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供磷脂校准品的来源、赋值过程以及测量不确定度等内容。
抗心磷脂抗体检测试剂盒(酶联免疫法)产品技术要求模板

医疗器械产品技术要求编号:抗心磷脂抗体检测试剂盒(酶联免疫法)1.产品型号/规格及划分说明1.1产品型号/规格48人份/盒、96人份/盒。
1.2结构组成试剂盒应包括下列主要部分:包被有心磷脂抗原的微孔板、ACL阴性对照、ACL阳性对照、标本稀释液(加有山羊血清的PBS缓冲液)、酶结合物(HRP标记的单抗人IgG)、显色剂A (主要成份为过氧化脲)、显色剂B(主要成份是TMB.2HCL)、浓缩洗涤液(25×,主要成份为PBS)、终止液(2MH2SO4)组成。
1.3 适用范围该试剂盒为体外诊断试剂盒,适用于酶标仪,用于临床上体外检测人血清中的抗心磷脂抗体IgG。
2性能指标2.1外观外观应符合如下要求:a)试剂盒各组份应齐全、完整,液体无渗漏;b)标签应清晰,易识别。
2.2液体装量液体试剂最低装量应不小于标示量。
2.3阴性参考品符合率对本公司提供的 15 份阴性参考品进行检测,阴性参考品符合率为 100%。
2.4阳性参考品符合率对本公司提供的 10 份阳性参考品进行检测,阳性参考品符合率为 100%。
2.5检测限对本公司提供的检测限参考品进行检测,应符合 4 份检测限参考品的检出要求:L1 检测 S/CO.比值应大于 4.0;L2 检测 S/CO.比值应大于 2.0;L3 检测 S/CO.比值应介于0.5~1.5;L4 检测 S/CO.比值应小于 1.0。
2.6重复性对本公司提供的重复性参考品重复检测 10 次,其变异系数 C V(%)应不大于 10%。
2.7批间差用 3 个批号试剂盒检测本公司提供的重复性参考品,3 个批号试剂盒之间的批间变异系数 CV 应不大于 15%。
2.8生物安全性检测ACL 阴阳对照应做 HBsAg,抗-HCV,抗-HIV,抗-TP 检测,结果为阴性。
1。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求baiding

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中小而密低密度脂蛋白胆固醇的含量。
1.1 规格校准品(选配):1×1mL;质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2 组成注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色到淡褐色液体,无可见不溶物。
2.1.2试剂2:淡黄色到黄色液体。
2.1.3校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.4质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度试剂空白吸光度≤0.05。
2.4 分析灵敏度样本浓度为50mg/dL时,吸光度差值应≥0.02。
2.5 线性区间在[8,100] mg/dL的范围内,线性相关系数r≥0.990。
测试浓度在[8,30] mg/dL 时;绝对偏差应不超过±3mg/dL;测试浓度在(30,100] mg/dL时,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度与已上市产品进行对比试验,在[8,100] mg/dL的范围内,线性相关系数r≥0.975。
测试浓度在[8,30] mg/dL时,绝对偏差应不超过±3mg/dL;测试浓度在(30,100] mg/dL时,相对偏差应不超过±10%。
2.8 质控品赋值有效性测试结果在质控范围内。
2.9 校准品/质控品瓶内重复性校准品/质控品瓶内重复性(CV)应不大于10%。
2.10 校准品/质控品批内瓶间差校准品/质控品批内瓶间差(CV)应不大于10%。
脂蛋白相关磷脂酶A2(Lp—PLA2)测定试剂盒(胶乳增强免疫比浊法) 产品技术要求性能指标

(100.0-800.0] ng/mL 范围内相对偏差应不超过±10%。 2.6 精密度 2.6.1 重复性
检测低值、高值两个水平的工作校准品,所得结果的变异系数(CV)应不 大于 8%。 2.6.2 批间差
检测低值、高值两个水平的工作校准品,所得结果的批间相对极差(R)应 不大于 10%。 2.7 准确度
脂蛋白相关磷脂酶 A2(Lp-PLA2)测定试剂盒 (胶乳增强免疫比浊法)
2. 性能指标 2.1 外观和性状 2.1.1 试剂盒各组分应齐全、完整、液体无渗漏; 2.1.2 中文包装标签应清晰、准确、牢固; 2.1.3 R1 应为清澈透明的液体,无板结、无絮状物;R2 为乳白色液体,无沉淀、
试剂装量要求。 2.3 空白限
空白限应不超过 8.0ng/mL。 2.4 分析灵敏度 测定 100ng/mL 样本时,吸光度变化(△A)应不小于 0.0200。 2.5 线性
试剂盒在 10.0-800.0ng/mL 的区间内 a) 其相关系数(r)应不小于 0.990; b) 在 [10.0-100.0] ng/mL 范 围 内 绝 对 偏 差 应 不 超 过 ± 10ng/mL , 在
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
磷脂测定试剂盒(氧化酶法)适用范围:用于体外定量测定人血清中磷脂的含量。
1.1规格
校准品(选配):1×1mL;
质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2 组成
品靶值、质控品质控范围详见包装标签。
2.1 外观
2.1.1试剂1:无色至淡黄色液体,无可见不溶物。
2.1.2试剂2:无色至淡黄色液体。
2.1.3校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.4质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量
液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度
试剂空白吸光度≤0.7。
2.4 分析灵敏度
样本浓度为200 mg/dL时,吸光度差值应≥0.05。
2.5 线性
在[20,1000] mg/dL的范围内,线性相关系数r≥0.990。
测试浓度在[20,300] mg/dL 时,绝对偏差应不超过±30 mg/dL;测试浓度在(300,1000] mg/dL 时,相对偏差应不超过±10%。
2.6 精密度
2.6.1重复性
用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于6%。
2.6.2批间差
用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度
与已上市产品进行对比试验,在[20,1000] mg/dL的范围内,线性相关系数r≥0.975。
测试浓度在[20,300] mg/dL 时,绝对偏差应不超过±30 mg/dL;测试浓度在(300,1000] mg/dL 时,相对偏差应不超过±10%。
2.8 质控品赋值有效性
测试结果在质控范围内。
2.9 校准品/质控品瓶内重复性
校准品/质控品瓶内重复性(CV)应不大于6%。
2.10 校准品/质控品批内瓶间差
校准品/质控品批内瓶间差(CV)应不大于6%。
2.11 溯源性
根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准品溯源至柏定公司内部工作较准品,并与山东博科生物产业有限公司生产的磷脂检测试剂盒(氧化酶法)比对赋值。
2.12 稳定性
2.12.1校准品复溶稳定性
校准品复溶后2℃~8℃密封避光保存可稳定24小时。
稳定期过后2小时内进行测试,测试结果与初测值的相对偏差应不超过±10%。
2.12.2质控品复溶稳定性
质控品复溶后2℃~8℃密封避光保存可稳定24小时。
稳定期过后2小时内进行测试,测试结果在质控范围内。
2.12.3效期稳定性
原包装试剂盒在2℃~8℃密封避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1、2.7、2.8、2.9和2.10的要求。
