201X年秋九年级化学下册第8章常见的酸碱盐8.3酸和碱的反应习题课件新版粤教版
科粤九年级化学下册第八章常见的酸碱盐复习(优秀文档PPT)

【方法突破】
解答推断题的四步法则:
的 Cu2+、Fe2+、Fe3+、Mg2+分别和OH-。
2.下列物质中属于碱的是(A)
酸、 碱 使紫色石蕊溶液变 (4)碳酸钾与稀盐酸:__K2CO3+2HCl===2KCl+H2CO3__。
[构建网络] 按照一定的顺序排列这些离子,就可以形成一种网络形式。 (5)___________________________________________________
的 酸、 酸
碱、 盐
浓酸的 特性
浓盐酸:有挥发性、有刺激性气味
浓硫酸:有很强的脱水性、吸水性、腐蚀 性,溶于水时放出大量的热
浓硝酸:有挥发性、有刺激性气味、有强腐蚀性
本章总结提升
稀
酸
的
常
化
见
学
的 酸、
酸
通 性
使紫色石蕊溶液变 红 ,无色酚酞溶液不变色
酸+较活泼的金属
盐 + 氢气 .
酸+某些金属氧化物
(3)碳酸钾和氯化钙反应生成碳酸钙沉淀和氯化钾,氯化钾对于氯化钠来说是杂质。 CuO+H2SO4===CuSO4+H2O
见 特性 氢氧化钙固体:有一定的腐蚀性,微溶于水 例3 化学兴趣小组的同学开展复分解反应研究性学习,设计了如下研究性学习思路:
①10户“居民”中,俗称熟石灰的是____________,属于氧化物的有____________________。
本章总结提升
(2)认识“村中的路”。只有相邻且能相互反应的“居民”间才是 通路。例如,图中涂成黑色实线的是一条从“Fe2O3家”到达出入 口的路。请你在图中涂出一条从“CO2家”到达任一出入口的路。
【答案】CO2→Ca(OH)2→Na2CO3→H2SO4→出入口(其他合理答案也可),图略。
九年级化学下册第八章常见的酸碱盐8.3酸和碱的反应作业设计新版粤教版

8.3 酸和碱的反应1.将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )A.6B.8 C.11 D.142.下列检测某溶液pH的操作正确的是( )A.将pH试纸投入待测液,对照标准比色卡读数B.用干燥、洁净的玻璃棒蘸取少量待测液,滴在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数C.用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH试纸上,对照标准比色卡读数D.用玻璃棒蘸取待测液滴在pH试纸上,3分钟后对照标准比色卡读数3.下列物质溶于水,所得溶液的pH大于7的是( )A.CO2B.HClC.NaClD.Ca(OH)24.向pH=11的溶液中滴加石蕊溶液,溶液呈( )A.无色B.紫色C.红色D.蓝色5.某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )A.AgNO3溶液B.NaOH溶液C.稀醋酸D.KNO3溶液6.小烧杯中盛有含石蕊的氢氧化钠溶液,逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )A.紫色——红色——蓝色B.蓝色——紫色——红色C.蓝色——红色——紫色D.紫色——蓝色——红色7.(1)向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成____色,pH______7(填“>”“<”或“=”),逐滴向锥形瓶中滴入盐酸并振荡,观察到的现象是__________________________,溶液的pH____________(填“增大”或“减小”)。
(2)有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用____________的方法。
8.向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如右图所示。
试剂X是下列物质中的( )A.MgB.H2OC.NaOHD.CaCO39.在A+B―→盐+水的反应中,A和B不可能是( )A.HCl和NaOHB.CO2和NaOHC.H2SO4和Fe2O3D.H2SO4和BaCl210.实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。
九年级化学下册第八章常见的酸碱盐8.3酸和碱的反应同步练习课件新版粤教版

“多变一”的特征,属于化合反应;2HgO====2Hg+O2↑,该反应符合“一
变多”的特征,属于分解反应。
最新中小学PPT课件资料
12
8.3 酸和碱的反应
知识点4 中和反应的应用 A
6.下列应用与中和反应原理无关的是( A.用浓硫酸干燥湿润的氧气 B.用熟石灰改良酸性土壤 C.服用含氢氧化铝的药物治疗胃酸过多
继续滴加稀盐酸,则酸过量,此时向溶液中加入碳酸钙后,与稀盐酸反应
生成氯化钙、水和二氧化碳,固体逐渐消失,有气泡产生。
最新中小学PPT课件资料
10
8.3 酸和碱的反应
知识点3 复分解反应 B
5.下列属于复分解反应的是(
A.4NH3+3O2 ====6H2O+2N2
点燃
)
B.Na2SiO3+H2SO4===H2SiO3↓+Na2SO4
A.氢原子
)
B.酸根离子
C.氢分子
D.氢离子
最新中小学PPT课件资料 3
8.3 酸和碱的反应
2.碱具有相似化学性质的原因是(
C
)
A.碱都能跟酸发生中和反应,生成盐和水 B.碱都能跟非金属氧化物发生反应,生成盐和水 C.解离时都能解离出OH-,在任何碱溶液中都含有OH- D.解离时都能解离出金属离子
时,说明氢氧化钠已反应完,此时稀盐酸与氢氧化钠可能恰好完全反应, 也可能稀盐酸过量。(2)稀盐酸和氢氧化钠反应生成氯化钠和水,反应的化 学方程式为NaOH+HCl===NaCl+H2O。
最新中小学PPT课件资料
7
8.3 酸和碱的反应
4.室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的温度,溶液温度随加入稀盐酸的质量
或“无变化”)。
(5)在C点溶液中加入碳酸钙,现象为________________________。
科粤版化学九年级下册第八章8.3酸和碱的反应 (共28张PPT)

1、中和反应;酸与碱作用生成盐和水的反应。 2、中和反应的实质是H+和OH- 结合生成水。 3、酸与碱反应时,酸溶液中的氢离子和碱溶液中的
氢氧根离子互相结合生成了中性的水,当二者恰好完全
反应时溶液呈中性。
【课堂练习】 3.下列反应,属于中和反应的是( C )
A. Ca(OH)2+ CO2==== CaCO3↓+H2O B. CuO + 2HCl ==== CuCl 2 + H2 O C. Cu(OH)2 + H2SO4 ==== CuSO4 + 2H2O D. AgNO3 + HCl ==== AgCl↓+ HNO3
新课引入
人的胃内有什么酸?在生活中,当胃酸 过多的病人看医生时,医生让病人口服胃舒 平(主要成分氢氧化铝),为什么胃舒平能治疗 这种胃病?
8.3 酸和碱的反应
1.认识酸和碱的组成,知道酸和碱在溶液中生成了氢离子 和氢氧根离子。 2.通过对酸和碱的反应探究,提高发现和提出问题的能力。 3.认识中和反应的实质,初步学会借助指示剂判断物质是
看玻璃棒上是否有固体。
进行实验
在试管中加入氢氧化钠溶液,滴入几滴无色酚酞溶液。再 用滴管慢慢滴入稀盐酸,并不断用振荡溶液,至溶液颜色刚好 变成无色为止。
实验现象: 溶液由红色变为无色 实验结论: 酸和碱能反应
反应的化学方程式为: HCl+NaOH====NaCl+H2O
对于无明显现象的酸和碱反应,通常要借助指示剂无色 酚酞溶液来帮助判断反应的发生。
-
2.碱溶液中共同存在导电的带电粒子 OH , 故碱有相似的性质。
碱 金属离子 + OH
-
【课堂练习】1.生活中常见的柠檬汁、番茄汁、柑橘汁、 酸奶等物质的水溶液都有一定的酸性,这 是由于它们( D ) A. 溶于水时生成了盐酸 B. 水溶液中含有酸分子 C. 组成中含有氢元素 D. 溶于水时,在水中解离产生了氢离子
【推荐】九年级化学下册第八章常见的酸碱盐8.3酸和碱的反应课件新版粤教版

3.医药应用
如果你被蚊虫叮咬,皮 肤会出现红肿而疼痛。这是 因为它们向你的皮肤“注射” 了“蚁酸”——甲酸。这时 可以涂抹弱碱性的肥皂水、 小苏打水、稀氨水或清凉油 以减轻疼痛。
例如:Fe2O3 + 6HCl == 2FeCl3 + 3H2O是复分解反应, 但不是中和反应。
3.请归纳化合、分解、置换、复分解等各种基本反应 类型的特点。
化合反应:由两种或两种以上的物质生成另一种物质的反应; 分解反应:由一种物质生成两种或两种以上的物质的反应;
置换反应:由一种单质和一种化合物生成另一种单质和另一 种化合物的反应; 复分解反应:由两种化合物相互交换成分生成另外两种化合 物的反应。
若其pH小于5.6,称为酸雨,酸雨的危害性很大。如 影响人类健康;使森林大面积枯死;使湖水酸化,鱼类死 亡;使农作物生长受到影响而减产;使名胜古迹,建筑物 腐蚀损坏等。
酸雨的危害
腐蚀金属
侵蚀雕像和建筑
破坏森林
使水中生物死亡
归纳总结
1.酸和碱溶于水生成的产物中都各自有其相同的一种 离子,在酸溶液中是氢离子,在碱溶液中是氢氧根离子。
氢氧化钠
实验现象:无明显实验现象。
2.为了观察到上述两种溶液发生反应的现象,应 采取什么措施?
1.在氢氧化钠溶液中滴加无色酚酞,此时溶液是红色; 2.再向其中逐渐加入稀盐酸; 3.观察到瞬间红色变无色,证明两种溶液发生了反应。
实验现象记录:
编号
操作步骤
观察到的现象
① 取3mLNaOH溶液于试管中,滴1、2 溶液由无色变红色 滴酚酞溶液
【科粤版九年级化学下册】第8章8-3酸和碱的反应课件

第八章 常见的酸、碱、盐
科粤版九年级化学下册
第八章 常见的酸、碱、盐
讨论: 1. 酚酞在实验中起什么作用? 答:起指示作用。因为NaOH与HCl反应无明显的
现象发生,根据酚酞溶液由红色变为无色来判断NaOH 和HCl是否反应完全。
2. 为什么在操作中必须逐滴滴入稀盐酸? 答:防止稀盐酸滴加过量。
注意: 滴加盐酸至红色恰好变成无色时即止。 否则盐酸过量。
H2 SO4
Ca2(HO2HO)2
科粤版九年级化学下册
第八章 常见的酸、碱、盐
3. 用于医药
⑴ 中和胃酸过多
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。 思考:可不可以用NaOH来中和胃酸、蚁酸?为什么? 答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
1.改良土壤的酸碱性
盐碱 地
熟石灰
酸性土壤
中性土壤
Ca(OH)2
碱性土 壤
加入酸 性物质 中性土壤
科粤版九年级化学下册
第八章 常见的酸、碱、盐
讨论: ⑴ 为什么向酸性土壤中加入熟石灰,而不可以加入
氢氧化钠粉末? 答:因为氢氧化钠的腐蚀性太强。
⑵ 导致土壤显酸性的主要原因是什么?
答:是酸第八章 常见的酸、碱、盐
2. 处理工厂的废水 ⑴ 如何处理硫酸厂生产中形成的含硫酸的污水? ⑵ 请写出有关反应的化学方程式: ⑶H用2SCOa4+OC来a中(O和H污)2 =水行Ca不S行O4?+ 2 H2O
CaO + H2O =Ca(OH)2 H2SO4+ Ca(OH)2 = CaSO4 + 2 H2O
新科粤版九年级化学下册《八章常见的酸、碱、盐8.3酸和碱的反应》教案_16

鼓励学生想办法证明 NaOH和 HCl 这个反应的确发生了。最后让学生完成该实验 设计,通过活动与探究让学生归纳出该反应的现象和特点, 能把学生的探究活动 与“双基”紧密结合,既体现了新《课标》的教学理念和课程目标,又兼顾了对 学生基础知识和基本技能的培养。 充分调动了学生的积极性和创造性,使学生 能较好的掌握本节课的学习内容。 在教师指导下, 充分发挥了学生的主体性, 让 学生进行实验探究, 在交流讨论中获得知识, 同时体验学习的成就感, 激发学习 兴趣。
生同时填写书 格。
本空白的地
方。
提问:在
探究过程观察 交流各自的过
到的现象有哪 程。
些?
哪些有现
象?哪些没有
实验现象?
引入:氢
氧 化 钠 与 盐 1. 学生思考论
酸,氢氧化钠 讨。
与稀硫酸等这
些都没有实验
现象,而氢氧 2. 学生进行实
化铜与稀盐酸 验探究。
反应,有现象。
酸和碱混合,
1. 培养学生动 手能力,观察 能力。 2. 形成认知冲 突,为进一步 探究做准备。
治的说明书, 书的内容,回
并提问:药品 答问题。
中的主要成分 是什么,有哪
些是你认识
的物质?为什
么这种药品能
治疗胃酸过多
呢?这节课我
们一起来学
习:酸和碱的
中和反应。
1、有三瓶 1、学生思考、
无色溶液 A、B、 请学生上讲台
C 可能是氢氧 展示验证的方
化钠溶液或盐 法,结果。
酸或水。你能
用指示剂(无 2、学生回答。
流,并让学生回
答中和反应在工
农业、医疗、生 活中的应用。
1. 书写化学方 程式,完成书 本的填空。
科粤版九年级化学下册练习课件-8.3酸和碱的反应

4
基础训练
知识点一 中和反应及其应用 5.下列物质能和盐酸发生中和反应的是( B ) A.硝酸银 B.熟石灰 C.氧化铜 D.锌
5
6.【山东淄博中考】下图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意 图,由此得出的结论正确的是( D )
A.反应后溶液的pH大于7 B.反应前两种溶液均能导电,反应后的溶液不导电 C.反应后溶液中的粒子只有Na+和Cl- D.反应前后各元素的化合价均无变化
11
(1)烧杯中发生反应的化学方程式为____N_a_O__H_+__H__C_l_=_=_=_N__a_C_l_+__H_2_O_______。 (2)仪器A中溶液的溶质是___H_C__l __(填化学式)。 (3)图3中V的数值最接近___1_2____(填“6”“12”或“16”)。 (4)下列说法错误的是____C____(填字母序号)。 A.图2中b点所示溶液中的溶质是NaCl和NaOH B.取图2中d点所示溶液加热蒸干,所得固体为纯净物 C.图2中c→d所示溶液中NaCl的质量不断增加 D.图3中e→f变化趋势可说明该反应是放热反应
7
综合提升
基础过关
1.关于复分解反应说法一定正确的是( D ) A.反应物为酸和碱 B.伴随有明显现象 C.生成物为盐和水 D.元素化合价不变 2.下列做法不是利用中和反应原理的是( C ) A.用熟石灰改良酸性土壤 B.用含氢氧化铝的药物治疗胃酸过多 C.用盐酸除去铁锈 D.用熟石灰处理含硫酸的工业废水
3
3.由两种化合物互相___交__换__成__分____,生成另外两种_化__合__物___的反应,叫做复 分解反应。
4.中和反应的应用:(1)用____熟__石__灰____来改良酸性土壤。(2)废水处理。如硫 酸厂的废水可用烧碱进行中和处理,反应的化学方程式为 ___H__2_S_O_4_+__2_N_a_O__H__=_=_=_N_a_2_S_O__4+__2_H__2_O____。(3)用于医药。如用含氢氧化铝的药物 治疗胃酸过多,反应的化学方程式为___3_H__C_l_+__A_l_(_O_H__)3_=_=_=_A__lC__l3_+__3_H__2O____。
九年级化学下册第八章常见的酸碱盐8.3酸和碱的反应同步课件新版粤教版

解析 根据酸和碱的化学性质分析各实验出现的现象:稀盐酸与铁、碳 酸钠反应可分别生成氢气和二氧化碳,即试管B、D中出现气泡;澄清 石灰水与碳酸钠反应产生碳酸钙白色沉淀,二氧化碳通入澄清石灰水 中会出现白色沉淀,即试管G、H中出现沉淀。
典例 某化学实验小组欲探究稀盐酸、氢氧化钙的化学性质, 取8支试管分别用A~H编号后,做了如图8-3-5所示的实验。
解析 用氢氧化钠溶液吸收二氧化硫,是碱与非金属氧化物的反应,不 属于中和反应;用氢氧化钠溶液处理泄漏的浓硫酸,是酸与碱的反应, 属于中和反应;用熟石灰和硫酸铜溶液配制波尔多液,是碱与盐的反 应,不属于中和反应;用生石灰作食品干燥剂,是生石灰与水发生的 化合反应。
方法透视 生成盐和水的反应不一定是中和反应,中和反应是 酸和碱的反应。
解析 中和反应是指酸跟碱生成盐和水的反应,中和反应属于复分解反
应。A为非金属氧化物与碱的反应,B为金属氧化物和酸的反应,C为盐
和碱的反应,D为碱和酸的反应。
方法透视 复分解反应的特点是化合物互相交换成分,反应前 后元素的化合价不变。复分解反应包含中和反应,中和反应属 于复分解反应。
【试题链接】小试身手 1,直击中考 8、9
【试题链接】小试身手 2、4、6、7,直击中考 11、12
常考3 会判断复分解反应,能说出复分解反应和中和反应的区别和联系。
【出题角度】考查对化学反应类型的判断,对复分解反应的理解或复分解反 应和中和反应的区别和联系等。
典例 下列反应中既是复分解反应又是中和反应的是( D ) A.SO2+2NaOH=Na2SO3+H2O B.CuO+H2SO4=CuSO4+H2O C.Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3 D.2NaOH+H2SO4=Na2SO4+2H2O
科粤版初中化学九下 8.3 酸和碱的反应 课件 _3PPT
NaCl + H2O
盐水
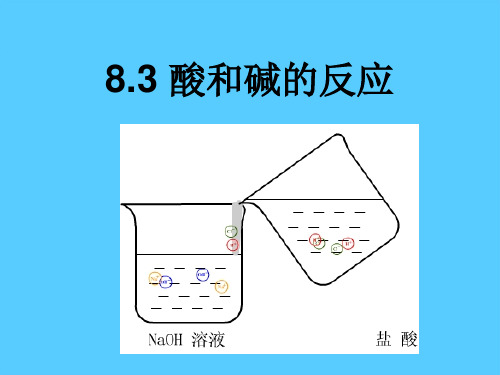
反应前后溶液中离子发生了怎样的变化?
NaOH = Na+ + OHHCl = H+ + Cl-
NaOH + HCl = NaCl +H2O
酸碱反应的实质: 酸溶液中的 H+ 和碱溶液中的 OH- 结合生 成H2O的过程
对比酸、碱的通性P239
项目
酸的主要化学性质 碱的主要化学性质
52.希望,只有和勤奋作伴,才能如虎添翼。 13.不要因为没有掌声而放弃你的梦想。 38.松驰的琴弦,永远奏不出美妙的乐曲。 91.生命就是一个一直在支出时间的过程,等时间支完了,生命也就走到了尽头。 76.人生就是场经营,有人经营感情,有人经营利益,有人经营幸福,而有人经营阴谋。 97.我们应当努力奋斗,有所作为。这样,我们就可以说,我们没有虚度年华,并有可能在时间的沙滩。 68.不要言过其实夸大其词会使人怀疑你的判断力。精明的人表现出的是严谨,有时还会故意缩小其词。 50.一时的挫折往往可以通过不屈的搏击,变成学问及见识。 79.成功之花,人们往往惊羡它现时的明艳,然而当初,它的芽儿却浸透了奋斗的泪泉,洒满了牺牲的血雨。 3.我怎么能倒下,我身后空无一人。 62.要让事情改变,先改变我自己;要让事情变得更好,先让自己变得更好。 62.人要有梦想,有了梦想才会努力奋斗,人生才会更有意义。如果没有梦想,那就只能做庸人。 16.勇敢的面对阳光,阴影自然都在身后。 11.不要沉溺于过去,不要幻想未来,集中精力,过好眼下的每一分每一秒!
特点:化合物中各成分相互交换,化 合价不变。
1.判断下列反应属于哪一基本反应类型, 并用线连接。
①Fe + 2HCl FeCl2 + H2↑ ② 2H2O 通电 2 H2↑ + O2↑ ③ 2 Mg + O2 点燃 2MgO
