第七章醇、硫醇、酚精品文档
第7章醇、硫醇、酚

CH3 H 3C C OH CH3 CH2 =CHCH 2 OH CH 2OH
叔丁醇
烯丙醇
苄醇
某些醇也用俗名。俗名一般是根据它们的最初
来源或性质命名。如:
CH3 OH CH2 CH CH2 OH OH OH
木精
(2)系统命名法 1)脂肪醇 ① 选主链
甘油
选含羟基的最长碳链为主链,
根据主链中碳原子数目称为某醇。
CH3 H2C C CH3 H OH
浓 H2SO4 60℃
CH3 H2C C CH3 + H2O
分子内脱水成烯反应的活性:叔丁醇 > 异丙醇 > 乙醇
仲醇和叔醇脱水时遵守查依采夫(Saytzeff)规
则,主产物一般是分子中双键碳上有较多取代基团 的烯烃,也即消除的氢主要来自含氢较少的β碳上。
CH3 CH3 CH C CH2 OH H H
一、醇的结构、分类和命名
1. 结构 Sp3不等性杂化
110℃
醇羟基中的氧原子认为是sp3不等性杂化,利
用两个单电子的sp3轨道形成C-O和O-H键,C-OH的键角接近于110°,余下两对未共用电子对分
别在另两个sp3轨道。
H H C H
sp 109°
3
O
sp
3
H
甲醇的棍棒模型
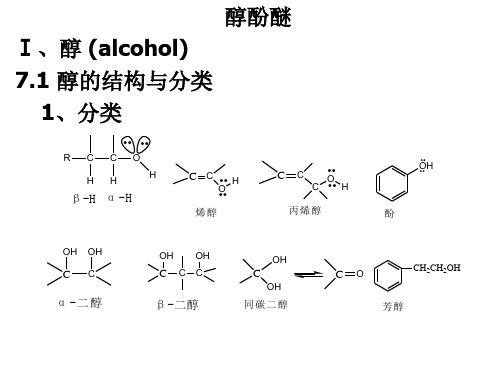
2. 分类
(1)根据羟基所连烃基结构不同分类 饱和脂肪醇 CH3CH2OH CH2=CHCH2OH
5
4
CH 3CH C CHCH 3 H 2 OH OH
3
CH3
1
OH CH 3 CH 3 CH C OH 2 3 4 1 CH 3 2- 甲基-2,3- 丁二醇
丙三醇3-甲基-2,4-戊二醇 Nhomakorabea2)芳香醇
第7章 醇、硫醇、酚

R-OH
醇
alcohol
OH
R-SH 硫醇
thiol or mercaptan
酚
phenol
概述
应用: 1、防腐消毒用的乙醇、苯酚、甲苯酚(其肥皂液 为来苏儿); 2、用作润滑剂的甘油,可治疗便秘;
3、常用的重金属中毒的解毒剂二巯基丙醇;
HO HS HS CH2 CH CH2
HO CH3-O CH2CH=CH2
三、化学性质
(二)、与重金属作用 与无机硫化物相似,硫醇可与汞、银和铝等重金 属以及它们的氧化物反应,生成不溶于水的硫醇盐。
2 R SH HgO ( RS )2Hg H2O
在医药上的应用:可作为重金属盐类中毒的解毒剂。
SH 酶
活性酶 SH
S
+ Hg 2+
酶
中毒酶 S
Hg
2+ 二巯基丁二酸钠
解毒反应
第七章 醇、硫醇、酚
(Chapter7 Alcohol, Thiol, Phenol)
第一节 醇 一、醇的结构分类和命名 二、醇的物理性质 三、醇的化学性质 四、甲醇、乙醇的功能和毒性 第二节 硫醇 第三节 酚
第七章 醇、硫醇、酚
概
述
醇是羟基与饱和碳原子直接相连的一类化合物. 酚是羟基与苯环直接相连的一类化合物. 硫醇是硫原子替代醇羟基中的氧原子的一类化合物.
Ph CH3CHCH2-OH
2-苯基-1-丙醇 2-phenyl-1-propanol
不饱和一元醇---以连有-OH和含不饱和键的最长碳 链为母体,从靠近-OH最近的一端开始编号。
4 3 2 1
CH3CH2CH2CHCH2CH2CH2 OH CH2=CH
6 5
第七章 醇 硫醇 酚.

第一节
1. 结构:
醇 (Alcohol)
一、结构、分类和命名:
醇的通式为ROH,R为烃基,-OH是连在烃基饱和碳上。以甲醇CH3OH 为例,见下图
2. 分类:
(1)根据羟基所连碳原子类型的不同醇可分为三种:
伯醇(1°)
仲醇 (2°)
叔醇(3° )
(2)根据所含羟基数目的多少,醇又可分为(含二个以上羟基 的醇称为多元醇):
此反应是较强的酸(H-OH)把较弱的酸(RO-H)从它的盐中 置换出来,故醇的酸性比水还弱;而形成的相应的碱,RO— 的碱性比OH—要强得多。 酸性: H2O > ROH > RH 碱性: R—> RO—> OH—
三、
除具有一元醇的一般化学性质外,还有一些特殊性质。 1. 与氢氧化铜的反应 乙二醇与稀硫酸铜的碱性溶液可形成绛蓝色的铜盐。
二、物理性质
1、形态(State):低级一元醇为无色液体,有显著的刺 激性酒味,随着碳数的增加,C4~C11的直链醇为油状粘稠液 体,C12以上则为蜡状固体。 2、沸点(b.p.): 链状饱和一元醇的沸点,通常与烷烃 的变化规律相似。但醇的沸点比与比与它相对分子质量相近的 烷烃、醚高得多
三、化学性质 (Reaction)
*断裂C-O键的反应 (一)与金属钠的反应
第七章 醇硫醇酚

上页 下页 返回 退出
1.3 醇的化学性质
醇的化学性质主要是由官能团羟基所决定, 同时也受到烃基的一些影响。从化学键来看C-O 和O-H都是极性键;因此,醇容易发生反应的部 位如虚线所示:
R C O H
酸碱性、醚的生成、酯的生成 卤化反应、脱水反应、氧化反应
上页 下页 返回 退出
H C O H
弱碱性
+
C H3
H2O
O H2
C H3 C H
C H C H3
+
重 排
C H3 C H3 C
+
2° 碳正离子
C H C H3 H
CH3 CH3 CH CH CH3 Br
Br-
3° 碳正离子
Br
CH3
仲醇与HX酸反应,
CH3 C Br
CH2 CH3
生成重排产物是SN1机理的重要特征
下页 退出
b. SN2:大多数伯醇,且没有重排反应。
第七章
醇 硫醇 酚
下页 返回 退出
基本内容和重点要求
醇、酚、醚的结构、分类和异构现象 醇、酚、醚的化学性质 环氧乙烷的开环反应 重点掌握醇、酚、醚的化学性质;醇 的氢键对其物理性质(沸点、水溶性)的影 响。
上页 下页 返回 退出
第一节 醇(Alcohols)
1.1 醇的结构、分类和命名
1.2 醇的物理性质
CH3 C CH2
2-甲基-2-乙基-1-己醇
H3C
CH2
CH2
CH2
CH2OH CH3
CH
CH CH3
CH3
OH
2-甲基-1-环己基-1-丙醇 上页 下页 返回 退出
如果为不饱和醇,应选择含有羟基并含有双键或 叁键的最长碳链作为主链,编号时应使羟基的位号最 小;在定名称时,表示主链碳原子数的“天干”或汉 字应写在“烯”字或“炔”字名称的前面。
7第七章醇硫醇酚1

△
⑤ 脱水(消除)反应
CH3CbH2CHCbH'3 OH
661£00H£2SCO4
CH3CH£CHCH3 £¨Saytzeff££ò £
2-££ £¨£÷££ú ££
CH2 CH CH2CH3 浓H2SO4 OH
CH CH CH2CH3
⑥1). KM氧n化O4反(H应+or OH-)、Na2Cr2O7-H2SO4 、HNO3
(一)酚的构造
.
sp2 H
O.
P–共轭 ··O—H
1.6D
①O–H键极性增强,–H比醇活泼 ②C–O键加强,–OH难取代 ③苯环被活化,环上易取代
(二)分类: 一元、多元酚 (三)命名
OH OH
邻-苯二酚
OH OH
OH 1,2,4-苯三酚
OH
α -萘酚
OH SO3H
间羟基苯磺酸
OH
CHO
对羟基苯甲醛
第七章 醇 硫醇 酚
醇 R-OH -OH(羟基)
酚 Ar-OH
OH -OH(羟基)
硫醇 R-SH -SH (巯基)
第一节 醇 一 醇的结构、分类和命名
H δ+
CO
H
1090
δ+
H
H
SP3
RO H
有较强的极性
1 醇的分类
饱 CH3–OH 甲醇 和 RCH2–OH 伯醇 醇 R2CH–OH 仲醇
按
R– 不饱 和醇
RSH + NaOH
RSNa + H2O
2 硫醇与重金属作用
RSH + Pb2+
R-S R-S Pb
3 氧化反应
[O]
2RSH
第7.1节 醇

(二) 与无机酸的酯化反应 二 醇与酸作用,脱去一分子H 醇与酸作用,脱去一分子H2O所得的产物称为 这种反应称为酯化反应 酯化反应。 酯,这种反应称为酯化反应。 若酸为无机含氧酸,产物则称为无机酸酯。 若酸为无机含氧酸,产物则称为无机酸酯。 无机酸酯 亚硝酸)、 )、H 如,与HNO3、HNO2 (亚硝酸)、 2SO4、 等反应生成相应的酯。 H3PO4等反应生成相应的酯。
H R C sp
3
sp3 O
10 8.9 °
H
H
O 原子为 sp 杂化 sp3 杂化轨道上有未共用电子对, 由于在 两对之间产生斥力,使得∠C-O-H 小于 109.5 °
3
2个电子分别形成 个电子分别形成 C-O及O-Hσ键 及 - σ
R-C
δ+
δ− O
由于O的电负性比C 由于O的电负性比C强,Oδ+ H和C-O极性较强,醇为极性 极性较强, H 和 极性较强 分子。 分子。
异戊醇
例如: 是二元酸, 种酯。 例如:H2SO4是二元酸,可形成酸性和中性 2种酯。
CH3CH2OH +HOSO2OH
减压蒸馏
CH3CH2OSO2OH + H2O 硫酸氢乙酯(酸性酯) (CH3CH2O)2SO2 + H2SO4
硫酸二乙酯(中性酯)
CH3CH2OSO2OH
人体内软骨中的硫酸软骨质就含有硫酸酯结构。 人体内软骨中的硫酸软骨质就含有硫酸酯结构。 硫酸软骨质就含有硫酸酯结构 硫酸二甲酯和硫酸二乙酯都是常用的烷基化试剂, 硫酸二甲酯和硫酸二乙酯都是常用的烷基化试剂,因 有剧毒,使用时应注意安全。 有剧毒,使用时应注意安全。
RONa + H 2 O
醇钠遇水
大学有机化学第七章 醇、硫醇、酚

C+稳定 脱水成烯越容易, 所以叔醇>仲醇>伯醇。
CH3 b a 提问: CH3-C-CH2CH3 b OH -H2O
*问 140 ℃ H3C C=C H3C
CH3 H
H+ CH3 C
CH3 H CH3 C H CH3 2,3-二甲基-1-丁醇
HOCH2CH2-SH
CH3CH2CH-CH2-CH3 SH
2-巯基乙醇
3-戊硫醇
二、物理性质(略)
三、硫醇的化学性质
1、弱酸性 R—SH + NaOH——>RS-Na+ + H2O 提问: R—OH + NaOH——> X
2、重金属盐的生成
重金属离子:As++、Hg++、Pb++、Cu++、Ag+
3、醛酮与Grignard试剂的加成
+ + H – C = O + R–MgX H2.5 3.5 H 无水乙醚 R-C-OMgX H + MgX2
1° 无水乙醚 CH3-CH-OMgX CH3CHO + CH3CH2MgX CH2CH3 CH3-CH-OH CH2CH3 2° + MgX2
H R-C-OMgX H
与金属钠反应: 伯醇 > 仲醇 > 叔醇
(二)羟基被卤素取代(补充)
R-OH + HX R-X + H2O
反应速度快慢与两种因素有关:
1、与氢卤酸有关: HI > HBr > HCl 2、与醇的类别有关: 如: CH CH3 3 ZnCl2-浓HCl CH3-C-OH CH3-C-Cl + 立即混浊 CH3 CH3
第七章 醇、硫醇、酚

第七章醇、硫醇、酚第一节醇一.醇的结构醇分子在结构上和水有许多相似之处,由氧原子(O)以sp3杂化轨道中的2个杂化轨道分别与碳(C)及氢(H)原子形成σ键,另2个杂化轨道被孤对电子占领。
由于氧的电负性较大,氧原子上的电子云密度较大,而碳和氢上的电子云密度较低,使醇分子的官能团—O H具有较强的极性。
二.命名醇根据烃基的不同可分为:3OH CH3CH2OH2=CH-CH2OHOHOH醇按羟基所连接的碳原子不同可分为:伯醇:羟基所连接的碳为一级碳如RCH2OH仲醇:羟基所连接的碳为二级碳如R2CHOH叔醇:羟基所连接的碳为三级碳如R3COH醇的命名规则见P102页(看书2分钟)(举几个例子让学生一起练习命名)三.物理性质(自学)问题:为什么低级醇易溶于水?为什么醇比多数分子量相近的其他有机物沸点高?四.化学性质醇主要发生O—H键断裂和C—O链断裂,具体表现为羟基H的活泼性及羟基被亲核试剂进攻而发生的亲核取代反应;以及羟基α位受羟基吸电子诱导效应的影响C—H键发生断裂,发生氧化或脱氢反应。
1.与金属钠的反应醇的酸性比水弱,比炔烃强。
表现在可以和活泼金属(Na、K、Mg、A1等)作用,分子中O—H键断裂,生成烷氧基金属(醇钠、醇钾、醇铝等),放出氢气,但反应的剧烈程度不如水。
HOH + Na NaOH + H2ROH + Na NaOH + H22ROH + Mg Mg(OH)2 + H22.形成盐醇可以作为质子的受体,可以接受强酸中的质子,形成盐,因此醇可以溶于强酸。
ROH + HCl [ROH2]++ Cl-3. 与无机盐形成结晶醇例如:CaCl2 4CH3OH CaCl2 4CH3CH2OH4、与无机酸作用硫酸氢甲酯CH3醇与无机酸反应,同样发生O-H 键断裂,生成酯。
例如:CH 3OH + HOSO 2OHCH 3OSO 2OH OH + CH 3OSO 2OH CH 3OSO 2OCH 3硫酸二甲酯硫酸二甲酯是常用的甲酯化试剂,易挥发,有剧毒,对呼吸器官和皮肤有强烈的刺激作用。
第七章醇、硫醇、酚-精选文档

酚 phenol
Ar-OH
芳香烃基
硫醇 thiol
R-SH
脂肪烃基
CH OH 如 : 3
OHCH SH 3
官能团:醇-OH
酚-OH
巯基 -SH
-OH 羟基
第一节
一、结构、分类和命名
醇 alcohol
结构:O采用sp3杂化
杂化
2px 2s 2py 2pz sp3杂化轨道
CH3-OH
1HNMR谱:d
1-6 ppm
O-H(加D2O消失); R2CH-OH
d 3-5 ppm
三、醇的化学性质
官能团为-OH,电负性O > C,C-O和 O-H极性大,易受反应试剂进攻而断裂。 H — C —— O a H 消除
氧 化 脱 氢
酸性;成酯
(一) 与金属钠的反应——O-H的断裂
H— O-H + Na ——> Na OH + H2 弱酸性(比水弱) R—O-H + Na ——> RO Na + H2 (反应激烈) (反应和缓)
醇的系统命名法:与烃类似,最长碳链含-OH,不论饱和 与 否,近-OH编号。取代基的位置常用 a、b、g、d等希腊字母 标明。
CH CH 3 CH 2 CH 2 CH 2CH 3 2-乙基-1-戊醇(b-乙基戊醇) CH 2 OH
CH 2CH 3 H 3C OH
2-ethyl-1-pentanol
连二醇与Cu(OH)2反应
具有两个相邻 -OH 的多元醇 ( 连二醇 ) 如 1,2- 丙二 醇、丙三醇等,加到Cu(OH)2沉淀中去,沉淀消失, 生成绛兰色配合物。
CH2—CH—CH2 OH OH OH
7第七章 醇 硫醇 酚1

第二节 一
硫醇
硫醇的结构与命名 -SH 巯基
C2H5SH 乙硫醇
HSCH2CH2OH 2-巯基乙醇 巯基乙醇
二
硫醇的物理性质
硫醇易挥发且有特殊臭味. 硫醇易挥发且有特殊臭味.低级硫醇在工业上作为臭味剂使 难溶于水. 用.难溶于水. 三 硫醇的化学性质 1 弱酸性
RSH + NaOH RSNa + H2O
三
(一)弱酸性 OH
酚的化学性质
溶于水
ONa + NaOH + H2O 不溶于水 OH
ONa + CO2 + H2O
+ NaHCO3
酸性:H2CO3>苯酚>H2O>ROH 苯酚> 酸性:
酸性 酚的苯环上连有吸电子基时, 酚的苯环上连有吸电子基时,其酸性比苯 酚强,连有给电子基时,其酸性比苯酚弱. 酚强,连有给电子基时,其酸性比苯酚弱.
sp2 H . O
1.6D
.
P–π共轭
O—H H
①O–H键极性增强,–H比醇活泼 H键极性增强, H OH难取代 ②C–O键加强,–OH难取代 O键加强, OH ③苯环被活化,环上易取代 苯环被活化,
分类: 一元, (二)分类: 一元,多元酚 (三)命名 OH OH OH OH 邻-苯二酚 1,2,4-苯三酚 , , -
1
卤代反应
OH Br2 CS2 Br OH Br Br2 H2O Br OH Br
苯酚鉴别
2
硝化反应
OH + 稀HNO3 25 ℃ OH NO2 + NO2 (15%) OH
(30%~40%)
3 磺化反应
OH 25 ℃ OH + H2SO4 100 ℃ SO3H OH (热力学控制产物 热力学控制产物) 热力学控制产物 SO3H (动力学控制产物 动力学控制产物) 动力学控制产物
醇、硫醇、酚《有机化学》
CH3CH2OCH2CH3
SN2
X
CH3 HOC2H5 + H3C C SN1 CH3
-H+
CH3 H3C C OC2H5 CH3
2、分子内脱水-----生成烯 醇脱水活性 :叔醇 > 仲醇 > 伯醇 叔醇、仲醇是E1机理,伯醇为E2机理。
CH3CH2OH
H+ H2SO4
180℃
H2C CH2
CH2CH3
多元醇 HOCH2CH2OH 乙二醇
CH2OH HOH2C C CH2OH CH2OH
,
CH2CHCH2
OH OH OH
, CH CH CH , HOCH CH CH CH OH
2 2 2 2 2 2 2
OH
OH
丙三醇
1,3-丙二醇
1,4-丁二醇
,
HOCH2CHCHCHCHCH2OH
OH OH OH OH
(C2H5)2O MW μ/10-30cm b.p 74 3.93 75 CH3CH2CH2OH 溶解度 ∞ CH3(CH2)2Cl 79 7.0 47 CH3(CH2)3OH 7.9 溶解度下降 CH3(CH2)2CHO 72 9.07 76 CH3(CH2)4OH 2.3 CH3(CH2)3OH 74 5.43 118 CH3(CH2)5OH 0.6
+HO
2
CH2CH2
-
OH2
+
-H2SO4 E2
H C H C
H H
HSO4
H
+
H2O
E1机理的脱水有C+重排
CH3 H H3C C C CH3 CH3OH
CH3
H+
第七章醇硫醇酚(3)

43
CH3CH2OH
75%溶液作消毒剂;溶剂(酊剂、醑剂); 变性酒精。
24
第二节
一、结构与命名 (一)结构 (二)命名 R-SH
硫醇
-SH 巯基
在相应的醇名称中加上“硫”字。 结构复杂时,把-SH 作为取代基。
CH3 SH
CH3CH2SH HOH2C CH2 SH 2-巯基乙醇 2-mercaptoethanol
3、按HO--连碳原子类型分
R R CH2 OH R R 仲醇(2° ) CH OH R C OH CH3OH 甲醇
5
伯醇(1° )
R 叔醇(3° )
二、命名:
(一)IUPAC命名法
脂肪醇命名的一般原则:
1、选主链(含羟基)
2、编号(近羟基一端开始)
3、取代基在前,母体在后(羟基为母体)
6
CH3CHCH2CH2OH
检查司机是否酒后驾车的分析仪就有根据此反应设计的。
在100ml血液中含有超过80mg乙醇(最大允许量)时,
呼出的气体即可使仪器得出正反应。
22
(2) 用CrO3/吡啶溶液
伯醇 仲醇
醛 酮
叔醇没有-H,不被氧化
23
五、甲醇、乙醇的功能与毒性(自学) (一)甲醇 CH3
OH
无色透明液体,有酒味,毒性:10ml失明、30ml致 死。 抗冻剂、溶剂,工业原料合成甲醛等。 (二)乙醇
CH3OH为例
H C H
O H H
109.3°
..
108.9 °
11
..
sp3杂化轨道
四、化学性质:
b a Rc CH CH O H d H H
结构与反应性: a.酸性H反应——O-H键极性
7有机化学-第七章醇、硫醇、酚

RONa + H-OH
R-OH + NaOH
(一) 与活泼金属反应——似水
乙炔钠与醇反应时生成乙炔,说明炔烃的酸性比醇更弱。
HC≡CNa + R-OH ——> HC≡CH + RONa 酸性序:H2O > R-OH > HC≡CH > NH3 > R-H
碱性序:OH < RO
<
HC≡C < NH2 < R
OH
H
慢 β α
快
OH2
C C
-H
+
快
C=C
H 2O
正碳离子
决定反应速度
问题1:伯、仲、叔醇脱水活性顺序如何? 正碳离子稳定性:
叔正碳离子>仲正碳离子>伯正碳离子
脱水反应活性 叔醇>仲醇>伯醇
问题2:不对称的醇脱水产物如何? CH3CHCHCH2 H OH H CH3CH=CHCH3 浓硫酸 主要产物
●常用于鉴别邻二醇类化合物
例如: 用化学方法鉴别下列化合物
(1)1,2-丙二醇与1,3-丙二醇
CH 3
CH CH 2 OH OH
Cu(OH)2
绛蓝色 —
CH 2 CH 2 CH 2 OH OH
(二)与无机含氧酸的酯化反应
甘油与硝酸反应
CH2—OH CH —OH +3HONO2 CH2—OH
H2SO4
第七章
醇、硫醇、酚
醇(alcohol): 是脂肪烃、脂环烃或芳香烃 侧链中氢被羟基取代而成的化合物
硫醇(thiol): 与醇相应的含硫化合物
酚(phenol): 是芳香环上的氢被羟基取代 而成的化合物。 醇:R—OH 硫醇: R—SH 酚:Ar—OH 官能团 —OH 羟基 官能团 —SH 巯基 官能团 —OH 羟基
第七章醇硫醇酚

酸性: H2O > ROH > RH 碱性: R— > RO— > OH—
(二) 与无机含氧酸的酯化反应 硝酸、硫酸、磷酸
硫酸氢甲酯 硫酸二甲酯
烷基一磷酸酯 烷基二磷酸酯 烷基三磷酸酯 (三) 脱水反应
醇分子内脱水机制:
正碳离子的稳定性次序为: 叔碳>仲碳>伯碳, 故不同脂肪醇脱水活性的顺序为: 叔醇>仲醇>伯醇。 醇的分子内脱水成烯的反应也遵循
CH3CH2SH+NaOH→CH3CH2SNa+H2O (二)硫醇与重金属作用
(三)硫醇的氧化反应
第三节 酚
一、结构、分类和命名
通式:Ar-OH 苯酚俗名石炭酸,是结构最简单的酚。
1、结构特点:
p-π共轭:
(1)使氧原子上的p电子云向苯环转移, 其电子云密度相对降低,使O-H键易离 解断裂,给出质子,从而显酸性;
二、酚的物理性质
酚类化合物室温下大多数为结晶性固体。
酚类与醇一样能形成分子间氢键,也能 与水分子之间形成氢键。但由于烃基部 分较大,酚类化合物在水中有一定溶解 度,并且随着分子中羟基数目的增多, 溶解度不断增大。
酚类化合物一般可溶于乙醇、乙醚、苯 等有机溶剂。
三、化学性质 (一)酸性与成盐
甲硫醇 3-戊硫醇 1,2-乙二硫醇 2-巯基乙 醇
二、物理性质 在室温下,甲硫醇为气体,其它硫醇为液体和 固体。硫醇的沸点比相对分子量相近的烷烃高, 但比结构相似的醇低得多。小分子的硫醇有强 烈的臭味。
三、 化学性质
(一)弱酸性 硫醇具有一定的酸性,乙硫醇的 pKa=10.6, 其酸性远远强于醇。
在人体内,乙醇可被肝脏的脱氢酶氧化 成乙醛,乙醛可被继续氧化成机体细胞 所同化的乙酸,这就是为什么人体可以 承受适量酒精的缘故。但过量饮酒会造 成乙醇在血液中潴留,导致酒精中毒。
07醇 硫醇 酚

C H 3C H C H 2C H 3 OH
异丁醇
C H 2 C H 2 C H 2 -O H Cl
叔丁醇
-C H 2 -O H
仲丁醇
g-氯丙醇
苯甲醇(苄醇)
7
第七章 醇、硫醇、酚
第一节 醇 (一、结构分类命名)
第七章 醇、硫醇、酚
第一节 醇
结构分类命名 物理性质
化学性质
第二节 硫醇 第三节 酚
1
第七章 醇、硫醇、酚
醇、酚、醚都是烃的含氧衍生物,也可看作 水的烃基衍生物。碳与氧以单键相连(C—O)。
R 取 代 1H R O H 醇 醇羟基
H O H
Ar取代1H
R 或 Ar 取代 2H
Ar H R
醇分子内脱水成烯的反应,也遵循 Saytzeff 规律,即主要产物是双键上连 有最多烃基的烯烃。
CH3 H OH H
4 6 % H 2S O 4
C H 3 -C H -C — C H 2 — — — — >
CH3
CH3
9 0 ~ 9 5 ℃ C H 3 C H = C -C H 3 + C H 3 C H 2 -C = C H 2
84%
16%
23
第七章 醇、硫醇、酚
第一节 醇 (三、化学性质)
脱水机制:在无机酸催化下, 醇的羟基质子化, 脱水 生成正碳离子中间体, 最后消去β-H 而生成乙烯。
H
β α
+ H+
快
H
β
C
C OH
H
C
α
C
07章 醇、硫醇、酚

NaOOC CH CH COONa S Hg S
CH2 CH CH2 OH SH SH
CH2 CH CH2 SH SH SO3Na
BAL
(三)氧化反应
[O] [H]
KMnO4
2 R SH
R S S
R
CH3SH
CH3SO3H
.. [O] R S. R .
O ↑ S R .. R O
CH3
S
CH3
CH3CH2CH CH2 H2 O CH3CH2CHCH3 H2SO4 OH (1:1) :) 19% CH3CH CHCH3 81%
R CH CH R' H OH
+ 快 R CH CH R' + H H + OH2
慢
RCH
CHR'
快 消消 β -H
R
+ CH CH H
R' + H O 2
甲基1, 迁移 甲基 2迁移
33-苯 基 -2-丁 醇
5. 多元醇 多元醇 选择连有尽可能多的羟 基的碳链作主链, 基的碳链作主链,依羟基数称某二 某三醇等。 醇、某三醇等。
CH2CH2CH2 OH OH
1, 1,3-丙 二 醇
二、Physical Properties of Alcohol
三、Chemical Properties of Alcohol
..
极性大, 极性大 , 易断裂 H 可质子化 易断裂, 易断裂 ,可发生亲核 取代反应和消去反应 可氧化
C
C H
O ..
1. 醇与金属钠反应
2 ROH
+ 2 Na
H R
2 RONa + H2↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
连二醇与Cu(OH)2反应
具有两个相邻-OH的多元醇(连二醇)如1,2-丙二 醇、丙三醇等,加到Cu(OH)2沉淀中去,沉淀消失, 生成绛兰色配合物。
+ CH2—CH—CH2
OH OH OH
Cu(OH)2 -2H2O
CH2—CH—CH2 O O OH
Cu 甘油铜
可 鉴 别 含 邻 二 醇 结 构 "CC H" H 化 合 物 OO HH
多元醇
命名 普通命名法 、 系统命名法
醇的普通命名法:烃基名+醇(省去基字)。
CH3CH2OH 乙醇
ethyl alcohol
(CH3)2CHOH 异丁醇
isopropyl alcohol
(CH3)3COH 叔丁醇
tertbutyl alcohol
CH2OH
苯甲醇(苄醇) benzyl alcohol
Question 2:完成反应式
H3C
(1) b
OH
b H2SO4
CH 3
b OHb (2)
b
H
CH3
-H2O
CH3
(四) 氧化反应
——脱去两个氢:羟基H和a-H
氧化反应(oxidation):得氧或去氢的反应; 还原反应(reduction):得氢或去氧的反应。
常用的氧化剂有K2CrO7(H2SO4溶液)、KMnO4。
第七章 醇、硫醇 、酚
本章重点
掌握醇、硫醇和酚的结构和命名 掌握醇、酚的波谱性质、化学性质 ; 了解二巯基化合物的解毒原理。
英文词汇
alcohol,thiol,phenol,benzyl alcohol,glycerol, catechol,oxidation,reduction
醇 alcohol
(1) 伯醇氧化成醛,醛易继续被氧化成酸:
aH
H
R—C—O [O]
H 伯醇
R—C = O [O]
H 醛
O R—C—OH
酸
(2) 仲醇氧化成酮,常用此法制备酮。
a
CH3-CH-(CH2)5CH3 OH
Kr2CrO4-H2SO4 D
CH3-C-(CH2)5CH3 O
2-辛酮(96%)
(3) 叔醇无a-H,在同样条件下不被氧化。
与FeCl3显色
THE END
2、鉴别下列化合物练习
1、完成反应式
1.CH 3CH 2CHC3 H浓2H SO 4 OH
2. HO
CH 3 KHM + n4O
CH 3
3.
+ B2r
OH
4. HO
CH 2CHC3+H NaOH OH
1,2-丙二醇 叔丁醇 苯甲醇 苯酚 儿茶酚
作业:
p111 7-5/(1)(3)(6)(10), 7-6/(1)(2)(5), 78/(2)(4), 7-9/(1)(3)(5) 阅读 section5 全文,翻译p13 第五段, p14/5.2 第一段
酸性:伯醇 > 仲醇 > 叔醇
Question 1 : 比 较 CH3CH2CH2OH 、 (CH3)2CHOH 及 (CH3)3COH 与 Na 反 应 的 活性以及相应醇钠的碱性大小。
由于R-OH的酸性比水弱,它的共轭碱RO-的碱 性就比OH-强。
活性:正丙醇> 异丙醇> 叔丁醇 碱性:叔丁醇钠> 异丙醇钠> 正丙醇钠
取代苯酚:R为-I效应——酸性; R为+I效应——酸性 。
Question 4:按酸性强弱顺序排列下列化合物。
OH
Cl
OH
O2N
OH CH3
OH
酸性:对硝基苯酚>对氯苯酚>苯酚>对甲苯酚
2. 苯环上的取代——亲电取代
p-p共轭,比苯更易取代,进入其邻、对位。
卤代:
OH
பைடு நூலகம்
OH
~100%Br + 3 Br2
OH K H 2C 2S2O 4 O r7 O
OH
A2g O 无 水 乙 醚
OH
O 对苯醌 O
O 邻苯醌
O R
CH 3 O
Vit K的通式 ——1,4-萘醌衍生物
O CH3 SO3Na H2O
O
Vit K3 ——人工合成品
本章要点
1. 醇的结构 氧原子sp3杂化,四面体构型 2. 醇的性质 O-H断裂;C-O断裂;氧化 3. 硫醇的性质 解毒;氧化 4. 酚的结构 氧原子sp2杂化,p~π共轭 5. 酚的性质 弱酸性;芳环的亲电取代;氧化;
CH2—CH2—CH2
OH
OH
1,3-丙二醇(1,3-propanediol )
CH2 CHCH2 OH OHOH
丙三醇(甘油,glycerol)
二、醇的波谱性质(P183、190)
醇-OH IR谱:3600~3200 cm-1 O-H(氢键); 1300~1000 cm-1 C-O。
1HNMR谱:d 1-6 ppm O-H(加D2O消失);
CH2 + ONO2
H2O
甘油三硝酸酯是一种缓解心绞痛的药物, 又是一种烈性炸药。
H2SO4为二元酸,与醇作用可生成酸式酯和中性酯。
O CH3-OH + HO-S-OH
CH3-OSO3H 硫酸氢甲酯
O CH3O-S-OCH3 硫酸二甲酯
O O
8~18碳 高级 醇的酸 性硫 酸 酯 的 钠 盐 (R-OSO3Na) 用作洗涤剂。
O
H
H
104.5o
CH3
O H
108.9o
分类
烯醇(RCH=CHOH)
R—CH2 OH R CH—OH RR
R—C—OH R
伯醇 ( 1o醇 ) 羟基连伯碳 仲醇 (2o醇) 羟基连仲碳 叔醇(3o醇) 羟基连叔碳
CH3CH2-OH
一元醇
CH2—CH2 OH OH
二元醇
CH2—CH—CH2 OH OH OH
Br
+ 3 HBr
Br
用于鉴别苯酚
动画模拟:用溴水检验苯酚
磺化:
25℃
OH
浓 H 2SO 4 100℃
OH SO 3H
浓 H2SO4, 100 ℃
OH
SO 3H
3. 与FeCl3显色 用此显色反应可鉴别含酚-OH或具有烯醇式结
构—C=C—OH的化合物。
电影片断: FeCl3检验酚类
4. 氧化反应 酚极易氧化,邻、对二元酚更易氧化。
通式: R-OH
脂肪烃基
酚 phenol
Ar-OH
芳香烃基
硫醇 thiol
R-SH
如 : C3O HH
OHC3S HH
官能团:醇-OH
酚-OH
-OH 羟基
巯基 -SH
第一节 醇 alcohol
一、结构、分类和命名
结构:O采用sp3杂化
杂化
2px 2py 2pz 2s
sp3杂化轨道
CH3-OH
143pm
常用氧化剂[O]:KMnO4 /H+,紫红色→棕色↓; K2Cr2O7 /H+,橙色→绿色。
改变条件:
Cr3O
RC2O HH RCH 醛O
C5H5N
电影片断:铬酸试剂氧化醇
动画模拟:酒后开车的检测
第二节 硫醇 thiol
一、结构和命名
1. 结构
H2O CH3OH C6H5-OH C2H5OC2H5 R-O-O-R
m-硝基苯酚
CH3 OH
O-甲苯酚
HO
SO3H
4-羟基苯磺酸
含羟基多元酚——酚羟基为取代基来命名
CH 3
HO OH 3,5-二羟基甲苯
OH OH
儿茶酚catechol
COOH OH
邻-羟基苯甲酸 (水杨酸)
酚的结构:
苯酚
OH
O采取sp2杂化,未杂化的p轨道(有一对电
子)与苯环的大p键形成p,p-共轭体系。
(注意与酚的区别)
醇的系统命名法:与烃类似,最长碳链含-OH,不论饱和 与 否,近-OH编号。取代基的位置常用 a、b、g、d等希腊字母 标明。
C3HC2HC2HCH C2H C3H2-乙基-1-戊醇(b-乙基戊醇) C2HOH 2-ethyl-1-pentanol
CH2CH3
5-甲基-2-乙基环己醇
SH
酶
+ Hg2+
SH
活性酶
S
酶
Hg + 2H+
S
中毒酶
酶的活 性恢复
SH
S
酶
+Hg
SH
S
HS COONa HS COONa
COONa 重金属硫醇
盐由尿排出
COONa
2. 氧化反应
2 3 C 2 S C + H 2 O 2 H H H C 3 C 2 S S H C H 2 C 3 + 2 H 2 H O H
O电子云密度,C-O极性 , p,p-共轭 不易断裂——难取代。
O-H极性,H易离去——弱酸 性。
苯环上电子云密度,易亲电 取代。
二、酚的波谱性质(P183、190)
酚-OH IR:O-H、C-O类似于醇,
3300~3000cm-1, C=C-H, 1675~1500cm-1, C=C。
H3C
OH
2-ethyl-5-methylcyclohexanol
CH3-CH=CH-CH-CH2CH2CH2CH3
CH-OH
CH2-
3-丁基-1-苯基- 4-己烯-2-醇 3-butyl--1-phenyl-4-hexen-2-ol
多元醇的命名:“某二醇、某三醇”等。-OH 数目与主链碳原子数相同时,可不标出羟基位次。
