2017届高考化学第一轮高效演练检测题15
2017届高考化学第一轮高效演练检测题50综述

高效演练•跟踪检测1. (2016 •张家界模拟)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1) 溴的基态原子的价电子排布图为__________ 。
(2) 在不太稀的溶液中,氢氟酸是以二分子缔合(HF) 2形式存在的。
使氢氟酸分子缔合的作用力是________ 。
(3) 请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是。
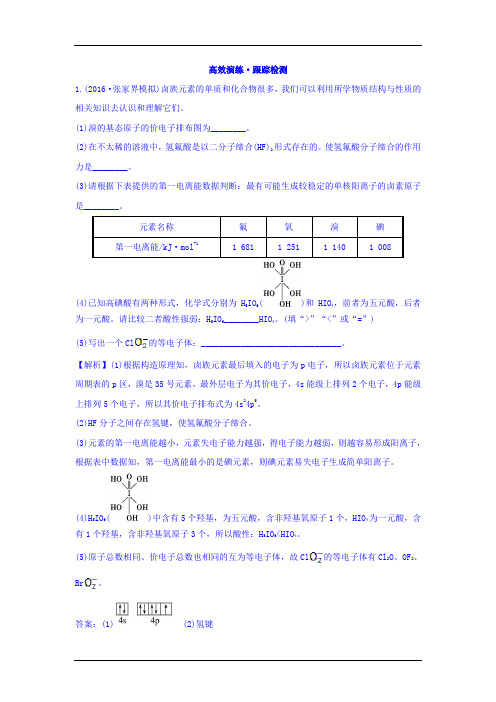
/\HO OH(4) 已知高碘酸有两种形式,化学式分别为闱06(门卜)和HICU,前者为五元酸,后者为一元酸。
请比较二者酸性强弱:HIO6 ______________ HIO4。
(填“或“=”)⑸写出一个CI0]的等电子体:_______________________________________ 。
【解析】(1)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为4s24p5。
(2) HF分子之间存在氢键,使氢氟酸分子缔合。
⑶元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,第一电离能最小的是碘元素,则碘元素易失电子生成简单阳离子。
HD 9 OH7/ZXHO OH(4)H 5106( 门卜)中含有5个羟基,为五元酸,含非羟基氧原子1个,HICU为一元酸,含有1个羟基,含非羟基氧原子3个,所以酸性:H5lO6<HIO4o⑸原子总数相同、价电子总数也相同的互为等电子体,故CI:;忑的等电子体有CI2O OF、B/_。
⑶碘(I) (4)<⑸Cl 20(或 OF 或 Br g.L')2.(2016 •开封模拟)氢、碳、氧、硫元素是自然界极为丰富的非金属元素,它们构成了许许 多多的化合物。
(1)如图所示是 H 2O 的空间构型, ______________________ HO 分子中每个氧原子都是杂化,HO 为_________ (填“极性”或“非极性”)分子。
2017届高考化学第一轮高效演练检测题6

高效演练·跟踪检测【教材母题拓展练】1.(RJ必修1·P38改编题)下列叙述正确的是( )A.氧化还原反应的本质是化合价发生变化B.有单质参加的化学反应一定是氧化还原反应C.臭氧氧化性很弱,不能用于餐具消毒D.反应中同一反应物可能既发生氧化反应又发生还原反应【解析】选D。
氧化还原反应的本质应是电子转移,而化合价发生变化是氧化还原反应的特征;氧气转化为臭氧是非氧化还原反应;臭氧氧化性可以杀菌消毒,常作消毒剂。
2.(RJ必修1·P39改编题)下列反应中,氧元素被还原且氧化剂与还原剂的物质的量之比为1∶2的是( )A.2KClO32KCl+3O2↑B.4P+5O22P2O5C.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑D.2H2+O22H2O【解析】选D。
氧元素被还原,即氧原子得到电子,反应后氧元素的化合价降低;D项中,氧化剂是氧气、还原剂是氢气,二者物质的量之比是1∶2。
3.(LK必修1·P5改编题)通入氯气后,下列变化中能实现的是( )A.HCl→H2B.CO2→COC.Fe2O3→FeD.Br-→Br2【解析】选D。
氯气有强氧化性,转化过程HCl→H2、CO2→CO、Fe2O3→Fe中氢元素、碳元素、铁元素化合价降低,需要加入还原剂;转化过程Br-→Br2,溴元素化合价升高,需要加入氧化剂,如Cl2。
4.(SJ必修1·P48改编题)下列生成单质的反应中,化合物既是氧化剂又是还原剂的是( )A. Br2+2NaI2NaBr+I2B.2H2O O2↑+2H2↑C.2C+SiO2Si+2CO↑D.4Al+3MnO23Mn+2Al2O3【解析】选B。
A项,该反应中,碘化钠中碘元素的化合价升高,所以碘化钠作还原剂,错误;C项,该反应中,二氧化硅中硅元素的化合价降低,所以二氧化硅作氧化剂,错误;D 项,该反应中,二氧化锰中锰元素的化合价降低,所以二氧化锰作氧化剂,错误。
2017年普通高等学校招生全国统一考试考前演练(一)理科综合化学试题含答案

7.化学在生产和日常生活中有着重要的作用。
下列有关说法正确的是A. “地沟油”经过加工处理后,可以用制肥皂B.二氧化硫有漂白性,大量用作棉、麻、纸张和食品的漂白C.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的D. PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶8.以下判断,结论正确的是选项项目结论A 三种有机化合物:丙烯、氯乙烯、苯分子内所有原子均在同一平面B 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇属于同一反应类型C 乙烯和苯都能使溴水褪色褪色的原理相同D C4H9Cl的同分异构体数目(不考虑立体异构)共有4种9.下列实验操作、现象和结论均正确的是选项实验操作现象结论A 向盛有1mL浓硫酸的试管中加入5mL0.1mol/L的2Cr2O7溶液溶液橙色变深增大生成物浓度,平衡Cr2O72-(橙色)+ H20 2CrO42-(黄色)+ 2H+逆向移动B 向Mg(OH)2悬浊液中加入少量氯化铵晶体沉淀溶解,溶液变说明反应Mg(OH)2+2NH4+Mg2++2NH3·H2O澄清C 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴3[Fe(CN)6]溶液无明显现象该过程未发生原电池反应D 向煤炉中灼热的煤炭上洒少量水产生淡蓝色火焰,煤炭燃烧更旺加少里水后,可使煤炭燃烧放出更多的热量10.以下数值大于或等于阿伏加德罗常数的是A.常温常压下,5.6L甲烷中的共价键数目B.标准状况下.17gD3中所含分子数目C.向0.2molNH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-教目D.0.1mol羟基(—OH)中所含电子数目11.某有机物能使澳的CC4溶液褪色,也能在一定条件下发生水解生成两种有机物,还能发生加聚反应生成高分子化合物,则此有机物中通常含有的基团的组合是A.卤素原子、碳碳双键B.羟基、羧基C.醛基、酯基D.碳碳双键、酯基12.甲~庚等元素在周期表中的相对位置如右表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。
2017届高考化学第一轮高效演练检测题1

高效演练·跟踪检测【教材母题拓展练】1.(RJ选修4·P52改编题)室温下,柠檬水溶液的pH是3,则其中由水电离出的c(OH-)是( )A.0.1 mol·L-1B.1×10-3mol·L-1C.1×10-7mol·L-1D.1×10-11mol·L-1【解析】选D。
柠檬水中的OH-全部来自水的电离。
pH=3,则c(H+)=0.001 mol·L-1,由水的离子积常数可知,c(OH-)=mol·L-1=1×10-11mol·L-1。
2.(RJ选修4·P52改编题)室温下,在48 mL 0.1 mol·L-1盐酸中加入12 mL0.4 mol·L-1NaOH溶液时,所得的溶液( )A.pH=7B.pH>7C.pH=10D.pH=8【解析】选A。
n(H+)=48×10-3L×0.1 mol·L-1=4.8×10-3mol,n(OH-)=12×10-3L×0.4 mol·L-1=4.8×10-3mol,n(H+)=n(OH-),pH=7。
3.(RJ选修4·P52改编题)甲溶液的pH是2,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为( )A.1 000∶1B.1∶1 000C.2∶5D.5∶2【解析】选A。
甲溶液的pH是2,c(H+)=10-2mol·L-1,乙溶液的pH是5,c(H+)=10-5mol·L-1,则甲溶液与乙溶液的c(H+)之比为10-2mol·L-1∶10-5mol·L-1=1 000∶1。
4.(RJ选修4·P52改编题)下列溶液pH由小到大的排列顺序是( )①0.1 mol·L-1HCl溶液②0.1 mol·L-1H2SO4溶液③0.1 mol·L-1NaOH溶液④0.1 mol·L-1CH3COOH溶液A.③④①②B.④③①②C.②①④③D.③④②①【解析】选C。
2017届高考化学第一轮高效演练检测题49

高效演练·跟踪检测1.(2016·唐山模拟)现有A、B、C、D、E、F六种位于周期表前四周期的元素,其原子序数依次增大,相关信息如下表所示:根据以上信息,回答下列问题:(1)画出元素C的基态价电子排布图:__________;F元素位于周期表的_________区;B、C、D三种元素的第一电离能由大到小顺序为______________________(用元素符号表示)。
(2)化合物BA2D2蒸气293 K时,理论测算密度为2.0 g·L-1,实际密度为2.5 g·L-1的原因是__________________________________。
(3)ED2中E原子的杂化类型为__________________;ED2易溶于水的原因可能是___________(填序号)。
①ED2与水极性相同②ED2可以与水反应(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为__________________。
【解析】A的一种核素的原子核内不含中子,则A是H;B原子核外电子有6种不同运动状态,则B是6号元素C;C的最高价氧化物对应的水化物与其氢化物可发生非氧化还原反应,则C是N;D单质之一为淡蓝色气体,可阻挡对人体有害的紫外线,则D是O;E位于短周期,基态原子M层成对电子数是未成对电子数的2倍,则E是S;F元素的一种氧化物M可用作油漆颜料,与某单质反应可应用于焊接钢轨,则F是Fe。
(1)7号元素N的基态价电子排布图是;F元素是Fe,位于周期表第4周期第Ⅷ族,因此位于d区;一般情况下,同一周期的元素,原子序数越大,原子半径越小,元素的第一电离能就越大,但是由于氮原子核外电子处于其电子层的半充满的稳定状态,失去电子比O还大,所以B、C、D三种元素的第一电离能由大到小的顺序为N>O>C。
(2)化合物BA2D2的结构简式是HCOOH,蒸气293K时,理论测算密度为2.0 g·L-1,实际密度为2.5 g·L-1的原因是甲酸分子是极性分子,分子之间存在氢键,增加了分子之间的吸引力,使物质的密度升高。
2017年高考化学一诊试卷 含解析

2017年四川省成都市龙泉中学高考化学一诊试卷一、选择题(每小题6分,本大题共7小题.每小题给出的四个选项中,只有一项是符合题目要求的.)1.化学在生活中有着广泛的应用,下列对应关系错误的是()化学性质实际应用A Al2(SO4)3和小苏打反应泡沫灭火器灭火B铁比铜金属性强FeCl3腐蚀Cu刻制印刷电路板C次氯酸盐具有氧化性漂白粉漂白织物D HF与SiO2反应氢氟酸在玻璃器皿上刻蚀标记A.A B.B C.C D.D2.X、Y、Z、W为原子序数依次增大的短周期非金属元素,且四种元素分别位于四个连续的主族中,Z元素的核电荷数为X元素的2倍.下列说法错误的是()A.气态氢化物的稳定性:W>ZB.简单离子半径:X<YC.液态ZW4气化需克服分子间作用力D.X、W可以同时出现在同一离子化合物中3.设N A为阿伏伽德罗常数的数值,下列说法正确的是()A.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为N AB.常温下,pH=12的Na2CO3溶液中含有的OH﹣离子数为0.01N A C.标准状况下,0。
56 L丙烷中含有共价键的数目为0.2 N A D.7.8 g Na2O2中含有的阴离子数为0。
2N A4.有两种有机物Q ()与P (),下列有关它们的说法中正确的是( )A.二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3:2 B.二者在NaOH醇溶液中均可发生消去反应C.一定条件下,二者在NaOH溶液中均可发生取代反应D.Q的一氯代物只有1种、P的一溴代物有2种5.下列实验操作与预期实验目的或所得实验结论一致的是( )选项实验操作实验目的或结论A向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤除去MgCl2溶液中少量FeCl3B向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失证明溶液中含SO42﹣C向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊证明该溶液中存在CO32﹣D两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液FeCl3溶液对H2O2分解速率无影响A.A B.B C.C D.D6.下列图示与对应的叙述不相符的是( )A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化C.图3表示0。
2017届高考化学第一轮高效演练检测题52

专题评估月考卷(二)元素及其化合物(90分钟100分)一、选择题(本题包括16小题,每小题3分,共48分)1.化学与生产、生活密切相关,下列说法正确的是( )A.焰火的五彩缤纷是某些金属元素化学性质的展现B.将煤气化后再作为能源,可减少PM 2.5引起的危害C.用激光笔分别照射盛有蓝墨水、FeCl3溶液的玻璃杯均出现光亮的通路D.氨气液化时能吸收大量的热,常用来作制冷剂2.下列关于物质的用途或变化,说法正确的是( )A.Al2O3熔点很高,可用作耐火材料B.高纯度的硅单质用于制作光导纤维C.铝热反应是炼铁最常用的方法D.N2与O2在放电条件下直接化合生成NO23.强酸X的转化关系如图:酸X氧化物酸X图中单质可能为( )A.CB.FeC.AlD.Cu4.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )5.下列实验操作、现象和结论均正确的是( )6.下列叙述正确的是( )A.Li在氧气中燃烧主要生成Li2O2B.卤族元素单质X2(X代表F、Cl、Br、I)均可以与水反应生成HXC.将SO2通入次氯酸钙溶液可能得到次氯酸D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu7.为了证明硫酸亚铁铵晶体的成分中含有N、Fe2+、S和H2O,下列实验叙述中不正确的是( )A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水B.取少量硫酸亚铁铵晶体放入试管中,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NC.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SD.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+8.下列有关物质的性质和该性质的应用均正确的是( )A.NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体B.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污C.次氯酸钠具有强还原性,可用于配制“84”消毒液D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸9.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,下列离子方程式与事实不符的是( )A.OH-+C+2H+HC+H2OB.2OH-+C+3H+HC+2H2OC.2OH-+C+4H+CO2↑+3H2OD.OH-+C+3H+CO2↑+2H2O10.科学的假设与猜想是科学探究的先导和价值所在,在下列假设或猜想引导下的探究肯定没有意义的是( )A.探究SO2和Na2O2反应可能有Na2SO4生成B.探究NO和N2O可能化合生成NO2C.探究NO2可能被NaOH溶液完全吸收生成NaNO2和NaNO3D.探究向滴有酚酞溶液的NaOH溶液中通入Cl2,酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用11.下列实验中不能出现沉淀现象的是( )A.NO2和SO2气体同时通入BaCl2溶液中B.SO2气体通入BaCl2溶液中C.SO2气体通入Ba(NO3)2溶液中D.SO2气体和过量NH3同时通入BaCl2溶液中12.下列相关反应的离子方程式书写正确的是( )A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+Fe3++3H2OB.NaHCO3溶液中加入过量Ba(OH)2溶液:2HC+Ba2++2OH-BaCO3↓+2H2O+CC.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使S完全沉淀:Al3++2S+2Ba2+ +4OH-Al+2BaSO4↓+2H2OD.向含有0.4 mol FeBr2的溶液中通入0.1 mol Cl2:2Fe2++Cl22Fe3++2Cl-13.甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图所示。
2017届高考化学第一轮高效演练检测题16

高效演练·跟踪检测1.(RJ选修4·P19改编题)对于化学反应3W(g)+2X(g)4Y(g)+3Z(g),下列反应速率关系中,正确的是( )A.v(W)=3v(Z)B.2v(X)=3v(Z)C.2v(X)=v(Y)D.3v(W)=2v(X)【解析】选C。
对于任一化学反应,用不同的物质表示该反应的速率,其数值之比等于其化学计量数之比,v(W)∶v(X)∶v(Y)∶v(Z)=3∶2∶4∶3。
v(W)=v(Z),A错误;3v(X)=2v(Z),B错误;2v(X)=v(Y),C正确;2v(W)=3v(X),D错误。
2.(RJ选修4·P19改编题)NH3和纯净的O2在一定条件下发生反应:4NH 3(g)+3O2(g)2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( )A.v(N2)=0.125 mol·L-1·min-1B.v(H2O)=0.375 mol·L-1·min-1C.v(O2)=0.225 mol·L-1·min-1D.v(NH3)=0.250 mol·L-1·min-1【解析】选C。
设4 min时,生成6xmol H2O(g)4NH 3(g)+3O2(g)2N2(g)+ 6H2O(g) n(总)起始/mol 4 3 0 0 7变化/mol 4x 3x 2x 6x4 min时/mol 4-4x 3-3x 2x 6x 7+x据题意,则有:=0.4 解得:x=0.5则4 min内H2O的变化浓度为Δc(H2O)==1.5 mol·L-1,v(H2O)==0.375 mol·L-1·min-1,再由各物质表示的速率之比等于各物质的化学计量数之比,可得各物质表示的反应速率分别为v(N2)=0.125 mol·L-1·min-1,v(NH3)=0.250 mol·L-1·min-1,v(O2)=0.187 5 mol·L-1·min-1。
2017届高考化学第一轮高效演练检测题

1.(RJ必修1·P29改编题)胶体与溶液最简单的鉴别方法和本质区别是( )A.分散质粒子直径大小,是否有丁达尔效应B.是否无色透明,是否稳定C.是否有丁达尔效应,分散质粒子直径大小D.是否稳定、能否电泳【解析】选C。
胶体分散系与其他分散系的本质区别是分散质粒子直径大小,鉴别溶液和胶体最简单的方法是丁达尔效应。
2.(RJ必修1·P42改编题)下列有关物质分类或归类正确的是( )A.混合物:空气、碘酒、水玻璃、熟石灰B.化合物:烧碱、氯化氢、干冰、胆矾C.电解质:干冰、胆矾、铁、生石灰、盐酸D.单质:液态氧、白磷、氮气、碘酒【解析】选B。
A项,熟石灰是纯净物;B项,全是化合物;C项,干冰是非电解质,盐酸是混合物,铁既不是电解质也不是非电解质;D项,碘酒是混合物。
3. (RJ必修1·P29、P42改编题)当光束通过下列分散系:①有尘埃的空气②稀硫酸③油水混合物④稀豆浆,能观察到丁达尔效应的是( )A.①②B.②③C.①④D.②④【解析】选C。
胶体能发生丁达尔效应,①④为胶体,②为溶液,③为乳浊液。
【模拟预测强化练】1.(2016·南昌模拟)德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。
下列说法正确的是( )A.水、双氧水、水玻璃都是纯净物B.石墨和C60互为同位素C.磷酸钙中所含的元素都是短周期元素D.一定条件下石墨转化为C60是化学变化【解析】选D。
水、双氧水都是纯净物,水玻璃是硅酸钠水溶液属于混合物,A错误;石墨和C60是碳元素的不同单质,互为同素异形体,B错误;钙元素是长周期元素,C错误;同素异形体之间的转化属于化学变化,一定条件下石墨转化为C60是化学变化,D正确。
2.(2016·石家庄模拟)“纳米材料”是粒子直径为1~100 nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )①是溶液②是胶体③能产生丁达尔效应④能透过滤纸⑤不能透过滤纸⑥静置后会析出黑色沉淀A.①④⑤B.②③⑤C.②③④D.①③④⑥【解析】选C。
2017届高考化学第一轮高效演练检测题50
高效演练·跟踪检测1.(2016·张家界模拟)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)溴的基态原子的价电子排布图为________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。
使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
(4)已知高碘酸有两种形式,化学式分别为H5IO6()和HIO4,前者为五元酸,后者为一元酸。
请比较二者酸性强弱:H5IO6________HIO4。
(填“>”“<”或“=”)(5)写出一个Cl的等电子体:________________________________。
【解析】(1)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为4s24p5。
(2)HF分子之间存在氢键,使氢氟酸分子缔合。
(3)元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,第一电离能最小的是碘元素,则碘元素易失电子生成简单阳离子。
(4)H5IO6()中含有5个羟基,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基,含非羟基氧原子3个,所以酸性:H5IO6<HIO4。
(5)原子总数相同、价电子总数也相同的互为等电子体,故Cl的等电子体有Cl2O、OF2、Br。
答案:(1)(2)氢键(3)碘(I) (4)< (5)Cl2O(或OF2或Br)2.(2016·开封模拟)氢、碳、氧、硫元素是自然界极为丰富的非金属元素,它们构成了许许多多的化合物。
(1)如图所示是H2O2的空间构型,H2O2分子中每个氧原子都是__________杂化,H2O2为__________(填“极性”或“非极性”)分子。
2017届高考化学第一轮高效演练检测题46

高效演练·跟踪检测1.以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:请回答下列问题:(1)在炉气制造中,生成SO2的化学方程式为__________。
(2)炉气精制的作用是将含有SO2的炉气________、________和干燥,如果炉气不经过精制,对SO2催化氧化的影响是____________________________________________________________________________________________________。
(3)精制炉气(含SO2体积分数为7%,O2为11 %,N2为82%)中SO2平衡转化率与温度及压强关系如图所示。
在实际生产中SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是____________________________________________________。
(4)在SO2催化氧化设备中设置热交换器的目的是____________________________________________,从而充分利用能源。
【解析】SO2在催化氧化过程中,炉气中含有的砷、硒化合物等杂质和矿尘,都会使催化剂中毒,失去催化能力,因而需要除尘、水洗;水蒸气对设备和生产有不良影响,故需干燥。
B点的转化率虽高、但压强高于常压,加压必须增加设备的性能,增大投资和能量消耗,另外,常压下转化率已经达到97%左右,转化率已经很高,加压,对平衡转化率的影响不大,故不选择B点。
C点的转化率最大,但反应速率低,故选择催化剂的活性最大的A点温度。
答案:(1)4FeS2+11O22Fe2O3+8SO2(2)除尘水洗矿尘以及砷、硒等元素的化合物会使催化剂中毒,水蒸气对设备和生产有不良影响(3)不选B点,是因为压强大对设备的投资大,消耗的动能大,同温度下SO2原料的转化率在0.1 MPa时已达到97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用0.1 MPa;不选择C点,是因为温度低催化剂的催化作用受影响,反应速率低,450℃时,催化剂的催化效率最高(4)利用反应放出的热量预热原料气,上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全【方法规律】2.(2016·大连模拟)工业合成氨技术是对人类的巨大贡献之一。
2017届高考化学第一轮高效演练检测题25

高效演练·跟踪检测【教材母题拓展练】1.(RJ必修1·P99改编题)下列制备和收集气体的实验装置合理的是( )【解析】选D。
A中固体混合物加热时,试管口应略向下倾斜且在收集NH3的试管口放一团棉花;B中收集NO应用排水法,排空气法收集到的是NO2;H2密度小于空气,应用向下排空气法收集。
2.(RJ必修1·P96改编题)某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2②Cl2③CH4④HCl⑤NH3⑥NO⑦NO2⑧SO2,下列操作正确的是( )A.烧瓶是干燥的,由A进气收集①③⑤B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧C.在烧瓶中充满水,由A进气收集①③⑤⑦D.在烧瓶中充满水,由B进气收集⑥【解析】选A。
由A进气,应该收集密度比空气小且不和空气反应的气体,①③⑤可以用此方法收集,A项正确;由B进气,应该收集密度比空气大且不和空气反应的气体,②④⑦⑧可以用此方法收集,B项错误;用排水法收集的气体在水中的溶解度小,且应该由A进气,因此C、D两项错误。
3.(SJ必修1·P99改编题)下列实验装置、选用的试剂或实验操作都正确的是( )A.实验室用A装置制取NH3B.可用B装置吸收NH3,并防止倒吸C.可用C装置稀释浓硫酸D.可用D装置除去CO2中的HCl【解析】选B。
NH4Cl受热分解生成的NH3和HCl在试管口会重新生成NH4Cl,A错误;倒置的漏斗可防止倒吸,B正确;不能在量筒中稀释浓硫酸,C错误;饱和Na2CO3溶液能吸收CO2,D错误。
【模拟预测强化练】1.(2016·襄阳模拟)实验室对制备气体反应的基本要求是“反应条件易满足、能平稳地产生气流、所得气体中尽可能不含杂质成分(除少量水蒸气及少量原料汽化形成的物质)”,下列反应一般能用于实验室制备气体的是( )A.Na2O2与CO2反应制备O2B.H2O2与MnO2混合制备O2C.加热浓硝酸制备NO2D.浓NaOH溶液与NH4Cl溶液混合加热制备NH3【解析】选B。
2017届高考化学第一轮高效演练检测题2

高效演练·跟踪检测1.(RJ选修4·P59改编题)下列反应既不是水解反应,又不是氧化还原反应的是( )A.N+H 2O NH3·H2O+H+B.HS-+H 2O H2S+OH-C.Br 2+H2O HBr+HBrOD.H 2S+H2O H3O++HS-【解析】选D。
A项为N的水解反应;B项是HS-的水解反应;C项是Br2与水的反应,属于氧化还原反应;D项为H2S的电离。
2.(RJ选修4·P59改编题)常温下,0.1 mol·L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列判断中正确的是( )A.HX、HY、HZ的酸性依次增强B.离子浓度:c(Z-)>c(Y-)>c(X-)C.电离常数:K(HZ)>K(HY)D.c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ)【解析】选D。
NaX、NaY、NaZ的pH分别为7、8、9,则HX是强酸,HY、HZ是弱酸,再根据水解规律可知HY的酸性强于HZ的酸性。
所以酸性:HX>HY>HZ,故A、C错误。
根据“越弱越水解”可知B错误。
D选项是正确的物料守恒关系式。
3.(RJ选修4·P59改编题)把0.02 mol·L-1CH3COOH溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )A.c(CH3COO-)>c(Na+)B.c(CH3COOH)>c(CH3COO-)C.2c(H+)=c(CH3COO-)-c(CH3COOH)D.c(CH3COOH)+c(CH3COO-)<0.01 mol·L-1【解析】选A。
CH3COOH溶液与NaOH溶液混合后,发生反应:CH3COOH+NaOH CH3COONa+H2O,并且生成的CH3COONa和剩余的CH3COOH浓度相等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高效演练·跟踪检测
1.(RJ选修4·P83改编题)下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极
B.电解熔融氯化钠制钠时不能用铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
【解析】选C。
A项,锌比铜活泼,故铜作正极,错误;B项,电解熔融氯化钠时用铜作阳极,阳极上Cl-不能失电子生成Cl2,错误;电镀时,待镀金属作阴极,镀层金属为阳极,C 正确;电解H2SO4制H2、O2时,阳极必为惰性电极,D错误。
2.(RJ选修4·P87改编题)钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为
( ) A.Fe-2e-Fe2+ B.Fe-3e-Fe3+
C.O2+2H2O+4e-4OH-
D.2H++2e-H2↑
【解析】选C。
根据原电池原理:正极发生得电子的反应,排除A、B,由于钢铁发生吸氧腐蚀,故得电子的物质是氧气,故选C。
3.(RJ选修4·P83改编题)1 L 1 mol·L-1的AgNO3溶液在以银为阳极,铁为阴极的电解槽中电解,当阴极增重2.16 g时,下列判断不正确的是( )
A.溶液浓度仍为1 mol·L-1
B.阳极上产生112 mL O2(标准状况)
C.转移的电子数是1.204×1022
D.反应中有0.02 mol金属被氧化
【解析】选B。
电镀过程中,溶液的浓度不变,A正确;阳极反应为Ag-e-Ag+,阴极反应为Ag++ e-Ag,阳极上无氧气生成,故B错;2.16 g Ag的物质的量为0.02 mol,故阳极有0.02 mol银被氧化,转移的电子数是1.204×1022,C、D均正确。
【模拟预测强化练】
1.(2016·青岛模拟)下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
【解析】选A。
电解熔融的氧化铝制取金属铝所需温度很高,若用铁作阳极一则因铁失电子,二则铁在高温条件下可熔化,故实际生产中利用石墨作电极,故选A。
2.下列说法正确的是( )
A.钢铁因含杂质而易发生腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用其来减缓金属的腐蚀
C.金属发生化学腐蚀还是电化学腐蚀的主要区别在于金属的纯度不同
D.无论哪种类型的腐蚀,其实质都是金属被氧化
【解析】选D。
金属通过改变其内部结构制成合金可耐腐蚀,A错误;牺牲阳极的阴极保护法是利用原电池反应保护金属制品,B错误;决定金属腐蚀类型的因素是周围的环境,C错误。
3.(2016·泰安模拟)下列实验装置中,实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是( )
A.断开K2,闭合K1时,总反应的离子方程式为2H++2Cl-Cl2↑+H2↑
B.断开K2,闭合K1时,电子沿“b→Cu→电解质溶液→石墨→a”的路径流动
C.断开K2,闭合K1时,铜电极附近溶液变红
D.断开K1,闭合K2时,铜电极上的电极反应为Cl2+2e-2Cl-
【解析】选C。
A.断开K2,闭合K1时,是电解池装置,两极均有气泡产生,说明是电解饱和食盐水的反应,反应的离子方程式为2H2O+2Cl-Cl2↑+H2↑+2OH-,故A错误;B.断开K2,闭合K1时,是电解池装置,导线中是通过电子导电,溶液是通过离子的定向移动导电,故B 错误;C.断开K2,闭合K1时,是电解池装置,两极均有气泡产生,石墨作阳极,溶液中氯
离子失电子发生氧化反应,铜作阴极,氢离子得到电子发生还原反应,依据水的电离平衡,氢氧根离子浓度增大酚酞变红,故C正确;D.断开K1,闭合K2时,发现电流表指针偏转,证明是原电池反应,形成氢氯燃料电池,石墨作原电池正极,Cl2+2e-2Cl-。
【加固训练】(2016·聊城模拟)取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。
则下列说法错误的是( )
A.b电极是阴极
B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
【解析】选D。
电解饱和NaCl溶液,阳极生成Cl2,Cl2与水反应生成HClO和HCl,HClO具有漂白性,盐酸具有酸性,可使pH试纸变红色,HClO又可将红色漂白,故内圆为白色,外圈为红色,可推出a为阳极,A正确;a为阳极与电源正极相连,B正确;电解过程中,H2O 得电子,为氧化剂,C正确;b电极附近有OH-生成,pH增大,D错。
4.(2016·沈阳模拟)如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D 为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡。
试回答:
(1)p为____极,A极发生了______反应。
(2)C为____极,试管里收集到的气体是____;D为____极,试管里收集到的气体是______。
(3)C极的电极方程式是_____________________________________________。
(4)当反应进行一段时间后,A、B电极附近溶液的pH__________(填“增大”“减小”或“不变”)。
【解析】(1)接通电源,X沉积于B极,说明B为阴极,则A为阳极,故q为负极,p为正极,A上发生氧化反应。
(2)H2SO4电解池中,C为阳极,C试管内得O2,D为阴极,D试管内得H2。
(4)A极:X-2e-X2+,B极:X2++2e-X,两极附近pH不变。
答案:(1)正氧化(2)阳氧气阴氢气
(3)4OH--4e-O2↑+2H2O (4)不变
【互动探究】(1)当电路中通过0.4 mol电子时,C极得到气体在标准状况下的体积为______________。
提示:2.24 L C为阳极,C试管内得O2,则n(O2)=0.4 mol÷4=0.1 mol,故V(O2)=2.24 L。
(2)当电路中通过0.4 mol电子时,B电极上沉积金属X为12.8 g,则此金属的摩尔质量为________。
提示:64 g·mol-1设X的摩尔质量为Mg·mol-1,则
X2++ 2e-X
2 mol Mg
0.4 mol 12.8 g
得M=64。
