催化氧化
co催化氧化

co催化氧化Co催化氧化是一种重要的化学反应,在工业、环境保护等领域有着广泛的应用。
本文将介绍Co催化氧化的原理、应用及未来发展方向。
一、Co催化氧化的原理Co催化氧化是指以钴为催化剂,在氧气存在下,将有机废气中的有害物质氧化为无害物质的化学反应。
钴作为一种重要的催化剂,在反应中发挥着至关重要的作用。
它能够提高反应速率,降低反应温度和催化剂的用量,从而提高反应效率。
二、Co催化氧化的应用1. 工业领域Co催化氧化在工业领域有着广泛的应用。
例如,在石化、化工、印染、制药等行业中,会产生大量的有机废气,这些废气中含有大量的有害物质,如苯、甲醛、VOC等。
通过Co催化氧化技术,可以将这些有害物质高效地氧化为无害物质,减少对环境的污染,保护生态环境。
2. 环境保护Co催化氧化技术还可以用于环境保护。
例如,在城市垃圾焚烧、生活垃圾填埋等场所,会产生大量的有机废气,这些废气中含有大量的有害物质。
通过Co催化氧化技术,可以将这些有害物质高效地氧化为无害物质,减少对环境的污染,保护生态环境。
三、Co催化氧化的未来发展方向1. 提高催化效率Co催化氧化技术在工业和环境保护领域有着广泛的应用,但是其催化效率还有待提高。
未来的研究方向是寻找更高效、更稳定的催化剂,以提高催化效率。
2. 降低催化剂的成本Co催化氧化技术中所使用的钴催化剂价格较高,限制了其在工业领域的应用。
未来的研究方向是寻找更便宜的催化剂,以降低催化剂的成本。
3. 拓展应用领域Co催化氧化技术在工业和环境保护领域已经得到了广泛的应用,但其应用领域还有待拓展。
未来的研究方向是探索其在其他领域的应用,如医药、食品等。
四、结语Co催化氧化是一种重要的化学反应,在工业、环境保护等领域有着广泛的应用。
未来的研究方向是提高催化效率、降低催化剂的成本和拓展应用领域,以满足社会的需求。
相信在科学家们不断的努力下,Co催化氧化技术必将得到更广泛的应用和发展。
第六章 催化氧化

气态氧 空气 价廉易得; 但是动力消耗较大,排放废气量大。 纯氧(与空气相反) 废气量小,反应设备体 积也较小; 但是需空分装置。
2、强放热反应 氧化反应是强放热反应,尤其是完全氧化反应。 故,为了反应正常进行必须及时移走反应热。
①、均相催化氧化(多为气液相氧化反应) 在反应物和催化剂(液相)的液相中气态氧化剂 发生的氧化反应。 ②、非均相催化氧化 在固态催化剂下,气相的反应物和催化剂(固 相)发生的气相氧化反应。
第二节
均相催化氧化
工业上采用两类反应: ①、催化自氧化反应 自由基链式反应机理进行,催化剂的可变价过 渡金属离子通过单电子转移,促使链的引发及过氧 化物的分解。
2、络合催化氧化的工业应用 主要是烯烃在钯盐催化剂溶液中的络合催化氧 化。如,
1 2 − CuCl 2 − HCL,水溶液 CH 2 = CH 2 + O2 ⎯PdCl ⎯⎯ ⎯ ⎯ ⎯ ⎯ ⎯→ CH 3CHO 2 1 2 − CuCl 2 − HCL,水溶液 CH 3CH = CH 2 + O2 ⎯PdCl ⎯⎯ ⎯ ⎯ ⎯ ⎯ ⎯→ CH 3COCH 3 2 1 2 − CuCl 2 − HCL,水溶液 CH 3CH 2CH = CH 2 + O2 ⎯PdCl ⎯⎯ ⎯ ⎯ ⎯ ⎯ ⎯→ CH 3CH 2COCH 3 2
1 2 − CuCl 2 − HCL,水溶液 CH 2 = CH 2 + O2 ⎯PdCl ⎯⎯ ⎯ ⎯ ⎯ ⎯ ⎯→ CH 3CHO 2
反应机理: ①、乙烯的羰基化反应
¾
1 0 CH 2 = CH 2 + Pd Cl 2 + O2 ⎯ ⎯→ CH 3CHO + Pd ↓ +2 HCl 2
催化氧化(烃类选择性氧化)
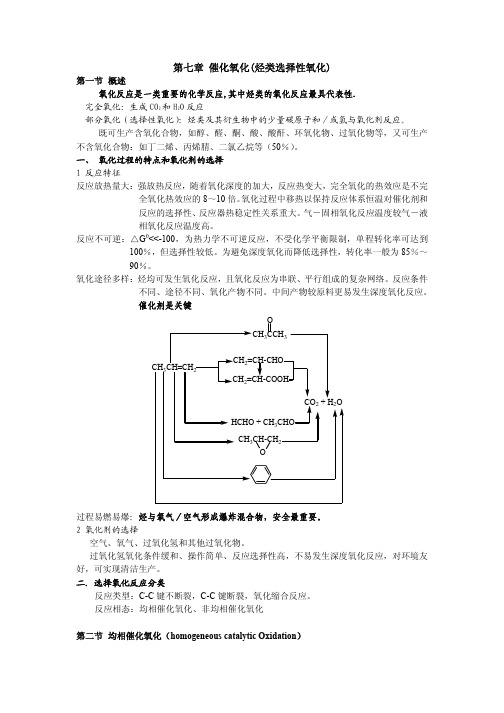
R +.H2O.
2R.OOH
.ROO + RO +H2O
RO.O . R'O + R'CHO (或酮)
.
R'O(或RO) + RH
R'OH(或ROH) + R
(5) E=167kJ/mol (6) (7)
(8) (9) (10)
分支反应生成不同碳原子数的醇和醛,进一步氧化为酮和酸,反应产物复杂。
2、催化剂体系 催化剂:Co、Mn 等过渡金属离子的醋酸盐和环烷酸盐;助催化剂
H3C
CH3
HOOC
COOH 反应产物为稳定的有机物,不易进一步氧化
CH3CHO
CH3COOH 高转化率和高选择性
而对于目的产物为中间产物的,由于中间产物较原料更易氧化,故应控制单程转化率,
通过循环操作实现高转化率。
OH
O
COOH
COOH 10%
O
C40
C-C-C-C
HAC 12%
反应产物分布与反应器物料返混程度相关
溴化物: NaBr, NH4Br,C2H2Br4,CBr4 3、反应影响因素
◇杂质:
以自由基为载链体的自氧化反应速度取决于链的传递速度,稳态时自由基的产生速度与
消失速度平衡,若体系中自由基浓度降低则反应速度急剧降低。自由基的再化合、自由基的
歧化、自由基与容器壁碰撞和反应体系中存在夺取自由基的杂质(阻化作用)
◇反应温度和氧分压 供氧能力大,反应由动力学控制
T 提高,k 增大,但不宜太高,否则 Q 吸〈Q 放,导致温度偏高,选择性降低,k 急
剧加速导致飞温。 T 降低,k 减小,Q 吸>Q 放,T 进一步降低,反应停止。
voc 催化氧化

voc催化氧化
VOC催化氧化是指通过催化剂的作用,将挥发性有机物(VOCs)转化为无害的水和二氧化碳等物质的过程。
该过程主要涉及VOCs在催化剂表面上的吸附和与表面上的氧分子发生反应。
VOC催化氧化主要通过以下步骤进行:
1.VOCs在催化剂表面上的吸附:VOCs分子在催化剂表面上的吸附是催化氧化的第一步。
吸附作用主要取决于VOCs分子与催化剂表面的相互作用力,如范德华力、静电引力等。
2.氧化反应:在催化剂的作用下,VOCs分子与表面上的氧分子发生反应,生成二氧化碳和水等无害物质。
这个过程主要涉及VOCs 分子的氧化还原反应,其中催化剂起到降低反应活化能的作用。
3.热量释放:催化氧化过程中会产生大量的热量,这些热量可以用于加热反应器或产生蒸汽等。
VOC催化氧化技术主要分为两大类:热催化氧化和光催化氧化。
热催化氧化主要利用加热方式提高反应温度,促进VOCs与氧气之间的反应;光催化氧化则利用光能激发催化剂,促进电子转移和化学反应。
在选择催化剂时,需要考虑VOCs的种类、浓度、反应温度等因素。
常见的催化剂包括金属催化剂(如铂、钯等贵金属)和非金属催化剂(如氧化物、氮化物等)。
这些催化剂具有不同的催化活性和选择性,适用于不同的VOCs处理场景。
VOC催化氧化技术在环境保护和健康保障方面具有重要意义。
通
过将有害的VOCs转化为无害的物质,可以减少环境污染和健康风险。
同时,该技术还可用于工业生产过程中的废气处理和室内空气净化等领域。
催化氧化反应原理

催化氧化反应原理氧化反应是化学过程中最为重要的反应之一,它可以将物质释放出其他物质,如氧,氢等。
催化氧化是一种特殊的氧化反应,利用催化剂来加速反应,使反应速度增加,从而提高反应产物的完成率。
催化氧化反应具有广泛的应用,如燃料电池,生物反应,制药等。
催化氧化反应的原理是,催化剂能够将反应物的分子结构转变为反应活性的结构,从而有效地促进反应,并将活性物质结合到催化剂的表面上,从而产生一定的变形,使反应物与催化剂之间形成一定的化学键,这样反应物就可以升级到活性层次,从而使反应发生更快。
催化氧化反应在分子水平上的反应类型是自由基反应,自由基反应指的是有机物质中的不稳定的分子在反应过程中改变其分子结构,从而使反应变得更快。
催化氧化反应涉及到活性中间体的分子形成和衰变,这些活性中间体的生成往往比简单的氧化反应要快得多,通过分子形态的改变使反应物有效能地把氧化剂转化为产物。
催化氧化反应是一种非常有效的反应,它可以以非常低的能量水平来完成反应,这种低能量水平使更多的反应产物形成,而不需要经过更高的能量水平。
因此,催化氧化反应的速率比普通的氧化反应要快得多,也可以节约能源,提高反应的效率。
催化氧化反应是一种重要的化学反应,它不仅在燃料电池,生物学,制药等领域有着广泛的应用,而且在日常生活中也有所体现,如食品加工,污水处理,酸性电池,汽车尾气净化等,都是催化氧化反应的应用性实例。
虽然催化氧化反应具有多方面的优势,但是它也有一些不足之处,如反应过程复杂,反应速度较慢,催化剂耗费较大,稳定性低等。
这些不足之处使得催化氧化反应的研究仍有待深入,以实现催化氧化反应的进一步提高。
催化氧化反应是一种十分重要的化学过程,它不仅在燃料电池,生物,制药,食品加工,污水处理,酸性电池,汽车尾气净化等领域具有广泛的应用,而且可以降低反应的能量水平,提高反应的完成率和效率。
虽然催化氧化反应的研究还有待深入,但是随着日新月异的科学技术的发展,催化氧化反应的应用越来越广泛,为人类发展带来了更多的机遇和潜力。
催化氧化的名词解释

催化氧化的名词解释催化氧化是一种化学反应,利用催化剂来促进有机物或无机物的氧化过程。
催化氧化反应在工业生产、环境治理以及有机合成等领域都具有重要的应用价值。
催化氧化反应的原理是通过引入特定的催化剂,提高反应的速率和效果。
催化剂是一种能够降低反应活化能的物质,它不参与反应本身,也不被反应消耗,因此能够循环使用。
催化剂在反应过程中提供了一个反应表面,用于吸附反应物并促使其发生氧化反应。
催化氧化反应广泛应用于有机合成工艺中。
在有机合成中,催化氧化反应可以将含有不饱和键的有机物转化为具有更高氧化态的产物。
例如,利用催化氧化反应,可以将醛和羰基化合物氧化成酸。
这种转化在有机合成中具有重要的意义,可以实现对化合物结构和功能的调控。
此外,催化氧化反应也被广泛应用于环境治理中。
例如,通过催化氧化反应可以将有机废水中的有害物质转化为无害的产物。
这对于环境保护和水资源管理具有重要意义。
催化氧化反应还可以将空气中的有害气体,如二氧化硫、一氧化碳等通过氧化转化为无害或低毒的物质,以减少它们对大气环境的影响。
在工业生产中,催化氧化反应也扮演着重要的角色。
例如,催化剂在石化工业中被广泛应用,例如催化裂化、催化重整等过程中,通过催化氧化反应可以实现化学物质的转化、选区性氧化和氧化还原等反应。
催化氧化反应在实际应用中面临一些挑战。
首先,催化剂的选择十分关键,不同的反应需要具有不同特性的催化剂,包括催化剂的活性、选择性和稳定性等。
其次,催化氧化反应的条件控制也是一个难题,包括反应温度、压力以及其他反应条件的优化。
此外,反应体系中存在多相反应的情况,使得催化剂与反应物之间的相互作用和分离问题成为瓶颈之一。
在未来,随着科技的进步和研究的不断深入,催化氧化反应将会逐渐得到改进和优化。
新型的催化剂设计和制备技术的发展,以及反应条件的进一步优化,将提高催化氧化反应的效率和选择性。
同时,对于反应机理的深入研究也将为催化氧化领域的进展提供重要的理论基础。
常温常压催化氧化

常温常压催化氧化1、催化氧化催化氧化是一种新型高效的催化氧化技术,其原理就是在污水与催化剂表面接触的情况下,利用强氧化剂—二氧化氯在常温常压下催化氧化废水中的有机污染物,将大分子有机污染物氧化成小分子有机污染物,直至氧化成CO2,降低了污水的COD值,较好地去除了有机污染物。
在降解COD 的过程中,将有机物的双键打断,苯环类开环,发色基团随之脱离。
如硝基、氨基、偶氮基和磺酸基团等,从而达到脱色的目的。
同时也有效地提高了BOD/COD值,使之易于生物降解。
这用二氧化氯作氧化剂的催化氧化反应,打开了一些高浓度、高毒性、高色度、高含盐量废水在常规予处理后与生化处理之间的瓶颈,有些废水可直接催化氧化后达到排放标准。
2、催化氧化工艺的优点常温常压以CLO2为氧化剂的催化氧化工艺具有下列特点:催化氧化反应是在常温常压下进行,反应条件温和,设备易加工,投资低廉,操作也较稳定。
采用CLO2作氧化剂,氧化能力强,是氯的2.6倍,对有机物的降觧以生成含氧基团的小分子为主,不产生鹵代烃等二次污染物,氧化后污水无返色现象。
采用化学法现埸制备二氧化氯,制备简便,残液作碱性污水调节PH用,对投资和运行费用相对较低。
催化剂制备方法可靠,流失率低,使用寿命较长,无重金属污染。
催化氧化反应器效率高,工艺流程短小,占地面积少,对污水适应性强,既可以降解有机物,又可以处理含氰化物、硫化物、铁、锰等无机物。
3、氧化剂的性质(二氧化氯)二氧化氯氧化剂是一种黄绿色气体,具有氯相似的刺激气味,沸点为11℃,二氧化氯易溶于水,溶解度为氯的5倍,溶于水后随浓度的提高颜色由黄绿色变为橙红色。
与氯不同,二氧化氯在水中以纯粹的溶解气体存在,不易发生水解反应。
二氧化氯在空气中或水中,遇较高温度和光照下都会发生分解,放出氧。
二氧化氯具有较强的氧化能力,其氧化还原电位E0=-1.50V,在氧化过程中,正四价[CL]变成负一价[CL],有5个电子的转移,它的理论氧化能力是氯的2.63倍。
催化氧化

常温常压催化氧化1、催化氧化催化氧化是一种新型高效的催化氧化技术,其原理就是在污水与催化剂表面接触的情况下,利用强氧化剂—二氧化氯在常温常压下催化氧化废水中的有机污染物,将大分子有机污染物氧化成小分子有机污染物,直至氧化成CO2,降低了污水的COD值,较好地去除了有机污染物。
在降解COD 的过程中,将有机物的双键打断,苯环类开环,发色基团随之脱离。
如硝基、氨基、偶氮基和磺酸基团等,从而达到脱色的目的。
同时也有效地提高了BOD/COD值,使之易于生物降解。
这用二氧化氯作氧化剂的催化氧化反应,打开了一些高浓度、高毒性、高色度、高含盐量废水在常规予处理后与生化处理之间的瓶颈,有些废水可直接催化氧化后达到排放标准。
2、催化氧化工艺的优点常温常压以CLO2为氧化剂的催化氧化工艺具有下列特点:催化氧化反应是在常温常压下进行,反应条件温和,设备易加工,投资低廉,操作也较稳定。
采用CLO2作氧化剂,氧化能力强,是氯的2.6倍,对有机物的降觧以生成含氧基团的小分子为主,不产生鹵代烃等二次污染物,氧化后污水无返色现象。
采用化学法现埸制备二氧化氯,制备简便,残液作碱性污水调节PH用,对投资和运行费用相对较低。
催化剂制备方法可靠,流失率低,使用寿命较长,无重金属污染。
催化氧化反应器效率高,工艺流程短小,占地面积少,对污水适应性强,既可以降解有机物,又可以处理含氰化物、硫化物、铁、锰等无机物。
3、氧化剂的性质(二氧化氯)二氧化氯氧化剂是一种黄绿色气体,具有氯相似的刺激气味,沸点为11℃,二氧化氯易溶于水,溶解度为氯的5倍,溶于水后随浓度的提高颜色由黄绿色变为橙红色。
与氯不同,二氧化氯在水中以纯粹的溶解气体存在,不易发生水解反应。
二氧化氯在空气中或水中,遇较高温度和光照下都会发生分解,放出氧。
二氧化氯具有较强的氧化能力,其氧化还原电位E0=-1.50V,在氧化过程中,正四价[CL]变成负一价[CL],有5个电子的转移,它的理论氧化能力是氯的2.63倍。
co催化氧化

co催化氧化CO催化氧化是一种重要的化学反应过程,在工业生产和环境保护中具有广泛的应用。
在这篇文章中,我们将深入探讨CO催化氧化的原理、机制和应用,以及其在现代社会中的重要性。
让我们来了解一下CO催化氧化的基本原理。
CO催化氧化是指将一氧化碳(CO)与氧气(O₂)在催化剂的作用下转化为二氧化碳(CO₂)的化学反应过程。
这个过程通常涉及到一种叫做催化剂的物质,它能够降低反应的活化能,加快反应速率,从而实现CO的有效氧化。
常见的催化剂包括铜、铁、镍等金属,以及氧化物如氧化铝、氧化锌等。
在CO催化氧化的反应机制中,一氧化碳和氧气首先吸附到催化剂表面上形成中间态,然后通过一系列的表面扩散和反应步骤,最终转化为二氧化碳。
这个过程涉及到吸附、解离、扩散、表面反应等多个步骤,需要精密的催化剂设计和控制反应条件来实现高效转化。
CO催化氧化在工业生产中具有重要的应用价值。
一氧化碳是许多工业过程中的有害气体,如炼油、化工、钢铁等行业都会产生CO废气。
通过CO催化氧化反应,可以将有害的一氧化碳转化为无害的二氧化碳,达到净化废气、保护环境的目的。
此外,CO催化氧化还可以用于生产一氧化碳气体传感器、燃料电池等领域,具有广阔的市场前景和应用潜力。
除了工业应用外,CO催化氧化在环境保护和能源转化领域也具有重要意义。
随着全球气候变暖和环境污染日益严重,CO催化氧化技术可以帮助减少大气中的一氧化碳排放,改善空气质量,保护生态环境。
同时,将CO转化为CO₂还可以作为一种清洁能源的转化途径,为碳中和和可持续发展做出贡献。
总的来说,CO催化氧化是一种重要的化学反应过程,具有广泛的应用前景和社会意义。
通过深入研究其原理和机制,不断改进催化剂设计和反应条件,可以实现高效转化CO的目标,为环境保护和可持续发展做出贡献。
希望这篇文章能够增加对CO催化氧化的了解,激发更多人关注和研究这一重要领域,共同推动科技进步和社会发展。
催化氧化

工艺过程
原料加入氧化塔,通压缩空气。升温激发反应。反应 激发并放热。
通水降温,分水,稍冷,将物料放出。
加碱中和,冷却析晶。过滤,水洗,干燥,得产品。 对硝基苯甲酸钠溶液经酸化处理后,得副产物。
反应条件及影响因素
催化剂:采用乙酸锰和硬脂酸钴,要防止苯胺、酚类、
铁盐造成催化剂中毒。
反应温度:反应激发时需供给热能产生游离基。激发
缺点:①选择适宜的性能优良的催化剂比较困难;②反应
温度高,要求原料和氧化产物在反应条件下热稳定性好; ③传热效率低,反应热不易及时移出,需要强化传热。
二、气相催化氧化
反应过程:①反应物在催化剂表面扩散;②反应
物在催化剂表面吸附;③被吸附的反应物发生氧
化反应,并释放出热量;④氧化产物自催化剂表 面脱附; ⑤脱附的产物由催化剂表面扩散到流动 相并带走热量。
化学氧化剂众多,学会举一反三。
主要内容
概述
催化氧化与催化脱氢
化学氧化法
生物氧化法
概述
定义:狭义:加氧去氢。
广义:电子转移,使C上电子云降低。
分类:催化氧化、化学氧化、生物氧化 应用:将烯烃、醇、醛、酮、活性亚甲基化合物、芳烃
等氧化成相应的醇、环氧化物、醛、酮、酸等 化
100~200℃之间,反应压力也不太高。可用于高温下不 稳定的化合物。液相催化氧化具有较高的选择性,反 应可停留在中间阶段,常用于制备有机过氧化物、有 机酸,控制合适的条件可以制备醇、醛、酮等重要有
机合成中间体。
反应机理(自由基历程)
能量
链引发
R H R H
R
+
H
+
Mn+
催化氧化

乙醛氧化制醋酸,对二甲苯制对苯二甲酸
2. 连串氧化反应,目的产物是中间产物,获得高选 择性必须限制转化率。
环己烷氧化制环已酮(醇),转化率只能控制在10%左右
3. 有些目的产物(例如过氧化物)易分解,转化率要限制
氧化反应结果与反应器中物料的返混程度也有关:
动力学控制区
度 传质控制区 速 应 反
生产控制区
降低温度有利于氧 在溶液中的吸收
氧分压
反应控制在既有传质控制又有动力学控制的区域
当在反应器中动力学控制区和传质控制区并存时, 温度有波动,仍能使反应稳定进行
3.氧化气空速的影响
氧化气空速=
空气或氧气的流量,Nm3/h(标准状态) 反应器液体的滞留量,m3
一个原料多个产品 需在爆炸极限外反应
使反应朝着所要求的方向进行,关键是催化剂
第二节 均相催化氧化
均相催化氧化大多是气—液相氧化反应,气相 氧化因缺少合适的催化剂,且反应控制也较困 难,故工业上很少采用。
均相催化氧化的特点
催化剂活性较高、选择性较好 反应条件不太苛刻,反应比较平稳 设备简单,容积较小,生产能力较高 反应温度通常不太高,反应热利用率较低 在腐蚀性较强的体系时要采用特殊材质 催化剂多为贵金属,必须分离回收
氧气分压改变对反应的选择性有影响
反应温度不宜过高,会使反应选择性降低,低 碳原子副产物增多,尾气中二氧化碳含量增高, 甚至使反应失控,最终可能造成爆炸。
工业上进行液相自氧化反应,为了反应能稳定地进行,应 该保持足够高的反应温度,达样在氧浓度高的区域是动力 学控制,而在氧浓度低的区域就转为氧的传质控制。
※ 液相催化自氧化,反应往往是在气液相接触界面附近进行, 空速大,有利于气液相接触,能加速氧的吸收。
催化氧化

我国乙酸主要用途
醋酸质量标准[GB/T1628-2008]
第四章 催化氧化
13
二、生产方法
1.烃类[丁烷等] 液相氧化法; 2.甲醇羰基合成法; ★ 3.乙醛氧化法 A.乙醇-乙醛氧化法★ B.乙烯-乙醛氧化法★ C.乙炔-乙醛氧化法
第四章 催化氧化
14
三、乙酸生产规模
2005年全球醋酸产能约1018.8万t/a,产量787.4万t,世界 最大的生产商为美国Celanese(100万t/a)。 2005年我国醋酸产能200万t/a,产量为137万t。 2008年我国共有醋酸生产企业20多家,总产能约410万t, 产量171.8万t[其中甲醇羰基合成法7家占总产能74.4%; 乙烯乙醛法4家占11.1%;乙醇乙醛法11家占14.5%] ,已 成为继美国之后世界第二大生产国,但开工率为42%。 2008年我国乙酸主要生产厂. 2010年我国醋酸产能620万t/a,产量为384万t 。
近期价格:冰醋酸3500-4000元/ t;食用冰醋酸近7000.
第四章 催化氧化 15
四、乙醛氧化法
(一)生产原理[催化剂:醋酸锰]
主反应:CH3CHO+0.5O2→CH3COOH +346KJ/mol 副反应:
反应机理:自由基链锁反应
第四章 催化氧化 16
(二)乙醛氧化法工艺流程及主要设备
第四章 催化氧化 22
三、生产原理
1. 主反应:
C3H6+NH3+1.5O2→ CH2=CH-CN+3H2O +512.9KJ/mol 2. 副反应: C3H6+3NH3+3O2→ 3HCN+6H2O +Q 2C3H6+3NH3+3O2→ 3CH3CN+3H2O +Q C3H6+O2→ CH2=CH-CHO+H2O +Q C3H6+4.5O2→ 3CO2+3H2O +Q 3. 催化剂: 主-钼铋氧化物;助-磷铁钴镍钾氧化物
催化氧化_精品文档

催化氧化催化氧化是一种重要的化学反应过程,广泛应用于许多领域,包括有机合成、环境工程和能源转换等。
催化氧化反应通过催化剂的作用,促使氧气与底物之间发生氧化反应,从而产生目标产物。
首先,我们来了解一下催化氧化反应的基本原理。
催化氧化反应的起始步骤通常涉及氧气的吸附和激活。
在催化剂表面,氧气分子会发生吸附,使得氧气分子之间的键长和键角发生变化。
这些变化促进了氧气分子与底物之间的反应,进而在反应中形成键,产生氧化产物。
催化氧化反应中使用的催化剂种类繁多,常见的包括金属催化剂和生物催化剂等。
金属催化剂通常是过渡金属离子或金属氧化物,其优点在于反应活性高、催化剂的恢复性好。
生物催化剂则是指酶或细胞等生物体内部分,其优点在于高选择性和温和的反应条件。
催化氧化反应在有机合成中具有广泛的应用。
通过催化氧化反应,可以实现底物的选择性氧化,从而合成出具有特定官能团的化合物。
例如,在医药领域中,催化氧化反应常被用于合成药物前体,从而提高药物的活性和选择性。
此外,催化氧化反应还在精细化工和材料科学中有着重要的应用,用于合成涂料、染料和高分子材料等。
环境工程中的催化氧化反应主要用于废水和废气的处理。
催化氧化反应可以将有机废物氧化为无害的物质,减少污染物的排放。
其中,常用的催化剂包括负载型催化剂和贵金属催化剂等。
负载型催化剂是将活性组分负载到惰性或活性载体上的催化剂,其优点在于催化剂的重复使用性好和成本较低。
贵金属催化剂具有较高的催化活性和选择性,但成本较高。
能源转换领域中,催化氧化反应被广泛用于燃料电池和化学反应器中。
在燃料电池中,催化氧化反应用于将氢气或氢氧离子氧化成水,从而产生电能。
在化学反应器中,催化氧化反应被应用于有机物的氧化,从而提供产热和产气的能量。
总的来说,催化氧化是一种重要的化学反应过程,广泛应用于有机合成、环境工程和能源转换等领域。
通过合理设计和选择催化剂,可以提高反应效率、选择性和产物质量,并减少能源消耗和环境污染。
催化剂氧化态和还原态

催化剂氧化态和还原态催化剂(Catalyst)是指能够增加反应速率的物质或条件。
在化学反应中,催化剂可以加速反应的过程,减少反应所需要的能量。
催化剂“氧化-还原”(Oxidation-Reduction)是一种特殊类型的催化反应。
这类反应中,一种物质从还原态转化为氧化态,而另一种物质则从氧化态转变为还原态,从而促进化学反应平衡的建立和稳定。
催化剂的氧化态和还原态是氧化还原反应(Oxidation-Reduction reaction)的关键。
当催化剂处于还原态,它会把一种元素从氧化态转化为还原态,从而增加反应的速率。
同样的,当催化剂处于氧化态时,它会把一种元素从还原态转化为氧化态,从而减少反应速率。
因此,催化剂的氧化态和还原态是氧化还原反应的影响因素。
在非催化状态下,氧化还原反应的速率可能很低。
考虑到这一点,催化剂被引入到氧化还原反应中,以加速整个反应,而不会改变反应物的性质或有任何副作用。
催化剂可以被某种物质衡量,并在两个不完全相同的反应过程中,可以明显减少反应的活化能。
催化剂的氧化还原态又称为离子态或发生态,指的是一种物质在化学反应发生之前被处理后的状态,其发生有助于催化反应的加速。
催化剂的氧化态和还原态在催化反应中扮演着至关重要的角色。
催化剂的氧化态和还原态,既可以促进整个催化反应,又可以控制整个反应的速率。
此外,催化剂氧化态和还原态还能够影响反应物的性质,以及反应最终结果的可得性。
催化剂氧化态和还原态的变化,将有助于解决各种环境和其他污染问题,比如对室内空气的污染物的成分进行识别和清除。
此外,催化剂氧化态和还原态变化也可用于合成新的材料和有机物,以满足工业和农业应用的高要求。
总而言之,催化剂氧化态和还原态变化可以显著提高全球环境和生态系统的各种应用,改善地球上各种资源的利用效率。
因此,催化剂的氧化态和还原态变化成为研究者面临的另一个重要课题,以指导先进的化学反应技术的发展,从而达到环境应用的更积极的目的。
催化氧化生成醛的条件

催化氧化生成醛的条件醛是一类重要的有机化合物,广泛应用于化工、医药、食品等领域。
催化氧化反应是制备醛的一种常用方法,通过合适的催化剂和反应条件,可以将醇、醚等有机物氧化生成醛。
本文将探讨催化氧化生成醛的条件。
1. 催化剂的选择在催化氧化反应中,选择合适的催化剂对于产醛反应的效率和选择性至关重要。
常见的催化剂有金属催化剂和非金属催化剂。
金属催化剂如铜、银、铂等具有良好的催化活性,可以在较低的温度下催化氧化反应。
非金属催化剂如过渡金属氧化物、稀土氧化物等也具有较高的催化活性,可以选择适合的催化剂来催化氧化生成醛。
2. 反应温度反应温度是催化氧化反应的一个重要参数。
一般来说,较高的反应温度有利于提高反应速率,但过高的温度可能导致副反应的发生,降低产醛的选择性。
因此,在选择反应温度时需要平衡反应速率和产醛选择性,找到合适的反应温度。
3. 氧气浓度氧气是催化氧化反应中的氧化剂,反应中适当的氧气浓度对于反应的进行至关重要。
较高的氧气浓度可以提高氧化剂的供应速率,促进反应的进行。
但过高的氧气浓度可能导致过氧化副产物的生成,降低产醛的选择性。
因此,在反应中需要控制适当的氧气浓度,以达到理想的反应效果。
4. 反应时间反应时间是催化氧化反应中的另一个重要参数。
反应时间过短可能导致反应不完全,产物得率低;反应时间过长可能导致副反应的发生,降低产醛的选择性。
因此,在反应中需要控制适当的反应时间,以保证产醛的得率和选择性。
5. 反应溶剂反应溶剂在催化氧化反应中起到溶解反应物和催化剂的作用,影响反应的进行。
一般来说,极性溶剂对于催化氧化反应的进行有利,可以提高反应速率和选择性。
常用的反应溶剂有水、醇、酮等。
在选择反应溶剂时需要考虑反应物的溶解度和催化剂的稳定性,找到适合的反应溶剂。
通过合适的催化剂选择、控制反应温度、氧气浓度、反应时间和反应溶剂等条件,可以实现催化氧化生成醛的反应。
催化氧化反应是一种高效、环保的合成方法,具有重要的应用价值。
催化氧化反应的条件

催化氧化反应的条件
催化氧化是一种催化反应,它可以把有机物分解成无机物。
它可以消耗污染物,然后释放出安全的产物,因此被广泛应用于废水处理中。
要实现催化氧化反应,必须满足几种条件才能够达到最优效果。
首先,要实现催化氧化反应,需要一定的温度。
这种反应的温度最低可以降至零下10度,最高约为70-90度,尽管不同的反应需要的温度也有所不同,但一定要保持温度均衡,否
则会影响反应速率。
其次,还需要一定的pH值,不同的污染物需要不同的pH。
有些污染物在酸性环境中容易污染,有些污染物则在碱性环境中容易氧化。
因此,催化氧化反应一般都设置在中性环境,以保持最佳的吸收效果。
最后,还需要一种催化剂。
这种物质可以加速化学反应的速度,所以它是不可缺少的。
各种污染物催化反应的催化剂也不同,需要根据具体情况选择适当的催化剂。
总之,要想实现催化氧化反应,最重要的是温度、pH值和催化剂的调节,只有满足这些
条件才能达到最优效果,为环境提供清洁能源。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
邻氨基苯甲醚废水
对氨基苯乙醚废水
2002 Vol. 18
中国给水排水
No. 4
催化氧化反应, 在稳定、 高效降 解有机物的同 时使 BOD 5 COD 由 0. 154 提高到 0. 359, 大大有利于后 续生化处理。催化氧化出水进入水质调整池, 与地 面冲洗水以 1 &4 混匀 , 其含盐量降至 15 000 mg L
4 3 4 3
资额 : 1 723. 97 万元 。 两个污水厂的处理工艺均为水解+ A O, 设计单位 : 北京中联环工程股份有限公司。 目前该工程已完成初步设计。 ( 山东省淄博市临淄区城建水厂 崔福花 供稿)
# 72 #
以下 , 达到生化处理要求后则进入接触氧化池进行 处理, 出水经二沉池排放, 污泥全部回流。 经监测 , 整个系统处理效果见表 6, 催化氧化装 置的处理效果见表 7。
色度 ( 倍) 10 000 50 10 000 50 80 去除率 ( %) 99. 5 99. 5 SS ( mg L ) 5 000 50 4 900 40 80 去除率 ( %) 99. 0 99. 2 挥发酚 ( mg L ) 90 0. 3 95 40. 2 0. 5 去除率 ( %) 99. 7 99. 8
图 1 试验工艺流程
∀
工业废水
1 2 2 试验结果 模拟废水 控制各种模拟 废水的 pH = 5~ 7, 加入 10% 的 ClO2 水溶液, 室温下催化反应 15 min 后结果见表 1。
当废水 pH = 5~ 7 、 加入 10% 的 ClO2 水溶液, 反应时间为 15 min 时 , 对无机类废水的 COD 去除 率 > 90% , 对有机类废水的 COD 去除率为 70% ~ 90% , 试验结果分别见表 3、 4。
基金项目 : 浙江省科技计划项目 ( 99- 1- 063)
# 70 #
2002 Vol. 18
表 2 比较试验结果 有 机成分 乙醇 苯酚 苯胺 硝基苯 三 乙醇胺 甲醛 处理方法 单独氧化 催化氧化 单独氧化 催化氧化 单独氧化 催化氧化 单独氧化 催化氧化 单独氧化 催化氧化 单独氧化 催化氧化 表3 类 别
对有机类废水处理结果 进水浓度 ( mg L ) 13 000 12 800 13 100 10 800 9 900 10 600 8 200 8 600 9 000 18 000 18 200 18 500 35 34 35 23 23 23 42 41 41 40 40 41 000 700 200 000 200 250 000 800 900 000 500 000 出水浓度 ( mg L ) 3 280 3 170 3 306 2 800 2 500 2 470 1 600 1 580 1 670 5 210 5 220 5 250 5 5 5 4 4 4 4 4 4 5 5 5 200 110 210 680 700 710 400 380 385 000 100 130 去除率 ( %) 74. 8 75. 2 74. 8 74. 1 74. 9 76. 7 80. 5 81. 6 81. 4 71. 1 71. 3 71. 6 85. 1 85. 3 85. 2 79. 7 79. 7 79. 7 89. 5 89. 5 89. 5 87. 5 87. 4 87. 5
中国给水排水 2002 Vol. 18 CH INA WAT ER & WAST EWAT ER No. 4
ClO 2 催化氧化处理高浓度有机化工废水
徐锡彪, 褚宏伟
( 嘉兴市大禹环境工程有限公司, 浙江 嘉兴 314000)
摘 要: 排放 。 关键词 : 有机化工废水 ; 催化氧化; ClO 2 文章编号: 1000- 4602( 2002) 04- 0070- 03
表1 模拟废水处理结果 出水浓度 ( mg L) 去除率 ( %) 43 94. 5 54 52 95 116 120 110 69 86 68 94. 2 93. 7 90. 6 90. 4 88. 9 82. 3 94. 9 89. 5 91. 9
以 ClO2 为氧化剂, 在自制催化剂存在的条件下可将高浓度有机化工废水中的有机 70% , 对色度的去除率 95% , 若再后接生化处理可使出水达标
2 2 工程概况 浙江省嘉兴市中 华化工集团以生产香兰素为 主 , 废水量为 120 m d, 工程占地为 1 000 m , 投资 为 500 万元。废水水质见表 5, 工艺流程见图 3 。
表5 pH 6. 0 或 7. 0 废水水质 色度 ( 倍) 10 000 挥发酚 ( mg L ) 100 BOD 5 ( mg L ) 5 000 COD SS ( mg L) ( mg L ) 60 000 5 000
系统处理结果
GB 8978 ∋ 1996 的医药 原料药行业二级标准
催化氧化处理效果 去除率 (%) 64. 0 65. 4 [ 1] [ 2] [ 3] BOD 5 COD 0. 150 0. 358 0. 158 0. 360 色度 ( 倍) 8 000 300 8 000 300 去除率 ( %) 96. 2 96. 2 挥发酚 ( mg L ) 85 0. 5 90 0. 5 去除率 (%) 99. 4 99. 4
催化氧化反应器采用塔式结构, 尺寸为
1 800
mm ∃ 5 000 mm, 塔内装填颗粒状催化剂, 从塔底进 水、 进气, 塔上部出水。在常温、 常压下废水在催化 剂的表面与 ClO 2 水溶液和空气发生三相反应, 其处 理水量 为 2 m h, 进水 COD % 5 ∃ 10 mg L, 对
3 4
含亚硝酸钠 废水 ( COD ) 含硫废水 ( COD ) 含氰电镀废水 ( CN - ) 表4 类 别
COD 去 除率
70% 。 ClO2 发生 器用于 现场 制备
ClO 2 , 尺寸为 500 mm ∃ 1 300 mm ∃ 1 500 mm 。机 械过滤器是催化氧化塔的保护装置, 主要是为了防 止过多悬浮物进入催化氧化塔, 其尺寸为 ∃ 2 500 mm 。 600 m m
物氧化分解 , 对 COD 的去除率
中图分类号 : X703. 1
文献标识码: C
方法及结果 1 试验原理、
1 1 原理 在高效表面催化剂存在的条件下, 利用 ClO 2 在 常温、 常压下氧 化降解高 浓度污 染物 ( COD ) 的 目 的, 与此同时通过打断有机分子中的双键发色团( 如 偶氮基、 硝基、 硫化羰基、 碳亚氨基等) 来实现彻底脱 色, 同时有效提高 BOD 5 COD 值。 1 2 试验方法及结果 试验流程见图 1。 1 2 1 试验方法
E- mail : dayu@ mail. jxpH. zj. cn 收稿日期 : 2001- 09- 21
# 工程信息 #
山东省淄博市临淄区污水处理工程
该工程处理规模 : 5 ∃ 10 m d( 包括齐都、 淄河污水处理厂 ) , 其中齐都污水处理厂处理规模: 3 ∃ 10 m d, 2 4 3 2 占地面积 : 2. 3 hm , 投资额 : 2 819. 58 万元; 淄河污水处理厂处理规模: 2 ∃ 10 m d, 占地面积: 1. 6 hm , 投
3 结语 高浓度有机化工废水一般色度高、 有机成分难 以降解, 其 BOD 5 COD 值很低, 故实际工程中直接 采用生化处理效果不好。利用新型催化氧化装置、 强氧化剂配以高效的表面催化剂对废水进行强烈的 化学氧化则出水色度基本 达标, 同时可使 COD 值 及 B OD 5 COD 值都适合生化处理 , 从而在常规的物 化处理和生化处理之间架设了一座桥梁。 参考文献 :
张嘉义 , 祝万鹏 . 臭 氧水处理技术的进展 [ J] . 环境科 学 进展 , 1995, 3( 6) : 18- 24. 魏宏斌 , 李田筹 . 水 中有机污染物的光催 化氧化 [ J] . 环 境科学进 展 , 1994, 2( 3) : 50- 57. 李家珍 . 染料、 染色工业废水处理 [ M ] . 北京 : 化学工 业 出版社 , 1997. 电话 : ( 0573) 2215460 2218312
2 1 催化氧化装置 催化氧化装置由催化氧化反应器、 ClO2 发生器 和机械过滤器组成 ( 见图 2) 。
图 2 工艺流程图
对无机类废水处理结果 进水浓度 ( mg L ) 2 100 1 800 1 900 600 580 710 90 120 80 出水浓度 ( mg L) 32 10 15 64 62 74 检不出 去除率 ( %) 98. 5 99. 4 99. 2 89. 3 89. 3 89. 6 100
有机成分 进水浓度 ( mg L) 甲醇 780 乙醇 三乙胺 三乙醇胺 吡啶 苯胺 硝基苯 苯酚 对苯二酚 丙酮 930 820 1 010 1 210 1 080 620 1 366 820 842
由表 1 可知, 对单一污染物的去除率为 80% ~ 95% 。 ! 比较试验 控制各种模拟废水的 pH = 5~ 7, 加入 10% 的 ClO 2 水溶液分别进行催化氧化和单独氧化, 试验结 果见表 2。 由表 2 可知 , 在催化剂存在下的 COD 去除率 高且反应时间短。
