水蒸气压
饱和水蒸汽压

饱和水蒸汽压Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT饱和蒸汽压饱和蒸汽压:蒸汽压指的是在液体(或者固体)的表面存在着该物质的蒸汽,这些蒸汽对液体表面产生的压强就是该液体的蒸汽压。
比如,水的表面就有水蒸汽压,当水的蒸汽压达到水面上的气体总压的时候,水就沸腾。
我们通常看到水烧开,就是在100摄氏度时水的蒸汽压等于一个大气压。
蒸汽压随温度变化而变化,温度越高,蒸汽压越大。
当然还和液体种类有关在一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸汽所产生的压强叫饱和蒸汽压,它随温度升高而增加。
如:放在杯子里的水,会因不断蒸发变得愈来愈少。
如果把纯水放在一个密闭的容器里,并抽走上方的空气。
当水不断蒸发时,水面上方汽相的压力,即水的蒸汽所具有的压力就不断增加。
但是,当温度一定时,汽相压力最终将稳定在一个固定的数值上,这时的汽相压力称为水在该温度下的饱和蒸汽压力。
当汽相压力的数值达到饱和蒸汽压力的数值时,液相的水分子仍然不断地气化,汽相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸汽的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。
所以,液态纯物质蒸汽所具有的压力为其饱和蒸汽压力时,汽液两相即达到了相平衡。
饱和蒸汽压是物质的一个重要性质,它的大小取决于物质的本性和温度。
饱和蒸汽压越大,表示该物质越容易挥发。
饱和水气压:定量空气中所能容纳的水气有一定的限度,当空气中的水气量达到此一限度,我们就说此空气已经达到饱和,而空气所能容纳的最大水气量就称为饱和水气量。
通常我们会以水气压来代表水气含量的多寡。
空气的饱和水气压会随着气温而改变;一般来说,气温愈高时,空气的饱和水气压愈大,反之,空气温度愈低则愈容易达到饱和。
空气中水气所产生的压力,称为水气压,有时也把水气压叫做绝对湿度。
水气压取决于空气中的水气含量,当空气中水气含量增多时,水气压就相应增大。
水的饱和蒸汽压与温度对应表

水的饱和蒸汽压与温度对应表蒸气压蒸气压指的是在液体(或者固体)的表面存在着该物质的蒸气,这些蒸气对液体表面产生的压强就是该液体的蒸气压。
比如,水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。
我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。
蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。
一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。
如:放在杯子里的水,会因不断蒸发变得愈来愈少。
如果把纯水放在一个密闭的容器里,并抽走上方的空气。
当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。
但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。
当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。
所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。
饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。
饱和蒸气压越大,表示该物质越容易挥发。
当气液或气固两相平衡时,气相中A物质的气压,就为液相或固相中A物质的饱和蒸气压,简称蒸气压。
下面为影响因素:1.对于放在真空容器中的液体,由于蒸发,液体分子不断进入气相,使气相压力变大,当两相平衡时气相压强就为该液体饱和蒸汽压,其也等于液相的外压;温度升高,液体分子能量更高,更易脱离液体的束缚进入气相,使饱和蒸气压变大。
2.但是一般液体都暴露在空气中,液相外压=蒸气压力+空气压力=101.325KPa),并假设空气不溶于这种液体,一般情况由于外压的增加,蒸气压变大(不过影响比较小)3.一般讨论的蒸气压都为大量液体的蒸气压,但是当液体变为很小的液滴是,且液滴尺寸越小,由于表面张力而产生附加压力越大,而使蒸气压变高(这也是形成过热液体,过饱和溶液等亚稳态体系的原因)。
实际水汽压和饱和水汽压的关系

实际水汽压和饱和水汽压的关系实际水汽压与饱和水汽压的关系水汽压是指在一定温度下空气中所含有的水蒸气的压强。
而饱和水汽压则是指在一定温度下,空气中所含有的水蒸气达到饱和状态时的压强。
实际水汽压与饱和水汽压之间存在着密切的关系。
当空气中的水蒸气含量一定时,随着温度的升高,空气中的水蒸气分子运动速度加快,相互之间的碰撞频率增加,导致水蒸气分子从液态转变为气态的速率增加。
这就会使空气中的水蒸气分子的密度增加,从而增加了实际水汽压。
而饱和水汽压则是指在一定温度下,空气中所含有的水蒸气达到饱和状态时的压强。
当空气中的水蒸气含量达到饱和状态时,水蒸气分子从液态转变为气态的速率与从气态转变为液态的速率达到动态平衡。
这时,饱和水汽压达到最大值。
可以看出,实际水汽压与饱和水汽压之间存在一个平衡状态。
当实际水汽压小于饱和水汽压时,空气中的水蒸气会继续从液态转变为气态,直到实际水汽压等于饱和水汽压为止。
而当实际水汽压大于饱和水汽压时,空气中的水蒸气会开始从气态转变为液态,直到实际水汽压等于饱和水汽压为止。
实际水汽压与饱和水汽压的关系可以用公式来表示,但为了避免使用数学公式,我们可以用简单的语言来描述。
实际水汽压与饱和水汽压之间的差异取决于温度的变化。
随着温度的升高,实际水汽压逐渐接近饱和水汽压,而随着温度的降低,实际水汽压则逐渐远离饱和水汽压。
总结起来,实际水汽压与饱和水汽压之间存在着平衡状态。
实际水汽压受到温度的影响,随着温度的变化而变化。
当实际水汽压小于饱和水汽压时,空气中的水蒸气将继续从液态转变为气态。
而当实际水汽压大于饱和水汽压时,空气中的水蒸气将开始从气态转变为液态。
这一过程使得实际水汽压趋近于饱和水汽压,保持了自然界中水蒸气的平衡状态。
蒸气压计算

蒸气压计算你是否有过这样的经验:将一瓶水放到烈日下暴晒几小时,然后打开瓶盖时会听到很小的“嘶嘶”声?这是所谓的“蒸气压”原理导致的。
在化学中,蒸气压是密封容器中的物质蒸发时,也就是转化为气体时对容器壁施加的压力。
[1]要计算特定温度下的蒸气压,需要使用克劳修斯-克拉珀龙方程:ln(P1/P2) = (ΔH vap/R)((1/T2) - (1/T1))。
你也可以使用拉乌尔定律来计算蒸气压:P溶液=P溶剂X溶剂。
使用克劳修斯-克拉珀龙方程写出克劳修斯-克拉珀龙方程。
根据蒸气压随时间的变化率来计算蒸气压的公式被称为克劳修斯-克拉珀龙方程,它以物理学家鲁道夫•克劳修斯和伯诺瓦•保罗常使用的就是这一公式。
公式写作:ln(P1/P2) = (ΔH vap/R)((1/T2) -(1/T1))。
其中,各变量的含义如下:ΔH vap:液体的汽化焓。
这个值通常可以在化学课本后的表格中查到。
R:理想气体常数,即8.314 J/(K × Mol)。
T1:蒸气压已知时的温度,或起始温度。
T2:求蒸气压时的温度,或最终温度。
P1和P2:温度为T1和T2时的蒸气压。
2将已知值代入公式中。
由于克劳修斯-克拉珀龙方程有很多不同的变量,所以看上去有些复杂,但掌握了正确的信息后,方程其实并不难。
最基础的蒸气压问题会给出两个温度值和一个压力值,或给出两个压力值和一个温度值。
有了这些已知条件后,解题就很简单了。
例如,假设题目告诉我们,温度为295 K时,装满液体的容器的蒸气压为1个标准大气压(atm)。
题目问:“温度为393 K时,蒸气压等于多少?”我们已知两个温度值和一个压力值,所以可以使用克劳修斯-克拉珀龙方程来求出另一个压力值。
将已知值代入变量中,得到ln(1/P2) = (ΔH vap/R)((1/393) - (1/295))。
注意,克劳修斯-克拉珀龙方程必须使用开尔文温度值。
而压力值可以使用任意单位,只要P1和P2保持统一即可。
水在不同温度下的饱和蒸汽压

水在不同温度下的饱和蒸汽压蒸发是液体向气体的过渡过程。
当液体受热升温,其中的分子获得足够的能量以克服表面张力和吸附力,脱离液体表面向空气中扩散,形成气体分子,从而促进液体的蒸发。
在一定压力下,液体和气体之间处于动态的平衡状态,液体蒸发速度等于气体凝聚速度,称为饱和状态。
饱和状态下的水蒸气压叫做饱和蒸汽压,它与液体的温度有关,温度越高,饱和蒸汽压越大。
水在不同温度下的饱和蒸汽压具有一定的规律。
以下是水在不同温度下的饱和蒸汽压数据。
温度(℃) 饱和蒸汽压(Pa)0 611.735 871.9910 1233.6015 1705.6520 2337.3725 3165.4630 4238.0935 5606.1440 7333.2845 9510.9650 12233.5655 15611.0360 19710.1465 24520.4570 30130.4575 36643.0580 44170.2685 52839.4490 62781.0395 74136.69100 87036.10从上面的数据可以看出,随着温度的升高,水的饱和蒸汽压也逐渐增大。
这是因为,随着液体温度的升高,其中分子的动能增加,导致分子脱离液体表面的能力增强,使得蒸发速度增大,气体压强也因此增大。
同时,饱和蒸汽压的变化与大气压力有关。
大气压力越大,液体就需要更大的能量才能使其中的分子脱离表面,因此,液体到饱和状态所需要的能量也相应增大,导致饱和蒸汽压变小。
这也解释了为什么在高海拔地区,由于大气压力较小,液体的蒸发速度增大,水的沸点降低。
总之,了解水在不同温度下的饱和蒸汽压对于工业和日常生活中液体蒸发和气体凝结现象的了解有很大帮助。
同时,也是控制环境湿度、水汽压等物理参数的重要依据。
饱和水蒸气压的简称

饱和水蒸气压的简称
饱和水蒸气压(Saturated Water Vapor Pressure)是指水蒸
气在恒定温度下混合在气体中的平衡状态下的压力。
这种压力随着气温的变化而变化,是气温的一个重要参数,可以用来衡量空气湿度。
水蒸气的压力的变化受到温度的影响,这是由物理学家理查德·洛伊·乔伊斯在1873年提出的“乔伊斯-洛伊-韦伯定律”表
明的。
该定律指出,气温和每立方米气体中水蒸气的压力之间有一定的关系。
它提出了一个公式,用于计算不同温度下水蒸气的压力,即:P=6.11·e^((aT)/(b+T))。
其中,P表示水蒸气压力,T表示气温(以摄氏度为单位),a和b是常数,分别为17.67和243.5。
水蒸气压力的变化不仅受温度的影响,也受到湿度的影响,湿度越高,水蒸气压力就越高。
当水蒸气压力达到饱和时,就是湿度达到100%的状态,也就是湿度达到最大,水蒸气压力
也达到最大,此时的水蒸气压力就是饱和水蒸气压力。
饱和水蒸气压力是空气湿度的参照标准,可以用来衡量空气湿度。
它也可以用来估算气温下的空气湿度,从而判断气温下的空气湿度是否正常。
饱和水蒸气压力是空气湿度的重要参数,也是气温的一个重要参数。
它可以用来衡量空气湿度,也可以用来衡量气温。
因此,它是大气科学和气象学研究中不可或缺的重要指标。
饱和蒸汽压力与温度对照表

下的水蒸气压力。
饱和水蒸气压力数值与饱和温度相关,当温度上升时,对应的饱和水蒸气压力随之上升。
饱和水蒸气压力基本信息
定义
饱和水蒸气压力,又称饱和蒸汽压,指密闭条件下水的气相与液相达到平衡即饱和状态下的水蒸气压力。
该压力数值与对应的温度有关。
原理
当液体在有限的密闭空间中蒸发时,液体分子通过液面进入上面空间,成为蒸汽分子。
由于蒸汽分子处于紊乱的热运动之中,它们相互碰撞,并和容器壁以及液面发生碰撞,在和液面碰撞时,有的分子则被液体分子所吸引,而重新返回液体中成为液体分子。
开始蒸发时,进入空间的分子数目多于返回液体中分子的数目,随着蒸发的继续进行,空间蒸汽分子的密度不断增大,因而返回液体中的分子数目也增多。
当单位时间内进入空间的分子数目与返回液体中的分子数目相等时,则蒸发与凝结处于动平衡状态,这时虽然蒸发和凝结仍在进行,但空间中蒸汽分子的密度不再增大,此时的状态称为饱和状态。
在饱和状态下的液体称为饱和液体,其对应的蒸汽是饱和蒸汽。
饱和水蒸气压力与温度的关系
下的水蒸气压力。
饱和水蒸气压力数值与饱和温度相关,当温度上升时,对应的饱和水蒸气压力随之上升。
蒸汽压力与温度对照表
注:加热室温度差=壳层压力(真空度)相应温度-加热室料液温度。
过热度=蒸汽温度-饱和蒸汽压力相应温度。
水在不同温度下的饱和蒸气压
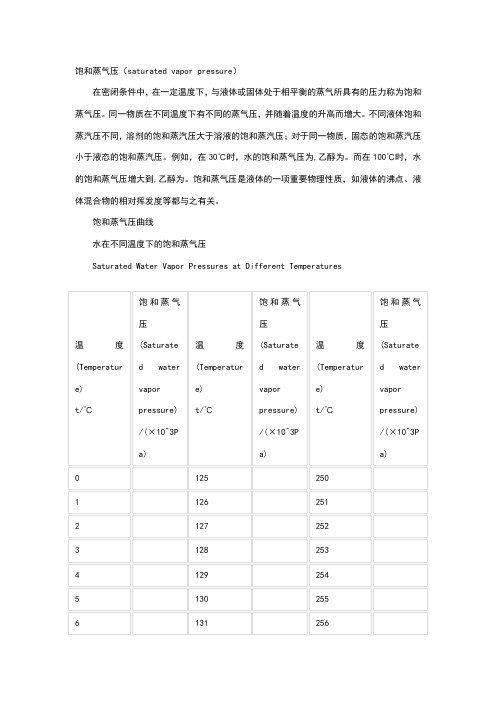
饱和蒸气压(saturated vapor pressure)在密闭条件中,在一定温度下,与液体或固体处于相平衡的蒸气所具有的压力称为饱和蒸气压。
同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。
不同液体饱和蒸汽压不同,溶剂的饱和蒸汽压大于溶液的饱和蒸汽压;对于同一物质,固态的饱和蒸汽压小于液态的饱和蒸汽压。
例如,在30℃时,水的饱和蒸气压为,乙醇为。
而在100℃时,水的饱和蒸气压增大到,乙醇为。
饱和蒸气压是液体的一项重要物理性质,如液体的沸点、液体混合物的相对挥发度等都与之有关。
饱和蒸气压曲线水在不同温度下的饱和蒸气压Saturated Water Vapor Pressures at Different Temperatures编辑本段饱和蒸汽压公式(1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v))式中p为蒸汽压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。
该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。
(2)Clapeyron 方程:若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron方程:ln p=A-B/T式中B=H(v)/(R*Z(v))。
(3)Antoine方程:ln p=A-B/(T+C)式中,A,B,C为Antoine常数,可查数据表。
Antoine方程是对Clausius-Clapeyron 方程最简单的改进,在~范围内误差小。
编辑本段附录在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。
其公式如下lgP=A-B/(t+C) (1)式中:P—物质的蒸气压,毫米汞柱;t—温度,℃公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算lgP=T+C (2)式中:P—物质的蒸气压,毫米汞柱;表1 不同物质的蒸气压名称分子式范围(℃) A B C银 Ag 1650~1950 公式(2) 250氯化银 AgCl 1255~1442 公式(2)三氯化铝 AlCl3 70~190 公式(2) 115氧化铝 Al2O3 1840~2200 公式(2) 540砷 As 440~815 公式(2) 133砷 As 800~860 公式(2)三氧化二砷 As2O3 100~310 公式(2)三氧化二砷 As2O3 315~490 公式(2)氩 Ar ~ 公式(2)金 Au 2315~2500 公式(2) 385三氯化硼BCl3 ……钡 Ba 930~1130 公式(2) 350铋 Bi 1210~1420 公式(2) 200溴Br2 ……碳 C 3880~4430 公式(2) 540二氧化碳CO2 ……二硫化碳 CS2 -10~+160一氧化碳 CO -210~-160四氯化碳 CCl4 ……钙 Ca 500~700 公式(2) 195钙 960~1100 公式(2) 370镉 Cd 150~ 公式(2) 109镉 500~840 公式(2)氯Cl2 (240)二氧化氯 ClO2 -59~+11 公式(2)钴 Co 2374 公式(2) 309铯 Cs 200~230 公式(2)铜 Cu 2100~2310 公式(2) 468氯化亚铜 Cu2Cl2 878~1369 公式(2)铁 Fe 2220~2450 公式(2) 309氯化亚铁 FeCl2 700~930 公式(2)氢 H2 ~-248氟化氢 HF -55~+105氯化氢 HCl -127~-60溴化氢 HBr -120~-87① 270 溴化氢 -120~-60 250碘化氢 HI -97~-51 公式(2)碘化氢 -50~-34 公式(2)氰化氢 HCN -85~-40氰化氢 -40~+70过氧化氢 H2O2 10~90 公式(2)水② H2O 0~60水③ 60~150硒化氢 H2Se 66~-26 公式(2)硫化氢 H2S -110~83 公式(2)碲化氢 H2Te -46~0 公式(2)氦He (290)汞 Hg 100~200汞 200~300汞 300~400汞 400~800氯化汞 HgCl2 60~130 公式(2)氯化汞 130~270 公式(2)氯化汞 HgCl2 275~309 公式(2)氯化亚汞Hg2Cl2 …碘I2 …钾 K 260~760 公式(2)氟化钾 KF 1278~1500 公式(2)氯化钾 KCl 690~1105 公式(2)氯化钾 1116~1418 公式(2)溴化钾 KBr 906~1063 公式(2)溴化钾 1095~1375 公式(2)碘化钾 KI 843~1028 公式(2)碘化钾 1063~1333 公式(2)氢氧化钾 KOH 1170~1327 公式(2) 136 氪 Kr ~-169 公式(2)氟化锂 LiF 1398~1666 公式(2)镁 Mg 900~1070 公式(2) 260锰 Mn 1510~1900 公式(2) 267钼 Mo 1800~2240 公式(2) 680氮 N2 -210~-180一氧化氮 NO -200~161 公式(2)一氧化氮 ~148 公式(2)三氧化二氮 N2O3 -25~0 公式(2)四氧化二氮 N2O4 -100~-40 公式(2)四氧化二氮 -40~-10 公式(2)五氧化二氮 N2O5 -30~+30 公式(2)氯化亚硝酰 NOCl ~ 公式(2)肼 N2H4 -10~+39肼 39~250钠 Na 180~883 公式(2)氯化钠 NaF 1562~1701 公式(2)氯化钠 NaCl 976~1155 公式(2)氯化钠 1562~1430 公式(2)溴化钠 NaBr 1138~1394 公式(2)碘化钠 NaI 1063~1307 公式(2)氢氧化钠 NaOH 1010~1402 公式(2) 132 氖Ne ……镍 Ni 2360 公式(2) 309四羰基镍 Ni(CO) 4 2~40 公式(2)氧 O2 -210~-160臭氧O3 ……磷(白磷) P 20~ 公式(2)磷(紫磷) P 380~590 公式(2)磷化氢PH3 ……铅 Pb 525~1325 公式(2)氯化铅 PbCl2 500~950 公式(2)铂 Pt 1425~1765 公式(2) 486铷 Rb 250~370 公式(2) 76氡Rn (250)硫S ……二氧化硫SO2 ……三氧化硫 SO3 24~48 公式(2)锑 Sb 1070~1325 公式(2) 189三氯化锑 SbCl3 170~253 公式(2)硒Se ……二氧化硒SeO2 ……硅 Si 1200~1320 公式(2) 170四氯化硅 SiCl4 -70~+5 公式(2)甲硅烷 SiH4 -160~112 公式(2)二氧化硅 SiO2 1860~2230 公式(2) 506 锡 Sn 1950~2270 公式(2) 328锶 Sr 940~1140 公式(2) 360铊 Tl 950~1200 公式(2) 120钨 W 2230~2770 公式(2) 897氙Ke (260)锌 Zn 250~ 公式(2) 133甲烷 XH4 固体③甲烷液体氯甲烷 CH3Cl -47~-10 公式(2)三氯甲烷 CHCl3 -30~+150二苯基甲烷 C13H12 217~283 公式(2)氯溴甲烷 CH2ClBr -10~+155硝基甲烷 CH3O2N 47~100 公式(2)乙烷C2HS ……氯乙烷 C2H5Cl 65~+70 230溴乙烷 C2H5Br -50~+130均二氯乙烷C2H4Cl2 ……均二溴乙烷C2H4Br2 ……环氧乙烷 C2H4O -70~+100偏二氯乙烷 C2H2Cl2 0~30 公式(2)1,1,2一三氯乙烷C2H3Cl3 ……丙烷C3H8 ……正氯丙烷 C3H7Cl 0~50 公式(2)环氧丙烷(1,2) C3H6O -35~+130 232 正丁烷C4H10 ……异丁烷C4H10 ……正戊烷C5H12 ……异戊烷C5H12 ……环戊烷C5H10 ……正己烷C6H14 ……环已烷④ C6H12 -50~200正庚烷C7H16 ……正辛烷 C8H18 -20~+40正辛烷 20~200异辛烷(2-甲基庚烷)C8H18 …… 正壬烷 C9H20 -10~+60正壬烷 60~230正癸烷 C10H22 10~80正癸烷 70~260正十一烷 C11H24 15~100正十一烷 100~310正十二烷 C12H26 5~120正十二烷 115~320正十三烷 C13H28 15~132正十三烷 132~330正十四烷 C14H30 15~145正十四烷 145~340正十五烷 C15H32 15~160正十五烷 160~350正十六烷C16H34 ……正十七烷 C17H36 20~190正十七烷 190~320正十八烷 C18H38 20~200正十八烷 200~350正十九烷 160~410正二十烷 C20H42 25~223正二十烷 223~420乙烯C2H4 ……氯乙烯 C2H3 Cl -11~+501,1,2一三氯乙烯C2HCl3 ...... 苯乙烯C8H8 (206)丙烯C3H6 ……丁稀-1 C4H8 ……顺-2-丁烯C4H8 ……反-2-丁稀C4H8 ……2-甲基丙烯-1 C4H8 ……1,2一丁二烯 C4H6 -60~+801,3一丁二烯 C4H6 -80~+652-甲基丁二稀-1,3 C5H8 -50~+95 乙炔 C2H2 -140~-82 公式(2)甲醇 CH4O -20~+140苯甲醇 C7H8O 20~113苯甲醇 113~300乙醇C2H6O ……正丙醇C3H8O ……异丙醇 C3H8O 0~113正丁醇 C4H10 75~ 公式(2)特丁醇 C4H10 ……乙二醇 C2H6O2 25~112乙二醇 112~340乙醛 -45~+70 230丙酮C3H6O (224)二乙基酮C5H10O (204)甲乙酮C4H3O (216)甲酸CH2O2 ……苯甲酸 C7H6O2 60~110 公式(2)乙酸 C2H4O2 0~36 225乙酸 36~170 211丙酸 C3H6O2 0~60 1690 210丙酸 60~185正丁酸 C4H8O2 0~82 200正丁酸 82~210 179月硅酸 C12H24O2 164~205 公式(2)十四烷酸 C14H28O2 190~224 公式(2)乙酐 C4H6O3 100~140 公式(2)顺丁烯二酸酐 C4H2O3 60~160 公式(2)邻苯二甲酸酐 C3H4O3 160~285 公式(2)酷酸乙醋 C4H8 O2 -20~+150甲酸乙酯 C3H6O2 -30~+235醋酸甲酯C3H6O2 ……苯甲酸甲酯 C8H8O2 25~100苯甲酸甲酯 100~260甲酸甲酯C2H4O2 ……水杨酸甲酯 C8H8O3 175~215 公式(2)氨基甲酸乙酯C3H7O2N ……甲醚C2H6O ……二苯醚C12H10O 25~147⑤二苯醚 147~325甲乙醚 C3H8O 0~25 公式(2)乙醚C4H10O ……甲胺 CH5N -93~-45甲胺 -45~+50二甲胺 C2H7N -80~-30二甲胺 -30~+65三甲胺 C3H9N -90~-40三甲胺 -60~+850乙胺 C2H7N -70~-20乙胺 -20~+90二乙胺 C4H11N -30~+100三乙胺 C6H15N 0~130苯胺C6H7N (200)二甲替甲酰胺 C3H7ON 15~60二甲替酰胺 60~350二苯胺 C12H11N 278~284 公式(2)间硝基苯胺 C6H6O2N2 190~260 公式(2)邻硝基苯胺 C6H5O2N2 150~260 公式(2)对硝基苯胺 C6H6O2N2 190~260 公式(2)苯酚C6H6O ……邻甲酚C7H8O ……间甲酚C7H8O ……对甲酚C7H8O ……α-萘酚C10H8O ……苯⑥ C6H6 ……氯苯 C6H5Cl 0~42氯苯 42~230邻二氯苯C6H4Cl2 (200)乙苯C8H10 ……氟苯 C6H5F -40~+180硝基苯 C6H6O2N 112~209 公式(2)甲苯C7H8 ……邻硝基甲苯 C7H7O2N 50~225 公式(2)间硝基甲苯 C7H7O2N 55~235 公式(2)对硝基甲苯 C7H7O2N 80~240 公式(2)三硝基甲苯C7H5O6N3 (160)邻二甲苯C8H10 ……间二甲苯 C8H10对二甲苯 C8H10乙酰苯 C8H8O 30~100 公式(2)乙腈C2H3N (230)丙烯腈 C3H3N -20~+140氰 C2N2 -72~-28 公式(2)氰 C2N2 -36~-6 公式(2)萘C10H8 ……α-甲基綦C11H10 ……β-甲基萘C11H10 ……蓖 C14H10 100~160 公式(2) 72蓖 223~342 公式(2)蓖醌 C14H3O2 224~286 公式(2)蓖醌 285~370 公式(2)樟脑 C10H16O 0~18 公式(2)咔唑 C12H9N 244~352 公式(2)芴 C13H10 161~300 公式(2)呋喃 C4H4O -35~+90吗啉 C4H9ON 0~44吗啉 44~170菲 C14H10 203~347 公式(2)喹啉 C9H7N 180~240 公式(2)噻吩 C4H4S -10~180草酸 C2H2O4 55~105 公式(2)光气 COCl2 -68~+68 230氨⑥ NH3 -83~+60氯化铵 NH4Cl 100~400 公式(2)氰化铵 NH4CN 7~17 公式(2)开放分类:。
水的饱和蒸汽压与温度对应表(生活知识)

水的饱和蒸汽压与温度对应表一、水的饱和蒸汽压与温度的关系蒸汽压是一定外界条件下,液体中的液态分子会蒸发为气态分子,同时气态分子也会撞击液面回归液态。
这是单组分系统发生的两相变化,一定时间后,即可达到平衡。
平衡时,气态分子含量达到最大值,这些气态分子对液体产生的压强称为蒸气压。
水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。
我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。
蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。
一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。
如:放在杯子里的水,会因不断蒸发变得愈来愈少。
如果把纯水放在一个密闭的容器里,并抽走上方的空气。
当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。
但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。
当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。
所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。
饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。
饱和蒸气压越大,表示该物质越容易挥发。
二、水的饱和蒸汽压与温度对应表水的饱和蒸汽压与温度对应表温度℃饱和蒸气压kPa 温度℃饱和蒸气压kPa 温度℃饱和蒸气压kPa0 0.61129 125 232.01 250 3973.61 0.65716 126 239.24 251 4041.22 0.70605 127 246.66 252 4109.63 0.75813 128 254.25 253 4178.94 0.81359 129 262.04 254 4249.15 0.8726 130 270.02 255 4320.26 0.93537 131 278.2 256 4392.27 1.0021 132 286.57 257 4465.18 1.073 133 295.15 258 45399 1.1482 134 303.93 259 4613.710 1.2281 135 312.93 260 4689.411 1.3129 136 322.14 261 4766.112 1.4027 137 331.57 262 4843.713 1.4979 138 341.22 263 4922.314 1.5988 139 351.09 264 5001.815 1.7056 140 361.19 265 5082.316 1.8185 141 371.53 266 5163.817 1.938 142 382.11 267 5246.318 2.0644 143 392.92 268 5329.819 2.1978 144 403.98 269 5414.320 2.3388 145 415.29 270 5499.921 2.4877 146 426.85 271 5586.422 2.6447 147 438.67 272 5674.023 2.8104 148 450.75 273 5762.724 2.9850 149 463.10 274 5852.425 3.1690 150 475.72 275 5943.126 3.3629 151 488.61 276 6035.027 3.5670 152 501.78 277 6127.928 3.7818 153 515.23 278 6221.929 4.0078 154 528.96 279 6317.230 4.2455 155 542.99 280 6413.231 4.4953 156 557.32 281 6510.532 4.7578 157 571.94 282 6608.933 5.0335 158 586.87 283 6708.534 5.3229 159 602.11 284 6809.235 5.6267 160 617.66 285 6911.136 5.9453 161 633.53 286 7014.137 6.2795 162 649.73 287 7118.338 6.6298 163 666.25 288 7223.739 6.9969 164 683.10 289 7330.240 7.3814 165 700.29 290 7438.041 7.7840 166 717.83 291 7547.042 8.2054 167 735.70 292 7657.243 8.6463 168 753.94 293 7768.644 9.1075 169 772.52 294 7881.345 9.5898 170 791.47 295 7995.246 10.094 171 810.78 296 8110.347 10.62 172 830.47 297 8226.848 11.171 173 850.53 298 8344.549 11.745 174 870.98 299 8463.550 12.344 175 891.80 300 8583.851 12.97 176 913.03 301 8705.452 13.623 177 934.64 302 8828.353 14.303 178 956.66 303 8952.654 15.012 179 979.09 304 9078.255 15.752 180 1001.9 305 9205.156 16.522 181 1025.2 306 9333.457 17.324 182 1048.9 307 9463.158 18.159 183 1073 308 9594.259 19.028 184 1097.5 309 9726.760 19.932 185 1122.5 310 9860.561 20.873 186 1147.9 311 9995.862 21.851 187 1173.8 312 1013363 22.868 188 1200.1 313 1027164 23.925 189 1226.1 314 1041065 25.022 190 1254.2 315 1055166 26.163 191 1281.9 316 1069467 27.347 192 1310.1 317 1083868 28.576 193 1338.8 318 1098469 29.852 194 1368.0 319 1113170 31.176 195 1397.6 320 1127971 32.549 196 1427.8 321 1142972 33.972 197 1458.5 322 1158173 35.448 198 1489.7 323 1173474 36.978 199 1521.4 324 1188975 38.563 200 1553.6 325 1204676 40.205 201 1568.4 326 1220477 41.905 202 1619.7 327 1236478 43.665 203 1653.6 328 1252579 45.487 204 1688.0 329 1268880 47.373 205 1722.9 330 1285281 49.324 206 1758.4 331 1301982 51.342 207 1794.5 332 1318783 53.428 208 1831.1 333 1335784 55.585 209 1868.4 334 1352885 57.815 210 1906.2 335 1370186 60.119 211 1944.6 336 1387687 62.499 212 1983.6 337 1405388 64.958 213 2023.2 338 1423289 67.496 214 2063.4 339 1441290 70.117 215 2104.2 340 1459491 72.823 216 2145.7 341 1477892 75.614 217 2187.8 342 1496493 78.494 218 2230.5 343 1515294 81.465 219 2273.8 344 1534295 84.529 220 2317.8 345 1553396 87.688 221 2362.5 346 1572797 90.945 222 2407.8 347 1592298 94.301 223 2453.8 348 1612099 97.759 224 2500.5 349 16320 100 101.32 225 2547.9 350 16521 101 104.99 226 2595.9 351 16825 102 108.77 227 2644.6 352 16932 103 112.66 228 2694.1 353 17138 104 116.67 229 2744.2 354 17348 105 120.79 230 2795.1 355 17561 106 125.03 231 2846.7 356 17775 107 129.39 232 2899.0 357 17992 108 133.88 233 2952.1 358 18211 109 138.50 234 3005.9 359 18432 110 143.24 235 3060.4 360 18655 111 1148.12 236 3115.7 361 18881112 153.13 237 3171.8 362 19110 113 158.29 238 3288.6 363 19340 114 163.58 239 3286.3 364 19574 115 169.02 240 3344.7 365 19809 116 174.61 241 3403.9 366 20048 117 180.34 242 3463.9 367 20289 118 186.23 243 3524.7 368 20533 119 192.28 244 3586.3 369 20780 120 198.48 245 3648.8 370 21030 121 204.85 246 3712.1 371 21286 122 211.38 247 3776.2 372 21539 123 218.09 248 3841.2 373 21803 124 224.96 249 3907.0 - - 三、水的饱和蒸汽压与温度的换算公式当10℃≤T≤168℃时,采用安托尼方程计算:lgP=7.07406-(1657.46/(T+227.02))式中:P——水在T温度时的饱和蒸汽压,kPa;T——水的温度,℃四、水的饱和蒸汽压曲线。
水的饱和蒸汽压与温度对应表

水的饱和蒸汽压与温度对应表一、水的饱和蒸汽压与温度的关系蒸汽压是一定外界条件下,液体中的液态分子会蒸发为气态分子,同时气态分子也会撞击液面回归液态。
这是单组分系统发生的两相变化,一定时间后,即可达到平衡。
平衡时,气态分子含量达到最大值,这些气态分子对液体产生的压强称为蒸气压。
水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。
我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。
蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。
一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。
如:放在杯子里的水,会因不断蒸发变得愈来愈少。
如果把纯水放在一个密闭的容器里,并抽走上方的空气。
当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。
但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。
当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。
所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。
饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。
饱和蒸气压越大,表示该物质越容易挥发。
二、水的饱和蒸汽压与温度对应表水的饱和蒸汽压与温度对应表118 186.23 243 3524.7 368 20533 119 192.28 244 3586.3 369 20780 120 198.48 245 3648.8 370 21030 121 204.85 246 3712.1 371 21286 122 211.38 247 3776.2 372 21539 123 218.09 248 3841.2 373 21803 124 224.96 249 3907.0 - - 三、水的饱和蒸汽压与温度的换算公式当10℃≤T≤168℃时,采用安托尼方程计算:lgP=7.07406-(1657.46/(T+227.02))式中:P——水在T温度时的饱和蒸汽压,kPa;T——水的温度,℃四、水的饱和蒸汽压曲线。
饱和空气的水蒸气分压力表

饱和空气的水蒸气分压力表一、引言在大气科学和气象学中,饱和空气的水蒸气分压力表是一个非常重要的工具。
它可以用来计算空气中水分子的浓度,从而预测天气、研究大气化学等方面提供帮助。
本文将详细介绍饱和空气的水蒸气分压力表的定义、原理、应用以及常见问题。
二、定义饱和空气是指在一定温度下,所含水蒸气量已达到最大值,不能再吸收更多的水蒸气。
此时,空气中水蒸汽的分压力称为饱和水蒸汽分压力。
饱和空气的水蒸汽分压力取决于温度,通常用Pws表示。
在标准大气压下(1013.25 hPa),不同温度下的Pws值如下表所示:温度(℃)0 5 10 15 20 25 30Pws(hPa) 6.11 12.26 19.92 31.67 50.3879.77 122.4三、原理饱和空气中所含水分子数量与温度有关。
当温度升高时,空气中的水分子数量也会增加。
在一定温度下,空气中所含的水分子数量达到最大值时,称为空气处于饱和状态。
此时,空气中水分子的浓度不再增加,而是保持不变。
饱和空气的水蒸汽分压力是指在一定温度下,空气中所含水分子达到最大值时,这些水分子对于总压力的贡献。
因此,在不同温度下,饱和空气的水蒸汽分压力也会不同。
四、应用1. 气象学饱和空气的水蒸汽分压力表是天气预报中必不可少的工具之一。
通过计算空气中所含水蒸汽量与其饱和状态下所含水蒸汽量之比,可以得出相对湿度。
相对湿度越高,则空气中所含的水蒸汽越多,天气越潮湿;相反,则天气较干燥。
2. 化学在化学实验室中,饱和空气的水蒸汽分压力表也有广泛应用。
例如,在某些化学反应中需要控制反应体系中的湿度,就可以使用该表来计算所需加入的水分子数量。
3. 工程在工程领域中,饱和空气的水蒸汽分压力表也有一定应用。
例如,在建筑物中,需要控制室内湿度,以保证室内环境的舒适性和健康性。
此时,可以使用该表来计算所需加入或减少的水分子数量。
五、常见问题1. 什么是相对湿度?相对湿度是指空气中所含水蒸汽量与其饱和状态下所含水蒸汽量之比。
水 饱和蒸气压

水饱和蒸气压水的饱和蒸汽压是指在一定温度下,液体水和气态水(蒸汽)的平衡状态下,气态水所产生的压强。
这个概念在化学、物理、环境科学等领域都有着广泛的应用,并且还具有很高的研究价值。
理解饱和蒸汽压的重要性首先,理解饱和蒸汽压对于科研和技术发展都非常重要。
对于无数个领域来说,对饱和蒸汽压的研究和应用,如蒸馏、化学反应过程中的热力学模型、气体发生器的设计、空气净化器的运作原理等都有很大的作用,而这些能为我们的生产、生活带来更大的方便和效益。
其次,饱和蒸汽压是描述大气环境中水蒸汽含量的重要指标。
在云的形成、降水的产生等大气现象中,饱和蒸汽压都有着至关重要的作用。
如何计算饱和蒸汽压决定水饱和蒸气压的因素是温度。
温度越高,饱和蒸汽压越高。
在理想状态下,对于特定温度下的水和气态水可以实现平衡,也就是说水蒸气的产生和凝结具有相等的速率。
此时水蒸灵压才能达到最大值,称之为“饱和蒸汽压”。
由于饱和蒸汽压是温度的函数,它可以被计算出来。
比如说,对于20摄氏度的水,它的饱和蒸汽压为2338.8Pa,那么在气压为101.3kPa的情况下,水就可以沸腾,而这个温度就叫做水的沸点。
应用范围水的饱和蒸汽压在化学中有着重要的应用。
在化学反应中,当某个反应物产生水蒸气时,它的数量和相对湿度有着极大的影响。
因为水的饱和蒸汽压决定了水分子在气体相中的浓度,而这又影响了反应的速率。
因此在混合气体的传递过程中,饱和蒸汽压常常要被考虑到。
此外,饱和蒸汽压在空间科学中也有着重要的应用。
在地球的大气中,水蒸气是其中一种主要的组成部分。
此外,月球和火星等星球上的水也以水蒸气的形式出现。
测量这些行星大气中的水蒸气可以告诉我们它们的化学和气候特征的重要信息。
结论综上所述,水的饱和蒸汽压对于环境、化学和空间科学都有着广泛的应用。
理解饱和蒸气压这个概念,在日常生产生活中也有很多实际应用,比如烤箱、蒸笼、汽车发动机等等。
因此,深入了解饱和蒸汽压的概念,可帮助我们更好地理解许多现象和过程。
水蒸气临界压力

水蒸气临界压力
水蒸气临界压力是指在一定温度下,水蒸气变为液态时所需达到的最小压力。
当水蒸气的压力低于临界压力时,水蒸气会直接转化为气体状态,而不是液态状态。
水蒸气临界压力与温度有关,当温度升高时,临界压力也会随之增加。
在常见的自然环境下,水蒸气临界压力约为22.1 MPa(兆帕),对应的温度为374℃。
这也是为什么在高温高压的情况下,水蒸气可以同时存在于液态与气态之间的原因。
水蒸气临界压力的概念在工程、化工以及能源等领域中都有着广泛的应用。
例如,在热力发电中,水的临界压力和温度是非常重要的参数,因为它们可以影响蒸汽轮机效率和工作温度,进而影响电站的发电效率。
此外,还有一些工业领域,例如化学反应、材料加工等,需要使用高温高压条件下的水蒸气进行反应或处理,因此对于水蒸气临界压力的研究和掌握也具有重要意义。
总之,水蒸气临界压力是自然界与工业生产中不可避免的物理现象之一,对于我们的生活和工作都有着深远的影响。
