卤素
卤素

H2 + F2 == 2HF
H2 +C 2 == 2H l l C
光 或 照
点 燃
H2 + B 2 == 2H r r B
H 2 + I2 小结
∆
500 ℃
2HI
和H2化合条件越来越难
卤素
2. 卤素间的置换 Cl2 + 2NaBr == 2NaCl + Br2 Br2 + 2KI == 2KBr + I2 KI KCl Cl2 + 2 ______ == 2 ______ + I2 小结 氧化性 还原性 Cl2 > Br2 > I2 I- > Br- > Cl-
氯 Cl2 溴 Br2 碘
I2
逐 黄绿色气体 3.214g/L 渐 增 3 深红棕色液体 3.119g/cm 大
紫黑色固体 4.93g/cm3
逐 -101 渐-34.6 增 -7.2 58.78 大
113.5
184.4
卤素
二、卤素的化学性质
1. 氧化性 ⑴ 和金属 2Fe + 3X2 == 2FeX3 Fe + I2 == FeI2 小结 氧化性 F、Cl、Br > I (F、Cl、Br)
卤素
3. 和水 2F2 + 2H2O == 4HF + O2 氧化性 F2 > O2
X2 + H2O == HX + HXO 氯水
颜色
溴水 橙黄色
碘水 棕黄色
黄绿色
卤素
三、卤素的检验
1. X-的检验 Ag+ + X- == AgX↓ AgCl
颜色
(Cl、Br、I) AgBr 淡黄色 AgI 黄色
第十二章 卤素

§1. 卤素单质
一. 物理性质------熔、沸点和颜色
1.状态、颜色
状态原因:半径依次增大,分子量也增大,所以色散力也增大,所以分 别以气体—液体—固体状态存在。 显色原因:利用分子轨道能级图解释显色。卤素分子中π*和σ*反键轨道 能量相差较小,这个能差随着Z的增大而变小。 F2 电子数少,反键 π*、σ*轨道能差大△E大。 F2吸收可见光中能量高、波长短的那部分 光(蓝、紫光),而显示出长波段那部分光,复合色变成黄色。
HXO都不稳定,仅存在于水溶液中,从Cl到I 稳定性减 小,分解方式:
(3) 氧化性
HXO不稳定,表明HXO的氧化性很强。
XO- 盐比HXO酸稳定性高,所以经常用其盐 在酸性介质中做氧化剂。
2.HXO的制备
1)次氯酸酐Cl2O溶于水制得HClO
步骤: 将Cl2通到新制干燥的HgO表面,加热制得Cl2O
二 化学性质
从卤素在自然界中存在形式可以看出卤素单 质化学活泼性很强,价电子层结构,易获一个 电子达到8电子稳定结构。卤素单质是强氧化 剂,而F2最强,随Z增大,氧化能力变弱。碘 不仅以负一价的离子存在于自然界中,而且以 +5价态存在于碘酸钠中,说明碘具有一定的还 原性,它们的化学活泼性,从F2到I2依次减弱。
Cl、Br、I具有不同价态的含氧酸
X: 采取SP3杂化,O的2P电子与卤素3d空轨道间形成d-pπ键。 由于稳定性原因,只有常见的氯的含氧酸研究得多
一、次卤酸
1. 化学性质 (1) 酸性
因为随半径增大,分子中 H— O—X,X—O 结合力减小,X
对 H+ 斥力变小,导致酸性减小。
(2) 热稳定性
卤素元素及知识点总结

卤素元素及知识点总结卤素元素是周期表中的第17族元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素具有共同的特性,如高电负性、对金属有强烈的化学活性、易离子化等特点。
在化学和生物学领域,卤素元素的应用非常广泛,如消毒、药物制剂、化工生产等领域。
1. 氟(F)氟是周期表中最活泼的非金属元素,其电负性为3.98,是所有元素中最高的。
氟的化合物被广泛用于制造有机化合物、药物、农药和农业化肥等。
氟也是强力的腐蚀剂,能够与金属形成氟化物,并能用于制造不锈钢和铝合金。
2. 氯(Cl)氯是一种绿色有毒气体,具有刺激性气味。
氯是一种重要的工业原料,广泛用于生产塑料、橡胶、药物等化学产品。
氯化物也被用作食品加工中的脱色剂和防腐剂。
氯化合物也被广泛用于水处理、消毒等领域。
3. 溴(Br)溴是一种棕红色液体,有辛辣的气味。
溴和其化合物主要用于生产染料、消毒剂、防火剂等。
溴化银是曾经广泛用于摄影的感光材料。
4. 碘(I)碘是一种紫黑色晶体,具有金属光泽。
碘主要用于制备医药、化工原料和感光材料等。
碘也是人体必需的微量元素,对人体健康至关重要。
5. 砹(At)砹是一种放射性元素,非常不稳定。
由于其稀缺性和毒性,砹的应用非常有限。
卤素元素的化学性质主要体现在其化合物中,包括卤化物、卤氧酸盐、卤代烃等。
卤素元素可以形成离子化合物,也可以形成共价化合物。
除氟外,其他卤素元素主要以共价键的形式存在。
在生物学领域,卤素元素对生命体的作用非常重要。
如氯化物在维持体内水盐平衡、传导神经冲动和肌肉收缩等过程中起着重要作用。
碘是甲状腺激素的组成部分,对人体的新陈代谢、生长发育、心血管功能等有重要影响。
然而,卤素元素也有毒性,过量摄入会损害人体的健康。
氟过量摄入会导致骨骼矿化不良、牙齿斑点等疾病,碘过量摄入会影响甲状腺功能,导致甲亢或甲减等疾病。
卤素元素也具有重要的应用价值。
如氟化物广泛用于牙膏、口香糖等口腔护理产品中,氯化物和溴化物被用作水处理剂、消毒剂等。
卤素知识讲座

10.飞荣达直接客户之无卤素要求
富士康(FOXCONN): 溴(Br)<900PPM 氯(Cl)<900PPM 氯(Cl)+溴(Br)<1500PPM
对于替代阻燃剂,不允许使用以下物质: 三氧化二锑(Sb2O3) 磷酸三苯酯(TPP) 红磷
10.飞荣达直接客户之无卤素要求
智富、迈拓: 溴(Br)<900PPM 氯(Cl)<900PPM 氯(Cl)+溴(Br)<1500PPM
14.无卤产品的定义
无卤产品(Halogen Free):根据某要求, 将卤素含量控制在一定范围内的产品。此范 围将比含卤产品大大减少对环境、生命财产 的影响。
根据IEC61249-2-21:2003标准:氯小 于900PPM,溴小于900PPM,氯、溴之和 小于1500PPM的覆铜板,定义为无卤覆铜 板。
卤素溶于水,在空气中与水蒸汽结合会形成 酸雨;塑料在注塑过程中,卤素会释放出卤 化氢,腐蚀模具;PCB板在(>200度)的 高温焊接过程中也会释放出溴化氢;有机氯 和有机溴化合物燃烧时发烟大,会产生有毒 气体二恶英,破坏环境。
3.卤素的危害
二恶英(Dioxin):是一种无色无味、毒性严重的脂溶性物质,二 恶英实际上是二恶英类(Dioxins)一个简称,它指的并不是一种 单一物质,而是结构和性质都很相似的包含众多同类物或异构体 的两大类有机化合物,全称分别是多氯二苯并二恶英 (简称 PCDDs)和多氯二苯并呋喃 (简称PCDFs))这类物质非常稳定, 熔点较高,极难溶于水,可以溶于大部分有机溶剂,是无色无味 的脂溶性物质,所以非常容易在生物体内积累。自然界的微生物 和水解作用对二恶英的分子结构影响较小,因此,环境中的二恶 英很难自然降解消除。它包括210种化合物。它的毒性十分大,是 氰化物的130倍、砒霜的900倍,有“世纪之毒”之称。国际癌症 研究中心已将其列为人类一级致癌物。环保专家称,“二恶英”, 常以微小的颗粒存在于大气、土壤和水中,主要的污染源是化工 冶金工业、垃圾焚烧、造纸以及生产杀虫剂等产业。日常生活所 用的胶袋,PVC(聚氯乙烯)软胶等物都含有氯,燃烧这些物品 时便会释放出二恶英,悬浮于空气中。
卤素

At2
具有放射性 咱不讨论- - ...
1.卤素都能跟金属起反应生成卤化物。
非金属性越强,反应越易进行,生成的卤化物越稳定。
2.卤属都能跟氢气反应生成卤化氢。
F2低温下暗处就剧烈反应甚至爆炬产生HF稳定。Cl2低温下缓慢反应需光照或加热条件下进行。Br2 I2高温下才能反应,HI不稳定可分解为H2和I2 所以为可逆反应。
随着分子量的增大,卤素分子间的色散力逐渐增强,颜色变深,它们的熔点、沸点、密度、原子体积也依次递增
卤素的化学性质都很相似,它们的最外电子层上都有7个电子,有取得一个电子形成稳定的八隅体结构的卤离子的倾向
除F外,卤素的氧化态为+1、+3、+5、+7
卤素与氢结合成卤化氢,溶于水生成氢卤酸。
卤素之间形成的化合物称为互卤化物,如ClF3、ICl。
2F2+2H2O=4HF(aq)+O2 X2+H2O=HX(aq)+HXO(aq) X=表示Cl Br I (aq)代表是溶液.
4.卤素各单质的活泼性比较。
卤素各单质的活泼性顺序:F2>Cl2>Br2>I2 前者可将后者从其金属化物中置换出来.
5.碘与淀粉反应:碘+淀粉→蓝色,检验I2或淀粉的存在。
氟、氟化氢和氢氟酸对玻璃有较强的腐蚀性。
氟是氧化性最强的元素,只能呈-1价.其没有正价.
单质氟与盐溶液的反应,都是先与水反应,生成的氢氟酸再与盐的反应,通入碱中可能导致爆炸。
化学性质活泼,能与几乎所有元素发生反应(除氦、氖)。
水溶液氢氟酸是一种弱酸。但却是稳定性、腐蚀性最强的氢卤酸,如果皮肤不慎粘到,将一直腐蚀到骨髓。
卤素

(2)物质的颜色与吸收光颜色的关系 )
物质的颜色
绿 黄 青
橙 红
白光 蓝 紫
青蓝
黄绿 黄 橙 红 紫红 紫 蓝 青蓝 青
吸收光 波长(nm) 颜色 波长(nm) 400— 紫 400—450 450— 蓝 450—480 480— 青蓝 480—490 490— 青 490—500 500— 绿 500—560 560— 黄绿 560—580 580— 黄 580—600 600— 橙 600—650 红 ) X2为非极性分子,分子间作用 为非极性分子, 力主要为┄┄ ┄┄色散力 力主要为┄┄色散力 熔沸点F 依次升高。 ∴熔沸点 2→I2 依次升高。 聚集态 F2(g)→CI2(g)→Br2(l)→I2(g) Br2:非金属中的唯一液体 I2:固体易升华,紫黑 粉红 固体易升华,紫黑→粉红
(2)与非金属作用 )
F2
反应活性 与H2反应条件 暗处 光照 Pt/350℃ 高温 ℃ F2可与所有除 O2、N2,稀有气体He和Ne外的非金属作用 稀有气体 和 外的非金属作用 直接化合成高价氟化物。 直接化合成高价氟化物。 Cl2也可与大多数非金属单质化合,但不如 2猛烈。 也可与大多数非金属单质化合,但不如F 猛烈。 2 S(s) + Cl2(g) = S2Cl2(l) 红黄色液体 S(s) + Cl2(g)(过量 = SCl2(l) 深红色发烟液体 过量) 过量 2 P(s) + 3 Cl2(g) = 2 PCl3(l) 无色发烟液体 2 P(s) + 5 Cl2(g) (过量 = 2 PCl5(l) 淡黄固体 过量) 过量 Br2和I2与许多非金属作用反应,但不如 2、Cl2激烈,不能 与许多非金属作用反应,但不如F 激烈, 氧化到最高价。 氧化到最高价。
卤素
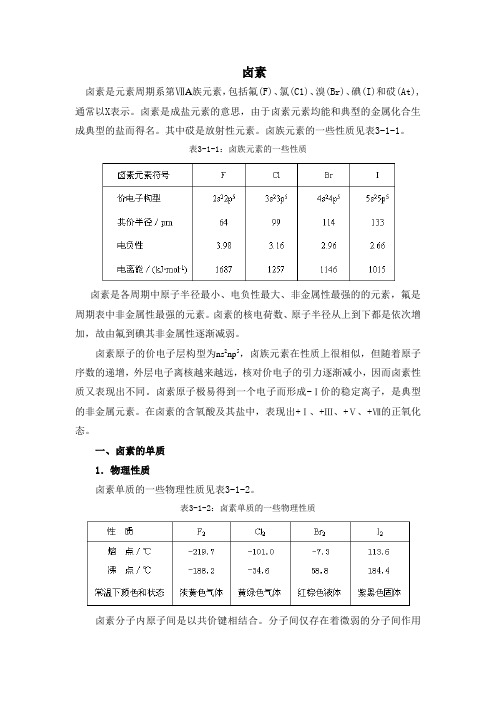
卤素卤素是元素周期系第ⅦA族元素,包括氟(F)、氯(C1)、溴(Br)、碘(I)和砹(At),通常以X表示。
卤素是成盐元素的意思,由于卤素元素均能和典型的金属化合生成典型的盐而得名。
其中砹是放射性元素。
卤族元素的一些性质见表3-1-1。
表3-1-1:卤族元素的一些性质卤素是各周期中原子半径最小、电负性最大、非金属性最强的的元素,氟是周期表中非金属性最强的元素。
卤素的核电荷数、原子半径从上到下都是依次增加,故由氟到碘其非金属性逐渐减弱。
卤素原子的价电子层构型为ns2np5,卤族元素在性质上很相似,但随着原子序数的递增,外层电子离核越来越远,核对价电子的引力逐渐减小,因而卤素性质又表现出不同。
卤素原子极易得到一个电子而形成-Ⅰ价的稳定离子,是典型的非金属元素。
在卤素的含氧酸及其盐中,表现出+Ⅰ、+Ⅲ、+Ⅴ、+Ⅶ的正氧化态。
一、卤素的单质1.物理性质卤素单质的一些物理性质见表3-1-2。
表3-1-2:卤素单质的一些物理性质卤素分子内原子间是以共价键相结合。
分子间仅存在着微弱的分子间作用力,随着相对分子质量的增大,分子的变形性逐渐增大,分子间的色散力也逐渐增强,因此,卤素单质的一些物理性质呈现规律性变化。
如卤素单质的熔点、沸点等按F—C1—Br—I的顺序依次升高。
常温下,氟和氯是气体,溴是易挥发的液体,碘为固体(易升华)。
可见卤素单质的颜色随着相对分子质量的增大而逐渐加深,这是由于从氟至碘外层电子离核越来越远,相应的外层电子更易被激发,所以外层电子被激发所需要的能量就越少,故使物质的颜色逐渐变深。
卤素单质是非极性分子,在水中的溶解度不大,易溶于有机溶剂。
氟不溶于水,它能剧烈地分解水而放出氧气。
溴在有机溶剂中的颜色随溴浓度的增加而逐渐加深,从黄色到棕红色。
碘溶于溶剂中所形成溶液的颜色随溶剂不同而有区别。
卤素单质均有刺激气味,吸人较多的蒸气会发生严重中毒,甚至造成死亡。
它们的毒性从氟到碘依次减轻。
溴易挥发,高浓度的液溴可使皮肤严重灼伤;碘的蒸气有毒,强烈刺激皮肤和眼睛;使用时要特别小心。
12-卤素

BrO4
-
BrO3
-
BrO-
Br2(l)
Br-
HI3O62- 0.65 IO3- 0.15 IO- 0.42 I2(s) 0.54 I在 0B图中,除X2/X-电对外,其余电对的电极电势虽为正值,但 均较小,即在碱性介质中,各种含氧酸盐的氧化性较含氧酸弱。
14.2.2 卤素单质物理性质
卤素单质
聚集状态 颜色 熔点/℃ 沸点/℃ 汽化热/(KJ· mol-1) 溶解度/g· (100gH2O)-1
• Cl2也可与大多数非金属化合,但不如F2猛烈。 Br2 、I2更差。 2S + Cl2 = S2Cl2 S + Cl2(过量) = SCl2
2P + 3Cl2 = 2PCl3
2P + 5Cl2(过量) = 2PCl5 2P + 3Br2 = 2PBr3 2P + 5Br2(过量) = 2PBr5
氟
气 浅黄 -219.6 -188 6.32 分解水
氯
气 黄绿 -101 -34.6 20.41 0.732
溴
液 红棕 -7.2 58.78 30.71 3.58
碘
固 紫黑 113.5 184.3 46.61 0.029
密度/(g· cm-3)
1.11(l)
1.57(l)
3.12(l)
4.93(s)
F F F I F F
Cl Cl
F F F F F I F F
I
例:ICl2 (7 + 1×2) / 2 = 4.5 (杂化轨道理论:sp3d),直线型 例:IF7 (7 + 1×7) / 2 = 7 五角双锥
对于ClF3 (7+3) 2 = 5
卤素PPT课件

05
卤素在生活生产中应用
食盐与人体健康关系探讨
食盐的化学成分及作用
主要成分为氯化钠(NaCl),是人体必需的营养元素之一,对于维持细胞内外渗透压平衡、 神经传导和肌肉收缩等生理功能具有重要作用。
食盐摄入量与健康关系
适量摄入食盐对维持人体健康至关重要,但过量摄入可能导致高血压、心血管疾病等健康问 题。世界卫生组织建议每日食盐摄入量不超过5克。
06
卤素对环境影响及治理措 施
大气中卤代烃污染现状及危害
卤代烃在大气中的来源
工业排放、汽车尾气、农药使用等。
大气中卤代烃的浓度及分布
受排放源、气象条件、地形等因素影响,浓度分布不均。
卤代烃对大气的危害
破坏臭氧层,导致紫外线辐射增强;形成光化学烟雾,危害人类健 康。
水体中卤代烃污染现状及危害
卤代烃在水体中的来源
溴和碘
物理性质
溴是一种红棕色、有刺激性气味 的液体,密度比水大,易挥发; 碘是一种紫黑色、有金属光泽的
固体,密度比水大,易升华。
化学性质
溴和碘的化学性质较为相似,都 具有氧化性,能与多种元素直接
化合生成溴化物和碘化物。
用途
溴和碘在有机合成、医药、农药 等领域有着广泛的应用。例如, 溴可用于制取溴化物、染料、灭 火剂等;碘可用于制取碘化物、
氯气可以与大多数金属直接反应,生 成相应的氯化物。
卤素性质变化规律
01
随着原子序数的增加, 卤素的非金属性逐渐减 弱,金属性逐渐增强。
02
卤素单质的颜色逐渐加 深,从氟气的浅黄绿色 到碘单质的紫黑色。
03
04
卤素单质的密度逐渐增 大,熔点和沸点也逐渐 升高。
卤素单质的氧化性逐渐 减弱,还原性逐渐增强。
卤素

2F₂+2OH⁻→OF₂+2F⁻+H₂O
卤的氧化物中氯原子具有多种不同氧化态,可用新制得的黄色Hgo和CI₂制取
2CI₂+2Hgo=HgCI•H₂O+CI₂O
同浓度卤酸的氧化性强弱关系比较
HBrO3、HClO3和HIO3 Br与Cl相比,外层18电子的Br吸引电子的能力大于8电子的Cl; Br与I的最外层都是18电子但Br的半径r小于I,所以Br的得电子能 力也大于I。故3种卤酸氧化性顺序为:HBrO3>HClO3>HIO HBrO4、H5IO6和HClO4 稀溶液中HClO4完全解离,ClO4-为正四面体结构,对称性高, 且不受H+反极化作用的 影响,比较稳定,所以氧化能力低。 高卤酸的标准电极势数值 排列: BrO4-/BrO3- H5IO6/IO3- ClO4-/ClO3- EAθ/V 1.85 1.60 1.20 比较卤酸的标准电极电势可知氧化性:HBrO4>H5IO6>HClO4
绝大数卤素互化物是不稳定的,熔沸点低。最稳定的XY型卤素互化物是CIF, 其物理性质介于组成元素的分子性质之间。卤素互化物都是氧化剂,与大多 数金属和非金属猛烈反应生成相应的卤化物;发生水解作用生成卤离子和卤 氧离子,其分子中较大电负性较小的卤原子生成卤氧离子。 氟的卤素互化物如CIF₃、CIF₅、BrF₃通常都作为氟化剂,使金属、非金属及金 属的氧化物以及金属的卤化物、溴化物和碘化物转变为氟化物
卤化物
卤素和电负性较小的元素形成的化合物叫做卤化物。由非金属或高氧化 态金属形成的卤化物BCl₃、CCl₄、SbCl₅、SF₆、WCl₆等,不论气相、液相或 是固相,往往形成共价型卤化分子,它们有挥发性、较低的熔点和沸点, 有的不溶于水,溶于水的往往发生强烈的水解。 碱金属、碱土金属及若干镧系和锕系元素,它们的电负性小,离子半径 大,形成的卤化物主要是离子型的。它们有高的熔点和沸点,在极性溶 剂中易溶解,其溶液有导电性,熔融状态时也能导电。同一周期各元素 的卤化物,随着金属离子半径减小和氧化数增大,离子性依次降低,共 价性依次增强,熔沸点依次降低。 同一金属的卤化物随着卤离子半径的增大,变形性也增大,按氟氯溴碘 的顺序其离子性依次降低,共价性依次增加。一般来说,金属氟化物主 要是,离子型化合物其它卤化物从氯到碘共价型化合物则逐渐增多。 不同氧化物的同一金属,其高氧化态卤化物的离子性小于低氧化态卤化 物的的离子性
卤素的解释

卤素(halogen)测试|无卤检测|卤素四项(氟F/氯Cl/溴Br/碘I)/ 卤素测试报告什么是卤素(halogen)?卤素(halogen)的应用是什么?卤素(halogen)有什么危害?卤素(halogen)测试怎么做?为什么通常是卤素(halogen)四项测试?什么是卤素测试报告?卤素(halogen)的大致应用范围是哪些?什么限制卤素(halogen)使用的相关法规?本版将就一些大家关心的问题,做个简单介绍。
一、什么是卤素(halogen)?卤素(halogen)是化学周期表中第ⅦA族非金属元素。
卤素(halogen)具体来说指的是氟(Fluorine)、氯(Chlorine)、溴(Bromine)、碘(Iodine)和砹(Astatine)五种元素,合称卤素。
由于砹(Astatine)为放射性元素,因此,人们通常所指的卤素习惯上是氟F、氯CI、溴Br、碘I四种元素。
卤素化合物经常作为一种阻燃剂应用于电子零组件与材料、产品外壳、塑胶等。
此种阻燃剂无法回收使用,而且在燃烧与加热过程中会释放有害物质,威胁到人类身体的健康、环境和下一代子孙。
二、卤素(halogen)的应用卤素(halogen)(氟Fluorine/氯Chlorine/溴Bromine/碘Iodine)大多在聚合物材料中以有机物形式存在。
用于常见产品中的卤素化合物主要有PBB、PBDE、TBBP-A、PCB、六溴十二烷、三溴苯酚、短链氯化石蜡;另有用于冷冻剂、隔热材料等的臭氧破坏物质CFCs、HCFCs、HFCs等。
一般来说,卤素化合物大多是应用于阻燃剂、制冷剂、溶剂、有机化工原料、农药杀虫剂、漂白剂、羊毛脱脂剂等。
三、其它含有卤素(halogen) (F/Cl/Br/I)的各类物质有机氯化合物:用于塑料的耐燃剂、增塑剂、印刷电路格等上的耐燃剂等;聚氯乙烯(PVC):电源电缆、連接电缆、产品内連线用塑料电线、粘合剂、高压塑料电线、退磁线圈的包里、绝缘胶带;灭蚁灵(Mirex):用于树脂、橡胶、涂料、纺织物、电气产品等的阻燃剂、防锈剂等;氯化烷烃(CP):用作含有附件产品的外框(外壳)、印刷电路板(碳链长为10 -13、含氯量为50wt%以上的短链型氯化烷烃類对象);多氯化萘(PCN):润滑油、涂料等用途(氯原子数≧3以上的多氯化萘(PCN)产品);多氯联苯(PCB / PCBs):绝缘油、润滑油、塑料耐燃剂等;其它有机溴化合物:用于塑料的耐燃剂印刷电路板等上的耐燃剂等;四溴双酚-(TBBP-A):用于塑料的耐燃剂(以PS、ABS、PC/ABS、Mppe等四种塑料最常使用半导体封装材料与体积路板基材);多溴二苯醚(PBDE),用于塑料的耐燃剂;多溴联苯(PBB):用于塑料的耐燃剂;氯化石蜡Chlorinated paraffins;氯三联苯(PCT)Polychlorinated terphenyls。
卤素

卤素(ⅦA族)氟F、氯Cl、溴Br、碘I 统称为卤素。
价电子构型:ns2np5氧化态:除氟外(-1),均可呈现0、-1、+1、+3、+5、+7卤素的存在氟:是自然界中广泛分布的元素之一,在卤素中,它在地壳中的含量仅次于氯。
氟在地壳的存量为0.072%,克拉克值0.0625,存在量的排序数为12,自然界中氟主要以萤石(Fluorite)存在,其主要成分为氟化钙(CaF2)、冰晶石(3NaF.AlF3)及以氟磷酸钙[Ca5F(PO4)3]为主的矿物。
氯:氯在地壳中的含量为0.031%,自然界的氯大多以氯离子形式存在于化合物中,氯的最大来源是海水。
矿物中有光卤石(KCl ﹒MgCl6﹒6H2O)溴:以溴化物的形式存在于海水和地壳中碘:以碘化物形式存在,南美洲智利硝石含有少量的碘酸钠。
海中的植物可以富集碘。
卤素单质物理性质氟:通常情况下氟气是一种浅黄绿色的、有强烈助燃性的、刺激性毒气,是已知的最强的氧化剂之一。
熔点-219.62℃,沸点-188.14℃。
氟的电负性最高,吸引电子能力强氯:气态氯单质俗称氯气,液态氯单质俗称液氯。
在常温下,氯气是一种黄绿色、刺激性气味、有毒的气体。
压力为101.325KPa 时,氯单质的沸点为-34.4℃,熔点为-101.5℃。
氯气可溶于水和碱性溶液,易溶于CS2和CCl4等有机溶剂,饱和时1体积水溶解2体积氯气。
溴:深棕红色、易挥发、有强烈刺激性臭味、液体密度:3.119g/cm3,熔点:-7.2℃ ,沸点:58.76℃,在常温下,是唯一的液态非金属。
碘:紫黑色晶体,具有金属光泽,性脆,易升华。
有毒性和腐蚀性。
密度4.93 克/立方厘米。
熔点113.5℃,沸点184.35℃。
加热时,碘升华为紫色蒸汽,这种蒸气有刺激性气味,有毒。
易溶于乙醚、乙醇、氯仿和其他有机溶剂,形成紫色溶液,但微溶于水(但如果水中含碘离子会使其溶解度增大:I-+I2==I3-,也溶于氢碘酸和碘化钾溶液而呈深褐色。
第12章 卤素

实验室中用化学方法制备单质氟的过程如下: 2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2 SbCl5 + 5HF = SbF5 + 5HCl K2MnF6 + 2SbF5 423K 2KSbF6 + MnF4 2MnF4 → 2MnF3 + F2
工业上用电解氧化法来制备单质氟: - - 阳极:2F = F2↑+ 2e - - - 阴极:2HF2 + 2e = H2↑+ 4F 电解总反应:2KHF2 = 2KF + F2↑+ H2↑
大量碘由碘酸钠制取: - - - - 2IO3 + 5HSO3 = 3HSO4 + 2SO42 H2O + I2 即: - - - - IO3 +HSO3 = I + 3SO42 +H+ - - IO3 + 5I + 6H+= 3I2 + 3H2O
二、卤化氢和氢卤酸
1. 卤化氢的性质 2. 氢卤酸的性质(酸性、还原性) 酸性变化规律: HF HCl HBr HI 弱 强 + - HF H +F Kao=6.6×10-4 - - HF+F HF2 Ko=5
汽化热(KJ/mol) 在水中溶解度(g/100g 水) (298K)
分解水
0.732
3.58
0.029
2. 卤素单质的化学性质(氧化性)
a、与金属作用
F2:在低温和高温下都可以和所有金属直 接作用, 生成高价氟化物。(Cu、Ni、Mg除外) Cl2: 也可与各种金属作用,反应较剧烈。氯在干燥 的情况下不与铁作用。
2. 卤素互化物
由两种卤素组成的化合物叫卤素互化物。如ICl、ICl3、 IF5、IF7 卤素互化物遇水即水解: XX′+H2O=H++X-+HXO IF5+3H2O=H++IO3-+5HF 半径较大的碱金属可形成多卤化物如KI3、KICl2、 KICl4、CsIBr2等,一般没有氟。它们在结构和性质 方面与卤素互化物近似。多卤化物不稳定,受热易分 解,分解后倾向于生成晶格更稳定的物质。
卤素

氟 氯 石油产区的矿井水 干海藻 智利硝石 油井盐水 人工合成
卤素的电势图
卤素单质
卤素单质的物理性质 卤素单质的化学性质
卤素的制备和用途
卤素单质的物理性质
卤素分子内原子间以共价键相结合而形成双原子分子。 从氟到碘,随着分子间色散力的逐渐增加,卤素单质的密度、 熔点、沸点、临界温度和气化热的物理性质俊依次递增。
稀的 HF 是弱酸,而当其浓度大于 5.0 mol ·dm–3时,
酸性增强。因为,随着浓度的增大, HF 分子间的氢键增
强,形成 [HF]2 缔合分子,而 [HF]2 的酸性比 HF 强。
HF(aq)
2 HF
H+(aq) + F–(aq)
– H+ + HF2
K a
= 6.310–4
K = 3.310–3
1
金属卤化物的制备
卤化氢或氢卤酸与活泼金属、金属氧化物和氢氧化物
以及金属难溶盐作用, 可以得到相应的金属卤化物:
Zn + 2 HCl CuO + 2 HCl ZnCl2 + H2 (与活泼金属反应) CuCl2 + H2O (与金属氧化物反应)
NaOH + HCl NaCl + H2O (与氢氧化物反应) CaCO3 + 2 HCl CaCl2 + H2O + CO2
– – –
1
单质氟的制备
F2 是最强的氧化剂,所以通常不能采用氧化F 离子
-
的方法制备单质氟。
电解法制备单质氟 : 阳极反应:
2F – 2e 2
– HF2
–
–
F2
–
阴极反应:
+ 2e
第6章 卤素

一、P区元素概述 含ⅢA~ⅦA 及零族,沿B-Si-As-Te-At为 对角线, 右上方为非金属元素区,含21种 元素;左下方为10种金属元素。 特点: 1、原子结构 :价层 ns2 np1-6 2、金属性、非金属性:同一周期从左到右、 非金属性增强 ,金属性减弱 ;同族,从上 到下,除ⅦA外,均从典型非金属元素过渡 到金属元素 。 3、氧化数:⑴除零族元素外 ,常具有多种氧 化数, 除正氧化数外,还有负氧化数。
常温
Cl2 Br2 I2 ClO
BrO 3 IO 3
-
加热
ClO 3
-
低温 ClOO
PH 4
BrO 3 IO 3
-
-
BrO (0 C) PH 6
IO 3
-
PH 9
§ 11.1 p区元素概述
ⅠA
元素周期系的分区及各区的价电 子组态
ⅡA
0
ⅢA―ⅦA
S区
ⅢB―ⅦB
Ⅷ
ⅠB ⅡB
p 区
ns1–2
第11章
卤素
氧族元素
卤素
• 一. 卤素概述: • 1.第VIIA族包括氟、氯、溴、碘 和砹五种元素,总称为卤素。卤 素希腊原文为成盐元素的意思。。 • 砹是放射性元素,在自然界中仅 以微量而短暂地存在于镭、锕或 钍的蜕变产物中。
注意价电子结构和氧化数
2np5 2.价电子层结构:ns
• 导致非单质的氧化数: • 1)最低氧化数:-1 • 2)最高氧化数:F:-1;其它:+7 • 3) 氧化数都是奇数(为什么)
• 氧化还原性 F2
-
Cl2
Br2
I2
E (X 2 /X ) /V: 2.889 1.360 1.0774 0.5345
卤素单质卤素氢化物卤素碳化物的熔沸点

卤素单质卤素氢化物卤素碳化物的熔沸点卤素是周期表中第七族的元素,包括氟、氯、溴、碘和砹。
它们都是单质,性质非常活泼,常常与其他元素形成化合物。
其中,卤素氢化物和卤素碳化物是两类重要的化合物,它们具有特定的熔沸点,这些性质对于其在化学工业中的应用有着重要的意义。
首先,我们来看一下卤素单质的性质。
卤素单质是指卤素元素以自由的形式存在,具有活泼的化学性质。
在自然界中,卤素单质以分子形式存在,如氯气(Cl2)、溴蒸气(Br2)等。
这些卤素单质常常具有鲜明的颜色和刺激性气味,具有很高的蒸气压,易挥发。
它们在常温下多为二原子分子。
卤素单质是非金属元素,具有很强的氧化性,能与大多数金属发生反应,形成相应的卤化物。
卤素氢化物是一类由卤素与氢元素形成的化合物,如氟化氢(HF)、氯化氢(HCl)等。
这些化合物在化学工业中有着广泛的应用,用于制取其他化学品、用作溶剂、用于金属腐蚀等。
卤素氢化物的熔沸点因其种类而异,如氟化氢的熔点约为-83.6℃,沸点约为19.5℃;氯化氢的熔点约为-114℃,沸点约为-85℃。
可以看出,随着卤素原子量的增加,其氢化物的熔沸点也会相应增加。
这是由于卤素原子量的增加会使分子间的范德瓦尔斯力增强,从而导致氢化物分子间的相互作用增强,使其熔沸点升高。
卤素碳化物是一类由卤素与碳元素形成的化合物,如四氯化碳(CCl4)、三溴化碳(CBr3)等。
这些化合物在有机合成、溶剂、干洗剂等方面有着重要的应用。
卤素碳化物的熔沸点也因其种类而异,如四氯化碳的熔点约为-22.92℃,沸点约为76.72℃;三溴化碳的熔点一般在20-60℃之间,沸点则在100-150℃之间。
同样地,随着卤素原子量的增加,其碳化物的熔沸点也会相应增加。
这是由于卤素原子量的增加会使分子间的范德瓦尔斯力增强,从而导致碳化物分子间的相互作用增强,使其熔沸点升高。
综上所述,卤素氢化物和卤素碳化物的熔沸点取决于其分子间相互作用的强弱,而这又与卤素原子量有关。
卤素

常温 强光照射
Br2
常温 600C
I2
高温
爆炸、放出大量热
缓慢
爆炸
不如氯 明显
减 小
缓慢
10.2.1.3 与H2O反应
卤素与水可发生两类反应,分别是氧化作用和歧化作用:
(1)氧化作用 2X2 + 2H2O
4HX + O2↑
(2)歧化水解 X2 + H2O
H+ + X- + HXO
F2的氧化性强,只能与水发生第一类反应,且反应激烈:
主要氧化数
氟(F) 氯(Cl) 溴(Br) 碘(I)
9
17
35
53
2s22p5 3s23p5
4s24p5 5s25p5
64
99
114
133
4.0
3.0
2.8
2.5
1681 125非1 金属性1减140弱 1008
-1、0
-1、0
-1、0
-1、0 +1、+3 +5、+1、+3 +5、 +1、+3
+7
+7
力依次减弱:F2 > Cl2 > Br2 > I2
电极电势: F2/F-
Eθ (X2/X-) 2.87
Cl2/Cl1.36
Br2/Br- I2/I1.065 0.535
10.2.1.1 与金属、非金属反应
卤素
反应物质
所有金属
F2
除氮、氧外的非金属
Cl2 Br2 、I2
与上类似
活泼金属 其他金属
反应程度
10.3.2.2 还原性
卤素

单质氟的制备
1、单质氟的制备(P459图14-2) 、单质氟的制备 图
氯单质的发现
1、单质氯的发现:氯 、单质氯的发现: 是由瑞典化学家舍勒(C.W. 是由瑞典化学家舍勒 Scheele)在1774年用软锰矿 在 年用软锰矿 (MnO2)与盐酸反应而发现的, 与盐酸反应而发现的, 与盐酸反应而发现的 氯气为黄绿色, 氯气为黄绿色,所以氯一词 希腊文原意是黄绿色。 希腊文原意是黄绿色。
氟的特殊性
氟的原子半径特别小, 氟的原子半径特别小 , 其核周围电子密 度较大, 度较大 , 当它接受外来一个电子或共用 电子对成键时, 电子对成键时 , 将引起电子间较大的斥 力 , 这种斥力部分地抵消了气态氟形成 气态氟离子, 气态氟离子 , 或氟形成单质分子时所放 出的能量。所以氟的电子亲合势小于氯. 出的能量。所以氟的电子亲合势小于氯 尽管氟的电子亲合势反常 地小于氯, 但因F 地小于氯 , 但因 2 的离解 能较小, 能较小 , F- 离子的水合能 较大, 较大 , 所以氟在卤素中仍 然是个最强的氧化剂。 然是个最强的氧化剂。
单质的化学性质
2、氯(电极电势 、 电极电势=1.358V)也能与各种金属和大多 )也能与各种金属和大多
数非金属(除氮、 数非金属(除氮、氧、稀有元素外)直接化合,但有 稀有元素外)直接化合, 些反应需要加热,反应还比较剧烈。而氯与Co、 、 些反应需要加热,反应还比较剧烈。而氯与 、S、V 氧化为: 和Bi氧化为 氧化为 CoCl2,SCl4,VCl4,BiCl3(不是最高氧化态) , , , (不是最高氧化态)
卤
卤 素 通 性 卤 素 单 质 卤 化 氢 和 氢 卤 酸 卤 化 物 卤 素 互 化 物 多 卤 化 物 元 素 电 势 图
高一化学 卤素

高一化学卤素一、介绍卤素卤素是化学元素周期表第17族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素在自然界中广泛存在,并且常用于许多化学和生物学应用中。
在本文中,我们将对卤素的性质、用途以及相关实验进行探讨。
二、卤素的性质1. 卤素的物理性质卤素在常温下会呈现不同的物态。
氟气和氯气都是无色气体,而溴是深红色液体,碘是紫黑色固体,砹则是放射性的固体。
卤素的沸点和熔点随着原子序数的增加逐渐升高,同时密度也逐渐增加。
2. 卤素的化学性质卤素在化学反应中表现出一系列的特性。
它们可以与金属发生反应,并形成离子化合物。
例如,氯可以与钠发生反应,生成氯化钠。
另外,卤素还可以与非金属发生反应,并形成共价化合物。
例如,氟可以与氢发生反应,生成氟化氢。
三、卤素的应用1. 工业应用卤素在工业上有着广泛的应用。
氯被用于消毒水处理、漂白剂以及合成许多化合物的原料。
溴被广泛应用于制药和农业领域,用于消毒和灭虫。
碘被用于制备碘酒、碘盐和消毒剂。
砹在放射治疗中具有一定的应用价值。
2. 生物学应用卤素在生物学中也起着重要的作用。
氯化物是人体内必需的微量元素,对维持水盐平衡和神经、肌肉正常功能发挥着重要作用。
碘是甲状腺激素的重要组成部分,对身体的生长和代谢有着重要影响。
四、相关实验1. 氯离子的检测实验材料:稀盐酸(HCl)、银氨溶液(AgNO3)、氨水(NH3)实验步骤:a. 将少量的盐酸滴加到待检测的溶液中,观察是否产生气体释放。
b. 向溶液中加入几滴银氨溶液,观察是否产生白色沉淀。
c. 加入氨水后,观察沉淀是否溶解。
实验结果:a. 如果产生气体释放,可能是盐酸与氯化物反应产生氯气。
b. 如果产生白色沉淀,可能是盐酸与氯化物反应产生氯化银。
c. 沉淀溶解则表示盐酸与氯化物反应产生了可溶性的化合物。
2. 碘离子的检测实验材料:稀盐酸(HCl)、硫酸(H2SO4)、淀粉溶液实验步骤:a. 将待检测溶液加热,观察是否发生变色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五、从海水中提取的元素——溴和碘 从海水中提取的元素 溴和碘
1.从海水中提取溴 1.从海水中提取溴 原理: 氧化为Br 原理:将Br-氧化为Br2 三个步骤:浓缩、氧化、 三个步骤:浓缩、氧化、提取
晒盐提取NaCl后 NaCl 简单流程:海水 晒盐提取NaCl后 -苦卤 简单流程: 提取KCl后 提取KCl后 KCl
6.一种分离物质的方法——萃取:课本P40 6.一种分离物质的方法——萃取:课本P40 一种分离物质的方法——萃取 萃取的条件: 萃取的条件: 溶质在两种溶剂中的溶解度不 (1)溶质在两种溶剂中的溶解度不 (1) 同,相差越大越好。 相差越大越好。 (2)两种溶剂互不相溶。 (2)两种溶剂互不相溶。 两种溶剂互不相溶 分液——把两种互不相溶(分层) 分液——把两种互不相溶(分层)的液体进行分 ——把两种互不相溶 离的操作。 离的操作。 *分液操作时,下层液体从分液漏斗下端流出, 分液操作时,下层液体从分液漏斗下端流出, 上层液体从分液漏斗上口倒出。 上层液体从分液漏斗上口倒出。
VH2O:VCl2 = 1:2
* 氯水应密闭保存在棕色试剂瓶中
2.溴 2.溴(Br2)的物理性质 状态: 液体, 状态: 液体,易挥发 颜色: 颜色: 气味: 气味: 毒性: 毒性: 深棕红色, 深棕红色,蒸气为红棕色 刺激性 有毒, 有毒,会严重灼伤皮肤
溶解性: 微溶于水,易溶于有机溶剂 溶解性: 微溶于水, 溴的水溶液——溴水:橙黄色 溴水: * 溴的水溶液 溴水 液溴和溴水应密闭保存在棕色试剂瓶中; * 液溴和溴水应密闭保存在棕色试剂瓶中;液溴 需水封以减少挥发
§2-3 从海水中提取溴和碘
卤族元素(卤素)的单质分子都是双原子分子(X 卤族元素(卤素)的单质分子都是双原子分子(X2)
一、卤素单质的物理性质(常温、常压下) 卤素单质的物理性质(常温、常压下)
1.氯 1.氯(Cl2)的物理性质 状态: 状态: 气体 颜色: 颜色: 黄绿色 气味: 气味: 刺激性 毒性: 毒性: 有毒 溶解性: 溶解性:能溶于水
想一想:氟能否将氯离子从溶液中置换出来? 想一想:氟能否将氯离子从溶液中置换出来?
2.卤素 卤素 X2(g) + H2(g) → 2HX(g)
【推测1】 推测1 (1)卤素与氢气反应的条件 越来越高, 卤素与氢气反应的条件: (1)卤素与氢气反应的条件:越来越高,即反应由易到难 (2)反应的程度 反应的程度: (2)反应的程度: 由剧烈到缓和, 由剧烈到缓和,程度越来越小 (3)反应的热效应 反应的热效应: (3)反应的热效应: 放出的热量有多到少 (4)产物的稳定性 产物的稳定性: (4)产物的稳定性: 由大到小 【推测2】氯、溴、碘跟水反应的程度 推测2
3.碘 3.碘(I2)的物理性质 状态: 状态: 固体 颜色: 紫黑色, 颜色: 紫黑色,蒸气为紫红色 气味: 刺激性(蒸气) 气味: 刺激性(蒸气) 毒性: 毒性较小(蒸气) 毒性: 毒性较小(蒸气) 溶解性: 几乎不溶,易溶于有机溶剂 溶解性: 几乎不溶, 碘的水溶液——碘水:棕黄色 碘水: * 碘的水溶液 碘水 * 碘和碘水应密闭保存在棕色试剂瓶中 碘的特性: 遇淀粉变蓝; 易升华。 * 碘的特性:①遇淀粉变蓝;②易升华。 想一想:如何将混入砂子中的(或与NaCl固体混 想一想:如何将混入砂子中的(或与NaCl固体混 NaCl 合的)碘提取出来? 合的)碘提取出来?
3.卤化银(AgX)的不稳定性——感光性 3.卤化银(AgX)的不稳定性——感光性 卤化银(AgX)的不稳定性—— AgX见光分解: AgX见光分解:2AgX 见光分解
光照
2Ag + X2
(1)AgX感光性的应用: (1)AgX感光性的应用: 感光性的应用 AgCl—— ——指纹显影 AgCl——指纹显影 AgBr——制摄影胶卷和感光纸 AgBr——制摄影胶卷和感光纸 —— ——变色镜 AgX ——变色镜 (2)AgI的用途: (2)AgI的用途:人工降雨 的用途
*3.卤素(X )都能与金属反应 3.卤素 2 卤素(X +2e 卤化物) X2 2X-(卤化物)
三、卤素化合物的化学性质
1.卤化氢(HX)的性质 1.卤化氢(HX)的性质 卤化氢(HX) (1)卤化氢均为无色, (1)卤化氢均为无色,刺激性气体 卤化氢均为无色 (2)卤化氢均极易溶于水,生成氢卤酸, (2)卤化氢均极易溶于水,生成氢卤酸,故易在空 卤化氢均极易溶于水 气中形成白雾(酸雾) 气中形成白雾(酸雾)
提取
海洋植物
晒干、灼烧、 晒干、灼烧、浸泡 蒸馏, 蒸馏,提纯
I-(aq) I2
加入CCl4, Cl2氧化 加入CCl4,通Cl2氧化 CCl4
I2(CCl4)
反应式:Cl2 + 2I- → I2 + 2Cl反应式:
四、卤素与人体健康 卤素的应用
1.氟——人体必需的微量元素 1.氟——人体必需的微量元素 人体必需的微量 2.氯——人体必需的大量元素 人体必需的大量 2.氯——人体必需的大量元素 3.溴——人的神经系统对溴的化合物很敏感 3.溴——人的神经系统对溴的化合物很敏感 4.碘——人体必需的微量元素 人体必需的微量 4.碘——人体必需的微量元素 5.含氟化合物的应用 5.含氟化合物的应用 (1)“特氟龙 特氟龙” (1)“特氟龙” (2)氟利昂 (2)氟利昂 (3)含氟橡胶 (3)含氟橡胶 (4)含氟牙膏 (4)含氟牙膏 6.含溴化合物的应用:课本P39/图 6.含溴化合物的应用:课本P39/图2.18 含溴化合物的应用 P39/
Br :0.067g/L
2.5Br :2.5-3g/L
浓苦卤
精制
通Cl2氧化 Cl2氧化
Br-:6g/L
仍在苦卤中
Br2
鼓入热空气或水蒸气, 鼓入热空气或水蒸气,冷凝
粗Br2
高纯度Br 高纯度Br2
反应式: 反应式:Cl2 + 2Br- → Br2 + 2Cl-
2.从海带中提取碘 2.从海带中提取碘 原理: 氧化为I 原理:将I-氧化为I2 简单流程: 简单流程:海水
试一试:能否根据氯、 试一试:能否根据氯、溴、碘的物理性质推测氟 的物理性质? 的物理性质? 4.氟 4.氟(F2)的物理性质 状态: 状态: 气体 颜色: 颜色: 很淡的黄绿色 气味: 刺激性 气味: 毒性: 毒性: 剧毒 溶解性: 与水剧烈反应 溶解性: *常温、黑暗下:2F2 + 2H2O → 4HF + O2 常温、黑暗下: 置换出O 活泼性: ∴ F2置换出O2,活泼性:F2 ﹥ O2
二、卤素单质的化学性质
1.氯 1.氯、溴、碘的活泼性 现有化学试剂: 试 现有化学试剂:氯水 溴水 碘水 四氯化碳 一 NaCl(aq) NaBr(aq) KI(aq) 试 设计实验方案:证明卤素单质的活泼性。 设计实验方案:证明卤素单质的活泼性。
Cl2 + 2NaBr → 2NaCl + Br2 Cl2 + 2KI → 2KCl + I2 Br2 + 2KI → 2KBr + I2 非金属单质的活泼性 F2 > Cl2 > Br2 > I2
2.可溶性卤化物(X 2.可溶性卤化物(X-)的检验 可溶性卤化物 问题:溶液中加入AgNO (aq)产生白色沉淀 产生白色沉淀, 问题:溶液中加入AgNO3(aq)产生白色沉淀,是 否一定含有Cl 否一定含有Cl-? 方法1:HNO3酸化的AgNO3溶液——检验Cl-、Br-、I酸化的AgNO 溶液——检验Cl ——检验 方法1 方法2 氯水和CCl ——检验 检验Br 方法2:氯水和CCl4——检验Br-、I* 还能用淀粉显示I2的存在 还能用淀粉显示I
