家兔膈肌放电与呼吸运动
实验十家兔呼吸运动的调节解读

实验十家兔呼吸运动的调节2005级生物科学(1)班赵银锁(40508010)一、实验目的1.学习气管插管的方法;2.学习记录呼吸运动的方法和膈肌放电的引导方法;3.观察观察并分析肺牵张反射以及影响呼吸运动各种因素。
二、实验动物与器材1.实验动物:家兔;2.实验器材:兔体手术台、常用手术器械、动物呼吸传感器(张力传感器)、引导电极、计算机采集系统、气管插管、注射器、橡皮管、20%氨基甲酸乙酯、生理盐水。
三、实验步骤1. 麻醉→背位固定→剪去颈部与剑突腹面的被毛→切开颈部皮肤→分离气管→分离双侧迷走神经,穿线备用→插入气管插管。
2. 剑突软骨分离术切开胸骨下端剑突部位的皮肤,并沿腹白线再切开长约2cm的切口。
细心分离剑突表面的组织,并暴露剑突软骨,提起剑突,可见剑突随膈肌的收缩而自由运动。
3. 将系有棉线的金属钩钩于剑突中间部位,线的另一端系于张力传感器的应变梁上。
4. 开启计算机采集系统,“呼吸-同步记录”,调节记录系统,使呼吸曲线清楚地显示在显示器上。
5. 剪掉腹部的被毛,切开腹部皮肤,从腹白线切开腹部肌肉,用针形记录电极插入膈肌,6 观察记录膈肌放电(1)记录正常的呼吸运动、膈肌放电,注意分清呼气和吸气运动与曲线的方向。
(2)增加无效腔对呼吸运动的影响将长约0.5m、内径1cm的橡皮管连于气管插管的一个侧管上,用止血钳夹闭另一侧管,使无效腔增加,观察并记录呼吸运动的改变,一旦出现明显变化,则立即打开止血钳,去除橡皮管,待呼吸恢复正常。
(3)增加气道阻力对呼吸运动的影响待呼吸运动恢复正常后,将气管插管的两个侧管同时夹闭数秒钟,观察呼吸变化。
方法与步骤观察项目(4)肺牵张反射在气管插管的一个侧管上,连通一个20ml注射器,并吸入20ml空气。
待呼吸运动平稳后,在吸气末用相当正常呼吸时三个呼吸节律的时间,徐徐向肺内注入20ml 空气,同时夹闭气管插管的另一侧管。
注意观察呼吸节律的变化及呼吸运动的状态。
膈肌放电_实验报告

一、实验目的1. 通过观察膈肌放电,加深对呼吸运动中枢起源和调节机制的认识。
2. 了解膈神经和膈肌放电在呼吸运动中的作用。
二、实验原理呼吸运动是由呼吸中枢节律性活动引起的,这种活动通过膈神经和肋间神经传导至膈肌和肋间肌,从而产生节律性的呼吸运动。
本实验通过记录膈神经和膈肌放电,反映呼吸中枢的活动和外界刺激对呼吸运动的调节作用。
三、实验材料1. 家兔一只2. 信号处理系统、示波器、前置放大器、监听器、哺乳类动物手术器材一套3. 引导电极及固定架、注射器(30ml、20ml、1ml)、装有CO2的气囊、玻璃分针4. 20%氨基甲酸乙酯、生理盐水和医用液体石蜡加温至38~40℃、尼可刹米注射液四、实验步骤1. 麻醉和固定:用20%氨基甲酸乙酯麻醉家兔,进行气管插管,固定于手术台上。
2. 分离迷走神经:在颈部分离双侧迷走神经,并各穿一细线打松结备用。
3. 分离膈神经:在胸部分离膈神经,并安置记录电极。
4. 暴露膈肌:在腹部暴露膈肌,并安置记录电极。
5. 连接信号处理系统:将引导电极连接至信号处理系统,调整放大器增益、高频滤波和时间常数等参数。
6. 观察正常膈肌放电活动:记录正常情况下膈肌放电活动,分析呼吸频率和呼吸幅度。
7. 增加无效腔:连接长橡皮管,观察膈肌放电活动变化。
8. 吸入CO2:向气囊中充入CO2,观察膈肌放电活动变化。
9. 肺牵张反射:在吸气末注入20ml空气,在呼气末抽出20ml空气,观察膈肌放电活动变化。
10. 切断双侧迷走神经:切断双侧迷走神经,观察膈肌放电活动变化。
五、实验结果1. 正常膈肌放电活动:在正常麻醉状态下,实验动物保持平稳的呼吸节律,曲线疏密反映呼吸频率,曲线高度反映呼吸幅度。
2. 增加无效腔:连接长橡皮管后,膈肌放电活动频率降低,呼吸幅度减小。
3. 吸入CO2:吸入CO2后,膈肌放电活动频率增加,呼吸幅度增大。
4. 肺牵张反射:在吸气末注入空气,膈肌放电活动频率降低,呼吸幅度减小;在呼气末抽出空气,膈肌放电活动频率增加,呼吸幅度增大。
膈神经实验报告

实验日期:2023年11月15日实验对象:成年家兔实验目的:1. 观察膈神经的解剖结构和功能。
2. 研究膈神经放电活动的特征及其与呼吸节律的关系。
3. 探讨膈神经在呼吸调节中的作用。
实验原理:膈神经是人体重要的神经之一,起源于颈3、颈4、颈5神经前支,负责支配膈肌的运动,从而参与呼吸调节。
本实验通过观察膈神经放电活动,分析其与呼吸节律的关系,探讨膈神经在呼吸调节中的作用。
实验方法:1. 实验动物准备:选用成年家兔一只,体重约2kg,雌雄不限。
2. 麻醉与固定:使用25%乌拉坦溶液(1g/kg)进行耳缘静脉注射,待动物麻醉后,将其固定于实验台上。
3. 解剖与暴露:沿颈部正中线切开皮肤,暴露颈总动脉、迷走神经和膈神经。
在颈4、颈5神经前支处找到膈神经起始部,并将其分离出来。
4. 信号采集:使用微电极插入膈神经,记录膈神经放电活动。
同时,使用呼吸监测仪记录动物的呼吸节律。
5. 数据处理:将膈神经放电活动与呼吸节律进行同步分析,探讨其关系。
实验结果:1. 膈神经解剖结构:膈神经起源于颈3、颈4、颈5神经前支,在颈部下行过程中,与颈总动脉、迷走神经和交感神经相伴行。
在进入胸部后,膈神经分为左右两支,支配膈肌的运动。
2. 膈神经放电活动:在正常呼吸过程中,膈神经放电活动呈现出规律性,与呼吸节律同步。
当动物呼吸加深加快时,膈神经放电频率增加;当呼吸减慢变浅时,膈神经放电频率降低。
3. 膈神经与呼吸节律的关系:通过同步分析膈神经放电活动与呼吸节律,发现膈神经放电活动与呼吸节律具有高度一致性。
当呼吸节律发生变化时,膈神经放电活动也随之改变。
实验结论:1. 膈神经是人体重要的神经之一,起源于颈3、颈4、颈5神经前支,负责支配膈肌的运动,从而参与呼吸调节。
2. 膈神经放电活动与呼吸节律具有高度一致性,当呼吸节律发生变化时,膈神经放电活动也随之改变。
3. 膈神经在呼吸调节中起着重要作用,其放电活动与呼吸节律的同步性可能是呼吸调节的重要机制之一。
家兔呼吸运动的调节.

肺容积
肺容积有4部分:
– 潮气量:平静呼吸时,每次吸入或呼出的气体量。 – 补吸气量:平静吸气末再用力吸入的最大气量。 – 补呼气量:平静呼气末再用力呼出的气量。 – 余(残)气量: 用力呼气后,仍然残留在肺内无法呼 出的气量。 肺活量:潮气量、补吸气量和补呼气量总称为肺活量 无效腔:呼吸时存在于呼吸道内的气量
2. 剑突软骨分离术 切开胸骨下端剑突部位的皮肤,并 沿腹白线再切开长约2cm的切口。细心分离剑突表面的 组织,并暴露剑突软骨。
方法与步骤
3. 将系有棉线的金属钩钩于剑突中间部位,线的另一端 系于张力传感器的应变梁上。
4. 开启计算机采集系统,接通张力传感器的输入通道,
调节记录系统,使呼吸曲线清楚地显示在显示器上。 同时记录膈肌放电。
动物与器材
家兔
兔体手术台、常用手术器械、动物呼吸传感器 (张力传感器)、压力传感器、引导电极、刺 激电极、计算机采集系统、气管插管、动脉夹、 注射器、橡皮管、20%氨基甲酸乙酯、生理盐 水、肝素、石蜡油。
方法与步骤
本实验通过张力传感器记录膈肌的运动。
1. 将动物麻醉后,背位固定于手术台上。剪去颈部与剑 突腹面的被毛,切开颈部皮肤,分离气管并插入气管插 管。 再分离出一侧颈总动脉与双侧迷走神经, 穿线备用。
(4)待呼吸运动恢复正常后,结扎颈部单侧迷走神经, 观察并记录呼吸运动和血压的变化。再结扎另一侧 迷走神经,观察并记录呼吸运动和血压的变化。 (5)分别刺激迷走神经中枢端与外周端,观察并记录 呼吸运动和血压的变化。
注意事项
分离剑突表面的组织时勿伤及胸腔。 肺牵张反射时注意,注气与抽气时间仅限于三个呼 吸节律的时间,然后立即打开夹闭的侧管。 结扎迷走神经时,第一结一定要紧、狠,务必阻断 神经冲动的传导。
生理因素及药物对呼吸运动及膈神经放电的影响实验报告 (完整版)

家兔呼吸运动的调节实验目的:1.用气管插管描记呼吸流量间接反映家兔呼吸运动(呼吸频率、节律、幅度)的方法,研究吸入二氧化碳、静脉注射乳酸溶液、增大解剖无效腔以改变血液中二氧化碳浓度、氧气浓度、[H+]和气道阻力、切断颈部迷走神经、电刺激迷走神经中枢端对呼吸运动的影响并初步探讨其作用部位,并分析机制。
2.掌握气管插管术和神经血管分离术。
实验材料:对象:家兔;试剂:20g/L 乳酸溶液,氨基甲酸乙酯;仪器:RM6240生物信号采集系统,手术器械一套,兔手术台,T型气管插管,注射器,50cm长橡皮管一条,CO2气袋,丝线,铁架台,婴儿秤,呼吸换能器,电刺激连线。
实验方法:1.麻醉固定:家兔称重后,将氨基甲酸乙酯以5ml/kg 的体重剂量由兔耳缘静脉内缓慢注入,注意观察家兔的反应。
待麻醉后,将家兔仰卧固定于兔手术台上,先后固定四肢及兔头。
2.手术:剪去家兔颈部的被毛,沿颈部正中线作一长6~7cm的切口,用止血钳钝性分离皮下组织,暴露并游离气管,并于气管下穿线备用。
在气管两侧肌肉深面颈动脉鞘内分离迷走神经,并在其下穿线备用。
在甲状软骨下第4~5个气管软骨处作一“⊥”形切口。
将T型气管插管向肺的方向插入气管内,用预留备用线线结扎固定。
手术完毕后用纸巾擦拭手术伤口部位。
3.观察准备:用皮管连接气管插管和呼吸换能器。
打开呼吸换能器,启动计算机RM6240生物信号采集系统,点击“实验”菜单,选择“呼吸运动调节”,双击一通道,调节增益、采样参数,使基线归零,令图形位于屏幕中央,便于观察。
4.观察项目(1)记录正常呼吸曲线作为对照,辨认曲线上呼气、吸气的波形方向。
(2)在气管插管一个侧管上接一根长50cm胶管(流量法:接通气口),观察和记录呼吸运动的变化。
(3)增加吸入气中CO2浓度:待呼吸曲线恢复正常,将装有CO2气袋的皮管口移近气管插管的侧管,打开皮管夹子,使吸入气中含有较多的CO2。
记录并观察吸入高浓度的CO2对呼吸运动的影响。
实验四 膈肌放电

[H+]↑
4. 增大无效腔
PO2↓、 PCO2↑
肺扩张
刺激 牵拉呼吸道(吸气)
肺缩小
肺缩小(呼气)
感受器(呼吸道) 传入/出神经 呼吸中枢(延髓)
效应 意义
兴奋性↑ 迷走神经兴奋性↑ 抑制吸气神经元活动
吸气停止,转为呼气
兴奋性↓ 迷走神经兴奋性↓ 吸气神经元活动↑
转为吸气
(负反馈调节)阻止吸气过深过长,促使吸气转 为呼气,调节呼吸频率和深度
观察各种刺激对呼吸运动的影响
1. 吸入CO2
2. 窒息
3. 注射乳酸
PO2↓、 PCO2↑
[H+]↑
4. 增大无效腔 PO2↓、 PCO2↑
5. 肺牵张反射(肺扩张 和 肺萎缩)
观察各种刺激对呼吸运动的影响
1. 吸入CO2
2. 窒息
3. 注射乳酸
PO2↓、 PCO2↑
[H+]↑
4. 增大无效腔 PO2↓、 PCO2↑ 5. 肺牵张反射(肺扩张 和 肺萎缩)
注意:
内壁必须清理干净后才能进行插管。
“⊥”形口
5. 气管插管。
3.分离迷走神经:在左右迷走神经下各备2根线
颈总动脉 交感神经
减压神经 迷走神经 最粗
颈动脉鞘
4. 连接电极,记录膈肌放电 。
• 切开胸骨下端剑突部位的皮肤,沿腹白线剪 开约5 cm小口。 •打开腹腔,暴露与之相连的膈肌
• 将 2根针形电极 插入膈肌上,注意不要扎穿. • 地线端:夹住腹部皮肤即可
膈肌
5. 连接张力换能器,记录呼吸运动。
用弯钩针在剑突上皮肤穿一线并固定,线 的另一端则连至张力传感器,线与腹部垂 直,并使张力合适。 注意:
家兔膈肌放电实验报告

一、实验目的1. 了解家兔膈肌放电的生理特性,观察其放电活动与呼吸运动的关系。
2. 掌握膈肌放电实验的操作步骤,提高实验技能。
3. 分析影响家兔膈肌放电活动的因素,为研究呼吸运动调控提供实验依据。
二、实验原理家兔膈肌放电是反映呼吸运动的重要指标,其放电活动与呼吸运动呈正相关。
通过记录膈肌放电,可以分析呼吸运动的节律、频率和强度等生理特性。
本实验采用家兔作为实验动物,通过手术暴露膈肌,记录膈肌放电活动,观察其放电与呼吸运动的关系。
三、实验材料与仪器1. 实验动物:家兔(体重2-3kg);2. 仪器:手术显微镜、手术器械、生理盐水、生理盐水灌流装置、引导电极、放大器、示波器、计算机采集系统、气管插管、注射器等;3. 试剂:20%氨基甲酸乙酯、生理盐水、生理盐水灌流液等。
四、实验步骤1. 家兔麻醉:采用20%氨基甲酸乙酯进行麻醉,剂量为1g/kg,耳缘静脉注射;2. 家兔固定:将家兔仰卧固定在手术台上,充分暴露颈部和胸部;3. 分离膈神经:在颈部分离膈神经,并穿线备用;4. 暴露膈肌:在胸部切开皮肤和肌肉,暴露膈肌;5. 安置引导电极:将引导电极插入膈肌,记录膈肌放电活动;6. 记录膈肌放电:连接放大器、示波器和计算机采集系统,记录膈肌放电活动;7. 观察并分析膈肌放电活动:观察膈肌放电与呼吸运动的关系,分析放电活动的节律、频率和强度等生理特性;8. 恢复实验动物:完成实验后,将实验动物恢复至正常状态。
五、实验结果与分析1. 膈肌放电与呼吸运动的关系:在实验过程中,观察膈肌放电与呼吸运动呈正相关,即膈肌放电活动增强时,呼吸运动加剧,放电活动减弱时,呼吸运动减弱;2. 膈肌放电活动的节律:在正常生理状态下,膈肌放电活动呈现一定的节律性,放电频率约为每分钟15-20次;3. 膈肌放电活动的频率和强度:在实验过程中,通过改变呼吸频率和深度,观察膈肌放电活动的频率和强度变化。
结果显示,呼吸频率和深度增加时,膈肌放电活动的频率和强度也随之增加;4. 影响膈肌放电活动的因素:实验中发现,以下因素可影响膈肌放电活动:a. 麻醉深度:麻醉深度过深或过浅均会影响膈肌放电活动;b. 膈神经损伤:膈神经损伤会导致膈肌放电活动减弱或消失;c. 呼吸道阻塞:呼吸道阻塞会导致膈肌放电活动减弱或消失;d. 肺部疾病:肺部疾病可导致膈肌放电活动异常。
家兔呼吸运动的调节

家兔呼吸运动的调节【目的要求】1.学习测定兔呼吸运动的方法。
2.学习记录膈肌放电的方法。
3.观察并分析肺牵张反射以及影响呼吸运动的各种因素。
【实验基本原理】呼吸运动是呼吸肌的舒缩运动,是呼吸肌(胸壁上的肋间肌和隔肌)在神经系统控制下进行的有节律的收缩和舒张造成的。
膈肌的收缩活动受来自中枢的传出神经支配,传出冲动的节律与频率,影响膈肌的收缩节律、频率与强度.人体及高等动物的呼吸运动所以能持续地节律性地进行,是由于体内调节机制的存在。
体内、外的各种刺激,可以直接作用于中枢或不同的感受器,反射性地影响呼吸运动,以适应机体代谢的需要。
肺牵张反射是保证呼吸运动节律的机制之一。
血液中CO2分压的改变,通过对中枢性与外周性化学感受器的刺激及反射性调节,是保证血液中气体分压稳定的重要机制。
【实验动物与器材】实验动物:家兔实验工具:兔体手术台、常用手术器械、张力传感器、引导电极、计算机采集系统、气管插管、注射器、橡皮管实验试剂:20%氨基甲酸乙酯、生理盐水【实验方法与步骤】1. 麻醉→背位固定→剪去颈部与剑突腹面的被毛→切开颈部皮肤,分离气管并插入气管插管→分离出双侧迷走神经,穿线备用。
气管务必分离干净,插管后务必扎紧,避免漏气2. 剑突软骨分离术切开胸骨下端剑突部位的皮肤,并沿腹白线再切开长约2cm的切口。
细心分离剑突表面的组织,并暴露剑突软骨与骨柄。
提起剑突,可见剑突随膈肌的收缩而自由运动。
3. 将系有剑突的金属钩钩于剑突中间部位,线的另一端系于张力传感器的应变梁上。
4. 开启计算机采集系统,接通张力传感器的输入通道,调节记录系统,使呼吸曲线清楚地显示在显示器5. 记录膈肌放电.【实验观察项目】(1)记录正常的呼吸运动、膈肌放电曲线,注意分清呼气和吸气运动与曲线的方向。
(2)增加无效腔对呼吸运动的影响将长约0.5m、内径1cm的橡皮管连于气管插管的一个侧管上,用止血钳夹闭另一侧管,使无效腔增加,观察并记录呼吸运动的改变,一旦出现明显变化,则立即打开止血钳,去除橡皮管,待呼吸恢复正常。
生理学实验5-2 家兔呼吸运动的影响因素观测

实验5-2 家兔呼吸运动的影响因素观测一、目的要求1. 学习记录家兔呼吸运动的方法。
2. 观察并分析肺牵张反射及其他因素对呼吸运动的影响。
二、基本原理人体及高等动物的呼吸运动所以能持续地、节律性地进行,是由于体内调节机制的存在。
正常节律性呼吸运动是在中枢神经系统参与下,通过多种传入冲动的作用,反射性调节呼吸的频率和深度来完成的。
体内外的各种刺激,可以直接作用于中枢或不同的感受器,反射性地影响呼吸运动,以适应机体代谢的需要。
肺的牵张反射参与呼吸节律的调节。
三、实验材料家兔,家兔手术台,手术器械,带输液管的粗针头,张力传感器与滑轮或,压力传感器,生理信号采集系统,20ml注射器,橡皮管(长1.5m,内径1cm),纱布,3%乳酸溶液,50mg/ml尼可刹米注射液,生理盐水。
四、方法与步骤依实验4-8的方法,将动物麻醉、固定,进行颈部气管及神经分离术,插入气管插管,分离出一侧颈总动脉和双侧迷走神经,穿线备用。
1.剑突软骨手术。
2.开启计算机采集系统。
3.将系有长线的金属钩,钩住游离的剑突软骨中间部位,线的另一端通过万能滑轮系于张力传感器的应变梁上,然后把张力传感器与采集系统第1通道连接。
4.将粗针头上的输液管与压力传感器相通,剪开右侧胸部下方的皮肤,在右腋前线第4、5肋骨之间将针头垂直刺入胸膜腔内。
将压力传感器的侧支封闭,然后与采集系统第2通道连接,注意:针头的斜面应朝向头侧。
刺入时可先用较大的力量穿透皮肤,然后控制进针力量,以防进针过深。
5.点击采集系统菜单“输入信号”,输入“1通道-呼吸,2通道-压力”,调节系统参数,使呼吸曲线清楚地显示在显示器上,而压力扫描曲线随呼吸搏动而变化。
6.实验观察(1)记录平静呼吸的运动曲线的大小,并仔细识别吸气或呼气运动与曲线方向的关系。
(2)增加无效腔对呼吸运动的影响。
(3)气道阻力对呼吸运动的影响。
(4)肺牵张反射对呼吸运动的影响。
(5)血中H+增多对呼吸运动的影响。
家兔膈神经放电实验中常见问题的解决方法以及与膈肌放电、呼吸运动的同步记录
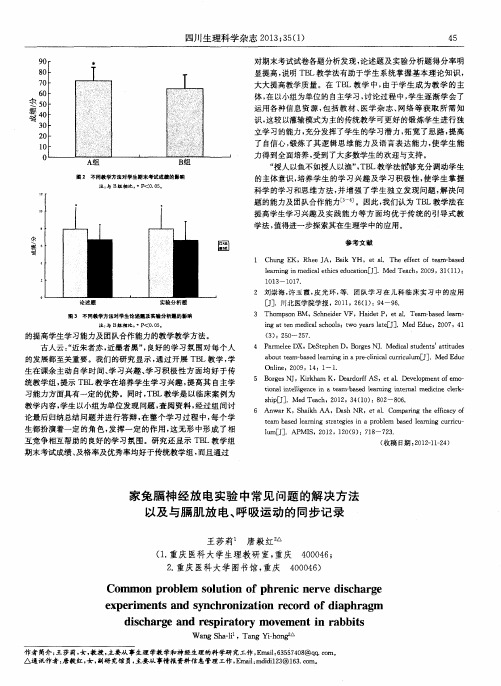
了自信心 , 锻炼 了其 逻辑思 维能 力及语 言表达 能力 , 使学 生能
A组 B组
力得到全面培养 , 受到 了大多数学生的欢迎与支持 。 “ 授人 以鱼不如授人以渔” , T B L教学法胄 够充 分调动学生 的主体意识 , 培养学生 的学 习兴趣 及学 习积极 性 , 使 学生 掌握 科学的学习和思 维方法 , 并 增强 了学生 独立发 现问题 , 解决 问 题 的能力及 团队合作能力 _ 5 —3 。因此 , 我们认为 TB L教学法在 提高学 生学 习兴趣 及实 践能力 等方 面均优 于传统 的引导式 教
圈 2 不 同教学方法对学生期 末考试成绩 的影 响
注: 与 B组相 比, *P <0 . 0 5 。
学法 , 值得进一步探 索其在 生理学 中的应用 。
圜
参 考 文献
1 C h u n g E K,Rh e e J A,B a l k YH,e t a 1 . Th e e f f e c t o f t e a m- b a s e d
a b o u t t e a m - b a s d e l e a r n i g n i n a p r e - c l i n i c a l c u r r i c u l u m [ J ] . Me d E d u c
On l i n e,2 0 0 9,1 4:1 —1 .
圈 3 不同教学方法对学生论述墨殛实验分析墨的彰响
注: 与 B姐 相 比 , *P <0 . 0 5 。
i n g a t t e n me di c a l s c h o o l s : t w o y e a r s l a t e [ J 3 . Me d E d u c , 2 0 0 7 , 4 1
家兔膈神经实验报告

一、实验目的1. 了解膈神经的解剖结构及其在呼吸运动中的作用。
2. 掌握观察膈神经放电的方法和技巧。
3. 分析膈神经放电与呼吸运动之间的关系。
二、实验原理膈神经是混合神经,由躯体运动纤维和内脏感觉纤维组成。
躯体运动纤维支配膈肌,使膈肌收缩,参与呼吸运动;内脏感觉纤维则将膈肌和胸膜等部位的感觉信息传入中枢。
本实验通过观察膈神经放电,了解膈肌的活动规律及其与呼吸运动的关系。
三、实验材料与仪器1. 实验动物:家兔2. 实验仪器:手术台、常用手术器械、张力传感器、引导电极、计算机采集系统、气管插管、注射器、橡皮管、生理盐水、25%乌拉坦等。
四、实验方法与步骤1. 麻醉与固定:用25%乌拉坦溶液(1g/kg体重)对家兔进行耳缘静脉注射麻醉,麻醉后固定于手术台上。
2. 剪毛与切口:在颈部剪去被毛,沿颈正中切开皮肤约5-7cm。
3. 分离膈神经:在颈总动脉、迷走神经和交感神经之间分离出膈神经,清除附着的脂肪或结缔组织。
4. 连接电极:将引导电极插入膈神经,另一端连接到计算机采集系统。
5. 插入气管插管:分离气管,插入气管插管,以保持呼吸道通畅。
6. 记录膈神经放电:打开计算机采集系统,观察膈神经放电波形,记录放电频率、幅度和波形特征。
7. 观察呼吸运动:观察家兔呼吸运动的变化,记录呼吸频率、幅度和节律。
8. 实验结束:实验结束后,拔除气管插管,缝合切口,给予家兔适量的生理盐水,观察其恢复情况。
五、实验结果与分析1. 膈神经放电波形:在实验过程中,膈神经放电波形表现为一系列的脉冲波形,放电频率与呼吸频率一致。
2. 膈神经放电幅度:膈神经放电幅度在不同呼吸阶段有所变化,吸气时放电幅度较大,呼气时放电幅度较小。
3. 膈神经放电与呼吸运动的关系:观察结果显示,膈神经放电与呼吸运动密切相关。
在吸气过程中,膈神经放电频率增加,幅度增大;在呼气过程中,膈神经放电频率降低,幅度减小。
六、实验结论1. 膈神经在呼吸运动中起着至关重要的作用,其放电活动与呼吸运动密切相关。
家兔呼吸运动的调节

华南师范大学实验报告学生姓名:谭晓东学号:20102501024专业:生物科学年级、班级:10科四课程名称:动物生理学实验实验项目:家兔呼吸运动调节实验类型:验证实验时间:2013年5月7日实验指导老师:黄俊柅实验评分:1. 实验目的1.1学习测定兔呼吸运动的方法。
1.2学习记录膈肌放电的方法。
1.3观察并分析肺牵张反射以及影响呼吸运动的各种因素。
2.实验原理呼吸运动是呼吸肌的舒缩运动,是呼吸肌(胸壁上的肋间肌和隔肌)在神经系统控制下进行的有节律的收缩和舒张造成的。
膈肌的收缩活动受来自中枢的传出神经支配,传出冲动的节律与频率,影响膈肌的收缩节律、频率与强度. 人体及高等动物的呼吸运动所以能持续地节律性地进行,是由于体内调节机制的存在。
体内、外的各种刺激,可以直接作用于中枢或不同的感受器,反射性地影响呼吸运动,以适应机体代谢的需要。
肺牵张反射是保证呼吸运动节律的机制之一。
3. 实验材料3.1.实验对象:家兔3.2.实验器材:兔手术台、常规手术器械、金冠剪、手术剪、手术刀、眼科镊、眼科剪、玻璃分针、棉花、纱布、棉线、小弯钩、烧杯、污物缸、塑料绳、长塑料管、棉签、20ml 注射器、5ml注射器、1ml注射器、照明灯、保护电极、滑轮、支架、PowerLab生理实验系统、气管插管、张力传器感3.3.实验试剂:麻醉剂(2%戊巴比妥钠 2ml/Kg )、生理盐水、50mg/ml尼可刹米注射液4. 实验步骤4.1. 家兔麻醉固定:称重,耳缘静脉注射麻药,固定、剪颈部皮毛和胸部剑突位置皮毛。
4.2. 颈部气管及神经分离手术:钝性分离颈部肌肉等组织,暴露气管、穿线、手术刀手术剪T形切口,事先准备好的棉签将气管中的血块弄出,插好气管插管并结扎。
分离双侧迷走神经,分别穿2线备用。
4.3. 剑突软骨分离手术:切开剑突位置皮肤约2cm,细心分离剑突软骨周边组织,暴露剑突软骨,剪断骨柄,保留骨柄下方膈肌与剑突相连。
4.4. 连接实验装置:连接好PowerLab实验装置,用棉线上的小弯钩勾住剑突,通过滑轮与张力换能器连接,调节好力度大小,设置调节通道2桥式放大器(5mV,10Hz)和刺激器(100脉冲,1V,1mS,40Hz)。
家兔呼吸运动的调节

家兔呼吸运动的调节【目的要求】1.学习测定兔呼吸运动的方法。
2.学习记录膈肌放电的方法。
3.观察并分析肺牵张反射以及影响呼吸运动的各种因素。
【实验基本原理】呼吸运动是呼吸肌的舒缩运动,是呼吸肌(胸壁上的肋间肌和隔肌)在神经系统控制下进行的有节律的收缩和舒张造成的。
膈肌的收缩活动受来自中枢的传出神经支配,传出冲动的节律与频率,影响膈肌的收缩节律、频率与强度.人体及高等动物的呼吸运动所以能持续地节律性地进行,是由于体内调节机制的存在。
体内、外的各种刺激,可以直接作用于中枢或不同的感受器,反射性地影响呼吸运动,以适应机体代谢的需要。
肺牵张反射是保证呼吸运动节律的机制之一。
血液中CO2分压的改变,通过对中枢性与外周性化学感受器的刺激及反射性调节,是保证血液中气体分压稳定的重要机制。
【实验动物与器材】实验动物:家兔实验工具:兔体手术台、常用手术器械、张力传感器、引导电极、计算机采集系统、气管插管、注射器、橡皮管实验试剂:20%氨基甲酸乙酯、生理盐水【实验方法与步骤】1. 麻醉→背位固定→剪去颈部与剑突腹面的被毛→切开颈部皮肤,分离气管并插入气管插管→分离出双侧迷走神经,穿线备用。
气管务必分离干净,插管后务必扎紧,避免漏气2. 剑突软骨分离术切开胸骨下端剑突部位的皮肤,并沿腹白线再切开长约2cm 的切口。
细心分离剑突表面的组织,并暴露剑突软骨与骨柄。
提起剑突,可见剑突随膈肌的收缩而自由运动。
3. 将系有剑突的金属钩钩于剑突中间部位,线的另一端系于张力传感器的应变梁上。
4. 开启计算机采集系统,接通张力传感器的输入通道,调节记录系统,使呼吸曲线清楚地显示在显示器5. 记录膈肌放电.【实验观察项目】(1)记录正常的呼吸运动、膈肌放电曲线,注意分清呼气和吸气运动与曲线的方向。
(2)增加无效腔对呼吸运动的影响将长约0.5m、内径1cm的橡皮管连于气管插管的一个侧管上,用止血钳夹闭另一侧管,使无效腔增加,观察并记录呼吸运动的改变,一旦出现明显变化,则立即打开止血钳,去除橡皮管,待呼吸恢复正常。
家兔膈肌放电实验报告

家兔膈肌放电实验报告家兔膈肌放电实验报告引言:家兔膈肌放电实验是一项用于研究家兔呼吸系统的实验,通过观察家兔膈肌的放电情况,可以了解呼吸系统的正常功能以及可能存在的问题。
本实验旨在探究家兔膈肌的放电机制以及其对呼吸的影响。
实验设计:本实验使用了10只健康的家兔作为实验对象,首先需要将家兔固定在实验台上,以保证实验过程的稳定性。
然后,通过电极将家兔膈肌与记录仪相连,以记录膈肌的电活动。
接下来,通过不同的刺激方式,观察家兔膈肌的放电情况。
实验过程:1. 静息状态下的膈肌放电:在家兔处于静息状态下,记录膈肌的放电情况。
观察到膈肌放电呈现规律的起伏,说明家兔的呼吸系统正常运作。
2. 呼吸负荷增加时的膈肌放电:通过给家兔施加呼吸负荷增加的刺激,比如让家兔进行剧烈运动或者给予呼吸负荷增加的药物,观察膈肌放电的变化。
发现膈肌放电的幅度增加,说明家兔在应对呼吸负荷增加时,膈肌的收缩力度增加,以保持正常呼吸。
3. 呼吸负荷减轻时的膈肌放电:通过给家兔施加呼吸负荷减轻的刺激,比如让家兔处于静息状态或者给予呼吸负荷减轻的药物,观察膈肌放电的变化。
发现膈肌放电的幅度减小,说明家兔在呼吸负荷减轻时,膈肌的收缩力度减小,以适应呼吸负荷的变化。
4. 非正常呼吸状态下的膈肌放电:通过给家兔施加非正常呼吸状态的刺激,比如限制呼吸或者给予呼吸困难的药物,观察膈肌放电的变化。
发现膈肌放电的幅度减小或者出现异常波动,说明家兔在非正常呼吸状态下,膈肌的收缩力度受到影响,呼吸系统出现问题。
实验结果:通过实验观察和数据记录,我们得出了以下结论:1. 家兔膈肌的放电呈现规律的起伏,与正常呼吸有关。
2. 在呼吸负荷增加时,膈肌放电的幅度增加,以保持正常呼吸。
3. 在呼吸负荷减轻时,膈肌放电的幅度减小,以适应呼吸负荷的变化。
4. 在非正常呼吸状态下,膈肌放电的幅度减小或者出现异常波动,呼吸系统出现问题。
讨论与展望:本实验通过观察家兔膈肌的放电情况,可以初步了解呼吸系统的正常功能以及可能存在的问题。
家兔膈肌实验报告

一、实验目的1. 了解膈肌的结构和功能。
2. 观察膈肌在呼吸运动中的活动规律。
3. 探究影响膈肌活动的因素。
二、实验原理呼吸运动是机体进行气体交换的重要生理过程,其中膈肌是主要的呼吸肌。
膈肌位于胸腔和腹腔之间,呈穹窿状,收缩时下降,扩张胸腔,使肺容量增大,从而吸入气体;松弛时上升,压缩胸腔,使肺容量减小,从而呼出气体。
本实验通过观察家兔膈肌在呼吸运动中的活动规律,以及分析影响膈肌活动的因素,进一步了解呼吸运动的机制。
三、实验动物与器材实验动物:家兔1只实验器材:解剖显微镜、解剖剪、镊子、缝针、缝线、生理盐水、注射器、麻醉剂、气管插管、呼吸机、心电图机、生理信号采集系统等。
四、实验步骤1. 麻醉与固定:将家兔用麻醉剂麻醉,然后仰卧固定在解剖台上。
2. 气管插管:将气管插管插入家兔气管,连接呼吸机,维持家兔呼吸。
3. 心电图监测:将心电图电极连接在家兔心脏部位,监测心脏活动。
4. 膈肌分离:沿家兔腹部正中线切开皮肤,暴露膈肌,分离出一段膈肌。
5. 引导电极植入:将引导电极植入膈肌,连接生理信号采集系统。
6. 记录膈肌放电活动:启动呼吸机,观察并记录膈肌放电活动。
7. 改变呼吸频率:调节呼吸机,观察不同呼吸频率下膈肌放电活动的变化。
8. 改变呼吸深度:调节呼吸机,观察不同呼吸深度下膈肌放电活动的变化。
9. 观察其他因素对膈肌活动的影响:如温度、二氧化碳浓度、缺氧等。
五、实验结果1. 膈肌放电活动规律:在正常呼吸状态下,膈肌放电活动呈现规律性的周期性变化,与呼吸运动同步。
2. 呼吸频率对膈肌活动的影响:随着呼吸频率的增加,膈肌放电活动的频率也相应增加;随着呼吸频率的减少,膈肌放电活动的频率也相应减少。
3. 呼吸深度对膈肌活动的影响:随着呼吸深度的增加,膈肌放电活动的幅度也相应增加;随着呼吸深度的减少,膈肌放电活动的幅度也相应减少。
4. 其他因素对膈肌活动的影响:温度升高、二氧化碳浓度增加、缺氧等均可影响膈肌放电活动。
家兔呼吸运动调节、膈肌放电

步骤和项目
3.腹部手术,膈肌放电:暴露胸骨剑突, 将两个引导电极分别插入剑突下的膈小肌 上。 4.观察项目 描记正常呼吸运动曲线及膈肌放电: (1)CO2对呼吸运动的影响:气管插管的 侧管与含有CO2大试管(内盛水碱与20% 醋酸)的细管相通,使兔吸入CO2 ,观察 并记录呼吸运动变化。
器材药品
钠石灰,25%乌拉坦,油酸,生理盐水, 20%醋酸,水碱,BL420微机系统,哺乳 动物手术器械一套,兔台,气管插管,膈 肌放电引导电极,注射器,50厘米长橡皮 管,压力换能器。
步骤和项目
1.动物称重,用25%乌拉坦(4ml/kg b.w.ip)麻醉并固定 2.颈部手术,气管插管:颈部剪毛,颈部 正中纵行切开6cm,钝性剥离暴露气管, 其下穿线备用,分离两侧迷走神经各穿一 线备用,气管做一倒“T”字切口,插入气管 插管并结扎固定之。
步骤和项目
(4)气管狭窄对呼吸运动的影响:用止血 钳夹闭与气管相连的橡皮管的口径约2/3, 观察呼吸的频率、幅度的变化。 (5)窒息对呼吸运动的影响:迅速将气 管插管的侧管完全夹闭,待呼吸明显增强 后立即松开。 (6)切断单侧、双侧迷走神经,观察家兔 呼吸的深度及频率变化。
步骤和项目
(7)复制肺水肿模型: a.耳缘静脉注射油酸0.2ml.,30分钟后追加 0.2ml。 b.观察实验兔呼吸及一般情况改变,描记 呼吸,记录外呼吸表现(频率次/分)与深 度,记录注射时间,约30-60分钟,气管内 涌出粉红色泡沫样液体,以及呼吸明显浅 频,提示肺水肿已经形成。
步骤和项目
c.处死家兔。 d.结扎肺门,取肺:两肺称重,测肺系数 (肺系数=肺湿重(g)/体重(kg)), 并与正常进行比较。 肺系数正常值:白兔4.21+/-0.50;灰兔 4.25+/-0.62;杂色兔4.15+/-0.49
实验二 家兔膈肌放电与呼吸运动

呼吸与膈肌放电曲线
家兔呼吸运动与膈肌放电的测定
1.材料(materials) 材料( 材料 1.1 动物: 体重 动物: 体重1.5kg家兔 (rabbit),雌雄不限。 家兔 ,雌雄不限。 1.2 器材: RM6420 生物信号处理系统(成都仪器厂), 器材: 生物信号处理系统(成都仪器厂) 张力换能器,引导电极、兔用手术器械一套、 张力换能器,引导电极、兔用手术器械一套、兔固定 台、气管插管、注射器(20 ml、1 ml各一个)、棉线。 气管插管、注射器( 、 各一个)、棉线。 各一个)、棉线 1.3 药品试剂 20%乌来糖(氨基甲酸乙酯 urethane) 乌来糖( 乌来糖
家兔膈肌放电与呼吸运动实验
关树文
实验目的
学习掌握计算机生物信号系统的使用 掌握记录呼吸及膈肌放电的方法, 掌握记录呼吸及膈肌放电的方法,同时加深对 呼吸运动调节的认识 。 掌握气管插管术等手术操作
实验原理
膈肌为吸气肌。当膈肌收缩时,穹窿顶变平, 膈肌为吸气肌。当膈肌收缩时,穹窿顶变平, 下移和稍向前运动,中心腱也下降, 下移和稍向前运动,中心腱也下降,因为使胸 廓的上下径增大,胸腔内压力低于大气压, 廓的上下径增大,胸腔内压力低于大气压,产 生吸气。 生吸气。 无论是在整体或离体情况下, 无论是在整体或离体情况下,也无论是直接刺 激或间接刺激,总是先引起兴奋, 激或间接刺激,总是先引起兴奋,然后由兴奋 触发收缩机制,引起肌肉收缩。 触发收缩机制,引起肌肉收缩。 利用针形电极插入膈肌, 利用针形电极插入膈肌,所记录到的肌肉电活 动称为膈肌放电。 动称为膈肌放电。
2. 方法/kg 体重耳缘静脉 家兔称重, 体重耳缘静脉20%乌来糖麻醉家兔,家兔麻醉 乌来糖麻醉家兔, 乌来糖麻醉家兔 后将其仰卧,固定四肢和头。 后将其仰卧,固定四肢和头。 2.2 颈部手术 颈正中切口 ~7cm左右皮肤。用血管钳钝性分离出气管 颈正中切口5~ 左右皮肤。 左右皮肤 穿线备用。 穿线备用。 2.3 气管插管 用手术剪在甲状软骨下 用手术剪在甲状软骨下1cm处剪一“⊥”切口 插入气管插 处剪一“ 切口,插入气管插 处剪一 结扎固定。 管,结扎固定。 2.4 将气管插管一端连接呼吸换能器。 将气管插管一端连接呼吸换能器。 2.5 在胸骨剑突下 在胸骨剑突下3cm处切开皮肤、打开腹腔,将胃向下腹部推移,暴 处切开皮肤、打开腹腔,将胃向下腹部推移, 处切开皮肤 露膈肌。将引导电极插入膈肌。 露膈肌。将引导电极插入膈肌。
生理因素及药物对呼吸运动及膈神经放电的影响

生理因素及药物对呼吸运动及膈神经放电的影响一、实验目的1.学习用计算机生物信号系统记录呼吸及膈神经放电的方法。
2.观察血液化学成分改变对呼吸运动及膈神经放电的影响。
3.观察肺牵张反射以及迷走神经在此反射中的作用。
二、实验原理呼吸运动能够有节律地进行,并能适应机体代谢的需要,有赖于呼吸中枢的调节作用。
体内外各种刺激可以直接作用于呼吸中枢或通过不同的感受器反射性地作用呼吸运动,由此调节呼吸运动的频率和深度,使肺通气能适应机体代谢需要。
三、实验材料1、实验对象:家兔。
器材、药品:哺乳动物手术器械一套、兔手术台、气管套管、注射器(20ml、5ml各一副)、30cm长的像皮管一根、纱布、线、引导电极固定架、三维调节器、玻璃分针、输液架、压力换能器或张力换能器、BL-410计算机生物信号采集处理系统、20%氨基甲酸乙酯溶液、3%乳酸溶液、生理盐水和液体石蜡(加温38~40°C)、10%尼可刹米注射剂、氮气、CO2。
四、方法与步骤(一) 动物准备1.麻醉与固定 20%氨基甲酸乙酯耳缘静脉缓慢注射(0.75~1.0g /kg体重),麻醉完成后背位交叉固定于兔手术台上。
3.分离膈神经在颈外静脉与胸锁乳突肌之间向纵深分离直至脊柱肌,透过脊柱肌表面浅筋膜可见到颈椎发出的第3、4、5颈神经丛。
由颈3、4、5发出的腹支汇合成如细丝大小的神经分支,紧贴前斜方肌的腹缘并于肌纤维平行走向胸腔。
此即为膈神经。
用玻璃分分针将其分离1.5~2cm引线备用。
最后用热生理盐水纱布覆盖手术野。
4.膈神经放电的记录用止血钳夹住切口皮肤及组织,向上方牵引固定,使之形成皮兜。
在皮兜内分离神经处滴加40℃液体石腊保温防干燥。
然后用玻璃分针将膈神经轻轻挑入引导电极上,通过三维调节器调节紧张度,神经不可牵拉过紧,记录电极应悬空,避免接触周围组织。
在颈部皮肤切口处用导线使动物接地。
5.膈肌放电将二根记录电极从剑突下插入使其接触膈肌以记录膈肌放电。
呼吸运动调节及膈肌放电

尼可刹米)对呼吸的影响 ◆观察迷走神经在呼吸调节中的作用 ◆ 学会并熟练掌握气管插管和呼吸的 记录方法 ◆熟悉膈肌放电的引导方法
3
呼吸运动的记录方法及膈肌放 电的引导
(一)动物手术 1. 麻醉(4ml/Kg乌拉坦)完全后固定于兔 实验台上 2. 剪去颈部、剑突周围的兔毛后,沿颈 部正中剪开皮肤,钝性分离气管,并 进行气管插管;分离双侧迷走神经, 穿线备用。
4
呼吸运动的记录方法及膈肌放 电的引导
1.在剑突下剪一纵行小切口,仔细暴 露于剑突下的粉红色膈小肌,注意 勿机械牵拉过度损伤膈肌,以免导 致气胸(aerothorax)。
5
膈肌的解剖位点及实验操作
6
暴露位于剑突下的粉红色膈小肌
7
膈肌放电的引导
仪器连接及软件操作 1.将膈肌电极小心钩住附着于剑突软骨部位的膈 小肌,另一端与BL-410系统的1通道相连,依次 选定信号输入→通道1→肌肉放电,记录膈肌放 电(注意接地);
12
实验报告要点
1.列表记录各实验项目时呼吸运动和膈肌放电 的变化。 2.讨论正常呼吸形成原理,分析各实验项目时 呼吸和膈肌放电变化的机制。 3.结论。
13
8
2.呼吸换能器与 气管插管直管相 连,接入二通道。 软件设定选择信 号输入→二通道 →呼吸
9
呼吸运动的记录方法及膈肌放 电的引导
3.“增益”、“采样速 度”、“刺激器设置” 等依 具体情况进行 调整。一般只调节增 益,采样速率调节在 640ms/div
右图为理想状态下记录到的标 准曲线
10
某些化学因素和迷走神经对呼吸运动的影响
呼吸运动调节及膈肌放电
Regulation of respiratory movement and disphragmatic muscle discharge
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
关树文
实验目的
学习掌握计算机生物信号系统的使用 掌吸运动调节的认识 。 掌握气管插管术等手术操作
实验原理
膈肌为吸气肌。当膈肌收缩时,穹窿顶变平, 膈肌为吸气肌。当膈肌收缩时,穹窿顶变平, 下移和稍向前运动,中心腱也下降, 下移和稍向前运动,中心腱也下降,因为使胸 廓的上下径增大,胸腔内压力低于大气压, 廓的上下径增大,胸腔内压力低于大气压,产 生吸气。 生吸气。 无论是在整体或离体情况下, 无论是在整体或离体情况下,也无论是直接刺 激或间接刺激,总是先引起兴奋, 激或间接刺激,总是先引起兴奋,然后由兴奋 触发收缩机制,引起肌肉收缩。 触发收缩机制,引起肌肉收缩。 利用针形电极插入膈肌, 利用针形电极插入膈肌,所记录到的肌肉电活 动称为膈肌放电。 动称为膈肌放电。
2. 方法(methods) 方法(
2.1 家兔称重,按5ml/kg 体重耳缘静脉 家兔称重, 体重耳缘静脉20%乌来糖麻醉家兔,家兔麻醉 乌来糖麻醉家兔, 乌来糖麻醉家兔 后将其仰卧,固定四肢和头。 后将其仰卧,固定四肢和头。 2.2 颈部手术 颈正中切口 ~7cm左右皮肤。用血管钳钝性分离出气管 颈正中切口5~ 左右皮肤。 左右皮肤 穿线备用。 穿线备用。 2.3 气管插管 用手术剪在甲状软骨下 用手术剪在甲状软骨下1cm处剪一“⊥”切口 插入气管插 处剪一“ 切口,插入气管插 处剪一 结扎固定。 管,结扎固定。 2.4 将气管插管一端连接呼吸换能器。 将气管插管一端连接呼吸换能器。 2.5 在胸骨剑突下 在胸骨剑突下3cm处切开皮肤、打开腹腔,将胃向下腹部推移,暴 处切开皮肤、打开腹腔,将胃向下腹部推移, 处切开皮肤 露膈肌。将引导电极插入膈肌。 露膈肌。将引导电极插入膈肌。
3.观察记录(observations) 观察记录( 观察记录
3.1 记录膈肌放电曲线和呼吸曲线。 记录膈肌放电曲线和呼吸曲线。 讨论:放电现象与呼吸运动的关系( 讨论:放电现象与呼吸运动的关系(是否先放电后 收缩?) 收缩?) 3.2 记录家兔正常的呼吸频率和通气量 3.3 记录增加气道长度前后家兔膈肌肌电图、呼吸 记录增加气道长度前后家兔膈肌肌电图、 频率和通气量的变化
注意事项
1.记录电极不可短接!除尖端外,其余部分应做 记录电极不可短接!除尖端外, 记录电极不可短接 绝缘处理,仪器和动物都要接地。 绝缘处理,仪器和动物都要接地。 2.记录电极插入时防止将膈肌刺破造成气胸;电 记录电极插入时防止将膈肌刺破造成气胸; 记录电极插入时防止将膈肌刺破造成气胸 极应妥善固定,防止脱落。 极应妥善固定,防止脱落。 3.乌来糖注射剂量不要过多(3-4ml)。 乌来糖注射剂量不要过多( - 乌来糖注射剂量不要过多 )。
呼吸与膈肌放电曲线
家兔呼吸运动与膈肌放电的测定
1.材料(materials) 材料( 材料 1.1 动物: 体重 动物: 体重1.5kg家兔 (rabbit),雌雄不限。 家兔 ,雌雄不限。 1.2 器材: RM6420 生物信号处理系统(成都仪器厂), 器材: 生物信号处理系统(成都仪器厂) 张力换能器,引导电极、兔用手术器械一套、 张力换能器,引导电极、兔用手术器械一套、兔固定 台、气管插管、注射器(20 ml、1 ml各一个)、棉线。 气管插管、注射器( 、 各一个)、棉线。 各一个)、棉线 1.3 药品试剂 20%乌来糖(氨基甲酸乙酯 urethane) 乌来糖( 乌来糖
