瑞戈非尼(Stivarga)说明书
索拉非尼 瑞戈非尼 分子 结构 区别

索拉非尼瑞戈非尼分子结构区别索拉非尼(Sorafenib)和瑞戈非尼(Regorafenib)是两种常用的抗癌药物,它们属于多激酶抑制剂,用于治疗一些固体肿瘤。
尽管它们的名称相似,但这两种药物的分子结构和药理特征有所不同。
本文将对索拉非尼和瑞戈非尼的分子结构和区别进行详细描述。
首先,索拉非尼和瑞戈非尼的分子结构有一定的相似性,它们都是由有机化合物构成的。
索拉非尼是一种肾上腺素能受体激动剂,它的分子式为C21H16ClF3N4O3,分子量为464.83g/mol。
索拉非尼的结构主要由四个环组成,包括:噻吩环、苯环、三氟甲基苯环和氨基甲酰苯环。
这四个环通过键和原子相互连接,形成一个稳定的分子结构。
瑞戈非尼的分子式为C21H15ClF4N4O3,分子量为482.82g/mol。
瑞戈非尼的分子结构也由四个环组成,包括:噻吩环、苯环、四氟甲基苯环和氨基甲酰苯环。
与索拉非尼不同的是,瑞戈非尼的四氟甲基苯环中有四个氟原子取代。
这样的结构差异可能导致瑞戈非尼具有不同的药理特性。
除了分子结构的差异外,索拉非尼和瑞戈非尼还在药理特性上有所不同。
索拉非尼主要通过抑制多种关键激酶的活性来抑制肿瘤细胞的增殖和血管生成。
它能抑制细胞增殖与存活所涉及的信号转导通路,如Raf/MEK/ERK信号通路。
此外,索拉非尼还抑制了血管内皮生长因子受体(VEGFR-1、VEGFR-2、VEGFR-3)、血小板来源性生长因子受体(PDGFR-β)、c-kit和B-RAF等成对关键调控细胞增殖和血管生成的激酶。
瑞戈非尼与索拉非尼相比,具有更加广泛的激酶抑制谱。
它能抑制更多种类的癌症相关激酶。
此外,瑞戈非尼还能影响细胞周期、细胞凋亡和免疫调节等多种细胞过程,从而发挥其抗肿瘤作用。
瑞戈非尼的激酶抑制谱包括:VEGFR-1、VEGFR-2、VEGFR-3、PDGFR-β、FGFR-1、FGFR-2、KIT、RET等。
与索拉非尼相比,瑞戈非尼的抗肿瘤活性可能更强。
血管内皮生长因子抑制剂的研究进展

肿瘤严重地威胁着人类的健康,随着分子肿瘤学的迅速发展,恶性肿瘤的发病机制也逐渐被阐明.研究发现细胞周期失控是引发癌变的主要原因,细胞内促增殖系统成分的过度表达以及抑增殖系统成分的缺失,都会引起细胞增殖系统失控,导致细胞过度增殖而发生癌变[1].血管内皮生长因子是肿瘤细胞中分离得到的新型生长因子,具有促进新血管生成以及增加血管的通透性的作用[2].肿瘤细胞的生长和迁移是一个复杂的过程,需要血管新生为其增殖提供营养,整个过程受到很多因素的影响[3].研究发现,V E G F 可与V E G FR 特异地促进内皮细胞分裂,共同激发血管内皮细胞产生新生的血管,为肿瘤的增殖和转移提供条件,因此V E G F 及其受体成为抗肿瘤研究的重要靶点.1血管内皮生长因子结构及特性V EG F 最初是从牛垂体滤泡细胞中分离出一种能选择性促进血管内皮细胞分裂的同源二聚体糖蛋白,其相对分子质量是45000[4],五个家族成员包括V EG F-A 、V E G F-B 、V E G F-C 、V EG F-D 和胎盘生长因子(PG F),V E G F-A 具有很强的血管通透性,在早期胚胎的血管的生成有着重要作用,并在肝癌、黑色素瘤等肿瘤组织中高度表达.V EG F-B 在正常的血管、心脏等组织及器官中均有表达,但肿瘤血管中V E G F-B 的作用还未明确;V E G F-C 在内皮细胞和肿瘤细胞均会表达[5];V E G F-D 存在于成纤维细胞、巨噬细胞以及平滑肌细胞中[6].2V E G F 及受体与肿瘤关系以V EG F/V E G FR 为靶点的抗肿瘤治疗,主要是基于肿瘤血管形成.V EG F 与其他生长因子不同,它具有高亲和力和特异性;V EG FR 主要局限于内皮细胞内,这决定了它与肿瘤血管的生成密切相关.因此,V EG F 受体信号的过度激活是肿瘤增殖的重要影响因子,在人体内特异性地抑制V E G F 与其受体的结合可减少血管生成,切断肿瘤的血液供给,能够有效抑制肿瘤细胞的生长以及向其他组织浸润以及迁移[7].临床研究发现,V E G FR 能在多种肿瘤组织中被激活,如:甲状腺癌、黑色素瘤以及肺癌等,其通过调节肿瘤内的血管系统向肿瘤组织供养.因此,阻碍V EG F 及其受体经特异性结合而产生的信号传导就能够有效地对肿瘤细胞的产生发挥作用,抑制肿瘤细胞的生长和转移.3以V E G F/V E G FR 为靶点的抗肿瘤药物研究3.1单克隆抗体抑制剂近年来,对血管内皮生长因子(V EG F)抑制类药物的研究不断深入,新的结构类型药物不断被开发.贝伐单抗(B e-vaci z um ab)是重组的人源化单克隆抗体,体内外检测都证实I gG 1抗体能与V EG F 结合同时抑制其生物活性,阻断V EG F 导致的血管通透性的增加,从而抑制肿瘤细胞的生长,对肾癌、乳腺癌、结肠癌等均有较好的治疗作用[8].血管生成抑制剂贝伐单抗联合紫杉醇及泼尼松治疗转移性乳腺癌,治疗过程给药安全,疗效显著[9].诺华制药公司与德国先灵制药公司共同研制开发了口服小分子抑制剂瓦他拉是通过抑制酪氨酸激酶信号分子的表达,阻碍新生血管的生长达到抑制肿瘤细胞生长的目的.雷莫芦单抗(R am uci r um ab )是新型的人I gG 1单克隆抗体,能有效阻断V EG F 与V E G -FR 2结合,对胃癌、肺癌及结肠癌都并表现出良好的耐受性和治疗效果,与其他化疗药物联合应用也有治疗作用[10].3.2多靶点酪氨酸激酶抑制剂V EG F 与其受体结合激活酪氨酸激酶才能发挥其生物效能,抑制受体的活性及下游信号的传导,阻止肿瘤细胞的生长和转移.索拉非尼和厄洛替尼属于口服多靶点酪氨酸激酶抑制剂,共同用于治疗晚期非小细胞肺癌,具有较好的抗肿瘤效果和耐受性[11].瑞戈非尼(St i var ga)是一种高效的口服多靶点激酶抑制剂,对V EG FR -2具有较强的抑制作用,可强效阻断N I H -3T3细胞中V EG FR -2的自磷酸化,对抗肿瘤血管新生和抑制肿瘤细胞的浸润转移有较强的作用.临床试验中,瑞戈非尼在肾细胞癌和结肠癌的治疗中显示了良好的有效性和耐受性[12].Lenvat i ni b 是口服的多靶点抗血管生成抑制剂,能够抑制V EG FR 2(K D R )/V EG FR 3(Fl t -4)在的体内活性.体内实验显示,对V EG F 和FG F 介导的血管生成均有较强的抑制作用,在肿瘤模型中,表现出较高的抗肿瘤血管内皮生长因子抑制剂的研究进展苏适,韩美欣,高婷婷,李慧宇,潘芷茹,董立强(绥化学院食品与制药工程学院,黑龙江绥化152061)摘要:肿瘤的生长需要依靠自身血管供氧和营养物质,血管内皮生长因子(V EG F)在调节血管生成中起着非常重要的作用,是内皮细胞的增殖以及迁移等重要的影响因子.目前,血管内皮生长因子抑制剂作为一类新型的小分子抗肿瘤药物,已经在临床治疗上得到了成功的应用.近年,已研究出多种对V EG F 及其受体具有高选择性的抑制剂.本文从不同血管内皮生长因子抑制剂出发,综述了以V EG F/V EG FR 为靶点的抗肿瘤药物的研究进展,为癌症的治疗提供有效的临床策略.关键词:血管内皮生长因子;肿瘤;抗血管生成;抑制剂中图分类号:O 626文献标识码:A文章编号:1673-260X (2018)05-0060-02收稿日期:2018-03-13基金项目:黑龙江省大学生创新训练资助项目(201710236023);绥化学院科学技术资助项目(K 201702004)V ol .34N o.5M ay 2018赤峰学院学报(自然科学版)J our nalofChi f eng U ni ver s i t y (N at ur alSci ence Edi t i on )第34卷第5期2018年5月60--. All Rights Reserved.活性.多靶点酪氨酸激酶抑制剂的研究,为抗肿瘤药物的研究提供一个重要的研究方向.3.3以V E G F/V EG FR为靶点的天然化合物抑制剂由于中草药的低毒、来源广泛及抗耐药等特点,对中草药中抗血管生成活性成分的研究也逐渐增多.国内外已有实验研究报道参麦注射液[13]在体外和体内均具有一定的抗肿瘤血管生成作用,干扰肿瘤内血管内皮生长因子发挥作用.青天葵(N er vi l i a f or di i Schl t r)中发现的鼠李秦素(R ham nazi n)是可能干预肿瘤血管生成的一种天然化合物,能显著地抑制V EG FR2在肿瘤组织中的过度激活,可以用于抑制肿瘤血管新生[14].此外,实验研究中发现,马钱子碱能通过靶向抑制V EG FR2的下游蛋白激酶的活性和信号传导,抑制肿瘤血管的新生,有望成为一种抗肿瘤的先导药物,可以为抗肿瘤药物的研究提供一个新的思路.3.4联合用药治疗及其他治疗手段联合应用抗血管基因治疗和化学疗法,能够降低肿瘤细胞的耐药性提高治疗效果,降低药物的毒副作用.贝伐单抗与氟尿嘧啶联合治疗胰腺内分泌肿瘤的临床实验中,多数的肿瘤患者生存期(O S)可达两年,并未出现到预期外的毒性[15].在结直肠癌的三期临床研究发现,贝伐单抗与其他化疗药物联用治疗,患者的总生存率优于单独使用贝伐单抗.将贝伐单抗与放疗联合治疗抗肿瘤中发现,放疗前与予贝伐单抗联合使用比单一放疗效果更好,组织学结果显示肿瘤细胞坏死的数增加,新血管的生成明显降低.此外,体内外实验研究发现,Lenvat i ni b和G ol vat i ni b二者联合应用考察其对胰腺癌细胞的影响中发现,联合用药可以很好地克服V EG FR抑制剂的抗性.4展望肿瘤血管生成在涉及肿瘤细胞从生成到转移的整个过程,因此抗血管生成疗法已成为肿瘤治疗最有效的方法之一,以V EG F/V E G FR为靶点的抑制剂具有良好的前景,通过抑制肿瘤生长达到治疗目的.目前,化合物的构效关系、药理学、药物化学和药物动力学的研究手段已经成熟, V EG F/V EG FR系统在内的血管生成信号系统机制逐渐阐明,在肿瘤血管生成中的重要作用以及它具有特异性强、不易产生耐药性、不受肿瘤细胞周期限制等优点,具有良好的应用前景.———————————————————参考文献:〔1〕Q.Y.H e,Y.Y.Li ang and D.S.W ang.C har act er i s⁃t i cs of M i t ot i c C el l D eat h I nduced by Enedi yne A nt i bi⁃ot i c Li dam yci n i n H um an Epi t hel i al T um or C el l s.I nt er⁃nat i onal J our anal of R adi at i on O ncol ogy B i ol ogy Phys i cs.2002,20(2):261-266.〔2〕Li Y,Fu SY,W ang LH,et al.C opper i m pr oves t he an⁃t i angi ogeni c act i vi t y of di s ul f i r am t hr ough t he EG FR/ Sr c/V EG F pat hw ay i n gl i om as[J].C ancer Let t,2015,369(1):86-92.〔3〕C heng C C,G uan SS,Y ang H J,et al.B l ocki ng hem e oxygenas e-1by zi nc pr ot opor phyr i n r educes t um or hy⁃poxi a-m edi at ed V EG F r el eas e and i nhi bi t s t um or angi o⁃genes i s as a pot ent i al t her apeut i c agent agai ns t col or ect alcancer[J].J B i om ed Sci,2016,23(1):18-25.〔4〕Y ang X,Z hang Y,H os aka K,et al.V EG F-B pr o⁃m ot es cancer m et as t as i s t hr ough a V EG F-A-i ndepen⁃dent m echani s m and s er ves as a m ar ker of poor pr ogno⁃s i s f or cancer pat i ent s[J].Pr oc N at l A cad Sci,2015,112(22):E2900-2909.〔5〕C hen J C,C hang Y W,H ong C C,et al.T he r ol e of t he V EG F-C/V EG FR s axi s i n t um or pr ogr es s i on and t her⁃apy[J].I nt J M ol Sci,2012,14(1):88-107.〔6〕El-C hem al y S,Pacheco-R odr i guez G,M al i de D,et al.N ucl ear l ocal i zat i on of vas cul ar endot hel i al gr ow t h f ac⁃t or-D and r egul at i on of c-M yc-dependent t r ans cr i pt si n hum an l ung f i br obl as t s[J].A m J R es pi r C el l M ol B i ol,2014,5(1):34-42.〔7〕Li Y,Fu SY,W ang LH,et al.C opper i m pr oves t he ant i-angi ogeni c act i vi t y of di s ul f i r am t hr ough t he EG FR/Sr c/ V EG F pat hw ay i n gl i om as[J].C ancer Let t,2015,369(1): 86-92.〔8〕Y u Y,C ai W,Pei C,et al.R ham nazi n,a novel i nhi bi t or of V EG FR2s i gnal i ng w i t h pot ent ant i angi ogeni c act i vi t y and ant i t um or ef f i cacy[J].B i ochem B i ophys R es C om⁃m un,2015,458(4):913-917.〔9〕N akagaw a T,M at s us hi m a T,K aw ano S,et al.Lenvat i ni bi n com bi nat i on w i t h gol vat i ni b over com es hepat ocyt egr ow t h f act or pat hw ay-i nduced r es i s t ance t o vas cul ar endot hel i al gr ow t h f act or r ecept or i nhi bi t or[J].C ancer Sci,2014,105(6):723-730.〔10〕M r os s K,Fr os t A,St ei nbi l d S,et al.A phas e I dos e-es cal at i on s t udy of r egor af eni b(B A Y73-4506),ani nhi bi t or of oncogeni c,angi ogeni c,and s t r om al ki nas es,i npat i ent s w i t h advanced s ol i d t um or s[J].C l i nC ancer R es, 2012,18(9):2658-2667.〔11〕N i s hi o M,H or ai T,H or i i ke A,et al.Phas e I s t udy of l envat i ni b com bi ned w i t h car bopl at i n and pacl i t axel i n pat i ent s w i t h non-s m al l-cel l l ung cancer[J].B r J C an⁃cer,2013,109(3):538-544.〔12〕Font anel l a C,O ngar o E,B ol zonel l o S,et al.C l i ni cal ad-vances i n t he devel opm ent of novel V EG FR2i n⁃hi bi t or s[J].A nn T r ans l M ed,2014,2(12):123.〔13〕G i r ar d N.A nt i angi ogeni c agent s and chem ot her apy i n ad-vanced non-s m al l cel l l ung cancer:a cl i ni cal per⁃s pect i ve[J].Exper t R ev A nt i cancer T her,2013,13(10): 1193-1198.〔14〕胡静,钱晓萍,刘宝瑞.参麦注射液联合热疗抑制血管生成作用的体内外实验研究.现代肿瘤医学,2007,15(2): 165-168.〔15〕D ucr eux M,D ahan L,Sm i t h D,et al.B evaci zum ab com bi ned w i t h5-FU/s t r ept ozoci n i n pat i ent s w i t h pr ogr es s i ve m et as t at i c w el l-di f f er ent i at ed pancr eat i c en⁃docr i ne t um our s(B ET T ER t r i al):a phas e域non-r an⁃dom i s ed t r i al[J].Eur J C ancer,2014,50(18):3098-3103.61--. All Rights Reserved.。
Invacare 产品用户手册说明书

This manual MUST be given to the user of the product.BEFORE using this product,read this manual and save for future reference.I I1General1.1SymbolsSignal words are used in this manual and apply to hazards or unsafe practices which could result in personal injury or property damage.DANGER!–Danger indicates an imminently hazardous situation which,if not avoided,will result in death or serious injury.WARNING!–Warning indicates a potentially hazardous situation which,if not avoided,could result in death or serious injuryCAUTION!–Caution indicates apotentially hazardous situation which,if not avoided,may result in property damage or minor injury or both.Gives useful tips,recommendations and information of efficient,trouble-free use.2Safety2.1General GuidelinesDANGER!Risk Of Death,Injury Or DamageBed accessories designed by other manufacturers have NOT been tested by e of NON-Invacare bed accessories may result in injury or death.–Use ONLY Invacare rails,mattresses,bed extenders and other accessories with Invacare bed products.DANGER!Risk Of Death,Injury Or DamageImproper use of this product may cause injury or damage.–If you are unable to understand the warnings,cautions or instructions,contact a healthcare professional,dealer or technical personnel before attempting to use this equipment–Do not use this product or any available optional equipment without first completely reading and understanding these instructions and any additional instructional material such as user manuals,service manuals or instruction sheets supplied with this product or optional equipment.Continued use of the bed with damaged parts could lead to the bed malfunctioning,causing injury to the user and/or caregiver.–Check ALL bed components and carton for damage,and test components before use.In case of damage or if the bed is not working properly,contact a technician or Invacare for repair.To avoid injury or product damage–Set-up and Assembly instructions MUST be performed by qualified technicians only."Qualified Technician Only"sections are marked accordingly.WARNING!Risk Of Injury Or DamageThe Fixed Trapeze has a safe working load of 168lb.The Fixed Trapeze is designed to provide support,increase stability and assist the user when repositioning himself/herself in bed.–The trapeze is not designed to support the total body weight of an individual or to be used as an assist device when transferring into or out of a e the trapeze as a positioning device only.–The Fixed Trapeze MUST ONLY be installed onto beds with metal framed headboards.Invacare®Floor Base and Fixed TrapezeenModel Nos.7714P and 7740A User ManualInvacare®Floor Base and Fixed TrapezeDANGER!Risk Of Death or InjuryTo avoidrisk of falling or other injuries:–After ANY adjustments,repair or service and BEFORE use,make sure that allattaching component parts are secure.–DO NOT INSTALLOR ADJUST TRAPEZE OF AN OCCUPIED BED.–DO NOT attach swivel trapezes to the floor base.This may cause the floor base to tip over.–Floor Base MUST be positioned under the bed at the headboard position.–Ensure that the snap buttons fully protrude through the adjustment hole of the floor leg assembly.This ensures thatthe Floor Base is properly installed and securely locked in position.3Setup3.1Assembling the Floor Base1.Install the "A"frame A into the floor base assembly B with the snap buttons C facing the short length D of the floor base.2.Depress the snap button on one leg E of the "A"frame and slide it into the floor base assembly until anaudible “click”is heard.Make sure that the snap button fully protrudes through the adjustment hole of the floor base assembly.This ensures that the Floor Base is properly installed and securely locked in place.3.Repeat STEPS 1and 2for the opposite side.4.Attach brackets to the floor base.Refer to Attaching Brackets to Floor Base,page 2.3.2Attaching Brackets to Floor Base/Bed End Attaching Brackets to Floor Base1.Place the floor base F on a flat surface.2.Position the lower bed bracket G in the center of the bottom rail H of the floor base with the tubular hook I facing down.3.Securely tighten the wing nuts J to secure the lower bed bracket to the floor base.4.Position the upper bed bracket K in the center of the top rail of the floor base with the tubular hook facing down.5.Securely tighten the wing nuts to secure the upper bed bracket to the floor base.Attaching Brackets to the BedEndPosition the lower bed bracket G in the center of the bottombed frame L.The lower bed and upper bed brackets KMUST be positioned as close to the center of the bed aspossible without interfering with the bed drive shaft M.1.Position the lower bed bracket G in the center of the bottombed frame with the tubular hook I facing up.Make sure thatthere is no interference between the lower bed bracket and thebed drive shaft M.2.Tighten wing nuts J to secure lower bed bracket onto bottombed frame.3.Position the tubular hook of the upper bed bracket K so it restson the top rail of bed end with the tubular hook facing down.4.Securely tighten the wing nuts to secure the upper bed bracketto the top rail of the bed end.3.3Installing the TrapezeDANGER!Risk Of Death or InjuryTo avoid risk of falling or other injuries:–DO NOT INSTALL OR ADJUST TRAPEZE OF ANOCCUPIED BED.–DO NOT attach swivel trapezes to the floor base.Thismay cause the floor base to tip over.–Floor Base MUST be positioned under the bed at theheadboard position.When using the floor base F in conjunction with a bed L,the long legs of the floor base should slide under the bed.Refer to3.4"S"hook U.1.Loosen trapeze key V by turning counterclockwise.2.Slide the clamp W to desired position on the upper offset bar P.3.Secure the trapeze clamp to the offset bar by turning the keyclockwise.3.5Storing the FloorBase1.Remove the trapeze from the floor base.2.Depress one snap button X on floor leg assembly and lift up on the "A"frame Y until the snap button clears the top of the floor leg assembly.3.Rotate one leg of the floor base assembly 270°clockwise away from the other leg.4.Rotate the remaining leg of the floor base assembly 90°clockwise towards the other leg.4Warranty4.1WarrantyPLEASE NOTE:THE WARRANTY BELOW HAS BEEN DRAFTED TO COMPLY WITH FEDERAL LAW APPLICABLE TO PRODUCTS MANUFACTURED AFTER JULY 4,1975.This warranty is extended only to the original purchaser/user of our products.This warranty gives you specific legal rights and you may also have other legal rights which vary from state to state.Invacare warrants its product to be free from defects in materials and workmanship for a period of one year of the product for the original purchaser.If within such warranty period any such product shall be proven to be defective,such product shall be repaired or replaced,at Invacare's option.This warranty does not include any labor or shipping charges incurred in replacement part installation or repair of any such product.Invacare's sole obligation and your exclusive remedy under this warranty shall be limited to such repair and/or replacement.For warranty service,please contact the dealer from whom you purchased your Invacare product.In the event you do not receive satisfactory warranty service,please write directly to Invacare at the address on the back cover.Provide dealer's name,address,model number,and the date of purchase,indicate nature of the defect and,if the product is serialized,indicate the serial number.Invacare corporation will issue a return authorization.the defective unit or parts must be returned for warranty inspection using the serial number,when applicable,as identification within thirty (30)days of return authorization date.DO NOT return products to our factory without our prior consent.c.o.d.shipments will be refused;please prepay shipping charges.LIMITATIONS AND EXCLUSIONS:THE WARRANTY SHALL NOT APPLY TO PROBLEMS ARISING FROM NORMAL WEAR OR FAILURE TO ADHERE TO THE ENCLOSED INSTRUCTIONS.IN ADDITION,THE FOREGOING WARRANTY SHALL NOT APPLY TO SERIAL NUMBERED PRODUCTS IF THE SERIAL NUMBER HAS BEEN REMOVED OR DEFACED;PRODUCTS SUBJECTED TO NEGLIGENCE,ACCIDENT,IMPROPER OPERATION,MAINTENANCE OR STORAGE;OR PRODUCTS MODIFIED WITHOUT INVACARE'S EXPRESS WRITTEN CONSENT INCLUDING,BUT NOT LIMITED TO:MODIFICATION THROUGH THE USE OF UNAUTHORIZED PARTS OR ATTACHMENTS:PRODUCTS DAMAGED BY REASON OF REPAIRS MADE TO ANY COMPONENT WITHOUT THE SPECIFIC CONSENT OF INVACARE;PRODUCTS DAMAGED BY CIRCUMSTANCES BEYOND INVACARE'S CONTROL;PRODUCTS REPAIRED BY ANYONE OTHER THAN AN INVACARE DEALER,SUCH EVALUATION SHALL BE SOLELY DETERMINED BY INVACARE.THE FOREGOING EXPRESS WARRANTY IS EXCLUSIVE AND IN LIEU OF ALL OTHER EXPRESS WARRANTIES WHATSOEVER,WHETHER EXPRESS OR IMPLIED,INCLUDING THE IMPLIED WARRANTIES OF MERCHANTABILITY AND FITNESS FOR A PARTICULAR PURPOSE AND THE SOLE REMEDY FOR VIOLATIONS OF ANY WARRANTY WHATSOEVER,SHALL BE LIMITED TO REPAIR OR REPLACEMENT OF THE DEFECTIVE PRODUCT PURSUANT TO THE TERMS CONTAINED HEREIN.THE APPLICATION OF ANY IMPLIED WARRANTY WHATSOEVER SHALL NOT EXTEND BEYOND THE DURATION OF THE EXPRESS WARRANTY PROVIDED HEREIN.INVACARE SHALL NOT BE LIABLE FOR ANY CONSEQUENTIAL OR INCIDENTAL DAMAGES WHATSOEVER.THIS WARRANTY SHALL BE EXTENDED TO COMPLY WITH STATE/PROVINCIAL LAWS AND REQUIREMENTS.Invacare USACanadaOne Invacare Way 570Matheson Blvd E.Unit 8Elyria,Ohio USA Mississauga,Ontario 44036–2125L4Z 4G4800–333–6900800–668–5324©2014Invacare Corporation All rights reserved.Republication,duplication ormodification in whole or in part is prohibited without prior written permission from Invacare.Trademarks are identified by ™and ®.All trademarks are owned by or licensed toInvacare Corporation or its subsidiaries unless otherwise noted.1180736-B-012014-11-03*1180736B-01*Making Life’s Experiences Possible™。
TKI类药物

过去十年,许多酪氨酸激酶抑制剂(TKI)药物已经在肿瘤领域应用,根据一篇最近的综述,看看截止到2013年8月份,由FDA 和EMA批准的所有TKI药物都有那些。
1、阿西替尼(axitinib,Inlyta)在2012年1月27日获FDA批准治疗对其它药物没有应答的晚期肾癌(肾细胞癌),由辉瑞(Pfizer)公司开发。
阿西替尼是多靶点酪氨酸激酶抑制剂,具体用法为5mg 空腹口服 2/日。
2、克唑替尼(crizotinib,XALKORI)用于治疗ALK阳性的局部晚期或转移的非小细胞肺癌,推荐剂量和方案是250 mg口服每天2次。
3、达沙替尼(Dasatinib,施达赛Sprycel)治疗对包括甲磺酸伊马替尼在内的治疗方案耐药或不能耐受的慢性髓细胞样白血病。
FDA也经正常程序批准达沙替尼治疗对其他疗法耐药或不能耐受的费城染色体阳性的急性淋巴细胞性白血病成人患者。
4、厄洛替尼(Erlotinib,特罗凯Tarceva)既往接受过至少一个化疗方案失败后的局部晚期或转移的非小细胞肺癌。
厄洛替尼单药用于非小细胞肺癌的推荐剂量为150mg/日,至少在进食前1小时或进食后2小时服用。
5、吉非替尼(Gefitinib,易瑞沙Iressa)适用于治疗既往接受过化学治疗或不适于化疗的局部晚期或转移性非小细胞肺癌。
推荐剂量为250mg(1片)每日1次,空腹或与食物同服。
6、伊马替尼(Imatinib,格列卫)用于治疗慢性粒细胞性白血病(CML),胃肠道间质瘤(胃肠道间质瘤)和其他一些疾病。
到2011年,该药已被FDA批准用于治疗10个不同的癌症。
7、拉帕替尼(Lapatinib;泰立沙Tykerb)联合卡培他滨治疗ErbB-2过度表达的,既往接受过包括蒽环类,紫杉醇,曲妥珠单抗(赫赛汀)治疗的晚期或转移性乳腺癌。
推荐剂量为1250mg,每日1次,第1~21天服用,与卡培他宾2000mg/d,第1~14天分2次服联用。
8、尼洛替尼(Nilotinib,达希纳Tasigna)适应症为对既往治疗(包括伊马替尼)耐药或不耐受的费城染色体阳性的慢性髓性白血病(Ph+ CML)慢性期或加速期成人患者。
瑞戈非尼片说明书

核准日期:2017年3月22日 修改日期:2017年12月5日瑞戈非尼片说明书请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:瑞戈非尼片 商品名称:Stivarga® 拜万戈® 英文名称:Regorafenib Tablets 汉语拼音:Ruigefeini Pian【成份】主要成份:瑞戈非尼化学名称:4-[4-({[4-氯-3-(三氟甲基)苯基]氨基甲酰}氨基)-3-氟苯氧基]-N-甲基吡啶-2-甲酰胺一水合物化学结构式:分子式:C 21H 15ClF 4N 4O 3•H 2O 分子量:500.83 【性状】本品为浅粉色椭圆形薄膜衣片。
【适应症】1. 适用于治疗既往接受过以氟尿嘧啶、奥沙利铂和伊立替康为基础的化疗, 以及既往接受过或不适合接受抗VEGF 治疗、 抗EGFR 治疗(RAS 野生型)的转移性结直肠癌(mCRC )患者。
2. 既往接受过甲磺酸伊马替尼及苹果酸舒尼替尼治疗的局部晚期的、无法手术切除的或转移性的胃肠道间质瘤(GIST )患者。
3. 既往接受过索拉非尼治疗的肝细胞癌(HCC )患者。
【规格】警告:肝脏毒性•在临床研究中发生了严重的、有时是致命性的肝脏毒性; •在治疗前及治疗中进行肝功能监测;•在使用瑞戈非尼片治疗中,可根据肝功检测或肝细胞坏死所表现出来的肝脏毒性的严重程度和持续性,暂停后降低剂量或停药。
40mg【用法用量】瑞戈非尼应由在抗癌治疗给药方面有经验的医生开具。
推荐剂量推荐剂量为160mg(4片,每片含40mg 瑞戈非尼),每日一次,于每一疗程的前21天口服,28天为一疗程。
服用方法瑞戈非尼片应在每天同一时间,在低脂早餐(脂肪含量30%)后随水整片吞服。
患者不得在同一天服用两剂药物以弥补(前一天)漏服的剂量。
如果服用瑞戈非尼后出现呕吐,同一天内患者不得再次服药。
治疗时间应持续治疗直至患者不能临床受益或出现不可耐受的毒性反应。
剂量调整及特殊使用说明基于个人的安全性及耐受性考虑,可能需要中断给药或降低剂量。
结直肠癌最全指南——新药提前看
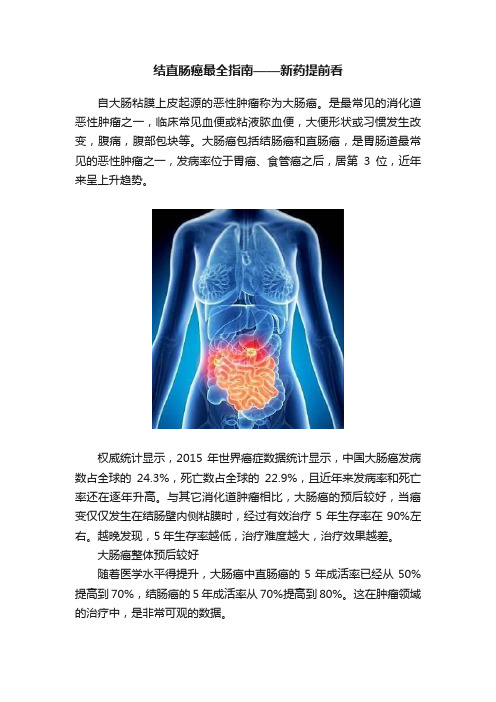
结直肠癌最全指南——新药提前看自大肠粘膜上皮起源的恶性肿瘤称为大肠癌。
是最常见的消化道恶性肿瘤之一,临床常见血便或粘液脓血便,大便形状或习惯发生改变,腹痛,腹部包块等。
大肠癌包括结肠癌和直肠癌,是胃肠道最常见的恶性肿瘤之一,发病率位于胃癌、食管癌之后,居第3位,近年来呈上升趋势。
权威统计显示,2015年世界癌症数据统计显示,中国大肠癌发病数占全球的24.3%,死亡数占全球的22.9%,且近年来发病率和死亡率还在逐年升高。
与其它消化道肿瘤相比,大肠癌的预后较好,当癌变仅仅发生在结肠壁内侧粘膜时,经过有效治疗5年生存率在90%左右。
越晚发现,5年生存率越低,治疗难度越大,治疗效果越差。
大肠癌整体预后较好随着医学水平得提升,大肠癌中直肠癌的5年成活率已经从50%提高到70%,结肠癌的5年成活率从70%提高到80%。
这在肿瘤领域的治疗中,是非常可观的数据。
包括手术、放疗、辅助或姑息化疗、靶向治疗、介入治疗、射频治疗、免疫治疗等积极治疗方案,使大肠癌成为少数可能治愈的肿瘤之一,整体预后较好。
如果及时介入中医中药和中医按摩治疗,十年以上生存期的可能性也大大提高,部分病人可以完全康复。
大肠癌的治疗大肠癌的治疗武器很多,包括手术、放化疗、靶向免疫治疗等等等等,这些武器合理科学的序贯应用、以及持续跟踪、动态病灶评估、疗效评价、毒副作用评价和防治,以及临床策略的及时调整,对大肠癌的健康治疗是至关重要的。
手术治疗:首选的治疗方式,需要评估患者的手术指征。
术前可新辅助化疗/放化疗,以增加手术切除成功率;术后辅助化疗/放化疗、靶向药等其他治疗。
化学治疗:通常作为不能手术治疗的病例的主要治疗方式。
严格按照化疗周期进行用药,定期进行影像学检查以判断肿瘤治疗情况。
放射治疗:可作为手术治疗及化疗的辅助治疗,也可作为部分类型肿瘤的首选治疗方式,放疗期间需注意近期及远期毒性反应。
靶向治疗:针对已经明确的致癌位点的肿瘤患者,通过药物精确的针对癌细胞进行杀灭,不会波及肿瘤周围的正常组织细胞。
瑞戈非尼中文说明书

瑞戈非尼中文说明书瑞戈非尼中文说明书警告:肝毒性·在既往临床研究中报道有严重甚至致命的肝毒性[见警告和注意事项(5.1)]·治疗前和治疗过程中需要监测肝功能[见警告和注意事项(5.1)] ·当肝功能监测发现肝酶升高或肝细胞坏死时,应中止治疗,根据肝功能损失的严重程度和持续时间评估后续是否需要减量或停止拜万戈治疗[见剂量和用法(2.2)]1 适应症和用法1.1 结直肠癌拜万戈获批用于治疗既往接受过氟尿嘧啶、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗VEGF治疗、抗EGFR 治疗(RAS野生型)的转移性结直肠癌患者。
1.2 胃肠间质瘤拜万戈获批用于治疗既往接受过甲磺酸伊马替尼及苹果酸舒尼替尼治疗的局部晚期的、无法手术切除的或转移性的胃肠间质瘤患者。
1.3 肝癌拜万戈获批用于治疗既往接受过索拉非尼治疗的肝细胞肝癌。
2 用法和用量2.1 推荐剂量推荐服用拜万戈的剂量为160mg(4x40mg),口服,1日1次,28天为1个周期,每个周期的第1-21天服药。
持续治疗直至患者出现疾病进展或不可耐受的毒性反应。
在每天同一时间段服药拜万戈。
在低脂饮食(热量低于600卡路里,脂肪含量<30%)后服用[见临床药理学(12.3)],以温开水送服。
若前1天漏服,第2天无需补服前1天的药量。
2.2 剂量调整如果需要调整剂量,每次减量40mg(1片);推荐的拜万戈每日最低剂量为80mg。
出现以下情况时需中止拜万戈治疗:· 再次出现2度的手足皮肤反应(HFSR)[手足综合症(PPES)]或调整剂量后一周内HFSR无缓解;3度的HFSR需要停药至少7天· 有症状的2度高血压· 3-4度的任意不良反应· 任意级别的感染加重出现以下情况时拜万戈需减量至120mg:· 首次出现2度HRSF,无论时间长短· 除感染以为的其他3-4度不良反应恢复后· 3度的天冬氨酸转氨酶(AST)/丙氨酸转氨酶(ALT)升高,仅当潜在获益超过肝脏毒性的风险时才考虑继续原来的用药剂量出现以下情况时拜万戈需减量至80mg:· 在120mg剂量时,再次出现2度HFSR· 在120mg剂量时,任意3-4度不良反应恢复后(肝脏毒性或感染除外)出现以下情况时需终止拜万戈治疗:· 不能耐受80mg剂量· AST或ALT升高超过正常上限(ULN)的20倍· AST或ALT升高超过ULN的3倍且同时伴有胆红素超过ULN2倍· 在减量至120mg剂量时,再次出现AST或ALT升高超过ULN 的5倍· 任意的4度不良反应;仅当潜在获益超过风险时才考虑继续用药3 剂型和优势瑞戈非尼为40mg,淡红色,椭圆形,薄膜包衣片剂,药片两侧分别印有‘BAYER’和‘40’。
UHPLC-MS

UHPLC-MS/MS法测定瑞戈非尼中两种痕量基因毒性杂质陈爽ꎬ刘柱ꎬ石云峰ꎬ朱价ꎬ罗英(浙江省食品药品检验研究院ꎬ浙江杭州310058)摘要:目的㊀建立超高效液相色谱-串联质谱(UHPLC-MS/MS)方法测定瑞戈非尼中两类基因毒性杂质[3-氟-4-氨基苯酚(SM2)㊁3-三氟甲基-4-氯异氰酸苯酯(SM3)]的含量ꎮ方法㊀采用色谱柱AgilentRRHDC18(2.1mmˑ100mmꎬ1.8μm)ꎬ流动相为0.05%甲酸水-甲醇ꎬ梯度洗脱ꎬ流速为0.3mL min-1ꎬ柱温为35ħꎻ采用Agilent1290-6470A液质联用仪和电喷雾离子源(AJSESI)源检测ꎬ正负离子模式采集数据ꎮ结果㊀本方法的专属性㊁线性与范围㊁定量限与检测限㊁准确度㊁精密度及稳定性均符合«中国药典»的验证指标ꎮ结论㊀本方法操作简便ꎬ结果可靠ꎬ用于两批瑞戈非尼中潜在毒性杂质(3-氟-4-氨基苯酚㊁3-三氟甲基-4-氯异氰酸苯酯)的测定ꎮ两批样品中均未检测到SM2ꎬ而基因毒性杂质SM3的含量分别为13.6ˑ10-6和41.4ˑ10-6ꎮ关键词:瑞戈非尼ꎻ基因毒性杂质ꎻ超高效液相色谱-串联质谱中图分类号:R927.1㊀文献标志码:A㊀文章编号:2095-5375(2023)07-0485-005doi:10.13506/j.cnki.jpr.2023.07.010DeterminationoftwotracegenotoxicimpuritiesinRegorafenibbyUHPLC-MS/MSCHENShuangꎬLIUZhuꎬSHIYunfengꎬZHUJiaꎬLUOYing(ZhejiangInstituteforFoodandDrugControlꎬHangzhou310058ꎬChina)Abstract:Objective㊀ToestablishanUHPLC-MS/MSanalyticalmethodforthedeterminationofgenotoxicimpuritiesinRegorafenib.Methods㊀ThemethodwasachievedonaAgilentRRHDC18column(2.1mmˑ100mmꎬ1.8μm)utilizingamobilephaseof0.05%Formicacidwater(A)-Methanol(B)withgradientelutionattheflowrateof0.3mL min-1.Thetemperatureofcolumnwassetat35ħ.TheAgilent1290-6470ALC-MSwasusedtodetect(AJSESIsourceꎬinMultipleReactionMonitoringmode).Results㊀ThespecificityꎬlinearityandrangeꎬLOQandLODꎬaccuracyꎬprecisionandstabilityofthemethodwereallinaccordancewiththevalidationofChinesePharmacopoeia.Conclusion㊀Theproposedmethodwassuccessfullyappliedtodeterminethetrace-levelPGIsintwobatchesofregorafenib.ThecontentsofSM2werenotobservedinthetwobatchesofsamplesꎬwhereasthecontentsofSM3weredeterminedtobe13.6ˑ10-6and41.4ˑ10-6ꎬrespectively.Keywords:RegorafenibꎻGenotoxicimpurityꎻUHPLC-MS/MS㊀㊀基因毒性杂质(或遗传毒性杂质ꎬgenotoxicim ̄purityꎬGTI)是少量即能引起细胞DNA损伤ꎬ诱导基因突变ꎬ并具有致癌倾向的化合物[1]ꎮ欧洲药品管理局(EMEA)㊁美国食品药品管理局(FDA)及人用药品注册技术要求国际协调会(ICH)先后颁布了基因毒性杂质控制的指导文件[2-4]ꎬ推荐以毒理学关注阈值(TTCꎬ1.5μg d-1)来控制用药风险ꎬ并发布基因毒性警示结构基团ꎮ瑞戈非尼(Regorafenib)是拜耳药业研发并于2017年3月在国内上市的一种新型口服多靶点的磷酸激酶抑制剂ꎬ本品以促进肿瘤血管生成和细胞增殖的多种蛋白激酶为靶标ꎬ达到治疗晚期及转移性结肠癌㊁进展期肝细胞癌㊁胃肠道恶性间质肿瘤㊁儿童神经母细胞瘤和胶质母细胞瘤及一些转移性实体肿瘤的目的ꎮ瑞戈非尼的合成路线中起始物料SM2㊁SM3结构中均含有苯胺类基因毒性警示结构基团ꎬ具有潜在基因毒性ꎬ详见图1ꎮ瑞戈非尼已收载于«中国药典»和«欧洲药典»ꎬ已经报道了一种LC-MS/MS法定量同时测定肝细胞癌患者血浆中瑞戈非尼中及其两种活性代谢物的含量的方法[17]ꎬ但目前也未见相关文献报道本品中两种苯胺类基因毒性杂质SM2㊁SM3的测定方法ꎮ㊀作者简介:陈爽ꎬ女ꎬ硕士ꎬ副主任药师ꎬ研究方向:药物质量研究㊁标准提高研究ꎬE-mail:credear@126.comA.3-氟-4-氨基苯酚(SM2)ꎻB.3-三氟甲基-4-氯异氰酸苯酯(SM3)图1㊀瑞戈非尼中苯胺类基因毒性杂质结构因此建立超高效液相色谱-串联质谱(UHPLC-MS/MS)方法对瑞戈非尼中少量的苯胺类基因毒性杂质的含量进行控制ꎮ本研究依照ICH推荐的条件ꎬ建立了方法并从方法的专属性㊁溶液稳定性㊁线性与范围㊁定量限与检测限㊁准确度㊁精密度方面进行了方法学研究ꎬ本法灵敏㊁可靠㊁简便ꎬ为瑞戈非尼工艺过程控制和质量保障提供参考依据ꎮ1㊀仪器与试剂Agilent1290-6470ALC-MS联用系统(美国安捷伦)ꎬ配备电喷雾离子源(AJSESI)ꎬ质谱软件为AgilentMassHunter工作站ꎻXS205DU百万分之一电子天平(瑞士梅特勒托利多公司)ꎮAgilentRRHDC18(2.1mmˑ100mmꎬ1.8μmꎬ填料:十八烷基硅烷键合硅胶ꎻAgilent公司)ꎮ3-氟-4-氨基苯酚对照品(批号:P1156811ꎬ纯度:98%)ꎬ3-三氟甲基-4-氯异氰酸苯酯对照品(杭州华东医药集团新药研究院有限公司ꎬ批号:191201ꎬ纯度:99.76%)ꎻ瑞戈非尼(批号:RGFN-B-190901㊁Z193-A1911001ꎬ由A公司提供)ꎻ甲醇(默克试剂有限公司)㊁异丙醇㊁甲酸(阿拉丁有限公司)均为色谱级ꎮ2㊀方法与结果2.1㊀色谱条件㊀液相色谱柱:AgilentRRHDC18(2.1mmˑ100mmꎬ1.8μm)ꎻ流速0.3mL min-1ꎻ0.05%甲酸水为流动相Aꎬ甲醇为流动相Bꎬ梯度洗脱(0~1.2minꎬ10%Bꎻ1.2~4.0minꎬ10%Bң60%Bꎻ4.0~8.0minꎬ60%Bꎻ8.0~13.0minꎬ95%Bꎻ13.0~13.10minꎬ95%Bң10%Bꎻ13.10~15.0minꎬ10%B)ꎻ柱温35ħꎻ进样体积5μLꎮ取0.6ng mL-1混标对照品溶液ꎬ在MRM模式下进样分析ꎬ结果如图2所示ꎬ各杂质之间分离度良好ꎮ2.2㊀质谱条件㊀采用电喷雾离子源(AJSESI)ꎬ正负离子检测模式MRM采集(SM2正离子模式㊁SM3㊀SM2[3-氟-4-氨基苯酚(3-Fluoro-4-aminophenol)]ꎻSM3[3-三氟甲基-4-氯异氰酸苯酯(3-trifluoromethyl-4-phenyl ̄chloroisocyanate)]图2㊀混合对照品溶液总离子流图负离子模式)ꎬ参数见表1ꎮ喷雾电压为3.5kVꎬ鞘气为250ħꎬ鞘气流速为11L min-1ꎬ雾化气为45psiꎬ干燥气温度为300ħꎬ干燥气流速为5L min-1ꎮ母离子及子离子:取0.6μg mL-1混标对照品溶液ꎬ在Scan模式下进样ꎬ进行MS分析ꎬ两种基因毒性杂质的质谱图如图4所示ꎬ其中3-氟-4-氨基苯酚的母离子为m/z128.05ꎬ3-三氟甲基-4-氯异氰酸苯酯的母离子为m/z280.00ꎮ各基因毒性杂质的MRM参数见表1ꎬ定量离子及定性离子的选择见表1ꎮ表1㊀MRM采集参数设置化合物类型母离子(m/z)子离子(m/z)碰撞能量/eV碎裂电压/V扫描时间/msSM2(ESI+)SM3(ESI-)定量离子128.0510817定性离子128.0581.125定量离子280219.913定性离子280199.92585112100㊀SM2[3-氟-4-氨基苯酚(3-fluoro-4-aminophenol)]ꎻSM3[3-三氟甲基-4-氯异氰酸苯酯(3-trifluoromethyl-4-phenyl ̄chloroisocyanate)]图3㊀两种基因毒性杂质的质谱图2.3㊀混标对照品溶液㊀精密称取3-氟-4-氨基苯酚对照品㊁3-三氟甲基-4-氯异氰酸苯酯对照品各约6mgꎬ加稀释剂异丙醇溶解并稀释成6ng mL-1的混标对照品储备液ꎮ精密量取适量ꎬ稀释10倍ꎬ作为0.6ng mL-1混标对照品溶液ꎮ2.4㊀供试品溶液㊀取本品约20mgꎬ精密称定ꎬ置20mL容量瓶ꎬ用稀释剂溶解并稀释到刻度ꎬ摇匀ꎻ再精密量取0.1mLꎬ置10mL容量瓶ꎮ异丙醇稀释至刻度ꎬ摇匀ꎬ作为供试品溶液(10μg mL-1)ꎮ2.5㊀100%加标供试品溶液㊀取本品约20mgꎬ精密称定ꎬ置20mL量瓶中ꎬ用异丙醇溶解稀释至刻度ꎬ摇匀ꎻ再精密量取0.1mLꎬ置10mL容量瓶ꎬ加入1mL对照品储备液后ꎬ再用异丙醇稀释至刻度ꎬ摇匀ꎬ作为100%加标供试品溶液ꎮ2.6㊀方法学考察㊀2.6.1㊀专属性试验㊀取稀释剂照上述条件进行试验ꎬ记录色谱图ꎬ结果显示稀释剂不干扰测定ꎬ表明该方法专属性良好ꎮ2.6.2㊀线性关系㊁检测限和定量限㊀精密量取混标对照品储备液适量ꎬ加稀释剂稀释得到浓度分别为0.15㊁0.3㊁0.45㊁0.6㊁0.9㊁1.2ng mL-1的混标对照品溶液ꎬ进样分析ꎬ绘制标准曲线ꎬ得线性方程(见表2)ꎮ逐步稀释ꎬ考察定量限及检测限(见图4)ꎮ表2㊀瑞戈非尼中两种基因毒性杂质的线性范围㊁定量检测限及精密度参数SM2SM3线性方程Y=4799.5X+27.1Y=893.3X+27.1范围/ng mL-10.15~1.170.15~1.19r0.99990.9991检测限/ng mL-10.060.06定量限/ng mL-10.150.15精密度RSD(%)1.321.97中间精密度RSD(%)2.532.24图4㊀定量限和检测限MRM质谱图2.6.3㊀稳定性试验㊀取 2.3 项下0.6ng mL-1的混标对照品溶液ꎬ 2.5 项下10μg mL-1的100%加标供试品溶液ꎬ连续进样16h进行分析ꎬ各峰面积偏离度的绝对值在8h内均小于17.22%ꎬ表明对照品溶液和100%加标供试品溶液在8h内稳定性良好ꎮ2.6.4㊀准确度和精密度试验㊀精密称取瑞戈非尼(批号:RGFN-B-190901㊁Z193-A1911001)约20mgꎬ一式12份ꎬ分别置20mL量瓶中ꎬ用异丙醇溶解稀释至刻度ꎬ摇匀ꎻ再精密量取0.1mLꎬ置10mL容量瓶ꎬ精密加入 2.3 项下浓度为6ng mL-1的混标对照品储备液溶液0.25㊁0.5㊁1.0㊁1.5mLꎬ分别溶解并稀释至刻度ꎬ摇匀ꎬ即得低(0.15ng mL-1ꎬ3份)㊁中(0.30ng mL-1ꎬ3份)㊁高(0.60ng mL-1ꎬ3份)㊁极高(0.90ng mL-1ꎬ3份)4个浓度的供试品加标溶液ꎬ取混标对照品溶液和各加标供试品溶液分别进样分析ꎬ外标法计算回收率结果见表3ꎬ各基因毒性杂质回收率均在90.64%~105.44%之间ꎬRSD均小于3.50%ꎬ表明各基因毒性杂质回收率和精密度良好ꎮ2.7㊀样品测定㊀取瑞戈非尼供试品2批(批号:RGFN-B-190901㊁Z193-A1911001)ꎬ每批精密称取2份约20mgꎬ置20mL量瓶中ꎬ加稀释剂溶解并稀释至刻度ꎬ摇匀ꎻ再精密量取0.1mLꎬ置10mL容量瓶ꎬ异丙醇稀释至刻度ꎬ摇匀ꎬ作为供试品溶液(10μg mL-1)ꎬ进样分析ꎬ结果2批次瑞戈非尼中SM2均未检出ꎬSM3均有检出(见表4)ꎮ表3㊀瑞戈非尼中各基因毒性杂质的回收率化合物加入量测得量回收率平均回收RSD(%)SM31.502.995.988.982.77101.332.78100.673.9790.644.1395.994.32102.347.0596.827.2299.677.42102.8410.25100.0010.0998.3310.2399.8999.153.41表4㊀瑞戈非尼中基因毒性杂质检测结果批号SM2含量(%)SM3含量(%)Z193-A19110010.00000.00136RGFN-B-1909010.00000.004143㊀讨论3.1㊀瑞戈非尼的合成工艺㊀如图1所示ꎬ以3-氟-4-氨基苯酚和N-甲基-4-氯-2-吡啶甲酰胺为原料㊁氢氧化钠为碱ꎬTHF为溶剂ꎬ回流反应得到中间体4-(4-氨基-3-氟苯氧基)-N-甲基吡啶-2-甲酰胺ꎬ该中间体再与4-氯-3-三氟甲基苯胺以羰基连接得到瑞戈非尼无水物(4-[4-[[[4-氯-3-(三氟甲基)苯基]氨基甲酰]氨基]-3-氟苯氧基]-N-甲基吡啶-2-甲酰胺)ꎬ加水而成ꎮ合成路线中涉及多个起始物料及中间体带有基因警示结构ꎬ因此ꎬ必须对瑞戈非尼合成路线中引入的带有基因警示结构的潜在基因毒性杂质进行控制ꎮ3.2㊀控制限度㊀参照瑞戈非尼片药品使用说明书ꎬ建议每日最低剂量为80mgꎬ每日最高剂量为160mgꎮ因为瑞戈非尼为抗肿瘤用药ꎬ可以不以ICHM7推荐的最严格的毒理学关注阈值(TTCꎬ1.5μg d-1)为控制限制ꎮ本研究基于治疗期ꎬ以相对严格的1~10年治疗期的TTC(10μg d-1)为控制限制计算ꎬ瑞戈非尼中基因毒性杂质限度应为62.5ˑ10-6ꎬ本研究以60ˑ10-6作为瑞戈非尼中基因毒性杂质的控制限度ꎮ本次研究用样品中未检出SM2ꎬ检出的SM3分别为13.6ˑ10-6㊁41.4ˑ10-6ꎬ均符合限度要求ꎬ但SM3检出量已超30%限度ꎬ值得关切ꎮ3.3㊀色谱条件的优化㊀色谱条件优化试验中ꎬ探索了甲醇㊁异丙醇和乙腈3种有机相(B相)ꎬ水相(A相)中添加不同比率的酸(0.1%甲酸水ꎬ0.05%甲酸水和0.1%乙酸水)对分离度和灵敏度的影响ꎮ结果显示ꎬ采用AgilentRRHDC18色谱柱ꎬ当流动相0.05%甲酸水溶液-甲醇梯度洗脱时ꎬ3-氟-4-氨基苯酚(SM2)㊁3-三氟甲基-4-氯异氰酸苯酯(SM3)响应较好ꎬ且两个化合物分离度良好ꎬ故流动相中选择0.05%甲酸水ꎮ本试验考察了流速0.2~0.4mL min-1范围内对苯胺类物质响应和峰形的影响ꎬ发现流速0.3mL min-1时ꎬSM2ꎬSM3离子化效率最高ꎬ出峰时间合适ꎬ且峰形较好ꎮ3.4㊀质谱解析㊀3-氟-4-氨基苯酚的质谱图中m/z128.05为[M+H]+离子ꎬ主要的碎片离子有m/z108和m/z81.1ꎬ其中m/z108为去氟基产物ꎬ反映了3-氟-4-氨基苯酚的结构特征ꎮ试验对3-氟-4-氨基苯酚2个离子对m/z128.05ң108和m/z128.05ң81.1的MRM参数见表1ꎬ其中ꎬ离子对m/z128.05ң108的信噪比较离子对m/z128.05ң81.1更高ꎬ因此选择m/z128.05ң108作为定量离子对ꎬm/z128.05ң81.1作为定性离子对ꎮ本法中SM3检测采用异丙醇衍生化ꎬ分析对象为SM3与异丙醇衍生后的产物ꎮ衍生产物精确分子量为281.04ꎬ其[M-H]-为280ꎬ反应过程见图5ꎮ图5㊀SM3衍生化反应(下转第525页)fattyacidbiogenesis:anewfamilyofanti-canceragents?[J].CurrPharmBiotechnolꎬ2006ꎬ7(6):483-493.[87]CHENXꎬHUANGKꎬHUSꎬetal.FASN-MediatedLipidMetabolismRegulatesGooseGranulosaCellsApoptosisandSteroidogenesis[J].FrontinPhysiolꎬ2020(11):600.[88]CHOYKꎬSONYꎬKIMSNꎬetal.MicroRNA-10a-5pregulatesmacrophagepolarizationandpromotestherapeuticadiposetissueremodeling[J].MolMetabꎬ2019(29):86-98.[89]XUEMꎬYANGMxingꎬZHANGWꎬetal.Characterizationꎬpharmacokineticsꎬandhypoglycemiceffectofberberineloadedsolidlipidnanoparticles[J].IntJNanomedicineꎬ2013(8):4677-4687.[90]XUEMꎬZHANGLꎬYANGMXꎬetal.Berberine-loadedsolidlipidnanoparticlesareconcentratedintheliverandamelioratehepatosteatosisindb/dbmice[J].IntJNano ̄medicineꎬ2015(10):5049-5057.[91]ZHAOJꎬZHAOQꎬLUJZꎬetal.NaturalNano-DrugDe ̄liverySysteminCoptidisRhizomaExtractwithModifiedBerberineHydrochloridePharmacokinetics[J].IntJNanomedicineꎬ2021(16):6297-6311.[92]DUONGTTꎬISOMÄKIAꎬPAAVERUꎬetal.Nanoformu ̄lationandEvaluationofOralBerberine-LoadedLiposomes[J].Moleculesꎬ2021ꎬ26(9):2591.[93]SAHIBZADAMUKꎬZAHOORMꎬSADIQAꎬetal.Bio ̄availabilityandhepatoprotectionenhancementofberberineanditsnanoparticlespreparedbyliquidantisol ̄ventmethod[J].SaudiJBiolSciꎬ2021ꎬ28(1):327-332.[94]CHOWYLꎬSOGAMEMꎬSATOF.13-Methylberberineꎬaberberineanaloguewithstrongeranti-adipogeniceffectsonmouse3T3-L1cells[J].ScientificReportsꎬ2016ꎬ6(1):38129.[95]REBELLOCJꎬGREENWAYFL.Obesitymedicationsindevelopment[J].ExpertOpinInvestigDrugsꎬ2020ꎬ29(1):63-71.(收稿日期:2022-12-31)(上接第488页)㊀㊀SM3衍生产物ꎬ在质谱离子源中ꎬ子离子为酯键断裂后重排的m/zꎬ碎裂途径见图6ꎮ图6㊀SM3子离子裂解途径本研究建立了超高效液相色谱-串联质谱法测定瑞戈非尼中的2种基因毒性杂质(3-氟-4-氨基苯酚(SM2)㊁3-三氟甲基-4-氯异氰酸苯酯(SM3)ꎬ并进行了方法学验证ꎬ可以有效控制瑞戈非尼的潜在基因毒性杂质ꎮ该方法专属性强ꎬ灵敏度高ꎬ满足基因毒性杂质测定要求ꎬ可以作为瑞戈非尼原料药中基因毒性杂质的质控方法ꎮ参考文献:[1]㊀EuropeanMedicinesAgency(EMA).GuidelineontheLimitsofGenotoxicImpurities(欧洲药品管理局关于基因毒性杂质限度指导原则)[EB/OL].[2015-03-02].http://www.Ema.Europa.eu/docs/en_GB/document_li ̄brary/Scientific_guideline/2009/09/WC500002903.pdf.[2]EuropeanMedicinesAgency(EMA).QuestionsandAnswersontheGuidelineontheLimitsofGenotoxicIm ̄purities[EB/OL].(2010-09-23)[2015-03-02].http//www.ema.europa.eu/docs/en_GB/document_library/Sci ̄entific_guideline/2009/09/WC500002907.pdf.[3]FoodandDrugAdministration(FDA).GenotoxicandCar ̄cinogenicImpuritiesInDrugSubstancesandProducts:RecommendedApproaches.[2015-08-26].[4]InternationalConferenceonHarmonizationofTechnicalRequirementsforRegistrationofPharmaceuticalsforHu ̄manUse(ICH).AssessmentandControlofDNAReactive(Mutagenic)ImpuritiesinPharmaceuticalstoLimitPo ̄tentialCarcinogenicRiskM7(R1).[2015-08-26].[5]RAMANNVVSSꎬPRASADAVSSꎬREDDYKR.Strategiesfortheidentificationꎬcontrolanddeterminationofgenotoxicimpuritiesindrugsubstances:apharmaceuticalindustryperspectives[J].JPharmBiomedAnalꎬ2011ꎬ55(4):662-667.[6]SZEKELYGꎬAMORESDESOUSAMCꎬGILMꎬetal.GenotoxicImpuritiesinPharmaceuticalManufacturing:SourcesꎬRegulationsꎬandMitigation[J].ChemicalReviewsꎬ2015ꎬ115(16):8182-8229.[7]甘勇军ꎬ王以武ꎬ张量ꎬ等.瑞戈非尼的合成工艺优化[J].中国医药工业杂志ꎬ2020ꎬ51(2):196-199.[8]曹琳ꎬ罗淑青ꎬ章燕ꎬ等.LC-QQQ-MS/MS分析苯磺酸氨氯地平中痕量苯磺酸酯类基因毒性杂质[J].中国现代应用药学ꎬ2020ꎬ37(11):1296-1300.[9]芦飞ꎬ邢珊珊ꎬ王咏.LC-MS测定醋酸甲羟孕酮中对甲苯磺酸甲酯及对甲苯磺酸乙酯的含量[J].中国现代应用药学ꎬ2018ꎬ35(5):657-659.(收稿日期:2023-02-24)。
瑞戈非尼用法

瑞戈非尼用法
瑞戈非尼是一种医药产品,主要用于治疗白血病和其他一些白血病相关疾病。
它属于一类特殊的药物,称为激酶抑制剂。
瑞戈非尼通过抑制异常激酶信号通路,抑制白血病细胞的生长和增殖。
瑞戈非尼通常以口服药丸的形式给予患者。
在开始使用之前,患者应该准确地
按照医生的指示来服用药物。
一般建议在饭后服用,以减少胃部不适的发生。
每日建议剂量会根据患者的具体情况而有所不同,因此患者需要按照医生的指示来调整剂量。
在使用瑞戈非尼期间,患者需要密切关注自己的身体状况。
如果出现任何不适
或副作用,应立即告知医生。
常见的副作用包括恶心、呕吐、腹泻、疲劳等。
此外,瑞戈非尼还可能导致血小板和白细胞数量下降,增加感染和出血的风险。
因此,密切的监测和定期的血液检查是必要的。
在使用瑞戈非尼期间,患者还需要遵循一些特殊的注意事项。
首先,避免接触
任何可能引起刺激或损伤的物质,如尖锐的物体和化学品。
此外,避免食用或接触有可能被污染的食物,以免引发食物中毒。
最后,遵循良好的个人卫生习惯,保持清洁和卫生。
总之,瑞戈非尼是一种用于治疗白血病和其他白血病相关疾病的药物。
患者在
使用瑞戈非尼期间应该密切遵循医生的指示,并注意监测身体状况和副作用。
此外,遵循特殊的注意事项可以帮助患者更好地管理他们的疾病。
瑞格菲尼中文说明书

【药物名】Regorafenib【商品名】Stivarga【通用名】瑞格非尼【初次获批时间】2012年【类别】小分子抑制剂【靶点】VEGFR【分子结构】分子式:C21H15ClF4N4O3•H2O分子量为:500.83【生产公司】拜耳医疗保健制药有限公司【适应症】 Stivarga 是一种激酶抑制剂适用于既往曾用基于氟嘧啶、奥沙利铂和伊立替康化疗方案(抗VEGF疗法)以及如果是KRAS野生型(抗EGFR 疗法)的转移结肠直肠癌(CRC)患者的治疗。
Stivarga还可以用于治疗曾接受甲磺酸伊马替尼和苹果酸舒尼替治疗的局部晚期、不可移除的或转移性胃肠道间质瘤患者的治疗。
【剂量和药物管理】推荐剂量: 28天为一个周期,每个周期的前21天,每天一次性口服160毫克Regorafenib。
持续治疗直到出现疾病进展或不可耐受的药物毒性。
每天的同一时间服药,用药前用低脂餐(热量少于60卡路里,脂肪少于30%)。
不要再同一天服用两剂Stivarga。
剂量调整:出现以下情况,中断用药:出现2级的手足皮肤反应,且反复发作,即使减少用药量也无法在7天内缓解。
若出现3级的手足皮肤反应,至少停药7天;出现症状的2级高血压;3级或4级副反应。
将剂量减少到120毫克: 2级的手足皮肤反应首次复发;3级或4级副反应缓解后;3级天冬氨酸转氨酶(AST)/丙氨酸转氨酶(ALT)升高,且用药获益大于潜在风险。
将剂量减少到80毫克: 120毫克剂量时,2级的手足皮肤反应复发;120毫克时,3级或4级副反应恢复后;永久停药:无法耐受80毫克剂量;AST或ALT超过20倍的正常上限值;AST或ALT超过3倍的正常上限值,伴随着胆红素超过2倍的正常上限值;剂量减少到120毫克后,AST或ALT超过5倍的正常上限值;任何4级不良反应。
【剂型和规格】40毫克、淡粉色、椭圆形、有薄膜包衣,两边分别写有“BAYER”和‘40’。
【禁忌症】无。
【警告和注意事项】(1)出血:对严重或威胁生命出血永久终止Stivarga。
曲前列尼尔注射液Treprostinil-详细说明书与重点

曲前列尼尔注射液Treprostinil 【商品名称】瑞莫杜林Remodulin成份:本品主要成份为曲前列尼尔。
化学名称:[[(1R, 2R, 3aS, 9aS)-2, 3, 3a, 4, 9, 9a-六氢-2-羟基-1-[(3S)-3-羟基辛烷基]-1 H -苯并[f]茚-5-基]氧基]乙酸,化学结构式:分子式:C23H34O5分子量:390.52辅料:枸橼酸钠二水合物﹑盐酸﹑间甲酚﹑氢氧化钠﹑氯化钠﹑注射用水。
适应症:本品用于治疗肺动脉高压(PAH, WHO分类1)﹐以减轻运动引起的相关症状。
在建立本品疗效的研究中﹐研究受试者包括NYHA功能分级II∼IV级的原发性和遗传性肺动脉高压(58%)﹑与先天性体肺循环分流相关的肺动脉高压(23%)以及与结缔组织疾病相关的肺动脉高压(19%)。
规格:(1)20ml : 20mg (2)20ml : 50mg (3)20ml : 100mg (4)20ml : 200mg用法用量:本品用20ml玻璃瓶包装﹐共有四个规格﹐分别含有20﹑50﹑100或200mg曲前列尼尔(1mg/ml ﹑2.5mg/ml﹑5mg/ml或10mg/ml)。
本品输注前需用注射用水或0.9%NaCl注射液稀释。
本品的给药方式为皮下或静脉注射给药。
首次接受前列环素输注治疗患者的初始剂量:本品只能连续皮下(SC)或静脉(IV)输注。
皮下输注是首选给药路径﹐但是﹐如果因为输注部位严重疼痛或反应而不能耐受皮下给药﹐也可经中心静脉导管给药。
初始输注速率为1.25ng/kg/min。
如果由于全身效应不能耐受初始剂量﹐应将注射速率降低至0.625ng/kg/min。
剂量调整:长期剂量调整的目标是确定曲前列尼尔的剂量﹐使其可改善肺动脉高压症状﹐同时减少本品的其他药理学效应(头痛﹑恶心﹑呕吐﹑坐立不安﹑焦虑以及输注部位疼痛或反应)。
根据临床疗效进行剂量调整。
在治疗的前四周﹐输注速率的增加值为每周1.25ng/kg/min﹐之后为每周2.5ng/kg/min。
化学仿制药参比制剂目录(第二十九批)(征求意见稿)
225mg
胶囊剂
GlaxoSmithKline LLC
未进口原研药品
美国橙皮书
29-29
盐酸普罗帕酮缓释胶囊
Propafenone Hydrochloride Extended-release Capsules
/Rythmol SR
325mg
胶囊剂
GlaxoSmithKline LLC
78mg/0.5ml
(以棕榈酸帕利哌酮计)
注射剂
Jassen Pharmaceuticls Inc
未进口原研药品
美国橙皮书
29-23
棕榈酸帕利哌酮注射液
Paliperidone Palmitate Extended-releaseInjectable Suspension/Invega Sustenna
29-12
盐酸氮卓斯汀滴眼液
Azelastine Hydrochloride Eye Drops
6ml:3mg
眼用制剂
MEDA PharmaGmbH& Co. KG
国内上市的原研药品
原研进口
29-13
伊布替尼胶囊
Ibrutinib Capsules
/Imbruvica(亿珂)
140mg
胶囊剂
Pharmacyclics LLC
国内上市的原研药品
原研进口
29-6
荧光素钠注射液
Fluorescein Sodium Injection
/Fluorescite(历设得)
5ml:0.5g(10%)
(以荧光素计)
注射剂
Alcon Laboratories Inc
国内上市的原研药品
EPOXY PLUS RESIN 产品说明书

14350REVISION DATE: 07/10/2008SAFETY DATA SHEETEPOXY PLUS RESINPRODUCT NO.X0152SUPPLIERITW DEVCONBAY 150SHANNON INDUSTRIAL ESTATESHANNONCO CLAREIRELANDT: +353 (0)61471299F: 353(0)61471285the aquatic environment.CLASSIFICATION Xi;R36/38. R43. N;R51/53.HUMAN HEALTHAvoid contact with skin and eyes. In case of accident or if you feel unwell, seek medical advice immediately (show label where possible). INHALATIONMove the exposed person to fresh air at once. When breathing is difficult, properly trained personnel may assist affected person by administering oxygen. Contact physician if discomfort continues.INGESTIONDo not induce vomiting. If vomiting occurs, the head should be kept low so that stomach vomit doesn't enter the lungs. Drink a few glasses of water or milk. Get medical attention.SKIN CONTACTRemove affected person from source of contamination. Wash skin thoroughly with soap and water for several minutes. Contact physician if irritation persists.EYE CONTACTPromptly wash eyes with plenty of water while lifting the eye lids. Continue to rinse for at least 15 minutes and get medical attention.EXTINGUISHING MEDIAExtinguish with foam, carbon dioxide or dry powder.EPOXY PLUS RESINSPECIAL FIRE FIGHTING PROCEDURESAvoid breathing fire vapours. Keep up-wind to avoid fumes. Avoid water in straight hose stream; will scatter and spread fire. Keep run-off water out of sewers and water sources. Dike for water control.SPECIFIC HAZARDSBy heating and fire, irritating vapours/gases may be formed.PROTECTIVE MEASURES IN FIREAvoid contact with skin and eyes. Wear protective clothing as described in Section 8 of this safety data sheet. Provide adequate ventilation. ENVIRONMENTAL PRECAUTIONSDo not allow to enter drains, sewers or watercourses. Spillages or uncontrolled discharges into watercourses must be IMMEDIATELY alerted to the Environmental Agency or other appropriate regulatory body.SPILL CLEAN UP METHODSAbsorb with sand or other inert absorbent. Transfer to covered steel drums for disposal. Containers with collected spillage must be properlyUSAGE PRECAUTIONSUse only in well-ventilated areas. Keep away from heat, sparks and open flame. Open drum carefully as content may be under pressure. Do not eat, drink or smoke when using the product. Observe good industrial hygiene practices.STORAGE PRECAUTIONSPROTECTIVE EQUIPMENTPROCESS CONDITIONSProvide eyewash, quick drench.ENGINEERING MEASURESProvide adequate general and local exhaust ventilation.RESPIRATORY EQUIPMENTIf ventilation is insufficient, suitable respiratory protection must be provided.HAND PROTECTIONUse protective gloves made of: Rubber or plastic. Butyl rubber gloves are recommended.EYE PROTECTIONWear approved chemical safety goggles where eye exposure is reasonably probable.HYGIENE MEASURESKeep away from food, drink and animal feeding stuffs. Good personal hygiene is necessary. Wash hands and contaminated areas with water and soap before leaving the work site. Do not eat, drink or smoke when using the product. Change work clothing daily before leaving work place.SKIN PROTECTIONEPOXY PLUS RESINAPPEARANCE Viscous liquidCOLOUR GreyODOUR Slight odourSOLUBILITY Slightly soluble in water.BOILING POINT (°C)>260MELTING POINT (°C)N/DRELATIVE DENSITY 1.39 25 ºC VAPOUR DENSITY (air=1)>1VAPOUR PRESSURE0.03 mmHg 77.2EVAPORATION RATE<<1 (butyl acetate =1) pH-VALUE, CONC. SOLUTION7 @ 20 ºC FLASH POINT (°C)>204.4STABILITYStable under normal temperature conditions and recommended use.CONDITIONS TO AVOIDAvoid heat, flames and other sources of ignition.HAZARDOUS POLYMERISATIONWill not polymerise.MATERIALS TO AVOIDAvoid contact with: Strong oxidising agents. Strong acids. Amines.HAZARDOUS DECOMPOSITION PRODUCTSSKIN CONTACTIrritating to skin. May cause sensitisation by skin contact.EYE CONTACTIrritating to eyes.HEALTH WARNINGSPreparation contains an epoxy resin, which may cause sensitisation and development of allergy.Avoid releasing to the environment. The product contains substances which are toxic to aquatic organisms and which may cause long term adverse effects in the aquatic environment.MOBILITYDo not discharge into drains, water courses or onto the ground.WATER HAZARD CLASSIFICATIONWGK 2Dispose of waste and residues in accordance with local authority requirements.WASTE CLASSEPOXY PLUS RESINUK ROAD CLASS9PROPER SHIPPING NAME ENVIRONMENTALLY HAZARDOUS SUBSTANCE, LIQUID, N.O.S. (EPOXY RESIN (Number averageMW <= 700 ))UK ROAD PACK GR.UN NO. ROAD III3082ADR CLASS NO.Class 9: Miscellaneous9ADR CLASSdangerous substances andarticles.ADR PACK GROUP90HAZARD No. (ADR)IIIADR LABEL NO.2XHAZCHEM CODE9RID CLASS NO.CEFIC TEC(R) NO.990GM6-IIIUN NO. SEARID PACK GROUP3082IIIIMDG CLASS9IMDG PAGE NO.9EMSIMDG PACK GR.F-A, S-FIIIMARINE POLLUTANTSee GuideMFAG No.AIR CLASSUN NO. AIR93082Irritant Dangerous for theenvironmentCONTAINS EPOXY RESIN (Number average MW <= 700 )RISK PHRASESR51/53Toxic to aquatic organisms, may cause long-term adverse effects in the aquaticenvironment.R43May cause sensitisation by skin contact.R36/38Irritating to eyes and skin.SAFETY PHRASESS26In case of contact with eyes, rinse immediately with plenty of water and seek medicaladvice.Wear suitable gloves and eye/face protection.S37/39REV. NO./REPL. SDS GENERATED5DATE18.01.2005RISK PHRASES IN FULLR36/38Irritating to eyes and skin.R43May cause sensitisation by skin contact.R51/53Toxic to aquatic organisms, may cause long-term adverse effects in the aquatic environment.EPOXY PLUS RESINDISCLAIMERThis information relates only to the specific material designated and may not be valid for such material used in combination with any other materials or in any process. Such information is, to the best of the company's knowledge and belief, accurate and reliable as of the date indicated. However, no warranty guarantee or representation is made to its accuracy, reliability or completeness. It is the user's responsibility to satisfy himself as to the suitability of such information for his own particular use.14350。
索拉菲尼中文说明书

索拉菲尼中文说明书 The document was finally revised on 2021【药物名】sorafenib(索拉菲尼)【商品名】NEXAVAR【美国上市时间】2005, 优先审评,孤儿药物【类别】小分子【靶点】多靶点【分子结构】分子式:C21H16ClF3N4O3 × C7H8O3S分子质量: g/mol【生产公司】拜耳药业【购买地】美国【剂型和规格】口服片剂,200 mg/片【适应症和用途】多吉美是一种激酶抑制剂适用于治疗(1)不可切除的肝细胞癌(2)晚期肾细胞癌【本质】多吉美,一种激酶抑制剂,是索拉非尼的甲苯磺酸盐。
索拉非尼甲苯磺酸盐是一种白色至黄或棕色固体有分子式C21H16ClF3N4O3 × C7H8O3S和一个分子量g/mole。
索拉非尼甲苯磺酸盐特别不溶于水性介质,轻微溶于乙醇和溶于PEG 400。
各红,圆形多吉美薄膜包衣片含索拉非尼甲苯磺酸盐(274 mg)等同于200 mg索拉非尼和以下无活性成分:交联羧甲基纤维素钠,微晶纤维素,羟丙甲纤维素, 十二烷基硫酸钠, 硬脂酸镁, 聚乙二醇, 二氧化钛和三氧化二铁。
【作用机理】索拉非尼是一种激酶抑制剂在体外减低肿瘤细胞增殖。
索拉非尼显示抑制多种细胞内(CRAF, BRAF和mutant BRAF)和细胞表面激酶(KIT, FLT-3, RET, VEGFR-1, VEGFR-2, VEGFR-3,和PDGFR)。
这些激酶的几种被认为涉及肿瘤细胞内信号,血管生成,和凋亡。
在免疫功能低下小鼠中索拉非尼抑制人肝细胞癌和肾细胞癌和几种其它人肿瘤异种移植的肿瘤生长和血管生成。
【用法用量】(1)400 mg(2片)口服每天2次无食物。
(2)为处理怀疑不良药物反应可能需要中断治疗和/或减低剂量。
剂量可减低至400 mg每天1次或至400 mg每隔天1次.【储存方法】Venclexta应存储在86°F (30°C)温度以下;在接受治疗的第一个月内,将药片保存在原包装盒内,不要把药片放入别的容器中。
瑞戈非尼的功能主治

瑞戈非尼的功能主治1. 什么是瑞戈非尼瑞戈非尼是一种处方药物,作为一种非典型抗精神病药物,其活性成分为雷柏噻嗪。
它主要用于治疗精神分裂症和双相情感障碍。
瑞戈非尼可通过调节多巴胺和5-羟色胺等神经递质的活动来改善相关症状。
2. 瑞戈非尼的功能瑞戈非尼具有多种功能,主要包括:2.1 控制精神分裂症症状瑞戈非尼被广泛用于治疗精神分裂症。
它能够调节多巴胺的活动,减少多巴胺在脑部的过度活跃,从而改善幻听、妄想、思维紊乱等症状。
瑞戈非尼还能够减轻情感淡漠和社交退缩等精神分裂症的负性症状。
2.2 减少双相情感障碍的复发双相情感障碍是一种情绪波动剧烈的精神疾病,包括躁狂和抑郁两个极端。
瑞戈非尼作为稳态药物,可用于预防和减少双相情感障碍的复发。
它可通过调节神经递质活动来稳定情绪,减少躁狂和抑郁发作的频率和严重程度。
2.3 辅助治疗其他精神病症状除了上述两种主要功能外,瑞戈非尼还可用于辅助治疗其他一些精神病症状,包括焦虑、睡眠障碍和冲动控制障碍等。
它可以通过影响多巴胺和5-羟色胺活动来调节相关症状,帮助患者恢复正常的情绪和行为。
3. 瑞戈非尼的使用注意事项在使用瑞戈非尼时,请注意以下事项:•严格按照医生的指导和剂量使用,不可自行调整剂量或停药。
•使用期间需要定期进行血液和肝功能检查,以确保药物的安全性和有效性。
•避免饮酒或饮用大量咖啡因和其他兴奋剂。
•孕妇、哺乳期妇女、儿童和老年人应在医生的指导下使用。
•与其他药物一同使用时,请告知医生以避免不良的药物相互作用。
4. 瑞戈非尼的常见副作用使用瑞戈非尼可能引起一些常见的副作用,包括但不限于:•精神病性症状的加重,如幻觉、妄想等。
•长期使用可能导致血糖升高或患上糖尿病。
•可能引起心脏不适,如心悸、心动过速等。
•可能导致肌肉僵硬和肌肉运动障碍。
•可能引起体重增加和代谢紊乱。
5. 结束语瑞戈非尼作为一种非典型抗精神病药物,在治疗精神分裂症和双相情感障碍方面具有重要地位。
它主要通过调节神经递质活动来改善相关症状,并辅助治疗其他精神病症状。
李进教授:CONCURIII期研究结果最新解读

李进教授:CONCURIII期研究结果最新解读拜耳医药保健近日宣布,瑞戈非尼在难治性转移性结直肠癌亚洲患者中进行的III 期CONCUR 试验的结果发表在 The Lancet Oncology 上。
此结果再次证实了瑞戈非尼在关键性国际III 期CORRECT 试验的结果:较安慰剂显著改善总生存期(OS)。
CONCUR 试验在更广泛的转移性结直肠癌的亚洲人群中评估瑞戈非尼的临床疗效,为瑞戈非尼在难治性转移性结直肠癌患者中的安全性和有效性提供了另一个有力的证据。
结直肠癌在全球范围内以及亚洲的发病率持续增长。
尽管晚期治疗方法有所进步,但对于其他治疗选择的医疗需求仍然很高,特别是对于难治性转移性结直肠癌的患者。
该研究的主要负责人李进教授表示,「CONCUR 是第二个证明瑞戈非尼能够改善难治性转移性结直肠癌患者生存期的 III 期试验。
」CONCUR 试验中,相比于安慰剂组,瑞戈非尼组患者的总生存期显著延长(HR = 0.55,单侧 p = 0.00016,CI 0.40-0.77),这意味着死亡风险降低了45%。
瑞戈非尼联合最佳支持治疗(BSC)组的中位生存期为 8.8 个月,安慰剂联合 BSC 组的中位生存期为 6.3 个月。
此试验同时达到关键的次要终点:与仅最佳支持治疗相比,瑞戈非尼联合BSC 显著改善无进展生存期(PFS)(HR = 0.31, 单侧p<0.0001, CI 0.22-0.44);中位无进展生存期分别为 3.2 个月和 1.7 个月。
预设亚组的总生存期和无进展生存期分析结果显示,瑞戈非尼几乎在所有亚组均显示出临床获益的一致性。
在一项探索性分析中,对既往抗 EGFR 和/或抗 VEGF 靶向生物治疗对总生存期的影响进行评估,瑞戈非尼治疗患者中,既往均未接受过抗VEGF 或抗EGFR 治疗的患者其评估风险比为0.31(95% CI 0.19-0.53),既往接受过任意靶向抗肿瘤治疗(抗 VEGF,抗 EGFR,或两者皆有)的患者其评估风险为0.78(95% CI 0.51-1.19)。
瑞格菲尼中文说明书

【药物名】Regorafenib【商品名】Stivarga【通用名】瑞格非尼【初次获批时间】2012年【类别】小分子抑制剂【靶点】VEGFR【分子结构】分子式:C21H15ClF4N4O3•H2O分子量为:500.83【生产公司】拜耳医疗保健制药有限公司【适应症】 Stivarga 是一种激酶抑制剂适用于既往曾用基于氟嘧啶、奥沙利铂和伊立替康化疗方案(抗VEGF疗法)以及如果是KRAS野生型(抗EGFR疗法)的转移结肠直肠癌(CRC)患者的治疗。
Stivarga还可以用于治疗曾接受甲磺酸伊马替尼和苹果酸舒尼替治疗的局部晚期、不可移除的或转移性胃肠道间质瘤患者的治疗。
【剂量和药物管理】推荐剂量: 28天为一个周期,每个周期的前21天,每天一次性口服160毫克Regorafenib。
持续治疗直到出现疾病进展或不可耐受的药物毒性。
每天的同一时间服药,用药前用低脂餐(热量少于60卡路里,脂肪少于30%)。
不要再同一天服用两剂Stivarga。
剂量调整:出现以下情况,中断用药:出现2级的手足皮肤反应,且反复发作,即使减少用药量也无法在7天内缓解。
若出现3级的手足皮肤反应,至少停药7天;出现症状的2级高血压;3级或4级副反应。
将剂量减少到120毫克: 2级的手足皮肤反应首次复发;3级或4级副反应缓解后;3级天冬氨酸转氨酶(AST)/丙氨酸转氨酶(ALT)升高,且用药获益大于潜在风险。
将剂量减少到80毫克: 120毫克剂量时,2级的手足皮肤反应复发;120毫克时,3级或4级副反应恢复后;永久停药:无法耐受80毫克剂量;AST或ALT超过20倍的正常上限值;AST或ALT超过3倍的正常上限值,伴随着胆红素超过2倍的正常上限值;剂量减少到120毫克后,AST 或ALT超过5倍的正常上限值;任何4级不良反应。
【剂型和规格】40毫克、淡粉色、椭圆形、有薄膜包衣,两边分别写有“BAYER”和‘40’。
【禁忌症】无。
【警告和注意事项】(1)出血:对严重或威胁生命出血永久终止Stivarga。
【2018-2019】别克英朗说明书-实用word文档 (12页)

可以通过lamtec系统总线连到一个9针sub-d连接器上。 可以通过前面板按键进行操作,参数在2行lcd屏幕上显示。 etamatic还有一种特殊的型号,不带前面板。这种情况下,仅能通过可选的pc软件来
进行操作。
etamatic对它自身的功能和连接到etamatic上的控制元件进行连续的监视。230v输出包括:
后恢复。
(5)可逆性后部白质脑病 综合 征(rpls):终止stivarga。
(6)胃肠道穿孔或瘘管:终止stivarga。
(7)伤口愈合并发症:术前停止stivarga,在伤口裂开患者中终止。
(8)胚胎胎儿毒性:可能致胎儿危害,劝告妇女对胎儿潜在风险。篇三:英朗保养攻略 英朗保养攻略
刚买车都心疼爱车,容易被4s忽悠,在这里我写出英朗保养攻略送给大家 。 不想看文字的, 群里多问问就可以了。 切记一点 3万公里换火花塞!!! 我们群已经有好几辆车出现了点火线圈损坏的情况,
(gist)患者治疗。
临床试验数据
stivarga是一种多激酶抑制剂,可以阻断几种促进肿瘤生长的酶。stivarga新适应症的
安全性和有效性通过一项199名胃肠道间质瘤患者参与的临床试验得到评价,该199名患者
的胃肠道间质瘤不能通过手术切除,并且使用格列卫或索坦治疗后病情仍有进展。 试验中,患者被随机配给stivarga或安慰剂。同时所有患者也接受最佳的支持治疗,包
3 = 风门档板(或风机)交货时的标准设定为:通道1 = 空气
通道2 = 燃料(燃油)通道3 = 燃料(燃气)通道4 = 空气
选择要激活的通道。用参数366到367来选择(曲线设定1和2) 通道设定用二进制位来选择:位0 ? 通道1 ?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
瑞戈非尼(Stivarga)
【规格】
40mg/片
【适应症】
用于不能通过手术切除以及使用其它已上市药物治疗无效的晚期胃肠道间质瘤(GIST)患者治疗。
【禁忌症】
对本品有严重超敏反应者禁用。
【用法用量】
160mg口服。
每天1次每28天疗程,与食物服用。
【不良反应】
最常见不良反应(≥30%)是乏力/疲乏、减低食欲和食物摄入量、手足皮肤反应(HFSR)、腹泻、口腔粘膜炎、体重减轻、感染、高血压和发音困难。
【注意事项】
1.出血:对严重或威胁生命出血永久终止用药。
2.皮肤学毒性:减低或终止Stivarga取决于皮肤学毒性的严重程度和持久性。
3.高血压:对严重或不能控制的高血压暂时或永久终止Stivarga。
4.心脏缺血和梗死:拒给Stivarga对新或急性心脏缺血/梗死和只有急性缺血事件解决后恢复。
5.可逆性后部白质脑病综合征(RPLS):终止Stivarga。
6.胃肠道穿孔或瘘管:终止Stivarga。
7.伤口愈合并发症:术前停止Stivarga,在伤口裂开患者中终止。
8.胚胎胎儿毒性:可能致胎儿危害,劝告妇女对胎儿潜在风险。
