化学部分溶解性表
溶解性表详解

部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
子
H+
NH
+ 4
1.写出所有的阳离子与CO32-结合所生成的
K+
化合物的化学式和名称。
Na + 2.生成的化合物有什么共性?什么是盐酸
Ba2+
盐?
Ca 2+ Mg2+
3.共有几种?几种可溶、几种微溶、几种 不溶?
Fe2+
3.除BaSO4不溶,CaSO4、Ag2SO4微
Fe3+
溶,11种硫酸盐可溶。
Cu2 +
Ag +
SO4 2- (硫酸根) CO32 - (碳酸根)
H2SO4 (硫酸) (NH4)2SO4(硫酸铵) K2SO4 (硫酸钾) Na2SO4 (硫酸钠) BaSO4 (硫酸钡) CaSO4 (硫酸钙) MgSO4 (硫酸镁) Al2(SO4)2 (硫酸铝) MnSO4 (硫酸锰) ZnSO4 (硫酸锌) Fe SO4 (硫酸亚铁) Fe2(SO4)3 (硫酸铁) CuSO4 (硫酸铜) Ag2SO4 (硫酸银)
Ag +
AgCl(氯化银)
SO4 2- (硫酸根) CO32 - (碳酸根)
2.它们的阴离子全部是Cl - , 酸根离子全部是Cl- 离子的 化合物叫盐酸盐。 3.除AgCl不溶,12种盐酸 盐可溶。
部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
NH
+ 4
K+
NH 3.H2O (铵水) KOH (氢氧化钾)
化学手册_溶解度表
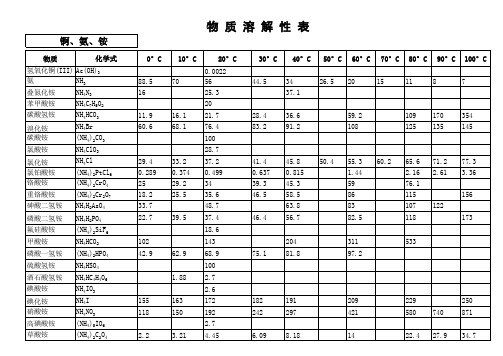
68.9
95
103
144 150
153
钯、钡、铋、铂、钚
物质
化学式
氢氧化钯(II) 氢氧化钯(IV) 乙酸钡
砷酸钡 叠氮化钡 溴酸钡 溴化钡 碳酸钡 氯酸钡 氯化钡 氯酸钡 铬酸钡 氰化钡 亚铁氰化钡
Pd(OH)2 Pd(OH)4 Ba(C2H3O2)2
Ba3(AsO4)2 Ba(N3)2 Ba(BrO3)2 BaBr2 BaCO3 Ba(ClO3)2 BaCl2 Ba(ClO2)2 BaCrO4 Ba(CN)2 Ba2Fe(CN)6
4.89
0.16 2.8×10-2 31.9 1.3×10-2 0.687 3.89 3.5×10-2 223 6×10-3 9.02 72.8 3×10-3 3.8 336 1.5×10-2 9×10-3 5×10-3 2.448×10-4 7.86 7.298×10-4 2.868×10-7 7.761×10-4
105 59.4 80.8
氟化钡 氟硅酸钡 甲酸钡 磷酸氢钡 亚磷酸氢钡 氢氧化钡 碘酸钡 碘化钡 钼酸钡 硝酸钡 亚硝酸钡 草酸钡 氧化钡 高氯酸钡 高锰酸钡 焦磷酸钡 硒酸钡 硫酸钡
BaF2 BaSiF6 Ba(HCO2)2 BaHPO4 BaHPO3 Ba(OH)2·8H2O Ba(IO3)2 BaI2 BaMoO4 Ba(NO3)2 Ba(NO2)2 BaC2O4·2H2O BaO Ba(ClO4)2 Ba(MnO4)2 Ba2P2O7 BaSeO4 BaSO4
22.4 27.9 34.7
高氯酸铵 高锰酸铵 磷酸铵 硒酸铵 硫酸铵 亚硫酸铵 酒石酸铵
硫氰酸铵 硫代硫酸铵 钒酸铵
NH4ClO4 NH4MnO4 (NH4)3PO4 (NH4)2SeO4 (NH4)2SO4 (NH4)2SO3 (NH4)2C4H4O6 NH4SCN (NH4)2S2O3 NH4VO3
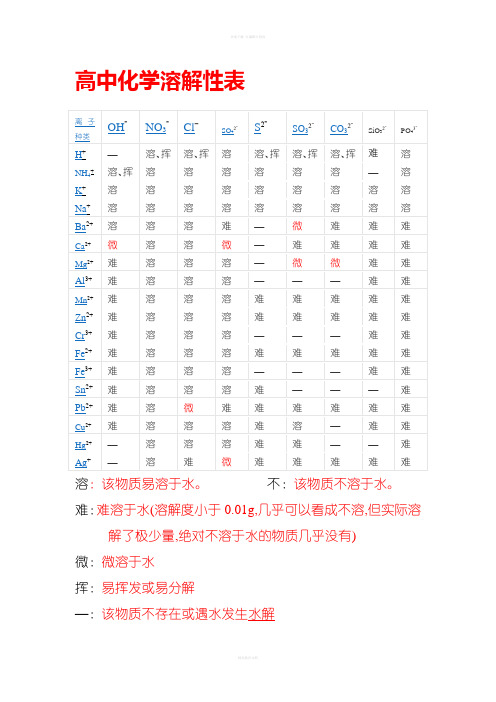
高中化学溶解性表
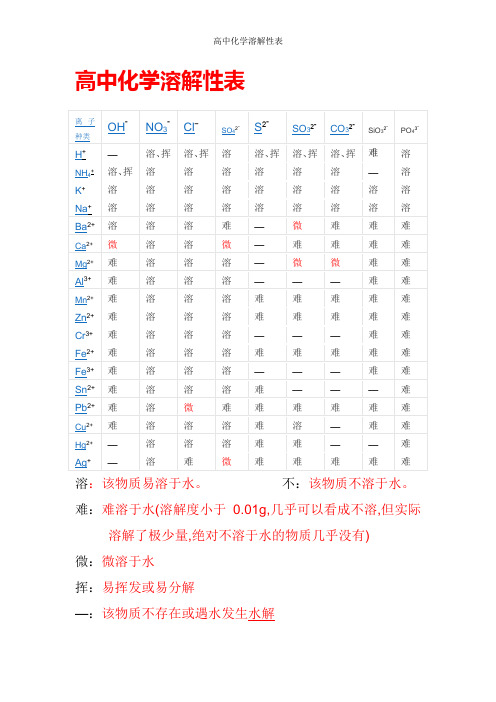
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
—:该物质不存在或遇水发生水解
红褐色:Fe(OH)3
沉淀鉴别
沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;
Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);
BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);
不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住(见上表)。
化学溶解性表

化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH- 、硝酸根NO3- 、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO 42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>O s>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3 +2H2O10.碳酸氢钠加热的反应2Na HCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应N H4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应 2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应 2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2H Cl+S↓71.硫化氢与浓硫酸的反应 H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca(OH)2(3) Mg2++2OH2-==== Mg(OH)2↓ (4) Mg(OH)2+2HCl==== MgCl2+2H2O(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3105.硅酸加热分解H2SiO3==== SiO2+H2O106.铝与氧气的反应4Al+3O2==== 2Al2O3107.铝与氯气的反应2Al+3Cl2==== 2AlCl3108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4]115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH)3↓+3(NH4)2S O4117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl 119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl 121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+Na Cl+H2O122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3N aCl125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3 127.铜与氧气的反应2Cu+O2==== 2CuO 128.铜与氯气的反应Cu+Cl2==== CuCl2129.铜氧化在高温下转化4CuO==== 2Cu2O+O 2↑ 130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体 (1)(2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体(1)(2)()()()2332222332H H H CO HCO CO S HS H S SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O 4.与水反应产生气体 (1)单质⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na ⎪⎧↑+=+2222422O NaOH O H O Na(2)化合物5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
化学溶解性表

沉淀溶解性表:碱溶铵、钾、钠、钡、钙,盐酸盐多数溶,银例外。
硝酸盐全溶于水,碳酸盐只溶铵、钾、钠、镁。
硫酸盐钡不溶,钙、银溶微(微溶)。
白色:BaSO4 BaCO3 CaCO3 AgCl Ag2CO3黄色:AgI浅黄色:AlBr微溶:CaSO4 MgSO4称化学式溶解性溶液及沉淀颜色硝酸 HNO3 溶、挥无色氯化氢 HCl 溶、挥无色硫酸 H2SO4 溶无色碳酸 H2CO3 溶、挥无色一水合氨 NH3.H2O 溶、挥无色硝酸铵 NH4NO3 溶无色氯化铵 NH4Cl 溶无色硫酸铵 (NH4)2SO4 溶无色碳酸氨 (NH4)2CO3 溶无色氢氧化钾 KOH 溶无色硝酸钾 KNO3 溶无色氯化钾 KCL 溶无色硫酸钾 K2SO4 溶无色碳酸钾 K2CO3 溶无色氢氧化钠 NaOH 溶无色硝酸钠 NaNO3 溶无色氯化钠 NaCl 溶无色硫酸钠 Na2SO4 溶无色碳酸钠 Na2CO3 溶无色氢氧化钡 Ba(OH)2 溶无色硝酸钡 Ba(NO3)2 溶无色硫酸钡 BaSO4 溶白色碳酸钡 BaCO3 不白色氢氧化钙 Ca(OH)2 微无色、白色硝酸钙 Ca(NO3)2 溶无色氯化钙 CaCl 溶无色硫酸钙 CaSO4 微无色、白色碳酸钙 CaCO3 不白色氢氧化镁 Mg(OH)2 不白色硝酸镁 Mg(NO3)2 溶无色氯化镁 MgCl2 溶无色硫酸镁 MgSO4 溶无色碳酸镁 MgCO3 微无色、白色氢氧化铝 Al(OH)3 不白色硝酸铝 Al(NO3)3 溶无色氯化铝 AlCl3 溶无色硫酸铝 Al2(SO4)3 溶无色碳酸铝 / 氢氧化锰 Mn(OH)2 不白色硝酸锰 Mn(NO3)2 溶无色氯化锰 MnCl2 溶无色硫酸锰 MnSO4 溶无色碳酸锰 MnCO3 不白色氢氧化锌 Zn(OH)2 不白色硝酸锌 Zn(NO3)2 溶无色氯化锌 ZnCl2 溶无色硫酸锌 ZnSO4 溶无色碳酸锌 ZnCO3 不白色氢氧化亚铁 Fe(OH)2 不白色硝酸亚铁 Fe(NO3)2 溶浅绿色氯化亚铁 FeCl2 溶浅绿色硫酸亚铁 FeSO4 溶浅绿色碳酸亚铁 FeCO3 不白色氢氧化铁 Fe(OH)3 不红褐色硝酸铁 Fe(NO3)3 溶黄色氯化铁 FeCl3 溶黄色硫酸铁 Fe2(SO4)3 溶黄色碳酸铁 / 氢氧化铜 Cu(OH)2 不蓝色硝酸铜 Cu(NO3)2 溶蓝色氯化铜 CuCl2 溶蓝绿色硫酸铜 CuSO4 溶蓝色碳酸铜 CuCO3 不蓝色氢氧化银 / 硝酸银 AgNO3 溶无色氯化银 AgCl 不白色硫酸银 Ag2SO4 微无色、白色碳酸银 Ag2CO3 不白色。
化学溶解性表

化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH-、硝酸根NO3-、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>Os>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O10.碳酸氢钠加热的反应2NaHC O3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应 2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应 2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2H Cl+S↓71.硫化氢与浓硫酸的反应 H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca(OH)2 (3) Mg2++2OH2-==== Mg(OH)2↓ (4) Mg(OH)2+2HCl==== MgCl2+2H2O (5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑ 103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O 104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3 105.硅酸加热分解H2SiO3==== SiO2+H2O 106.铝与氧气的反应4Al+3O2==== 2Al2O3 107.铝与氯气的反应2Al+3Cl2==== 2AlCl3 108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑ 110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3 112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3 113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4] 115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH)3↓+3(NH4)2SO4 117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl 118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl 119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+NaCl+H2O 122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O 124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3NaCl 125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3 126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3 127.铜与氧气的反应2Cu+O2==== 2CuO 128.铜与氯气的反应Cu+Cl2==== CuCl2 129.铜氧化在高温下转化4CuO==== 2Cu2O+O 2↑ 130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体(1)(2)铵盐:O H NH NH 234+↑−→−+碱⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质2.与酸反应产生气体(1) (2)()()()2332222332H H H CO HCO CO S HS H S SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O4.与水反应产生气体 (1)单质(2)化合物5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
化学手册_溶解度表

4
14.4
18.6
2.697×10-4
9.7×10-2
84.7
87.9
136 6.046×10-3 188 6.235×10-6 64
150 195 58.9
76.6 1.292×10-12 4.642×10-2
7.14 0.265
152 376 135
25.3
92.1 194 203 55 78.5
硫化钡
BaS
砷酸铋 氢氧化铋
BiAsO4 Bi(OH)3
碘化铋
BiI3
磷酸铋 硫化铋 氢氧化铂(II)
BiPO4 Bi2S3 Pt(OH)2
溴化铂(IV) PtBr4 氟化钚(III) PuF3
氟化钚(IV) PuF4
26.2 1.67 182 4.95 50.3 239
2.88
0.159 28 2.48 201 6.67 60
碳酸镉 氯酸镉 氯化镉
氰化镉 亚铁氰化镉 氟化镉 甲酸镉
氢氧化镉
碘酸镉 碘化镉 硝酸镉 草酸镉 高氯酸镉 磷酸镉 硒酸镉 硫酸镉
硫化镉 钨酸镉
CaSeO4·2H2O CaSO4·2H2O
CaWO4 ZrF4
Zr(SO4)2·4H2O Cd3(AsO4)2 Cd(C7H5O2)2 Cd(BrO3)2 CdBr2
磷酸二氢铵 氟硅酸铵 甲酸铵 磷酸一氢铵 硫酸氢铵 酒石酸氢铵 碘酸铵
碘化铵 硝酸铵 高碘酸铵 草酸铵
NH4H2PO4 (NH4)2SiF6 NH4HCO2 (NH4)2HPO4 NH4HSO4 NH4HC4H4O6 NH4IO3 NH4I NH4NO3 (NH4)5IO6 (NH4)2C2O4
物质溶解性表
初中化学 常见物质 溶解性表

初中化学常见物质溶解性表1. 水(H2O):水是一种非常常见的液体,它是一种极性分子,这意味着水分子具有部分正电和部分负电。
这种极性使得水能够方便地溶解许多极性分子,如纤维素和蛋白质。
但它不能流畅地溶解许多非极性物质,如油和脂肪。
2. 氧气(O2):氧气是一种非极性气体,因为它由两个相同的非极性原子氧组成。
它不能在水中溶解,但可以在一些有机溶剂中溶解。
它具有较低的溶解度,所以它是一种不良的生物体呼吸气体。
3. 纯乙醇(C2H5OH):纯乙醇是一种极性分子,它能够在水中溶解。
但它的溶解度依赖于温度和乙醇的浓度。
当乙醇浓度比较低时,它能够溶解于水中,但浓度超过一定值时,它的溶解度会变得很小。
4. 盐酸(HCl):盐酸是一种强酸,它能够在水中溶解,因为水分子能够解开盐酸的离子键,使盐酸分解为氢离子和氯离子。
这两种离子极易溶于水中。
它的溶解度取决于温度和盐酸的浓度。
5. 氨水(NH3):氨水是一种弱碱,它能够在水中溶解,因为水分子和氨分子之间存在氢键。
当氨水分解为氨离子和氢离子时,它能够轻松地溶于水中。
它的溶解度也取决于温度和氨水的浓度。
6. 碳酸钙(CaCO3):碳酸钙是一种难溶于水的盐。
它可以在水中存在,但只是以微小的量。
当碳酸钙沉淀时,它会从水中移除,使水变得干净。
它的溶解度取决于水的pH值、温度和溶液中的其它离子浓度。
7. 溴水(Br2):溴水是一种非极性分子,在水中溶解度很小。
溴水溶解的时候,它会形成一些氧化物和酸,但由于其溶解度较小,这些产物不会在水中停留很长时间。
8. 硝酸(HNO3):硝酸是一种强酸,能够在水中溶解。
它的溶解度也取决于温度和硝酸的浓度。
当浓度比较高的时候,硝酸变得非常危险,可以腐蚀和腐蚀很多材料。
9. 乳酸(C3H6O3):乳酸是一种极性分子,能够在水中溶解。
但随着浓度的增加,它在水中的溶解度会降低。
这使得乳酸变得难以用于一些需要高浓度的应用中。
10. 溴化镁(MgBr2):溴化镁是一种离子化合物,能够在水中溶解。
高中化学溶解性表

高中化学溶解性表离子OHˉNO3ˉClˉSO42ˉS2ˉSO32ˉCO32ˉSiO32ˉPO43ˉ种类H+—溶、挥溶、挥溶溶、挥溶、挥溶、挥难溶NH4+溶、挥溶溶溶溶溶溶—溶K+溶溶溶溶溶溶溶溶溶Na+溶溶溶溶溶溶溶溶溶Ba2+溶溶溶难—微难难难Ca2+微溶溶微—难难难难Mg2+难溶溶溶—微微难难Al3+难溶溶溶———难难Mn2+难溶溶溶难难难难难Zn2+难溶溶溶难难难难难Cr3+难溶溶溶———难难Fe2+难溶溶溶难难难难难Fe3+难溶溶溶———难难Sn2+难溶溶溶难———难Pb2+难溶微难难难难难难Cu2+难溶溶溶难溶—难难Hg2+—溶溶溶难难——难Ag+—溶难微难难难难难溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解常见沉淀:白色:BaSO4、BaCO3、CaCO3、AgCl、Mg(OH)2、Fe(OH)2、Al(OH)3、ZnCO3、MnCO3、Zn(OH)2。
蓝色:Cu(OH)2、CuCO3浅黄色:AgBr、Ag2CO3红褐色:Fe(OH)3沉淀鉴别Cu(OH)2蓝色沉淀;Fe(OH)3红褐色沉淀;AgBr淡黄色沉淀;AgI ,Ag3PO4黄色沉淀;AgCl白色沉淀;CuO黑色沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
高中化学溶解性表
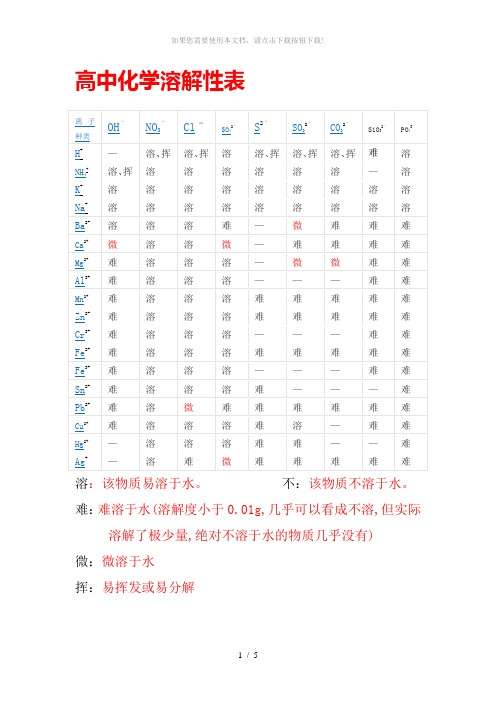
高中化学溶解性表溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解沉淀鉴别色沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住(见上表)。
8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。
9、障碍与失败,是通往成功最稳靠的踏脚石,肯研究、利用它们,便能从失败中培养出成功。
10、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。
(注:可编辑下载,若有不当之处,请指正,谢谢!)。
高中化学常用物质溶解性表及沉淀颜色

高中化学常用物质溶解性表及沉淀颜色Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO22NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成。
溶解性表详解

Al2(SO4)2 (硫酸铝)
——
MnSO4 (硫酸锰) ZnSO4 (硫酸锌)
MnCO3 (不) ZnCO3 (不)
Fe2+
Fe(OH)2( 氢氧化亚铁) Fe(NO3)2 (硝酸亚铁) FeCl2 (氯化亚铁) Fe SO4 (硫酸亚铁) FeCO3 (不)
Fe3+
Fe(OH )3(氢氧化铁) Fe2(NO3)3(硝酸铁) FeCl3(氯化铁)
Ag +
AgCl(氯化银)
SO4 2- (硫酸根) CO32 - (碳酸根)
2.它们的阴离子全部是Cl - , 酸根离子全部是Cl- 离子的 化合物叫盐酸盐。 3.除AgCl不溶,12种盐酸 盐可溶。
部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
NH4NO3(硝酸铵)
KOH (氢氧化钾) KNO3 (硝酸钾)
Na +
NaOH (氢氧化钠) NaNO3(硝酸钠)
Ba2+
Ba(OH )2(氢氧化钡) Ba(NO3)2 (硝酸钡)
Ca 2+
Ca(OH)2 (氢氧化钙) Ca(NO3)2 (硝酸钙)
Mg2+
Mg(OH)2(氢氧化镁) Mg(NO3)2(硝酸镁)
Mg(NO3)2(硝酸镁)
Al2(NO3)3 (硝酸铝)
Mn(NO3)2 (硝酸锰) 2.除HNO3外,13种盐的阴离子全部是NO3 - , Zn(NO3)2 (硝酸锌) 酸根离子全部是NO3 - 离子的化合物叫硝酸盐。
Fe(NO3)2 (硝酸亚铁) 3.13种硝酸盐全溶。
Fe2(NO3)3(硝酸铁)
部分酸碱盐的溶解性表

Ag2CO3 碳酸银 不
Ag
+
说明:溶表示可溶于水;不表示不溶于水;微表示微溶于水;挥表示挥发性
O2-
(NH4)2O 硫酸铵 溶 K2O 硫酸钾 溶 Na2O 硫酸钠 溶 BaO 硫酸钡 不 CaO 硫酸钙 微 MgO 硫酸镁 溶 Al2O3 硫酸铝 溶 MnO 硫酸锰 溶 ZnO 硫酸锌 溶 FeO 硫酸亚铁 溶 Fe2O3 硫酸铁 溶 CuO 硫酸铜 溶 Ag2O 硫酸银 微
OHH2O H+ 水 NH3•H2O NH4
+
NO3HNO3 硝酸 溶、挥 NH4NO3 硝酸铵 溶 KNO3 硝酸钾 溶 NaNO3 硝酸钠 溶 Ba(NO3)2 硝酸钡 溶 Ca(NO3)2 硝酸钙 溶 Mg(NO3)2 硝酸镁 溶 Al(NO3)3 硝酸铝 溶 Mn(NO3)2 硝酸锰 溶 Zn(NO3)2 硝酸锌 溶 Fe(NO3)2 硝酸亚铁 溶 Fe(NO3)3 硝酸铁 溶 Cu(NO3)2 硝酸铜 溶 AgNO3 硝酸银 溶
SO42H2SO4 硫酸 溶 (NH4)2SO4 硫酸铵 溶 K2SO4 硫酸钾 溶 Na2SO4 硫酸钠 溶 BaSO4 硫酸钡 不 CaSO4 硫酸钙 微 MgSO4 硫酸镁 溶 Al2(SO4)3 硫酸铝 溶 MnSO4 硫酸锰 溶 ZnSO4 硫酸锌 溶 FeSO4 硫酸亚铁 溶 Fe2(SO4)3 硫酸铁 溶 CuSO4 硫酸铜 溶 Ag2SO4 硫酸银 微
ClHCl 盐酸 溶、挥 NH4Cl 氯化铵 溶 KCl 盐酸 溶 NaCl 氯化钠 溶 BaCl2 氯化钡 溶 CaCl2 氯化钙 溶 MgCl2 氯化镁 溶 AlCl3 氯化铝 溶 MnCl2 氯化锰 溶 ZnCl2 氯化锌 溶 FeCl2 氯化亚铁 溶 FeCl3 氯化铁 溶 CuCl2 氯化铜 溶 AgCl 氯化银 不
高中化学溶解性表
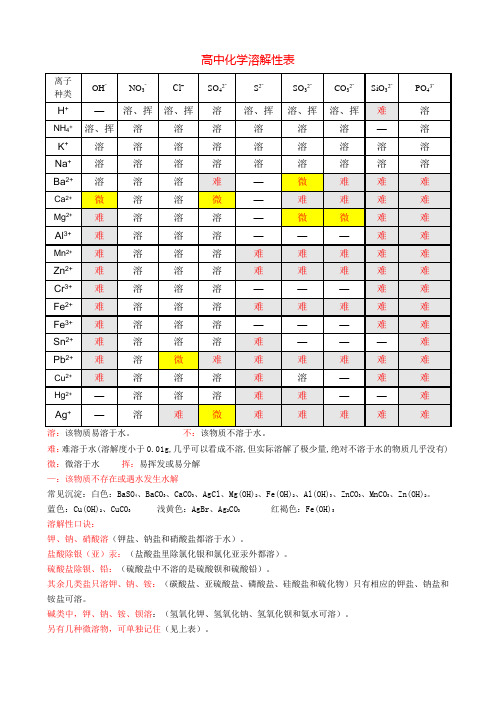
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有) 微:微溶于水挥:易挥发或易分解
—:该物质不存在或遇水发生水解
常见沉淀:白色:BaSO4、BaCO3、CaCO3、AgCl、Mg(OH)2、Fe(OH)2、Al(OH)3、ZnCO3、MnCO3、Zn(OH)2。
蓝色:Cu(OH)2、CuCO3浅黄色:AgBr、Ag2CO3红褐色:Fe(OH)3
溶解性口诀:
钾、钠、硝酸溶(钾盐、钠盐和硝酸盐都溶于水)。
盐酸除银(亚)汞:(盐酸盐里除氯化银和氯化亚汞外都溶)。
硫酸盐除钡、铅:(硫酸盐中不溶的是硫酸钡和硫酸铅)。
其余几类盐只溶钾、钠、铵:(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只有相应的钾盐、钠盐和铵盐可溶。
碱类中,钾、钠、铵、钡溶:(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)。
另有几种微溶物,可单独记住(见上表)。
高中化学溶解性表
高中化学溶解性表溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解红褐色:Fe(OH)3沉淀鉴别Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住(见上表)。
8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。
9、障碍与失败,是通往成功最稳靠的踏脚石,肯研究、利用它们,便能从失败中培养出成功。
10、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NO3(-1)
Cl(-1)
SO4(-2)
CO3(-2)
PO4(-3)
H(+1)
(H2O)
溶、挥
溶、挥
溶
溶、挥
溶
(HNO3)
(HCl)
(H2SO4)
(H2CO3)
K(+1)
溶(KOH)
溶(KNO3)
溶(KCl)
溶(K2SO4)
溶(K2CO3)
溶
Na(+1)
溶(NaOH)
溶(NaNO3)
溶(NaCl)
(溶,挥)
(溶,挥)
溶
(溶,挥)
(溶,挥)
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
不
不ห้องสมุดไป่ตู้
微
溶
溶
微
不
不
溶
溶
溶
微
不
溶
溶
溶
—
不
溶
溶
溶
不
不
溶
溶
溶
不
不
溶
溶
溶
不
不
溶
溶
溶
—
不
溶
溶
溶
不
—
溶
不
微
不
说明:此为20℃时的情况。“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了。
溶Cu(NO3)2
溶(CuCl2)
溶(CuSO4)
---
不
Ag(+1)
---
溶(AgNO3)
不(AgCl)
微(Ag2SO4)
不(Ag2CO3)
不
微(CaSO4)
不(CaCO3)
不
Mg(+2)
不Mg(OH)2
溶Mg(NO3)2
溶(MgCl2)
溶(MgSO4)
微(MgCO3)
不
Al(+3)
不Al(OH)3
溶Al(NO3)3
溶(AlCl3)
溶Al2(SO4)3
---
不
Mn(+2)
不Mn(OH)2
溶Mn(NO3)2
溶(MnCl2)
溶(MnSO4)
不(MnCO3)
不
Zn(+2)
不Zn(OH)2
溶Zn(NO3)2
溶(ZnCl2)
溶(ZnSO4)
不(ZnCO3)
不
Fe(+2)
不Fe(OH)2
溶Fe(NO3)2
溶(FeCl2)
溶(FeSO4)
不(FeCO3)
不
Fe(+3)
不Fe(OH)3
溶Fe(NO3)3
溶(FeCl3)
溶Fe2(SO4)3
---
不
Cu(+2)
不Cu(OH)2
溶(Na2SO4)
溶(Na2CO3)
溶
NH4(+1)
溶、挥(NH4OH)
溶(NH4NO3)
溶(NH4Cl)
溶(NH4)2SO4
溶(NH4)2CO3
溶
Ba(+2)
溶Ba(OH)2
溶Ba(NO3)2
溶BaCl2
不(BaSO4)
不(BaCO3)
不
Ca(+2)
微Ca(OH)2
溶Ca(NO3)2
溶(CaCl2)
