Chapter 3 不饱和烃 烯烃 炔烃(修改, 完整)
第三章不饱和烃

到含氢较多的双键C原子上,而带负电荷的部分加到含
氢较少或不含氢的双键碳原子上,这一规则简称为马氏
规则。★★★★★
利用马氏规则,可以预测反应的主产物。
⑷ 过氧化物效应——在利用马氏规则时要注意,当反
应条件改变时,例如在ROOR存在下,烯烃和HBr加成 的取向正好和马尔科夫尼科夫规律相反,叫做烯烃与 HBr加成的过氧化物效应。 ★★★★★
⑵ SP2杂化轨道的形状:和SP3杂化轨道 相似,也是不对称的葫芦形,一头大一 头小,只是大的一头比SP3 杂化轨道更 大,小的一头比 SP3杂化轨道更小。
⑶ SP2杂化轨道的空间取向:三个SP2杂 化轨道的对称轴分布在同一平面上,并以 C原子为中心分别指向正三角形的三个顶 。 点,夹角互成120 ;未参加杂化的 2P轨道, 仍然保持原来的形状,其对称轴垂直于三 个SP2 轨道对称轴所在的平面。
只有HBr有过氧化物效应
4、加硫酸 ⑴ 与浓硫酸反应,生成烷基硫酸(或叫酸性硫酸酯) CH2=CH2 + HO-SO2-OH ⑵ 符合马尔科夫尼科夫规则 CH3-CH2-OSO3H
2-甲基丙烯
叔丁基硫酸
⑶ 烷基硫酸的水解(烯烃的间接水合)--制醇 CH3-CH2-OSO3H + H2O
H2SO4
3、顺反异构
条件:—任何一个双键碳原子上所连接的两个原子或原 子团都要不同。 注意: 只要任何一个双键碳原子所连接的两个取代基 是相同的,就没有顺反异构。
二、烯烃的命名 (一)系统命名法原则与烷烃相似 1、选主链:选择含有双键在内的最长碳链为主链, 支链作为取代基,按主链碳原子数称为某烯或某碳烯。 碳原子数在十以下的,用天干表示,在十个以上的用中 文数字表示十一、十二……表示,称为某碳烯。
有机化学--第三章 不饱和烃:烯烃和炔烃

碳碳双键不能绕键轴自由旋转。因此,当两个双键碳 原子各连有两个不同的原子或基团时,可能产生两种不同 的空间排列方式。
一些烯烃的物理性质
构型:(I)和(Ⅱ)的分子式相同,构造亦相同,但分子中的原子在空间 排列不同。分子中原子在空间的排列形式称为构型。 构型异构体:(I)和(Ⅱ)是由于构型不同而产生的异构体,称为构型异 构体(configurational isomers)。构型异构体具有不同的物理性质。
3.1.1 碳原子轨道的sp2杂化
H
H
CC
H
Hale Waihona Puke H1/3s +2/3p
3.1.2 碳碳双键的组成
在乙烯中,成键的两碳原子各以一个sp2杂化轨道彼 此交盖形成一个C—C σ键,并各以两个sp2杂化轨道分 别与两个氢原子的1s轨道形成两个C—H σ键,这样形成 的五个σ键其对称轴都在同一平面内。
由于每个碳原子上余下的p轨道的对称轴垂直于同一 平面,且彼此平行,这样两个p轨道就从侧面相互平行交 盖成键,组成新的轨道,称为π轨道。处于π轨道的电子称 为π电子,这样构成的共价键称为π键。
含一个碳碳三键者称为炔烃(alkynes),通式为CnH2n-2, 碳碳三键(一C≡C一)是炔烃的官能团。分子中既含有碳碳 双键,又含有碳碳三键者称为烯炔。
3.1 烯烃和炔烃的结构
碳碳双键是由两对共用电子构成,通常用两条短线表 示:C=C。碳碳三键由三对共用电子构成,通常用三条 短线表示:C≡C。但实验事实表明,它们都不是由两个 或三个σ键加合而成:
与烷基相似,一个不饱和烃从形式上去掉两个氢原 子也构成亚基。最常见的不饱和亚基有—CH=CH—, 称为1,2-亚乙烯基。
第三章不饱和烃烯烃和炔烃

第三章不饱和烃烯烃和炔烃第三章不饱和烃:烯烃和炔烃本章重点内容一、命名1、烯烃和炔烃构造异构体的命名1)选择含双键或三键在内的最长碳链为主链。
2)靠近双键或三键一端编号,重键的位次用数字标明(标号较小的碳原子)。
3)书写:与烷烃书写格式相同(当主链碳原子数大于十时,命名时汉字数字与烯或炔字之间应加一个“碳”字)。
3H3CCH3CH3H3CCCH34,4-二甲基-2-戊烯 3-甲基-1-丁炔通常将碳碳双键处于端位的烯烃,统称α-烯烃。
碳碳三键处于端位的炔烃,一般称为端位炔烃。
2、烯烃顺反异构体的命名顺反命名法:两个相同原子或基团处于双键碳原子同一侧的称为顺式,反之称为反式。
但当两个双键碳原子所连接的四个原子或基团都不相同时,则难用顺反命名法命名。
Z,E—命名法:依据次序规则比较出两个双键碳原子所连接取代基优先次序。
当较优基团处于双键的同侧时,称Z式;处于异侧时,称E式。
BrClCCClHH3CCH3CH2CCH2CH2CH3CH(CH3)2反-1,2-二氯溴乙烯(Z)-3-甲基-4-异丙基-3-庚烯3、烯炔的命名1)选择含有双键和叁键在内的最长碳链为主链;2)在满足最低系列原则下,优先考虑双键,使其具有较小编号; 3)书写:称某碳“烯”某“炔”;4)若双键和三键处于相同的位次供选择时,优先给双键较低编号。
HCCCH2CH2CH21-己烯-5-炔二、结构与性质1、结构:烯烃为sp2杂化,余下一个未参与杂化的p轨道,垂直与三个杂化轨道对称轴所在的平面。
炔烃为sp杂化,未参与杂化的两个p轨道的对称轴互相垂直且都垂直于sp杂化轨道对称轴所在直线。
2、性质物理性质电负性:三键碳原子>双键碳原子>饱和碳原子;沸点:烯烃顺式异构体>反式异构体。
顺式异构体具有弱极性,分子间作用力增大,故沸点较高。
熔点:反式异构体>顺式异构体。
反式异构体对称性教好,晶格紧密,故熔点较高。
化学性质 1)加成反应加氢:炔烃比烯烃更容易进行催化氢化(与分子形状有关,炔烃为线型结构,易吸附)。
有机化学第3章 不饱和烃

Cl
Br
CC
H
Cl
(Z)-1,2-二氯-1-溴乙烯 (反-1,2-二氯-1-溴乙烯)
Cl C
H
Cl C
Br
(E)-1,2-二氯-1-溴乙烯 (顺-1,2-二氯-1-溴乙烯)
28
6. 烯炔的命名
第三章 烯烃和炔烃 (三、烯烃和炔烃的命名)
• 编号时尽可能使重键的位次之和最低。 • 当双键和三键处于两头相同的位次时,
反式:两个取代基在环异侧 顺式:两个取代基在环同侧
15
第三章 烯烃和炔烃 (二、烯烃和炔烃的同分异构)
问题:下列化合物是否存在顺反异构?
CH3
C2H5 D
C=C
H
Cl H
H C=C
CH3
CH2-CH-CH3 CH-CH3
16
第三章 烯烃和炔烃 (三、烯烃和炔烃的命名)
三、烯烃和炔烃的命名
1. 简单的烯烃常用普通命名法
98
7
CH3
CH2CH3
10,10-二甲基-3-乙基-9-异丙基-4-十一碳烯
例3
4 CH3 3 CH2CH3
4 –甲基–3–乙基环庚烯
12
例4 CH3CC CCH2CH3 2 –甲基–3–己炔
CH3
19
4. 烯基与炔基
第三章 烯烃和炔烃 (三、烯烃和炔烃的命名)
CH2 CH
乙烯基 (vinyl)
3. 烯烃的比重都小于1,都是无色物质,溶于有机溶剂,不溶于水。
CH3 C C CH3
H
H
沸点(bp): 3.7℃ 熔点(mp): -138.9℃
CH3
H
CC
H
CH3
0.88℃
第三章 不饱和烃(Unsaturated Hydrocarbon...

次序规则
(1)双键碳原子所连接的原子或基团按原子序
数大小,把大的排在前面,小的排在后面。同位 素按相对原子质量大小次序排列。例如:
I>Br>Cl>S>P>O>N>C>D>H
(2)当双键碳原子连接的基团的第一个原子相同 时,则还需比较后面的原子。
(CH3)3C
> (CH3)2CH >CH3CH2CH2CH2 > >CH3CH2 >H3C
返回
加 硫 酸
H2C CH2 + H2SO4
0~15℃
H3C CH2OSO3H
硫酸氢乙酯
H2SO4 0~15℃ 170℃
H2C CH2
H3C CH2OSO3H
H2O H2SO4
H3C CH2OH
CH3CH CH2
H 2SO 4 20℃
H3C CH CH3 OSO3H
H 2O
H3C CH CH3 OH
H Br
-
CH3 H CH3 C
Br
CH3
Br C H CH3
CH3 Br H (R) H Br (R) CH3 dl-
CH3 H Br (S) Br H (S) CH3
Br
加卤化氢
亲电 试剂
H2C CH2
+
HCl
AlCl3 130~250℃
H3C CH2Cl
卤化氢发生加成反应的活泼性顺序:
HI > HBr > HCl
RCH
CH2 + HBH2
RCH2CH2BH2
一烷基硼
RCH
CH2 + RCH2CH2BH2
RCH2CH2BCH2CH2R H 二烷基硼
第三章-烯烃、炔烃、二烯烃

以反式加成产物为主
Br
Br
CH2 CH2 + Br2 NaCl水溶液 CH2 CH2 + CH2 CH2
Br
Cl
亲电试剂:试剂带有正电荷,或者电子云密度较低,在
反应中进攻反应物上带部分负电荷的位置,这种试剂叫
做亲电试剂,例如X+(卤素)、R+、H +等。详见课本 P54-56。
亲电加成反应:由亲电试剂进攻而引起的加成反应。
1埃 = 0.1纳米(nm) = 10-10米(m)
1
键的特点: 1.成键原子不能绕两核连线自由旋转。
2.键比键易断裂。
3.电子云易极化。
PS:极化(polarization),指事物在一定条件下发生两极 分化,使其性质相对于原来状态有所偏离的现象
烯烃的同分异构
构造异构:碳链异构;官能团位置异构 构型异构:顺反异构 (几何异构or立体异构)
链终止 CH3CH· CH2Br +Br· CH3CHBrCH2Br
注:过氧化物只对HBr有影响,不影响HCl和HI。
诱导效应:受分子中电负性不同的原子或基团的影响,整个分 子中成键的电子云向着一个方向偏移,分子发生极化的效应。
δ+ δ- δ+ δH3C CH CH2 + HBr
CH3CHCH2 Br
电负性差别:O:3.5 Cl:3.1 O> Cl
由于次氯酸不稳定,反应中常用氯气和水代替次氯酸
Cl2 + H2O HOCl + HCl
H2C CH2 + Cl2 + H2O
CH2 CH2 OH Cl
(2) 臭氧化反应
O
CH3CH CH2 O3 CH3HC O
第六讲 第三章 不饱和烃:烯烃和炔烃(2)
C C
+
H-X
-X -
C=C H
+
+X快
C=C X H
乙烯基碳正离子
由于卤素的吸电子作用, 阶段。 几 1 由于卤素的吸电子作用,反应能控制在加一分子 HX 阶段。 加成, 加成 常用汞盐和铜盐做催化剂。 点 2 与HCl加成,常用汞盐和铜盐做催化剂。 讨 3 与卤化氢的加成,在相应卤离子(如:(CH3 )4N+Cl-)存在下, 与卤化氢的加成,在相应卤离子( 存在下, 论 通常进行反式加成。例如: 通常进行反式加成。例如:
*1. Markovnikov规则 不对称烯烃与氯化氢等极性试剂进行加成反应时, 规则 不对称烯烃与氯化氢等极性试剂进行加成反应时, 氢原子总是加到含氢较多的双键碳原子上, 氢原子总是加到含氢较多的双键碳原子上,氯原子或其它原子或基团则加 到含氢较少的或不含氢的双键碳原子上。这条经验规则简称马氏规则。 到含氢较少的或不含氢的双键碳原子上。这条经验规则简称马氏规则。 例如
CH3CH2CH=CH2 + HBr HAc 80% (CH3)2C=CH2 + HCl CH3CH2CH2CH2Br
~100%
(CH3)2C CH3 Cl
第 六 讲 (6)
*2. 不对称炔烃与卤化氢等极性试剂进行加成反应时,也符合马氏规则。 不对称炔烃与卤化氢等极性试剂进行加成反应时,也符合马氏规则。 Br 例如 (CH3)2CHC CH HBr (CH3)2CHC=CH2 HBr (CH3)2CH C CH3
NaCl CH2=CH2 + Br2 水溶液
Br H2C CH2 Br 1,2-二溴乙烷 二溴乙烷
Cl H2C CH2 Br 1-氯-2-溴乙烷 氯 溴乙烷
《有机化学》第三章 不饱和烃

吸电子基团: +NR3>NO2>CN>COOH>F>Cl>Br>I>COOR>OR>
COR>SH>OH> C CR>C6H5>CH=CH2>H
诱导效应的特点:
(1)诱导效应的强弱取决于原了或基团的电负性的大小
的两原子可相对的自由旋转。 能相对自由旋转。Βιβλιοθήκη c.键的可极化度:较小。 较大
1.2 单烯烃的异构现象
1.2.1 结构异构
CH3 CH2 CH CH2 CH3 CH CH CH3
1-丁 烯
2-丁 烯
官能团碳碳双键 位置异构
CH3 C CH2 2-甲 基 丁 烯 CH3
碳链异构
结构异构是由于分子中各原子的结合顺序不同而引起的, 位置异构和碳链异构均属于结构异构。
(2) 与卤化氢的加成
CH3CH CHCH3 + HCl CH3CH2CHCH3
2–丁烯
HBr CH3CH2CH CH2
Markovnikov规则
Cl
2–氯丁烷
Br
CH3CHCH CH3
80 %
CH3CHCH2 CH2Br 20 %
当不对称的烯烃与卤化氢等极性试剂加成时,氢原总
是加到含氢较多的双键碳原子上,卤原子(或其子或
上相互重叠。
从侧面重叠。
电子云的分布情况 a. 电子云集中于两原子 电子云分布在 键所
核的连线上,呈圆柱形分布。 在平面的上下两方,呈块
状分布。
第3章 不饱和烃:烯烃和炔烃

H C CH3 CH3 空间位阻 115.5 反式比顺式稳定性大
119.7
CH3CH CH2 (CH3)2C (CH3)2C (CH3)2C CH2 CHCH3 C(CH3)2
双键碳原子连接 的烷基数目越多 烯烃越稳定
② 炔烃的稳定性 RC≡CR′ > RC≡CH > HC≡CH ③ 烯烃与炔烃稳定性的比较 乙炔 乙烯 氢化热 176.6 137.2
• 卤原子吸电诱导效应,使双键碳原子电子云密度 降低,易停留在1分子加成阶段
35
② 反应机理
X C C X X C C X C
环正离子 环卤鎓离子 控速步骤
SN2
X
由离去基团 背面进攻
X C X C
+
X C C X
炔烃与卤素加成的反应机理与烯烃类似
36
③ 活性 • 卤素活性:F2 难控制 • 烯烃活性:
+
CH3
CH
CH2
HX _ _ X
CH
CH3
+
(1) (2)
CH2
CH2
中间体正碳离 子的稳定性决 定加成的取向
41
• 碳正离子中间体的活化能:(1)<(2)
42
• 碳正离子的结构
H C C+
加成产物顺反各半
2 SP3 SP 、 空P轨道 ,
SP2杂化轨道比SP3具有更多的S成分,使C-C σ键 的电子云偏向SP2杂化碳原子
17
Chapter 7
18
例: 比较以下基团的H3
CH CH2
CH CH2 C
CH3
>
CHCH2CH3 H
C
2
与
C CH3 CH3 CH3
第三章 不饱和烃:烯烃和炔烃(7学时)

CH3CH CH C CH
CH C CH2CH CH2
3 –戊烯–1–炔
1–戊烯–4–炔
CH3C C CH CH2CH CH2 CH2CH3
4 –乙基–1–庚烯–5–炔
CH C CH CH2 1–丁烯–3–炔
CH3C C CH CH2CH CHCH3 CH CH2
5 –乙烯基–2–辛烯–6–炔
37
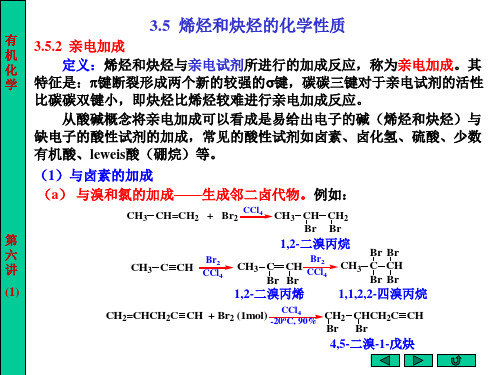
3.5 烯烃和炔烃的化学性质
44
nickel borides
②. P-2(硼化镍)催化剂
CH3CH2C
P2
CCH2CH3 H2
CH3CH2
CH2CH3
CC
H
H
98%
cis-addition
特点:使反应停留在烯烃阶段,得顺式加成产物。
45
炔烃的化学还原
chemical reduction
①. 在液氨中用碱金属(Li、Na、K)还原生成反式烯烃
-杂化-
sp 杂化轨道形成过程示意图
13
14
15
π bond
3.1.3 π 键特性
1)π 键是较弱的共价键,键能比σ键低,易断裂;
2)不能自由旋转。 3)π键的极化度大,具有较大的流动性及反应活性。
一个 sp3 杂化轨道 ¼ s 轨道 ¾ p 轨道
16
3.2 烯烃和炔烃的同分异构
isomerism
不饱和度 ∆
number of double bonds ring numbers
number of triple bond
∆=双键数+环数+2×三键数
∆=C+1-H/2-X/2+N/2
双键数+环数+2×三键数=C+1-H/2-X/2+N/2
有机化学 第三章 不饱和烃

同分异构现象
1.碳链异构:和烷烃一样,
2.官能团位置异构:由于双键或三键位置不同所产生的异构,如:
3. 立体异构:由于双键不能绕σ键键轴旋转,导致相连基团在空间的不同排列方式 产生的异构现象。
顺反异构—— 相同基团在双键同侧为顺式,不同侧为反式
CH3
CH3
CC
H
H
顺式(cis)
本章学习内容
1.烯烃、炔烃等不饱和烃的命名(掌握) 2.烯烃、炔烃及共轭二烯烃的结构特征(理解) 3.烯烃、炔烃、共轭二烯烃的物理、化学性质(重点难点掌握)
3.1 分类
烯烃(alkene):C=C 不饱和烃
单烯烃:含一个双键
多烯烃 :含两个及以上个双键, 含两个双键叫二烯烃
炔烃(alkyne):
H3C CH3CH2
CH2CH2CH3 CH2CH3
Br Cl
Cl
H
顺-3-甲基-4-乙基-3-庚烯 (E)-3-甲基-4-乙基-3-庚烯
反-1,2-二氯-1-溴乙烯 (Z) -1,2-二氯-1-溴乙烯
课堂练习:命名下列化合物
CH3CH2 H
Cl CH3
H3C CH3CH2
CH3 CHCH3 CH2CH2CH3
氯加在含氢多的碳原子上,合成卤代醇的方法。
+ H2C CH2 H O Cl
H2C Cl
CH2 OH
+ H3C CH CH2
H O Cl
H3C
CH OH
CH2 Cl
4. 与卤化氢加成(亲电加成)——碳正离子中间体机理 反应历程:H+首先与双键中的p电子对结合使另一碳原子形成 碳正离子,碳正离子再与X- 结合成卤代烷。
第3章 不饱和烃
CH3-C=CH2
CH3
19
三、烯烃的性质
(一)物理性质
烯烃在物理性质上与相应的烷烃相似,但 它们的沸点低些,而相对密度稍高。 C2~C4 是气体,C5~C18是液体,C19 以上是固体。 所有烯烃的相对密度都小于1,并有特殊 气味。 烯烃难溶于水而能溶于有机溶剂,如乙醚、 四氯化碳等。
n CH CH2 AlR3 TiCl4 1MPa , 50℃ CH3
[ CH CH2 ]
CH3
聚丙烯
n
30
作业
p39 一、1、2、3、6、11、13、14、15 二、6 四、3、4
第2节 二烯烃
一、二烯烃的分类和命名 二、共轭二烯烃的结构和共轭效 应 三、共轭二烯烃的化学性质
H2C=CH2+H2O
H3PO4
300℃,7~8MPa
H3C-CH2OH
H3PO4/硅藻土 CH3CH2CH=CH2+H2O 300℃
CH3CH2CHCH3 OH
27
(二)化学性质
2.氧化反应
(1)碱性或中性高锰酸钾氧化
室温 CH2-CH2+KOH+MnO2 ↓
CH2=CH2+KMnO4+H2O
38
三、共轭二烯烃的化学性质
1.加成反应
共轭二烯烃与一分子卤素、卤化氢等亲电试剂进行加 成反应,产物通常有1,2-加成和1,4-加成两种。
低温及非极性溶剂中以1,2-加成为主 高温及极性溶剂中以1,4-加成为主。 与卤化氢加成符合马氏规则
1,2-加成
CH2BrCHBrCH=CH2 CH2=CH-CH=CH2+Br2-1,4-加成 CH2BrCH=CHCH2Br
3 第3章 不饱和烃:烯烃和炔烃

CH3 CH-CH3 C
4
顺- 3-甲基-2-戊烯 (E )-3-甲基-2-戊烯
3
CH2CH2CH2CH3
5 6 7 8
(E)-3-甲基-4-异丙基-3-辛烯
21
课堂练习:命名下列化合物.
CH3CH2 CH3CH2
Cl
Cl
CH3CH2 CH3CH2 H3C H3C
H CH CH3 3 H
CH3 CHCH3 CHCH3 Br Br
CH3COOH CH3 70%-85%
H
H CH3 CH3
烯烃双键碳原子上取代基越少, 空间位阻就小, 越易在 催化剂表面吸附, 进而氢化速度快。因此, 烯烃催化氢 化的速度是: R2C=CR2 < R2C=CHR < R2C=CH2~RCH=CHR
< RCH=CH2 < CH2=CH2
30
炔烃的加成反应
② 碳碳三键上的氢(炔-H)有一定的酸性。
原因: 电负性Csp> Csp2> Csp3, 使C-H键极性增强。
7
3.2 烯烃和炔烃的同分异构
3.2.1 烯烃 构造异构 碳架异构 位置异构:官能团(重键)位置 立体异构:构型异构:顺反异构 3.2.2 炔烃 构造异构 无立体异构
8
3.2.1 烯烃
1、构造异构 (如:C4H8)
CH3
H3 C H
CH2 CH3 CH2 CH3
H3 C CH3 CH2 CH2
Cl Cl
22
附加: 环烯烃从双键开始编号, 加字头“环”, 为环某烯, 如
CH2CH3
环戊烯
CH3
4-乙基-1-环己烯
CH3 CH2CH3
1 2
第三章不饱和烃

CH 3CH
CH2 HBr
or
RO O R
CH 3CH 2CH 2Br
但对HCl、HI无影响。
3.催化氢化
CH3— CH CH3 CH2 H2 Ni CH3CH2CH3
H
CH3 H
C C
C
CH3 H
H2 Ni
H2 Ni
CH3CH2CH2CH3 119.7kJ· mol-1
H C CH3
例:δδδ+
δδ+
δ+
δ-
δ+
δ-
CH3
CH2
CH2
Cl
CH3
CH
CH2
诱导效应的特点:(A)诱导效应的强弱,取决于原 子或基团的电负性,与H原子的电负性相差越大,诱 导效应就越强。 顺序:F>Cl>Br>I>CH3O->HO- >C6H5->H 吸电子能力越大 H<CH3-<C2H5-<(CH3)2CH-<(CH3)3C-
烷烃:CH3—CH3 CnH2n+2 氢饱和,键用完 氢稀少,
烯烃:H2C=CH2 CnH2n
炔烃:HC≡CH CnH2n-2
氢缺少。
3.1.1 烯烃和炔烃的结构 代表物:H2C=CH2 乙烯
H—C≡C—H 乙炔 1.乙烯的结构
H C H C H H
平面型. H-C-H键角117°,H-C-C键角121°
CH3CH
CH2 + HOSO3H
CH3CH—OSO3H CH3
(4)与H2O加成
H2 O CH3CHOH △ CH3
CH 3CH
CH2 H2O
H3 PO4 硅藻土 195oC 2MPa
CH 3CHCH 3 OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 不 饱 和 烃 《有机化学》(第四版)
不饱和烃: 含有碳-碳重 键的碳氢化 合物 分 类
烯烃
C C
C C H3C C C H
炔烃
烯烃: 链烯 炔烃: 链炔
环烯 环炔(较少)
官能团: CC(烯烃)、CC(炔烃) 端烯、炔: CC、CC键在链端的烯、炔
Z, E -命名法:依据次序规则, 比较出两个双 键碳原子上所连接的取代基优先次序。当优 先基团处于双键的同侧时,称 Z -式;处于 异侧时,称 E - 式。
H C C CH3 CH3 H C2H5 CH3 C C CH3 C2H5
(E)-3-甲基-2-戊烯
(Z)-3-甲基-2-戊烯
顺和Z、反和E 之间没有对应关系!
碳链编号遵循最低系列原则, 使双键、三 键具有尽可能低的编号(即从靠近不饱和 键的一端开始编号);
其它与烯烃、炔烃的命名相似。
CH3CH CH C CH
5 4 3 2 1
CH3C CCHC2H5 CH2CH CH2
3 2 1
7
6
5 4
3-戊烯-1-炔
4-乙基-1-庚烯-5-炔
特殊情况: 若双键和三键处于相同的位次时, 优先给双 键最低编号。
(c) 当基团含有双键和三键时, 可以认为双键 和三键原子连接着两个或三个相同的原子。
H C CH CH2 C C C H C H HC H C H C
6 1 2 1
N C H C N C N N C C
1
HC
6 2 3
H C N
2
C HC H
N
3
C N 6
3C
H H
优先顺序:
C N> > C CH > CH CH2
H2C=CH-COOH < H2C=CH-Br < H2C=CH2 < CH3CH=CH2 < (CH3)2C=CH2 < (CH3)2C=CHCH3 < (CH3)2C=C(CH3)2
(b) 亲电加成反应机理: Step 1: 形成溴嗡离子(决速步骤)
-从背面进攻生成产物(快步骤) 。 Step 2: X
180(或)反式
反应的立体化学:反式加成。
Br Br H H H H Br+ Br Br Br H Br Br
- H
(2) 与卤化氢加成 (Markovnikov规则) (a) 与卤化氢加成
C2H5CH CHC2H5 + HBr
CHCl3 o -30 C
C2H5CH CHC2H5 Br I H (mixture) H
基态时碳原子核外电子排布: 1s22s22p2 烯烃C: sp2杂化轨道 (hybrid orbitals) : 基态 激发态 sp2杂化态
1 . 烯烃碳原子轨道的sp2 杂化
1个2s轨道 + 2个2p轨道 = 3个sp2杂化轨道。 每个sp2 杂化轨道 = 1/3 s + 2/3 p
1个sp2 杂化轨道
Y R CH2 C C X
C C
X2
hv or heat
R CH2
C C
[O]
烯烃α-氢的反应
加成(或氢化)、氧化反应
X-Y
Y C C H X
X-Y
Y X H C C Y X
M C C
(M= Na, Ag, Cu, etc)
H C C
[O]
炔氢的反应
加成(或氢化)、氧化反应
Br H2C CH C CH +
CCl4 Br2 o -20 C
H2C CH C CH Br
不饱和烃的反应活性:
Parent
原因: 给电子基团使C-C双键的电子云密度增加, 因而有利于亲电加成反应的进行, 反之拉电 子基团则不利于亲电加成反应的进行。 卤素活性顺序:F > Cl > Br > I。
H2C C CH2CH3 CH2CH2CH3
3 4 5 1 2 1 2 3 4 5 6
H3C CHC CCH CH3 CH3 CH3
2-乙基(-1-)戊烯
5 1 2 3 4
2,5-二甲基-3-己炔
8 1 5 2 4 3
C2H5
H3C
3-乙基(-1-)环戊烯
4-甲基(-1-)环辛炔
烯炔的命名 选择含有C-C双键和C-C三键在内的最长 碳链为主链, 根据主链碳个数称“烯炔”;
(1) 与卤素加成 (a) 与溴和氯加成
CH3 CH CH2 + Br2
CCl4
Br CH3 CH CH2 Br Br Br Br
Br2/CCl4
CH3 C CH2 + Br2
CCl4
CH3 C CH Br
CH3 C CH Br Br
用途:检验含碳-碳重键的化合物。 烯烃比炔烃更易于与卤素加成, 原因是烯烃碳 的电负性小于炔。
1个C-Cσ键, 2个C-Hσ键 2个C-Hσ键组成一条直线
2个π键 均垂直于上述直线 且两个π键相互垂直 乙炔则是直线型分子。
3.2 烯烃和炔烃的同分异构现象
碳架异构 (碳链的改变造成的) C 4 时 官能团位次异构(双键、叁键在链 中的位置不同造成的) 顺反异构(因双键不能反转导致原 子或基团在空间的不同排列不同 造成的)
烯烃 CH2 C H 3C H CH2 CH2 CH2 氢 化 热 / kJ · mo l 1 3 7 .2 1 2 5 .9 1 2 6 .8 1 1 8 .8 1 1 2 .5 1 1 1 .3 1 1 9 .7 1 1 5 .5
-1
C H 3C H 2C H (C H 3 ) 2 C (C H 3 ) 2 C (C H 3 ) 2 C 顺 - C H 3C H 反 - C H 3C H
Cat. = Pd-CaCO3/quinoline
立体选择还原(针对炔烃还原成烯烃而言) Lindlar催化剂 (Pd-CaCO3/喹啉)
n-C3H7 C C C2H5 + H2
Lindlar catalyst 100%
n-C3H7 C C H
C2H5 H
顺式产物
P-2催化剂(Ni2B), 它是由醋酸镍在乙醇中用 硼氢化钠还原制得。 CH CH
H2C C CH2CH3 CH2CH2CH3
3 4 5 1 2 1 2 3 4 5 6
H3C CHC CCH CH3 CH3 CH3
戊烯
5 1 2 3 4
己炔
8 1 5 4 3 2
C2H5
环戊烯
环辛炔
H3C
命名: 取代基位次、数目、名称写于“ 烯 或炔”之前,用 “”隔开 。主链超过10个 碳原子的称“ 十一,十二,碳烯”或碳炔。
3.1 烯烃和炔烃的结构
C C
键 能 / k J m ol · 键 长 / nm
-1
C C
611 0.134
C C
837 0.120
347 0.154
表观现象: CC、CC都不是由两个或三个C-C 单 键的简单组合而成的。 反应表现: CC、CC与C-C单键表现出截然不同的化 学性质。
3个sp2 杂化轨道
余下1个未参与杂化的2p轨道(哑铃状), 则垂直于由三个杂化轨道对称轴所组成的平
2. 碳-碳双键的组成
乙烯分子中
4个C-Hσ键(sp2-1s1) 1个C-Cσ键(sp2- sp2 ) 5个σ键在一个平面内
1个C-Cπ键 乙烯是平面型分子。
C=C双键中σ键与π键的区别
C-Cσ 键 C-Cπ 键
同分异构 碳链异构 丁 烯
CH3CH2CH CH2 CH3 CH3C CH2
位次异构
CH3CH CHCH3
顺反异构
H3C C H H C H3C C H C H CH3 CH3
CH3CH2CH2C
CH
CH3CH2C
CCH3
戊 炔
CH3 CH3CHC CH
3.3 烯烃和炔烃的命名 3.3.1 常见的烯基和炔基
3.5.1 加氢 (1) 催化氢化和还原
CH3CH CH3CH CH2 + H2 CCH3 + H2
Ni, ethanol 25
o
C, 5 MPa
o
CH3CH2CH3 CH3CH2CH2CH3
Ni, ethanol 25 C, 5 MPa
烯烃的相对活性:
H2C CH2 > H2C CHR > RHC CHR > RHC CR2 > R2C CR2 H2C CR2
+ HI
KI, H3PO4
炔烃与卤化氢加成的加成比烯烃困难。但也 可根据卤化氢的量控制反应进程。
HC CH
HCl, HgCl2 150-160 oC
由sp2杂化轨道以“头 由未参与杂化的p轨道侧 碰头”方式交盖组成。 面交盖而成。 电子云呈圆筒状, 分布 电子云分散在由5个σ键 在两成键原子中心连 所组成平面的上、下方。 线周围。 能单独存在。 不能单独存在,只能与 C-Cσ键共存。
3. π键的特征
形成双键的碳原子不能沿C-C 键轴 自由旋转。 π键键能较σ键的低,易极化,不稳定 而易被打开;因而具有较大的反应活 性。
顺-2-戊烯
H C C CH3 C H 2C H 2C H 3 CH3 C H 2C H 3 C H 3C H 2
反-2-戊烯
C H (C H 3 ) 2 C C C H 2C H 2C H 3
下述例子难用顺反命名法命名:
(乙) Z , E -标记法 次序规则: (a) 与双键碳原子直接相连的原子按原子序 数大小排列, 大者 “优先”。 I > Br > Cl > S > O > N > C > D > H > : (b) 如与双键碳原子直接相连的原子的原子序 数相同, 则需再比较由该原子外推至相邻的第 二个原子的原子序数,如仍相同,继续外推, 直到比较出 “优先” 基团为止。 -C(CH3)3 > -CH(CH3)2 > -CH2CH3 > -CH3 -CH2Cl > -CH2OH > -CH2NH2
