不同类型补充水的循环水自然PH值的计算公式
ph值公式

ph值公式
pH值,又称酸碱度,它表示溶液中某个体系的酸性或碱性的程度。
它的取值
范围是0~14,其中7为中性,小于7则表示是酸性,大于7则表示碱性。
它的计
算方法是:
首先,计算出溶液中的H+浓度(即酸的浓度),单位为mol/L,它的公式为:
[ H+ ] = 10-pH
其次,通过这个H+浓度,就可以求出溶液的pH值,它的公式为:
pH= -Log[H+]
pH值可以指示溶液是酸性,还是碱性,因此,对于生活中的物质,可以根据
它们的pH值,来划分出酸,中性和碱三种类别,这对检测、分类物质的效果极其
重要。
矿物水的PH值有着规律性,它在纯净水中可以是7,但它在湖水中可能会
比纯净水有更大的范围,它的取值在6-8之间,各类湖水、河水、海水及其他水体,它们的PH值也将有所不同。
此外,在大气中,H+浓度较低,pH值在7以上,具有碱性,所以说在大气中能够起到缓冲作用,使大气稳定。
总之,pH值是衡量某个体系是酸性还是碱性的重要指标,它使我们可以了解
不同环境的pH值,从而帮助我们更好的处理一些问题,比如在生态学中,可以帮
助我们改善水体的质量指标,确保水质的稳定,提高水的生态环境。
PH计算公式范文

PH计算公式范文
1. PH = -log[H+]
其中,[H+]表示溶液中氢离子的浓度。
这个公式适用于溶液中只有一
种酸或碱,并且浓度知道的情况。
举个例子,假设我们有一个溶液,其中氢离子的浓度为0.001mol/L,那么我们可以使用上述公式计算PH值:
PH = -log(0.001) = 3
2.PH=14-pOH
PH和pOH是一对互补的指标,pOH表示溶液中羟氢离子(OH-)浓度
的负对数。
这个公式适用于溶液既含有酸又含有碱的情况。
假设我们有一个溶液,其中羟氢离子的浓度为0.01mol/L,那么我们
可以使用上述公式计算PH值:
pOH = -log(0.01) = 2
PH=14-2=12
除了使用上述公式外,还可以使用PH计算器或PH计来测量物质溶液
的PH值。
需要注意的是,PH值的范围是0-14、当PH值小于7时,溶液为酸性;当PH值大于7时,溶液为碱性;当PH值等于7时,溶液为中性。
循环水加酸量计算

循环水加酸量计算1、循环冷却水加酸调PH,是为了提高浓缩倍数及阻垢的需要,根据酸碱中和原理,理论上加酸量等于碱度降低量。
如果循环水加酸前后的碱度差为ΔM,则:ΔM=M前—M后,M前为循环水调PH前碱度,M后为循环水调PH后碱度。
M前和M后可由现场实测或由自然PH值与碱度计算公式求得。
如果用98%的硫酸调PH,循环水单位用量为:A=49/ΔM(50*0.98*1000)=ΔM/1000,A----循环水单位加酸量 g/l或kg/m?,49----为硫酸的克当量。
2、循环水冷却系统加酸量为:首次加酸量=A*V (kg);是为了中和循环水碱度首次加入量; 系统运行时加酸量=AB*24 (kg/d);在首次加入量的基础下,为了维持循环冷却水一定浓缩倍数下的PH一天的加酸量。
V---系统保有水量或容积 m?,B----系统排污量(包括蒸发量)m?/h,例如:V=5000 m?,B=93 m?/h,M前=320mg/l,M后=135 mg/l(控制PH值为8.2),求:系统98%硫酸量的加入量。
解:循环水单位加酸量A=ΔM/1000= (M前—M后)/1000=0.185 kg/m?,系统首次加酸量=A*V=0.185*5000=925 kg,运行加酸= AB*24=0.185*93*24=412.92 kg。
电厂循环水处理系统发展趋势发布日期:2012.4.12 [打印本页] [关闭本页] [返回上一页]一、早期循环水处理技术循环水技术发展早期,主研究各微溶盐类于不同pH下溶解度,极限碳酸盐硬度、朗格里尔饱和指数及雷兹纳稳定指数、安定性指数、经验公式的方法判断碳酸盐沉积趋势,磷酸钙饱指数判断磷酸钙是否析出。
受技术水平限制,循环水浓缩倍率一般二点五以下,用加聚磷酸盐辅助硫酸方法处理。
循环水杀菌灭藻用加氯处理。
早期循环水处理技术浓缩倍率低,循环水系统需水量大。
加氯一有水效果差且氯胺类污染物生,随水资源日益短缺及环保要求日益严格,于应用的逐渐被新技术取代。
PH值如何计算范文

PH值如何计算范文PH值是用来表示溶液酸碱性强度的一个指标,通过测量溶液中的氢离子(H+)浓度来确定。
下面将详细介绍PH值的计算方法。
PH值的定义是对数形式的,用以表示酸碱度的强弱程度,它表示溶液中氢离子的浓度。
PH值的计算公式为:PH = -log10 [H+]其中[H+]表示溶液中氢离子浓度的对数值。
当溶液为酸性时,[H+]浓度高,PH值低于7;当溶液为碱性时,[H+]浓度低,PH值高于7;当溶液为中性时,[H+]和[OH-]浓度相等,PH值为7为了正确计算PH值,首先需要了解溶液中氢离子浓度的计算方法。
在水中,可能同时存在氢离子(H+)和氢氧根离子(OH-)。
根据溶液中[H+]和[OH-]的浓度关系,可以知道:[H+]×[OH-]=1×10^-14这是因为水在一定温度下,离子乘积的值是一个常数(1×10^-14)。
根据这个关系,可以根据已知溶液中一个离子浓度来计算另一个离子的浓度。
当溶液酸碱性强度相对较弱时,如纯水或稀酸碱溶液,可以近似假设溶液中[H+]≈[OH-]。
以此作为前提,可以根据[H+]或[OH-]中任意一个浓度值来计算PH值。
例如,当已知[H+]浓度为1 × 10^-7 mol/L时,可以用计算PH值的公式:PH = -log10 (1 × 10^-7) = 7这表示溶液为中性,pH值为7当溶液为酸性或碱性较强的情况下,无法采用近似假设[H+]≈[OH-]。
此时,需要借助公式[H+]×[OH-]=1×10^-14,根据已知[H+]或[OH-]浓度计算另一离子的浓度,然后再代入PH计算公式。
例如,当已知[H+]浓度为1 × 10^-3 mol/L时[H+]×[OH-]=1×10^-14(1×10^-3)×[OH-]=1×10^-14[OH-] = (1 × 10^-14) / (1 × 10^-3) = 1 × 10^-11 mol/L接着,代入PH计算公式:PH = -log10 (1 × 10^-3) = 3这表示溶液为强酸性,PH值为3综上所述,PH值的计算需要根据已知的氢离子浓度或氢氧根离子浓度来进行,并且在计算时要注意溶液的酸碱强度程度。
pH值计算公式范文

pH值计算公式范文pH是指溶液中氢离子(H+)的浓度的一个数值表示,是酸碱性的一个重要指标。
pH的计算公式可以有多种方法,下面主要介绍两种常用的计算公式。
1. pH=-log[H+]这是最常用的计算pH值的公式。
其中[H+]表示溶液中的氢离子浓度,单位为mol/L。
公式中的“-log”表示取以10为底的负对数运算,即负对数越大,表示溶液中的氢离子浓度越低,pH值越高;负对数越小,表示溶液中的氢离子浓度越高,pH值越低。
通过这种计算方法,可以准确地计算出任意溶液的pH值。
例如,如果溶液中的氢离子浓度为1×10^-5 mol/L,则pH=-log(1×10^-5)=-(-5)=5、这意味着这个溶液的pH值为5,是一个弱酸性溶液。
2. pH=pKa+log([A-]/[HA])这是在酸性溶液中计算pH值的公式。
其中pKa表示酸的解离常数的负对数,[A-]表示酸解离后的阴离子浓度,[HA]表示酸的未解离分子浓度。
这个公式是在酸的解离平衡条件下推导出来的。
需要注意的是,这个公式只适用于一元酸溶液,对于复杂的酸溶液不适用。
对于复杂的酸溶液,可以先将其分解成酸的主要成分,然后分别计算每个成分的pH值,再结合成总的pH值。
例如,如果有一个0.1mol/L的乙酸(CH3COOH)溶液,其pKa为4.75,以及0.01mol/L的乙酸根离子(CH3COO-)浓度,则pH=4.75+log(0.01/0.1)=4.75+log(0.1)=4.75+(-1)=3.75、这意味着这个溶液的pH值为3.75,属于弱酸性溶液。
无论使用哪种计算公式,都可以得出溶液的pH值。
pH值的范围一般在0-14之间,其中pH值为7的溶液称为中性溶液,pH值小于7的溶液称为酸性溶液,pH值大于7的溶液称为碱性溶液。
关于PH值的计算

关于PH值的计算PH值是一个用来衡量溶液酸碱程度的指标。
pH值的计算是通过测定溶液中氢离子(H+)的浓度来得到的。
根据酸碱理论,酸性溶液中氢离子的浓度高,而碱性溶液中氢离子的浓度低。
pH值的取值范围是0到14,其中低于7的溶液被认为是酸性的,高于7的溶液被认为是碱性的,而等于7的溶液则是中性的。
在溶液中,水分子会自发地发生自离解反应,生成氢离子(H+)和氢氧根离子(OH-)。
在中性溶液中,氢离子和氢氧根离子的浓度是相等的。
pH值的计算是通过测定溶液中氢离子浓度的负对数来进行的。
pH = -log[H+]其中[H+]代表氢离子的浓度,log是指以10为底的对数运算。
根据这个公式,pH值与氢离子浓度成反比关系。
也就是说,氢离子浓度越高,pH值越低,溶液越酸性;氢离子浓度越低,pH值越高,溶液越碱性。
测定溶液的pH值可以使用一种叫做pH计的仪器。
在常见的pH计中,会使用一种叫做玻璃电极的传感器来测量溶液中的氢离子浓度。
玻璃电极的原理是基于玻璃与溶液中的氢离子发生反应,产生微弱的电势。
根据这个电势的变化,可以推算出溶液中的氢离子浓度,从而计算出pH值。
除了玻璃电极,还有其他类型的电极,如差减电极、非玻璃电极等,也可以用来测量pH值。
除了使用pH计进行测量,还可以通过化学指示剂的变色来判断溶液的酸碱性。
化学指示剂是一种溶液变色的物质,它能根据溶液的酸碱性发生颜色的变化。
常用的化学指示剂有酚酞、溴酚蓝、甲基橙、溴甲酚绿等。
根据化学指示剂在不同pH值下的颜色变化规律,可以快速推测溶液的酸碱性。
pH值在许多领域都有重要的应用。
例如,在生物学中,pH值对于维持生物体内部环境的稳定至关重要。
在环境科学中,pH值可以用来评估水体、土壤的酸碱程度,以及污染物的溶解、迁移和活性。
在医学和药学领域,pH值是药物的溶解度和吸收性的重要参数。
同时,pH值还在食品、饮料、农业等众多领域中起到了重要的作用。
总结起来,pH值的计算是基于溶液中氢离子浓度的负对数进行的。
循环水系统中PH值的调整参考资料

循环水系统中PH值的调整PH值是循环水系统的主要运行指标之一,一般煤气站循环水的pH值是在6.5~7.5之间。
所以基本上属于中性的,但在用加酸进行煤气站循环水处理时,其PH值就要明显下降,一般在处理水中加酸调整到PH值=3~4时,效果就明显的提高,此水返回系统,势必造成系统pH值下降。
当系统内PH值下降时,需要较长时间才能恢复,因为PH值的调整不是简单的代数加和的平均值,如1吨PH=7的水和1吨PH=5的水加和后,不会达到2吨PH=6的水,经试验,当PH下降至3时,需要用15倍PH=7的水加入,才能使混合液的PH值恢复到PH=6.1。
由此可见,在投酸时应严格根据水系统的PH值而定,当系统的PH值下降时,应适当减少投酸的水处理量,使系统维持到PH=6以上。
PH值是循環水系統的主要運行指標之一,一般煤氣站循環水的pH值是在6.5~7.5之間。
所以基本上屬於中性的,但在用加酸進行煤氣站循環水處理時,其PH值就要明顯下降,一般在處理水中加酸調整到PH值=3~4時,效果就明顯的提高,此水返回系統,勢必造成系統pH值下降。
當系統內PH值下降時,需要較長時間才能恢復,因為PH值的調整不是簡單的代數加和的平均值,如1噸PH=7的水和1噸PH=5的水加和後,不會達到2噸PH=6的水,經試驗,當PH下降至3時,需要用15倍PH=7的水加入,才能使混合液的PH值恢復到PH=6.1。
由此可見,在投酸時應嚴格根據水系統的PH值而定,當系統的PH值下降時,應適當減少投酸的水處理量,使系統維持到PH=6以上。
PH值是循环水系统的主要运行指标之一,一般煤气站循环水的pH值是在6.5~7.5之间。
所以基本上属于中性的,但在用加酸进行煤气站循环水处理时,其PH值就要明显下降,一般在处理水中加酸调整到PH值=3~4时,效果就明显的提高,此水返回系统,势必造成系统pH值下降。
当系统内PH值下降时,需要较长时间才能恢复,因为PH值的调整不是简单的代数加和的平均值,如1吨PH=7的水和1吨PH=5的水加和后,不会达到2吨PH=6的水,经试验,当PH下降至3时,需要用15倍PH=7的水加入,才能使混合液的PH值恢复到PH=6.1。
循环水加酸计算方法

循环冷却水中加酸量的计算循环冷却水加酸调pH值,是为提高浓缩倍数及阻垢的需要。
根据酸碱中和原理,理论上加酸量等于碱度降低量。
如果循环水加酸前后的碱度差△M,则:△M=M前-M后M前为循环水调pH值前的碱度,M后为调pH值后的碱度,M 前、M后可由现场实测或由“自然pH值与碱度计算”相关公式计算求得。
如用98%硫酸调pH值,循环水单位用量为:A=49△M/(50×0.98×1000)=△M/1000 (6-2-2)式中:A—循环水单位加酸量,g/L或kg/ m3;49—1〔H+〕molH2SO4质量,g/〔H+〕molH2SO4(即克当量)2 B 循环冷却水系统总加酸量为:系统中首次加酸量=Avkg (6-2-3)9 j4 Z# O2 系统运行时加酸量=AB•24•kg/d (6-2-4) 式中:V—系统保有水量或系统容积, m3;B—系统排污量(包括飞溅及风吹m3损失量),m3/h。
公式(6-2-3)是为中和循环冷却水碱度,系统首次加入的酸量。
公式(6-2-4)是在公式(6-2-3)基础上,为维持循环冷却水一定浓缩倍数下的pH值一天的加酸量。
例:V=5000 m3、B=93 m3/h,M前=320 mg/L、M后=135 mg/L (控制pH值8.2),求系统硫酸(98%)加入量kg解:循环水单位加酸量A=(320-135)/1000=0.185 kg/ m3系统首次加酸量=A V=0.185×5000=925 kg. p' t7 I" 为维持系统pH值,其运行时加酸量=AB•24=0.185×93×24=412.92 kg/ d! ^) }1 答:为中和该系统冷却水碱度首次加酸量需925 kg,为继续维持该系统一定浓缩倍数下的循环水的pH值,一天的加酸量为412.92 kg。
ph值的计算方法

ph值的计算方法
pH的计算方法:
1、强酸
cmol·L-1HnA强酸溶液,c(H+)=ncmol·L-1―→pH=-lgnc。
2、强碱
cmol·L-1B(OH)n强碱溶液,c(OH-)=ncmol·L-1,
n(H+)=mol·L-1―→pH=14+lg_nc。
混合溶液pH的计算方法如下图:
其中[H+]指的是溶液中氢离子的活度(有时也被写为[H3O+],水合氢离子活度),单位为摩尔/升,在稀溶液中,氢离子活度约等于氢离子的浓度,可以用氢离子浓度来进行近似计算。
例:1、在25°C下,pH=7的水溶液(如:纯水)为中性,这是因为水在25°C下自然电离出的氢离子和氢氧根离子浓度的乘积(水的离子积常数)始终是1×10−14,且两种离子的浓度都是1×10−7mol/L。
2、pH小于7说明H+的浓度大于OH−的浓度,故溶液酸性强,而pH大于7则说明H+的浓度小于OH−的浓度,故溶液碱性强。
所以pH愈小,溶液的酸性愈强;pH愈大,溶液的碱性也就愈强。
3、在非水溶液或25°C的条件下,pH=7可能并不代表溶液呈中性,这需要通过计算该溶剂在这种条件下的电离常数来决定pH为中性的值。
如373K(100℃)的温度下,水的离子积常数为5.5×10−13,即pH约为6.13,此时为中性溶液。
水中酸碱度的计算

1-碱度碱度又称盐基度。
指的是化合物中羟基与铝的摩尔比。
一般用符号B来代表碱度%。
它是碱式氯化铝的重要质量指标,它直接决定着产品的化学结构形态和许多特性,如聚合度、分子电荷数、混凝能力、贮存稳定性、pH值等。
水中碱度是指水中所含能与强酸发生中和作用的全部物质.亦即能接受质子H+的物质总量。
水中碱度主要由三类物质组成:强碱:如氢氧化钠、氢氧化钙等;弱碱:如氨、苯胺等;强碱弱酸盐:如碳酸盐、酸性碳酸盐、硼酸盐、磷酸盐、硅酸盐等;此外,还有有机碱等。
而循环水碱度主要由下列公式表示:M=2[CO32-]+[HCO3-]+[OH-] +[HSiO3-]+[H2P04-]+2[HPO42-]+[NH3]由于正常情况下,循环水水质中后四项含量很少,故平时只表示前三项;即总碱度M为:M=2[CO32-]+[HCO3-]+[OH-]工业循冷却水碱度的测定一直沿用传统的中和滴定法:用酚酞作指示剂测定碱度,称为酚酞碱度,用符号P表示;用甲基橙作指示剂测定碱度,称为全碱度碱度,用符号M表示。
对于不同的水质环境,碱度的计算方法略有不同,为了更好的反映水质的情况,我们需要选择合适的方法来计算。
各种碱度用标准酸滴定时可起下列反应:0H-十H+=H20CO32-十H+=HC03-;HC03-+H+=Hz0十CO2当滴定至酚酞指示剂由红色变为无色时,溶液pH值即为8.3,指示水中氢氧根离子(0H-)已被中和,碳酸盐均被转化为重碳酸盐,此时的滴定结果称为“酚酞碱度”—P;当滴定至甲基橙指示剂由黄色度为橙红色时,溶液的pH值为4.4—4.5,指示水中的重碳酸盐(包括原有的和由碳酸盐转化成的)已被中和,此时的滴定结果称为“总碱度”—M。
通过计算可求出相应的碳酸盐、重碳酸盐和氢氧根离子的含量。
但对于废水、污水,则由于组分复杂,这种计算是无实际意义的。
2-酸度在化学中,酸度(或称中和值、酸值、酸度)表示中和1克化学物质所需的氢氧化钾(KOH)的毫克数,以A表示酸度。
水酸碱性测试计算公式

水酸碱性测试计算公式水酸碱性测试是用来测定溶液中的酸碱性程度的一种常用方法。
通过测试溶液的pH值来判断其酸碱性,pH值越小表示溶液越酸,pH值越大表示溶液越碱,而pH值为7表示溶液是中性的。
在实际应用中,我们经常需要根据溶液中各种物质的浓度来计算其pH值,这就需要用到一些水酸碱性测试的计算公式。
本文将介绍一些常用的水酸碱性测试计算公式,并举例说明其应用。
1. pH的计算公式。
pH值是用来表示溶液酸碱性的指标,其计算公式如下:pH = -log[H+]其中[H+]表示溶液中氢离子的浓度。
在一般情况下,我们可以通过测定溶液中的氢离子浓度来计算其pH值。
例如,如果溶液中的氢离子浓度为1×10^-7mol/L,那么其pH值就是7,表示这是一个中性溶液。
2. 强酸和强碱的pH计算公式。
对于强酸和强碱来说,其pH值可以直接通过浓度计算得到。
强酸的pH值计算公式如下:pH = -log[C]其中[C]表示强酸的浓度。
同样地,强碱的pH值计算公式如下:pH = 14 + log[C]其中[C]表示强碱的浓度。
例如,如果一种强酸的浓度为0.01mol/L,那么其pH值就是2,表示这是一个酸性溶液。
3. 弱酸和弱碱的pH计算公式。
对于弱酸和弱碱来说,其pH值的计算就要复杂一些,需要考虑到其离子的解离程度。
弱酸的pH值计算公式如下:pH = 1/2(pKa log[C])。
其中pKa表示弱酸的酸解离常数,[C]表示弱酸的浓度。
同样地,弱碱的pH值计算公式如下:pH = 1/2(pKb log[C])。
其中pKb表示弱碱的碱解离常数,[C]表示弱碱的浓度。
例如,如果一种弱酸的酸解离常数为1×10^-5,浓度为0.01mol/L,那么其pH值就可以通过上述公式计算得到。
4. 酸碱中和反应的pH计算公式。
在一些酸碱中和反应中,我们需要计算反应后溶液的pH值。
这时可以通过溶液中酸和碱的摩尔浓度来计算。
如果酸和碱的摩尔浓度分别为n1和n2,那么反应后溶液的pH值可以通过下面的公式计算得到:pH = 1/2(pKa log(n1/n2))。
循环冷却水中pH值及碱度计算
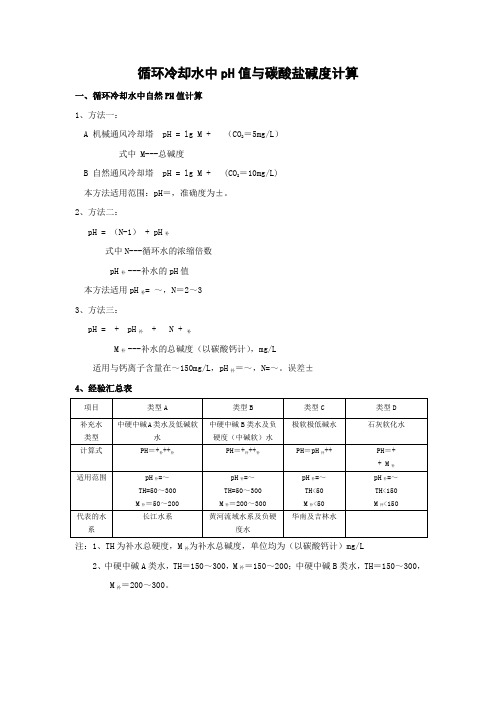
循环冷却水中pH值与碳酸盐碱度计算
一、循环冷却水中自然PH值计算
1、方法一:
A 机械通风冷却塔 pH = lg M + (CO2=5mg/L)
式中 M---总碱度
B 自然通风冷却塔 pH = lg M + (CO2=10mg/L)
本方法适用范围:pH=,准确度为±。
2、方法二:
pH = (N-1) + pH补
式中N---循环水的浓缩倍数
pH补---补水的pH值
本方法适用pH补= ~,N=2~3
3、方法三:
pH = + pH补 + N + 补
M补---补水的总碱度(以碳酸钙计),mg/L
适用与钙离子含量在~150mg/L,pH补=~,N=~。
误差±
4、经验汇总表
注:1、TH为补水总硬度,M补为补水总碱度,单位均为(以碳酸钙计)mg/L
2、中硬中碱A类水,TH=150~300,M补=150~200;中硬中碱B类水,TH=150~300,
M补=200~300。
二、敞开式循环冷却水中的碱度计算 1、计算公式 lgM = pH –
式中 M---循环水的碱度 2、BETZ 公司整理的对应数据
3、国内整理的经验参数
注:1、M 为循环水总碱度,mg/L (以碳酸钙计)
2、pH 为循环水的pH 值,当pH 等于自然pH 时,计算所得M 为自然pH 值时的总碱度。
4、循环水的pH-M 关系
说明:对于已经投产的系统,可以累计其相关参数并归纳成该装置的曲线图,供日后参考适用。
ph计算最简式

ph计算最简式酸碱度,即酸碱性,是指溶液中氢离子(H+)或氢氧根离子(OH-)的浓度。
在化学中,我们使用pH值来表示溶液的酸碱度。
pH值是一个无量纲的指标,它的取值范围从0到14。
pH值小于7表示酸性溶液,pH值大于7表示碱性溶液,而pH值等于7表示中性溶液。
那么,如何计算pH值呢?pH值的计算公式如下:pH = -log10[H+]其中[H+]表示氢离子的浓度。
根据这个公式,我们可以得出一些结论:1. 当溶液中氢离子浓度增加时,pH值会减小,溶液会更酸;2. 当溶液中氢离子浓度减小时,pH值会增大,溶液会更碱;3. pH值为7时,溶液为中性。
现在我们来看一个例子,假设有一瓶溶液,其中氢离子的浓度为0.001mol/L。
我们可以使用pH值的计算公式来计算其pH值:pH = -log10(0.001) ≈ 3所以,这个溶液的pH值约为3,属于酸性溶液。
将溶液的酸碱度表示为pH值的好处在于,它提供了一种简单而直观的方式来描述溶液的酸碱性。
而且,pH值的取值范围广泛,可以覆盖大部分溶液的酸碱度。
此外,pH值还可以用来判断某些物质的性质和反应的进行程度。
在实际应用中,pH值广泛用于环境监测、生物化学、食品科学等领域。
例如,在环境监测中,pH值可以用来评估水体或土壤的酸碱度,从而判断其对生物的适宜程度。
在食品科学中,pH值可以用来检测食品的新鲜度和稳定性,判断是否发生了腐败或变质。
除了pH值之外,还有其他一些指标可以用来描述溶液的酸碱性。
例如,酸度和碱度可以用酸碱度计来测量,酸碱度计使用指示剂(如酚酞、溴酚蓝等)来显示溶液的酸碱性。
另外,还有一种称为酸碱反应的化学反应可以用来判断溶液的酸碱性,酸碱反应中酸和碱会发生中和反应,生成盐和水。
pH值是一种用来表示溶液酸碱度的无量纲指标。
通过计算溶液中氢离子的浓度,我们可以得到溶液的pH值,并据此判断其酸碱性。
pH值的应用广泛,可以帮助我们了解溶液的性质,评估其适宜程度,以及判断食品的新鲜度和稳定性等。
ph计算的四个公式

ph计算的四个公式
酸碱度描述的是水溶液的酸碱性强弱程度,用pH来表示。
热力学标准状况时,pH=7的水溶液呈中性,pH<7者显酸性,pH>7者显碱性。
pH范围在0~14之间,只适用于稀溶液,氢离子浓度或氢氧根离子浓度大于1mol/L的溶液的酸碱度直接用浓度表示。
相关概念:
pH小于7说明H+的浓度大于OH-的浓度,故溶液酸性强,而pH大于7则说明H+的浓度小于OH-的浓度,故溶液碱性强。
所以pH愈小,溶液的酸性愈强;pH愈大,溶液的碱性也就愈强。
在非水溶液或非标准温度和压力的条件下,pH=7可能并不代表溶液呈中性,这需要通过计算该溶剂在这种条件下的电离常数来决定pH为中性的值。
如373K(100℃)的温度下,中性溶液的pH≈6。
ph值计算公式

ph值计算公式
ph计算的四个公式如下:
(1)pH= -lg[H+];[H+]=10-pH。
(2)pOH= -lg[OH-];[OH-]=10-pOH。
(3)KW=[H+]·[OH-]=1×10-14。
(4)pH+pOH=14。
皮肤对pH值在4.2~6.0范围内的酸性物质(碱性物质)也有相当的缓冲能力,被称为酸(碱)中和作用。
人体皮肤的好与坏,其主要的原因在于人体皮肤是否健康,而是否健康,则又体现于皮肤的碱中和能力。
研究表明,人在不同时期皮肤的pH值常在4.5~6.5之间变化,但偶尔也会有一些超出这个范围的。
如果皮肤pH值在多数时期处于5.0~5.6之外,皮肤的碱中和能力就会减弱,肤质就会改变,最终导致皮肤的衰老和损害。
所以,多去选配相对应的护肤品,使皮肤pH值保持在5.0~5.6之间,皮肤才会呈现出最佳状态。
可以选用常见的PH试纸测试日用品的pH值。
水质分类表
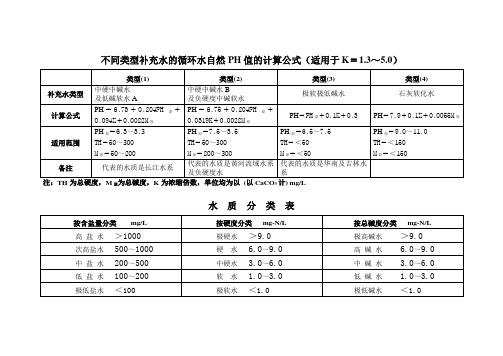
代表的水质是华南及吉林水系
注:TH为总硬度,M原为总碱度,K为浓缩倍数,单位均为以(以CaCO3计) mg/L
水质分类表
按含盐量分类mg/L
按硬度分类mg-N/L
按总碱度分类mg-N/L
高盐水>1000
极硬水>9.0
极高碱水>9.0
次高盐水500~1000
硬水6.0~9.0
高碱水6.0~9.0
中盐水200~500
中硬水3.0~6.0
中碱水3.0~6.0
低盐水100~200
软水1.0~3.0
低碱水1.0~3.0
极低盐水<100
极软水<1.0
极低碱水<1.0
不同类型补充水的循环水自然PH值的计算公式(适用于K=1.3~5.0)
类型(1)
类型(2)
类型(3)
类型(4)
补充水类型
中硬碱水
及低碱软水A
中硬中碱水B
及负硬度中碱软水
极软极低碱水
石灰软化水
计算公式
PH=6.78+0.204PH原+0.094K+0.0022M原
PH=6.75+0.204PH原+0.0819K+0.0022M原
PH=PH原+0.1K+0.8
PH=7.9+0.1K+0.0055M原
适用范围
PH原=6.8~8.3
TH=50~300
M原=50~200
PH原=7.5~8.5
TH=50~300
M原=200~300
PH原=6.5~7.5
TH=<50
M原=<50
PH原=9.0~11.0
TH=<150
M原=<150
备注
代表的水质是长江水系
循环冷却水中pH值及碱度计算

循环冷却水中pH值与碳酸盐碱度计算
一、循环冷却水中自然PH值计算
1、方法一:
A 机械通风冷却塔 pH = lg M +5.60 (CO2=5mg/L)
式中 M---总碱度
B 自然通风冷却塔 pH = lg M +5.29 (CO2=10mg/L)
本方法适用范围:pH=4.3-8.7,准确度为±0.02。
2、方法二:
pH = 0.69(N-1) + pH补
式中N---循环水的浓缩倍数
pH补---补水的pH值
本方法适用pH补= 7.5~8.0,N=2~3
3、方法三:
pH = 6.78 + 0.204 pH补 + 0.094 N + 0.0022M补
M补---补水的总碱度(以碳酸钙计),mg/L
适用与钙离子含量在17.5~150mg/L,pH补=6.3~8.3,N=1.32~4.86。
误差±0.1 4、经验汇总表
注:1、TH为补水总硬度,M补为补水总碱度,单位均为(以碳酸钙计)mg/L
2、中硬中碱A类水,TH=150~300,M补=150~200;中硬中碱B类水,TH=150~300,
M补=200~300。
二、敞开式循环冷却水中的碱度计算 1、计算公式
lgM =0.619 pH –2.663
式中 M---循环水的碱度 2、BETZ 公司整理的对应数据
3、国内整理的经验参数
注:1、M
为循环水总碱度,mg/L (以碳酸钙计)
2、pH 为循环水的pH 值,当pH 等于自然pH 时,计算所得M 为自然pH 值时的总碱度。
4、循环水的pH-M 关系
说明:对于已经投产的系统,可以累计其相关参数并归纳成该装置的曲线图,供日后参考适用。
酸碱度计算公式小结

酸碱度计算公式小结酸碱度(pH)是一种用来衡量物质酸性或碱性的指标。
在化学、生物学、环境科学等领域中,pH是一个关键的参数,对于了解和控制溶液的性质和反应非常重要。
pH的计算基于溶液中氢离子(H+)的浓度,通过使用pH计或手动计算公式来确定。
pH计算公式是通过测量溶液中氢离子的浓度来计算的。
氢离子浓度通常以摩尔每升(mol/L)表示。
pH计算公式有两个主要类型:负对数公式和指数公式。
1.负对数公式:pH=-log[H+]其中[H+]表示溶液中氢离子的浓度。
负对数公式是最常见和最简单的pH计算方法。
它是基于10为底的对数计算,将氢离子浓度转换为负对数。
2.指数公式:pH=14-log[H+]指数公式也是一种常见的pH计算方法。
它是基于14为底的对数计算。
在这种公式中,将氢离子浓度转换为负对数,并添加14来获得最终的pH 值。
这两种公式分别适用于不同的场景和需求。
在大多数情况下,负对数公式是最常用的公式,因为它简单易懂,并且适用于大多数酸碱溶液。
指数公式则更适用于特殊情况,如强酸或强碱溶液。
除了这些基本的pH计算公式外,还有一些其他的因素需要考虑:1.温度校正:因为温度对溶液中氢离子的浓度有影响,所以在进行pH计算时需要进行温度校正。
不同的温度校正方法有所不同,但基本原理是通过根据溶液中氢离子的酸解离常数和温度之间的关系来进行校正。
2.酸碱指示剂:在一些情况下,可以使用酸碱指示剂来帮助确定溶液的pH值。
酸碱指示剂是一种可以根据溶液的pH值而改变颜色的化学物质。
根据酸碱指示剂的颜色变化可以估计溶液的pH值。
3.pH计:pH计是一种自动测量溶液pH值的仪器。
它通过测量溶液中的电势差来确定pH值,并将结果直接显示在屏幕上。
pH计可以极大地简化pH的测量过程,并提高准确性和精度。
总结起来,酸碱度的计算公式是基于溶液中氢离子浓度的。
负对数公式和指数公式是最常见的pH计算方法。
在进行pH计算时,还需要考虑温度校正、酸碱指示剂和使用pH计等因素。
