关于含氧酸命名规则及酸性强弱的问题
【常见酸的酸性强弱的比较】

【常见酸的酸性强弱的比较】
①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金
属性Cl>S>P>C>Si 则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3
②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
如酸性HClO4>HClO3>HClO2>HClO, H2SO4>H2SO3, HNO3>HNO2, H3PO4>H3PO3>H3PO2
①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强,如酸性:
HI>HBr>HCl>HF(弱酸)
②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S
由反应方向判据:
CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,
则酸性:H2CO3>H3BO3>HCO3-
R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径
越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:
NaOH、Mg(OH)2、Al(OH)3 、H-2SiO3、H3PO4、H2SO4、HClO4、自左至
右,碱性减弱,酸性增强。
羧酸酸性强弱跟烃基和羧基的相互影响有一定的关系,这种相互影响常用诱导效应来加以解释。
且有Cl3CCOOH>CHCl2COOH>CH2ClCOOH>CH3COOH。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较-CAL-FENGHAI.-(YICAI)-Company One1常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论。
则Ka越大,越易电离,酸性越强。
如果是质子理论。
则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来。
①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸。
在书写方程式的时候要注意不要忽略了酸的强氧化性。
酸性HClO4>HClO3>HClO2>HClO(氧化性HClO>HClO2>HClO3>HClO4)H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl>H2S。
在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性。
①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强。
如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
无机含氧酸的结构与命名规律
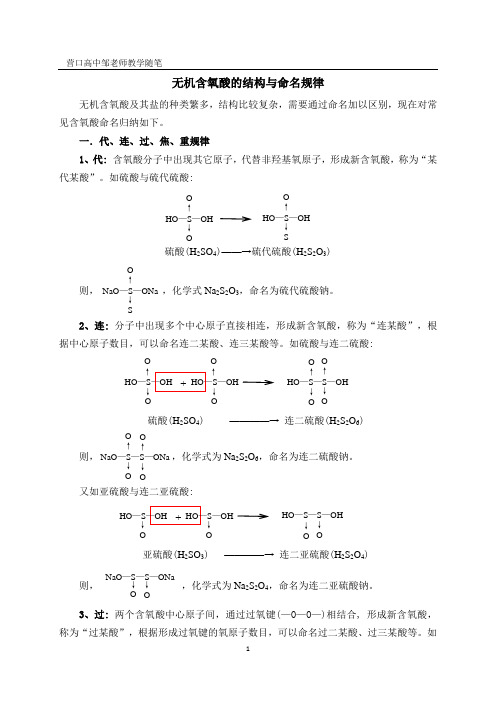
无机含氧酸的结构与命名规律无机含氧酸及其盐的种类繁多,结构比较复杂,需要通过命名加以区别,现在对常见含氧酸命名归纳如下。
一.代、连、过、焦、重规律1、代: 含氧酸分子中出现其它原子,代替非羟基氧原子,形成新含氧酸,称为“某代某酸”。
如硫酸与硫代硫酸:则,,化学式Na 2S 2O 3,命名为硫代硫酸钠。
2、连: 分子中出现多个中心原子直接相连,形成新含氧酸,称为“连某酸”,根据中心原子数目,可以命名连二某酸、连三某酸等。
如硫酸与连二硫酸:则,,化学式为Na 2S 2O 6,命名为连二硫酸钠。
又如亚硫酸与连二亚硫酸:则,,化学式为Na 2S 2O 4,命名为连二亚硫酸钠。
3、过: 两个含氧酸中心原子间,通过过氧键(—O —O —)相结合, 形成新含氧酸,称为“过某酸”,根据形成过氧键的氧原子数目,可以命名过二某酸、过三某酸等。
如NaO —S —S —ONa↓O ↓O亚硫酸(H 2SO 3) ————→ 连二亚硫酸(H 2S 2O 4)+ HO —S —OH ↓ O HO —S —OH↓ OHO —S —S —OH↓O ↓ONaO —S —S —ONa O ↑ ↓O O ↑↓O+ 硫酸(H 2SO 4) ————→ 连二硫酸(H 2S 2O 6)HO —S —OH O ↑ ↓ O HO —S —OHO ↑↓ OHO —S —S —OHO ↑ ↓O O↑↓ONaO —S —ONa O ↑↓SHO —S —OHO ↑↓OHO —S —OHO ↑↓S硫酸(H 2SO 4)——→硫代硫酸(H 2S 2O 3)硫酸与过二硫酸:则,,化学式为Na 2S 2O 8,命名为过二硫酸钠。
4、焦、重:含氧酸通过分子间脱水相结合, 形成新含氧酸,称为“焦某酸”,或“重某酸”,根据结合前含氧酸分子数,可以命名焦二某酸(简称焦某酸),焦三某酸。
如硫酸与焦硫酸:则,,化学式为Na 2S 2O 7,命名为焦硫酸钠,或重硫酸钠;,化学式为Na 2Cr 2O 7,命名为重铬酸钠,或焦铬酸钠。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]常见酸的酸性强弱的比较含氧酸的酸性强弱的判据:①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si 则酸性:HClO 4>H 2SO 4>H 3PO 4>H 2CO 3>H 2SiO 3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
如酸性HClO 4>HClO 3>HClO 2>HClO ,H 2SO 4>H 2SO 3,HNO 3>HNO 2,H 3PO 4>H 3PO 3>H 3PO 2 无氧酸(气态氢化物的水溶液)酸性强弱的判据:①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强,如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H 2S 由反应方向判据:酸A+盐B→盐A’+酸B’ 则酸性 A>B’如:CO 2+2H 2O+NaBO 2=H 3BO 3+NaHCO 3,H 3BO 3+Na 2CO 3=NaBO 2+NaHCO 3+H 2O , 则酸性:H 2CO 3>H 3BO 3>HCO 3- 由R-O-H 模型来判据:R 元素的价态越来越高,半径越小,则R-OH 的酸性越强,R 元素的价态越低,半径越大,则R-O-H 的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH 、Mg(OH)2、Al(OH)3、H 2SiO 3、H 3PO4、H 2SO 4、HClO 4。
自左至右,碱性减弱,酸性增强。
由电子效应来比较:羧酸酸性强弱跟烃基和羧基的相互影响有一定的关系,这种相互影响常用诱导效应来加以解释。
且有Cl 3CCOOH>CHCl 2COOH>CH 2ClCOOH>CH 3COOH碱的碱性强弱的比较总原则:根据碱的电离常数的大小:碱的电离常数越大,该碱的碱性越强。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较含氧酸的酸性强弱的判据:①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
如酸性HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强,如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
自左至右,碱性减弱,酸性增强。
由电子效应来比较:羧酸酸性强弱跟烃基和羧基的相互影响有一定的关系,这种相互影响常用诱导效应来加以解释。
且有Cl3CCOOH>CHCl2COOH>CH2ClCOOH>CH3COOH碱的碱性强弱的比较总原则:根据碱的电离常数的大小:碱的电离常数越大,该碱的碱性越强。
推论:金属阳离子的水解常数越大,由该金属原子在该价态组成的氢氧化物的碱性越弱。
1、金属元素的电负性越小,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越强。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论。
则Ka越大,越易电离,酸性越强。
如果是质子理论。
则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来。
①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸。
在书写方程式的时候要注意不要忽略了酸的强氧化性。
酸性HClO4>HClO3>HClO2>HClO(氧化性HClO>HClO2>HClO3>HClO4)H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl>H2S。
在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性。
①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强。
如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
关于含氧酸命名规则及酸性强弱的问题

关于含氧酸命名规则及酸性强弱的问题
王笃年
【期刊名称】《高中数理化》
【年(卷),期】2013(000)013
【摘要】含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚某酸、次某酸、偏某酸等,这些名称究竟是怎样规定的?不同元素的含氧酸,同种元素不同价态的含氧酸,其酸性强弱有何规律?为什么会有这样的规律?含氧酸的酸性强弱究竟取决于什么因素呢?
【总页数】2页(P92,115)
【作者】王笃年
【作者单位】北京十一学校
【正文语种】中文
【相关文献】
1.影响含氧酸酸性强弱的因素
2.无机含氧酸氧化性强弱的标度
3.无机含氧酸氧化性强弱的确定
4.无机含氧酸氧化性强弱递变规律的探讨
5.衡量P区无机含氧酸氧化性强弱的经验公式
因版权原因,仅展示原文概要,查看原文内容请购买。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论。
则Ka越大,越易电离,酸性越强。
如果是质子理论。
则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来。
b5E2RGbCAP①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3p1EanqFDPw②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸。
在书写方程式的时候要注意不要忽略了酸的强氧化性。
DXDiTa9E3d酸性HClO4>HClO3>HClO2>HClO<氧化性HClO>HClO2>HClO3>HClO4)RTCrpUDGiTH2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸<气态氢化物的水溶液)酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl >H2S。
5PCzVD7HxA在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性。
jLBHrnAILg①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强。
如酸性:HI>HBr>HCl>HF(弱酸>②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’ 则酸性A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,xHAQX74J0X则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH>2、Al(OH>3、H2SiO3、H3PO4、H2SO4、HClO4。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论。
则Ka越大,越易电离,酸性越强。
如果是质子理论。
则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来。
①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸。
在书写方程式的时候要注意不要忽略了酸的强氧化性。
酸性HClO4>HClO3>HClO2>HClO(氧化性HClO>HClO2>HClO3>HClO4)H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl > H2S。
在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性。
①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强。
如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性 A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论;则Ka越大,越易电离,酸性越强;如果是质子理论;则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来;①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强;如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强;有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸;在书写方程式的时候要注意不要忽略了酸的强氧化性;酸性HClO4>HClO3>HClO2>HClO氧化性HClO>HClO2>HClO3>HClO4H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸气态氢化物的水溶液酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl > H2S;在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性;①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强;如酸性:HI>HBr>HCl>HF弱酸②非同一主族元素的无氧酸酸性,需靠记忆;如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性 A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、MgOH2、AlOH3、H2SiO3、H3PO4、H2SO4、HClO4;自左至右,碱性减弱,酸性增强;由电子效应来比较:羧酸酸性强弱跟烃基和羧基的相互影响有一定的关系,这种相互影响常用诱导效应诱导效应是指在有机分子中引入一原子或基团后,使分子中成键电子云密度分布发生变化,从而使化学键发生极化的现象,称为诱导效应;来加以解释;且有Cl3CCOOH>CHCl2COOH>CH2ClCOOH>CH3COOH有机酸的酸性:一般来说,分子量越大的酸酸性越弱;因为在有机酸中,酸显酸性是因为有羧基的存在;如果酸的原子量很大,与羧几相连的碳与羧基中的氧的碳氧键就越弱,相应的氧氢键就越强,所以氢就越不容易游离出来;碱的碱性强弱的比较总原则:根据碱的电离常数的大小:碱的电离常数越大,该碱的碱性越强;推论:金属阳离子的水解常数越大,由该金属原子在该价态组成的氢氧化物的碱性越弱; 1、金属元素的电负性越小,该金属的最高价氧化物对应的水化物即氢氧化物的碱性越强;A一般金属活动性越大即金属活动性顺序表中排位越靠前,该金属的最高价氧化物对应的水化物即氢氧化物的碱性越强;B元素周期表中,同周期的金属{主族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物即氢氧化物的碱性越弱;同周期的金属{副族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物即氢氧化物的碱性越弱;同周期的金属主族与副族元素之间不能应用此规律;C元素周期表中,同族的金属{主族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物即氢氧化物的碱性越强;一般同族的金属{副族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物即氢氧化物的碱性越弱;2、同种金属元素不同价态的氧化物对应的水化物即氢氧化物的碱性的判断方法可根据盐类水解的规律:盐中有弱酸或碱根就水解,越弱越水解,水解产物越稳定,判断而得:同种金属元素低价态的氧化物对应的水化物即氢氧化物的碱性比其高价态的氧化物对应的水化物即氢氧化物的碱性;其实氧化物对应水化物的酸碱性可用离子键理论解释R离子和氢离子中,谁对氧离子的吸引力若,就在谁处电离;在A处电离,该氢氧化物显碱性,在B处电离,该氢氧化物显酸性;随着同主族的R的原子序数的增大,R的半径也递增,对氧离子的引力自然减弱,越显碱性如:碱性:LiOH<NaOH<KOH<RbOH<CsOH;同样,随着同周期的R的原子序数的增大,R的半径减小,对氧离子的引力增强,越显酸性如:碱性:NaOH>MgOH2>AlOH3常见的弱碱有:FeOH2 、FeOH3 、CuOH2 、AgOH 、ZnOH2、AlOH3、MgOH2、NH3·H2O碱可以分为可溶性和不可溶性,常见的可溶的强碱有NaOH、KOH、BaOH2 、CaOH2常见的不可溶的弱碱有括号里写上颜色CuOH2蓝色FeOH2白色FeOH3红褐色MgOH2白色AlOH3白色。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较
首先要看你是哪种酸碱理论
如果是电离理论.则Ka越大,越易电离,酸性越强。
如果是质子理论。
则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:
在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来.
①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P〉C〉Si则酸性:HClO4〉H2SO4〉H3PO4〉H2CO3〉H2SiO3
②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸。
在书写方程式的时候要注意不要忽略了酸的强氧化性.
酸性HClO4〉HClO3>HClO2>HClO(氧化性HClO〉HClO2〉HClO3〉HClO4) H2SO4〉H2SO3,HNO3>HNO2,H3PO4〉H3PO3>H3PO2
无氧酸(气态氢化物的水溶液)酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl > H2S。
在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性.
①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强. 如酸性:HI〉HBr>HCl〉HF(弱酸)
②非同一主族元素的无氧酸酸性,需靠记忆.如酸性:HCl>HF〉H2S
由反应方向判据:。
常见酸的酸性强弱的比较(1)(1)

常见酸的酸性强弱的比较含氧酸的酸性强弱的判据:①不同元素的最高价含氧酸,成酸元素的非金属性越强,贝IJ酸性越强。
如非金属性Cl>S>P>C>Si 则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
如酸性HClO4>HClO3>HClO2>HClO ,H2SO4>H2SO3 ,HNO3>HNO2 ,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强,如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B f盐A ' +酸B'则酸性A>B '如:CO2+2H2O+NaBO2=H3BO3+NaHCO3 ,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O ,贝酸性:H2CO3>H3BO3>HCO3-由R-O-H 模型来判据:R 元素的价态越来越高,半径越小,贝R-OH 的酸性越强,R 元素的价态越低,半径越大,贝R-O-H 的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH 、Mg(OH)2 、Al(OH)3 、H2SiO3 、H3PO4 、H2SO4、HClO4 。
自左至右,碱性减弱,酸性增强。
由电子效应来比较: 羧酸酸性强弱跟烃基和羧基的相互影响有一定的关系,这种相互影响常用诱导效应来加以解释。
且有Cl3CCOOH>CHCl2COOH>CH2ClCOOH>CH3COOH碱的碱性强弱的比较总原贝:根据碱的电离常数的大小:碱的电离常数越大,该碱的碱性越强。
推论:金属阳离子的水解常数越大,由该金属原子在该价态组成的氢氧化物的碱性越弱。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论。
则Ka越大,越易电离,酸性越强。
如果是质子理论。
则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来。
①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸。
在书写方程式的时候要注意不要忽略了酸的强氧化性。
酸性HClO4>HClO3>HClO2>HClO(氧化性HClO>HClO2>HClO3>HClO4)H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl>H2S。
在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性。
①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强。
如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
酸性强弱与分子结构的关系

酸性强弱与分子结构的关系一、含氧酸的酸性与分子结构的关系含氧酸的分子中,原子的排列顺序是H —O —R ,(有的含氧酸有配位键H —O —R →O )。
含氧酸的酸性强弱主要取决于结构中的两个因素:1.比较中心原子跟氧的化学键的极性和氢氧键的极性,如果R —O 键的极性越小,对于氢氧键来说极性就越大,就越容易发生H —O 键的断裂,酸性就越强。
我们知道,同周期元素中,随R 的电荷数的增大,半径变得越小,R —O 键的极性就越小,R —O 间的引力加大,含氧酸的酸性就越强。
因此,Si 、P 、S 、Cl 的电荷数从4到7,而原子半径减小,所以H 4SiO 4、H 3PO 4、H 2SO 4、HClO 4的酸性依次增强。
2.含氧酸分子中未被氢化的氧原子数越多,含氧酸的酸性就越强。
因为,未被氢化的氧原子数越多,因氧的电负性大,中心原子电向未被氢化的氧原子转移,中心原子从O —H 键中吸引的电子也就越多,更易离解出H +。
所以,酸性HClO 4> HClO 3> HClO ,因为HClO 4分子中有三个未被氢化的氧原子,而次氯酸分子中没有未被氢化的氧原子。
二、无氧酸的酸性强度无氧酸的酸性强度是指氢化物水溶液的酸性强度。
同主族元素的氢化物水溶液的酸性自上而下增强。
如酸性HF<HCl<HBr<HI ,H 2O<H 2S<H 2Se<H 2Te 。
同主族自左至右酸性增强,如H 2O<HF ,H 2S<HCl 。
那么又该如何理解?从热力学循环计算可知无氧酸的酸性强度。
无氧酸HX 的离解过程分解为:HX 电离过程的总能量可表示为:ϑϑϑϑ321ΔH Y ΔH I D ΔH H +++++=∆从以上分解可知,HX 的电离程度主要与以下因素有关:①离解能D ;②电子亲合能Y ;③阴离子水合能ϑ3ΔH 。
在HF 、HCl 、HBr 、HI 分子中,HF 分子的化学键极性最强,因此,离解能D 特别大,说明吸热多,虽然F 原子的电子亲合能Y 和F 离子水合能ϑ3ΔH 也稍大,但总的热效应仍以离解能D 为主,因此,HF 更难电离,酸性也在同类中最弱。
无机含氧酸的判断

无机含氧酸酸性的判断【方法和规律】1、含氧酸的结构:无机含氧酸分子之所以显示酸性,是因为其分子中含有—OH,而—OH 上的O—H 键在水分子的作用下发生断裂而能够解离出H+而显示一定的酸性。
在含氧酸中,氢离子是和酸根上的一个氧相连接的2、比较无机含氧酸的酸性强弱规律(1)对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强如:HClO<HClO2<HClO3<HClO4;HNO2<HNO3;H2SO3<H2SO4解释:无机含氧酸的通式可写成(HO)m RO n,如果成酸元素R 相同,R 的正电性越高,导致R—O—H 中O 的电子向R 偏移的程度越大,在水分子的作用下越容易电离出H+,酸性越强(2)含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即:(HO)m RO n中,n值越大,酸性越强含氧酸酸性强弱与非羟基氧原子数的关系(3)①同一主族,自上而下,非金属元素最高价含氧酸酸性逐渐减弱②同一周期,从左向右,非金属元素最高价含氧酸酸性逐渐增强1、N 元素可以形成两种含氧酸HNO2和HNO3,酸性是HNO3________HNO2(填“强于”或“弱于”),原因是_______________________________________________________________________________________________ ____________________________________________________________________________________________ 2、H3AsO4和H3AsO3是砷的两种含氧酸,请根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因____________________________________________________________________________________________ ____________________________________________________________________________________________ 3、S 有两种常见的含氧酸,较高价的酸性比较低价的酸性________,理由是________________________________________________________________________________________________________________________________ 4、锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是___________________________________________________________________________________________________________________5、H2SeO3的K1和K2分别为2.7×10-3和 2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:①H2SeO3和H2SeO4溶液中第一步电离程度均大于第二步电离的原因_____________________________________________________________________________________________________________②H2SeO4比H2SeO3酸性强的原因____________________________________________________________________________________________________________________________________________6、NaBrO、NaBrO2、NaBrO3、NaBrO4四种钠盐中,Br 的杂化方式均为______杂化,阴离子空间构型为三角锥形的是______ (填化学式)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
很 多 时候 , 由于 元 素 原 子 半 径 小 , R 原 子 周 围 容
酸” , 如 次氯 酸 HC l O, 次磷酸 H。 P O 等 . 有 些元 素 的正 酸 分 子 中含 有 3个 或 3个 以上 的
含 氧酸 是 酸 中 的主 角 , 常见 的含 氧 酸 中 , 有 高 某 酸、 正某 酸 、 亚某 酸 、 次某酸、 偏某酸等 , 这 些 名称 究 竟 是 怎样规 定 的 ?不 同元素 的 含氧 酸 , 同种元 素不 同价
“ O — H” 键 的极 性 , 这 时 主要 是“ R 一 H” 中“ R — o”
有时 , 2个 正 酸分 子 间 可 以脱 去 1个水 分 子 连 接 起来 , 这就形 成 了“ 焦某 酸 ” . 如:
2 H2 S O 一 H2 O= = = H2 S 2 O7 ( 焦 硫酸 ) ;
通常 , 把 某 种元 素最 为常 见 的稳 定 含 氧 酸称 为 该
关孑含萤酸
命名规则及酸性强弱
一
◇
元 素 的“ 正酸” , 命名 时往往省略“ 正” 字, 直接 叫“ 某
酸” . 如 果该 元 素 还 有 比正 酸 中 元 素 化 合价 高 的 含 氧 酸, 一 般称 为“ 高 某酸 ” . 如 高氯酸 HC 1 O . 元 素化 合价 比正 酸 中低 2价 的 含 氧酸 称 为 该 元 素 的“ 亚某 酸” , 如硫 酸 H S O 与亚 硫酸 H。 S O。 、 磷 酸
相 同的. 如, P : O 是 H。 P O 和 HP O。的酸酐 .
元素 氧 化物 的水 化 物 在 水 溶 液 中究 竟 呈 酸 性 还 是碱 性 , 要 看 其 电 离 的方 式 . 如果 R元 素 的 金 属 性 较
强, 则“ R 一( ) H”中 , “ R — O” 键 的 极 性 大 大 超 过
键 断裂 , 即发 生 碱 式 电离 , 电离 出的离 子是 “ R¨’ 和
2 H。 P O 一H O—H P O ( 焦 磷酸 )
“ OH一’ , 该 物质 就呈 碱 性. 实 际 上 大 多数 碱 固态 时 都 是 以离子 化合 物 形 式 ( R 、 OH ) 存 在 的. 反之, 如 果
以磷元 素 的各种含 氧 酸为例 , 其 关系 如下 :
H P O ( 原磷酸)
( N磷原 子半径小 l 脱去 1 个 H a O分子)
H4 P20 7
2分子 脱 去 1 个 脱去 1 个 He O分子 H3 PO 4 H2 O 分子 HP O3
( 焦磷酸)
H。 P O 与 亚 磷 酸 H。 P O。 、 氯 酸 HC l o。与 亚 氯 酸
北京
I l g l b l B
王笃 年
HC 1 0 。 、 硝 酸 HNO。 与 亚硝 酸 HNO 等 ; 元 素 化合 价 比亚某 酸 中再低 2价 的含 氧 酸则 称 为该 元 素 的 “ 次 某
“
一
理论 上讲 , 每种 元 素都 有 其 “ 原酸 ( 碱) ” 形式 , 如 果用“ R ” 表示该 元 素 , 若 正 化 合 价为 + 的话 , 则 其 原
酸 的化学 式 为 “ R( OH) ” , 也可 以写成 H RO 的 形 式. 如原 硅酸 H S i O .价l 降 低2 价
H。 P O。 ( 亚磷酸)
中心 原子 化合价f 再降 低2 价
H P O 2 ( 次磷酸)
当然 , 含 氧 酸 还 有很 多 其 他 的形 式 , 如硫 代 硫 酸 H s O。 ( 可看作 硫 酸 分 子 中 1个 氧 原 子 被 1个 硫 原 子 替代 的产 物) , 过 二硫 酸 ( H S 。 O。 , 分 子 中含 有 1个
O— O 一” 过 氧根 原子 团 ) 等.
3 含 氧酸酸 性 强弱 的 比较
前 已述及 , 含 氧 酸 之所 以 呈 酸 性 , 是 因 为 其 分 子 在 水 中电离 时 , 断裂 了“ O— H” 键, 产生 出 H . 显然, 含 氧酸 酸性 的强 弱 与 “ O— H” 键 是 否 容 易 电离 有 关 . 既 然任何 含 氧酸 中都 含 有 “ o — H” 键, 那 为 什 么 其 电
R元素 非金 属性 较强 , 则“ R 一 0一 H” 中, “ R — o” 键 的 极性 远远 小 于“ O— H” 键 的极 性 , 主要是“ R — O— H” 中的“ o— H” 键 断裂 , 即发生 酸式 电离 , 电离 出 的离 子 是“ R ( ) 。’ 和“ H”’ , 该物 质 呈 酸性 . 如果 , “ R — O— H” 中, “ R O” 键与“ O — H” 键 的极 性 相 当 , 这 时 就 可 能 既 可能 发生 酸 式 电 离 , 又 可 能 发 生 碱 式 电离 , 该 物 质 就具 有 两性 . 2 含 氧酸名 称 的确定
式. 如 偏 磷 酸 HP O 。 ( H。 P O 一 H O) . 过去 , 人 们 称 H S i O 为 硅酸 的 时 候 , 就把 H S i O。叫作 “ 偏硅酸” ,
这种 叫法在 一些 参考 书上 还能看 到 . 可 以看 出 , 同种元素原酸、 偏 酸 与 正 酸 的 酸 酐 是
态 的含 氧酸 , 其 酸性强 弱 有 何规 律 ? 为什 么 会有 这 样 的规 律 ?含 氧酸 的酸 性强 弱究 竟取 决于 什么 因素 呢 ? 1 对含 氧酸 酸性 本质 的分析
0H 原 子 团 , 这样 的含 氧 酸 在一 定 条 件 下 可 以进 一 步 脱 去 1个 H O分子 , 这 就形 成 了该 元 素 的 “ 偏酸” 形
