能源材料第二讲-PPT文档资料
合集下载
新能源材料与技术-第2章 锂离子电池材料-1

嵌入和脱出来进行充放电;
离子电池的组成
14
01锂离子电池概述
八、锂离子电池的组成
锂离子电池的结构一般包括以下部件:正极、负极、电解质、隔膜、正极引线、负极引线、中心端子、 绝缘材料、安全阀、PTC (正温度控制端子)、电池壳。 以圆柱形锂离子电池为例,其结构如图2-2 (a)所示,扣式电池的结构与圆柱形电池的结构相似。方形 锂离子电池的结构如图2-2 (b)所示。聚合物锂离子电池的结构如图2-2 (c)所示。
以LiCoO2为例:
充电 放电
充电 放电
充电 放电
12
01锂离子电池概述
七、锂离子电池与锂原电池(锂电池)的主要区别
1. 锂电池是一次电池,不可充电;锂离子电池是二次电池,可充电; 2. 在负极材料的选择上,锂电池(锂原电池或者锂金属电池)使用锂金属或者锂合金为负极,
而锂离子电池主要选择的是石墨类材料。 3. 原理不同:锂电池是锂做负极发生的氧化还原反应;锂离子电池是通过锂离子在石墨负极上
能刺透在正负极之间起电子绝缘作用的隔膜,最终触到正极,造成电池内部短路,引起安全问题。 4. 1980年,M. Armand 提出了“摇椅式”二次锂电池的设想,即正负极材料采用可以储存和交换锂离子的
层状化合物,充放电过程中锂离子在正负极之间穿梭,从一边“摇”到另一边,往复循环,相当于锂的 浓差电池。 5. 在20世纪80年代初期,Goodenough 合成了 LiMO2 (M=Co、Ni、Mn) 化合物,这些材料均为层状化 合物,能够可逆地嵌入和脱出锂,后来逐渐发展成为二次电池的正极材料。这类材料的发现改变了二 次锂电池锂源为负极的传统思想。
锂离子电池的工作原理就是指其充放电原理。当对 电池进行充电时,电池的正极上有锂离子生成,生 成的锂离子经过电解液运动到负极。而作为负极的 碳呈层状结构,它有很多微孔,到达负极的锂离子 就嵌入到碳层的微孔中,嵌入的锂离子越多,充电 容量越高。放电时,锂离子从负极脱嵌进入正极。
离子电池的组成
14
01锂离子电池概述
八、锂离子电池的组成
锂离子电池的结构一般包括以下部件:正极、负极、电解质、隔膜、正极引线、负极引线、中心端子、 绝缘材料、安全阀、PTC (正温度控制端子)、电池壳。 以圆柱形锂离子电池为例,其结构如图2-2 (a)所示,扣式电池的结构与圆柱形电池的结构相似。方形 锂离子电池的结构如图2-2 (b)所示。聚合物锂离子电池的结构如图2-2 (c)所示。
以LiCoO2为例:
充电 放电
充电 放电
充电 放电
12
01锂离子电池概述
七、锂离子电池与锂原电池(锂电池)的主要区别
1. 锂电池是一次电池,不可充电;锂离子电池是二次电池,可充电; 2. 在负极材料的选择上,锂电池(锂原电池或者锂金属电池)使用锂金属或者锂合金为负极,
而锂离子电池主要选择的是石墨类材料。 3. 原理不同:锂电池是锂做负极发生的氧化还原反应;锂离子电池是通过锂离子在石墨负极上
能刺透在正负极之间起电子绝缘作用的隔膜,最终触到正极,造成电池内部短路,引起安全问题。 4. 1980年,M. Armand 提出了“摇椅式”二次锂电池的设想,即正负极材料采用可以储存和交换锂离子的
层状化合物,充放电过程中锂离子在正负极之间穿梭,从一边“摇”到另一边,往复循环,相当于锂的 浓差电池。 5. 在20世纪80年代初期,Goodenough 合成了 LiMO2 (M=Co、Ni、Mn) 化合物,这些材料均为层状化 合物,能够可逆地嵌入和脱出锂,后来逐渐发展成为二次电池的正极材料。这类材料的发现改变了二 次锂电池锂源为负极的传统思想。
锂离子电池的工作原理就是指其充放电原理。当对 电池进行充电时,电池的正极上有锂离子生成,生 成的锂离子经过电解液运动到负极。而作为负极的 碳呈层状结构,它有很多微孔,到达负极的锂离子 就嵌入到碳层的微孔中,嵌入的锂离子越多,充电 容量越高。放电时,锂离子从负极脱嵌进入正极。
功能材料之能源材料PPT

02
常见能源材料的特性与性能
电池材料的特性与性能
电池材料种类
包括锂离子电池、镍氢电池、铅酸电池等,每种材料具有不同的 特性与性能。
电池材料的电化学性能
包括能量密度、功率密度、循环寿命、充电速度等,直接影响电池 的储能和放电能力。
电池材料的安全性
电池材料应具有较高的安全性,无毒或低毒,不易燃烧或爆炸,以 确保使用过程中的安全。
燃料电池材料面临的挑战与前景
总结词:燃料电池是一种将化学能转化为电能的装置 ,其核心是燃料电池材料。目前,燃料电池材料面临 的主要挑战是提高电化学性能和降低成本。随着技术 的不断进步,燃料电池材料的前景非常广阔,未来将 会涌现出更多的新型燃料电池材料,为人类提供更加 高效、环保的能源解决方案。
详细描述:目前,质子交换膜燃料电池是最成熟的燃料 电池技术之一,其具有较高的能量密度和较低的成本。 但是,质子交换膜燃料电池的寿命较短,且需要使用贵 金属催化剂。因此,研究人员正在开发新型燃料电池材 料,如固体氧化物燃料电池、熔融碳酸盐燃料电池等。 这些新型燃料电池具有更高的电化学性能和更长的寿命 ,同时不需要使用贵金属催化剂。未来,随着技术的不 断进步和成本的降低,燃料电池有望在交通运输、电力 供应等领域得到广泛应用。
太阳能电池材料面临的挑战与前景
总结词
太阳能电池材料是一种重要的可再生能源材料,目前 面临的主要挑战是提高光电转换效率和降低成本。随 着技术的不断进步,太阳能电池材料的前景非常广阔 ,未来将会涌现出更多的新型太阳能电池材料,为人 类提供更加高效、环保的能源解决方案。
详细描述
目前,硅基太阳能电池是应用最广泛的太阳能电池,其 光电转换效率高、稳定性好,但是成本较高。因此,研 究人员正在开发新型太阳能电池材料,如钙钛矿太阳能 电池、染料敏化太阳能电池等,这些新型太阳能电池具 有更高的光电转换效率和更低的成本,有望成为未来的 主流太阳能电池。此外,随着技术的不断进步,太阳能 电池的集成度也将越来越高,未来将会出现更加高效、 环保的太阳能发电系统。
《能源材料第二讲》PPT课件

从能量转换的观点可将电化学过程分 为两大类:
1)利用化学反应,Gibbs函数降低 (ΔGm<0),产生电流,将化学能转 变为电能,这就是原电池;
2)用电流做功来推动化学反应,使 Gibbs函数升高(ΔGm>0),将电能 转换成化学能的过程。这就是电解池。
1.氧化反应和还原反应 化学反应一般都是氧化还原反应。以
1889年能斯特(Nernst)建立电极电位 的理论,提出表示电极电位与电极反 应各组分浓度间关系的能斯特公式
表达电极平衡电势E 与温度T和参与电极 反应物质活度ai关系 的公式。
能斯特 Nernst (1864-1941年)
19世纪70年代,Helmholtz首次提 出了双电层的概念
由Helmholtz最早提出的一种双电层结构。 他认为双电层的结构与平行板电容器相似, 双电层的里层在固体表面上,相反符号的外 层则与固体表面平行地分布在液体中,两层 之间的距离很小,约在离子大小的量级。在 此双电层中电势由里层向外层呈直线下降。 亥姆霍兹双电层模型对早期的电动现象研究 起过促进作用,但它不能代表双电层的实际 情形。
标准电极电位按次序排列,叫电化学 序。
装置原电池并计算电池的电动势
判断氧化剂、还原剂的相对强弱。电 极电位越正,表示该组分愈容易得到 电子,是较强的氧化剂;电极电位越 负,表示该组分愈容易失去电子,是 较强还原剂。
在实际测定中,由于标准氢电极的使 用条件十分严格,操作较困难,往往 使用某些具有稳定电极电势的参考电 极。
电解质溶液
电解质不一定能导电,而只有在溶于水或熔融状 态是电离出自由移动的离子后才能导电 。
能导电的不一定是电解质,判断某化合物是否是 电解质,不能只凭它在水溶液中导电与否,还需要 进一步考察其晶体结构和化学键的性质等因素。
《新能源材料》新型二次电池材料(课堂PPT)

➢镍氢电池要长期保存前,应该充电到80%左右保 存。新的镍氢电池有一些电,厂家已经预充电,防 止运输周转时间太长电池受到影响。长期保存的镍 氢电池用的时候,先将余电用完,再用正确方法充 放2-3次就可以恢复到最佳状态。
19
3种工作状态:正常工作状态、过充电状态和过放电状态。
表:镍氢电池的电极反应及对应的标准电位
工作状态
电极反应
镍 电 极 N iO O H + H 2O + e - N i(O H )2+ O H -
正常
氢 电 极 1 /2 H 2 + O H - H 2O + e-
总 反 应 1 /2 H 2 + N iO O H N i(O H )2
过充电
过放电 (反 极 )
镍 电 极 2 O H - 2 e- + 1 /2 O 2 + H 2O
第1篇 新型二次电池材料
第1章 新型二次电池概述 第2章 金属氢化物镍电池材料 第3章 锂离子电池材料
1
第1章 新型二次电池概述
电池是一种利用电化学的氧化-还原反应,进行化学能-----电能之间转换的储能装置。
2
电池的应用
3
一次电池只能放电一次。 二次电池可反复充放电循环使用,可充电电池。
一次电池
锌锰干电池 银锌纽扣电池
电池
锂原电池 铅酸电池
二次电池镍氢电池来自锂离子电池41800年伏打首先制成了伏打电池。 1836年英国化学家发明了古典原电池。 1865年法国化学家发明了第—个干电池。 现代的干电池不过是其改进。
5
1.1 锌锰干电池 锌锰干电池结构图
6
1.2 铅蓄电池
电池组成: 由金属铅板(负极)和紧附着二氧化铅的铅板(正 极)浸入30%(密度为1.2—1.3 g/cm3)的硫酸水溶液所组成。 铅蓄电池充电后电压可达2.2伏;放电后电压下降,当电压 降至l.25伏时(这时溶液密度为1.05 g/cm3 ) 不能再使用,必须 充电。铅蓄电池用于汽车、小型电动机车作为启动电源, 用于实验室作为常用电源,还广泛用于飞机、拖拉机、坦 克的照明光源。
19
3种工作状态:正常工作状态、过充电状态和过放电状态。
表:镍氢电池的电极反应及对应的标准电位
工作状态
电极反应
镍 电 极 N iO O H + H 2O + e - N i(O H )2+ O H -
正常
氢 电 极 1 /2 H 2 + O H - H 2O + e-
总 反 应 1 /2 H 2 + N iO O H N i(O H )2
过充电
过放电 (反 极 )
镍 电 极 2 O H - 2 e- + 1 /2 O 2 + H 2O
第1篇 新型二次电池材料
第1章 新型二次电池概述 第2章 金属氢化物镍电池材料 第3章 锂离子电池材料
1
第1章 新型二次电池概述
电池是一种利用电化学的氧化-还原反应,进行化学能-----电能之间转换的储能装置。
2
电池的应用
3
一次电池只能放电一次。 二次电池可反复充放电循环使用,可充电电池。
一次电池
锌锰干电池 银锌纽扣电池
电池
锂原电池 铅酸电池
二次电池镍氢电池来自锂离子电池41800年伏打首先制成了伏打电池。 1836年英国化学家发明了古典原电池。 1865年法国化学家发明了第—个干电池。 现代的干电池不过是其改进。
5
1.1 锌锰干电池 锌锰干电池结构图
6
1.2 铅蓄电池
电池组成: 由金属铅板(负极)和紧附着二氧化铅的铅板(正 极)浸入30%(密度为1.2—1.3 g/cm3)的硫酸水溶液所组成。 铅蓄电池充电后电压可达2.2伏;放电后电压下降,当电压 降至l.25伏时(这时溶液密度为1.05 g/cm3 ) 不能再使用,必须 充电。铅蓄电池用于汽车、小型电动机车作为启动电源, 用于实验室作为常用电源,还广泛用于飞机、拖拉机、坦 克的照明光源。
第二章-新能源材料--生物质能材料

方式使其发电和供热,也可用于发酵生产副产品— 甲烷气。
垃圾分类回收有利于利用城市固废作为生物质能材料。
需要指出,燃烧固体废料会可能导致大气污染, 所产生的污染物应特别予以注意。可能会产生二恶 英、含氮、硫氧化物以及重金属等,必须加以控制。
废液(污水)人类日常生活中产生的污水具有 可观的能源潜力。污水经过厌氧发酵可产生甲烷气。 在污水厌氧处理方面已有多年的实践经验。
生物质是指直接或间接利用大气、水、土地等通过光 合作用而产生的各种有机体。
广义而言生物质包括所有的植物、微生物以及以植物、 微生物为食物的动物及其生产的废弃物。狭义上主要是指 农林业生产过程中除粮食、果实以外的秸秆、树木、加工废 料、农林废弃物及动物的废弃物等物质(无生命、废弃物)。
特点:可再生性、天然性、广泛性。
生物质能化学转换技术:气化
同时,有一部分碳,由于氧气(空气)的供应 量不足,便生成一氧化碳,放出一部分热量。
2C + O2 2CO 在此层中主要是产生二氧化碳,一氧化碳的生 成量不多,水分也很少分解。 2)还原层 此时没有氧气存在,二氧化碳和水 蒸汽被还原成一氧化碳和氢气,进行吸热反应,
生物质能化学转换技术:气化
生物质能化学转换技术:气化
煤气发生炉由于原料不同而气化产物有差异外, 气化时吹入的气体不同,所得到的可燃性气体成分 也不同。
与煤原料气化相比较,生物质作为气化原料有 如下优点:生物质挥发成分高,70 - 80%为挥发 物。在较低的温度(约400℃)时大部分挥发物被 释放,煤在800℃左右时才释放30%的挥发物;
2.2 生物质能材料种类
生物质材料非常广泛 用于生产能量的生物质材料包括范围非常广泛,
来自农场和天然林地的薪柴,为获取能量而种植的 农林作物、农业、工业的废弃物、城市固体废物、 水生植物、微藻等都可以利用作为生物质能材料。
垃圾分类回收有利于利用城市固废作为生物质能材料。
需要指出,燃烧固体废料会可能导致大气污染, 所产生的污染物应特别予以注意。可能会产生二恶 英、含氮、硫氧化物以及重金属等,必须加以控制。
废液(污水)人类日常生活中产生的污水具有 可观的能源潜力。污水经过厌氧发酵可产生甲烷气。 在污水厌氧处理方面已有多年的实践经验。
生物质是指直接或间接利用大气、水、土地等通过光 合作用而产生的各种有机体。
广义而言生物质包括所有的植物、微生物以及以植物、 微生物为食物的动物及其生产的废弃物。狭义上主要是指 农林业生产过程中除粮食、果实以外的秸秆、树木、加工废 料、农林废弃物及动物的废弃物等物质(无生命、废弃物)。
特点:可再生性、天然性、广泛性。
生物质能化学转换技术:气化
同时,有一部分碳,由于氧气(空气)的供应 量不足,便生成一氧化碳,放出一部分热量。
2C + O2 2CO 在此层中主要是产生二氧化碳,一氧化碳的生 成量不多,水分也很少分解。 2)还原层 此时没有氧气存在,二氧化碳和水 蒸汽被还原成一氧化碳和氢气,进行吸热反应,
生物质能化学转换技术:气化
生物质能化学转换技术:气化
煤气发生炉由于原料不同而气化产物有差异外, 气化时吹入的气体不同,所得到的可燃性气体成分 也不同。
与煤原料气化相比较,生物质作为气化原料有 如下优点:生物质挥发成分高,70 - 80%为挥发 物。在较低的温度(约400℃)时大部分挥发物被 释放,煤在800℃左右时才释放30%的挥发物;
2.2 生物质能材料种类
生物质材料非常广泛 用于生产能量的生物质材料包括范围非常广泛,
来自农场和天然林地的薪柴,为获取能量而种植的 农林作物、农业、工业的废弃物、城市固体废物、 水生植物、微藻等都可以利用作为生物质能材料。
能源概述--常规能源介绍PPT(48张)

• 煤是黑色黄金。
(2)煤的成因
煤是怎样形成的?
在地质历史上,沼泽森林覆盖了大片 土地,包括菌类、蕨类、 灌木、乔木等 植物。但在不同时代海平面常有变化....
当水面升高时,植物因被淹而死 亡。 如果这些死亡的植物被沉积物覆盖而不透 氧气,植物就不会完全分解,而是在地下 形成有机地层。随着海平面的升降,会产 生多层有机地层。
•特点:挥发分低、比重大、 硬度高、燃烧时烟少、火苗短、 火力强。
• 无烟煤通常作民用和动力燃 料;质量好的无烟煤可作气化 原料、高炉喷吹和烧结铁矿石 的燃料以及作铸造燃料等;用 优质无烟煤还可以制造碳化硅、 碳粒砂、人造刚玉、人造石墨、 电极、电石和炭素材料。
中国无烟煤需求行业
•烟煤:燃烧时火焰较长而有烟的煤,煤化程度较大
LHV( MJ/kg ) 26~33 20~33 10~17
煤种 无烟煤
贫煤 低挥发分烟煤 高挥发分烟煤
褐煤
干燥无灰基挥发分含量(%) ≤9 9~19
19~30 30~40 40~50
LHV( MJ/kg ) > 20.9 > 18.4 >16.3 >15.5 > 11.7
拓展---各煤种的用途
• 无烟煤:是煤化程度最高的 煤,含碳量90%以上。
的煤。外观呈灰黑色至黑色,粉末从棕色到黑色。由 有光泽的和无光泽的部分互相集合合成层状,沥青、 油脂、玻璃、金属、金刚等光泽均有,具明显的条带 状、凸镜状构造。该种煤含碳量为75%~90%,不含 游离的腐殖酸。大多数具有粘结性;发热量较高。燃 烧时火焰长而多烟。多数能结焦。
• 根据挥发分含量、胶质层厚度或工艺性质,可分为 长焰煤、气煤、肥煤、焦煤、贫煤、瘦煤等。
(1)煤的元素组成
• 煤是由有机物质和无机物质混合组成的。煤中有机物 质主要由碳(C,82%~93%)、氢(H, 3.6%~5%)、氧(O,1.3%~10%)、氮(N, 1%~2%)四种元素构成,还有一些元素则组成煤中 的无机物质,主要有硫(S)、磷(P)以及稀有元 素等 。
(2)煤的成因
煤是怎样形成的?
在地质历史上,沼泽森林覆盖了大片 土地,包括菌类、蕨类、 灌木、乔木等 植物。但在不同时代海平面常有变化....
当水面升高时,植物因被淹而死 亡。 如果这些死亡的植物被沉积物覆盖而不透 氧气,植物就不会完全分解,而是在地下 形成有机地层。随着海平面的升降,会产 生多层有机地层。
•特点:挥发分低、比重大、 硬度高、燃烧时烟少、火苗短、 火力强。
• 无烟煤通常作民用和动力燃 料;质量好的无烟煤可作气化 原料、高炉喷吹和烧结铁矿石 的燃料以及作铸造燃料等;用 优质无烟煤还可以制造碳化硅、 碳粒砂、人造刚玉、人造石墨、 电极、电石和炭素材料。
中国无烟煤需求行业
•烟煤:燃烧时火焰较长而有烟的煤,煤化程度较大
LHV( MJ/kg ) 26~33 20~33 10~17
煤种 无烟煤
贫煤 低挥发分烟煤 高挥发分烟煤
褐煤
干燥无灰基挥发分含量(%) ≤9 9~19
19~30 30~40 40~50
LHV( MJ/kg ) > 20.9 > 18.4 >16.3 >15.5 > 11.7
拓展---各煤种的用途
• 无烟煤:是煤化程度最高的 煤,含碳量90%以上。
的煤。外观呈灰黑色至黑色,粉末从棕色到黑色。由 有光泽的和无光泽的部分互相集合合成层状,沥青、 油脂、玻璃、金属、金刚等光泽均有,具明显的条带 状、凸镜状构造。该种煤含碳量为75%~90%,不含 游离的腐殖酸。大多数具有粘结性;发热量较高。燃 烧时火焰长而多烟。多数能结焦。
• 根据挥发分含量、胶质层厚度或工艺性质,可分为 长焰煤、气煤、肥煤、焦煤、贫煤、瘦煤等。
(1)煤的元素组成
• 煤是由有机物质和无机物质混合组成的。煤中有机物 质主要由碳(C,82%~93%)、氢(H, 3.6%~5%)、氧(O,1.3%~10%)、氮(N, 1%~2%)四种元素构成,还有一些元素则组成煤中 的无机物质,主要有硫(S)、磷(P)以及稀有元 素等 。
能源材料PPT课件
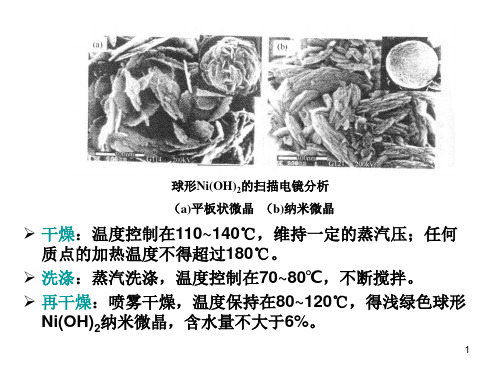
值,抑制电极在充电时氧的析出,使电极充电效 率提高,Ni(OH)2的利用率提高,降低电池内压。
Co2+的加入量一般为2%~3%。
3
球形Ni(OH)2中添加Co2+的作用
含Co和不含Co的镍电极的循环寿命
4
2)锌的影响 添加锌可形成Ni1-xZnx(OH)2固溶体。 可提高镍电极的析氧电位,抑制电极在充电过程
17
4、V基固溶体型合金 V基固溶体合金吸氢后可生成VH和VH2两种氢化物。 优点:具有储氢量大的特点; 缺点:V基合金本身不具备电极活性,因而对其电化
学应用很少研究。 解决办法:通过在V基固溶体的晶界上析出电催化活
性良好的TiNi等第二相后,可使V基固溶体合金成 为一类新型高容量储氢电极材料。
18
Ni(OH)2的电性
结晶度差、层错率高、微晶晶粒小、微晶排
列无序的Ni(OH)2,活化速度快,放电容量高, 循环寿命长,其它电性能也较好。
9
4、镍电极的制作 主要有烧结式和泡沫镍涂浆式两大类。
羟甲基 纤维素 钠
氢气氛
特点:机械强度高,温度适应性较强,可以高 倍率放电。
10
与烧结式电极相比,孔隙率高,可有效填充高密度的球 形Ni(OH)2,使镍电极的容量比体积及电池的能量密度得 到显著提高,但其生产成本较高。
中γ-NiOOH的生成,减少电极的体积膨胀; 充电过程中,锌离子的加入可使β-Ni(OH)2和β-
NiOOH 间的相互转化更加容易,使得镍电极的 工作电压平台加长; 可抑制电极膨胀,防止可能造成的电池微短路的 发生。
5
3)钙、镁的影响
钙镁过高(>0.02%)会降低Ni(OH)2的活性, 阻止Ni(OH)2中质子的传递,加速容量和电压 平台的衰减,影响电池循环寿命。
Co2+的加入量一般为2%~3%。
3
球形Ni(OH)2中添加Co2+的作用
含Co和不含Co的镍电极的循环寿命
4
2)锌的影响 添加锌可形成Ni1-xZnx(OH)2固溶体。 可提高镍电极的析氧电位,抑制电极在充电过程
17
4、V基固溶体型合金 V基固溶体合金吸氢后可生成VH和VH2两种氢化物。 优点:具有储氢量大的特点; 缺点:V基合金本身不具备电极活性,因而对其电化
学应用很少研究。 解决办法:通过在V基固溶体的晶界上析出电催化活
性良好的TiNi等第二相后,可使V基固溶体合金成 为一类新型高容量储氢电极材料。
18
Ni(OH)2的电性
结晶度差、层错率高、微晶晶粒小、微晶排
列无序的Ni(OH)2,活化速度快,放电容量高, 循环寿命长,其它电性能也较好。
9
4、镍电极的制作 主要有烧结式和泡沫镍涂浆式两大类。
羟甲基 纤维素 钠
氢气氛
特点:机械强度高,温度适应性较强,可以高 倍率放电。
10
与烧结式电极相比,孔隙率高,可有效填充高密度的球 形Ni(OH)2,使镍电极的容量比体积及电池的能量密度得 到显著提高,但其生产成本较高。
中γ-NiOOH的生成,减少电极的体积膨胀; 充电过程中,锌离子的加入可使β-Ni(OH)2和β-
NiOOH 间的相互转化更加容易,使得镍电极的 工作电压平台加长; 可抑制电极膨胀,防止可能造成的电池微短路的 发生。
5
3)钙、镁的影响
钙镁过高(>0.02%)会降低Ni(OH)2的活性, 阻止Ni(OH)2中质子的传递,加速容量和电压 平台的衰减,影响电池循环寿命。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1905年Tafel提出Tafel公式描述了 电流密度与氢过电位的关系。
1950年以前,电化学家企图用 化学热力学方法来处理一切电 化学问题。
化学热力学是物理化学和热力学的一个分支 学科,它主要研究物质系统在各种条件下的 物理和化学变化中所伴随着的能量变化,从 而对化学反应的方向和进行的程度作出准确 的判断。
(1789年—1854年)
从化学方面(即电流与化学反应的关系), 在1833年发现了法拉第(Faraday)定律。 随后,电化学理论又获得了进一步的发展。
(1)电流通过溶液时, 在电极上发生变化的 物质的量与所通过的 电量成正比; (2)当相同的电量通 过各种不同的电解质 溶液时,在各个电极 上发生变化的物质的 量与它们的化学当量 成正比。
法拉第 Faraday (1791-1867)
1887年阿伦尼乌斯(Arrhenius) 提出了电离学说;
1887年 提出电解质的电 离学说,认为电解质在水 溶液中部分电离成正、负 自由离子,溶液性质是所 有离子性质的加和函数。 提出电解质活度系数的概 念。解释了电解质反常的 渗透现象。这一学说不能 解释强电解质及浓溶液的 一些性质
由Helmholtz最早提出的一种双电层结构。 他认为双电层的结构与平行板电容器相似, 双电层的里层在固体表面上,相反符号的外 层则与固体表面平行地分布在液体中,两层 之间的距离很小,约在离子大小的量级。在 此双电层中电势由里层向外层呈直线下降。 亥姆霍兹双电层模型对早期的电动现象研究 起过促进作用,但它不能代表双电层的实际 情形。
般在10-7S/m~105S/m之间。半导体的 导电机理是通过空穴或电子导电。
电导率:
(1)定义或解释 电阻率的倒数为电导率。σ =1/ρ (2)单位: 在国际单位制中,电导率的单位是西门子/米。 (3)说明 电导率的物理意义是表示物质导电的性能。电导率越 大则导电性能越强,反之越小。
化学电源中某些金属氧化物的电阻率
伏打电池(volta cell):1799年,电池 的雏形,具有两个电极和电解质溶液。
伏打 AlessandroVlota (1745~1827年)
两种不同的金 属,中间隔有导电的 电解质溶液,便可以 产生电流,此类装置 都称为伏打电池。
1870年比利时工程师格拉姆发 明了发明电机后,为建立规模 较大的电化学工厂创造了有利 条件,促进了电化学工业的发 展。
第二讲 电化学基础
南昌大学材料学院
一、电化学体系的电传导
能导电的物体称为导体。电阻或电导
是表示导体导电能力的物理量。 根据导电机理的不同,导体分为两类。 有些导体依靠其中的电子传输电流, 可称之为电子导体或第一类导体。另 一类导体是靠离子的移动来实现其导 电,它们被称为离子导体或第二类导 体。
1.第一类导体
凡依靠电子流动传导电流的导体称为
第一类导体,比如金属、碳、金属间 化合物等。 电流通过第一类导体时没 有化学反应的伴随,但是由于电阻的 存在将有热的产生。对于金属来说, 导体的电导率的数量级为106S/m~ 108S/m,其电导率随着温度的上升而 降低。
半导体也属第一类导体,其电导率一
金属氧化 物
片状PbO2 紧密PbO2 微孔PbO2 α- PbO2
电阻率 (Ω﹡m) 2×10-6
74×10-6 95×10-8 1×10-5
金属氧化 物
β- PbO2 Ag2O Pb3O4 CuO
电阻率 (Ω﹡m) 4×10-5
约108 9.6×109 (0.5~1)×106
2.第二类导体 凡依靠离子的移动来传导电 流的导体,称为第二类导体。这 类导体包括所有的电解质溶液和 熔融态电解质以及部分固体电解 质。
二、电化学的研究对象及其发展
1.电化学的研究对象 长期以来,人们多是把电化学看作是 研究电能与化学能相互转换(电解过 程与在原电池中发生的过程)的科学。 但是,也有一些电化学的研究对象并 不能满足上述要求。
电化学系统是由电极和电 解质两种物质组成。当发生电 化学反应的时候,电流将连续 地通过由电极和电解质组成的 电化学系统。
阿伦尼乌斯 Arrhenius (1859~1927)
1889年能斯特(Nernst)建立电极电位 的理论,提出表示电极电位与电极反 应各组分浓度间关系的能斯特公式 表达电极平衡电势E 与温度T和参与电极 反应物质活度ai关系 的公式。
能斯特 Nernst (1864-1941年)
19世纪70年代,Helmholtz首次提 出了双电层的概念
定义:电化学是研究两类导 体(电子导体、离子导体) 形成的带电介面现象及其上 所发生的变化的科学。
电化学的研究对象应当包括 三部分:电子导体、离子导 体、两类导体的介面及其上 所发生的一切变化。
2.电化学的发展 古老的电池-巴格达电池:1932年由德 国的考古学家Wilhelm König在巴格达 东方的Khujut Rabuah遗迹中发现了 Parthian时代(公元前250~226)称 为巴格达电池的发掘物。这个电池是 将铜质圆筒埋在壶中,在它的中心插 入铁棒,灌入醋或葡萄酒即可得到电 流。
在物理学方面的工作,于1826年发 现了欧姆(Ohm)定律
欧姆发现了电阻中电流 与电压的正比关系,即 著名的欧姆定律;他还 证明了导体的电阻与其 长度成正比,与其横截 面积和传导系数成反比; 以及在稳定电流的情况 下,电荷不仅在导体的 表面上,而且在导体的 整个截面上运动。
格奥尔格·西蒙·欧姆 Georg Simo溶于水或熔融状 态是电离出自由移动的离子后才能导电 。 能导电的不一定是电解质,判断某化合物是否是 电解质,不能只凭它在水溶液中导电与否,还需要 进一步考察其晶体结构和化学键的性质等因素。
离子晶体,比如NaCl熔化后就成为
熔融电解质,也属于离子导体。其中 由于含有可以自由移动的Na+和Cl-,具 有离子导电性。高温燃料电池的应用。 固体电解质是指在电场作用下由于离 子的移动而具有导电性的固态物质。 各种固体电解质的导电能力往往相差 悬殊。
