第十六章杂环化合物
第十六 章杂环化合物

P2S5
Δ
CH3
S
CH3
五、卟啉化合物
CH CH3 N Fe CH3 N N CH3 CH2CH2COOH CH2CH2COOH N CH2 CH3 CH CH2
血红素
1853年分离得到晶体,1929年Fischer人工合成。
31
CH CH3 N
CH2
R CH2CH3 N
Mg N CH3 CH2 C O CH2 N CH3
(3)、磺化:
+ -
N
SO3
N H
+ -
N H
N SO 3
SO3H
O
H 2SO4 , 25℃
O
SO 3H
S
S
SO3H
18
(4)酰化:
N H
+ (CH3 CO)2 O
150 ~ 200℃
N H
BF3 -10 ℃
H 3PO4
COCH3
O
+ (CH3CO)2O
O
COCH3
S
+ (CH 3CO) 2O
S
O
CHO
3-甲基吡啶
2-呋喃甲醛
5
含有两种以上杂原子时:
则依照O,S,N 次序编号,编号时杂原子的位次之和应最小 。
4 3 4 2 5 3 4 2 5 3
N
5
N O
1
口恶 唑
N
2
S
1
N1 H 咪唑
噻唑
有些稠杂环化合物的原子编号是固定的。
5 6 7 8 1 4 3
1 6 5
N2 异喹啉
N N
3 4
CH3 CH3 CH2CONH 2 CH2CH2CONH 2 NC N Co +
第十六章 杂环化合物

双烯合成。
O
OO
=
=
O+
O
△
O 90%
=
=
O 顺丁烯二酸酐
O
吡咯也可以与苯炔、丁炔二酸发生类似的反应
N-H
△
N-H +
C-COOH N-H +
△
C-COOH
N-H -COOH -COOH
噻吩芳香性强不发生反应
3. 吡咯的酸碱性
吡咯表面上 是个仲胺,但实 际上吡咯是一个 很弱的碱,碱性 比苯胺弱得多, 基本可以认为其 无碱性
S
+ (CH3CO)2O
H2PO4 或SnCl4
S
-COCH3 70%
2-乙酰基噻吩
呋喃、噻吩、吡咯进行烷基化反应很难得到一烷基取 代物。
呋喃、噻吩、吡咯亲电取代以α-位为主
2. 加成反应
呋喃、噻吩、吡咯分子中都有一个顺丁二烯型结构, 因此它们又具有不饱和性质:
稳定性增加
共振能
S
N
O
(KJ / mol)152 125.5 90.4 71.1 12.6
① 碱性和亲核性 碱性:叔胺 >> 吡啶 > 吡咯
叔胺
N
pKb: ~ 4
8.8
N
NH2
H
9.37
~ 14
碱性增强
+ HCl N
· Cl -
N+ H 吡啶盐酸盐
吡啶氮原子还可以作为亲核试剂与R-X、Br2等亲电 试剂反应形成吡啶盐
+ Br2 N
· Br N+ Br
② 亲电取代反应
亲电取代反应似硝基苯。
常见芳香性六元杂环化合物(单环、稠环)
第十六章 杂环化合物、生物碱

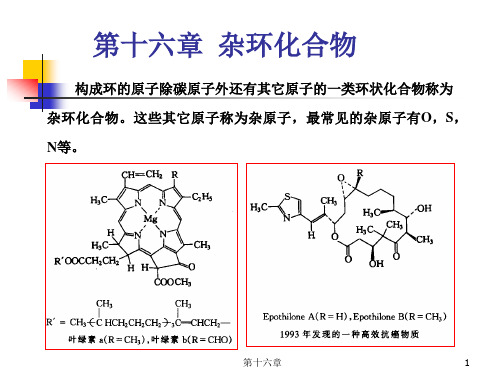
第十六章杂环化合物、生物碱第十六章杂环化合物、生物碱杂环化合物的定义:在环状有机化合物中,构成环的原子除了碳原子外还含有其他原子,这环状种化合物就叫做杂环化合物(heterocyclic compound)。
除碳以外的其他原子叫做杂原子。
常见的杂原子有:氮、氧、硫。
第一节杂环化合物的分类和命名一、分类按照环的大小和环的数目可分为:五元环单杂环OSN六元环H杂环N苯环与单杂环的稠合杂环(苯并杂环)稠杂环N两个或两个以上单杂环的稠合杂环NNNNH二、命名1、音译法:根据外文译音,选用同音汉字,加“口”字旁表示杂环。
ONS呋喃噻吩furanpyrrole吡咯HthiopheneN吡啶N咪N啶NHpyridinepyrimidineindole吲哚?取代杂环的命名:①杂环的编号从杂原子起依次1,2,3 ……(或:α,β,γ……)。
②如环上不止一个杂原子时,则从O、S、N的顺序依次编号。
③有两个相同杂原子的,应从连有H原子或取代基的开始编号。
④编号时注意杂原子或取代基的位次之和最小。
⑤稠杂环是特定的母体和固定的编号。
4CH354463CH3N3N512NH12C5N32H5S213-甲基吡啶4-甲基咪唑5-乙基噻唑2、根据结构命名:1即根据相应于杂环的碳环来命名,把杂环看作是相应的碳环中的碳原子被杂原子置换而形成的。
例如,吡啶可看作是苯环上一个碳原子被氮原子置换而成的,所以叫做氮杂苯。
NHO 茂(环戊二烯)氮茂S氧茂硫茂NNN苯氮苯1,3-二氮苯第二节一杂五元杂环化合物含有一个杂原子的典型五元杂环是呋喃、噻吩、吡咯。
OSNH一、呋喃、噻吩、吡咯的结构1、据现代物理方法证明:①呋喃、噻吩、吡咯都是一个平面的五元环结构,即成环的四个C原子和一个杂原子都是以SP2杂化轨道成键的。
②环上每个碳原子的P轨道有一个电子,杂原子P轨道上有两个电子。
③ P轨道垂直于五元环的平面,互相侧面重叠而形成一个与苯环相似的闭合共轭体系。
第十六章杂环化合物
第十六章
20
呋喃在镍催化下,加氢可得四氢呋喃。四氢呋喃沸点65.5℃,
是良好的溶剂,也是有机合成的原料。从四氢呋喃可得到己二酸和
己二胺,它们是制造尼龙—66的原料。
第十六章
21
尽管呋喃在温和条件下容易发生亲电取代反应,但由于它的芳
香性较弱,呋喃及其衍生物可以容易地进行Diels—Alder反应和一般
合物。最常见的和最稳定的杂环化合物可分为五元杂环和六元杂环 两大类,在每一类中又根据杂原子种类、数目、单环或稠环等再分 类。
第十六章
4
第十六章
5
第十六章
6
杂环化合物的命名采用英文名称的音译,一般在同音汉字的左
边加一“口”旁。对于含一个杂原子的杂环也可把靠近杂原子的位
置叫做α位,其次为β位和γ位。
沸点162℃。糠醛在醋酸存在下遇苯胺呈亮红色,可用来定性检验 糠醛。糠醛可由农副产品如燕麦壳、玉米芯、棉子壳等原料来制取。 这些原料中含有戊醛糖的高聚物 (戊聚糖)。戊聚糖用盐酸处理后, 先解聚变为戊醛糖,然后再失水而成糠醛。
第十六章
19
糠醛是一个很好的溶剂,也是有机合成的原料。糠醛的化学性
质同苯甲醛类似,例如糠醛与约50%氢氧化钠水溶液作用可生成糠
第十六章
7
16.1.2 结构和芳香性
呋喃、噻吩和吡咯是含一个杂原子的五元杂环化合物,组成环
的五个原子位于同一平面上,彼此以 σ键相连接,每个碳原子还有
一个电子在p轨道上,杂原子的未共用电子对也在p轨道上,这五个 p轨道都垂直于环所在的平面。
第十六章
8
呋喃、吡咯和噻吩的离域能分别为67 kJ· mol-1、88 kJ· mol-1和
第十六章杂环化合物2005

1.81D
N+ K
N+ K
+KOH(固)
.. N H
+NH - 液 NH3 +K 2
+
H2 O
+ NH3
+RMgX
N
+ RH
12
MgX
第三节 六元杂环化合物的化学性质 一、吡啶的化学性质
亲核试剂进攻部位
δ
γ
δ δ
亲电试剂进攻部位
β α
N
碱性与成盐
1. 碱性与成盐:
13
NH2 CH3NH2 NH3 N
+
Z
Z
N+ S O3
-
HC l
= ( NH、O、S )
C l C HC H2C l 2 (C H3C O ) O 2 S n C4 l
SO3 Z ( Z = NH、O ) Z
SO3H Z 噻吩可直接用 H2SO4 磺化。
COCH 3
五元杂环化合物进行亲电取代反应的特点是:使用较 为温和的试剂或反应条件。 五元杂环化合物亲电取代反应发生在α-位可用共振 9
(2) 五元杂环化合物是富电子体系,而苯环为等电子 体系,故环上的电子云密度比苯高,其亲电取代反应比苯 容易,尤其易发生在α- 位。杂原子的存在相当于在环上 引入了― NH2、―OH、 ―SH 等活化基团而使环活化, 故进行亲电取代反应的活泼顺序是:
N H
0.140
4 3
O
S
2. 六元杂环化合物 吡啶环的键长也发生了较大程度
pkb
3.36
4.75
8.8
9.3
N
N
CH3 C ≡N
第十六章 杂环化合物

第十六章杂环化合物♦杂环化合物的分类和命名;♦五元、六元杂环化合物的结构和性质;♦稠杂环化合物,喹啉的制法;♦了解生物碱;了解毒品的种类与危害。
♦呋喃、吡咯、噻吩的结构和性质;♦吡啶、喹啉的结构和性质。
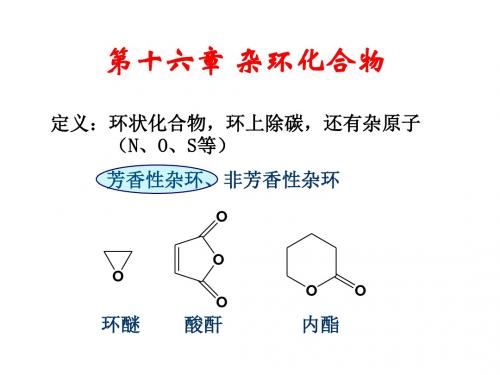
环状酸酐、内酯、内酰胺等,由于它们的环容易打开,性质和开链化合物相似,习惯上不看作杂环化合物。
杂环化合物是一大类有机物,占已知有机物的三分之一以上,广泛存在于自然界中。
⏹植物中的叶绿素和动物中的血红素,都含有杂环结构;⏹石油、煤焦油中,有含硫、含氮及含氧的杂环化合物;⏹生物的遗传,是核酸链上的嘌呤和嘧啶碱基在起作用。
⏹许多杂环化合物用作医药、农药、染料等。
杂环化合物的内容非常丰富,无论在理论研究或实际应用方面都很重要,本章只限于几类常见的杂环化合物。
sp2杂化轨道p轨道红外光谱:呋喃、吡咯、噻吩的C—H伸缩振动比苯的频率高,位于3077~3303cm-1处。
⏹吡咯的N—H伸缩振动:❒非极性稀溶液中在3495cm-1有一尖锐的峰;❒浓溶液中在3400cm-1出现一宽峰。
⏹环伸缩振动(骨架振动),和苯的骨架振动吸收位置接近,在1600~1300cm-1处出现2~4个峰,但峰的形状不同。
(3) 亲电取代反应呋喃、吡咯、噻吩环上的6个π电子分布在5个原子上,电荷密度比苯大。
⏹杂原子对环上电子的贡献为:N最多,O其次,S最少。
⏹亲电取代反应的活性为:吡咯>呋喃>噻吩>苯。
❒吡咯的反应活性和苯胺或苯酚相当,噻吩活性较差,但也比苯快得多。
由于呋喃、吡咯、噻吩环上的π电子云分布不匀,亲电取代反应主要发生在α-位上。
芳香性对亲电取代的影响:⏹噻吩、吡咯的芳香性较强,所以易取代而不易加成;⏹呋喃的芳香性较弱,更像二烯醚,亲电取代往往是通过加成-消除的方式进行的。
环的稳定性对亲电取代的影响:⏹吡咯在强酸性溶液中容易聚合或开环,因此亲电取代反应不能在强酸性溶液中进行。
⏹噻吩对酸不如吡咯和呋喃敏感,可以用硫酸磺化,用混酸硝化。
第十六章--杂环化合物

HOOC
N CO
CH3 CH3
S
CH NH C R O
R = CH2
为青霉素 G
R = CH2 O
为青霉素 V 常用青霉素
R = CH CH CH2 S CH3 为青霉素 O
青霉素具有强酸性(pKa≈2.7),在游离状 态下不稳定(青霉素O例外),故常将它们变成 钠盐、钾盐或有机碱盐用于临床。
0
0
0
0
0
0
- 0.02
- 0.03
O
+ 0.1
- 0.04
- 0.06
S
+ 0.20
- 0.06
- 0.10
N H
+ 0.32
五元杂环具有芳香性,但其芳香性不如 苯环,因环上旳π电子云密度比苯环大,且 分布不匀,它们在亲电取代反应中旳速率也 比要苯快得多。
亲电取代反应旳活性为:
吡咯 > 呋喃 > 噻吩 > 苯,主要进入α-位。
四、 呋喃、噻吩、吡咯旳制备
试验室制备 1、帕尔-诺尔(Paal, C.-Knorr, L.)合成法
t-Bu
Bu-t
OO
H2SO4-H2O, HAc TsOH, 甲苯, △
t-Bu
Bu-t
OH O
t-Bu
P2S5, 170℃
H
OH -H2O
t-Bu
O Bu-t
O
t-Bu
Bu-t (~40 %)
S
Bu-t
五元杂环 六元杂环
呋喃
O N
噁唑
第十六章 杂环化合物

N N pyrazine 吡嗪
5 6 7 8
4 3 6 7 2
5
4 3
4
6 3 2 1N 2
N
N2
8 1
5 6
5
7 8
1
7
quinoline 喹啉
isoquinoline 异喹啉
N1 H indole 吲哚
N 4 N9 H 3 purine 嘌呤
杂环化合物分类:
第一类:无芳香性的杂环化合物:
O 例: O 四氢呋喃 O 丁二酸酐 O N H 四氢吡咯 N H 六氢吡啶
CO2Et H2C COCH3 Et2NH CO2Et C COCH3
H2 C O
+
CH2
第二步:发生迈克加成
CH2
CO2Et C COCH3
+
H2 C
CO2Et COCH3
Et2NH
EtO2C H3C OO
CO2Et CH3
第三步:关环,生成二氢吡啶环
EtO2C H3 C OO
CO2Et CH3
KNO3 , H2SO4(SO3) N 300℃ Br N N
NO2 3-硝基吡啶
Br2 , HOAc N NH2 20℃
NH2
E N
E
H N
E
H N
E
H N
E N
E H E N N E H or N+
16.1.4 吡啶环上亲核取代反应 亲核取代是吡啶环特有的反应,苯系化合物没有类似的反应。 吡啶环 2, 4, 6 位上的卤素容易被亲核试剂取代。
N2
2
thiazole
oxazole
2 六元杂环
N N pyridine 吡啶 N pyrimidine 嘧啶 N pyridazine 哒嗪 N N N pyrazine 吡嗪
有机化学第十六章杂环

按照英文字母顺序排列取代基,并按照取代基的数目和位置进行编 号。
编号顺序
按照取代基的编号顺序进行编号,取代基的编号越小,优先级越高。
分类方法
1
根据杂环母核的环状结构分类:分为单环、双环 和多环杂环化合物。
2
根据杂环母核中杂原子的种类分类:分为含氧、 含氮、含硫和含磷等杂环化合物。
3
根据杂环母核中碳原子和杂原子的成键情况分类: 分为碳-碳键和碳-杂原子键杂环化合物。
杂环化合物的特点
01
02
03
稳定性
杂环化合物通常比相应的 碳环化合物更加稳定,因 为杂原子可以提供额外的 电子,增加环的稳定性。
芳香性
有些杂环化合物具有芳香 性,其特点是具有特殊的 电子分布和化学性质。
反应性
杂环化合物的反应性取决 于其结构和取代基的性质, 有些杂环化合物容易进行 亲电或亲核反应。
THANKS
感谢观看
随着科学技术的发展,杂环化合物在 未来的应用将更加广泛和深入。
同时,随着人们对环境保护和可持续 发展的重视,开发环境友好型的杂环 化合物合成方法和技术也将成为未来 的重要研究方向。
未来发展的方向包括开发新的杂环化 合物合成方法、研究杂环化合物的生 物活性与作用机制、探索杂环化合物 在其他领域的应用等。
杂环化合物的取代反应机理通常涉及亲核和亲电取代反应。
详细描述
杂环化合物的取代反应机理通常涉及亲核和亲电取代反应。在亲核取代反应中,亲核试剂进攻杂环上 的碳原子,形成负离子中间体;在亲电取代反应中,亲电试剂进攻杂环上的碳原子,形成正离子中间 体。这些中间体可以进一步发生重排或水解,最终形成取代产物。
05
在材料科学中的应用
杂环化合物在材料科学中也有广泛的应用,如高分子材料、功能材料和复合材料等。
第十六章杂环化合物
创制具有自主知识产权的新型化学合成药物
新化学实体药研究与开发的重要环节:
先导化合物的发现
EWG
EWG
EWG
R2
R
R
5
NH
6
R6R5N
O
R4
R2
R1S SR1
R1S O R4
OH
EWG = 吸电子基
R2 R8
R7
O
R
2-芳基苯并呋喃类化合物的合成:
OH
O
R1 R2
R4 R5
R3
R3
O
R6
R10
R8 R7
R9 R4
O
R5
R8
R6
R7
R3
R9 R4
RS O
R5
R8
R6
R7
Stemofurans A~K
3
5
环境友好无气味代硫醇试剂
硫醇类化合物是重要的精细有机化工产品:
O R1 R2
+ RSH
RS SR R1 R2
羰基保护试剂
O
R1
R2 + RSH
SR O
R1
R2
硫醚的合成
H3C OCH3
N HO
呋喃衍生物
O2N
O
CNN
H
O
O
痢特灵
速尿:利尿药物,用于治疗浮肿
O HN
COOH
Cl SO2NH2
甲氰咪胍:抗溃疡药物
S N
CH3 N H
HH NN
N CN
发莫替丁:抗溃疡药物
吡啶衍生物
烟酸和烟酰胺:维生素B族中的一种,能促进细胞的 新陈代谢
第16章 杂环化合物

Br2 300℃ 气 相 (产率 39%)
Br2 发烟 H2SO4 130℃ (产率 86%)
0.87 1.01
0.84
N
1.43
电子云密度
Br
N
H2SO4
N
350℃
SO3H
浓 H2SO4 22℃(产率 70%)
N
混酸 300℃ 24h (产率 6%)
NO2 N
b、亲核取代
7.50
N
7.87 9.15
异喹啉
二、化学性质
1、碱性 异喹啉 pKa=5.4
喹啉
吡啶
pKa=4.94
pKa=5.2
2、取代反应
(1)亲电取代——发生在苯环 (5-或8-位)上
NO2
浓 H2SO4 浓 HNO3
0℃ N
+
N
N
NO2
NO 2
HNO 3,H2SO4 N
+
N
N
NO 2
(2)亲核加成——发生在吡啶环上1,2-位加成
100 82 67 45 43 37 12
呋喃和噻吩均为无色液体。
1HNMR
δ 6.99 δ 7.18
S
δ 6.24 δ 7.29
O
二、化学性质 1、亲电取代 噻吩:对酸敏感性较低
S
呋喃
Br2 CH3COOH
HNO3 (CH3CO)2O
H2SO4
SnCl2 CH3COCl
Br S
S
NO2
S
SO3H
轭酸)=5.2],比苯胺强
(pKa=4.7),比脂肪胺弱。
+ HCl
Cl-
有机化学:16章 杂环化合物

异喹啉Isoquinoline
H N
吲哚 Indole
编号从杂原子开始,尽可能使取代基的位次较小。遇两
相同杂原子, 则由带取代基(或H)的杂原子开始。含多个
不同杂原子, 则按 O
S
N 顺序编号。
CH3
C2H5 O CH3 N
O2N O CHO
S CH2CH2OH
2-甲基5-乙基呋喃
4-甲基吡啶
5- 硝 基 -2呋喃甲醛
高效杀菌剂
H3C N
NaO3SH2C
CH3
O
N CH3
N
C6H5
退热药安乃近
N
H2N
SO2NH
S
抗菌药磺胺噻唑
近70年前的第一宗二甘醇杀人事件就与“磺胺‘药有关,1937年 ,美国田纳西州的马先吉尔药厂推出了“磺胺酏----马先吉尔” (酏剂是以酒精作溶剂的一种药物剂型),这种配制成又甜
又香消炎药水主要是给小孩服用的。
两个互变异构体的平衡体系
6
1N
5
7
N
2
98
N4 N
3
H
N N
NH N
9H-嘌呤
7H-嘌呤
核酸中存在的嘌呤环系:
NH2
O
N
N
HN
N
NN H
腺嘌呤
H2N N
N H
鸟嘌呤
NH2
N
N
HOCH2 O N
N
HH
H
H
OH OH
腺嘌呤核苷(腺苷)
3. 喹啉、异喹啉
1) 亲电取代反应
N
试推测亲电试剂进入的位置 ----位
1、结构和芳香性
呋喃 furan
第十六章 杂环化合物

.. N H
氮上孤电子 对参与环内 共轭,不能 再与酸结合。
吡咯表面上是个仲胺,但实际上吡咯是一个很弱的碱,碱 性比苯胺弱得多,它只能慢慢地溶解在冷的稀酸溶液中。 酸性: pka: 10 -OH > N 15 H >
R-OH
18
+ KOH N H + RMgX N H
△
+ H 2O NK + 吡咯钾盐 + RH
在碱性介质中, 硝基苯被还原成两分子缩合的产物。
O 葡萄糖,NaOH N N
NO2 2
100 ℃
氧化偶氮苯
Zn(2mol),NaOH CH3OH
N N 偶氮苯
Zn(3mol),NaOH CH3OH
N H
N H
氢化偶氮苯
联苯胺重排应用实例 (合成偶氮染料)
联苯胺重排应用实例 (合成偶氮染料)
第十六章
Cl O
Cl + O
Cl
Cl2 -40℃ O
O
Br2, 0℃
Br O 稀释 O
(86 %)
Br2 AcO H
Br S
(78 %)
S
I2, HgO C6H6, 0℃
碘不活泼,要用催化剂才能发生
I S
一元取代
Br Br N H
Br Br
Br2, 0℃ EtO H SOCl2 (1 mol)
N H
Et2O, 0℃
偶联反应
重氮盐在弱碱、中性或弱酸性溶液中与酚或芳胺等 反应,生成有颜色的偶氮化合物,这个反应称为偶 合反应或偶联反应。
Ar N N Ar N N
(1)与酚偶联(弱碱性条件,pH=7~9)
(2)与芳胺偶联(与芳胺偶联条件,弱酸性, pH=4~7)
第16章 杂环化合物

+ N H
2H2
Pd N H 四氢吡咯
呋喃、吡咯还可作为双烯体,与亲双烯体,如丁烯二酸酐,发生环加成反应, 生成相应的产物,噻吩在加压下才能与亲二烯体加成。例如: O O
O + O O O O O
练习16.1 写出下列反应的主要产物。
(1) O (2) S (3) O (4) N H + CH3MgI + Br2 二噁烷 25℃ + H2SO4 25℃ (CH3CO)2O BF3
+ O
CH3COONO2
吡啶 -5-30º C O NO2
+
CH3COOH
+ S
CH3COONO2
(CH3CO)2O -10º C S NO2
+
CH3COOH
+ N H
CH3COONO2
(CH3CO)2O 5º C N H NO2
+
CH3COOH
③ 磺化反应 呋喃、吡咯对酸很敏感,强酸能使它们开环聚合,因此常用温和的非质子磺 化试剂,如用吡啶与三氧化硫的加合物作为磺化剂进行反应。
(3) 噻吩与苯共存于煤焦油中,是无色的有特殊气味的液体,熔点-38℃,沸点 84℃。在浓硫酸存在下,与靛红一同加热显示蓝色,反应灵敏。它们都易溶于有机 溶剂,不易溶于水。
下面是五元杂环芳香体系与相应的非芳香体系的偶极矩值。在非芳香体系 中只有诱导效应,由于O,S,N的电负性均比C大,故分子具有极性。相应的 芳香体系中除有诱导效应外,杂原子的一对p电子的部分电荷向环上转移,使 极性降低。特别是吡咯的偶极矩方向与四氢吡咯相反,说明氮上孤电子对向 环上移动。
2 . 物理性质 (1) 吡咯存在于煤焦油和骨焦油中,是无色液体,有弱的苯胺气味,熔点-23℃, 沸点131℃。吡咯蒸气或其醇溶液,能使浸过浓盐酸的松木片呈现红色。
第十六章 杂环化合物

§15.2 杂环化合物的结构和芳香性
§15.3呋喃、噻吩、吡咯的制备及反应
1
定义:成环的原子含有非碳原子的环状化合物。该非碳
原子也称杂原子。 例如:
O
S
N
N
H 杂环化合物和生物碱广泛存在于自然界中,在动植物 体内起着重要的生理作用。
2
γ δ
β
α
O
O=
=O O N H
18
O
O
SO3H
+
S + N SO3 N H
C2H4Cl2
H+
S
SO3H
N H
SO3H
+ H2SO4
S (环稳定)
25℃
H2 O
S 噻吩—2—磺酸 69~76%
SO3H
+ H2O
S
19
(C)卤化: + 2Br2 O + Br2 S Br + 2Br2 N H
0℃
Br
CH3COOH
O
Br
低温
S
Br Br
N3
2 CHO 6
N 1
2—呋喃甲醛
3—吡啶甲酸
H 4—甲基咪唑
S 1
2
5—甲基噻唑
5
4
5 CH3 O 1 2
3
CH3 N H β—吲哚乙酸
CH2COOH
CH3 γ
β N
α
2,5—二甲基呋喃 α,α’ —二甲基呋喃
γ —甲基吡啶 (4—甲基吡啶)
(3 —吲哚乙酸)
N 苯 氮(杂)苯 萘
N 1—氮(杂)萘
N pyridine 吡啶
第十六章 杂环化合物

Br2,CS2 -50℃
H Br O
Br + H
H Br O
H Br
-HBr
O 呋喃
Br O 2-溴呋喃
又例:
+ O (C H3C O ) O 2
B F3
CO CH 3 O
O O
O O O H H O + O
β 4 3 β α 5
O 1
2α
S
N H
furan 呋喃
thiophene 噻吩
pyrrole 吡咯
五元环中含两个或两个(至少有一个氮原子)以上的
杂原子的体系称唑。
4 3
4
2
3
例:
N N1 H
5
4 5
N
2
5
3
4
N
2
3
5
N1 H
N2
S1
O1
imidazole
pyrazole
thiazole
oxazole 噁唑
无芳性:如 :
O
(四氢呋喃)
O
(二噁烷)
O
有芳性:如 :
N H
(吡咯)
N
(吡啶)
芳杂环的数目很多,可根据环大小、杂原子的多少以 及单环和稠环来分类。 常见的杂环为五元、六元的单杂环及稠杂环。 稠杂环是由苯环及一个或多个单杂环绸合而成。
命名:采用外文名的音译,用带“口”字旁的同音汉字表示。 1. 五元杂环
C6H5 C HC N
Cl
N
Cl
N
KNH2
N
液 NH3
16杂环化合物

+
z
H E
z
H E
z
+
H E
β-取代 取代
z
H
H
E +
+E
+
E
z
z
+
*亲电取代反应的活性顺序: 亲电取代反应的活性顺序: 亲电取代反应的活性顺序 吡咯 > 呋喃 > 噻吩 > 苯 2)加成反应(催化加氢、 —阿反应 阿反应) (2)加成反应(催化加氢、狄—阿反应) 共轭二烯性: 共轭二烯性:呋喃 > 吡咯 > 噻吩
能与强酸成盐,与酰氯等生成鎓盐。 能与强酸成盐,与酰氯等生成鎓盐。p615
2. 吡啶环上的亲电取代 •吡啶 吡啶 杂环, 比苯难亲电取代, 杂环,故比苯难亲电取代,和硝基苯相似
π
6 吸电子能力较强), 缺电子芳 吸电子能力较强 6 (N吸电子能力较强), 为缺电子芳
*亲电取代反应主要在 位(β-位)发生; 亲电取代反应主要在3-位 亲电取代反应主要在 位 发生; *只有在极强的条件下才能发生硝化、磺化及卤 只有在极强的条件下才能发生硝化、 只有在极强的条件下才能发生硝化 化反应。但不发生F-C烷基化、酰化反应; 烷基化、 化反应。但不发生 烷基化 酰化反应; *吡啶环上有烷氧基,氨基等给电子基时,有助 吡啶环上有烷氧基,氨基等给电子基时, 吡啶环上有烷氧基 于亲电取代反应的进行, 于亲电取代反应的进行,但反应活性仍低于相 应的苯系化合物; 应的苯系化合物;
2
α NH N N HN γ
1
4
δ
8
β
5
7
6
16.5 吲哚
4 5 6 3 N1 2 H
吲哚的化学性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有芳香性
非共轭体系
电子数=6
电子数=6
无芳香性
有芳香性
有芳香性
§ 16-3 五元杂环化合物物理性质
一、物理性质
呋喃,存在于松木油中,为无色液体, Bp:31.36,有氯仿气味;遇盐酸浸湿的松木 片则显绿色(松木片反应)。 吡咯,存在于煤焦油和骨焦油中,为无色 液体,bp:130~131,有弱苯胺气味;遇盐 酸浸湿的松木片则显红色。
O
呋喃 Furan
N
吡咯 Pyrrole
S
噻吩 Thiophen
N
N
吡啶
喹啉
Pyridine
返回
杂环分类
五 元 杂 环
碳环母核
4 5 3
重要的杂环
4 5 3
单
N S 噻吩 N 吡咯
4 3 5
N
O
1
2
S
1
2
N
咪唑
N
环戊二烯
呋喃
4
噻唑
杂
5 3
N
2
环
六 元 杂 环
6
N N
1 2
6
N
N
1
N
苯 吡啶
哒嗪
嘧啶
N 吡咯 氮(杂)茂
S
噻吩 硫(杂)茂
N
O
吡啶 氮(杂)苯
2 -溴氧(杂)茂
2 ,4 ,6- 三氨基-1,3,5-三氮杂苯 2 ,4 ,6- 三氨基-1,3,5-三嗪
• 在没有误会的情况下,“杂”字可以省去。
返回
16.2 杂环化合物的结构与芳香性
(1)五元杂环化合物——呋喃、噻吩、吡咯的结构
• 五个原子处于同一平面;有一个闭合的共轭体系。符合 4n+2 休克尔规则。 杂原子均 以 sp2 杂 化 (未杂化 的P上有2 个电子参 加成环) p(2), sp2(1,1,2)
CH3- -CH3
O
2,4 -二甲基呋喃
返回
• 含有两个或以上的相同杂原子的单杂环衍生物,编 号从连有取代基(或氢原子)的那个杂原子开始,顺 序定位,使另一个杂原子的位次保持最小:
2. IUPAC法
二、杂环化合物的命名
杂环母体在对应的结构名前“加杂原子”+杂 如: O 茂 呋 喃 氧(杂)茂
-Br
O
N H
S
噻吩,与苯共存于煤焦油中, Bp:84.16,不 易用蒸馏的方法分离;它与吲哚醌在硫酸作 用下显蓝色。
§ 14-3 五元杂环化合物化学性质
(一) 环的不稳定性
由于呋喃中氧的电负性最大,三者中其芳香性最小;因三者是 富电子体系,且电子云密度分布不均匀,因此它们比苯要活泼, 稳定性差些。 活性 (不稳定性) 呋喃 > 吡咯 > 噻吩 > 苯
有机化学 Organic Chemistry
教材:高鸿宾 主编 高等教育出版社
第十六章 杂环化合物
制作: 陈 锋
东北大学理学院化学系
第十六章
杂环化合物
杂环化合物:参与成环的原子除碳原子外,还有其它 元素的原子,这类环状化合物叫做杂环化合物 •一般把除碳以外的成环原子叫杂原子,常见的杂原子 有氧、硫和氮:
• 环系中可含一个、两个或多个相同或不同的杂原子。
•环可以有三元环、四元环、五元环、六元环或更大, 可以是稠合的环。 • 杂环化合物种类繁多,约占全部已知有机化合物的 三分之一。
• 已经学过的杂环化合物: •这些化合物的性质与相应的脂肪族化合物相近。
• 本章介绍的是具有不同芳香性的杂环化合物 (简称芳杂化合物)。
呋喃 Furan
N N H
吡咯 Pyrrole
N N H
噻吩 Thiophen
N S
吡唑
咪唑
噻唑
Pyrazol
Imidazol
Thiazol
一杂六环
• 六元杂环 二杂六环
N
N
N
吡啶 Pyridine
嘧啶 Primidine
三杂六
三聚氰胺
二. 杂环化合物的命名
1. 音译法 即按照英文名称的译音,选用同音汉字,在加上“口”旁以表 示环状化合物。 如:
返回
吡嗪
杂环分类
碳环母核
重要的杂环
N
稠
N
苯
喹啉
异喹啉 N
杂 茚 环 蒽
N 吲哚
8 7
O
苯并呋喃
9
N
嘌呤
2
1
6
5
吖啶
10
N
3
4
返回
当环上有取代基时:
⑴以杂环为母体,编号时从杂原子开始,将杂原子编为1号, 依次1,2,3· · · · · · ,或与杂原子相邻的碳原子遍为α,依 次为α,β,γ······ CH
五元芳杂环;比苯小的,称为缺芳杂环,六元杂环。
• 作业第8题:下列化合物哪些具有芳香性?
N有3个键的,如-NH-,则N为SP2(1,1,1),剩余P=2电子(电子) N有2个键的,如-N=,则N为SP2(1,1,2),剩余P=1电子(电子)
电子数=6
电子数=8
有芳香性
电子数=6
反芳香性
位电子 云密度 -0.10
• 呋喃>吡咯 > 噻吩 > 苯 -0.03 -0.06 0 (不一致)
(2)六元杂环化合物——吡啶 • 氮原子与碳原子处在同一平面。 • 吡啶的结构与苯相似,符合休克尔规则,具有芳香性
杂原子均以 sp2 杂 化 ( 未杂化的P 上有1电子 参加成环) P(1), Sp2(1,1,2)
16.1 杂环化合物的分类和命名
•按骨架分类:五元杂环、六元杂环;单杂环和稠杂环等。 • 命名——按英文音译。常见的杂环有:
呋喃
噻吩
吡咯
吡啶
喹啉
噻唑
嘧啶
吲哚
16.1 杂环化合物的分类和命名
一. 杂环化合物的分类: • 按环的形式分:单杂环和稠杂环
(一)
单环杂环
一杂五环
O N H S
五元杂环
二杂五环
(二) 酸碱性
呋喃、噻吩为中性;吡咯具有弱酸性,Kb = 2.5 10-14 ;
p(2), sp2(1,1,1)
p(2), sp2(1,1,2)
• 芳香性程度的比较:
• 呋喃、吡咯、噻吩环中的杂原子上的未共用电子对 参与了环的共轭体系,使环上的电子云密度增大,故 比苯容易发生亲电取代反应,取代通常发生在-位。
芳香性强弱的次序
• 苯 > 噻吩 > 吡咯 > 呋喃 离域能:152 117 88 67 KJ/mol 取代反应活性的次序
• 吡啶在发生亲电取代反应较苯困难,主要发生在位。
• 相对来说,吡啶较易发生亲核取代反应,取代基往往 进入位。
• 由于芳杂环中电子的离域作用,环中的单、双键与 孤立的单、双键不同,因此,可用下列式子表示:
• 也可用共振式的叠加来表示,如吡咯:
• 芳香族化合物的电荷分布:
• 环上碳原子电荷密度比苯大的称为多芳杂环,通常为
-
3
O
-Br
2 -溴呋喃 α-溴呋喃
N
4 -甲基吡啶 γ-甲基吡啶
⑵当环上有两个或两个以上的杂原子时,应使杂原子所在的位次 数字最小;当环上有不同杂原子时,按O→S→N的次序编号。
H 3C 5 N1 H 4 N3 2
4
4-甲基咪唑
N
3 2
H3C
5 S 1
5-甲基噻吩
⑶环上连有不同取代基时,编号时遵守次序规则及最低系列原则
