肝病新药Ocaliva(obeticholic,奥贝胆酸)获准上市
国家药监局批准非奈利酮片上市

国家药监局批准非奈利酮片上市
佚名
【期刊名称】《中国处方药》
【年(卷),期】2022(20)8
【摘要】近日,国家药品监督管理局批准拜耳公司申报的1类创新药非奈利酮片(商品名:可申达/Kerendia)上市。
该药适用于与2型糖尿病相关的慢性肾脏病成人患者[肾小球滤过率估计值(eGFR)25~75 ml/(min·1.73 m^(2)),伴白蛋白尿],可降低eGFR持续下降、终末期肾病的风险。
非奈利酮是一种非甾体类、选择性盐皮质激素受体(MR)拮抗剂。
【总页数】1页(PI0001-I0001)
【正文语种】中文
【中图分类】R73
【相关文献】
1.国家药监局批准羟乙磺酸达尔西利片上市
2.国家药监局批准脯氨酸恒格列净片上市
3.国家药监局批准阿布昔替尼片上市
4.国家药监局批准维立西呱片上市
5.国家药监局附条件批准卡度尼利单抗注射液上市
因版权原因,仅展示原文概要,查看原文内容请购买。
奥贝胆酸有关物质的分析及合成

奥贝胆酸有关物质的分析及合成范甜;史校东;张晓晓;刘洋;姚军【摘要】为了控制奥贝胆酸药品的质量,从奥贝胆酸原料药中分离并鉴定了3种有关物质:3α-羟基-6-乙基-7-酮-5β-胆烷-24-酸(A),3α,7α-二羟基-6-亚乙基-5β-胆烷-24-酸(B)和3α(3α,7α-二羟基-6α-乙基-5β-胆烷-24-酰基氧基)-7α-羟基-6α-乙基-5β-胆烷-24-酸(C).分析了这些物质产生的原因并进行了设计合成,其结构经过核磁共振氢谱得以确认.研究表明,3个有关物质与奥贝胆酸粗品中的主要有关物质的相对保留时间完全一致,合成的有关物质与分离得到的有关物质的核磁共振氢谱图相符合,可以判定奥贝胆酸产品中的主要有关物质就是合成得到的有关物质A、有关物质B、有关物质C.解决了有关物质研究所需对照品的问题,提高了原料药的质量,为奥贝胆酸的质量研究和有关物质的控制提供了一定的帮助.%In order to control the quality of obeticholic acid,three related substances are separated from the obeticholic acid,as 3α-hydroxy-6-ethyl-7-keto-5β-cholene-24-acid (A ),3α,7α-dihydroxy-6-ethylidene-5β-cholene-24-acid (B ) and 3α(3α,7α-dihydroxy-6α-ethyl-5β-cholyl-24-acyloxy)-7α-hydroxy-6α-ethyl-5β-cholene-24-acid (C).The cause of the substances existence is analyzed and the route for preparing the substances is designed,and the structure of the substances are determined by 1 H NMR.The study shows that the relative retention time of the three related substances is consistent with that of the main related substances in obeticholic acid crude products,and the nuclear magnetic resonance hydrogen spectra of the synthesized related substances is consistent with that of the separated related substances,so it is determined that the main related substances inobeticholic acid products are the related substance A,related substance B and related substance C.The study solves the prob-lem of the reference substances needed for the study of the relative substances,improves the quality of the obeticholic acid,and provides some help for the quality research of obeticholic acid and control of the related substances.【期刊名称】《河北工业科技》【年(卷),期】2017(034)006【总页数】6页(P434-439)【关键词】中药化学;奥贝胆酸;结构鉴定;有关物质;合成;质量控制【作者】范甜;史校东;张晓晓;刘洋;姚军【作者单位】河北科技大学化学与制药工程学院,河北石家庄 050018;河北科技大学化学与制药工程学院,河北石家庄 050018;河北科技大学化学与制药工程学院,河北石家庄 050018;石家庄市第 23 中学,河北石家庄050000;河北科技大学化学与制药工程学院,河北石家庄 050018;河北省药用分子化学重点实验室-省部共建国家重点实验室培育基地,河北石家庄050018【正文语种】中文【中图分类】R975奥贝胆酸,又名obeticholic acid,商品名Ocaliva,化学名6α-乙基-3α,7α-二羟基-5β-去氧胆酸-24-酸,是由美国 Intercept 制药公司研发的用于治疗原发性胆汁性肝硬化(PBC)和非酒精性脂肪性肝病(NAFLD)的新型药物[1-3],2016-05-27获得FDA加速批准[4],目前该药在中国国内并未上市。
降胆固醇药物立普妥的仿制药首次获FDA批准上市

胸痛 的发病 几率 。 印度 R nay公 司获 批准 生产 l 、04 、0mg abx 0 2 、0 8 药效 的阿托 伐他 汀仿 制 药。 仿制 药 必须具 有 与 商标 注 册 药物立 普妥 相 同 的质 量 与 效 力 , 生 产 与包 装 其 必须通 过相 同的质 量标准 认 证 。阿托 伐他 汀常 见 的 不 良反 应包 括 : 鼻道 感染 、 节痛 , 泻 , 关 腹 泌尿 道感 染
药数量和 品种 、 降低 采购价 格 的方式 进一 步 降低药 费 , 降低 的这部分药费可 以按 照降价额 的4 %给予补贴 , 0 如果可 以再 降低 80万元 , 0 得到 的补贴是 8 0×0 4=30万元 。合计在 0 . 2 7 0万元左右 , 4 比原来 的药 品的利润 7 0万要 多 , 0 而且是 在 医 疗成本 、 者负担大幅度降低 的基础上 实现的。 患
了 7 0万 元的负担 , 4 但是 患者减少 了 15 0万元 的药 费开支 , 0 按照现在各种 医疗保 险平 均报 销 5 %估 计计 算 ( 0 随着 医疗 保险力 度 的加 大 , 财政 支付 比例肯 定不 止 5 % ) 节省 财政 0 , 支付 7 0万元 。实 际仅仅 增加 很少 的 财政 支 出。如果 通 过 5 制定合理 的补偿 比例 , 全可 以实 现医 院 、 完 患者 和财政 三方
・
ห้องสมุดไป่ตู้
3 ・ 2
齐鲁 药 事 ・ l P a a uc fi 02 V 1 INo 1 Qi hr c taAft2 1 o 3 , . u m e il as .
且 降价对 医院有利时 , 医院的降价才是主动 的。
全球已经获批的干细胞药物
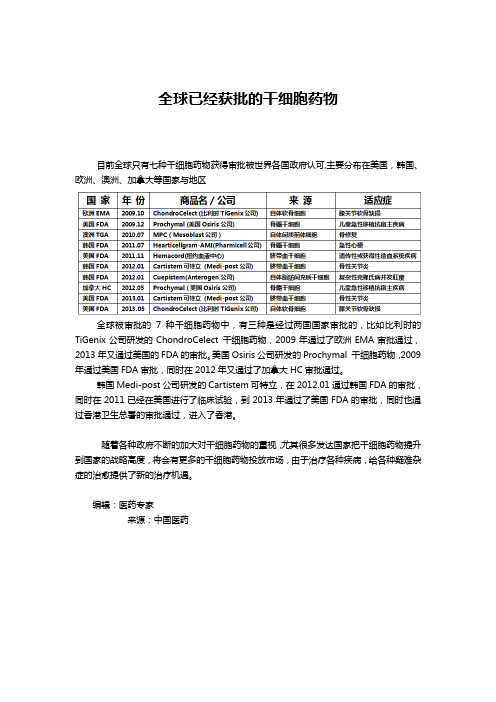
全球已经获批的干细胞药物
目前全球只有七种干细胞药物获得审批被世界各国政府认可,主要分布在美国,韩国、欧洲、澳洲、加拿大等国家与地区
全球被审批的7种干细胞药物中,有三种是经过两国国家审批的,比如比利时的TiGenix公司研发的ChondroCelect 干细胞药物,2009年通过了欧洲EMA审批通过,2013年又通过美国的FDA的审批。
美国Osiris公司研发的Prochymal 干细胞药物,2009年通过美国FDA审批,同时在2012年又通过了加拿大HC审批通过。
韩国Medi-post公司研发的Cartistem可特立,在2012.01通过韩国FDA的审批,同时在2011已经在美国进行了临床试验,到2013年通过了美国FDA的审批,同时也通过香港卫生总署的审批通过,进入了香港。
随着各种政府不断的加大对干细胞药物的重视,尤其很多发达国家把干细胞药物提升到国家的战略高度,将会有更多的干细胞药物投放市场,由于治疗各种疾病,给各种疑难杂症的治愈提供了新的治疗机遇。
编辑:医药专家
来源:中国医药。
奥贝胆酸合成工艺研究

奥贝胆酸合成工艺研究品种简介:OH化学结构式:中文名称:奥贝胆酸英文名:Obeticholic Acid商品名:Ocaliva分子式:C26H44O4 分子量:420.63CAS 登记号:459789-99-2研发公司:In tercept Pharmaceuticals上市时间:2016年5月27日药物类别:1类药新分子实体,优先审查适应症:原发性胆汁性肝硬化剂型规格:片剂5mg/10mg售价:$5776.00(5mg*30)产品简述:OCALIVA的活性成分是奥贝胆酸(obeticholic acid),奥贝胆酸是一种半合成的鹅去氧胆酸,也是法尼酯衍生物X受体(FXR)的特异性激动剂,FXR是表达于肝脏和小肠中的一种核受体,是胆汁酸、炎症、纤维化、代谢通路中的关键调节因子。
奥贝胆酸活化法尼醇X受体,间接一直细胞色素7A1(CYP7A1)的基因表达,CYP7A1是胆酸生物合成限速酶。
奥贝胆酸由In tercept制药公司研发成功,用于对旧标准治疗药物熊去氧胆酸没有充分应答或不能耐受的患者。
奥贝胆酸是一个新的分子实体,尚未经批准用于其他适应症。
Ocaliva旨在增加胆囊的胆汁,药物在临床研究评估涉及216人,常见副作用包括皮肤瘙痒、疲劳、腹痛、喉咙痛、眩晕和便秘。
奥贝胆酸被授予孤儿产品开发办公室授予的孤儿药。
OCALIVA 片剂以5mg 和10mg 的剂量用于口服给药。
片剂含奥贝胆酸为活性成分及以下非活性成分:微晶纤维素,羟基乙酸淀粉钠和硬脂酸镁。
膜包衣是含有聚乙烯醇部分水解的二氧化钛,聚乙二醇(聚乙二醇3350),滑石和氧化铁黄的Opadry II (黄色)。
二、与同类药物相比的特点和优势原发性胆汁性肝硬化(PBC),也即原发性胆汁胆管炎,是一种慢性肝内胆汁淤积型疾病。
患者早期通常无症状,1/3患者在几年后出现乏力和皮肤瘙痒症状。
通过血清碱性磷酸酶(ALP)升高是PBC最常见的生化异常。
PBC发病高峰为40到60岁,随着时间的推移,PBC发展为肝纤维化、肝硬化、肝代谢失调,最终死亡。
优思弗治疗原发性胆汁性肝硬化的实际疗效与前景展望

优思弗治疗原发性胆汁性肝硬化的实际疗效与前景展望原发性胆汁性肝硬化是一种慢性肝病,其特点是肝内胆汁淤积,导致肝细胞损伤和纤维化。
这一疾病不仅严重影响患者的生活质量,而且如果不进行及时治疗,最终可能会发展为肝衰竭或肝癌。
尽管目前对于这一疾病的治疗方法有很多,但仍有许多患者无法得到有效的治疗。
而优思弗,作为一种新型的胆汁酸受体拮抗剂,被设计用来治疗原发性胆汁性肝硬化。
它的作用机制是通过抑制胆汁酸的合成和分泌,从而减轻肝内胆汁淤积,改善肝功能。
在临床试验中,我们对优思弗的疗效进行了全面评估,包括肝功能指标的改善、肝组织学变化的减轻以及患者生活质量的提高。
在为期24个月的临床试验中,我们观察到,使用优思弗的患者在肝功能指标上有了显著改善。
具体来说,患者的ALT和AST水平明显下降,这表明肝细胞损伤得到了有效控制。
同时,患者的总胆红素水平也有所下降,这意味着肝内胆汁淤积得到了缓解。
这些结果表明,优思弗能够有效改善患者的肝功能。
我们对患者的肝组织学变化进行了详细观察。
我们发现,使用优思弗的患者,其肝纤维化的程度明显减轻。
这表明优思弗能够减缓甚至阻止肝硬化的进展。
同时,我们也观察到,患者的肝脏炎症程度也有所减轻,这有助于防止肝病进一步恶化。
最重要的是,我们发现优思弗能够显著提高患者的生活质量。
在临床试验中,患者报告了明显的症状改善,包括疲劳、瘙痒和黄疸等症状的减轻。
这不仅使患者的生活质量得到了提高,也使他们的生活充满了希望。
然而,尽管优思弗在治疗原发性胆汁性肝硬化方面表现出了显著的疗效,但我们仍然需要对其进行更深入的研究。
特别是在长期使用优思弗的安全性和有效性方面,我们需要更多的数据来支持。
同时,我们也需要对优思弗在不同类型的肝硬化患者中的疗效进行进一步研究,以便为更多的患者提供有效的治疗方案。
在我深入研究优思弗治疗原发性胆汁性肝硬化的实际疗效与前景展望的过程中,我逐渐意识到这项治疗方案不仅是一种医学上的突破,更是为众多患者带来了新的生机。
口服多发性硬化症治疗药物Aubagio获欧盟批准

取液 色谱 图上 科 罗索酸 峰前 有3 0~ 6 0 o C ) 处理后该色谱 峰消失 。 枇 杷 叶经 石油 醚 ( 3 0~ 6 0℃ ) 处 理 后 亦 可 除 去 大部
—
49 4.
[ 5 ] 王 晓燕, 李 多伟 , 何斌. 枇杷 叶 中熊果 酸及其 衍生 物的 研究进展 [ J ] . 西北药学杂志 , 2 0 1 2 , 2 7 ( 1 ) : 8 3—8 5 .
药典) 2 0 1 0年版( 一部) 记载 , 枇杷叶全年均可采收 , 而 本 实验 中夏 季采 收测 得 的含量 较秋 季采 收测 得 的
近年 来 , 国 内外 学者 对 枇 杷 叶 的化 学 成 分进 行 了较 为深入 的研 究 , 发现其含有挥发油、 三萜类 、 倍 半 萜类 、 黄 酮类 等活性 成 分 , 药 理研 究 表 明其 主要有 效成 分 集 中在 三 萜 酸 类 化 合 物 J 。熊 果 酸 具 有 镇 静、 抗炎、 抗菌、 抗 溃疡 、 降血 糖 等 多 种生 物学 效 应 ; 科 罗索 酸具有 降血糖 、 减肥 、 抗 肿瘤 、 抗炎、 抗 病毒 和 抗心 血 管 疾 病 等 作 用 。《中 国药 典 》 2 0 1 0年 版 ( 一 部) 测 定 枇杷 叶 中 的熊 果 酸 和齐 墩 果 酸 , 笔者以为, 从药 理作 用及 本 实验 所 测 的含 量 分 析 , 科 罗 索 酸 也 应作 为衡 量枇 杷 叶质量 的指标性 成 分进行 检 测 。
胞 的增 殖 , 从 而在 免疫 抑制 和抗 肿 瘤 中起 重要 作用 。 究 的数 据 , 数据表 明 , 在 为 期 2年 的 治 疗 中, 与安 慰
剂相比, A u b a g i o显 著 降低 了 MS的 年 复 发 率 , 同时 延 缓 了残疾 进展 。 A u b a g i o最 常见 副作 用 包 括 丙 氨 酸 氨基 转 移 酶
慢乙肝新药ABX203 (HeberNasvac)在古巴获得新药上市许可

慢乙肝新药ABX203 (HeberNasvac)在古巴获得新药上市许可专注于如HIV/AIDS和慢性乙型肝炎等这类病毒性疾病的抗病毒药物和治疗性疫苗研发并商业化的新兴领导者ABIVAX及基因工程和生物科技中心(CIGB)——全球生物科技领导者,今日宣布,古巴监管部门——国家药品、医疗器械和装备控制中心(CECMED),授予CIGB他们第一个慢乙肝治疗性疫苗ABX203(商品名:HeberNasvac)新药上市许可申请。
“在临床试验期间,接受ABX203治疗的慢乙肝患者,通过观察免疫反应显示,该治疗性疫苗可以帮助慢乙肝患者克服免疫麻痹——这也是典型的乙肝慢性化机制,”哈瓦那CIGB生物医学研究中心主任Gerardo Guillen博士说道。
“目前对ABX203的研究为慢乙肝治疗性疫苗的概念提供临床证据。
ABX203 (HerberNasvac)已经显示出了独一无二的持续效应,它已经较聚乙二醇干扰素(PEG - IFNα)对慢乙肝治疗到达了缩短持续用药时间和更好的耐受性。
换句话说,数据显示ABX203通过标准治疗即给慢乙肝患者提供相当的治疗优势。
”ABX203拥有鼻喷剂型和皮下注射剂型两种剂型,被设计成犹如强烈的机体细胞免疫反应似的诱导机体产生对HBsAg的中和性血清抗体,而慢乙肝患者的机体免疫反应通常非常弱或检测不到。
该治疗性疫苗由从HBV、表面抗原(HBsAg) 和核心抗原(HBcAg) 的2组重组蛋白构成。
ABIVAX 拥有包括亚洲、欧洲和非洲80多个国家的ABX203 商业开发和应用权。
该授权由CIGB授予从2013年开始,完成所有的后续在古巴和孟加拉国进行的成功I/II 和III 期临床试验。
这些研究显示ABX203耐受性良好并且具有跟PEG - IFNα具有相似的抗病毒效果。
此外,其对HBV病毒载量的效果也维持了非常长的一段时间。
在短期、更便捷的用药之后,该药独特的延长效用,提示ABX203 提供了相当大的治疗优势并改善采用标准治疗的慢乙肝患者依从性。
博路定(Baraclude),在中国通过建立市场而获得上市成功

博路定(Baraclude),在中国通过建立市场而获得上市成功某些情况下,制药公司会发现,在开发业务过程中产品上市发挥的作用在新兴医药市场与发达市场中大相径庭——公司需要在关注个别上市产品与建立某类药品的领先地位(例如抗生素)之间做出选择。
此外,公司寻求不同细分市场的业务增长也会为资源优先级与分配方面带来错综复杂的挑战与难题。
乙肝产品博路定(Baraclude,恩替卡韦)是在中国建立市场的标杆产品之一。
该产品在上市前的重要活动即为市场拓展。
创建与拓展市场至关重要,因此,公司需要耗费相当的时间对市场进行了深入了解。
关键挑战在于:博路定上市之前,拉米夫定是唯一一款可用的产品,这造成了处方医生与患者对尝试新的乙肝抗病毒药会产生一定的排斥,尽管拉米夫具有相当大的副作用。
因此,百时美施贵宝公司(BMS)在早期即在深入了解市场、驱动因素与行业相关方方面进行了大量投入。
在上市前18个月左右的时间内,公司还发起了监管与医疗的协作项目。
医疗团队积极准备,就乙肝和患者收益开展教育培训。
在中国(流行病难题最显著的市场),团队从寥寥数人发展到了产品上市时的100多人(包括销售代表)。
博路定的重要成功因素•BMS在产品上市之前做好充分准备,确保产品进入医院处方药清单。
为了实现这一目标,销售团队对医院市场格局进行了详尽分析,以识别哪些医院为重要目标医院。
此类格局分析工作始于产品上市1年前。
•定价策略是基于一线使用情况而确定的。
对内,这意味着公司需费时颇久向全球团队解释亚太区的定价原则。
对外,公司需从药物经济学的角度向行业相关方阐明产品定价的合理性。
且定价是以本土临床试验结果为支撑的。
•开展大量医疗营销活动,令相关团体确信产品的价值,以确保产品在上市之后可成为首选药品。
医生对乙肝为肝脏疾病(意味着应该治疗肝脏)还是病毒性疾病(意味着应当抑制病毒)存在分歧。
因此,需要通过细致的培训锁定适当的医生群体。
•公司组织的就绪程度对于产品上市的成功至关重要。
治疗非酒精性脂肪肝的潜在新药——奥贝胆酸

2 0 1 6年 9 』 】
_ I 未约物i
杂志
VOI . 1 4. NO 5
CI i ni cal Medi c at i on J our
l 家心急 防控 药物 I 技 术研究 r l 1 学 术 是持 .
激 活 的 转 录 因 子 , 凋 节 靶 基 因 的 表 达. F X R参 机 体 内 8 H 汁 酸 的 代谢 、 脂 代谢 和糖 代 谢 ,并起 着 重 要 的 调节
作片 】 … 激活 F XR就 能 够 发 挥 抑 制
物 标 志 物 一 碱 性 磷 酸 嗨 和 胆 素 的
水 平 ,临J 末研 究 的复 合 终 点碱 性 磷 酸
患 苦 得 到 了肝组 织 学 改善 ( 安慰 剂组
的药 物 有 约 3 0 个 ,叟 l 】 以法 呢醇 x 受 体 ( F X R) 为 靶 标 的潜 在 新 药奥 贝胆
酸 ( Ob e t i c h o l i c Ac i d ,OCA, 又名6 .
织学 改 善 ( 安慰 剂组 是 2 3 %) 另 外 ,在 l 项 只 有 糖 尿 病 患 者 入组 的随 机临 j 末实 验 中 ,O C A治 疗 时糖 耐受患 者的 肝组织 学反 应, 在胰岛 B乡 } H 胞功能障碍 ( 用H OMA 1 3 c e l l i n d e x 评估 ) 的 发 展进 程 『 { l 也 可 以 看 m来 结 果 显示 患 者接 受 低 剂 量 胰 岛 素 输 注 后 ,2 5 mg O C A 治 疗 组 患 者 的胰 岛素 敏 感性 较 基线 提 高 了
和逆 转 纤 维 化 和肝 硬 化 和降 低 ¨ 药 业 的关 注重 点 逐 渐 转 移到 其 他 肝病 碍 ) 领 域 ,如非 酒 精性 脂 肪 性肝 炎 ( N o n —
上市新药素比伏将为慢性乙型肝炎患者带来福音

提 供 更 新 更 好 的 药物 ,素 比伏 的上 市 标 志 着诺 华进 入抗 感 染领 域
的 第一 步。 不 久 的将 来 ,我 们还 要 推 出一 系列 的 目前 分别 处 于研 发早 期 或三 期 临床 阶段 的 乙型 肝 炎和 丙型 肝 炎治 疗 药物 。 北 京 诺 ”
解 病 情 变化 , 争取 最 大 限度 地 抑 制 HB N t D A病毒 水平 ,从 而延 缓 V
和 改 善疾 病 的进 程 。
秘- 竹 国 建 乙 辟 兔 新 略 + E 将 立 型 炎 瘟 第 我
根据 科技 部 近 日制 定 的 《 技 促 进 疾 病 防 治 实施 方 案》 “ 科 , 十
一
五 ”期 间 ,我 国将 力争初 步建 立 适 合 我 国 乙型 肝 炎 流 行 病 学特
点 的 免 疫 策略 , 大 幅度提 高 乙型 肝 炎 防治 水 平 。
“ 一五 ”期 问 ,我 国 力 争初 步建 立 适 合 我 国 乙型 肝 炎流 行 十
病 学特 点 的 免疫 策 略 ,开 发 1 2项 新 剂 型 乙型 肝 炎 疫 苗 , 了解 至
准 。 中 国是 全世 界 感染 乙型肝 炎病 毒 人 数最 多 的 国 家 , 约有 1 2 . 亿 人 呈 乙型 肝 炎 表 面抗 原 阳性 ,其 中 约有 5 0 0万人 为慢 性 乙型 0
肝 炎患 者 。在 现 有 治 疗 情 况 下 ,中 国每 年 有 近 5 O万人 死 于 慢 性 乙
2 7 第3 0 年 期恒 0
}
维普资讯
信 息
. )
心
首个昆虫类抗乙肝新药上市

首个昆虫类抗乙肝新药上市
佚名
【期刊名称】《健康大视野:医药保健》
【年(卷),期】2006(000)009
【摘要】由昆明赛诺制药有限公司开发的治疗慢性乙肝的中药二类新药“肝龙胶囊”日前获得新药证书和生产批文。
这是第一个获得国家食品药品监督管理局批准的昆虫类治疗慢性乙肝的中药二类新药。
【总页数】1页(P59)
【正文语种】中文
【中图分类】R97
【相关文献】
1.杜绝滥用乙肝新药——写在阿德福韦、恩替卡韦等乙肝新药上市前 [J], 刘士敬
2.全球首个乙肝靶向治疗新药进入临床 [J],
3.我国首个既抗乙肝病毒又抗艾滋病病毒的新药 [J],
4.英首个“潜力创新药”授予抗脑癌疫苗 [J],
5.新药专项“三重”课题军民融合成功典范——国家战略性药品、抗超级耐药菌感染新药“替加环素(海正力星)”上市发布会在京举行 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
FDA批准治疗原发性胆汁性肝硬化药物Obeticholic Acid上市

FDA批准治疗原发性胆汁性肝硬化药物Obeticholic Acid
上市
佚名
【期刊名称】《中国执业药师》
【年(卷),期】2016(0)8
【摘要】美国FDA于2016年5月27日批准Intercep制药公司的Obeticholic Acid(参考译名:奥贝胆酸,商品名:Ocaliva)片剂上市,与熊去氧胆酸(UDCA)合用于对UDCA应答不充分或单用于对UDCA不耐受的原发性胆汁性肝硬化(PBC)成年患者。
【总页数】1页(P14-14)
【关键词】原发性胆汁性肝硬化;FDA批准;硬化药物;上市;熊去氧胆酸;治疗;UDCA;美国FDA
【正文语种】中文
【中图分类】R575.2
【相关文献】
1.FDA拓展批准瑞戈非尼用于治疗肝癌/FDA批准midostaurin和化疗药结合治疗急性髓系白血病/FDA批准丙肝药物Sovaldi和Harvoni用于儿科患者 [J],
2.FDA批准首例用于治疗巨细胞动脉炎药物Actemra/FDA批准首个治疗ADHD 仿制药/FDA批准Ceritinib用于一线治疗ALK阳性的转移性非小细胞肺癌 [J],
3.FDA批准诺华Utibron Neohaler用于慢阻肺的治疗/FDA对艾伯维丙肝药物存在严重肝损伤风险提出警告/FDA叫停减肥药物Zafgen的临床试验 [J],
4.FDA批准医疗器械Optune用于治疗脑癌/CFDA批准首个卵巢储备功能检测上市/FDA批准帮助盲人通过舌头处理视觉信号的器械 [J],
5.美国FDA批准癫痫治疗药物Sabril(vigabatrin)首个仿制药上市 [J], 夏训明(编译);
因版权原因,仅展示原文概要,查看原文内容请购买。
oca给药方案的名词解释

oca给药方案的名词解释OCA 给药方案的名词解释引言:随着现代医学的快速发展,药物疗法在治疗疾病方面发挥着重要的作用。
其中,OCA(Obeticholic Acid)给药方案是一种新兴的治疗方案,逐渐受到医学界的关注。
本文将对 OCA 给药方案进行名词解释,以便读者更好地了解该方案在临床上的应用和意义。
一、OCA的定义OCA,全称为Obeticholic Acid,是一种合成型胆汁酸类似物,属于胆酸受体激动剂(FXR agonist),用于调节胆汁酸的水平。
OCA 是一种高选择性的 FXR 受体激动剂,通过激活这一受体来改善肝脏的炎症和纤维化等病理过程。
二、OCA 给药方案的目的OCA 给药方案的主要目的是为了治疗某些与非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)相关的疾病。
NAFLD 和 NASH 是一类与肥胖、糖尿病等代谢性疾病相关的肝脏疾病。
OCA 给药方案可通过减少肝脏的炎症和纤维化程度,改善肝功能,从而延缓疾病的进展。
三、OCA 给药方案的应用领域1.非酒精性脂肪性肝病(NAFLD):NAFLD 是指剂量& 180250贺该愣肝脏中积累过多脂肪,患者不饮酒或仅轻度饮酒。
OCA 给药方案作为一种新型的治疗选择,被广泛应用于NAFLD 患者,用于改善他们的肝功能和减少肝脏炎症。
2.非酒精性脂肪性肝炎(NASH):NASH 是 NAFLD 的临床表现之一,其特点是在非酒精性脂肪肝的基础上伴有肝脏炎症和纤维化。
OCA 给药方案被视为一种可行的治疗方法,可以降低其病理过程的严重程度。
3.其他适应症:除了 NAFLD 和 NASH,OCA 给药方案还被研究用于治疗原发性胆汁性胆管炎、原发性硬化性胆管炎等其他肝胆系统疾病。
四、OCA 给药方案的剂量和安全性根据不同的疾病类型和严重程度,OCA 给药方案的剂量有所不同。
目前,临床研究已明确了针对每种疾病的建议剂量范围。
然而,在使用 OCA 给药方案时需要注意患者的严重不良反应,如肝功能异常、恶心、疲劳等,并及时监测和调整给药方案。
全球首个抗肝癌单抗导向治疗药物获准上市

全球首个抗肝癌单抗导向治疗药物获准上市
佚名
【期刊名称】《肝博士》
【年(卷),期】2005(000)003
【摘要】新华社5月10日电由中国人民解放军第四军医大学、成都华神集团股份有限公司联合研制的治疗肝癌新药——碘131美妥昔单抗注射液,日前获得国家食品药品监督管理局颁发的生产文号。
这是全球第一个专门用于治疗原发性肝癌的单抗导向同住素药物,也是我国具有自主知识产权的抗体类药物。
据这一新药的主要研制者、第四军医大学教授细胞工程中心主任陈志南介绍,
【总页数】1页(P65)
【正文语种】中文
【中图分类】R735.7
【相关文献】
1.中国首个抗肝癌单抗导向药物已投入临床使用 [J],
2.全球第一个抗肝癌单抗导向治疗药物 [J],
3.首个抗肝癌单抗导向药物进入临床 [J],
4.第一个抗肝癌单抗导向治疗药物上市 [J],
5.我国研制出全球第一个单抗导向抗肝癌药 [J], 张国民
因版权原因,仅展示原文概要,查看原文内容请购买。
我国首创的抗肝炎国家一类新药“百赛诺”

我国首创的抗肝炎国家一类新药“百赛诺”
本刊编辑部
【期刊名称】《解放军保健医学杂志》
【年(卷),期】2001(3)4
【摘要】百赛诺(通用名:双环醇片)是由我国独立研制开发的国家一类抗肝炎合成新药,经国家卫生部新药审评中心批准,于2001年11月初在全国上市。
该药具有保肝降酶和抗肝炎病毒双重作用的机制。
【总页数】1页(P241-241)
【关键词】中国;抗肝炎药;不良反应;禁忌证
【作者】本刊编辑部
【作者单位】
【正文语种】中文
【中图分类】R975
【相关文献】
1.国家一类抗肝炎新药百赛诺(双环醇片) [J],
2.新产品新技术新工艺:2109.抗肝炎新药百赛诺即将上市 [J],
3.国家一类抗肝炎化学合成新药:—百赛诺 [J], 吴宝健
4.国家一类抗肝炎新药双环醇片(百赛诺(R)) [J],
5.国家一类新药百赛诺Ⅳ期临床结束 [J], 翁吉敏
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ocaliva(obeticholic acid)被美国FDA加快批准治疗原发性胆汁性肝硬化!
FDA宣布加速批准Ocaliva(obeticholic acid,OCA)联合熊去氧胆酸(UDCA)用于UDCA单药治疗应答不佳的原发性胆汁性胆管炎(PBC)成人患者,或单药用于无法耐受UDCA的PBC成人患者。
原发性胆汁性胆管炎(PBC)是一种肝内胆小管渐进性损伤的慢性疾病,主要是因胆管遭到自身免疫性破坏,导致胆汁淤积。
随时间损伤肝细胞,导致肝硬化和肝脏瘢痕形成。
当肝硬化进展和肝中瘢痕组织量增加后,肝脏将丧失其功能。
它主要影响女性,目前是美国女性进行肝脏移植手术的第二大病因。
在欧洲,该病约占胆汁淤积性疾病所致肝移植病例的一半左右,约占所有肝移植病例的6%。
Ocaliva的疗效和安全性监管文件的提交基于一项纳入了216例PBC患者的临床试验。
研究显示,相比于对照组,Ocaliva治疗一年后患者的ALP水平降低。
【概述】
商品名:Ocaliva
英文名:Obeticholic acid;INT-747
中文名:奥贝胆酸片
批准时间:2016年5月31日
用药方式:口服
用药指导:Haoeyou Satellite Clinics,U.S.
购药咨询:好医友远程医疗平台
生产厂家:Intercept公司
作用机理:Obeticholic是FXR,在肝脏和小肠中表达的核受体的激动剂。
FXR 是胆汁酸,炎性,纤维化,和代谢途径的关键调节。
FXR活化由胆固醇以及由胆汁酸增加运输出肝细胞的抑制从头合成降低胆汁酸的细胞内肝细胞浓度。
这些机制限制了循环的胆汁酸池的整体尺寸,同时促进胆汁分泌,从而减少肝脏暴露于胆汁酸。
【适应症】
Ocaliva联合熊去氧胆酸(ursodeoxycholic acid,UDCA)用于对UDCA反应不足的原发性胆汁性胆管炎(以前被称为原发性胆汁性肝硬化,PBC)成人患者,或作为单药疗法用于对UDCA不耐受的原发性胆汁性胆管炎成人患者。
【用法用量】
Ocaliva初始剂量5mg/天,基于临床反应,治疗6个月时逐渐滴定至10mg,有助于降低患者皮肤瘙痒的严重程度和发生率。
【剂型和规格】
片剂:5毫克,10毫克
【禁忌症】
Ocaliva不适用于肠道完全梗阻的患者。
【警告和注意事项】
肝相关的不良反应:监测肝脏生化检查和肝相关的不良反应的发展海拔;权衡继续治疗的益处的潜在风险。
不要每日一次超过10毫克。
调整中度或重度肝功能损害的用量。
严重的瘙痒:管理策略包括增加胆汁酸结合树脂或抗组胺药;Ocaliva剂量减少或中断给药。
减少HDL-C:监测治疗期间血脂水平的变化。
【不良反应】
最常见的不良反应(≥5%)为:皮肤瘙痒,乏力,腹痛等不适,皮疹,口咽部疼痛,头晕,便秘,关节痛,甲状腺功能异常和湿疹。
