土壤总DNA的几种提取方法
土壤DNA提取

1 试验材料吉林省松江河镇人参栽培土壤。
每份土壤样品经多点取样后充分混匀,用前过10 目筛,去除土壤中的须根、枯枝等杂物[2]。
1 .2 仪器设备及药品电子分析天平、恒温水浴锅、紫外凝胶成像系统、电泳槽、电泳仪、高速冷冻离心机、微量加样器、PCR 仪等。
TENP 缓冲液(50 mmol/L Tris,20 mmol/L EDTA,100mmol/L Na Cl,1% PVP,pH 10.0)、CTAB 提取缓冲液(100mmol/L Tris,100 mmol/L EDTA,100 mmol/L Na3PO4,1.5mol/L Na Cl,1%CTAB,pH 8.0)、SDS 提取缓冲液(100 mmol/LTris,50 mmol/L EDTA,50 mmol/L Na Cl,pH8.0,灭菌后加β-巯基乙醇至10 mmol/L)、异丙醇、氯仿、异戊醇、无水乙醇、琼脂糖、EB、Taq DNA 聚合酶、d NTP、6×凝胶上样缓冲液、DNAMarker 等。
主要试剂有十二烷基硫酸钠(SDS)、乙二胺四乙酸(EDTA)、十六烷基三甲基溴化铵(CTAB)、异硫氰酸胍,均为分析纯级。
1 .3 试验方法1.3.1 土壤微生物的洗涤取土壤样品2g,置于50m L 灭菌的离心管中;加入10m L TENP 缓冲液[3]悬浮土样,磁力搅拌器搅拌15 min;10000r/min 离心5min,弃上清,重复洗涤多次至上清基本无色;最后将沉淀收集至1.5ml 离心管中。
1.3.2 DNA 的提取1.3.2.1 CTAB 法按照李钧敏[4]的方法略作改动。
将沉淀重悬于500μl CTAB 提取缓冲液→65℃水浴2h→8000r/min,室温离心15 min,取上清→加入等体积氯仿:异戊醇(24∶1),12,000r/min 离心10 min,取上清→加入0.6 倍体积的异丙醇,4℃淀过夜→12000 r/min 4℃离心20min 收集DNA 沉淀→70%乙醇漂洗两次→干燥后将沉淀溶于100 μl p H 8.0 TE 缓冲液,备用。
土壤dna提取方法

土壤dna提取方法土壤DNA提取是指从土壤样本中获取土壤微生物DNA的过程。
它是研究土壤微生物群落结构和功能的关键步骤之一。
土壤微生物是土壤生态系统的重要组成部分,对土壤养分循环、生物地球化学循环和土壤质量具有重要影响。
因此,研究土壤微生物DNA有助于深入了解土壤生态系统的功能和稳定性。
土壤DNA提取方法可以根据不同的研究目的选择不同的方法。
下面我将介绍几种常用的土壤DNA提取方法。
1. CTAB法:CTAB(十六烷基三甲基溴化铵)法是最经典的土壤DNA提取方法之一。
它的原理是利用CTAB与DNA形成离子对,离子对会与蛋白质、多糖等溶于水的杂质结合,然后通过离心去除杂质,最后用溶剂将DNA沉淀下来。
这种方法的优点是提取得到的DNA质量较高,适用于较小的土壤样本。
但是,它的缺点是操作步骤繁琐,耗时长。
2. 磁珠法:磁珠法是一种常用的高通量土壤DNA提取方法。
它利用表面带电的磁珠与DNA结合,通过磁场将DNA捕获在磁珠上,然后用洗涤缓冲液去除杂质,最后用洗脱缓冲液将DNA从磁珠上溶解下来。
这种方法的优点是操作简单、快速,适用于大规模样本处理。
然而,提取得到的DNA质量可能较低,因为磁珠结合的特异性可能不如其他方法。
3. 快速法:快速法是一种在提取过程中省去DNA纯化步骤的方法。
其中,一种常用的快速法是表面粘贴法。
该方法通过在提取缓冲液中添加琼脂糖,并将土壤样本与缓冲液充分混合,将DNA留在微粒的表面上,然后通过离心将DNA粘在微粒上,最后用洗涤缓冲液去除杂质。
快速法的优点是操作简单、快速,适用于大规模样本处理。
但是,提取得到的DNA可能带有较多的杂质,对后续分析可能产生影响。
除了上述介绍的几种常用的土壤DNA提取方法外,还有其他一些特殊情况下使用的方法。
例如,对于硅酸盐土壤样品,可以使用硅酸盐法提取DNA;对于高含沙量的土壤样品,可以使用聚乙二醇(PEG)沉淀法提取DNA。
这些方法在不同的研究条件和样品类型下都有着特定的优势。
实验室土壤DNA提取方法

改良CTAB-SDS法1、称取1 g土壤样品,加1ml DNA提取液(0.1 mol/L Tris-Hcl;0.1 mol/L EDTA;0.1 mol/L 磷酸钠;1.5 mol/L Nacl;1%CTAB;pH 8.0,将各种试剂按配置的体积数称量混合即可。
),在漩涡震荡仪上混匀。
2、加入100ul溶菌酶温和37℃裂解30min,液氮冷冻10 min,65℃水浴10 min,反复冻融3次。
3、加入20% SDS缓冲液溶液100µl,65℃水浴2h,每20 min轻轻颠倒几次。
8000 r/min离心10 min,取上清。
4、剩余残渣中再加500µl DNA提取液和100µl SDS 缓冲液,65℃水浴30 min,8000 r/min室温离心10 min,取上清,合并两次的上清液。
5、等体积的氛-氯仿-异戊醇(25:24:1)抽提2至3次(氯仿:异戊醇(24:1)抽提一次),静置10min,12000rpm,10min取上清。
6、加入0.1倍体积的NaAc和0.6倍体积的无水乙醇混匀,4℃沉淀过夜。
7、13000 r/min离心5 min,70%乙醇清洗2次,30µl ddH2O溶解。
8、提取粗DNA在0.6%(1%)的Agrose,70 V(100V)电压下电泳1.5 h(40min)。
注意事项:这个千万不要4℃过夜啊,4℃过夜你会发现很多的絮状悬浮物,我之前犯过类似错误,这个是SDS和高浓度的盐在低温条件下析出来了。
室温放置1-2h就好。
提取土壤微生物总DNA的纯度和浓度检测对提取的土壤微生物总DNA进行琼脂糖凝胶电泳检测,同时采用紫外分光光度计分别测定提取土壤微生物总DNA稀释液在230 nm,260 nm,280 nm处的光密度值。
以OD260/OD280(DNA/蛋白质),OD260/OD230(DNA/腐植酸)比值检测DNA纯度。
DNA浓度=OD260值×50µg/ml×80×DNA 溶液体积/干土质量[68]试剂的配置:1、0.1 mol/L Tris-HclTris(三羟甲基氨基甲烷),Mr = 121.14,称取12.114g Tris溶解900ml的蒸馏水中,加水定容至1000ml。
实验室土壤DNA提取方法

实验室土壤DNA提取方法1.样品收集和处理:首先,选择代表性的土壤样品进行采集。
可以使用一支消毒过的勺子或铲子,在表层土壤(0-10厘米深度)从多个点上采集土壤样品。
将采集的土壤样品放入带有滴涤酒精的消毒塑料袋中,密封并标记。
2.去除有机污染物:将收集的土壤样品放在室温下放置48小时,以除去土壤中的有机污染物。
然后,使用筛网(孔径为2毫米)将土壤样品筛选,以去除大颗粒物。
3.细胞破碎:将筛好的土壤样品放入5毫升的离心管中,加入细胞破碎缓冲液(含有Tris-HCl缓冲液、EDTA、蛋白酶K和SDS),并加入玻璃珠。
用震荡器将土壤样品在高速震荡下破碎数分钟,直至土壤样品完全均质。
4.DNA提取:将土壤样品离心10分钟,以除去残余的土壤颗粒物。
将上清转移到新的离心管中。
加入NaCl和CTAB(cetyltrimethylammonium bromide)缓冲液,并轻轻倒置混匀。
将样品在65摄氏度的水浴中孵育30分钟。
加入异丙醇并轻轻倒置混匀,然后继续孵育5分钟。
用塑料吸管吸取上层的异丙醇溶液,避免吸取到DNA混淆物。
将异丙醇溶液转移至新的离心管中,并加入冷异丙醇,使DNA沉淀。
将离心管放置在-20摄氏度的冰箱中,孵育至少2小时,以沉淀DNA。
使用离心机将混悬液离心10分钟,以将沉淀的DNA分离出来。
去除上清液,并用70%乙醇洗涤DNA沉淀,以去除异丙醇和其他杂质。
将洗涤后的DNA沉淀风干,然后加入含有TE缓冲液(含有Tris-HCl和EDTA)的管中重溶。
对DNA溶液进行浓度和纯度检测,可以使用比色法或分光光度计来确定DNA的浓度和 A260/A280比值。
将DNA溶液储存在-20摄氏度的冰箱中,以便后续分析。
土壤DNA提取具有许多优点,如操作简单、成本低廉,并且可以获得大量的DNA,适用于各种微生物的遗传分析。
然而需要注意的是,土壤样品中存在有机物和多种离子,可能会对DNA提取的效果产生影响,因此在提取过程中需要仔细操作,以确保提取到高质量的DNA。
土壤微生物总DNA提取及其PCR优化

土壤微生物总DNA提取及其PCR优化土壤中的微生物是土壤生态系统中非常重要的组成部分,对于土壤的生物地球化学循环和植物生长起着至关重要的作用。
因此,了解土壤中的微生物群落结构和功能对于研究土壤生态系统和提高农田肥力具有重要意义。
土壤微生物群落分析通常需要进行土壤微生物总DNA的提取,并利用PCR技术对其进行检测和分析。
本文章将介绍土壤微生物总DNA提取的步骤,并对PCR反应进行优化。
1.土壤样品采集:将土壤样品收集到干净的塑料袋中,并尽快将其带回实验室进行处理。
2.土壤样品处理:将土壤样品通过筛网过滤,去除大颗粒物质。
然后,将土壤样品进行均匀混合,以保证提取的土壤微生物样品的代表性。
可以根据具体的研究目的和需求,选择不同的土壤样品处理方法,例如:酶处理、分离培养等。
3.DNA提取:根据所选用的DNA提取试剂盒的说明书,按照其提取方案进行操作。
一般而言,土壤微生物总DNA提取的步骤包括:细胞破碎、蛋白质沉淀、DNA溶解和纯化等步骤。
4. DNA质量检测:提取的土壤微生物总DNA可以通过紫外分光光度计或凝胶电泳等方法进行检测。
常用的DNA浓度检测方法为:通过分光光度计检测DNA的吸光度260 nm/280 nm比值,一般DNA的260 nm/280 nm比值在1.7-1.9之间为纯净的DNA样品。
PCR是一种被广泛应用于土壤微生物群落分析的技术,可以检测和分析微生物群落结构和功能。
下面是PCR反应优化的几个关键步骤:1.引物设计:选择适当的引物对于PCR反应的成功至关重要,引物应能够特异性地扩增所需的目标基因片段。
引物的设计可以根据所研究的微生物基因组序列进行,也可以利用已有的引物库进行。
2.酶和缓冲液优化:PCR反应中酶的选择和相应的缓冲液对于PCR反应的效果有着重要的影响。
可尝试不同品牌和类型的聚合酶和缓冲液,根据实验结果选择最适合的组合。
3.PCR温度参数优化:PCR反应的温度参数也会对PCR反应的效果产生重要影响。
茶园土壤微生物总DNA不同提取方法的比较

茶 园土壤 微生物 总 D A 不 同提取 方法 的 比较 N
胡磊 杨广 尤 民生
福 建 农 林 大 学应 用 生 态 研 究 所 , 州 50 2 福 3 00 通 讯作 者 , y u a . uc mso @0 ue . d n
DOI 1 .9 9 g b 0 90 0 61 : 3 6 / a . 2 .0 3 0
Ab t a t T a i o a s lt n a d c l eme h d o ir b sh sb e u d t a e l tt n e e t g sr c r d t n l o ai n u t t o f c o e a e n f n o h v i ai si r f c i i i o ur m o mi o n l n t ewh l e o n o ma i n o i m ir b si e ln a i n n a e b e r d a l e l c d b l c lr h o e g n me i f r t f o l c o e n t ap a t t sa d h v e n g a u l r p a e y mo e u a o s o y
D NA提 取 方法 。 关键 词 茶园, 土壤 微生 物, 子生 态学 , A 提取 分 DN
Co mpa io fDif r n rs n o fe e tDNA ta to e h d o o l ir b si a Ex r ci n M t o sf rS i M c o e n Te
e o o y m eho s c l g t d ,mo e v r he h g uaiy a g a m e n n a e r o e ,t i h q l ,lr e f g nta d u bi s d DNA r h m p ra tba i 0 h t r a e t e i o t n ss f r t e su n s lmi r be n t a p a t to s a h t dy o oi c o si e l n a i n tt e molc a e e .I t spa r we a ptd fv e ulr lv 1 n hi pe do e e DNA xta to i e r ci n
实验室土壤DNA提取方法

实验室土壤DNA提取方法实验室土壤DNA提取方法是一种用于从土壤中提取DNA样品的技术。
这是一项重要的技术,因为土壤中的DNA可以提供有关土壤生物多样性、微生物群落结构和功能以及植物和动物遗传信息的重要信息。
下面将介绍一种常见的实验室土壤DNA提取方法。
1.样品预处理:-收集土壤样品,并尽可能在采样后尽快进行处理,以防止DNA的降解。
-选择一个代表性的土壤样品,并将其通过筛网去除大颗粒物质。
-将筛选后的土壤样品以适当的方式保存,通常可以在低温下冷冻保存。
2.细胞破碎:- 将约10克的土壤样品加入到一根离心管中,加入适量的细胞破碎缓冲液,如Tris-EDTA缓冲液。
-使用搅拌器或振荡器将样品彻底混合,以确保土壤颗粒和细胞完全被破碎。
-将混合后的样品通过离心将颗粒物质沉淀在底部,上清液转移到新的离心管中。
3.DNA纯化:-使用商业化的DNA提取试剂盒,按照厂家说明书的指导进行操作。
这些试剂盒通常包含各种缓冲液、酶和柱子等,可以高效地提取DNA。
-将上清液转移到新的离心管中,并加入适量的蛋白酶和蛋白酶K,以去除样品中的蛋白质。
-加入适量的盐溶液,以沉淀DNA。
沉淀后,使用吸管将上清液抽走。
- 将DNA沉淀物重新悬浮在适量的缓冲液中,如TE缓冲液(10 mM Tris-HCl,1 mM EDTA,pH 8.0)。
4.DNA质量和浓度检测:-使用紫外-可见分光光度计测量DNA的浓度和纯度。
纯度可以通过A260/A280比值来评估,纯度范围在1.8-2.0之间较为理想。
-可以使用琼脂糖凝胶电泳等方法来检测DNA的大小和完整性。
需要注意的是,不同类型的土壤样品可能需要稍微不同的处理方法。
例如,含有高浓度有机物的土壤可能需要额外的酶处理步骤,以去除有机物的干扰。
此外,一些土壤样品可能需要通过使用特殊试剂或方法来克服DNA提取中的抑制剂。
总的来说,实验室土壤DNA提取方法是一项复杂的技术,需要仔细操作和优化。
通过正确地执行这些步骤,可以成功地从土壤样品中提取高质量的DNA,并为后续的分子生物学研究提供可靠的样品。
总DNA提取(蛋白酶K法)

改进蛋白酶K法提取环境微生物样品总DNA(Zhu S)
所需试剂:
0.15M NaCl
0.1M EDTA
1% SDS
NaAc (3M, pH 5.2)
蛋白酶K溶液20mg/ml (用无菌水配制)
溶菌酶溶液50mg/ml (用无菌水配制)
液氮
实验步骤:
(1)将适量环境样品(如土壤或污泥)装入1.5 ml Eppendorf管;
(2)加入1 ml 0.15M NaCl-0.1M EDTA;
(3)加入溶菌酶(sigma)至终浓度为2mg/ml并置于37℃水浴中温育1h;
(4)冻融三个循环(液氮3 min-65℃干热器3min);
(5)分别加入蛋白酶K溶液和SDS至终浓度为0.02和0.5%(wt / vol每一百ml 溶
液中溶质克数),65℃温育1h;
(6)裂解液依次用等体积的酚、酚-氯仿-异戊醇(25:24:1)、氯仿抽提;
(7)加入1/4体积的NaAc (3M, pH 5.2)和2体积冷的纯乙醇沉淀核酸;-20℃放
置1h;
(8)离心收集12000prm,10min,回收DNA沉淀;
(9)DNA沉淀用70%乙醇和无水乙醇洗涤后风干;
(10)每管加入30-50ulTE(Tris-HCl缓冲液)回溶及电泳检测,-20℃保存。
注:这种方法比较适合提取土壤环境微生物样品的总DNA。
因为本法没有利用机械力量破碎细胞,因而所提取到的总DNA受机械剪切的程度较少,故用这种方法提出的DNA进行PCR扩增,其产物通常含有较少的嵌合体(chimera)。
土壤中总DNA的提取(手提法)
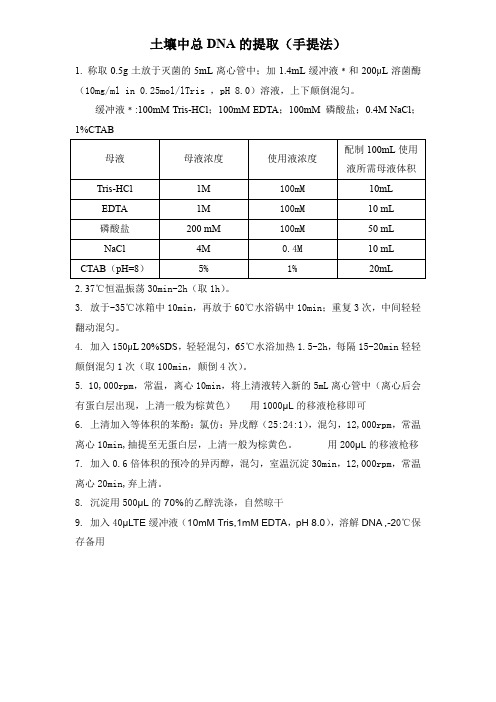
土壤中总DNA的提取(手提法)
1. 称取0.5g土放于灭菌的5mL离心管中;加1.4mL缓冲液﹡和200μL溶菌酶(10mg/ml in 0.25mol/lTris ,pH 8.0)溶液,上下颠倒混匀。
缓冲液﹡:100mM Tris-HCl;100mM EDTA;100mM 磷酸盐;0.4M NaCl;1%CTAB
2. 37℃恒温振荡30min-2h(取1h)。
3. 放于-35℃冰箱中10min,再放于60℃水浴锅中10min;重复3次,中间轻轻翻动混匀。
4. 加入150μL 20%SDS,轻轻混匀,65℃水浴加热1.5-2h,每隔15-20min轻轻颠倒混匀1次(取100min,颠倒4次)。
5. 10,000rpm,常温,离心10min,将上清液转入新的5mL离心管中(离心后会有蛋白层出现,上清一般为棕黄色)用1000μL的移液枪移即可
6. 上清加入等体积的苯酚:氯仿:异戊醇(25:24:1),混匀,12,000rpm,常温离心10min,抽提至无蛋白层,上清一般为棕黄色。
用200μL的移液枪移
7. 加入0.6倍体积的预冷的异丙醇,混匀,室温沉淀30min,12,000rpm,常温离心20min,弃上清。
8. 沉淀用500μL的70%的乙醇洗涤,自然晾干
9. 加入40μLTE缓冲液(10mM Tris,1mM EDTA,pH 8.0),溶解DNA ,-20℃保存备用。
不同环境中土壤微生物总DNA的提取与纯化

simi ora i s vr 3 1k s to . h N mon n ui f iee tol cora i ee ol c ogns wa o e 2 . bb t hd T eD A a u t dpr yo f rn im rogns w r r s m y h me i a t df s i ms
cora i g a fr t a g et Th rd xrce NA o im c ogns sp ri hn l ro ns i o i loe s h h h . ecu eet t D f ol r rai wa u f b p eo g s m nr n s w t i s i e ad s o i s m ie y d —
1S D 6 rNA基 因 的 引物 可 以扩 增 到 相 应 的片 段 。 关 键 词 :D ; 壤 微 生 物 ; NA提 取 ; C 扩 增 S S土 D PR
中图分类号 :14 3 ¥ 5 .4
文献标识码 : A
文章编号 :0 2—8 6 (0 8 0 —0 1 —0 10 1 12 0 ) 1 0 2 5
d fe e t h x r ce i r n ,t e ta t DNA mo n s 5 5 — 7 9 g p rg a d y s i, d t e e ta t f e d a u twa 3. 5 5 9. 3 t r m r o la h x r ce DNA mo n f o l n — z e n d a u t iri o s
2 中国热带农 业科 学院环境与植 物保护研究所 , 海南儋 州 5 13 ) . 7 7 7
摘要 : 采用 S S高盐缓冲液抽 提法提取 了林地 、 区 、 D 厂 菜地 3种不 同环境 中土壤微 生物总 D A, N 结果表 明 , 该方 法可以从 土壤 微生物 中提取 到长度 大于 2 .k 3 1b的 D A; 同环境 中提取 的 DN N 不 A产量和纯度 都存在 一定 的差异 , 每克干土 的 D A提取量介于 5 .5 7 .3 g之间 , 中以处于原始状态 的丛林提取量最高 。粗提 的土壤微 生物 N 3 5 ~5 99 其 D A采 用酚氯仿 和柱 式 腐 殖 酸 去 除 剂 进 行 纯 化 , 化 后 的 土 壤 微 生 物 D A 可 以用 于 P R扩 增 , 用 细 菌 N 纯 N C 使
不同环境中土壤微生物总DNA的提取与纯化

收稿日期:2007210201基金项目:中央公益性科研院所基本科研业务专项(2007hzslJ011)作者简介:吴红萍(19822),男,江西萍乡人,硕士研究生,研究方向为资源微生物开发和利用。
3为通讯作者。
不同环境中土壤微生物总DNA 的提取与纯化吴红萍1, 郑服丛23(11海南大学环境与植物保护学院, 海南儋州 571737;21中国热带农业科学院环境与植物保护研究所, 海南儋州 571737) 摘要:采用SDS 高盐缓冲液抽提法提取了林地、厂区、菜地3种不同环境中土壤微生物总DNA ,结果表明,该方法可以从土壤微生物中提取到长度大于2311kb 的DNA ;不同环境中提取的DNA 产量和纯度都存在一定的差异,每克干土的DNA 提取量介于53155~579193μg 之间,其中以处于原始状态的丛林提取量最高。
粗提的土壤微生物DNA 采用酚氯仿和柱式腐殖酸去除剂进行纯化,纯化后的土壤微生物DNA 可以用于PCR 扩增,使用细菌16SrDNA 基因的引物可以扩增到相应的片段。
关键词:SDS ;土壤微生物;DNA 提取;PCR 扩增中图分类号:S154134 文献标识码:A 文章编号:1002-8161(2008)01-0012-05Extraction and purif ication of total D NA of soilmicroorganisms in different environmentsWU Hong 2ping 1,ZHEN G Fu 2cong 23(11College of Environment and Plant Protection ,Hainan U niversity ,Danz hou ,Hainan 571737,China ; 21Environment and Plant Protection Institute ,Chinese Academy ofT ropical A gricultural Sciences ,Danz hou ,Hainan 571737,China )Abstract :In this experiment ,the total DNA of soil microorganisms from forest land ,factory area and vegetable plot were extracted by high salt buffer solution of SDS extraction method 1The results showed that the extracted DNA length of soil microorganisms was over 2311kb by this method 1The DNA amount and purity of different soil microorganisms were different ,the extracted DNA amount was 531552579193μg per gram dry soil ,and the extracted DNA amount of soil mi 2croorganisms in original forest was the highest 1The crude extracted DNA of soil microorganisms was purified by phenol 2chloroform and column humic acid ,then purified DNA could be used as templates for PCR amplification ,and corresponding fragments could be amplified by using primers of bacterial 16S rDNA gene 1K ey w ord :SDS ;soil microorganisms ;DNA extraction ;PCR amplification 土壤是微生物的大本营,土壤微生物在生物地球化学循环中扮演着非常重要的角色,对地表生态系统乃至全球都存在重要影响。
土壤总DNA的几种提取方法

土壤总DNA的几种提取方法1.CTAB法CTAB法是一种常用的土壤总DNA提取方法。
该方法使用CTAB(十六烷基三甲基溴化铵)缓冲液,可以有效去除土壤中的蛋白质、多糖和有机酸等干扰物质。
首先将土壤样品与CTAB缓冲液混合,然后进行细胞破碎、去蛋白、去RNA等步骤,最后通过苯酚-氯仿提取和酒精沉淀来纯化土壤DNA。
2.醋酸盐法醋酸盐法是一种简单、快速的土壤DNA提取方法。
该方法通过醋酸盐缓冲液以及Tween 20和SDS等表面活性剂,可以迅速裂解土壤颗粒并去除蛋白质、多糖等杂质。
该方法的优点是操作简单、提取时间短,适用于大批量样品。
3.快速CTAB法快速CTAB法是对传统CTAB法的改进。
该方法中加入Na2EDTA可以有效去除DNA上的脱氧核酸酶,从而保护土壤DNA的完整性。
与传统CTAB法相比,快速CTAB法可以在较短的时间内提取优质土壤DNA。
4.商业化土壤DNA提取试剂盒近年来,越来越多的商业化土壤DNA提取试剂盒被开发出来。
这些试剂盒对土壤样品进行了优化处理,可以快速、高效地提取土壤总DNA。
商业化试剂盒通常使用快速离心和滤膜等技术,可提高DNA的纯度和产量,并且操作简单,适用于初学者和大批量样品处理。
5.玻璃珠法玻璃珠法是一种机械破碎法,适用于多样品同时提取。
该方法先将土壤样品与玻璃珠放在试管中,通过震荡破碎方式将细菌和DNA释放出来。
然后通过离心和滤膜等步骤来纯化土壤DNA。
6.CTAB-SDS混合法CTAB-SDS混合法是结合了CTAB法和SDS(十二烷基硫酸钠)法的优点的土壤DNA提取方法。
CTAB-SDS混合法使用CTAB缓冲液同时包含CTAB 和SDS两种表面活性剂,在去除蛋白质的同时也可以有效裂解囊泡等难以破碎的结构,提高土壤DNA的纯度和产量。
总之,土壤总DNA的提取方法有很多种,选择适合的提取方法需要考虑土壤样品的特性、实验目的以及实验室设备和经验等因素。
同时,为了保证提取的DNA质量,需要注意样品的保存和处理过程中的卫生和无菌操作。
土壤dna提取原理

土壤dna提取原理
土壤DNA提取是一种用于提取土壤中的DNA分子的技术。
它主要基于以下原理:
1. 细胞破碎:首先,土壤样品需要经过细胞破碎步骤,以使细胞膜破裂,使DNA能够被释放出来。
这可以通过物理或化学
方法进行,如震荡、振荡或使用酶解剂。
2. DNA纯化:一旦DNA释放,必须通过纯化步骤来去除其他的污染物,如蛋白质、RNA等。
这通常通过DNA的亲合性纯化或使用离心、过滤等方法来实现。
3. DNA溶解:在纯化步骤之后,DNA通常以溶液的形式存在。
这是为了方便后续的DNA分析,如PCR反应等。
4. DNA浓缩:土壤样品中的DNA通常量很低,因此在分析之前需要进行浓缩。
这可以通过吸附于胶体粒子上或使用商业化的DNA浓缩试剂盒来实现。
5. DNA保存:最后,提取的土壤DNA需要妥善保存以防止降解。
在-20°C或更低的温度下存储,并使用RNA酶抑制剂、
抗氧化剂等添加剂来保护DNA的完整性。
通过以上步骤,可以成功地提取出土壤样品中的DNA,并用
于后续的分子生物学研究,如环境监测、物种鉴定等。
土壤DNA提取方法汇总

碱液加热煮沸法(Direct Cellular Lysis/Protein Extraction Protocol for Soil)1、称取3g(可根据实际情况,按比例增减土样的用量)新鲜土样(采集后放于-4℃保存,一周内用于DNA提取),装于50ml离心管中,然后向装有土壤样品离心管中加入37℃预热的10mlDNA提取液(100mmol/LTris[pH8.0],100mmol/L disodium EDTA,200mmol/L NaCl,2%[W/V] PVP,2%[W/V] CTAB,2%巯基乙醇[V/V],6mg/ml溶菌酶)(1 2)2、漩涡振荡混匀,然后再37℃下水浴40min,水浴期间,每隔10分钟左右,混匀样品;3、水浴结束后,加入10ml SDS buffer(100mmol/L Tris [pH 8.0],100mmol/L EDTA,200mmol/L NaCl,2%[W/V] SDS,160ug/ml的蛋白激酶K),65℃水浴1.5h,每隔20min上下颠倒混匀一次,注意不要剧烈的震荡,以免DNA断裂;4、室温下,6000g离心10分钟,收集上清液;5、按上述方法再将土样残渣抽提一次(重复2、3、4,提取液由10ml变为6ml),合并上清液;(以上步骤为细胞的裂解以及蛋白质、脂类以及腐植酸等杂质的去除)6、在上清液中加入等体积的苯酚/氯仿/异戊醇(25:24:1)(去蛋白质以及直链淀粉),颠倒混匀放置10min,16000g 18℃离心20min,收集水相;7、再加入等体积的氯仿/异戊醇(24:1),抽提一次,颠倒混匀放置10min,16000g 18℃离心20min,收集水相;8、用加入0.6倍体积的预冷(-20℃)异丙醇和0.1倍体积的3M醋酸钠(pH5.2)室温沉淀1-2h(到有白色沉淀出现),16000g 25℃离心20min,弃上清液;9、用75%乙醇漂洗2-3次,真空干燥或者是冷冻干燥,或者是室温自然干燥,加dd水或者是TE缓冲液重悬浮(体积为100-500ul,根据DNA的量决定),备用(或者是根据实验需要过DNA纯化柱)。
土壤DNA的提取方法

1直接法提取DNA直接法提取DNA的步骤如下:1)取1 g土样,倒入灭菌的50mL离心管中;2)加入10 mL TENPP缓冲液(20 mmol/L EDTA, 50 mmol/L Tris, 1% PVPP, 100 mmol/L NaCl,pH 10.0)用振荡仪振荡数分钟,使土样悬浮并充分混匀;3)10 000 r/min离心5 min,弃上清,重复洗涤3-5次,至上清基本无色;4)加入 5 mL PBS缓冲液(2.7 mmol/L KCl, 100 mmol/L NaCl, 2 mmol/L KH2PO4,10 mmol/L Na2HPO4, pH 7.4)漂洗,10 000 r/min离心5 min,弃上清,;5)加入13.5 mL DNA提取缓冲液(100 mmol/L Tris, 100 mmol/L EDTA, 100 mmol/L Na3PO4, 1.5 M NaCl, 1%CTAB, pH 8.0),混匀后液氮反复冻溶3次,加入100 μL蛋白酶K(25 mg/mL)和200 μL溶菌酶(50 mg/mL, pH 8. 0),37℃水浴30 min,期间颠倒混匀3次;6)加入2 mL 20% SDS,65℃水浴2 h,期间颠倒混匀5-6次;7)8 000 r/min室温15 min,取上清至新管;8)用等体积氯仿:异戊醇(24:1)抽提,吸出水层,加入0.6倍体积的异丙醇,4℃沉淀1 h或更长;9)11 000 r/min 4℃离心20 min,沉淀DNA;10)去上清,用70%乙醇漂洗,11 000 r/min 4℃离心5 min,并重复漂洗1次,置于超净工作台吹干;11)干燥后,用100 μL ddH2O(含RNAse 20 mg/mL)溶解,转入1.5 mL离心管,37℃放置30 min,置于-20℃冰箱中保存。
2间接法提DNA间接法提取土壤DNA所用介质为Nycodenz,密度梯度离心,步骤如下:1) 称取1 g土样,倒入已灭菌的50 mL离心管中;2) 加入15 mL预冷无菌蒸馏水,并涡旋混匀;3) 将10 mL Nycodenz(8 g Nycodenz溶于10 mL灭菌蒸馏水,稍加热便于溶解)小心泵入土壤悬浮液底部,4℃,11 000 r/min离心30 min;4) 小心收集在下层Nycodenz-土壤颗粒与上层水层分界面显白色的微生物细胞层(吸到上层水层对结果没有影响)至新管;5) 提取DNA按照1.2.1直接法提取DNA第5-11个步骤。
土壤微生物总DNA测定

实验概要通过对比不同DNA提取及纯化方法,选择和优化适合于土壤样品不同分子量DNA提取及纯化的技术路线。
实验原理土壤是微生物最大的栖息地,20世纪80年代,微生物学家采用免培养(culture-in-dependent)方法,即直接从土壤中提取微生物总DNA的技术,使得在基因水平研究这些未培养微生物的存在、群落结构和功能等情况成为可能。
从环境样品中直接提取和纯化微生物总DNA是在分子水平上研究未培养微生物基因资源的关键。
从环境样品中提取核酸通常有两种方法:直接裂解法(也称为原位裂解法)和间接裂解法(也称为异位裂解法)。
直接裂解法是先在原位将细胞裂解后直接从土壤样品中提取DNA。
间接裂解法是先把细菌细胞和土壤颗粒分开,然后裂解细胞,提取DNA,最后进行纯化。
就DNA产量、分子操作所需要的DNA纯度和微生物多样性的代表性而言,两种方法各有优缺点。
主要试剂DNA提取缓冲液(100 mmol/L Tris, 100 mmol/L EDTA, 100 mmol/L Na3PO4, 1.5 M NaCl, 1%CTAB, pH 8.0)蛋白酶K(25 mg/mL)溶菌酶(50 mg/mL, pH 8. 0)20% SDS氯仿:异戊醇(24:1)异丙醇70%乙醇RNAse 20 mg/mLTENP缓冲液(50 mmol/L Tris, 20 mmol/L EDTA, 100 mmol/L NaCl, 1% PVP, pH 10.0)Nycodenz(Axis-Shield, Oslo, Norway;8 g Nycodenz溶于10 mL灭菌蒸馏水)主要设备50mL和1.5 mL离心管水浴锅高速离心机涡旋器实验材料土壤样品实验步骤1. 直接法(1) 称取1 g土壤样品,置于50 mL灭菌的离心管中;(2) 加入13.5 mL DNA提取缓冲液(100 mmol/L Tris, 100 mmol/L EDTA, 100 mmol/L Na3PO4, 1.5 M NaCl, 1%CTAB, pH 8.0),混匀后加入100 μL蛋白酶K(25 mg/mL)和200 μL溶菌酶(50 mg/mL, pH 8. 0),37℃水浴30 min,每隔10 min颠倒混匀;(3) 加入2 mL 20% SDS,65℃水浴2 h,每隔20 min颠倒混匀;(4) 8 000 r/min室温离心15 min,取上清,用等体积氯仿:异戊醇(24:1)抽提一次;(5) 水相中加入0.6倍体积的异丙醇,4℃沉淀过夜;(6) 11 000 r/min 4℃离心20 min收集DNA沉淀;(7) 70%乙醇漂洗两次,干燥后用100 μL ddH2O(含RNAse 20 mg/mL)溶解,转入1.5 mL 离心管。
四种提取土壤DNA的方法

OMEGA试剂盒法1称取500mg玻璃珠于15ml离心管中,加入0.2-0.5g土壤样品。
加1ml Buffer SLX Mlus,以最大转速涡旋震荡3-5min,以溶解土样。
2.加入100µl Buffer DS,震荡混匀。
3.70o C水浴10min,水浴过程中,轻轻震荡。
4.于室温离心(3000rpm)3min,上清吸取800µl至2ml离心管,加入270µl Buffer SP2,充分震荡混匀。
5.冰浴5min, 4o C、12000rpm离心5min。
6.小心将上清移至新的2ml离心管中,加入0.7倍体积异丙醇,反复颠倒混匀(轻轻地20-30次),于室温放置30min。
7.4o C、12000rpm离心10min,以沉淀DNA。
8.弃上清,确保不将DNA团块倒掉,将管口至于卫生纸上1min,以流干液体。
9.加入200µl Elution Buffer于管内,轻轻震荡10s。
10.加入50-100µl HTR Reagent ,轻轻震荡10S。
11.室温放置2min,12000rpm离心2min。
12.将上清移至新的离心管中,加入等体积XP2 Buffer,轻轻震荡混匀。
13.将上一步中的样品转移到插有柱子的收集管中,10000rpm室温离心1min,弃上清。
14.加入300µl XP2 Buffer, 10000rpm离心2min,弃收集管。
15.将柱子插入新的收集管,加入700µl SPW Wash Buffer(提前用无水乙醇配好), 10000rpm离心1min,弃上清。
16.重复上一步。
17.弃液体,12000rpm室温离心2min。
18.将柱子插入新的离心管中,加入30-50µl Elution Buffer于柱子中央,65o C水浴10-15min。
19.12000rpm离心1min,洗脱DNA,洗脱液保留。
土壤DNA的提取方法

土壤DNA的提取方法1.CTAB法CTAB(正十六烷基三甲基溴化铵)法是最常用的土壤DNA提取方法之一,其基本步骤如下:(1) 取约10 g土壤样品,加入30 ml预先加热的CTAB提取液(CTAB、Tris-HCl缓冲液、EDTA、NaCl和β-巯基乙醇)。
(2) 将混合物在50°C水浴中孵育1小时,然后加入1.5 ml氯仿混合均匀,并离心10分钟。
(3)将上清转移到新离心管中,加入等体积的异丙醇混合均匀,然后离心10分钟。
(4)弃去上清,加入70%乙醇洗涤两次,离心10分钟,弃去上清后干燥沉淀。
(5)加入适量TE缓冲液重溶沉淀,取一小部分进行质检,其余分装入冻存管中保存。
2.快速提取法快速提取法是一种简化了传统CTAB法的土壤DNA提取方法,其基本步骤如下:(1) 取约2 g土壤样品,加入适量的提取缓冲液(包含Tris-HCL缓冲液、SDS、pH调节剂等)。
(2)将混合物在65°C水浴中孵育一定时间,加入异丙醇与沉淀。
(3)将混合物离心,弃去上清,加入70%乙醇洗涤,离心后弃去上清并干燥沉淀。
(4)加入TE缓冲液重溶沉淀,分装入冻存管中保存。
3.商用DNA提取试剂盒法商用DNA提取试剂盒法是一种简单、快速的土壤DNA提取方法,市面上有很多品牌可供选择。
通常的操作步骤如下:(1)取约0.5g土壤样品,加入适量的提取试剂缓冲液,根据试剂盒说明进行操作。
缓冲液中的成分通常包括维持DNA稳定性的蛋白酶抑制剂、表面活性剂和助提剂等。
(2)混合物经过一系列离心、洗涤和干燥步骤,最后加入适量的重溶缓冲液溶解DNA,并进行后续的质检和保存。
除了上述方法外,还有其他一些改进的土壤DNA提取方法被用于特定的研究需求,例如使用聚乙二醇(PEG)提取法、硅胶凝胶膜提示法等。
此外,在土壤DNA提取的过程中需要注意以下几点:-样品收集时应保持无污染状态,避免外源性DNA的污染。
-所选的DNA提取方法要符合研究需求,例如提取总DNA或特定微生物群体的DNA。
土壤DNA和植物DNA提取方法

现在主要的提取方法有:氯仿异戊醇抽提法、离心柱试剂盒法和磁珠法。
其中磁珠法作为一种新型核酸提取法,相较于传统方法来说优势明显:(1)生物磁珠具有小尺寸效应和表面效应,能够高效提取DNA;(2)磁珠表面能够进行化学修饰,从而与DNA进行特异性吸附;(3)磁珠法用时少,操作简单,且对环境无污染。
一、提取难点要想在土壤和植物中提取DNA,样本的液化是关键的一步,像土壤和植物都是固体样本,很难直接在试剂盒的作用下用于核酸提取。
提取过程中固体样本会跟杂质一样,严重阻碍磁珠吸附核酸,并且损耗大量的磁珠位点,很难取得良好的提取效果。
所以,在土壤和植物DNA 提取时,要对样本进行预处理。
土壤的预处理首先需要浸泡,必要时可以进行水浴,因为从土壤中提取DNA并非提取土壤本身,而是提取土壤中存在的微生物DNA。
然后在样本中加入氧化锆-二氧化硅微珠和缓冲液,接着对其进行离心,取上清液即可用于进一步提取。
在植物中提取DNA时,需要剪取适量样本,对其进行研磨。
研磨时如果需要保护RNA,可以采用液氮研磨的方式。
如果不需要提取RNA,也可以加入裂解液或者生理盐水帮助研磨成匀浆状态,如果所得匀浆较为浑浊,可对其进行适当离心处理,取上清液即可用于进一步提取。
二、磁珠法提取试剂盒[MISSING IMAGE: , ]【图:使用朗司土壤试剂盒提取4种土壤样本的电泳结果】【图:使用朗司植物试剂盒提取叶片(50mg)总DNA的电泳结果,S1-S16为重复实验】三、磁珠法核酸提取仪(16通量)结合磁珠法核酸纯化技术,配合公司自主研发的16通量LemnisCare MGX-1600全自动核酸提取仪,可以完成目标核酸的自动提取,更加安全可靠,大大节省科研人员操作的同时,得到高纯度的土壤和植物DNA。
经测试,MGX-1600提纯灵敏度表现优秀,102拷贝/mL样品的阳性检出率>95%。
以下是主要技术参数:。
土壤dna提取方法

土壤dna提取方法土壤DNA提取是分子生物学研究和环境微生物学研究中的重要步骤,可以帮助我们了解土壤微生物的多样性和功能。
下面我将详细介绍几种常用的土壤DNA 提取方法。
1. 酚类方法酚类方法是最早采用的土壤DNA提取方法之一。
它利用酚和氯仿等有机试剂,通过物理和化学作用将细胞膜破裂,释放出DNA。
这种方法简单易行,但提取的DNA质量可能较差。
此外,酚类方法需要大量有害的有机溶剂,对环境和操作人员有潜在的危害。
2. 商业提取试剂盒方法随着分子生物学技术的进步,商业化的土壤DNA提取试剂盒逐渐出现。
这些试剂盒通常包含缓冲液、蛋白酶和柱式离心管等。
这种方法操作简单,操作时间短,并具有更高的DNA提取质量和稳定性。
而且,这些试剂盒被广泛应用于土壤微生物群落结构和功能的研究中。
3. 超声波方法超声波方法是利用超声波的机械震荡作用使细胞壁破裂,释放DNA。
这种方法操作简单,提取时间短,不需要有机试剂,且适用于多种土壤类型。
然而,超声波提取的DNA可能存在碎片化和氧化的问题。
此外,超声波震荡也可能导致DNA的降解。
4. 磁珠法磁珠法是一种新兴的土壤DNA提取方法。
它利用磁珠表面特异性的修饰物(如硅烷基或羧基)与DNA结合,然后通过磁力作用将DNA与其他成分分离。
这种方法有效地提取高质量的DNA,且可以通过调节磁珠表面的化学修饰来选择性地富集目标DNA。
磁珠法具有高效、高灵敏度和高特异性的特点,是目前土壤DNA提取的研究热点之一。
总结起来,土壤DNA提取方法种类繁多,每种方法都有其优缺点。
在选择合适的方法时,需要考虑实验目的、样本特性、实验设备和实验操作的复杂程度等多个因素。
此外,不同土壤样品可能需要不同的提取方法进行优化和比较,以获得高质量的土壤DNA。
因此,在进行土壤DNA提取实验时,我们应该结合实际情况选择合适的方法,并进行充分的前期准备、优化和实验控制,以确保提取到高质量、高纯度的土壤DNA。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
土壤总DNA的几种提取方法
SDS 高盐法(方案1)
具体步骤:
称取1 g 土壤,放入研钵中,倒入适量的液氮,立即研磨;再倒入适量的液氮,研磨,重复3 次,使土壤颗粒研成粉末;
将13.5 ml 提取缓冲液(0.1 mol/L磷酸盐[pH = 8.0 ] ,0.1 mol/L EDTA [pH 8.0 ] ,0.1 mol/L Tris-HCl [pH 8.0 ] ,1.5 mol/L NaCl ,1.0 % CTAB) 和50μl 蛋白酶K(10 g/L ) 与5 g 土壤置于50 ml 的离心管中,放入37 ℃恒温摇床上,225 r·min - 1振荡30 min ;
加入1.5 ml20 % SDS ,轻轻混匀,65 ℃水浴加热2 h ,每隔15~30 min 轻轻摇匀1 次;5 000 r·min - 1离心10 min ,将上清液转入新的50 ml 离心管中;取4.5 ml 提取缓冲液加入原离心管,摇匀泥浆,加入0.5 ml 20 % SDS ,65 ℃水浴15 min ,用上述同样的离心速度离心10 min ,将上清液与原上清液合并;再重复此步骤1 次;
用与上清液等量的三氯甲烷于离心管中混匀,5000 r·min - 1离心20 min ;收集上清液,并加入0.6 倍体积的异丙醇,室温静置1 h ;25 ℃下12 000 r·min - 1离心20 min ,倒出上清液,干燥后加入500μl 去离子水,溶解粘附于离心管壁的DNA 及其杂质,并收集于1.5 ml 的微型离心管中.
变性剂加SDS 高盐法(方案2)
具体步骤:
取1 g 土样和等量的灭菌石英砂在研钵中混合,加入1 ml 变性剂(4 mol/L异硫青酸胍,10mmol/L Tris-HCl [pH 7.0 ] ,1 mmol/L EDTA[pH 8.0 ] ,0.5 % 2-巯基乙醇) ;液氮冰冻,研磨至溶解,重复3 次;
转入50 ml 离心管中,加入9 ml 提取缓冲液(0.1 mol/L磷酸钠[pH 7.0 ] , Tris-HCl [ pH 7.0 ] , 0.1 mol /L EDTA [ pH8.0 ] ,1.5 mol/L NaCl ,1 %CTAB ,2 %SDS) ;65 ℃水浴1 h ,每10 min 轻轻混匀1 次;5 000 r·min - 1 离心10 min ,取上清;
在原管中加入5 ml 提取缓冲液,混合后,65 ℃水浴10min ,离心,取上清,合入上述上清液;重复一次;加入等体积的氯仿混合,5 000 r·min - 1离心20 min ,取上清;加入0.6 倍体积的异丙醇,室温沉淀1 h ;20~25 ℃,12 000 r·min - 1离心20 min ,TE 溶解沉淀.
SDS-酚氯仿抽提法(方案3)
称取1g土壤样品,加入1ml 0.1mol/l PH8.0 磷酸缓冲液,玻璃珠振荡1min。
溶菌酶5mg,使终浓度为 2.5mg/ml,室温振荡15min,放置冰箱30min,加125ul 20%SDS振荡处理15min,离心,分装EP管,加酚(1:1体积),抽提1次,氯仿-异戊醇(1:1体积),抽提2次,加0.6体积异丙醇,室温放置1h,离心,70%乙醇清洗,200Ul TE 溶解。
冻融溶菌酶SDS裂解法(方案4)
取1g土壤样品,加如0.5ml灭菌的抽提缓冲液(100 mmol/L Tris-HCl , 100 mmol/L EDTA, 200 mmol/L NaCl, 1.0% PVP, 2.0%CTAB , PH8.0), 加玻
璃珠旋涡5~10 min,在液氮中冷却1 min后迅速在沸水中煮2 min,如此重复3次,13 000r/min离心10 min。
上清夜快速置于冰上备用,沉淀用于进一步裂解。
将上述沉淀悬浮于0.2ml提取缓冲液中,旋涡10min,加入溶菌酶(100ml/l)50ul,轻轻混匀后,37C温浴30min,再加入250ul SDS 缓冲液(100 mmol/l Tris-HCl, 200 mmol/l NaCl,2.0% SDS, PH8.0),上下颠倒10min,13000 r/min离心10min,收集上清夜。
二、DNA纯化
葡聚糖-200凝胶G离心层析纯化
取2ml灭过菌的一次性塑料注射器,用注射器推杆将灭过菌的玻璃棉推到注射器筒底部,使其厚度约为0.5cm,然后向注射器筒中加入TE缓冲液浸透的葡聚糖凝胶G-200,制成简式离心层析柱,再置于10ml的离心管中,于高速冷冻离心机上以3000r/min离心20min,去除葡聚糖凝胶G-200中的TE缓冲液,将离心层析柱再置于另一10ml 的离心管中,在离心层析柱顶部加入50ul粗土壤DNA,以10 min为周期于3000r/min离心,分别收集层析液。
层析液浓缩至50ul
三、DNA的琼脂糖凝胶电泳
证明存在DNA。
四、DNA 的纯度和定量检测
用紫外分光光度计测量纯化后的DNA 溶液在波长为230 nm、260 nm、280 nm 下的OD 值,分别算出A260/A230及A260/A280值。
来估计DNA的纯度。
五、纯化后土壤DNA 的PCR扩增
PCR 反应体系为50μL ,模板为1μL 。
PCR反应引物(放线菌通用引物):
反应条件: 94 ℃ 3 min 预变性; 94 ℃ 1 min , 56 ℃1 min ,72 ℃1 min ,30 个循环;72 ℃补平5 min。
PCR 产物用2 %的琼脂糖凝胶电泳检测。
六、检测扩增结果
凝胶电泳,用溴乙锭染色,在紫外光下检查结果。
