(浙江选考)202x版高考化学大一轮复习 第15讲 盐类的水解课时作业
高考化学总复习 课时作业 盐类的水解 _01

目夺市安危阳光实验学校课时作业(二十五) 盐类的水解(对应学生用书P263)一、选择题(本题包括10个小题,每小题5分,共50分)1.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )①将水加热煮沸②向水中投入一小块金属钠③向水中通CO2④向水中加入明矾晶体⑤向水中加NaHCO3固体⑥向水中加NaHSO4固体A.①②④⑤B.①④⑤C.③④⑤D.④2.下列说法正确的是( )A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度C.用加热的方法可以除去KCl溶液中的Fe3+D.洗涤油污常用热的碳酸钠溶液解析:A 项,氯化铝溶液蒸干、灼烧后得到氧化铝,而硫酸铝溶液蒸干、灼烧后得到的仍是硫酸铝,不正确;B项,所加酸应是稀硫酸,不能引入新杂质;C项,加热时Fe3+水解生成Fe(OH)3胶体不能除去Fe3+。
答案:D3.将0.10 mol/L的AlCl3溶液10 mL与0.10 mol/L的KOH溶液40 mL充分混合,所得溶液中各种微粒的物质的量浓度关系正确的是( ) A.c(K+)>c(Cl-)>c(AlO-2)>c(OH-)>c(H+)B.c(K+)>c(Cl-)>c(AlO-2)>c(H+)>c(OH-)C.c(Cl-)>c(K+)>c(OH-)>c(AlO-2)>c(H+)D.c(Cl-)>c(K+)>c(AlO-2)>c(OH-)>c(H+)解析:0.10 mol/L的AlCl3溶液10 mL与0.10 mol/L的KOH溶液40 mL充分混合恰好完全反应生成KAlO2 0.001 mol和KCl 0.003 mol,所以K+浓度最大,其次是Cl-,然后AlO-2水解呈碱性,故A正确。
高考化学一轮复习 课时作业 盐类的水解高三全册化学试题

回夺市安然阳光实验学校课时作业24 盐类的水解时间:45分钟一、选择题1.(2020·湖北武汉华中师大附中模拟)下列事实中与盐类的水解有关的叙述有( C )①NaHSO4溶液呈酸性;②铵态氮肥与草木灰不能混合使用;③加热能增加纯碱溶液的去污能力;④配制CuCl2溶液,用稀盐酸溶解CuCl2固体;⑤NaHS溶液中c(H2S)>c(S2-);⑥氯化铵溶液可去除金属制品表面的锈斑;⑦蒸发FeCl3溶液制得FeCl3固体时可加入SOCl2;⑧向NaAlO2溶液中加入NaHCO3溶液可产生Al(OH)3白色沉淀。
A.8项B.7项C.6项D.5项解析:本题考查盐类水解的应用。
NaHSO4在水溶液中完全电离生成氢离子、钠离子和硫酸根离子,使溶液呈酸性,与盐类水解无关,故①不符合题意;铵态氮肥不能与草木灰混合使用,是由于铵根离子与碳酸根离子发生互促水解反应,有氨气逸出,造成氮元素损失,与盐类水解有关,故②符合题意;纯碱的成分是碳酸钠,属于强碱弱酸盐,碳酸根离子水解使溶液呈碱性,加热促进碳酸根离子的水解,增强去污能力,与盐类水解有关,故③符合题意;CuCl2属于强酸弱碱盐,铜离子水解导致溶液呈酸性,为抑制铜离子的水解,在配制该溶液时加入少量的稀盐酸,所以与盐类水解有关,故④符合题意;NaHS属于酸式盐,HS-水解生成H2S,电离生成S2-,c(H2S)>c(S2-),说明水解程度大于电离程度,与盐类水解有关,故⑤符合题意;氯化铵属于强酸弱碱盐,铵根离子水解使溶液呈酸性,酸和锈斑反应生成盐和水,所以氯化铵溶液可去除金属制品表面的锈斑,与盐类水解有关,故⑥符合题意;FeCl3属于强酸弱碱盐,铁离子水解生成氢氧化铁和HCl,升高温度促进其水解,得不到FeCl3,SOCl2水解生成SO2和HCl,蒸发FeCl3溶液制FeCl3固体时加入SOCl2可抑制Fe3+水解,与盐类水解有关,故⑦符合题意;NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,反应的离子方程式为HCO-3+AlO-2+H2O===CO2-3+Al(OH)3↓,与盐类水解无关,故⑧不符合题意。
2021届一轮高考化学:盐类的水解(浙江)练习及答案

2021届一轮高考化学:盐类的水解(浙江)练习及答案(一轮)专题:盐类的水解一、选择题1、25 ℃时,在10 mL浓度均为0.1 mol·L-1的盐酸和醋酸混合溶液中滴加0.1 mol·L-1 NaOH溶液,下列有关溶液中离子浓度关系正确的是()A.未加NaOH溶液时,c(H+)>c(Cl-)=c(CH3COOH)B.加入10 mL NaOH溶液时:c(CH3COO-)+c(OH-)=c(H+)C.加入NaOH溶液至pH=7时:c(Na+)=c(Cl-)D.加入20 mL NaOH溶液时:c(Na+)=c(CH3COO-)+c(Cl-)【答案】B2、已知常温下浓度为0.1 mol·L-1的下列溶液的pH如表所示:A.加热0.1 mol·L-1NaClO溶液测其pH,pH小于9.7B.0.1 mol·L-1Na2CO3溶液中,存在关系:c(OH-)-c(H+)=c(HCO-3)+2c(H2CO3) C.根据上表数据得出三种酸电离平衡常数大小关系为:HF>HClO>H2CO3(一级电离平衡常数)D.pH=2的HF溶液与pH=12的NaOH溶液以体积比1∶1 混合,则有c(Na +)=c(F-)>c(H+)=c(OH-)答案:B解析:根据“越弱越水解”可知对应的酸的酸性HF>HClO>HCO-3,酸性越强,酸的电离常数越大,故电离常数大小关系为HF>HClO>H2CO3(二级电离平衡常数),C项错误;弱酸根离子的水解为吸热反应,加热促进水解,故加热0.1 mol·L-1的NaClO溶液时,其pH>9.7,A项错误;根据质子守恒知,B 项正确;氢氟酸为弱酸,pH=2的HF溶液与pH=12的NaOH溶液等体积混合时,氢氟酸过量,溶液呈酸性,D项错误。
3、下列各式中属于正确的水解反应离子方程式的是()A.NH+4+H2O NH3·H2O+H+B.S2-+2H 2O H2S+2OH-C.CH 3COOH+H2O CH3COO-+H3O+D.CH3COOH+OH-===CH3COO-+H2O答案 A4、25 ℃时,在10 mL浓度均为0.1 mol·L-1的NaOH和NH3·H2O混合溶液中滴加0.1 mol·L-1的盐酸,下列有关溶液中粒子浓度关系正确的是()。
2021_2022版高中化学课时分层作业15盐类水解反应的利用含解析新人教版选修4202103171

盐类水解反应的利用(30分钟50分)一、选择题(本题包括6小题,每小题6分,共36分)1.(2019·某某高二检测)已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随pH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可在加热搅拌的条件下,加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )A.NH3·H2OB.MgOC.Mg(OH)2D.MgCO3【解析】选A。
MgO消耗Fe3+水解生成的盐酸,促使Fe3+水解生成Fe(OH)3,同时MgO转化为MgCl2,不会引入新的杂质,即使MgO过量,由于MgO难溶于水,也不会引起二次污染。
Mg(OH)2和MgCO3原理与MgO相同。
加入NH3·H2O可能使Mg2+沉淀,同时引入其他杂质。
【补偿训练】同时对农作物施用含N、P、K的三种化肥,给定下列化肥:①K2CO3、②K Cl、③Ca(H2PO4)2、④(NH4)2SO4、⑤NH3·H2O,其中最合理的组合方式是( )A.①③④B.②③④C.①③⑤D.②③⑤【解析】选B。
Ca(H2PO4)2是其中唯一含磷的肥料,肯定要用,由于Ca(H2PO4)2是酸式盐,其水溶液呈酸性,不宜与碱性肥料NH3·H2O及水解呈碱性的K2CO3混合施用,只能与中性肥料K Cl 和酸性肥料(NH4)2SO4混合施用。
2.无色透明溶液中能大量共存的离子组是( )A.Na+、Al3+、HC、NB.Al、Cl-、Mg2+、K+C.N、Na+、CH3COO-、ND.Na+、N、ClO-、I-【解析】选C。
A项Al3+与HC发生相互促进的水解反应;B项Mg2+会与Al水解生成的OH-结合生成Mg(OH)2沉淀;D项ClO-会氧化I-。
3.将下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,得到化学组成与原固体物质相同的是( )①胆矾②氯化镁③硫酸铝④次氯酸钠A.③B.①④C.①②③④D.全部【解析】选A。
浙江高考化学一轮复习:盐类水解

专题二
第15讲 盐类的水解
考情概览
基础夯实
误区警示
即时演练
-7-
基础梳理 感悟选考 对点训练
(3)发生相互促进的水解时,如果反应彻底,则生成物中出现的不 溶于水的沉淀或气体物质均要注明状态,即标上“↓”和“↑”符号,中间 用“ ”连接,如 Al3++3HCO3- Al(OH)3↓+3CO2↑。
基础夯实
基础梳理 感悟选考 对点训练
误区警示
即时演练
-15-
难点释疑 如何判断盐溶液的酸碱性? 提示:溶液的酸碱性取决于c(H+)、c(OH-)的相对大小,当 c(H+)>c(OH-)时,溶液呈酸性;当c(H+)<c(OH-)时,溶液呈碱性;当 c(H+)=c(OH-)时,溶液呈中性。若盐电离出的离子中只有酸根离子 水解,即弱酸根离子与水电离出来的H+结合,使溶液中c(H+)<c(OH-), 溶液呈碱性;若盐电离出的离子中只有金属离子或 NH水4+ 解,即弱碱 阳离子与水电离出来的OH-结合,使溶液中c(H+)>c(OH-),溶液呈酸 性。水解的程度越大,对水电离的促进越大,溶液的碱性或酸性越 强。至于阴、阳离子都发生水解的情况,要根据弱酸、弱碱对应的 Ka、Kb的相对大小判断。
专题二
第15讲 盐类的水解
考情概览
基础夯实
误区警示
即时演练
-6-
基础梳理 感悟选考 对点训练
高考化学总复习《8.3 盐类的水解》课时作业

《与名师对话》高考总复习(JS版)高三化学《盐类的水解》课时作业建议用时实际用时分值得分45分钟100分一、选择题本题包括10小题,每小题5分,共50分1.下列操作会使H2O的电离平衡向电离方向移动,且o/L的Na2CO3、NaHCO3、NH42CO3、NH4HCO3溶液中,测得c CO32-分别为a、b、c、d单位为mo/L下列判断正确的是A.a=b=c=d B.a>c>d>bC.a>c>b>d D.a>b>c>d答案:C3.下列各式属于水解反应的水解方程式且正确的是A.NH4++H2O===NH3·H2O+H+B.S2-+2H2O H2S+2OH-C.CH3COOH CH3COO-+H+D.CH3COO-+H2O CH3COOH+OH-答案:D4.下列有关问题,与盐的水解有关的是①NH4C与ZnC2溶液可作焊接金属中的除锈剂②用NaHCO3与A2SO43两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AC3溶液得到AOH3固体A.仅①②③ B.仅②③④C.仅①④⑤ D.①②③④⑤解析:本题考查盐类水解的应用与解释。
①中NH4C与ZnC2溶液水解均显酸性,可以除去金属表面的锈;②用HCO3-与A3+两种离子水解相互促进,产生二氧化碳,可作灭火剂;③草木灰主要成分为碳酸钾,水解显碱性,而铵态氮肥水解显酸性,且NH4+与OH-生成NH3,易挥发,因而不能混合施用;④碳酸钠溶液水解显碱性,而磨口玻璃塞中二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口粘合而打不开,因此实验室盛放碳酸钠的试剂瓶应用橡胶塞或软木塞;⑤AC3溶液中存在水解平衡:AC3+3H2OAOH3+3HC,加热时,HC挥发使平衡不断右移,最终得到AOH3固体如果灼烧,会得到A2O3固体。
答案:D5.物质的量浓度相同的下列溶液中,符合按o·L-1的KHA溶液,其L mo·L-1醋酸钠溶液与10 mL mo·L-1盐酸混合后的溶液中:2c H++c CH3COOH=c CH3COO-+2c OH-D.在25 mL mo·L-1NaOH溶液中逐滴加入mo·L-1CH3COOH溶液,溶液o/L KHA溶液的o·L-1的四种溶液,稀释相同倍数时,其o/L,故混合后CH3COOH剩余,溶液呈酸性,c Na+2酸性c CN-,则溶液显________填“酸性”、“碱性”或“中性”,混合溶液中离子浓度大小顺序为:____________________________________。
新高考化学第一轮复习:盐类的水解(含解析)

新高考化学第一轮复习——盐类的水解【答案】一、选择题1、在0.1 mol·L-1K2CO3溶液中,由于CO2-3的水解,使得c(CO2-3)<0.1 mol·L-1。
如果要使c(CO2-3)更接近0.1 mol·L-1,可以采取的措施是( ) A.加入适量水 B.加入少量盐酸C.加入适量KOH固体 D.加热解析:K2CO3溶液中存在CO2-3的水解平衡:CO2-3+H 2O HCO-3+OH-。
加入适量水,平衡正向移动,但溶液的体积增大,则c(CO2-3)减小,A错误;加入少量盐酸,CO2-3与H+结合生成HCO-3,则c(CO2-3)减小,B错误;加入适量KOH固体,溶液中c(OH-)增大,水解平衡逆向移动,溶液中c(CO2-3)增大,更接近0.1 mol·L-1,C正确;加热,促使CO2-3的水解平衡正向移动,c(CO2-3)减小,D错误。
答案:C2、常温下,下列有关溶液的说法正确的是( )A.NaHCO3溶液加水稀释,c(Na+)与c(HCO-3)的比值将增大B.pH=1的一元酸和pH=13的一元碱等体积混合后的溶液中:c(OH-)=c(H +)C.0.1 mol·L-1硫酸铵溶液中:c(SO2-4)>c(NH+4)>c(H+)>c(OH-)D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)解析:加水稀释,促进阴离子水解,NaHCO3溶液加水稀释,c(Na+)与c(HCO-3)的比值将增大,故A正确;pH=1的一元酸和pH=13的一元碱等体积混合,只有强酸和强碱等体积混合才会pH=7,弱酸和强碱反应显酸性,反之显碱性,故B错误;0.1 mol·L-1硫酸铵溶液中:c(NH+4)>c(SO2-4)>c(H+)>c(OH-),故C错误;硫化钠溶液中,质子守恒关系式为c(OH-)=c(H+)+c(HS-)+2c(H2S),故D错误。
高三化学一轮复习课时作业2: 盐类的水解

基础课时3 盐类的水解(时间:45分钟)1.下列有关盐类水解的叙述中正确的是()。
A.溶液呈中性的盐一定是强酸强碱盐B.含有弱酸根盐的水溶液一定呈碱性C.盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱D.强酸强碱盐的水溶液一定呈中性解析如果弱酸、弱碱的电离程度相当,生成的盐的水溶液也呈中性,如CH3COONH4;含有弱酸根盐的水溶液不一定呈碱性,如NaHSO3溶液呈酸性;强酸强碱盐的水溶液不一定呈中性,例如NaHSO4。
答案 C2.(2013·广州诊断)常温时,某溶液中由水电离出的H+和OH-的物质的量浓度的乘积为1×10-10,则该溶液可能是()。
①H2SO4;②CH3COOH;③NH4Cl;④KOH⑤CH3COONaA.①④⑤B.③⑤C.①②③D.③解析由题意易求得水电离出的c(H+)=c(OH-)=1×10-5 mol·L-1>1×10-7 mol·L-1,说明所加试剂促进了水的电离;酸和碱抑制水的电离,而能水解的盐促进水的电离。
答案 B3.(2013·宜昌联考)下列说法正确的是()。
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度C.用加热的方法可以除去KCl溶液中的Fe3+D.洗涤油污常用热的碳酸钠溶液解析A项,氯化铝溶液蒸干、灼烧后得到氧化铝,而硫酸铝溶液蒸干、灼烧后得到的仍是硫酸铝,不正确;B项,所加酸应是稀硫酸,不能引入新杂质;C项,加热法不能除去KCl溶液中的Fe3+。
答案 D4.(2014·太原模拟)CH3COONa溶液中存在水解平衡:CH3COO-+H2O CH3COOH+OH-,下列说法正确的是()。
A.加入少量NaOH固体,c(CH3COO-)减小B.加入少量FeCl3固体,c(CH3COO-)减小C.稀释溶液,溶液的pH增大D.加入适量的醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+) > c(OH-)解析加入NaOH固体使平衡左移,c(CH3COO-)增大,A项错;CH3COO-水解溶液呈碱性,Fe3+水解溶液呈酸性,二者水解相互促进,使c(CH3COO -)减小,B项正确;稀释溶液虽然促进CH3COO-的水解,但由于溶液体积增大占主要趋势,故c(OH-)减小,pH减小,C项错;依据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),可知D项错。
高考化学一轮复习 8.3盐类的水解课时作业

盐类的水解1.下列根据反应原理设计的应用,不正确的是( )A.CO2-3+H2OHCO-3+OH-;用热的纯碱溶液清洗油污B.Al3++3H2O Al(OH)3(胶体)+3H+;明矾净水C.TiCl4+(x+2)H2O(过量) TiO2·x H2O↓+4HCl;制备TiO2纳米粉D.SnCl2+H2O Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠答案: D2.向三份0.1 mol·L-1 CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.增大、减小、增大解析:CH3COO-离子水解显碱性,SO2-3水解也呈碱性会抑制CH3COO-离子的水解,CH3COO-浓度增大,NH+4和Fe 2+水解均呈酸性,会促进CH3COO-离子水解,CH3COO-离子浓度会减小。
答案: A3.在25 ℃时,在浓度为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH+4)分别为a、b、c(单位:mol·L-1)。
下列判断正确的是( )A.a=b=c B.a>b>cC.a>c>b D.c>a>b解析:三种溶液中都存在水解平衡:NH+4+H2O NH3·H2O+H+,对于(NH4)2CO3来说,因CO2-3+H+HCO-3,而使上述平衡向右移动,促进了NH+4的水解;对于(NH4)2Fe(SO4)2来说,Fe2++2H2O Fe(OH)2+2H+,c(H+)增大,抑制NH+4的水解。
答案: D4.为了配制NH+4的浓度与Cl-的浓度之比为1∶1的溶液,可在NH4Cl溶液中加入( ) A.适量的HCl B.适量的NaClC.适量的氨水D.适量的NaOH解析:由于溶液中NH+4的水解:NH+4+H2O NH3·H2O+H+,NH+4的浓度减小,从而使溶液中NH+4与Cl-的浓度比小于1∶1。
高考化学一轮总复习:7.3《盐类的水解》课时作业及答案
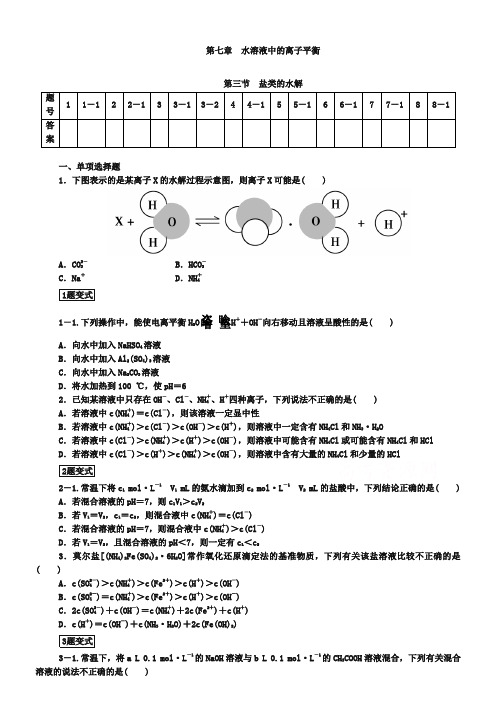
第七章水溶液中的离子平衡第三节盐类的水解一、单项选择题1.下图表示的是某离子X的水解过程示意图,则离子X可能是( )A.CO2-3B.HCO-3C.Na+D.NH+41题变式1-1.下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈酸性的是( )A.向水中加入NaHSO4溶液B.向水中加入Al2(SO4)3溶液C.向水中加入Na2CO3溶液D.将水加热到100 ℃,使pH=62.已知某溶液中只存在OH-、Cl-、NH+4、H+四种离子,下列说法不正确的是( )A.若溶液中c(NH+4)=c(Cl-),则该溶液一定显中性B.若溶液中c(NH+4)>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3·H2OC.若溶液中c(Cl-)>c(NH+4)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HClD.若溶液中c(Cl-)>c(H+)>c(NH+4)>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl2题变式2-1.常温下将c1mol·L-1 V1 mL的氨水滴加到c2mol·L-1 V2 mL的盐酸中,下列结论正确的是( ) A.若混合溶液的pH=7,则c1V1>c2V2B.若V1=V2,c1=c2,则混合液中c(NH+4)=c(Cl-)C.若混合溶液的pH=7,则混合液中c(NH+4)>c(Cl-)D.若V1=V2,且混合溶液的pH<7,则一定有c1<c23.莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液比较不正确的是( )A.c(SO2-4)>c(NH+4)>c(Fe2+)>c(H+)>c(OH-)B.c(SO2-4)=c(NH+4)>c(Fe2+)>c(H+)>c(OH-)C.2c(SO2-4)+c(OH-)=c(NH+4)+2c(Fe2+)+c(H+)D.c(H+)=c(OH-)+c(NH3·H2O)+2c(Fe(OH)2)3题变式3-1.常温下,将a L 0.1 mol·L-1的NaOH溶液与b L 0.1 mol·L-1的CH3COOH溶液混合,下列有关混合溶液的说法不正确的是( )A.a<b时,可能存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-)B.a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)C.a=b时,c(CH3COOH)+c(H+)=c(OH-)D.无论a、b有何关系,均有c(H+)+c(Na+)=c(CH3COO-)+c(OH-)3-2.浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液②氢氧化钠溶液③醋酸钠溶液,下列说法不正确的是( )A.①和②等体积混合后的溶液中:c(OH-)=c(H+)+c(CH3COOH)B.①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)C.②和③等体积混合后溶液中由水电离出的c(H+)<10-7mol·L-1D.由水电离出的c(OH-):②>③>①4.对滴有酚酞试液的下列溶液,操作后颜色变深的是( )A.明矾溶液加热B.CH3COONa溶液加热C.氨水中加入少量NH4Cl固体D.小苏打溶液中加入少量NaCl固体4题变式4-1.向三份0.1 mol·L-1NH4Cl溶液中分别加入少量的Mg、NaOH、FeSO4固体(忽略溶液体积变化),则NH+4浓度的变化依次为( )A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.减小、减小、增大5.现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。
高三化学一轮总复习 讲与练课时作业 盐类的水解

证对市爱幕阳光实验学校课时作业29 盐类的水解时间:45分钟分值:100分一、选择题(共48分,每题4分)1.以下说法中错误的选项是( )A.在Na2S溶液中滴入酚酞试液,呈B.硫酸铵溶液显酸性C.一切钾盐、钠盐、硝酸盐都不发生水解D.醋酸盐溶于水能发生水解[答案]C[解析]Na2S水解使溶液显碱性,滴入酚酞试液,呈;硫酸铵是强酸弱碱盐,其水解使溶液显酸性;钾的弱酸盐、钠的弱酸盐、硝酸的弱碱盐都能发生水解;醋酸盐中存在弱酸根离子(CH3COO-),溶于水时能发生水解。
2.以下各组离子中,每个离子都能影的电离平衡的一组是( )A.Zn2+、Ag+、HCO-3、Cl-、PO3-4、SO2-4B.Fe3+、Br-、Al3+、H+、CO2-3、H2PO-4C.Ag+、SO2-3、SiO2-3、Fe2+、S2-D.Fe2+、ClO-、NO-3、HS-、Cu2+、HSO-3[答案]C[解析]A中Cl-、SO2-4不能影的电离平衡;B中Br-不能影的电离平衡;D中NO-3不能影的电离平衡。
3.以下离子方程式正确的选项是( )A.氯气和水的反Cl2+H2O===2H++Cl-+ClO-B.碳酸氢钠水解HCO-3+H2O H3O++CO2-3C.碳酸钠水解CO2-3+2H2O H2CO3+2OH-D.亚硫酸氢钠与过量的Ba(OH)2溶液HSO-3+Ba2++OH-===BaSO3↓+H2O [答案]D[解析]选项A中氯气与水生成的次氯酸是弱电解质,不能用离子形式表示;B选项是HCO-3的电离方程式;C选项中CO2-3水解该分步表示。
4.向CH3COONa稀溶液中参加(或通入)少许X物质,其溶液中微粒浓度变化如下表所示(溶液温度不变):微粒H+OH-CH3COO-CH3COOH物质的量浓度减小增大增大减小那么X物质可能为( )A.氯化氢 B.氢氧化钠C.蒸馏水D.醋酸[答案]B[解析]在CH3COONa溶液中发生水解:CH3COO-+H2O CH3COOH+OH-,参加的物质可以使c(OH-)、c(CH3COO-)增大,那么该物质本身显强碱性,会抑制CH3COO-的水解,故NaOH满足要求。
高考化学一轮复习 课时达标作业 盐类的水解高三全册化学试题

回夺市安然阳光实验学校课时达标作业26 盐类的水解基础题1.25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )A.均存在电离平衡和水解平衡B.存在的粒子种类相同C.c(OH-)前者大于后者D.分别加入NaOH固体,恢复到原温度,c(CO2-3)均增大2.0.1 mol·L-1AlCl3溶液,温度从20 ℃升高到50 ℃,浓度增幅最大的离子是( )A.Cl-B.Al3+C.H+ D.OH-3.短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )A.W2-、X+ B.X+、Y3+C.Y3+、Z2- D.X+、Z2-4.下列物质在常温时发生水解,对应的离子方程式正确的是( )A.Na2CO3:CO2-3+2H2O H2CO3+2OH-B.NH4Cl:NH+4+H2O NH3↑+H2O+H+C.CuSO4:Cu2++2H2O Cu(OH)2+2H+D.NaF:F-+H2O===HF+OH-5.常温下,稀释0.1 mol·L-1NH4Cl溶液,如图中的横坐标表示加水的量,则纵坐标可以表示的是( )A.NH+4水解的平衡常数B.溶液的pHC.溶液中NH+4数D.溶液中c(NH+4)6.已知t℃时,水的离子积为K w,该温度下,将a mol·L-1氨水溶液和b mol·L-1 HCl溶液等体积混合,下列判断一定正确的是( )A.若c(OH-)=K w mol·L-1,则混合液一定呈中性B.若a>b,则混合液中的c(NH+4)大于c(Cl-)C.若溶液呈酸性,则a<bD.混合液中c(Cl-)=c(NH+4)+c(NH3·H2O)7.常温下浓度均为0.1 mol/L的四种盐溶液,其pH如下表所示,下列说法正确的是( )序号①②③④溶液CH3COONa NaHCO3Na2CO3NaClOpH 8.8 9.7 11.6 10.3A.等浓度的CH3COOH和HClO溶液,pH小的是HClOB.Na2CO3和NaHCO3溶液中粒子种类不同C.溶液中水的电离程度①>②>④>③D.NaHCO3溶液中,c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)8.用物质的量都是0.1 mol的CH3COOH和CH3COONa配成1 L混合溶液,已知其中c(CH3COO-)>c(Na+),对该溶液的下列判断正确的是( ) A.c(H+)>c(OH-)B.c(CH3COO-)=0.1 mol·L-1C.c(CH3COOH)>c(CH3COO-)D.c(CH3COO-)+c(OH-)=0.1 mol·L-1能力题9.25 ℃时,用0.25 mol·L-1的NaOH溶液,分别滴定同浓度的三种稀酸溶液,滴定的曲线如图所示,下列判断不正确的是( )A.同浓度的稀酸中:c(A-)>c(B-)>c(D-)B.滴定至P点时,溶液中:c(B-)>c(HB)C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)10.Na2SO3溶液作为吸收液吸收SO2时,吸收液pH随n(SO2-3)n(HSO-3)变化图像如图:则以下离子浓度关系的判断正确的是( )A.NaHSO3溶液中c(H+)<c(OH-)B.Na2SO3溶液中c(Na+)>c(SO2-3)>c(HSO-3)>c(OH-)>c(H+)C.当吸收溶液呈中性时,c(Na+)>c(SO2-3)>c(HSO-3)>c(OH-)=c(H+)D.当吸收溶液呈中性时,c(Na+)>c(HSO-3)+c(SO2-3)11.某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )A.碳酸钠水解是吸热反应B.ab段说明水解平衡向右移动C.bc段说明水解平衡向左移动D.水的电离平衡也对pH产生影响12.常温下,将体积为V1的0.100 0 mol·L-1HCl溶液逐滴加入到体积为V2的0.100 0 mol·L-1Na2CO3溶液中,溶液中H2CO3、HCO-3、CO2-3所占的物质的量分数(α)随pH的变化曲线如图。
高考化学一轮总复习课件盐类的水解课后作业

利用酸碱指示剂的颜色变化来判断溶液的酸碱性。例如,酚酞在酸性溶液中呈无 色,在碱性溶液中呈红色。
实验验证和结果讨论
实验步骤
配制不同浓度的弱酸强碱盐溶液,测 定其pH值,并观察颜色变化。记录数 据并分析实验结果。
结果讨论
根据实验数据,分析弱酸强碱盐的水 解性质及其影响因素。讨论实验结果 与理论预测的一致性,并提出可能的 改进措施。
如盐类的水解和电离、沉淀溶解平衡等概念的区分。
忽略水解平衡的移动
在分析盐类水解问题时,容易忽略平衡移动原理的应用。
忽视题目中的关键信息
如溶液的浓度、温度等条件,导致分析错误。
课后作业布置及要求说明
作业内容
完成与盐类水解相关的练习题,包括判断题、选择题和计 算题等。
作业要求
独立思考、认真完成,对于不理解的问题及时请教老师或 同学。
在溶液中盐电离出来的离子跟水 所电离出来的H+或OH-结合生成 弱电解质的反应叫做盐类的水解 。
盐类水解条件
盐必须溶于水,盐中必须有弱酸 根或弱碱阳离子。
水解反应方程式书写规则
写出水解的离子方程 式,注意配平。
根据电荷守恒、质量 守恒检查方程式是否 正确。
写出生成物的化学式 ,注意沉淀、气体符 号的标注。
02
强酸弱碱盐水解性质探讨
强酸弱碱盐组成及特点
组成
由强酸根离子和弱碱阳离子组成,如 NH4Cl、AlCl3等。
特点
强酸弱碱盐在水中发生水解反应,生 成相应的酸和碱,同时水解过程受到 温度、浓度等因素的影响。
水解过程分析
水解反应方程式
以NH4Cl为例,NH4+ + H2O ⇌ NH3·H2O + H+。
(浙江选考)2020版高考化学大一轮复习第15讲盐类的水解课时作业

课后作业15 盐类的水解(时间:45分钟满分:100分)一、选择题(本题包括12小题,每小题5分,共60分,每小题只有一个选项符合题目要求)1.(2018·浙江新高考研究联盟第二次联考)下列物质的水溶液因水解而呈酸性的是( )A.NaHSO4B.(NH4)2SO4C.SO2D.H2SO4答案B解析NaHSO4在水溶液中电离:NaHSO4Na++H++S-,溶液显酸性是由于电离的缘故,故A错误;(NH4)2SO4属于强酸弱碱盐,其水溶液中存在:N+H2O NH3·H2O+H+,溶液因水解显酸性,故B正确;SO2与水反应生成H2SO3,H2SO3电离:H2SO3H++HS-,故因电离显酸性,C错误;H2SO4溶液因电离显酸性,D错误。
2.空气中直接蒸发并蒸干下列盐的溶液:①Fe2(SO4)3;②Na2CO3;③KCl;④CuCl2;⑤KHCO3,可以得到相应盐(可以含有结晶水)的是( )A.①②③B.①⑤C.②④D.③④⑤答案A解析蒸干CuCl2溶液时,CuCl2会水解为Cu(OH)2和HCl;蒸干KHCO3溶液时,KHCO3会受热分解生成K2CO3、CO2和H2O。
3.有四种物质的量浓度相同且由+1价阳离子A+、B+和-1价阴离子X-、Y-组成的盐溶液,常温下AX 溶液和BY溶液的pH都为7,AY溶液的pH<7,BX溶液的pH>7,则可能不水解的盐是( )A.AXB.BXC.AYD.BY答案D解析AY溶液的pH<7,说明A+发生水解反应:A++H2O AOH+H+,则Y-可能不发生水解反应或发生水解反应,但水解程度较A+小;BX溶液的pH>7,说明X-发生水解反应:X-+H2O HX+OH-,则B+可能不发生水解反应或发生水解反应,但水解程度较X-小,综上所述,含有X-或A+的盐,如AX、BX、AY均能发生水解反应,只有BY可能不发生水解反应。
4.盐类水解在工农业生产和日常生活中有着广泛的应用,下列说法与盐类水解无关的是( )A.生活中常用明矾净水B.用热的纯碱溶液洗涤餐具上的油污C.用稀硫酸除去铜器表面的铜绿D.长期使用硫酸铵化肥的土壤,易变酸性,可施用适量的熟石灰答案C解析选项A利用明矾水解生成的氢氧化铝胶体吸附水中的杂质;选项B利用碳酸根离子水解使溶液显碱性,来清洗油污;选项C中碱式碳酸铜溶于稀硫酸生成硫酸铜,与水解无关;选项D中硫酸铵水解导致土壤显酸性,所以可用熟石灰来中和。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课后作业15 盐类的水解(时间:45分钟满分:100分)一、选择题(本题包括12小题,每小题5分,共60分,每小题只有一个选项符合题目要求)1.(2018·浙江新高考研究联盟第二次联考)下列物质的水溶液因水解而呈酸性的是( )A.NaHSO4B.(NH4)2SO4C.SO2D.H2SO4答案B解析NaHSO4在水溶液中电离:NaHSO4Na++H++S O42-,溶液显酸性是由于电离的缘故,故A错误;(NH4)2SO4属于强酸弱碱盐,其水溶液中存在:N H4++H2O NH3·H2O+H+,溶液因水解显酸性,故B正确;SO2与水反应生成H2SO3,H2SO3电离:H2SO3H++HS O3-,故因电离显酸性,C错误;H2SO4溶液因电离显酸性,D错误。
2.空气中直接蒸发并蒸干下列盐的溶液:①Fe2(SO4)3;②Na2CO3;③KCl;④CuCl2;⑤KHCO3,可以得到相应盐(可以含有结晶水)的是( )A.①②③B.①⑤C.②④D.③④⑤答案A解析蒸干CuCl2溶液时,CuCl2会水解为Cu(OH)2和HCl;蒸干KHCO3溶液时,KHCO3会受热分解生成K2CO3、CO2和H2O。
3.有四种物质的量浓度相同且由+1价阳离子A+、B+和-1价阴离子X-、Y-组成的盐溶液,常温下AX 溶液和BY溶液的pH都为7,AY溶液的pH<7,BX溶液的pH>7,则可能不水解的盐是( )A.AXB.BXC.AYD.BY答案D解析AY溶液的pH<7,说明A+发生水解反应:A++H2O AOH+H+,则Y-可能不发生水解反应或发生水解反应,但水解程度较A+小;BX溶液的pH>7,说明X-发生水解反应:X-+H2O HX+OH-,则B+可能不发生水解反应或发生水解反应,但水解程度较X-小,综上所述,含有X-或A+的盐,如AX、BX、AY均能发生水解反应,只有BY可能不发生水解反应。
4.盐类水解在工农业生产和日常生活中有着广泛的应用,下列说法与盐类水解无关的是( )A.生活中常用明矾净水B.用热的纯碱溶液洗涤餐具上的油污C.用稀硫酸除去铜器表面的铜绿D.长期使用硫酸铵化肥的土壤,易变酸性,可施用适量的熟石灰答案C解析选项A利用明矾水解生成的氢氧化铝胶体吸附水中的杂质;选项B利用碳酸根离子水解使溶液显碱性,来清洗油污;选项C中碱式碳酸铜溶于稀硫酸生成硫酸铜,与水解无关;选项D中硫酸铵水解导致土壤显酸性,所以可用熟石灰来中和。
5.为了配制 N H4+的浓度和Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )A.适量的HClB.适量的NaClC.适量的氨水D.适量的NaOH答案C解析由于N H4+水解使NH4Cl溶液中N H4+的浓度和Cl-的浓度比小于1∶1,要使N H4+的浓度和Cl-的浓度比为1∶1,可通过抑制水解并且增大N H4+的浓度达到目的。
最好的方法是加入适量的氨水抑制N H4+水解。
A项虽可抑制水解,但增加了Cl-,B项引入了Na+,增加了Cl-;D项促进了水解,且引入了Na+。
6.下列说法不正确的是( )A.NH4Cl溶液呈酸性说明NH3·H2O是弱电解质B.醋酸钠溶液中c(Na+)>c(CH3COO-)C.常温下,在1 mol·L-1的盐酸中加入等体积等浓度的氨水,溶液导电能力减弱D.常温下相同pH的NaOH溶液和CH3COONa溶液中水电离出的OH-浓度相同答案D解析NH4Cl溶液呈酸性,说明NH4Cl是强酸弱碱盐,即NH3·H2O是弱电解质,故A正确;醋酸钠溶液中CH3COO-水解,所以c(Na+)>c(CH3COO-),故B正确;常温下,在1mol·L-1的盐酸中加入等体积等浓度的氨水,离子浓度减小,溶液导电能力减弱,故C正确;NaOH抑制水的电离,CH3COONa促进水的电离,故D错误。
7.向10.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。
下列有关叙述正确的是( )A.M~N间一定存在c(Cl-)>c(N H4+)>c(OH-)>c(H+)B.M点对应的盐酸体积为10.0 mLC.pH=7时,溶液中有c(N H4+)=c(Cl-)=c(H+)=c(OH-)D.P点所处的溶液中存在:2c(N H4+)+2c(NH3·H2O)=c(Cl-)答案D解析A项,不符合电荷守恒,M~N间应存在c(N H4+)>c(Cl-)>c(OH-)>c(H+)或c(N H4+)>c(OH-)>c(Cl-)>c(H+),错误;M点pH=7,此时氨水应稍过量,故盐酸体积小于10mL,B项错误;当溶液pH=7时,c(H+)=c(OH-),再由电荷守恒c(N H4+)+c(H+)=c(OH-)+c(Cl-),可推知c(N H4+)=c(Cl-),故有c(N H4+)=c(Cl-)>c(H+)=c(OH-),C项错误;P点时溶液相当于等物质的量浓度的NH4Cl溶液和HCl溶液等体积混合,由物料守恒可知c(Cl-)=2[c(N H4+)+c(NH3·H2O)],D项正确。
8.25 ℃时某些弱酸的电离平衡常数如表所示:CH3COOH HClO H2CO3K=1.8×1K=3.0×1K a1=4.4×10-50-80-7K a2=4.7×10-11常温下,稀释CH 3COOH 、HClO 两种酸时,溶液的pH 随加水量变化的曲线如图所示,下列说法正确的是( )A.相同浓度的CH 3COONa 和NaClO 的混合溶液中,各离子浓度的大小关系是:c (Na +)>c (ClO -)>c (CH 3COO -)>c (OH -)>c (H +) B.图像中a 、c两点所处的溶液中c (P -)c (HP)·c (OH -)相等(HP代表CH 3COOH 或HClO)C.图像中a 点酸的浓度大于b 点酸的浓度D.向NaClO 溶液中通入少量二氧化碳的离子方程式为2ClO -+CO 2+H 2O 2HClO+C O 32-答案B解析醋酸的电离常数大于次氯酸,所以醋酸钠的水解程度小于次氯酸钠,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH 3COONa 和NaClO 的混合液中,各离子浓度的大小关系是:c (Na +)>c (CH 3COO -)>c (ClO -)>c (OH -)>c (H +),故A 错误;在c (P -)c (HP)·c (OH -)的分子、分母上同时乘以c (H +)可得:c (HP)c W,由于水的离子积和电离平衡常数只受温度影响,a 、c 两点对应溶液的温度相同,故该比值相等,B 正确;pH 相等的CH 3COOH 、HClO,稀释相同的倍数时,较强酸中H +浓度小于较弱酸,则较弱酸的pH 小于较强酸,酸性CH 3COOH>HClO,所以a 所在曲线表示CH 3COOH,b 所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度较小,次氯酸的浓度较大,a 、b 两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图像中a 点酸的浓度小于b 点酸的浓度,C 错误;碳酸的二级电离小于次氯酸,所以HC O 3-的酸性弱于次氯酸,则向NaClO 溶液中通入少量二氧化碳的离子方程式为ClO -+CO 2+H 2O HClO+HC O 3-,D 错误。
9.已知NaHSO 3溶液显酸性,溶液中存在以下平衡:HS O 3-+H 2O H 2SO 3+OH - ①HS O 3-H ++S O 32-②向0.1 mol·L -1的NaHSO 3溶液中分别加入以下物质,下列有关说法正确的是( ) A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c (HS O 3-)增大B.加入少量Na 2SO 3固体,则c (H +)+c (Na +)=c (HS O 3-)+c (OH -)+12c (S O 32-)C.加入少量NaOH 溶液,c (SO 32-)c (HSO 3-)、c (OH -)c (H +)的值均增大D.加入氨水至中性,则2c (Na +)=c (S O 32-)>c (H +)=c (OH -)答案C解析A 项,加入少量金属Na,Na 与水反应生成NaOH,NaOH 中和HS O 3-,c (HS O 3-)减小,c (S O 32-)增大;B 项,加入Na 2SO 3固体,根据电荷守恒,c (Na +)+c (H +)=c (OH -)+c (HS O 3-)+2c (S O 32-);C 项,加入少量NaOH 溶液,平衡②右移使c (SO 32-)c (HSO 3-)增大;c (OH -)c (H +)也增大;D项,由电荷守恒,c (Na +)+c (N H 4+)+c (H +)=c (OH-)+c (HS O 3-)+2c (S O 32-),可知D 错。
10.25 ℃时,相同体积和pH 的NaX 、NaY 、NaZ 三种物质的盐溶液,分别加水稀释,溶液pH 的变化与所加水的体积关系如下图所示。
下列说法正确的是( )A.在上述三种盐的原溶液中,水的电离度大小是NaX>NaY>NaZB.在等物质的量浓度的NaX 、NaY 、NaZ 的混合液中,离子浓度的大小关系是c (Z -)>c (Y -)>c (X -) C.等体积、等pH 的NaX 溶液和NaY 溶液混合后,溶液中存在c (HX)c (X -)=c (HY)c (Y -)D.在0.2 mol·L -1NaX 溶液中加入等体积0.1 mol·L -1的盐酸,所得混合液中存在c (H +)+c (HX)=c (OH -)+c (Cl -)答案D解析加水稀释促进盐类水解,稀释相同的倍数时,pH 变化越大,说明该盐的水解程度越小,其相对应的酸的酸性越强,所以这三种酸的强弱顺序是HX>HY>HZ,则酸根离子水解程度的大小顺序是Z ->Y ->X -,酸根离子的水解程度越大,水的电离程度越大。
A 项,因原溶液pH 相同,故水的电离度大小相同,错误;B 项,等物质的量浓度的NaX 、NaY 、NaZ 的混合液中,酸根离子的水解程度越大,其溶液中酸根离子的浓度越小,所以离子浓度的大小关系是c (Z -)<c (Y -)<c (X -),错误;C 项,酸的酸性强弱不同,等体积等pH 的NaX 溶液和NaY 溶液中,X -和Y -的水解程度不同,c (HX)c (X -)、c (HY)c (Y -)可分别理解为X -和Y -的水解百分数,二者不相等,所以该选项错误;D 项,相当于等物质的量浓度的NaX 、NaCl 、HX 溶液等体积混合,根据电荷守恒得c (H +)+c (Na +)=c (OH -)+c (Cl -)+c (X -),根据物料守恒得c (Na +)=c (HX)+c (X -)=2c (Cl -),所以得c (H +)+c (HX)=c (OH -)+c (Cl -),正确。
