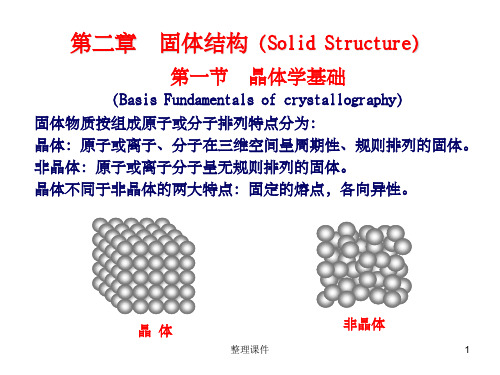
固体结构PPT课件
合集下载
无机化学固体结构

无机化学
(3) 18e构型 构型 Cu+ Zn2+ 1s22s22p63s23p63d10 1s22s22p63s23p63d10
(4) (18+2)e构型 次外层为 ,最外层为 构型(次外层为 构型 次外层为18e,最外层为2e) Sn2+ 50 1s22s22p63s23p63d104s24p64d105s2
无机化学
晶系 立方 四方 正交 六方 三方 单斜 三斜 a= b=c a= b≠ c a≠ b≠c a = b ≠c a=b=c a≠ b≠c a≠ b≠c
晶
胞
实
例
α = β = γ = 90° α = β = γ = 90° α = β = γ = 90° α = β = 90°γ =120°
NaCl,CaF2,ZnS SiO2,MgF2,NiSO4 K2SO4,BaCO3,HgCl SiO2,AgI,CuS
α = β = γ < 120°(≠ 90°) Al2O3,CaCO3(方解石) α = γ = 90°β ≠ 90° α ≠ β ≠ γ ≠90° KClO3,K3[Fe(CN)6], Na2B4O7 CuSO4·5H2O,K2Cr2O7
无机化学
晶体类型 结点上的粒子
离子晶 体
原子晶 体
分子晶体 极性 分子
无机化学
二、典型离子晶体构型
NaCl型离子晶体 型离子晶体
无机化学
CsCl型离子晶体 型离子晶体
无机化学
立方ZnS型离子晶体 立方 型离子晶体
无机化学
三、离子晶体的半径比规则
P267离子晶体半径比与配位数的关系 离子晶体半径比与配位数的关系
无机化学
四、离子键强度与离子晶体的晶格能
材料科学基础-固体的结构
晶带面和与晶带轴之间存在以下关系:
hu+kv+lw=0
此关系称为晶带定理。满足该关系的(hkl)晶面都属于以
[uvw]为晶带轴的晶带。
[uvw]
整理课件
32
第二章 固体结构
利用晶带定理:
①已知两个不平行的晶面(h1k1l1)和(h2k2l2),求出其晶带 轴[uvw]。
u : v : w ( k 1 l 2 k 2 l 1 ) : ( l 1 h 2 l 2 h 1 ) : ( h 1 k 2 h 2 k 1 )
整理课件
16
第二章 固体结构
整理课件
17
第二章 固体结构
整理课件
18
第二章 固体结构
整理课件
19
第二章 固体结构
整理课件
20
第二章 固体结构
整理课件
21
第二章 固体结构
整理课件
22
第二章 固体结构
晶面族:原子排列规律、面间距完全相同,仅空间位向 关系不同的一组晶面(等价晶面),以{h k l}表示。
如六个柱面分别为: ( 1 0 0 ),(0 1 0 ),(1 1 0 ),(1 0 0 ),(0 1 0 ),( 1 1 0 ) c
(1 1 0)
(100)
a2
a1 [100 ]
[110 ]
整理课件
25
第二章 固体结构
根据六方晶系的对称特点,通常采用a1, a2, a3和c四个晶轴确
定六方晶系的晶面指数和晶向指数。
具有相同空间点阵的不同晶体结构
晶体结构相似而具有空间点阵不同
整理课件
13
第二章 固体结构
二、晶向指数和晶面指数
(Miller Indices of Crystallographic Direction and Planes) 1、晶向与晶向指数
hu+kv+lw=0
此关系称为晶带定理。满足该关系的(hkl)晶面都属于以
[uvw]为晶带轴的晶带。
[uvw]
整理课件
32
第二章 固体结构
利用晶带定理:
①已知两个不平行的晶面(h1k1l1)和(h2k2l2),求出其晶带 轴[uvw]。
u : v : w ( k 1 l 2 k 2 l 1 ) : ( l 1 h 2 l 2 h 1 ) : ( h 1 k 2 h 2 k 1 )
整理课件
16
第二章 固体结构
整理课件
17
第二章 固体结构
整理课件
18
第二章 固体结构
整理课件
19
第二章 固体结构
整理课件
20
第二章 固体结构
整理课件
21
第二章 固体结构
整理课件
22
第二章 固体结构
晶面族:原子排列规律、面间距完全相同,仅空间位向 关系不同的一组晶面(等价晶面),以{h k l}表示。
如六个柱面分别为: ( 1 0 0 ),(0 1 0 ),(1 1 0 ),(1 0 0 ),(0 1 0 ),( 1 1 0 ) c
(1 1 0)
(100)
a2
a1 [100 ]
[110 ]
整理课件
25
第二章 固体结构
根据六方晶系的对称特点,通常采用a1, a2, a3和c四个晶轴确
定六方晶系的晶面指数和晶向指数。
具有相同空间点阵的不同晶体结构
晶体结构相似而具有空间点阵不同
整理课件
13
第二章 固体结构
二、晶向指数和晶面指数
(Miller Indices of Crystallographic Direction and Planes) 1、晶向与晶向指数
材料科学基础2课件(1)

钠长石 Na[AlSi3O8]
绿柱石 Be3Al2(SiO3)6
硫
祖母绿
蓝宝石
放大1000倍的雪花
晶体概念的发展
几种不同外形的石英晶体——内部质点的规则排列形成规 则的多面体外形
晶体的棱角:面和棱的存在以及它们之间的规 则性是晶体的宏观特性之一。晶体自发生长成 规则几何外形的性质称为自限性。互相平行的 面之间的夹角是守恒的,这些平行的面称为对 应面,对应面的这种关系称为面角守恒定律。
立方晶系: <111>=[111]+[111]+[111]+[111]+[111]+[111]
+[111]+[111]
晶面指数
晶格中同一平面上的格 点构成一个晶面
整个晶格可以看成是由 无数互相平行且等距离 分布的全同的晶面构成
晶格的所有格点都处在 这族晶面上而无遗漏
晶格中存在无数取向不 同的晶面族
初基晶轴构成的平行六面体称为初基晶胞。 点阵平移矢量定义为:
T= u a+v b+w c 任意两个阵点都可以用这种形式的矢量连接
起来。 初基晶胞在空间无限重复构成空间点阵。
7个晶系 14种布拉菲点阵
根据六个点阵参数间的关系,可将全部空 间点阵归属于7种类型,即七个晶系
按照每个阵点周围环境相同的要求,用数 学方法可以推导出能够反映空间点阵全部 特征的单位平行六面体只有14种,称为14 种布拉菲点阵z c Nhomakorabeaa
x
by
晶胞、晶轴和点阵参数
晶胞的描述
图 空间点阵
点阵的描述
点阵平移矢量:
以任意一个阵点为原点,以矢 量a, b, c为坐标基矢,其他任 意阵点可表示为:
材料科学基础固体结构之幻灯片PPT

5.节约规那么
鲍林第五规那么指出:"在同一晶体 中,同种正离子与同种负离子的结合方式 应最大限度地趋于一致。"因为在一个均 匀的构造中,不同形状的配位多面体很难 有效堆积在一起。
体1 =2
密排六方构造
n = 12*1/6 +2*1/2 +3 = 6
2.点阵常数与原子半径: 晶胞的大小一般是由晶胞的棱边长
度〔即a,b,c〕衡量的,它是表征晶体构 造的一个重要根本参数。
如果把金属原子看作刚球,并 设其半径为R,根据几何学关系 不难求出三种典型金属晶体构 造的点阵常数与R之间的关系:
离子晶体中,正离子的配位数通常为4和6, 但也有少数为3,8,12。
2.电价规那么
在一个稳定的离子晶体构造中,每个负 离子的电价Z-等于或接近等于与之相邻接 的各正离子静电强度S 的总和。这就是鲍 林第二规那么,也称电价规那么。
正离子的静电 :S键 Z强 n 度
负离子的:Z电 价Si Z/ni
式中K为致密度;n为晶胞中原子数;v是一个原子的 体积。
fcc: CN=12, K=0.74 bcc: CN=8+6, K=0.68 hcp: CN=6+6, K=0.74
4 晶体的原子堆垛方式和间隙
原子密排面在空间一层一层平行的堆垛起 来就分别构成以上三种晶体构造。
面心立方和密排六方构造的致密度均为 0.74,是纯金属中最密集的构造。
面心立方点阵中的间隙
密排六方点阵中的间隙
二. 多晶型性
有些固态金属在不同的温度和压力下具有不同的晶体构造即具有 多晶型性,转变的产物称为同素异构体。
例如,铁在912℃以下为体心立方构造。称为α-Fe;在912~ 1394℃具有面心立方构造,称为γ-Fe;温度超过1394℃至熔点间 又变成体心立方构造,称为δ-Fe。由于不同晶体构造的致密度不 同,当金属由一种晶体构造变为另一种晶体构造时,将伴随有质 量体积的跃变即体积的突变。
固体物理课件 第一章 晶体结构

晶面指数(122)
a
c b
(100)
(110)
(111)
在固体物理学中,为了从本质上分析固体的性质,经常要研究晶体中的 波。根据德布罗意在1924年提出的物质波的概念,任何基本粒子都可以 看成波,也就是具备波粒二象性。这是物理学中的基本概念,在固体物 理学中也是一个贯穿始终的概念。
在研究晶体结构时,必须分析x射线(电磁波)在晶体中的传播和衍射 在解释固体热性质的晶格振动理论中,原子的振动以机械波的形式在晶 体中传播;
1 3 Ω = a1 ⋅ a 2 × a 3 = a 2
(
)
金刚石
c
c
面心立方
钙钛矿 CaTiO3 (ABO3)
Ca
O
Ti
简单立方
所有的格点都分布在相互平行的一族平面 上,且每个平面上都有格点分布,这样的 平面称为晶面,该平面组称为晶面族。
特征: (1)同一晶面族中的晶面相互平行; (2)相邻晶面之间的间距相等;(面间距是
至今为止,晶体内部结构的观测还需要依靠衍射现象来进行。
(1)X射线 -由高速电子撞击物质的原子所产生的电磁波。 早在1895年伦琴发现x射线之后不久,劳厄等在1912年就意识到X射线的 波长在0.1nm量级,与晶体中的原子间距相同,晶体中的原子如果按点阵排 列,晶体必可成为X射线的天然三维衍射光栅,会发生衍射现象。在 Friedrich和Knipping的协助下,照出了硫酸铜晶体的衍射斑,并作出了正确 的理论解释。随后,1913年布拉格父子建立了X射线衍射理论,并制造了第 一台X射线摄谱仪,建立了晶体结构研究的第一个实验分析方法,先后测定 了氯化钠、氯化钾、金刚石、石英等晶体的结构。从而历史性地一举奠定 了用X射线衍射测定晶体的原子周期性长程序结构的地位。 时至今日,X射线衍射(XRD)仍为确定晶体结构,包括只具有短程序的无 定型材料结构的重要工具。
固体结构

பைடு நூலகம்
3.离子的极化力 影响因素:离子的电荷,离子的半径,离子的外层电子构型 4.离子的变形性 影响因素:离子电荷,离子的半径,离子的外层电子构型 5.附加极化力: 一些18电子或者18+2电子构型的阳离子,他们的极化和变形性都很强, 当它们对阴离子产生极化作用的时候,本身也会被阴离子所极化,阴 阳离子相互极化的结果,使彼此变形性增大,诱导偶极增大,相邻异 极电荷更加集中,导致彼此的极化力都进一步加强,这种因相互极化 而增大的极化能力,称为附加极化力. 6.离子极化对物质结构和性质的影响 (1).键型过度:离子极化的结果,使正负离子之间产生了额外的吸引 力,甚至有可能使两个离子的轨道或者电子云产生变形而导致轨道的 相互重叠,致使离子间距离减小,键的离子性降低而共价键增强,离 子相互极化越强,就有可能由离子键过度到共价键。 (2). 性质的改变: a.溶解度的变化 b.化合物颜色的变化 c.晶体的熔点
第十章 固体结构
10.1晶体结构类型 10.1.1晶体结构的特征与晶体理论 1. 晶体理论的基本概念: a. 晶格:组成晶体的微粒在空间作用下有规则的排列,如果把这些微粒 抽象成几何点,那样这些几何点就具有一定的几何形状。我们把从晶体 中抽象出来的几何图形称为点阵。 b. 晶胞:晶胞是包括晶格点上的微粒在内的平行六面体。它的晶体的最 小重复单位,通过晶胞在空间平行并无隙地堆砌而成晶体。 10.1.2晶体缺陷 非晶体 1.晶体缺陷: a.定义:晶体中一切偏离理想的晶格结构都称为晶体的缺陷 b.种类:本征缺陷和杂质缺陷 2.非晶体 10.1.3晶体类型 简介金属晶体,离子晶体,分子晶体和原子晶体
10.4.2氢键 1.定义:是指氢原子与电负性的较大的某原子以极性共价键结合时,还能 吸引另外一个电负性较大,而且半径较小的某原子,也可不同的孤对 电子所形成的分子间或者离子间的键 2.特征 (1).氢键的键能比化学键的键能要弱的多,与分子间力有相同的数量级 (2).氢键具有饱和性和方向性。 3.种类: (1).分子间氢键 (2).分子内氢键 硝酸的熔点和沸点较低,酸性较强,都与分子内氢键有关 4.实质:氢键是一种静电吸引作用 5.氢键与分子间力的区别与联系 (1).区别:氢键有方向性和饱和性,而分子键无方向性和饱和性,而且氢 键可以存在分子之间 (2).联系:都是一种静电吸引作用;分子间作用与氢键的键能具有相同的 数量级。
3.离子的极化力 影响因素:离子的电荷,离子的半径,离子的外层电子构型 4.离子的变形性 影响因素:离子电荷,离子的半径,离子的外层电子构型 5.附加极化力: 一些18电子或者18+2电子构型的阳离子,他们的极化和变形性都很强, 当它们对阴离子产生极化作用的时候,本身也会被阴离子所极化,阴 阳离子相互极化的结果,使彼此变形性增大,诱导偶极增大,相邻异 极电荷更加集中,导致彼此的极化力都进一步加强,这种因相互极化 而增大的极化能力,称为附加极化力. 6.离子极化对物质结构和性质的影响 (1).键型过度:离子极化的结果,使正负离子之间产生了额外的吸引 力,甚至有可能使两个离子的轨道或者电子云产生变形而导致轨道的 相互重叠,致使离子间距离减小,键的离子性降低而共价键增强,离 子相互极化越强,就有可能由离子键过度到共价键。 (2). 性质的改变: a.溶解度的变化 b.化合物颜色的变化 c.晶体的熔点
第十章 固体结构
10.1晶体结构类型 10.1.1晶体结构的特征与晶体理论 1. 晶体理论的基本概念: a. 晶格:组成晶体的微粒在空间作用下有规则的排列,如果把这些微粒 抽象成几何点,那样这些几何点就具有一定的几何形状。我们把从晶体 中抽象出来的几何图形称为点阵。 b. 晶胞:晶胞是包括晶格点上的微粒在内的平行六面体。它的晶体的最 小重复单位,通过晶胞在空间平行并无隙地堆砌而成晶体。 10.1.2晶体缺陷 非晶体 1.晶体缺陷: a.定义:晶体中一切偏离理想的晶格结构都称为晶体的缺陷 b.种类:本征缺陷和杂质缺陷 2.非晶体 10.1.3晶体类型 简介金属晶体,离子晶体,分子晶体和原子晶体
10.4.2氢键 1.定义:是指氢原子与电负性的较大的某原子以极性共价键结合时,还能 吸引另外一个电负性较大,而且半径较小的某原子,也可不同的孤对 电子所形成的分子间或者离子间的键 2.特征 (1).氢键的键能比化学键的键能要弱的多,与分子间力有相同的数量级 (2).氢键具有饱和性和方向性。 3.种类: (1).分子间氢键 (2).分子内氢键 硝酸的熔点和沸点较低,酸性较强,都与分子内氢键有关 4.实质:氢键是一种静电吸引作用 5.氢键与分子间力的区别与联系 (1).区别:氢键有方向性和饱和性,而分子键无方向性和饱和性,而且氢 键可以存在分子之间 (2).联系:都是一种静电吸引作用;分子间作用与氢键的键能具有相同的 数量级。
(完整版)固体物理课件ppt完全版

布拉伐格子 + 基元 = 晶体结构
③ 格矢量:若在布拉伐格子中取格点为原点,它至其
他格点的矢量 Rl 称为格矢量。可表示为
Rl
l1a1
l2a2
l3a3
,
a1,
a2 ,
a3为
一组基矢
注意事项:
1)一个布拉伐格子基矢的取法不是唯一的
2
4x
·
1
3
二维布拉伐格子几种可能的基矢和原胞取法 2)不同的基矢一般形成不同的布拉伐格子
2·堆积方式:AB AB AB……,上、下两个底面为A
层,中间的三个原子为 B 层
3·原胞:
a, 1
a 2
在密排面内,互成1200角,a3
沿垂直
密排面的方向构成的菱形柱体 → 原胞
B A
六角密排晶格的堆积方式
A
a
B c
六角密排晶格结构的典型单元
a3
a1
a2
六角密排晶格结构的原胞
4·注意: A 层中的原子≠ B 层中的原子 → 复式晶格
bγ a
b a
b a
b a
简六体心底正简单三面心正单方底心单心交 立斜交斜 方 简单立方体心正交面立方简四体心四方简单正交简单菱方简单单斜单方
二 、原胞
所有晶格的共同特点 — 具有周期性(平移对称性)
描
用原胞和基矢来描述
述
方
位置坐标描述
式
1、 定义:
原胞:一个晶格最小的周期性单元,也称为固体物理 学原胞
a1, a2 , a3 为晶格基矢
复式晶格:
l1, l2 , l3 为一组整数
每个原子的位置坐标:r l1a1 l2a2 l3a3
固体物理课件第二章_晶体的结构

Na+构成面心立方格子 Cl-也构成面心立方格子
(6) CsCl: 由两个简单立方子晶格彼此沿 立方体空间对角线位移1/2 的长度套构而成
(7) 闪锌矿结构
化合物半导体 —— 锑化铟、砷化镓、磷化铟 面心立方的嵌套
(8) 钙钛矿结构
钛酸钙(CaTiO3) 钛酸钡(BaTiO3) 锆酸铅(PbZrO3) 铌酸锂(LiNbO3) 钽酸锂(LiTaO3)等
面心立方格子:原点和12个近邻格点连线的垂 直平分面围成的正十二面体
体心立方格子:原点和8个近邻格点连线的垂直 平分面围成的正八面体,沿立方轴的6个次近 邻格点连线的垂直平分面割去八面体的六个角, 形成的14面体 —— 八个面是正六边形,六个面是正四边形
§1.2 晶列和晶面
思考: 金刚石为什么有固定的面? 这些面和晶格结构有什么关系?
根据周期性:
f e
k k
ikx
fk e
k
ik ( x na )
f k eikx f k eik( x na)
k k
e
ik na
1
m 0,1,2,
k na k Rn 2m
2 k h Gh a
k=b的波传过一个晶格长度,相位改变2π
晶面:所有结点可以看成分布在一系列相互平 行等距的平面族上,每个平面族称为一个晶面 晶面用法向或晶面指数标志
例:同一个格子,两组不同的晶面族
晶面的性质: –晶格中一族的晶面不仅平行,并且等距 –一族晶面必包含了所有格点 –三个基矢末端的格点必分别落在该族的不 同晶面上(有理指数定理)
晶面(米勒)指数:晶面把基矢 a1 , a2 , a3 分别
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Packing); 体心立方堆积(Body-Centred Cubic Packing)。
.
10.1.3 球的密堆积
1、六方密堆积:(Hexgonal Close Packing) hcp 第三层与第一层对齐,产生ABAB…方 式。 配位数:12 空间占有率: 74.05%
.
2、面心立方密堆积:(Face-Centred Cubic Close Packing) fcc
边 长 a=b=c a=b=c a = b≠ c a = b≠ c a≠ b≠ c a≠ b≠ c a≠ b≠ c
夹 角
α=β=γ= 900 α=β=γ≠ 900 α=β=γ= 900 α=β=900, γ=1200 α=β=γ= 900 α=β=900, γ≠900 α≠ β≠ γ≠ 900
晶 体 实 例
NaCl Al2O3 SnO2 AgI HgCl2 KClO3 CuSO4· 5H2O
按带心型式分类,将七大晶系分为14种
型式。例如,立方晶系分为简单立方、体心
立方和面心立方三种.型式。
.
金属晶体中粒子的排列方式常见的有三种: 六方密堆积(Hexgonal Close Packing); 面心立方密堆积(Face-Centred Cubic Close
△ rHm78k6Jmo-1l U 78k6.Jmo-1l
1、Born-Haber循环
K(s) +
1 2
Br
2
(l)
气化热 △ rHm,3
升
1
华 焓
△
rHm,1 1
2
2
键能
Br2 (g)
△ rHm,4
△fHm
K(g)
Br (g)
△ rHm,5
电子亲和能
△ rHm,2
电离能
ቤተ መጻሕፍቲ ባይዱ
KBr(s)
U △ rHm,6
八面体空隙: 一层的三个球 与错位排列的 另一层三个球 间的空隙。
.
10.1.4 晶体类型
晶体的分类
组成 粒子
粒子间 作用力
物理性质
熔沸点
硬度
熔融导 电性
例
金属晶体
原子 离子
金属键 高低
大小
好
Cr, K
原子晶体 原子 共价键 高
大
差 SiO 2
离子晶体 离子 离子键 高
大
好 NaCl
分子晶体
分子
分子间 力
由晶胞参数a,b,c,
α,β,γ表示, a,b,c 为六面体边长, α,β,
γ 分别是bc , ca , ab 所 组成的夹角。
.
2、晶胞的内容:粒子的种类,数目及它在 晶胞中的相对位置。
按晶胞参数的差异将晶体分成七种晶系。
晶 系 立 方 晶 系 三 方 晶 系 四 方 晶 系 六 方 晶 系 正 交 晶 系 单 斜 晶 系 三 斜 晶 系
晶胞中离子的个数: Zn2:4个
S2-: 61814个
.
28
半径比(r+/r-)规则: 其中一层横截面: (4r)22(2r2r)2
令r 1
r/r 0.414
NaCl晶体
.
r/r 0.414理想的稳定结构(NaCl)
r / r 0.225 → 0.414 0.414 → 0.732 0.732 → 1.00
半径比规则
配位数 4 6 8
.
构型 ZnS 型 NaCl 型 CsCl 型
10.3.2 晶格能
定义:在标准状态下,按下列化学反
应计量式使离子晶体变为气体正离子和气
态负离子时所吸收的能量称为晶格能,用
U 表示。 MaXb(s)
例如:NaCl(s)
aMb+(g) + bXa-(g) △rHm Na+ (g) + Cl- (g)
第三层与 第一层有错位, 以 ABCABC… 配方位式数排:列1。2 空间占有率:
74.05%
.
3.体心立方堆积:(Body-Centred Cubic Packing) bcc 配位数:8
空间占有率: 68.02%
.
密堆积层间的两类空隙
四面体空隙: 一层的三个球 与上或下层密 堆积的球间的 空隙。
(红球-Na+ ,
绿球-Cl-)
Na: 12114个 Cl: 81614个
4
82
.
CsCl型
晶格: 简单立方 配位比: 8:8 (红球-Cs+ , 绿球-Cl-)
Cs:1个
晶胞中离子的个数: Cl-:811个 8
.
ZnS型(立方型)
晶格:面心立方
配位比:4:4
(红球-Zn2+ , 绿球-S2-)
10.3.1 离子晶体的特征结构 10.3.2 晶格能 10.3.3 离子极化
10.3.1 离子晶体的特征结构
离子晶体:密堆积空隙的填充。 阴离子:大球,密堆积,形成空隙。 阳离子:小球,填充空隙。 规则:阴阳离子相互接触稳定;
配位数大,稳定。
.
1、三种典型的离子晶体 NaCl型 晶格:面心立方 配位比:6:6 晶胞中离子的个数:
低
小
差 干冰
.
§10.2 金属晶体
10.2.1 金属晶体的结构 10.2.2 金属键理论 10.2.3 金属合金
10.2.1 金属晶体的结构
金属晶体是金属原子或离子彼此靠金 属键结合而成的。金属键没有方向性,金 属晶体内原子以配位数高为特征。 金属晶体的结构:等径球的密堆积。
.
§10.3 离子晶体
Br (g) +
K + (g)
.
△fHm= △ rHm,1 + △ rHm,2 +△ rHm,3 +△ rHm,4 +△ rHm,5 + △ rHm,6
△ rHm,1=89.2kJ·mol-1 △ rHm,2=418.8kJ·mol-1 △ rHm,3=15.5kJ·mol-1 △ rHm,4 =96.5kJ·mol-1 △ rHm,5=-324.7kJ·mol-1 △fHm =295.3kJ·mol-1
上述数据代入上式求得:
第十章 固体结构
§10.1 §10.2 §10.3 §10.4 §10.5
晶体结构和类型 金属晶体 离子晶体 分子晶体 层状晶体
本章重点:
1、晶胞参数 a,b,c,α,β,γ;
2、晶胞、球的密堆积; 3、晶体类型(金属晶体、原子晶体、离子晶体、
分子晶体) 4、三种典型的离子晶体(NaCl、CsCl、ZnS) 5、离子的极化率(α) 、离子的极化力(f ) 6、分子间作用力(色散力、诱导力、取向力)
.
§10.1 晶体结构和类型
10.1.1 晶体结构的特征与晶格理论 10.1.2 晶体缺陷 非晶体 10.1.3 球的密堆积 10.1.4 晶体类型
10.1.1 晶体结构的特征与晶格理论
晶胞:晶体的最小重复单元,通过晶胞 在空间平移无隙地堆砌而成晶体。 晶胞的两个要素: 1. 晶胞的大小与形状:
.
10.1.3 球的密堆积
1、六方密堆积:(Hexgonal Close Packing) hcp 第三层与第一层对齐,产生ABAB…方 式。 配位数:12 空间占有率: 74.05%
.
2、面心立方密堆积:(Face-Centred Cubic Close Packing) fcc
边 长 a=b=c a=b=c a = b≠ c a = b≠ c a≠ b≠ c a≠ b≠ c a≠ b≠ c
夹 角
α=β=γ= 900 α=β=γ≠ 900 α=β=γ= 900 α=β=900, γ=1200 α=β=γ= 900 α=β=900, γ≠900 α≠ β≠ γ≠ 900
晶 体 实 例
NaCl Al2O3 SnO2 AgI HgCl2 KClO3 CuSO4· 5H2O
按带心型式分类,将七大晶系分为14种
型式。例如,立方晶系分为简单立方、体心
立方和面心立方三种.型式。
.
金属晶体中粒子的排列方式常见的有三种: 六方密堆积(Hexgonal Close Packing); 面心立方密堆积(Face-Centred Cubic Close
△ rHm78k6Jmo-1l U 78k6.Jmo-1l
1、Born-Haber循环
K(s) +
1 2
Br
2
(l)
气化热 △ rHm,3
升
1
华 焓
△
rHm,1 1
2
2
键能
Br2 (g)
△ rHm,4
△fHm
K(g)
Br (g)
△ rHm,5
电子亲和能
△ rHm,2
电离能
ቤተ መጻሕፍቲ ባይዱ
KBr(s)
U △ rHm,6
八面体空隙: 一层的三个球 与错位排列的 另一层三个球 间的空隙。
.
10.1.4 晶体类型
晶体的分类
组成 粒子
粒子间 作用力
物理性质
熔沸点
硬度
熔融导 电性
例
金属晶体
原子 离子
金属键 高低
大小
好
Cr, K
原子晶体 原子 共价键 高
大
差 SiO 2
离子晶体 离子 离子键 高
大
好 NaCl
分子晶体
分子
分子间 力
由晶胞参数a,b,c,
α,β,γ表示, a,b,c 为六面体边长, α,β,
γ 分别是bc , ca , ab 所 组成的夹角。
.
2、晶胞的内容:粒子的种类,数目及它在 晶胞中的相对位置。
按晶胞参数的差异将晶体分成七种晶系。
晶 系 立 方 晶 系 三 方 晶 系 四 方 晶 系 六 方 晶 系 正 交 晶 系 单 斜 晶 系 三 斜 晶 系
晶胞中离子的个数: Zn2:4个
S2-: 61814个
.
28
半径比(r+/r-)规则: 其中一层横截面: (4r)22(2r2r)2
令r 1
r/r 0.414
NaCl晶体
.
r/r 0.414理想的稳定结构(NaCl)
r / r 0.225 → 0.414 0.414 → 0.732 0.732 → 1.00
半径比规则
配位数 4 6 8
.
构型 ZnS 型 NaCl 型 CsCl 型
10.3.2 晶格能
定义:在标准状态下,按下列化学反
应计量式使离子晶体变为气体正离子和气
态负离子时所吸收的能量称为晶格能,用
U 表示。 MaXb(s)
例如:NaCl(s)
aMb+(g) + bXa-(g) △rHm Na+ (g) + Cl- (g)
第三层与 第一层有错位, 以 ABCABC… 配方位式数排:列1。2 空间占有率:
74.05%
.
3.体心立方堆积:(Body-Centred Cubic Packing) bcc 配位数:8
空间占有率: 68.02%
.
密堆积层间的两类空隙
四面体空隙: 一层的三个球 与上或下层密 堆积的球间的 空隙。
(红球-Na+ ,
绿球-Cl-)
Na: 12114个 Cl: 81614个
4
82
.
CsCl型
晶格: 简单立方 配位比: 8:8 (红球-Cs+ , 绿球-Cl-)
Cs:1个
晶胞中离子的个数: Cl-:811个 8
.
ZnS型(立方型)
晶格:面心立方
配位比:4:4
(红球-Zn2+ , 绿球-S2-)
10.3.1 离子晶体的特征结构 10.3.2 晶格能 10.3.3 离子极化
10.3.1 离子晶体的特征结构
离子晶体:密堆积空隙的填充。 阴离子:大球,密堆积,形成空隙。 阳离子:小球,填充空隙。 规则:阴阳离子相互接触稳定;
配位数大,稳定。
.
1、三种典型的离子晶体 NaCl型 晶格:面心立方 配位比:6:6 晶胞中离子的个数:
低
小
差 干冰
.
§10.2 金属晶体
10.2.1 金属晶体的结构 10.2.2 金属键理论 10.2.3 金属合金
10.2.1 金属晶体的结构
金属晶体是金属原子或离子彼此靠金 属键结合而成的。金属键没有方向性,金 属晶体内原子以配位数高为特征。 金属晶体的结构:等径球的密堆积。
.
§10.3 离子晶体
Br (g) +
K + (g)
.
△fHm= △ rHm,1 + △ rHm,2 +△ rHm,3 +△ rHm,4 +△ rHm,5 + △ rHm,6
△ rHm,1=89.2kJ·mol-1 △ rHm,2=418.8kJ·mol-1 △ rHm,3=15.5kJ·mol-1 △ rHm,4 =96.5kJ·mol-1 △ rHm,5=-324.7kJ·mol-1 △fHm =295.3kJ·mol-1
上述数据代入上式求得:
第十章 固体结构
§10.1 §10.2 §10.3 §10.4 §10.5
晶体结构和类型 金属晶体 离子晶体 分子晶体 层状晶体
本章重点:
1、晶胞参数 a,b,c,α,β,γ;
2、晶胞、球的密堆积; 3、晶体类型(金属晶体、原子晶体、离子晶体、
分子晶体) 4、三种典型的离子晶体(NaCl、CsCl、ZnS) 5、离子的极化率(α) 、离子的极化力(f ) 6、分子间作用力(色散力、诱导力、取向力)
.
§10.1 晶体结构和类型
10.1.1 晶体结构的特征与晶格理论 10.1.2 晶体缺陷 非晶体 10.1.3 球的密堆积 10.1.4 晶体类型
10.1.1 晶体结构的特征与晶格理论
晶胞:晶体的最小重复单元,通过晶胞 在空间平移无隙地堆砌而成晶体。 晶胞的两个要素: 1. 晶胞的大小与形状:
