催化原理及锂空气电池
锂空气电池解析

锂空气电池有一个重要的问题:Li2O2无法溶解于有机电解液中, Li2O2将不断 在负极材料表面沉积,这将阻止O2的进入,导致放电终止。因此气电极是关键因素。
锂空气电池中所用的空气电极通常由多孔碳组成,多孔碳结构可以为O2向碳-电 解液界面的扩散提供气体传输通道,同时多孔结构可以为放电过程中形成的Li2O2 提供存储空间。当碳材料的孔道完全被Li2O2所填充时,放电过程将会终止。电解液在 孔道内的传输也将是决定锂空气电池能量储存的另一重要参数。以上各方面表明,
多孔碳材料的微观结构将严重影响电池的性能。研究新型的多孔碳电极材料,从
而提高容量、能量及功率密度,并且改善体系的稳定性,已经成为该领域的研究
热点。
空气电极——多孔碳材料
系列研究表明,碳材料的结构、 孔容、孔径、比表面积等因素对电 池的性能有很大的影响。
在实际应用中,非水电解质锂空 气电池性能要低于理论值,主要是 因为Li与O2反应后会在空气电极的 表面生成不溶于非水电解质的Li2O2 或Li2O产物,该产物逐步堵住碳载 体的孔道,O2和Li+无法再通过孔道 传递,放电过程被迫终止。但同时 发现,并非所有空气电极的孔容而 是仅部分孔容被填满,放电过程即 终止。由右图可知,大部分氧化产 物沉淀在不超过20%孔纵深的孔口 周围。
问题。
锂-空气电池

为了减少气体扩散对电池性能的影响, Williford等设计了一种双重相互连通的孔隙系统 (一边有催化剂,另一边无催化剂)提高氧气传 输到空气电极内部的几率,从而提高锂空气电池 的效率。 通过上述对多孔碳空气电极的研究表明,孔容 (孔隙率)是决定多孔碳空气电机性能非常重要 的参数。一般而言,在反应比表面积充足的情况 下,碳材料的孔容越大,储存锂氧化物的空间就 越大,其容量也就越高。
4.2催化剂的效率
催化剂的催化效果不仅与其自身化学性质有关, 而且与其物理性质有关。
应用在空气电极上的催化剂种类较多,主要有以
下四种类:(1)多孔碳材料;(2)金属氧化物材料;(3) 贵金属及合金;(4)金属菁化合物。
对空气中催化剂的选择一方面要考虑催化剂的价
格,能够满足大规模商业化的应用;另一方面要 考虑催化剂的催化性能,能够满足答功率电化学 反应的要求。
主要内容: 1、锂-空气电池材料的主要问题 2、锂电极的保护 3、电解质材料 4、锂空气电极材料
1、锂-空气电池材料的主要问题
目前,锂-空气电池的研究还处于初始阶段,其 实际比能量还远远达不到其理论值,比功率较低、 循环性能也较差。目前制约其发展和应用的因素 有很多,以锂-空气电池为例,在电池材料方面主 要有:
图五为放电时间与孔隙结构之间的关系,其中 电极厚度为0.070cm,氧气分压为1.0atm,电流 密度为0.5mA.cm-2,电池总放电时间为56h。
Mirzaeian等采用碳酸钠催化剂与碳气凝胶复合作 为空气电极,研究了多孔碳的结构,孔隙率,孔径 以及比表面积对电池放电容量的影响。结果表明, 在孔容(2.195cm3.g-1)和孔径(14.23nm)时, 具有较高的放电容量(1290mAh.g-1,放电电流密 度20mA.cm-2)。 在相同厚度的空气电极中,碳的装载量与孔容是影 响电池放电容量的两个重要参数。在一定程度范围 内,随着碳装载量的增加,放电容量会有所提高。 Hayashi等研究了不同种类的碳材料作为空气电极 时电池的电化学性能。高的碳材料比表面积对应大 的放电容量。
新能源材料-金属空气电池ppt课件

7.3 锌空气电池
7.3.3 基本特性
(1)充电特性
锌空气电池的充电模式,打破了普通蓄电池的常规充电 模式,采用机械式更换电池的锌板或锌粒的"充电"模式,整 体更换锌空气电池的活性物质,将整个锌空气电池进行更换 ,电池不再需要花很长的时间来充电,更换一块20kWh的电 池块只需要1分40秒。只要在公路沿线设置锌板或锌粒匣以及 电解质器匣的机械式整体更换站,其效果如同现在内燃机汽 车的加油站,直接"充电",可以为用户提供很大的方便。
金属/空气电池由具有反应活性的负极和空气电极经电化 学反应偶合而成,它的正极反应物用之不尽。在某些情况 下,金属/空气电池具有很高的质量比能量和体积比能量。 这一体系的极限容量取决于负极的安时容量和反应产物的 贮存与处理技术。
已经研究和开发过的金属/空气电池有原电池、贮备电 池、可充电电池和机械再充式电池等。在机械充电电池设 计(即更换放完电的金属负极)中,电池在本质上相当于原电 池,它的空气电极为相对简单的“单功能”电极,只需要 在放电模式下工作。常规可充电金属/空气电池需要一个第 三电极(用来维持充电时放出氧气)或者一个“双功能”电极 (一个既可以还原氧又可以析氧的电极) 。
7.2 空气电极
7.2.2 外界环境的影响
(1)空气中的CO2的影响
在碱性环境中,二氧化碳会形成碱式碳酸盐而沉积在电 极的微孔结构中,故应使空气中的CO2始终维持在10010-6 以下。
(2)其他影响
锌电极中合金元素的特性和电解液都有可能影响空气电 极的性能和寿命。此外,活性物质中有害物质、隔膜的稳定 性与抗氧化性等因素对锌空气电池性能均有不同程度的影响 。
7.3 锌空气电池
7.3.2 结构
糊状的锌粉在阳极端,起催化作用的碳在阴极。电池壳体上的孔可 让空气中的氧进入腔体附着在阴极的碳上。同时,阳极的锌被氧化。 阴极——是起催化作用的碳从空气中吸收氧。 阳极——是锌粉和电解液的混合物,成糊状。 电解液——高浓度的氢氧化钾水溶液。 隔离层——用于隔离两级间固体 粉粒的移动。 绝缘和密封衬垫——尼龙材料。 电池外表面——镍金属外 壳,具有良好的防腐性的 导体。
锂离子电池原理及工艺大全

锂离子电池是一种二次电池(充电电池),它主要依靠Li+ 在两个电极之间往返嵌入和脱嵌来工作,它主要有能量密度高,充电时间快,使用寿命长等特点。
随着能源汽车下游产业不断发展,锂离子电池的生产规正在不断扩大。
锂离子电池原理及工艺 - 大全2018锂离子电池简介一,锂离子电池的原理、配方和工艺流程•1、工作原理•1.1正极构造•LiCoO2 + 导电剂 + 粘合剂 (PVDF) + 集流体(铝箔)•1.2负极构造•石墨 + 导电剂 + 增稠剂 (CMC) + 粘结剂 (SBR) + 集流体(铜箔)•1.3工作原理•1.3.1 充电过程•一个电源给电池充电,此时正极上的电子e从通过外部电路跑到负极上,正锂离子Li+从正极“跳进”电解液里,“爬过”隔膜上弯弯曲曲的小洞,“游泳”到达负极,与早就跑过来的电子结合在一起。
此时:正负极物理反应为:•1.3.2 电池放电过程•放电有恒流放电和恒阻放电,恒流放电其实是在外电路加一个可以随电压变化而变化的可变电阻,恒阻放电的实质都是在电池正负极加一个电阻让电子通过。
由此可知,只要负极上的电子不能从负极跑到正极,电池就不会放电。
电子和Li+都是同时行动的,方向相同但路不同,放电时,电子从负极经过电子导体跑到正极,锂离子Li+从负极“跳进”电解液里,“爬过”隔膜上弯弯曲曲的小洞,“游泳”到达正极,与早就跑过来的电子结合在一起。
•1.3.3 充放电特性•电芯正极采用LiCoO2 、LiNiO2、LiMn2O2,其中LiCoO2本是一种层结构很稳定的晶型,但当从LiCoO2拿走x个Li离子后,其结构可能发生变化,但是否发生变化取决于x的大小。
通过研究发现当x >0.5时,Li1-xCoO2的结构表现为极其不稳定,会发生晶型瘫塌,其外部表现为电芯的压倒终结。
所以电芯在使用过程中应通过限制充电电压来控制Li1-xCoO2中的x值,一般充电电压不大于4.2V那么x小于0.5 ,这时Li1-xCoO2的晶型仍是稳定的。
锌空气电池与锂空气电池

3.金属空气电池提供了很好的电化学性能,包括锌空气电池、镁空气电池、铁空 气电池、钙空气电池、锂空气电池等。在这些金属空气电池中,金属负极储存 能量,正极空气电极只是作为能量转换的工具,氧气来自空气中,取之不尽,这
样也就带来巨大的比能量,通常金属空气电池的理论比能量均在1000mAh.g-1
锌空气电池与锂空气电池
———从电池的工作原理与组成等方面介绍了锌空气 电池与锂空气电池的研究进展
报告人:赵啸宇,端木凡朋
精品课件
锌-空气电池
研究背景 :锌-空气电池的开发过程分为四代 工作原理 :基本的电极反应 电池结构 :以纽扣电池为例介绍基本结构 工作特性 :锌-空气电池工作时的特殊性质
步骤)
O2+H2O+2e→O2H-+OH-
O2H-→OH-+1∕2O2( 速控
精品课件
简化电池截面图
金属氧化物纽扣电池
负极壳 绝缘垫圈 锌负极
隔膜 正极 正极壳
锌空气纽扣电池
精品课件
电池结构
正极
隔膜 催化层 金属网 疏水膜 扩散膜 空气分散膜
精品课件
电池结构
负极内部将会预留15%-20%的体积为负极自由体积 催化层组分为碳与锰的氧化物混合所形成的导电介质 正极通过添加很细的聚四氟乙烯微粒,增加疏水性 金属网构成结构支架,并且作为集流体 疏水膜保持空气和电解液之间的界面,能防止气体透过和防止
精品课件
研究背景
精品课件
第二代锌-空气电池——纽扣电池
体积小,从纽扣到硬币大小 上世纪七十年代曾被作为助听器商业化
精品课件
工作原理
锌-空气电池直接使用空气中的氧气参与产生电能的化学反应 负极:Zn→Zn2++2e
ncm电池工作原理

ncm电池工作原理
NCM电池是一种锂离子电池,其工作原理涉及电化学反应和能
量存储。
NCM电池的名称源自其主要由镍(N)、钴(C)和锰(M)
组成的正极材料。
以下是关于NCM电池工作原理的全面解释:
1. 正负极材料,NCM电池的正极由镍、钴和锰的氧化物组成,
负极通常是石墨。
这些材料在充放电过程中发生电化学反应,使得
电池能够存储和释放能量。
2. 充放电过程,当NCM电池充电时,锂离子从正极材料中脱嵌,并通过电解质传输到负极材料中嵌入。
在放电过程中,这些锂离子
则从负极材料中脱嵌并返回正极材料。
3. 电解质,NCM电池中使用的电解质通常是有机溶剂和锂盐的
混合物,它们在充放电过程中起着传导锂离子的作用。
4. 电池反应,在充放电过程中,正负极材料发生氧化还原反应,使得锂离子在正负极材料之间转移,从而产生电能。
5. 安全性,NCM电池设计中通常会考虑安全性,采取措施以防
止过充、过放和过热等情况,以确保电池在使用过程中的稳定性和
安全性。
总的来说,NCM电池的工作原理涉及正负极材料的电化学反应、电解质的传导作用以及充放电过程中锂离子的转移,这些都是使得NCM电池能够存储和释放能量的关键因素。
希望这个回答能够全面
解释NCM电池的工作原理。
最新-锂离子电池正极材料与工艺详解(含三元材料)精选全文

八面体间隙
四面体间隙
02.锂离子电池正极材料简介
2.3 LiCoO2(层状) O3较O2,Li离子扩散克服能垒低,CO与Li混排需克服较高的能垒。
O3-LiCoO2结构: O原子为立方密堆积结构(ABCABC……)Li 与Co原子沿C轴方向交替占据八面体位置,且 共边( α –NaFeO2),属于六方晶系(三轴等长 ,任意两轴夹角相等),具有 R3m空间群。
02.锂离子电池正极材料简介
2.3 LiCoO2
大约对应Li0.5CoO2,由于空位有 序化出现,形成扭曲八面体单斜相
恒流充电,当电压达 到4.8V时O3正极几乎所有 的锂离子都能从正极中脱 出,大约80%的锂离子可 以在嵌入正极材料中;可 逆比容量220mA·h·g-1。
图(b)可以看出最 低电压平台O3结构的正极 最高。
(碳酸乙烯脂)
隔膜
在电解液中具有 良好的化学稳定 性及一定的机械
强度
对Li+的移动阻 碍小(内阻), 对孔径和孔隙率
的要求
良好的绝缘体, 并能阻挡从电极 上脱落物质微利
和枝晶的生长
聚乙烯、聚丙烯等聚 烯烃微孔隔膜
目录
CONTENTS
01 锂离子电池原理简介
02 锂离子电池正极材料简介
03 三元正极材料简介 04 前驱体的制备工艺 05 三元材料成品制备工艺
Li(Nix-Coy-Mnz)O2 ,x+y+z=1
3.2过渡元素对性能的影响
容量-循环性能
随着Ni含量上升,电池比容量上升,循环性能有所下降
03.三元正极材料
2.4 Li(Nix-Coy-Mnz)O2 ,x+y+z=1
3.2过渡元素对性能的影响
锂空气电池正极材料的研究进展

锂空气电池正极材料的研究进展摘要:随着能源产业的飞速发展和环境友好型社会的建设推动,锂空气电池以其极高的理论能量密度及无污染的特点,成为电池体系的研究热点之一。
锂空气电池正极材料对锂空气电池的性能起着重要作用,本文主要综述了锂空气电池正极材料的种类。
主要是碳材料、贵金属及合金,过渡金属及氧化物等。
关键词:锂空气电池,正极,单质,复合材料1引言锂空气电池根据电解液的状态不同,主要可分为水体系、有机体系、水-有机混合体系以及全固态锂空气电池[1]。
在有机体系锂空气电池工作时,原料O通2过多孔空气电极进入到电池内部,在电极表面被催化成氧离子或过氧根离子,与电解质中的锂离子结合生成过氧化锂或氧化锂,沉积在空气电极表面,当产物将空气电极的多孔结构完全堵塞时电池停止放电[2]。
锂空气电池概念自1974年被首次提出,因其不可比拟的理论能量密度,备受研究者的关注,历经几十年的发展和优化,其实际性能也得到了很大的提升,但是,当前的锂空气电池仍面临能量转换效率低、倍率性能差、循环寿命短等问题,极大地阻碍了其实际应用。
正极是锂空气电池的关键组成部分,其上面发生的氧还原反应(ORR)和析氧反应(OER)显著影响电池的工作性能,如过电位、倍率性能、循环稳定性等[3]。
因此,成功开发低成本、高活性、长寿命的高效双功能正极催化剂已成为促进锂空气电池性能提升和发展应用的迫切任务。
2锂空气电池正极单质材料种类碳材料:碳材料包括一些商业碳黑、多孔碳材料、碳纳米管和纳米纤维以及石墨烯等,由于高的导电性、低密度、低成本和易于构造多孔结构等优势,碳材料被广泛应用于锂空气电池中。
碳材料的低质量密度和高导电性有利于锂空气电池获得较大的重量比容量。
碳电极的孔结构可以用现有技术轻松调节,从而提高锂离子和氧气的传输效率[4]。
此外,碳材料的电子结构可以通过掺杂原子进行调整,掺杂原子可以形成催化Li2O2。
基于以上优点,碳材料既可以作为催化剂单独使用,也可以作为其他催化剂的载体使用。
钯催化剂对锂空气电池氧析出和氧还原反应的催化机理的研究

钯催化剂对锂空气电池氧析出和氧还原反应的催化机理的研究谷峰;王有伟;郑智慧;刘建军;陆文聪【摘要】锂空气电池以其超高的能量密度而备受关注,然而充、放电过电位高等问题严重限制了其实际应用.金属钯作为催化剂可而降低锂空气电池的充、放电过电位,但其充、放电反应催化机制尚不完善.本研究运用第一原理计算方法,建立了钯/氧气/过氧化锂(Pd/O2/Li2O2)的三相界面催化模型,从微观角度揭示钯催化剂在锂空气电池充、放电反应中的催化机制.研究表明,Pd/O基底通过促进Li2O2在界面处的电荷转移提高自身对LiO2吸附作用,从而加速放电产物在电极表面的形成,有效降低了充电过电位0.43 V.【期刊名称】《无机材料学报》【年(卷),期】2018(033)010【总页数】5页(P1131-1135)【关键词】钯催化剂;过电位;界面电荷转移;第一原理【作者】谷峰;王有伟;郑智慧;刘建军;陆文聪【作者单位】上海大学化学系,上海 200444;中国科学院上海硅酸盐研究所,上海200050;中国科学院上海硅酸盐研究所,上海 200050;上海大学化学系,上海200444;中国科学院上海硅酸盐研究所,上海 200050;中国科学院上海硅酸盐研究所,上海 200050;上海大学化学系,上海 200444【正文语种】中文【中图分类】TQ174锂空气电池与传统的锂离子电池相比, 由于正极反应物的O2广泛存在于空气中, 降低了电池的总质量, 具有极高的能量密度而备受关注[1-6]。
然而其充、放电动力学速率低, 导致充、放电过电位高、倍率性能低、循环性能差等问题, 严重制约了其实际应用[3-5]。
针对这一问题, 可以选用合适的异相催化剂材料提高反应速率, 但目前的催化剂材料只能单一地提高充电或放电过程的动力学速率。
因此, 发展可以同时提高充、放电反应速率的双效高活性催化剂是未来研究的重点[7-9]。
常见的催化剂体系主要包括过渡金属氧化物[10-12]、贵金属[1,13]、钙钛矿结构材料[9,14-16]等。
铝空气电池工作原理_铝空气电池致命缺点
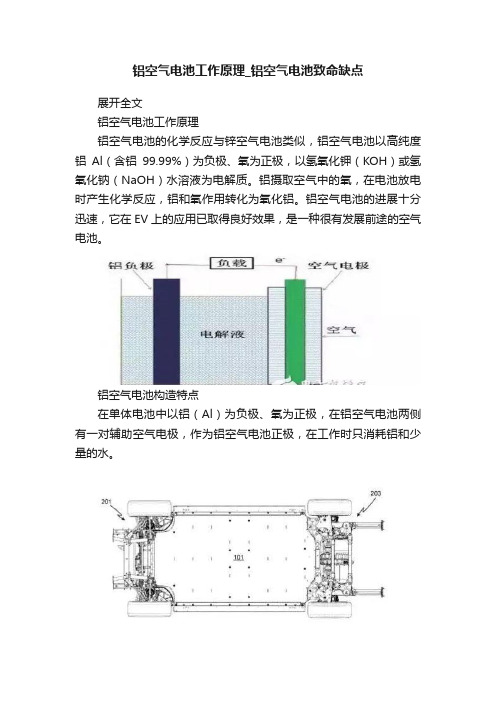
铝空气电池工作原理_铝空气电池致命缺点展开全文铝空气电池工作原理铝空气电池的化学反应与锌空气电池类似,铝空气电池以高纯度铝Al(含铝99.99%)为负极、氧为正极,以氢氧化钾(KOH)或氢氧化钠(NaOH)水溶液为电解质。
铝摄取空气中的氧,在电池放电时产生化学反应,铝和氧作用转化为氧化铝。
铝空气电池的进展十分迅速,它在EV上的应用已取得良好效果,是一种很有发展前途的空气电池。
铝空气电池构造特点在单体电池中以铝(Al)为负极、氧为正极,在铝空气电池两侧有一对辅助空气电极,作为铝空气电池正极,在工作时只消耗铝和少量的水。
铝空气电池主要特点(1)比能量高。
铝空气电池是一种新型高比能电池,理论比能量可达到8100Wh/kg目前研发的产品已经能达到300-400Wh/kg,远高于当今各类电池的比能量。
(2)比功率中等。
由于空气电极的工作电位远离其热力学平衡电位,其交换电流密度很小,电池放电时极化很大,导致电池的比功率只能达到50-200W/kg。
(3)使用寿命长。
铝电极可以不断更换,因此铝空气电池寿命的长短取决于空气电极的工作寿命。
(4)无毒、无有害气体产生。
电池电化学反应消耗铝、氧气和水,生成Al2O3·nH2O,可用于干燥吸附剂和催化剂载体、研磨抛光磨料、陶瓷及污水处理的优良沉淀剂等。
(5)适应性强。
电池结构和使用的原材料可根据实用环境和要求而变动,具有很强的适应性。
(6)电池负极原料铝廉价易得。
相比于其他的金属,金属铝的价格比较低,金属阳极的制造工艺比较简单。
铝空气电池致命缺点铝对人体不会造成伤害,可以回收循环使用,不污染环境。
铝的原材料丰富,已具有大规模的铝冶炼厂,生产成本较低。
铝回收再生方便,回收再生成本也较低。
而且可以采用更换铝电极的方法,来解决铝空气电池充电较慢的问题。
正如所有的事物有其优秀的一面也有不足的一方一样,铝空气电池也有不足之处。
虽然它含有高的比能量,但比功率较低,充电和放电速度比较缓慢,电压滞后,自放电率较大,需要采用热管理系统来防止铝空气电池工作时的过热。
锂离子电池 应用 储能 原因

锂离子电池应用储能原因汲取自然清洁能源的重要性不言而喻。
太阳能和风能等可再生能源虽然在效率和成本上有所提升,但其间歇性和波动性使得大规模储能需求凸显。
因此,储能系统在实现能源结构转型中扮演着关键角色。
在诸多储能技术之中,锂离子电池以其高能量密度、长循环寿命和无记忆效应等优势脱颖而出,成为储能领域的佼佼者。
本文将从锂离子电池的储能应用领域、工作原理、优缺点以及未来发展趋势等层面进行深入阐述,旨在揭示其在储能领域中的重要地位和广阔前景。
一、锂离子电池在储能领域的应用1.电网储能电网储能是指在电力系统中引入储能装置,实现电力的时间位移,从而优化电力系统运行。
锂离子电池广泛应用于电网储能领域,主要有以下作用:(1)削峰填谷及负荷调节:锂离代电池可以在电力负荷低谷时储存电能,在高峰时释放电能,从而降低电网的峰谷差,提高电网利用率,优化电力资源配置。
(2)电力质量改善:锂离子电池储能系统具备快速响应能力,可在毫秒级时间内注入或吸收电能,有效抑制电压波动,改善电网电能质量。
(3)可再生能源并网调节:风电和光伏发电存在波动性,锂离代电池可对其进行削峰填谷,实现平滑输出,促进可再生能源并网。
2.家用储能家庭用户可以通过锂离子电池储能系统实现对可再生能源的储存利用,提高能源自给自足率,降低购电成本。
同时,锂离子电池储能还可以为家庭用电提供备用电源,增强供电可靠性。
3.工商业储能工商业领域的储能需求主要包括:备用电源、削峰填谷、需量响应等。
高可靠性、长循环寿命的锂离子电池储能系统可以满足这些需求,促进企业节能减排,提高能源利用效率。
二、、锂离子电池工作原理锂离子电池是一种由正极、负极、隔膜、电解液等组成的二次电池。
在充电过程中,正极中的锂离子通过电解液迁移至负极;而放电过程则正好相反。
该过程的关键是在正、负极间存在着可逆的锂离子嵌入/脱嵌过程。
具体来说:1.正极材料锂离子电池正极材料主要包括层状氧化物(如钴酸锂)、尖晶石氧化物(如锰酸锂)等。
锂空气电池正极催化剂的研究进展

锂空气电池正极催化剂的研究进展王娜;林鸿鹏;方新荣;宋晓娜;刘元刚;武俊伟【摘要】简要阐述了锂空气电池的研究现状;围绕正极催化剂材料的研究进展,着重综述了不同类型碳材料及非碳催化剂材料的电化学催化性能及结论分析;指出了通过改进材料的制备方法和优化制备条件来获得高活性正极催化剂材料的研究方向.【期刊名称】《电池工业》【年(卷),期】2017(021)004【总页数】9页(P35-43)【关键词】锂空气电池;碳材料;非碳催化剂;催化活性【作者】王娜;林鸿鹏;方新荣;宋晓娜;刘元刚;武俊伟【作者单位】东莞市迈科新能源有限公司,广东东莞523800;东莞市迈科新能源有限公司,广东东莞523800;东莞市迈科新能源有限公司,广东东莞523800;东莞市迈科新能源有限公司,广东东莞523800;天津科技工作者创新创业服务中心,天津300041;哈尔滨工业大学(深圳)材料科学与工程学院,深圳518101【正文语种】中文【中图分类】TM9101 前言不同于传统的“摇椅式”锂离子电池,基于电化学过程中的氧还原反应(ORR)和氧析出反应(OER),金属空气电池可以实现可逆的充放电过程。
由于空气及活性物质(氧气)并不储存在电池内部,而是来自于外界,因而金属空气电池具有极高的理论能量密度,其中锂空气电池是最具潜力成为下一代高能量密度的储能系统。
在考虑O2质量的条件下,锂空气电池理论能量密度为5210Wh/kg (不包括氧气条件下能量密度高达11680Wh/kg),比传统锂离子电池能量密度高出5-10倍[1],是目前所有可充电电池体系中理论能量密度最高的。
如图1-1所示为不同电池体系实际能量密度及相应电动汽车续航里程和能源单价对比图[2],可见在所有的储能体系中,锂空气电池在理论上可以实现电动汽车接近现有燃油汽车的续航里程数(500km~600km)。
基于此,锂空气电池入选了IBM公司“电池500项目”,并由此受到全世界科技工作者的广泛研究。
锂空气电池

有机体系里空气电池
结构示意图
锂空气电池有一个重要的问题:Li2O2无法溶解于有机电解液中, Li2O2将不断 在负极材料表面沉积,这将阻止O2的进入,导致放电终止。因此人们意识到要提高 有机电解液体系的锂空气电池的放电容量,空气电极是关键因素。 锂空气电池中所用的空气电极通常由多孔碳组成,多孔碳结构可以为O2向碳电解液界面的扩散提供气体传输通道,同时多孔结构可以为放电过程中形成的 Li2O2提供存储空间。当碳材料的孔道完全被Li2O2所填充时,放电过程将会终止。电解 液在孔道内的传输也将是决定锂空气电池能量储存的另一重要参数。以上各方面 表明,多孔碳材料的微观结构将严重影响电池的性能。研究新型的多孔碳电极材 料,从而提高容量、能量及功率密度,并且改善体系的稳定性,已经成为该领域 的研究热点。
锂空气电池
锂-空气电池
锂空气电池原理如图所示,以金属锂为负极, 由碳基材料组成的多孔电极为正极,放电过程中, 金属锂在负极失去电子成为锂离子,电子通过外电 路到达多孔正极,电子将空气中的氧气还原,这一 反应持续进行,电池便可以向负载提供能量。充电 过程正好相反,在充电电压的作用下,放电过程中 产生的放电产物首先在多孔正极被氧化,重新放出 氧气,锂离子则在负极被还原成金属锂。由此可见, 整个过程中不会产生对环境有害的物质,完全是零 污染的绿色过程。 锂空气电池的另一个重大优势就是正极的活性 物质氧气是直接来源于周围空气,因而是取之不尽 用之不竭的,并且不需要储存在电池内部,这样既 降低了成本又减轻了电池的重量,所以电池的能量 密度完全取决于金属锂一侧。通过理论计算可以得 出,锂空气电池的能量密度可以达到13200Wh/Kg的 超高理论能量密度,这一能量密度足以和汽油相媲 美,从而有望完全代替汽油,真正实现纯电动汽车。
研究和优化新型锂空气电池的性能

研究和优化新型锂空气电池的性能摘要:随着电子产品的普及和新能源汽车的快速发展,对高能量密度、低成本、环境友好的电池需求日益迫切。
作为一种潜在的候选电池技术,锂空气电池具有较高的理论能量密度和良好的环境可持续性,引起了广泛的研究兴趣。
本论文综述了近年来对新型锂空气电池性能的研究,并重点介绍了优化其性能的方法,包括催化剂设计、氧气输送和电解液改进等。
通过不断地改进和创新,新型锂空气电池有望在未来的能源存储领域发挥重要作用。
关键词:锂空气电池、性能研究、催化剂设计、氧气输送、电解液改进第一章引言1.1 背景近年来,随着全球电子产品的快速发展以及对清洁能源的需求增加,锂电池作为一种重要的能量存储技术备受关注。
然而,传统的锂离子电池受限于其有限的能量密度和增加的成本,无法满足日益增长的电能需求。
因此,寻找更加高效、可持续和成本效益的电池技术成为当今研究的热点之一。
1.2 锂空气电池概述锂空气电池作为一种潜在的候选电池技术,具有较高的理论能量密度和良好的环境可持续性,引起了广泛的研究兴趣。
其工作原理是通过氧气和锂之间的反应来释放能量,氧气从空气中提取,然后通过催化反应与锂发生氧化反应。
与锂离子电池相比,锂空气电池的理论能量密度更高,可以满足更高能量密度应用的需求。
然而,锂空气电池在实际应用中仍面临诸多挑战,如低能量效率、催化剂活性和寿命等问题。
第二章锂空气电池性能研究进展2.1 催化剂设计催化剂是锂空气电池中至关重要的组成部分,可以提高氧气的电化学活性和电池的能量效率。
现有催化剂主要分为金属基催化剂和非金属基催化剂。
其中,碳基材料因其良好的导电性、高比表面积和成本效益优势被广泛研究。
此外,金属氧化物、金属酸盐和金属有机框架等也被用作催化剂。
未来研究可进一步探索合成新型催化剂,优化其活性和稳定性,以提高锂空气电池的性能。
2.2 氧气输送锂空气电池中的氧气输送对于电池的能量效率和长周期稳定性至关重要。
目前,常见的氧气输送方法主要包括自由扩散、气泵和多孔隔膜。
锂空气电池的工作原理

锂空气电池的工作原理1. 介绍锂空气电池的结构锂空气电池的结构主要包括锂阳极、氧气阴极、电解质和隔膜等部分。
锂阳极和氧气阴极之间通过电解质和隔膜隔开,以防止两者直接接触而发生短路或者其他问题。
(1)锂阳极锂空气电池的阳极通常由锂合金或者锂离子构成,这种材料具有高能量密度和低电位的特点,适合作为锂空气电池的阳极材料。
锂合金或者锂离子在放电过程中会脱除电子并向电解质中的阴极迁移,同时释放出电能。
(2)氧气阴极锂空气电池的阴极使用空气,因此被称为氧气阴极。
当电池处于放电状态时,氧气会与电解质中的阳离子发生氧化还原反应,从而释放出电能。
在充电状态时,氧气则被用来氧化阳离子并储存电能。
(3)电解质和隔膜电解质和隔膜在锂空气电池中起着重要的隔离作用,它们既能保护阳极和阴极不直接接触,又可以让阳离子和阴离子进行传输和交换。
同时,电解质要具有高离子导电性和化学稳定性,以保证电池的正常运行。
2. 锂空气电池的工作过程锂空气电池在放电和充电状态下存在不同的工作过程,下面将分别介绍这两个状态下的工作过程。
(1)放电状态在锂空气电池的放电状态下,锂合金或者锂离子会脱除电子,向电解质中的阴极迁移。
与此同时,氧气会与电解质中的阳离子发生氧化还原反应,释放出电能。
这个过程可以用以下方程式描述:阴极:O2 + 4e- + 4Li+ → 2Li2O阳极:2Li → 2Li+ + 2e-整体反应:2Li + O2 → 2Li2O这个氧化还原反应产生的电能可以被外部电路所捕获,并用于驱动电子设备或者储存起来。
(2)充电状态在锂空气电池的充电状态下,相反的反应过程会发生。
通过外部电源提供电能,并通过将氧气还原为氧化物并将锂离子还原为金属锂的反应,将电能储存起来。
反应可以用以下方程式描述:阴极:2Li2O → O2 + 4Li+ + 4e-阳极:2Li+ + 2e- → 2Li整体反应:2Li2O + 4Li → 4Li2O这个循环过程使得电池能够在放电和充电状态之间切换,并实现对电能的储存和释放。
锌空气电池与锂空气电池

工作特性
1)电池尺寸选择性灵活 从纽扣、硬币电池到大型方形电池, 用于助听设备的纽扣电池和军用方形电池较多。 2)电压稳定 额定开路电压为1.4V,终止电压一般为0.9-1.1V 3)体积比能量高 在所有纽扣电池中,锌-空气电池体积比能量 最高。
工作特性
4)放电特性:放电曲线平稳,放电电流越大,电压越低 5)储存寿命 通常用密封标签密封住气孔,防止气体迁移进入 电池引起电池性能的衰变;电池中锌电极会发生自放电反应, 因为锌在碱性电解质中呈热力学不稳定性,反应生成ZnO和H2, H2 可以从密封签中透过,防止电池变形。高温和潮湿会显著 影响自放电速度。
3.电解质&隔膜
这里介绍几种有机电解质
锂空气电池常用隔膜有聚烯烃隔膜、玻璃纤维和固体离子导电膜。
三、设计&性能
锂空气电池有多种结构形式有软包 装型、硬币型、塑料壳型等。最普 遍的结构是采用软包装型。
这是一个大型锂空气电池的单 体设计,外壳为特殊设计,边 长5in的方形,两侧均有空气窗 口,阳极的两面均有与之层叠 的空气阴极。这些单体集成起 来可成为大型锂空气电池。
锌空气电池与锂空气电池
———从电池的工作原理与组成等方面介绍了锌空气 电池与锂空气电池的研究进展
报告人:赵啸宇,端木凡朋
锌-空气电池
研究背景 :锌-空气电池的开发过程分为四代 :基本的电极反应
工作原理
电池结构 工作特性
:以纽扣电池为例介绍基本结构
:锌-空气电池工作时的特殊性质研究背景Βιβλιοθήκη Li +e →Li
+
-
4OH →O2+2H2O+4e
隔膜
催化剂
二、原理&结构——结构组成
四大空气电池

金属空气电池是以金属为燃料,与空气中的氧气发生氧化还原反应产生电能的一种特殊燃料电池。
金属空气电池以活泼的金属作为阳极,具有安全、环保、能量密度高等诸多优点。
具有良好的发展和应用前景,甚至被寄予厚望替代当前新能源汽车主要的动力电池类型—锂离子动力电池。
制作金属空气电池,可选用的原材料比较丰富。
目前已经取得研究进展的金属空气电池主要有铝空气电池、镁空气电池、锌空气电池、锂空气电池等。
这几种类型的金属空气电池有的已经具备大规模量产的条件,有的还停留在实验室阶段,有的已经在电动汽车方面取得良好的应用成果,并即将大规模装载新能源车辆。
本文将分别介绍上述几种金属空气电池的研发及应用进展。
一、铝空气电池1、工作原理铝空气电池以高纯度铝Al(含铝99.99%)为负极、氧为正极,以氢氧化钾(KOH)或氢氧化钠(NaOH)水溶液为电解质。
铝摄取空气中的氧,在电池放电时产生化学反应,铝和氧作用转化为氧化铝。
2、特点铝空气电池具有无毒、无害、无污染,可回收循环使用等特点。
对于电动汽车来说,铝空气电池具有质量轻、比能量大的显著特点。
资料显示,铝空气电池的理论比能量可达8100Wh/kg,目前的实际比能量约实现了350Wh/kg,是锂电池的2.3倍,镍氢电池的6倍,铅酸电池的7倍多。
这种电池对于减轻汽车重量,增加续航里程具有明显的帮助。
3、研发及应用进展国外:据相关资料,美国加利福尼亚州在使用铝空气电池的电动汽车上,有过只更换一次铝电极续驶里程达1600km的记录。
美铝加拿大公司和以色列公司Phinergy新展示的100公斤重的铝空气电池储存了可行驶3000公里的足够电量。
国内:云铝股份与昆明冶金研究院共同出资组建创能铝空气电池股份有限公司,投资铝-空气电池研发项目。
目前,创能铝空气电池研发项目正在推进中。
中国动力与PHINERGY成立合资公司,计划在大巴、旅游车、物流汽车及运动型多用途汽车等电动车型推广铝空气电池。
并计划在大陆、香港、澳门进行推广。
锂离子电池工作原理

锂离子电池工作原理正极反应:放电时锂离子嵌入,充电时锂离子脱嵌。
负极反应:放电时锂离子脱插,充电时锂离子插入。
电池总反应以炭材料为负极,以含锂的化合物作正极的锂电池,在充放电过程中,没有金属锂存在,只有锂离子,这就是锂离子电池。
当对电池进行充电时,电池的正极上有锂离子生成,生成的锂离子经过电解液运动到负极。
而作为负极的碳呈层状结构,它有很多微孔,达到负极的锂离子就嵌入到碳层的微孔中,嵌入的锂离子越多,充电容量越高。
同样,当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。
回正极的锂离子越多,放电容量越高。
我们通常所说的电池容量指的就是放电容量。
在Li-ion的充放电过程中,锂离子处于从正极→负极→正极的运动状态。
Li-ion Batteries就像一把摇椅,摇椅的两端为电池的两极,而锂离子就象运动员一样在摇椅来回奔跑。
所以Li-ion Batteries又叫摇椅式电池。
一般锂电池充电电流设定在0.2C至1C之间,电流越大,充电越快,同时电池发热也越大。
而且,过大的电流充电,容量不够满,因为电池内部的电化学反应需要时间。
就跟倒啤酒一样,倒太快的话会产生泡沫,反而不满。
正极正极材料:可选正极材料很多,目前主流产品多采用锂铁磷酸盐。
正极反应:放电时锂离子嵌入,充电时锂离子脱嵌。
充电时:LiFePO?→ Li1-xFePO? + xLi + xe放电时:Li1-xFePO?+ xLi + xe →LiFePO?负极负极材料:多采用石墨。
新的研究发现钛酸盐可能是更好的材料。
负极反应:放电时锂离子脱插,充电时锂离子插入。
充电时:xLi + xe + 6C →LixC6放电时:LixC6 → xLi + xe + 6C锂离子电池是一种二次电池(充电电池),它主要依靠锂离子在正极和负极之间移动来工作。
在充放电过程中,Li+ 在两个电极之间往返嵌入和脱嵌:充电池时,Li+从正极脱嵌,经过电解质嵌入负极,负极处于富锂状态;放电时则相反。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目前世界合成氨产量已经超过8000万吨/年
§1-3 催化的重要性
20世纪四十年代,美国环球油品公司发现和开发
了汽油烷基化硫酸催化材料 使燃料油品的辛烷
值由原来的87提高到100 这种燃料使英国飞机的 爆发加速能力提高了50% 确保了皇家空军战斗 机在1940年7月~10月间的不列颠空战中击败了强 大的德国空军 催化剂代表胜利 扭转了第二次世界大战的战局;
Fritz Haber 合成氨 (1868~1934) N2+3H2 2NH3 到19世纪中叶,所使用的氮肥主要来自智利的硝酸纳矿
19世纪后期,用炼焦的副产产品氨为原料,可以制成硫酸铵,作 为氮肥来使用。
自然界中游离氮只能被豆科植物的根瘤菌直接利用。 1907年,哈柏等在约550℃和 150至250个大气压的条件 下,得到了8.25%的氨,成功地制取了0.1公斤的合成氨 7月2日,哈柏在实验室建成世界上第一个氨合成装置的模 型。(催化剂为锇或铀) 为解决世界范围氮肥短缺问题,他提出 空气中的氮和水中 的氢在高温高压和催 化剂作用下能够发生化学反应并合成 氨,1904至1913年发明了合成氨生产技术,从而开创了 合成氨工业。于1918年获奖。
Ziegler, (1898~1973) 1949至1953年 发明了 高活性络 合催化剂,于 1963年获奖。
Natta 1903~1979)
§1-3 催化的重要性
世界上超过90%的化学品的生产都与催化有关。 利用催化技术每年所产生的收入超过1万亿美元,而 催化剂的制备成本约为几十亿美元。因此催化剂的成 本在产品的成本中占约0.1%。 我国的石化工业是国民经济的支柱产业:
催化作用是人们通过科学活动和生产实践认识到的一 种现象:某些物质对一系列反应有影响,但本身似乎 没有变化或参与反应。
催化剂的定义
1835年 Berzelins 把上述现象归结起来,认为是由一种 催化力 (Catalytic force) 所引起的,提出了催化作用 (Catalysis) 。 Mitscherlich 把 这 类 现 象 称 为 接 触 催 化 (Contact catalysis)。
催化原理及 锂空气电池
报告人:牛强
§1
催化作用与催化剂
§1-1 催化剂的发展与定义 §1-2 催化作用的基本特征 §1-3 催化的重要性
§1-1 催化剂的发展与定义
1781年(帕尔明蒂): 稀酸参加下的淀粉转化为糖. 1783年(普里斯特林): 在粘土上的醇的脱水. 1797年(舍莱): 稀酸参与下的乙酸乙酯的皂化反应. 1817年(Davy): 加热铂丝可促进煤气、烃类的氧化. 1822年(Dobereiner): Au,Ag,Pt使H2+O2H2O. 1834年(Mitscherlich): 硫酸可使醇脱水成醚.
1911年,博施和米塔希在BASF公司建造了世界 上第一座合成氨工厂。1913年9月9日,开始生 产,实现了合成氨工业化的生产,年产 3.6万吨 硫酸铵。(Fe系催化剂)
1908至1913年改进了高压合 成氨的催化方 法,实现了合 成氨的工业化生产,并在发 展高压化学方面取得重要成 就。于1931年 获奖。
§ 1-2 催化作用的基本特征 (1)
1. 不能改变化学平衡和平衡常数
△G=-RTLnKa
2. 催化剂的存在可改变化学反应的速度
H2 + O2
C 200 H2O
H2O
催化剂参与了整个化学反应过程,但反应前后没有发 生变化,而整个反应的速度是加快了,加速了到达平 衡的时间。
CO 2 + H2O O C
对于不同的反应,催化剂的活性是不同的。 选择性由催化剂的功能所决定,但也部分地决定于热力 学平衡。对热力学上不太有利的反应,更应选择性能优 良的催化剂。 有时选择性比活性更重要 A B (产物) C 原料比较昂贵时,往往更注重于提高选择性。
§1-3 催化的重要性
工业总产值占全国11.6%, 资产总值占全国14.18%;
§2 催化作用原理
1. 均相催化反应 化学反应原理:
1 A B E AB
催化反应:
C A B AB
2 A C E AC
3 AC B E AB C
1976年IUPAC(国际纯粹及应用化学协会)“催 化作用是一种化学作用,是靠用量极少而本身不 被消耗的一种叫做催化剂的外加物质来加速化学 反应的现象”。 1994年国家自然科学基金委员会在自然科学发展 调研报告中指出“催化是加速反应速度、控制反 应方向或产物构成,而不影响化学平衡的一类作 用。起这种作用的物质称为催化剂,它不在主反 应的化学计量式中反映出来,即在反应中不被消 耗。”
1919年 Ostwald (奥斯瓦尔德)对催化剂提出了更为精 确和完整的定义“催化剂能影响化学反应的速度,但 它本身并不因化学反应的结果而消耗,它亦不会改变 反应的最终的热力学平衡”。
催化剂是一种物质:
数量少而能产生巨大变化的物质; 可以改变反应速度,而本身不被消耗的物质。
催化剂的定义
Cu/ 200 C
§ 1-2 催化作用的基本特征 (2)
催化剂的使用,有时也可使反应速度减慢,延 长到达平衡的时间。 亚硫酸钠易被水中的氧氧化 加入醇后可抑制氧化的进行。
§ 1-2 催化作用的基本特征 (3)
3 催化剂对不同的反应具有选择性
C=C + O2 Cu-Mn-O Ag C
因此在二战中起决定作用的不列颠空战被称为:
§1-3 催化的重要性
20世纪五十人类获得了丰富的塑料和纤
维制品。它不仅带动了整个石化工业的兴 起,也推动了与材料相关的其他产业的发 展,同时也给人类的日常生活带来了巨大 的变化。
对齐格勒发明的催化剂加以改进,使其 适合于聚丙烯的大规模生产,产品的强 度高、硬度大、耐磨损,成为仅次于聚 乙烯的塑料主要品种之一,广泛用于汽 车、化工、包装、建筑、医疗、农业、 食品等工业。于1963年获奖。
