呼吸道标本的处理分解
呼吸道标本细菌学检验

呼吸道标本细菌学检验标准操作程序1.检验目的规范呼吸道标本细菌学检验操作规程,确保检验结果准确可靠。
2.适用范围呼吸道标本培养和涂片检查。
3.标本采集与运送3.1 采集时间以晨痰为好。
3.2 采集方法3.2.1 自然咳痰法用清水反复漱口后从气管深部咳出痰,吐入无菌容器内。
3.2.2 气管镜下采集法在病灶附近用导管吸或用支气管刷直接取得标本。
3.2.3 气管穿刺法在环甲膜下穿刺抽取痰液,收集标本,适用于厌氧菌培养。
3.2.4 呼吸机采集法使用呼吸机的病人,可利用呼吸机吸取深部痰入专用采集器内送检。
3.2.5 为了明确扁桃体炎、会厌炎、鼻咽部化脓性感染的病原体,可以采集拭子送检。
首先拭子用无菌生理盐水沾湿,然后用力在感染部位擦拭,采集标本与无菌管送检。
3.3 标本运送3.3.1 采集标本后立即送到实验室,放置时间不应超过2h。
3.3.2 延迟送检或待处理标本应置于4℃冰箱保存(疑为肺炎双球菌、流感嗜血杆菌等苛氧菌感染除外),以免杂菌生长,但必须在24h内处理。
3.3.3 对可疑烈性呼吸道传染病的患者检验标本,在采集、运送及保存过程中必须注意生物安全防护。
4.检验步骤4.1接种:用无菌拭子蘸取脓性部分,接种于血平板和巧克力平板第一区,再用一次性接种环分区划线接种。
4.2 涂片在接种的同时进行涂片。
用铅笔在磨砂部位编号,每片只涂一份标本。
4.3 培养:血平板、巧克力平板置35℃二氧化碳培养箱培养18-48h。
4.4 涂片染色镜检:涂片革兰染色,自然干燥后镜检。
先用低倍镜浏览整片,计数平均每个低倍视野WBC、上皮细胞的数量。
标本合格与否参考表1,合格标本再用油镜观察,主要观察片中主要细菌类型、WBC内吞噬什么细菌等,以作为看板时决定什么细菌要做的依据。
表1 痰液标本分级4.5 培养结果观察4.5.1 口咽部正常寄生的需氧菌主要是腐生的奈瑟菌、草绿色链球菌,4.5.2 有明确意义的病原菌: A群溶血性链球菌(咽炎)、流感嗜血杆菌(b型5y以下儿童急性会厌炎、急性支气管炎)、肺炎链球菌(急性支气管炎常继发于病毒感染、大叶性肺炎)、百日咳鲍特菌(咳嗽、支气管扩张)、金黄色葡萄球菌(肺炎)、军团菌(肺炎)、白喉棒状杆菌。
呼吸道标本的培养与鉴定

呼吸道标本的培养与鉴定人体的上呼吸道有常居的细菌群,下呼吸道是无菌的。
上呼吸道常居菌主要有:草绿色链球菌、α、β链球菌、微球菌、表皮葡萄球菌、拟杆菌、梭杆菌、口腔厌氧球菌、奈瑟菌(致病菌除外)等。
1. 下呼吸道感染的病原菌种类因感染部位而有所差异。
(1).咽炎最常见的病原菌是A群链球菌;(2).喉炎的病原菌以流感嗜血杆菌为主;(3).中耳炎常见病原菌为肺炎链球菌、流感嗜血杆菌、卡他莫拉菌及口腔厌氧菌;(4).社区获得性下呼吸道感染的常见病原菌包括肺炎链球菌、流感嗜血杆菌、肺炎克雷伯菌、肺炎衣原体、肺炎支原体、卡他莫拉菌、化脓性链球菌、结核分枝杆菌、嗜肺军团菌、诺卡菌等,金黄色葡萄球菌可引起社区获得性、进行性、坏死性肺部病变;(5)长期使用广谱抗菌药物及激素、粒细胞减少的患者容易受到侵袭性真菌的感染。
2.检验方法与程序通常用鼻咽拭子采集标本。
痰和支气管灌洗液用无菌痰杯留取。
应由临床医生指导留取。
痰标本及上呼吸道拭子标本应在2小时内送到实验室。
3.涂片检查直接涂片、革兰染色、镜检。
痰液标本每低倍视野上皮细胞应小于10个,白细胞应大于25个。
还可以初步判定是否有病原菌存在及病原菌的种类。
比如,念珠菌可直接在高倍镜下检查孢子及菌丝。
4.细菌培养通常采用分区划线接种的方法进行标本的初次接种。
①血平板适用于分离各类细菌,特别是β溶血性链球菌②巧克力平板于5%co2环境下分离嗜血杆菌、脑膜炎奈瑟菌或淋病奈瑟菌③中国蓝/麦康凯平板用于分离革兰氏阴性杆菌④沙氏平板用于分离念珠菌及其他酵母菌或真菌⑤厌氧血平板放厌氧环境,分离厌氧菌⑥罗-琴培养基或米氏7H10培养基,用于结核分枝杆菌的培养。
35℃培养18-24小时,观察细菌菌落形态及特点,呼吸道标本中的常居菌群不用鉴定,培养后生长于平板第二区或第三区的中等或大量细菌,或仅在第一区生长的纯种细菌,都是需要鉴定的细菌。
若无致病菌或呼吸道正常菌群生长,可能提示正常菌受抗菌药物的抑制。
呼吸道标本的采集与送检要求
3. 对可疑烈性呼吸道传染病(SARS、肺炭疽、肺鼠疫等)的患者 标本,在采集、运送或保存过程中必须注意生物安全保护。
二、临床微生物标本转运要求 1. 密闭运送原则。 2. 及时运送原则。 3. 生物安全原则,运送箱三层包装。
键(更加重要)。 4. 改善患者全身情况。
标本采集送检频次
一、怀疑普通细菌性肺炎: 1. 每天一次,连续2-3天。如果每天均报告同一种菌,
且++或+++,则有临床意义,但实际情况每天大多报告不 同菌。
2. 不建议24h内多次采集。
3. 关于是否一定要采集晨起第一口痰的质疑?——因第 一口痰会受胃肠道和口咽部细菌的影响,并存在过早采 集无法保证及时送检等问题。所以实际临床操作中只要 方便采集,正规口腔处理,及时送检,并非必须晨起第 一口痰。
一份培养结果与多个环节相关,最 关键的因素就是标本的正确采集与运 送!!!
感染的病原体是 什么?
是不是很难确诊 哪个是真正的致
病菌? Why?
微生物检测背景及流程
一、常规项目检验时间: 标本接收(1-2min)——标本接 种、涂片(5min)——细菌培养 (18-48h)——细菌鉴定、药敏 试验(18-24h或48小时)——结 果报告(5min)
2. 经人工气道吸引分泌物:是目前临床较为常用的微 生物标本。但由于这些宿主的气管纤毛黏液防御机制受 到损害,有学者提出此法的标本应该先做细胞学筛选。
五、培养阳性细菌都需要抗菌药物治疗吗? 1. 不是,培养阳性≠感染,可能为污染(血培养),可
呼吸道标本的细菌培养

整理ppt
15
国内概况:
• 国内最早儿童肺炎链球菌脑膜炎个案报告
在1942年。60年代中期以前研究资料显示 SP肺炎、脑膜炎在冬春季发病较多,是儿 科住院病人中常见病例多发生在婴幼儿。 SP性脑膜炎占化脑的11.1-22.1%,仅次于 流脑。SP也是小儿肺炎的重要病原菌之一, SP所致大叶性肺炎,5岁以下儿童中可占70 %。
整理ppt
9
(三)痰标本细菌培养存在的问题。
• 痰标本的培养时间:
呼吸道(痰)标本培养应该为24~72小时。24小 时培养后细菌生长稀少或未生长的平板应继续培 养到72小时后再作报告,防止一些生长缓慢的细 菌会遗漏,如卡他莫拉菌、奴卡菌、嗜血杆菌等。
整理ppt
10
(四)呼吸道(痰)标本的接种处理
儿童呼吸道常见细菌培养鉴定技术
整理ppt
1
病原菌确定原则
• 自从发现细菌以来,已经确定上百种疾病的病原菌,对这
些常见的传染病,通常只要检出已经确定的病原菌,就可 以认定这种疾病的原因。
• 新出现的传染病,需要用确定病原菌的古老标准来确定。
• 对病人组织、器官中分离到的一种微生物,不足以说明就
是疾病的原因。对于细菌性疾病,需要满足郭霍原则 (Koch)。
齐。
• 不典型的SP菌落有水滴样,菌落较大,边缘不整
齐;还有细小、似草绿色链球菌但较湿润的菌落 也需注意。
整理ppt
23
整理ppt
24
细菌染色形态
• 革兰氏染色阳性,呈矛头状,成双或链状排列,
有荚膜;在痰标本中大多数成双排列。
整理ppt
25
鉴定要点:
• Optochin敏感,胆汁溶菌和荚膜肿
胀试验阳性,菊糖分解试验阳性, 小鼠毒力试验阳性。
呼吸道标本采集

采集容器:应选择密封性好、防漏、不易变形、易于灭菌的采集容器,以便于保存和运输呼 吸道标本。
采集工具:应使用一次性或经过严格消毒的采集工具,避免交叉感染和污染。
采集环境及安全要求
采集环境:选 择清洁、安静、 通风良好的环 境,避免交叉
相关法律法规及规定
涉及的法律法规: 涉及《医疗废物 管理条例》、 《传染病防治法》 等相关法律法规
采集人员的资质 要求:必须具备 相应的医学知识 和技能,并经过 相关培训和考核
采集过程中的伦 理要求:尊重患 者的知情权和自 主权,保护患者 隐私,确保患者 安全
涉及的法律责任: 违反相关法律法 规及规定可能面 临行政处罚或刑 事责任
咽拭子标本采集
采集方法:使 用医用棉签擦
拭咽部
采集部位:咽 后壁、扁桃体
隐窝等处
采集目的:检 测呼吸道病毒、 细菌等病原体
注意事项:采 集前应告知患 者注意事项, 采集时应避免 损伤咽部粘膜
支气管肺泡灌洗液标本采集
采集方法:通过纤维支气管镜,将灌洗液注入肺泡内,然后回收 采集目的:用于诊断肺部感染、肺泡蛋白沉积症等疾病 优点:可以直接观察到肺泡内的病变情况,提高诊断的准确性 注意事项:采集前需要评估患者的病情和肺功能状态,避免出现不良反应
呼吸道标本采集
单击此处添加副标题
汇报人:XX
目录
添加目录项标题
呼吸道标本采集的种类 呼吸道标本采集的质量控 制
呼吸道标本采集的步骤
呼吸道标本采集的临床意 义
呼吸道标本采集的伦理和 法律问题
01
添加章节标题
02
呼吸道标本采集的 步骤
临床微生物标本的送检与采样指南

临床微生物标本的送检与采样指南呼吸道标本采集及运输一、上呼吸道标本1、送检指征上呼吸道感染包括咽炎、喉炎、会厌炎等,凡具有以下情况任何一项者疑似患者。
1.1 病毒性普通感冒伴有明显咽痛时,怀疑为咽部链球菌感染,应做细菌培养。
1.2 细菌性咽-扁桃体炎:明显咽痛、咽部发红、畏寒、发热,体温可达39°C以上。
1.3 喉咙痛、咳嗽、喉部有脓样分泌物等临床症状。
1.4 上呼吸道感染易并发鼻窦炎、中耳炎、气管-支气管炎,需送相应部位分泌物或痰液进行细菌培养。
2、标本采集上呼吸道标本包括鼻、鼻咽、咽拭子标本。
应根据临床表现和感染部位的不同有选择性的采集标本,以便更好地分离出病原菌。
采集时应选择无菌、不含抑制剂的棉拭子,预先用无菌生理盐水或营养肉汤蘸湿拭子,并直取感染部位,减少污染。
2.1 鼻拭子的采集:最好使用扩鼻器,先用拭子拭去鼻黏膜表面的分泌物并丢弃,用第2个试子蘸取无菌生理盐水或营养肉汤,插入鼻孔采集病灶标本。
2.2 咽拭子的采集:采集标本时患者先用清水漱口,由检查者将舌向外拉,使腭垂尽可能向外牵引,用无菌的鼻咽拭子(一端弯曲的金属棉拭)由口腔进入,越过舌根到咽后壁或腭垂后侧,采集鼻咽红肿处标本,取材后小心将试子退出,立即放人无菌试管内。
若咽部明显发红或有假膜存在时,应在局部擦拭取标本(最好拭子从膜底下擦拭)。
采集标本可在咽部多点采集标本,以提高检出率。
若无局部病变或做带菌者测试应于咽部或扁桃体上擦拭。
3、采集时间及频率3.1 检查时间:应于抗菌药物应用之前。
时间上无严格限制,但咽部是呼吸和食物的通路,也应晨起后采集为佳。
3.2 采集频率:重复采集标本的频率一般每日最多1次。
4、标本的运输标本采集后应立即送检,室温运送时间小于2小时,如果不能立即接种,必须装在无菌运送培养基中,避免由于干燥而使某些细菌死亡。
检测淋病奈瑟菌或脑膜炎奈瑟菌的拭子应放人含碳的转运培养基,采集后2小时内接种平板,以防细菌死亡。
呼吸道标本的处理分解

培养结果结合涂片判断定置菌或致病菌
3、前列腺液标本别离出凝固酶阴性葡萄球 菌或革兰阳性小杆菌,涂片未见到,可能 是污染细菌,应建议重送标本。
4、当涂片中见到的细菌,并由细菌吞嗜现 象存在,在培养时别离出该细菌可推测为 致病菌。〔涂片应注明细菌是细胞内或细 胞外〕
第二十七页,共九十一页。
培养结果结合涂片判断定置菌或致病菌
5、涂片报告的日期和培养报告日期要对应 便于医生判别结果的参考价值。
6、并每一视野可见到>20个/油镜或该菌占 所见到细菌的50%,可推测是标本中的优势 菌。
第二十八页,共九十一页。
第三局部 别离培养标准草案 有了合格的标本是保证培养成功的 重要条件,但如果没有适宜的别离 培养基和培养环境同样不能获得好 的结果,为此制定如下根本条例以 保证致病菌别离成功。
〔5〕小儿采集痰标本:用压舌板刺激咳嗽使肺部和器 官的分泌物喷出,用拭子采取标本送检,如不能立即送 检应种入输送培养基。
第二十页,共九十一页。
厌氧培养标本采集标准条例
1. 痰标本的厌氧培养标本采集:必须用气管 穿刺法获得痰液,从口腔吐出的痰标本不 能用于厌氧培养。
2. 尿标本的厌氧培养标本采集:耻骨上膀胱 穿刺获得尿标本可用于厌氧菌培养
内容简介
上呼吸道标本标准操作程序〔SOP〕 下呼吸道标本标准操作程序〔SOP〕 痰标本的标准化操作〔草案〕
第二页,共九十一页。
上呼吸道标本处理程序
大局部步骤需要在生物平安柜内接种
细菌性咽炎的实验室诊断
原理
大多数上呼吸道感染是由病毒引起的。细菌性咽炎经常是 由化脓性链球菌引起。但重度的会厌炎和喉气管炎那么是 例外,其一般是由于b型流感嗜血杆菌引起。
1、尿培养别离出3种以上的细菌,或别离 出凝固酶阴性葡萄球菌、革兰阳性棒状杆 菌等非定义为致病菌的细菌,涂片未见到, 应在报告中提示可能是污染细菌建议结合 临床表现考虑结果的参考价值。
五呼吸系统标本微生物检验

支气管肺泡灌洗液
应尽快送检,室温下不超过2小时; 如不能及时送检,应4℃保存,不超 过24小时。
呼吸系统感染常见微生物
01
02
03
细菌
肺炎链球菌、流感嗜血杆菌、 金黄色葡萄球菌、卡他莫拉菌
等。
病毒
呼吸道合胞病毒、流感病毒、 副流感病毒、腺病毒等。
真菌
白色念珠菌、曲霉菌等。
04
其他微生物
支原体、衣原体等。
定期演练和培训
定期组织实验人员进行应急演练和培训,提高应对生物安全事件的 能力和水平。
THANKS FOR WATCHING
感谢您的观看
肺炎链球菌检验
通过血平板培养、Optochin敏感试验和胆汁溶菌试验等方法进行 鉴定。
流感嗜血杆菌检验
采用巧克力平板进行分离培养,并通过卫星现象、X因子和V因子依赖 试验等方法进行鉴定。
05 微生物检验结果解读与临 床意义
检验结果解读原则及注意事项
遵循微生物学原则
在解读检验结果时,需遵循微生物学的基本原则,包括微生物的 种类、数量、生长特性等。
高度的敏感性和特异性。
真菌学检验
1 2 3
直接镜检
采集患者的呼吸道分泌物或组织样本,在显微镜 下直接观察真菌的形态和结构特征,以初步判断 真菌的种类。
培养法
将样本接种于适当的培养基上,进行真菌培养, 观察真菌的生长情况和菌落特征,以鉴定真菌种 类。
血清学检测
利用特异性抗体与真菌抗原的结合反应,进行血 清学检测,如凝集试验、沉淀试验等,以辅助诊 断真菌感染。
病毒
如流感病毒、呼吸道合胞病毒等,病毒感染一般采取对症治疗和支持治疗。
真菌
如白色念珠菌、曲霉菌等,真菌感染多见于免疫力低下患者,治疗需考虑抗真菌药物。
呼吸道标本采集和结果解读

添加项标题
检测方法的局限性:不同检测方法可能存在不同的敏感性和特 异性,影响结果的准确性。
添加项标题
标本采集的局限性:呼吸道标本采集过程中可能存在污染、取 样不足等问题,影响结果的可靠性。
添加项标题
检测试剂的局限性:不同品牌、不同批次的检测试剂可能存在 差异,导致结果不一致。
添加项标题
呼吸道标本采集 和检测的时间较 长,需要等待实 验室结果才能做 出诊断,可能会 延误患者的治疗
时间。
汇报人:XX
解读人员的局限性:不同专业背景和经验水平的解读人员可能 对结果有不同的理解和判断,影响结果的解读和解释。
呼吸道标本采集 和检测不适用于 所有情况,如病 情较轻、无呼吸 道症状的患者可 能无法采集到有
意义的标本。
呼吸道标本采集 和检测的准确性 受到多种因素的 影响,如采集方 法、标本保存和
运输等。
呼吸道标本采 集和检测的敏 感性较低,可 能会漏检某些 病原体,导致 误诊或漏诊。
呼吸道标本采集难度大,易 受污染
采集过程中易发生交叉感染
呼吸道标本采集对患者的创 伤较大
呼吸道标本检测的准确性受多 种因素影响,如病毒变异、检 测试剂的灵敏度等。
呼吸道标本采集的难度较大, 容易受到污染或交叉感染。
呼吸道标本检测的特异性有时 不够理想,容易出现假阳性或
假阴性的结果。
呼吸道标本检测的时间较长, 需要等待较长时间才能获得检
检测原理:利用聚合酶链式反应(PCR)技术扩增呼吸道标本中的病毒核酸片段,从而检测病毒 的存在。
采样方法:通常采用鼻咽拭子或痰液作为呼吸道标本,通过专用的采样拭子采集后送检。
检测步骤:包括样本采集、保存、运输、核酸提取和扩增等步骤,通过荧光定量PCR仪进行检测。
呼吸道标本采集

(4)标本运送:
咽拭子标本的运送宜采用带 保湿功能的运送培养基,避 免由于送检时间过长而干燥。 如未采用运送培养基,应于 0.5h 内 送 检 。 即 使 采 用 运 送 培养基,室温保存也不应超 过24h。
02 痰液标本
痰培养仅用于下呼吸道感染,主 要是肺部感染的诊断。
(1)临床采样指征:
咳嗽、脓性痰,伴有发热,影 像学检查出现新的或扩大的浸 润影;气道开放患者,出现脓 痰或血性痰;考虑下呼吸道感 染患者采集痰液标本,同时送 血培养标本。
(3)标签及申请单:
申请单除应包括患者基本信息外,患者的临床诊断、 症状、是否使用了抗菌药物、检测目的,标识是普通 培养、抗酸杆菌还是真菌培养。一定要注明标本种类 为肺泡灌洗液,以及采集时间。无菌管上的标签要求 有唯一标识号或条码,注明标本采集时间、检测目的。
(4)标本运输:
标本采集后需尽快送到实验室,不要冷藏标本。
质量不合格标本:显微镜下细胞学检查发现 标本受口咽部菌群污染。合格痰标本鳞状上 皮细胞<10个/低倍视野,白细胞>25个/低 倍视野,或白细胞与鳞状上皮细胞的数量比 值>2.5。
无标签或标签贴错。
标识信息不明,未提供 采集时间及送检目的等。
超过2h送达实验室,且未 正确保存的标本。
运送容器有渗漏。
同一天同一项目重 复送 检的痰标本。
(2)采集要求:
痰标本的采集时机十分关键,应严格遵循以下 原 则采集标本:
争取首剂抗菌药物治疗使用前及更换抗菌药物前采集。 标本采集后保证2h内送达实验室并得到接种。 只要有可能得到合格的痰标本,应马上采集、送检。 宜在医护人员直视下留取合格痰标本。 送检痰标本后三天内不主张再次送检。
(3)标本采集 :
呼吸道标本采集流程
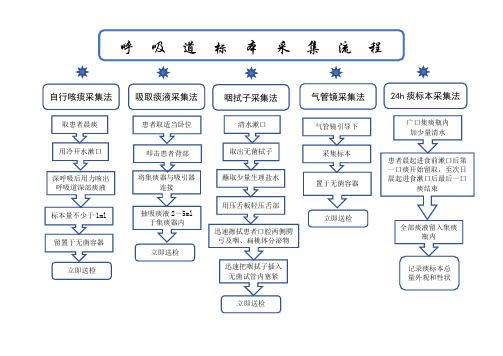
自行咳痰采集法 取患者晨痰
留置于无菌容器
用冷开水漱口
深呼吸后用力咳出
呼吸道深部痰液
立即送检 立即送检 吸取痰液采集法 气管镜采集法 咽拭子采集法 24h 痰标本采集法 标本量不少于1ml
清水漱口 取出无菌拭子 用压舌板轻压舌部 蘸取少量生理盐水 迅速擦拭患者口腔两侧腭弓及咽、扁桃体分泌物 迅速把咽拭子插入无菌试管内塞紧 立即送检 叩击患者背部 患者取适当卧位 将集痰器与吸引器连接 抽吸痰液2~5ml 于集痰器内 记录痰标本总
量外观和性状 广口集痰瓶内 加少量清水 患者晨起进食前漱口后第一口痰开始留取,至次日晨起进食漱口后最后一口痰结束 全部痰液留入集痰瓶内 立即送检 采集标本 气管镜引导下 置于无菌容器。
呼吸道标本细菌学检验标准操作规程

呼吸道标本细菌学检验标准操作规程1目的规范呼吸道标本细菌学检验标准操作规程,确保检验结果准确可靠。
2适用范围呼吸道标本培养和涂片检查。
3标本3.1标本类型:痰、咽拭子、支气管肺泡灌洗吸出液、支气管冲洗液或刷子、肺穿刺等。
3.2标本采集3.2.1采集时间:以晨痰为好;支气管扩张症病人,清晨起床后进行体位引流,可采集大量痰标本。
3.2.2自然咳法:在留取痰之前,用清水反复漱口,应从气管深处出痰,吐入无菌容器内。
3.2.3气管镜下采集法:在病灶附近用导管吸或用支气管刷直接取得标本。
3.2.4气管穿刺法:在环甲膜下穿刺抽取痰液,收集标本,适用于厌氧菌培养。
3.2.5棉拭采集法:用无菌棉拭子轻轻擦拭病人鼻咽部黏膜,留取标本,置无菌试管内送检。
3.3标本拒收标准3.3.1申请单姓名、科别、床号与标本的标签不符。
3.3.2痰标本呈水样或唾液样。
3.3.3痰涂片白细胞<10/低倍视野,上皮细胞>25/低倍视野。
3.3.4标本容器溢漏,无瓶盖。
3.3.5痰标本留取放置时间太长,超过2小时。
3.3.6未用指定的无菌容器作细菌培养。
3.4标本保存采集标本后立即送到实验室,放置时间不超过2小时。
4试剂、仪器4.1革兰染液、氧化酶试剂、3%触酶、血琼脂平板、巧克力平板、麦康凯平板、相关生化试剂等。
4.2VITEK鉴定系统;革兰阴性菌鉴定卡、革兰阴性菌药敏卡、革兰阳性菌鉴定卡、革兰阳性菌药敏卡、药敏纸片等,有效期及储存条件参见试剂说明书。
培养箱4.3接种针、接种环、电热灼烧器、显微镜、孵育箱、CO2等。
5细菌鉴定和药敏监控参见《质量管理程序》。
6检验步骤接收标本后,立即对标本进行编号、登记。
6.1肉眼观察:包括颜色、黏度、有无血丝或脓。
6.2涂片检查:可以确定标本是否适合做细菌培养,直接涂片镜检,依据低倍镜下观察白细胞和上皮细胞数目多少来评定。
并可初步判定是否有病原菌存在。
痰标本镜下分类分级白细胞(个)上皮细胞(个)A>25<10B>25<25C<10>25注:A、B两种情况的痰标本适合做培养,C不合格,应重新留标本。
痰及下呼吸道标本的采集指征、采集方法、注意事项、标本运送及临床情况沟通

痰及下呼吸道标本的采集指征、采集方法、注意事项、标本运送及临床情况沟通采集指征有下列体征之一,应进行痰培养:①咳嗽、咳痰,痰液可为脓性、血性、铁锈色或红棕色胶胨阳痰。
②咯血,包括泡沫血痰、鲜血和痰中带血等。
③呼吸困难,呼吸急促或哮喘,常伴有胸痛。
④发热伴白细a胞增高尤其是中性粒细胞或CRP、PCT明显增高。
⑤胸部影像学检查提示有感染可能。
肺部感染的患者有25-50%可能发生菌血症,应同时作血培养。
采集方法1、自然咳痰法以晨痰为佳,咳痰前先用冷开水、纯净水反复漱口三次,然后用力咳出呼吸道深部的痰,痰液直接吐入痰杯中,1h 内送检。
尽可能在用抗菌药物之前采集标本。
标本量应>1ml。
痰量少或无痰者可采用雾化吸入加温至45℃的10%Nacl水溶液,使痰液易于排出。
对难于自然咳痰患者可用无菌吸痰管)抽取气管深部分泌物。
2、对昏迷、重症、难治,或伴免疫抑制,或疑是厌氧菌引起的院内感染者,可采用纤维支气管镜采集法、防污染毛刷采集法(PSB)、支气管肺泡灌洗法(BAL)、环甲膜穿刺经气管吸引法(TTA)、经胸壁针穿刺吸引法(TNA)采集标本,均由临床医生按相应操作规程采集,但必须注意采集标本时尽可能避免咽喉部正常菌群的污染。
3、小儿取痰法:用弯压舌板向后压舌,将棉拭子伸入咽部,小儿经压舌刺激咳嗽时,可喷出肺部或气管分泌物粘在拭子上。
幼儿还可用手指轻叩胸骨柄上方,以诱发咳痰。
注意事项痰标本不能及时送检者,可暂存4℃冰箱。
室温下延搁数小时定植于口咽部的非致病菌呈过度生长而肺炎链球菌、葡萄球菌和流感嗜血杆菌检出率则明显下降。
标本运送标本应尽快送检,不能及时送检的标本,室温保持<2h,4℃冰箱保存<12h。
一般每天只需做一次。
痰及下呼吸道标本验收与拒收见下:1、送检目的不合适者,如咽拭子、咳痰、吸出的分泌物做厌氧菌培养无意义,应拒收。
2、申请单应填写完整无误。
标本标识必须唯一,未标采集时间、部位或检验要求等拒收。
3、标本容器必须符合规定,溢漏、无盖者拒收。
呼吸道标本的采集、储存和运送规范

㊃COVID-19特稿标准/指南㊃DOI:10.3969/j.issn.1673-5501.2020.01.005呼吸道标本的采集㊁储存和运送规范杨童玲1,3 夏爱梅1,3 胡晓静1 余艮珍2 史 欢2 顾 莺1 张晓波1 王传清1 张崇凡1 黄国英1作者单位 1复旦大学附属儿科医院 上海,201102;2华中科技大学同济医学院附属同济医院 武汉,430030;3共同第一作者通讯作者 张崇凡,E-mail:xt211311@aliyun.com;黄国英,E-mail:gyhuang@shmu.edu.cn流感病毒检测最常见的是采集呼吸道标本,可采用拭子㊁刷子㊁吸出物和灌洗液获取呼吸道标本,可以采集鼻咽㊁口咽㊁鼻孔等㊂曾使用培养法或直接法荧光抗体法进行检测[1,2],现以逆转录多聚酶链反应(RT-PCR)方法,可以通过样本中少量的病毒核酸扩增而提高检测率[3]㊂急性严重呼吸综合征冠状病毒2(SARS-CoV-2)感染流行期间,RT-PCR是SARS-CoV-2感染确诊的首选方法[4,5]㊂检测准确性最高的标本是下呼吸道标本,但属于有创性操作㊂由于核酸扩增检测可以检测更低浓度的病毒,并且不需要细胞的存在,因此喉部拭子或唾液样本可能是进行分析的合适样本[6],但其检出率低于83%[7]㊂相对无创而准确率高的是鼻咽抽吸物标本,能提供高浓度的感染细胞㊂对于儿童,采集一个口咽拭子和一个鼻部拭子的准确性相当于鼻咽拭子的准确性[8],是检测准确性与无创性采集的理想搭配㊂但临床上为了避免假阴性,通常会同时采集一个口咽拭子和一个鼻咽拭子㊂口咽拭子的采集相对比较简单,鼻咽拭子的采集需要经过培训,而且鼻咽拭子的采集过程可能会引发患者打喷嚏或者咳嗽而导致气溶胶的产生,存在交叉感染的风险[9]㊂本文基于新型冠状病毒肺炎(COVID-19)作为乙类传染病甲类管理办法,介绍呼吸道标本的采集㊁贮存和运送[10,11]㊂1 采集对象SARS-CoV-2感染的COVID-19疑似病例㊁疑似聚集性病例,其他需要进行SARS-CoV-2感染诊断或鉴别诊断病例,确诊的COVID-19是否康复的鉴别病例,或其他需要进一步SARS-CoV-2感染筛查检测的环境或生物材料㊂2 采集者从事SARS-CoV-2检测标本采集的技术人员应经过生物安全培训且为合格者和具备相应的实验技能㊂按照‘儿童新型冠状病毒感染/肺炎疑似和确诊病例快速筛查和临床实践指南“[12]的要求使用三级防护,最好使用全面型电动送风呼吸器面罩进行有效防护㊂3 采集标本SARS-CoV-2初步诊断测试,中国疾病预防控制中心(CDC)建议收集和检测咳嗽患儿的上呼吸道(鼻咽和口咽拭子)和下呼吸道(痰,如果可能)的样本㊂按照国家卫健委COVID-19诊疗方案(试行第六版)的要求,尽可能留取痰液标本,气管插管患者采集下呼吸道分泌物标本㊂4 采集标本时机临床怀疑SARS-CoV-2感染应立即向当地卫生部门报告,当地公共卫生工作人员将确定患者是否符合SARS-CoV-2感染调查对象的标准㊂临床标本应在临床或公共卫生实验室采集,用于常规呼吸道病原体检测㊂临床实验室不应从SARS-CoV-2感染者采集的样本中分离病毒㊂一旦确定了符合SARS-CoV-2感染对象,应尽快采集样本㊂5 采样管及其保存液上㊁下呼吸道标本采集后均置于含3mL病毒保存液的采样管中,推荐以Eagle's基础培养液为基础的保存液㊂保存液中也应添加胎牛血清或牛血清白蛋白等稳定病毒的蛋白质外壳的添加液㊂除此之外,还应添加青霉素㊁链霉素㊁庆大霉素及多黏菌素B等抑制细菌生长,保存液提供的样本基本是活病毒,可以最大程度保持样本的原始性,后续不仅可以用于病毒的核酸提取检测,还可用于病毒的培养和分离㊂6 采样拭子应选用合成纤维或人造纤维,不推荐海绵或棉花拭子,棉花的纤维对蛋白质吸附较强,导致病毒不易洗脱到保存液中,也不推荐尼龙类的纤维,其吸水性不佳,导致采样量不足,影响检出效率㊂7 样本的储存和拒收原则上样本应立即送检㊂以下是各种储存必需的条件:①采集后,应贴上相应的标签,样本可在4ħ以下保存㊃91㊃中国循证儿科杂志 2020年2月第15卷第1期72h,②如果预计提取检验会延迟,则将样本储存在-70ħ或更低的温度,③提取的核酸应储存于-70ħ或更低的温度㊂拒收的样本包括:①没有保存在2 8ħ或-70ħ或以下的样本;②样本标签或资料不完整;③样本类型不合适;④样本量不足㊂8 样本的运送①运送人员防护要求:需对运送人员进行专业培训,做好二级防护,目前中国的标本运送由CDC的专业人员来取,工作人员通道进入,污染通道离开㊂②样本需要双层密封袋密封,每袋装1份标本,将样本储存在4ħ,并使用密封的标本转运箱(内附有冰袋)立即运送㊂在每个样本容器上贴上患者的具体信息㊁样本的具体信息㊂为每个提交的样本填写卫生行政部门要求的表格㊂③如果样本在-70ħ下冷冻,运输时则将其放在密封的标本转运箱(内附有干冰)连夜运送,如无-70ħ保存条件,则于-20ħ冰箱暂存㊂9 加强沟通临床和实验室工作人员之间的及时沟通很重要,这样才能在处理可能SARS-CoV-2感染病例的标本时将感染的风险降到最低㊂10 上呼吸道标本采集10.1 口咽拭子 ①视野要求:口咽拭子取样时,应该在良好的照明条件下,使用一次性压舌板来确保咽喉部有足够的视野,压舌板将舌压到一边,避开舌头,拭子擦拭扁桃体(图1A㊁B)㊂②口咽拭子材质的要求:只能使用带塑料柄的合成纤维棉签,不能使用海藻酸钙拭子或带木柄的拭子,因为它们可能含有灭活某些病毒和抑制PCR检测的物质㊂③患儿体位和口腔防护要求:患儿取坐位或卧位,采集者坐在患儿对面,以能够看清患儿口咽部扁桃体为准,采集的时候要让患儿头部上抬30度,采集时患儿应该用口罩罩住鼻部,减少喷嚏或咳嗽飞沫飞溅(图1C)㊂④取材要求:将口咽拭子深入口咽部,在原位最好保持10s以吸收分泌物,用拭子棉签同时擦拭双侧咽扁桃体及咽后壁,轻度用力拭抹咽后壁部位,应避免触及舌部㊂将口咽拭子棉签头浸入采样管中,尾部弃去,旋紧管盖㊂10.2 鼻咽拭子采集(图1D㊁E) ①鼻咽拭子材质要求同口咽拭子㊂②准备含3mL病毒保存液的采样管备用㊂③患儿体位和口腔防护要求:患儿头部后仰70度,采集时患儿应该用口罩罩住下颌,减少咳嗽飞沫飞溅,取材人站在患儿侧方,防止飞沫飞溅㊂④鼻咽拭子棒长度要求:可以用鼻咽拭子棒测量一下,量出耳根到鼻孔的距离,并用手指做标记㊂⑤体验要求:将采样拭子以垂直鼻子(面部)方向插入鼻腔,与上颚平行,拭子伸入距离最少应达耳垂部位到鼻尖长度的一半,如果能够达到先前估计的深度最好,可有阻挡感㊂⑥取材要求:深入鼻咽部,使拭子在鼻内停留15 30s,轻轻旋转3 5次,以吸收分泌物,然后抽出拭子㊂⑦取材后要求:将鼻咽拭子棉签头浸入采样管中,尾部弃去,旋紧管盖㊂图1 上呼吸道标本采集注 A:扁桃体;B:鼻咽11 下呼吸道标本11.1 支气管灌洗液 将收集器头部从鼻孔或气管插口处插入气管,见患儿有咳嗽反射后再稍微深入1cm后,注入5mL温生理盐水,开放负压,旋转收集器头部并缓慢退出,收集抽取的黏液于病毒采样管中㊂11.2 肺泡灌洗 该方法适合危重患儿,患儿往往因为呼吸衰竭或肺不张需要行气管插管或纤维支气管镜灌洗,便于获取肺泡灌洗液标本,需要在支气管镜室局麻下行电子支气管镜术㊂支气管镜由左鼻孔进入气管㊁支气管后,镜端固定于右/左肺中叶开口,经气管活检孔缓缓加入灭菌温生理盐水,每次8mL灌洗2 3次,灌洗后吸出[13],收集至采样管中㊂11.3 鼻咽和气管抽吸 婴幼儿多需要采用该途径采集标本,使用痰液收集器连接负压吸引器,痰液收集器前端的吸痰管深入到患儿气道内,见患儿有咳嗽反射后再稍微深入1cm后开放负压,吸出2 3mL呼吸道分泌物至采样管中㊂参考文献[1]LoensK,VanHeirstraetenL,Malhotra-KumarS,etal.Optimalsamplingsitesandmethodsfordetectionofpathogenspossiblycausingcommunity-acquiredlowerrespiratorytractinfections.JClinMicrobiol,47(1):21-31[2]RobinsonJL,LeeBE,KothapalliS,etal.Useofthroatswab㊃02㊃ChinJEvidBasedPediatr Feburary2020,Vol15,No1orsalivaspecimensfordetectionofrespiratoryvirusesinchildren.ClinInfectDis,46(7):e61-64[3]CentersforDiseaseControlandPrevention(CDC).EvaluationofrapidinfluenzadiagnostictestsfordetectionofnovelinfluenzaA(H1N1)Virus-UnitedStates,2009.MMWRMorbMortalWklyRep,58(30):826-829[4]国家卫生健康委.关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知(2020-02-18).http://www.nhc.gov.cn/,2020.02.18[5]CormanVM,LandtO,KaiserM,etal.Detectionof2019novelcoronavirus(2019-nCoV)byreal-timeRT-PCR.EuroSurveill,2020,25(3).doi:10.2807/1560-7917[6]WangWK,ChenSY,LiuIJ,etal.DetectionofSARS-associatedcoronavirusinthroatwashandsalivainearlydiagnosis.EmergInfectDis,2004,10(7):1213-1219[7]RobinsonJL,LeeBE,KothapalliS,etal.Useofthroatswaborsalivaspecimensfor181detectionofrespiratoryvirusesinchildren.ClinInfectDis,46(7):e61-64[8]SpencerS,ThompsonMG,FlanneryB,etal.ComparisonofRespiratorySpecimenCollectionMethodsforDetectionofInfluenzaVirusInfectionbyRT-PCR:ALiteratureReview.JClinMicrobiol,57(9),pii:e00027-19[9]TellierR.ReviewofaerosoltransmissionofinfluenzaAvirus.EmergInfectDis,2006,12(11):1657-1662[10]国家卫生健康委.新型冠状病毒感染的肺炎实验室检测技术指南(第三版).2020.01.28[11]InformationforLaboratoriesCOVID-19RequestsforDiagnosticPanelsandVirus.https://www.cdc.gov/coronavirus/2019-ncov/lab/tool-virus-requests.html[12]复旦大学附属儿科医院.儿童新型冠状病毒感染/肺炎疑似和确诊病例快速筛查和临床实践指南.中国循证儿科杂志,15(1):1-4[13]黄宝兴,邓继岿,王红梅.1693例难治性肺炎患儿支气管肺泡灌洗液病原体培养分析.中国感染控制杂志,14(6):379-382.(收稿日期:2020-01-31 修回日期:2020-02-11)(本文编辑:张萍)㊃12㊃中国循证儿科杂志2020年2月第15卷第1期。
怎样的呼吸道标本才会给临床提供可靠的指标?

怎样的呼吸道标本才会给临床提供可靠的指标?呼吸道标本是临床细菌培养的重要组成部分,在临床中,呼吸道感染可分为上呼吸道及下呼吸道感染。
不同部位的感染病原菌差异较大,规范呼吸道标本细菌学检验标准操作规程,对其操作流程的充分了解有助于临床工作的开展,进而确保检验准确可靠。
因标本容易受到口咽部菌群的污染,致使送检标本不合格,而不合格的标本可导致错误的临床诊断与治疗。
因此,本文就怎样的呼吸道标本才会给临床提供可靠的指标做如下报道。
1.规范、正确采集呼吸道标本的原因感染性疾病诊断的金标准是病原学诊断,只有详细了解了病原学和药敏结果,才能真正做到选择正确的抗菌药物及合理用药,同时避免细菌耐药的发生。
最终可节省医疗费用,减少住院时间,降低病死率。
而病原学诊断结果的正确与否,关键在于标本质量。
标本质量直接决定检验结果的可靠性,只有前期进行及时规范的标本采集,后期患者的诊断及治疗才能得到较好的结果。
只有规范呼吸道标本细菌学检验标准操作规程,才能为临床提供可靠的指标,确保检验结果准确可靠。
1.呼吸道标本有哪些上呼吸道标本有口咽拭子、鼻咽拭子以及鼻咽吸取物等;下呼吸道标本有气管吸取液、支气管肺泡灌洗液以及痰液等。
3.呼吸道样本的正确采集方法3.1口咽拭子先用生理盐水漱口,将试子放入无菌生理盐水中湿润,瞩患者放松,采集时嘱患者头部后仰30°,发“啊”声,以暴露咽喉部,将压舌板插入口咽部压住病人舌前2/3,涤纶或藻酸钙拭子适度用力,来回擦拭双侧扁桃体,然后再擦拭咽后壁3-4次,并保留10-15秒,拭子进出口腔时需避免触及舌部、悬垂体、口腔粘膜和唾液;采样完毕后取出后置采样管,将拭子头沿标记折断,使拭子浸入至采样液中,旋紧管盖。
一般情况下,不单独选用咽拭子标本诊断上呼吸道感染,鼻咽拭子或鼻咽吸取物联合检验以提高呼吸道感染的病原检出率。
3.2鼻咽拭子嘱患者尽量保持头部后仰70°,将试子缓慢转动并插入病人鼻孔至颚部,切记不可太用力,沿鼻腔壁伸入鼻咽部直至感到一定阻力时,转动数次,停留数秒吸取分泌物,轻轻旋转取出拭子,将采样管标记部位塑料棍折断,试子浸泡至采样液中,旋紧管盖,并及时送达实验室。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
痰标本的采集和运送条例
1.
2.
标本采集时间:用抗生素前;晨痰; 采集方法: (1)自然咳痰:用清水漱口3次,应包括 咽喉部,用力咳出痰,与灭菌容器中或输 送培养基中。
痰标本的采集和运送条例
(2)帮助咳痰:不易获得痰的患者可雾化吸入加 温的氯化钠(45℃10%氯化钠水溶液) (3)支气管镜或支气管毛刷:由医生采集,建议 直接种入输送培养基。 (4)胃内采集痰标本:婴幼儿不会咳痰而且常把 痰误咽入胃中。可在清晨,用胃管插入胃内,用 注射器抽出胃液。 (5)小儿采集痰标本:用压舌板刺激咳嗽使肺部 和器官的分泌物喷出,用拭子采取标本送检,如 不能立即送检应种入输送培养基。
1. 2.
细菌实验室应对不同的细菌检验报告 时间和内容应有相应的规定,并告诉 临床各科,依此可防止不明原因的报 告延迟 应分两种报告形式: 危重感染报告: 常规报告:
涂片报告
1、革兰染色:危重报告30分钟报告。报 告内容应包括染色反应、是细菌或真 菌、细菌形态。有无细胞内吞嗜现象, 有无菌丝。 2、抗酸染色:报告抗酸染色阳性或阴性; 菌量以加号表示。常规报告24小时, 危重报告1小时。
标本
选择性培养基(如表1)
质量控制
上呼吸道标本处理程序
培养程序
在1/6琼脂表面用力滚动拭子,并划线分离。 在一区用接种针穿刺血平板几次。(图1) 把平板放置在5%CO2培养。
下呼操作 常规细菌培养 原理
下呼吸道感染包括支气管炎,细支气管炎和 肺炎。以上炎症,特别是肺炎,可以引起严 重甚至是致命的疾病。虽然病毒,支原体, 立克次(氏)体和真菌都可以引起下呼吸道感 染,但细菌是主要的病原体,其所占的比例 要比上呼吸道感染要高很多。
呼吸道标本的处理程序
王勇
内容简介
上呼吸道标本标准操作程序(SOP) 下呼吸道标本标准操作程序(SOP) 痰标本的规范化操作(草案)
上呼吸道标本处理程序
大部分步骤需要在生物安全柜内接种 细菌性咽炎的实验室诊断 原理
大多数上呼吸道感染是由病毒引起的。细菌性咽炎经 常是由化脓性链球菌引起。但重度的会厌炎和喉气管 炎则是例外,其一般是由于b型流感嗜血杆菌引起。 从扁桃体和后咽部采集标本的咽拭子 5%羊血琼脂 含抗生素的Thayer Martin 琼脂(GC+)和无抗生素的 <GCO>(仅用于淋病奈瑟菌病例) 巧克力琼脂(仅用于会厌炎和喉气管炎病例) 培养基使用之前,QC由培养基组负责。
唾液(S) 带血 (BS) 粘液状(M) 水样 (W) 粘液脓性的(MP) 脓痰(P)脓性粘液痰(PM)
拒收“唾液”标本并报告“标本不适合用于进一步处 理”“请重留”
下呼吸道标本的处理
显微镜检
用拭子取所有类型标本的脓液部分涂片, (最好在60度热固定涂片2小时),并 准备革兰染色 低倍镜下检查涂片(10倍目镜);定量 计数10个视野下鳞状上皮细胞和白细胞 平均数。按照表1分级标准记录在工作 表上。
草案分七部分
标本采集和运送的规范条例 培养前标本质量检测规范 标本接种规范条例 细菌鉴定基本流程规范条例 细菌药物敏感试验规范条例 实验室质量控制 细菌报告规范条例等
第一部分 标本采集和运送
标本采集和运送是细菌培养成功的最重要 的关键!
但由于标本的采集和运送常有护士或医生或病人 自己完成,所以也是最不容易做好的事情,而且 不知道问题所在之处,由此引发的最主要后果是 阳性率下降,这也是临床医生最不能接受的问题, 为此建议来一次革命,用输送培养基代替传统的 标本的容器。
第三部分 分离培养规范草案
有了合格的标本是保证培养成功的
重要条件,但如果没有适宜的分离 培养基和培养环境同样不能获得好 的结果,为此制定如下基本条例以 保证致病菌分离成功。
一、痰培养
1.
2.
3.
培养基:5%羊血琼脂、5%兔血巧克力琼脂、 中国兰琼脂或伊红美兰、加MRSA显色琼脂。 培养环境:5%羊血琼脂、5%兔血巧克力琼 脂置5-7%CO235℃环境培养、其他培养置 35℃空气培养。 结核培养:罗世鸡蛋斜面,每一标本种2 支,37度空气培养
合格的标本是培养成功的最重要的因素, 实验室有权利对不合格提出终止检查或要 求重送标本的要求,因此实验室必须建立 标本接种前的质量控制和标本合格的检测。 要求对除血液外的标本均作涂片革兰染色 检查,用于评价标本的质量和区别分离细 菌是定植菌或致病菌。
痰培养标本培养前规范
实验室在接种前必须作痰涂片革兰染色当 在低倍镜下白细胞小于10个每视野、上皮 细胞大于25个每视野时应作为不宜作培养 的标本 当白细胞小于10个每视野,上皮细胞小于 25个每视野时再参照油镜观察标本中细菌 分布作判断;
下呼吸道标本的处理
材料
培养基 5%羊血平板 巧克力平板 中国兰 念珠菌显色培养基 试剂
Sputasol(OXOID)
下呼吸道标本的处理
质量控制
培养基使用之前,QC由培养基组负责。
操作程序
肉眼观察 记录痰标本的外观并记录在申请单背面。 外观描述及简写如下:
厌氧培养标本采集规范条例
1.
2.
3.
痰标本的厌氧培养标本采集:必须用气管 穿刺法获得痰液,从口腔吐出的痰标本不 能用于厌氧培养。 尿标本的厌氧培养标本采集:耻骨上膀胱 穿刺获得尿标本可用于厌氧菌培养 便标本厌氧培养标本采集;可用排出的便 作厌氧培养但也应少与空气接触。
第二部分标本培养前规范草案
趋向性鉴定试验
革兰阳性球菌:触酶试验、凝固酶试验 革兰阴性杆菌:氧化酶试验
生化试验
应包括临床常见分离致病菌的生物特 征;有条件的实验室建议购买商品鉴 定系统,根据标本量选择手工操作的 API系统或半自动的ATB系统或全自动 的VITEK-2COMPACT,或PHENIX-100等, 无条件的实验室可自行配制生化试剂, 但应有质量控制记录保证试剂的实效 性。
真菌检测
3.
4.
真菌鉴定应区别是白色念珠菌或非白色念 珠菌;是曲菌或毛霉菌,可用显色培养基 或传统手工鉴定厚膜孢子的方法,对丝状 真菌用小培养观察生长过程初步鉴定真菌 种并区别曲菌或毛霉菌。有条件的实验室 也可用自动化设备或分子生物学方法作鉴 定。 有条件的单位可开展真菌药敏试验(应用 稀释法报告MIC结果),真菌耐药监测为 临床用药提供参考。
3、前列腺液标本分离出凝固酶阴性葡萄球 菌或革兰阳性小杆菌,涂片未见到,可能 是污染细菌,应建议重送标本。 4、当涂片中见到的细菌,并由细菌吞嗜现 象存在,在培养时分离出该细菌可推测为 致病菌。(涂片应注明细菌是细胞内或细 胞外)
培养结果结合涂片判断定置菌或致病菌
5、涂片报告的日期和培养报告日期要对应 便于医生判别结果的参考价值。 6、并每一视野可见到>20个/油镜或该菌占 所见到细菌的50%,可推测是标本中的优势 菌。
低倍镜下细胞计数(10个视野平均数)
倍数 0 偶见 1+ 2+ 3+
上皮细胞×100
无
<10
10-25
>2 5
WBC
×100
无
<25
/
25-75
>80(或四分之一视野> 20)
如果标本要求革兰染色,在100倍目镜下 检查病原体并记录在工作表上 对涂片显示上皮细胞占优势,(3+)丢 掉标本并报告“涂片显示口腔正常菌群 污染”“标本不适合用于进一步处 理”“请重留”
血清学试验
肠道致病菌生化特征符合的前提下必 须有血清学的试验作最后确认,基层 细菌室应具备1-3项血清试剂。
血清学鉴定
1. 2. 3. 4.
志贺氏菌多价和单价凝集血清 沙门氏菌多价和单价凝集血清 致病性大肠杆菌多价和单价凝集血清 耶尔森氏菌凝集血清
真菌检测
1.
2.
每一基层实验室必须开展真菌涂片, 报告临床是否找到真菌;是否见到真 菌菌丝;从形态辨别曲菌或毛霉菌 开展真菌分离培养,应具备最基本的 沙保弱培养基
1、尿培养分离出3种以上的细菌,或分离 出凝固酶阴性葡萄球菌、革兰阳性棒状杆 菌等非定义为致病菌的细菌,涂片未见到, 应在报告中提示可能是污染细菌建议结合 临床表现考虑结果的参考价值。 2、眼结膜拭子分离出凝固酶阴性葡萄球菌, 涂片未见到,可能是污染细菌,应建议重 送标本。
培养结果结合涂片判断定置菌或致病菌
厌氧培养
在正常上班时间。 申请厌氧培养的可适应邀请实验室,由临 床医生或护士采集,细菌室行床边接种。
自然排出的便标本和尿标本、用棉拭子采 集的分泌物、自然咳出的痰标本均为不合 格的厌氧培养标本,应于退检。
没有条件或不能及时送检的情况下均应用 输送培养基放置标本。
培养结果结合涂片判断定置菌或致病菌
第五部分 药物敏感试验规范
基层细菌室应开展K-B纸片扩
散法药敏试验,应用WHONET 软件开展本单位的耐药监测 为临床用药提供参考
药敏标准
1.
2. 3.
用CLSI指南推荐的K-B药敏标准进行 常规药敏试验判断 根据CLSI更新及时替换应用的标准 根据CLSI推荐的方法,开展重要耐药 菌的检测,如MRSA、VRE、HLARE、 ESBL。
下呼吸道标本的处理
下呼吸道标本培养的常见病原菌
革兰阴性菌 脑膜炎奈瑟氏菌 流感嗜血杆菌 肠杆菌科细菌 非发酵菌 嗜肺军团菌
