只含有碳氢两种元素的化合物
烃由碳氢两种元素组成的有机化合物叫碳氢化合物
正丁基 异丁基 仲丁基
n-Bu― i-Bu― s-Bu―
CH3
CH3―C―CH3
叔丁基
t-Bu―
9
2. 命名 1)普通命名法(适用于简单化合物)
• 1~10个碳的烷烃,词头用:甲、乙、丙、丁、戊、己、庚、 辛、壬、癸;
• 10个碳以上,用数字十一等表示。
• 碳架异构体用正、异、新等词头区分。
正
异
新
序不同而产生的异构体。
C4H10
C5H12
CH3
CH3CH2CH2CH3 CH3CHCH3
3
由碳架不同引起的异构,称碳架异构。(属构造异构) 它们的性质(如熔点、沸点)有差别。
正丁烷
熔点(℃) -135 沸点(℃) -0.5
异丁烷
-145 -11.7
异构体数目随碳原子数目增加而迅速增加:
碳原子数目: 1 2 3 4 5 6 7 10 20
• 每对重叠氢H-C-C-H重叠张力 (扭转张力): ~3.9kJ/mol
• 室温下分子热运动可产生83.6 kJ/mol 的能量,转动能:11.7 kJ/mol
• 室温下,构象异构体处于迅速 转化的动态平衡中,不能分离。
• 从统计观点来看,在某一瞬 间,交叉式构象比重叠式构象所 占的比例要大得多。T=25℃, 比 例大约为160:1
b. 构象的稳定性 乙烷两个极端构象稳定性比较
重叠式
锯
H
架
式
H
交叉式
H
伞 形
H 2.29Å H
式
H
H
H
H
H
H
2.50Å
H H
H
H
H
排斥力最大,内能高
有机化学【烷烃】

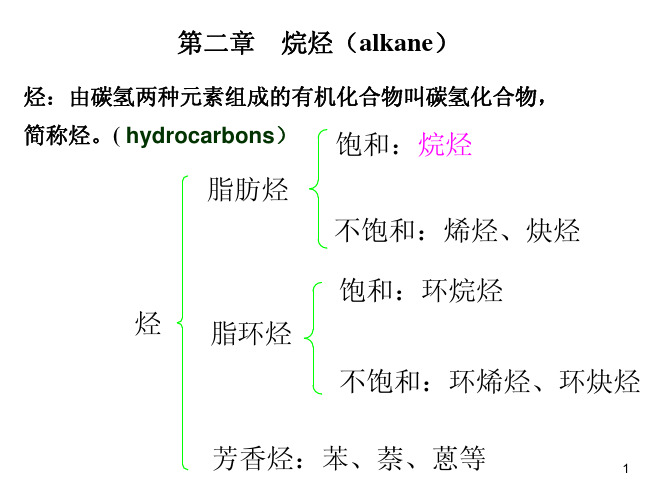
烃(hydrocarbon)的定义:
分子中只含有碳(carbon)和氢 (hydrogen)两种元素的有机化合物叫做 碳氢化合物,简称烃。
其它有机化合物可以看作是烃的衍 生物,所以烃是有机化合物的“母体”。
开链烃 (脂肪烃)
饱和烃(烷烃) 如 CH3-CH3 烯烃 如 CH2=CH2
n-butyl i-butyl sec-butyl tert-butyl
三、烷烃的结构
甲烷的四面体结构
碳原子轨道的sp3杂化
109.5º
• 烷烃分子中的碳都是sp3杂化。
• 烷烃中的碳氢键和碳碳键都是σ键。
σ键的定义
在化学中,将两个轨道沿着轨道对称轴 方向重叠形成的键叫σ键。
σ键的特点
(1)电子云可以达到最大程度的重叠,所以 比较牢固。 (2)σ键旋转时不会破坏电子云的重叠,所 以σ键可以自由旋转。
(A)从烷烃的构造式中选取最长的连 续碳链作为主链,支链作为取代基。当 含有不止一个相等的最长碳链可供选择 时,一般选取包含支链最多的最长碳链 作为主链。根据主链所含碳原子数称为 “某”烷。
例:
1
CH3CH2CH2_ CH_CH2CH3 CH_CH3
CH3
CH3CH2CH2_ CH2_CH2CH3
当二个氢原子的间距少于0.240 nm (即 二个氢原子的半径和)时,氢原子之间会产 生排斥力,从而使分子内能增高,所以重叠 式比交叉式内能高。
两氢离距相比:
0.250 nm > 0.240 nm > 0.229 nm
能量差别:
E重叠 > E交叉 E=12.6KJ•mol-1
乙烷不同构象的能量变化曲线
例:
21
分子中只含有碳和氢两种元素的有机化合物汇总

丙烷
C 3H 8
H
C H
H
H
CH3 CH2 CH3
丁烷
C4H10
H
C H
CH3 (CH2)2CH3
-CH2-基团叫做亚甲基, -CH3基团叫做亚甲基。
直链烷烃的通式: H-(CH2)n-H 或 CnH2n+2
(2)烷烃的构造异构
链端碳上氢原子
H H C H H C H H C H H
CH3 (CH2)2CH3 正丁烷 (b.p. :-0.5oC;m.p. :-138.3oC)
第二章
烷
烃
分子中只含有碳和氢两种元素的有机化合物 叫做碳氢化合物,简称烃。
烷烃 开链烃 (简称链烃或脂肪烃) 烯烃 二烯烃 炔烃等 闭链烃 (又叫环烃) 脂环烃
烃
芳香烃
2.1 烷烃的通式、同系列和构造异构
(1) 烷烃的通式 烷烃系列化合物的结构特点:
(a)甲烷碳原子的四个价键都和氢原子相结合; (b)其它烷烃分子中,碳原子的四个价键,除以单键与其他 碳原子互相结合成碳链外,其余的价键都和氢原子相结合, 即完全为氢原子所饱和。因此,烷烃又称为饱和烃。
(II)带有支链的烷烃 ——看作是直链烷烃的烷基衍生物。
(A)选择主链——把构造式中连续的最长碳链作为母体 称为某烷。较短的链作为支链,看作取代基。命名时将 基名放在母体名称前,称某基某烷。
CH2CH3 CH3 CHCH2CHCH2CH3 CH2CH2CH3
CH3
=
CH3CH2CHCH2CHCH2CH2CH3 CH3
CH3 CH2CH2CH2CH3 正戊烷
H3C H C CH3 CH2CH3
CH3 CH2CH2CH3
3 H3C 2 H C 1 CH3
只含有碳氢两种元素的化合物

第九章 烃只含有碳氢两种元素的化合物,称为碳氢化合物,简称烃。
烃是一类非常重要的有机化合物,广泛存在于自然界中,如石油和煤中就存有大量的烃类物质。
烃是有机化合物的“母体”,其它各类有机化合物可视为它的衍生物。
根据烃分子中的碳架呈链状或环状,可以把烃分为链烃和环烃两大类。
链烃又叫脂肪烃,它又分为饱和烃和不饱和烃。
表9-1 烃的分类烃链烃环烃饱和烃(烷烃)不饱和烃烯烃炔烃脂环烃芳香烃例如:例如:例如:例如:例如:HC CH H 3C H C CH 2H 3C CH 2CH 3第一节 烷 烃分子中碳原子间都以单键相连结,碳原子的其余价键都与氢原子结合,这样的开链烃称为饱和链烃,简称烷烃。
最简单的烷烃是甲烷。
一、甲烷的分子结构甲烷由一个碳原子和四个氢原子组成,分子式为CH 4,甲烷的电子式和结构式为:H CHH H C H H HH上述甲烷分子的结构式并不能反映出甲烷分子的立体构型。
经物理实验方法证明,甲烷的四个C-H键键长相等,都是1.09×10-10 m,四个键角相同,都是109。
28′。
据此甲烷应是一个正四面体结构的分子,碳原子位于正四面体的中心,四个价键伸向正四面体的四个顶角,与四个氢原子结合。
(见图9-1)图9-1甲烷的空间结构模型(a)正四面体模型(b)凯库勒模型(c)斯陶特模型怎样解释甲烷分子的立体结构呢?(一)碳原子的sp3杂化鲍林等人提出了原子轨道杂化理论,该理论认为,形成甲烷分轨道上,形成四个子时,碳原子的一个2s电子吸收能量激发到2pz单电子轨道,碳原子从基态变为激发态,激发后,碳原子就可以形成四个共价键,但实验证明,甲烷分子的四个碳氢键是完全相同的。
为了解决这一矛盾,鲍林等人进一步提出了原子轨道的杂化,即碳原子的1个2s轨道、3个2p轨道重新组合形成四个能量相等的新轨道,这个过程叫做原子轨道的杂化。
这种由1s轨道和3个p轨道参加的杂化,叫sp3杂化,形成的新轨道叫sp3杂化轨道。
新教材2023版高中化学课时作业15烃及有机高分子材料新人教版必修第二册

课时作业15 烃及有机高分子材料[学业达标]1.下列关于烃的说法正确的是( )A.烃是指仅含有碳和氢两种元素的有机物B.烃是指分子里含碳元素的化合物C.烃是指发生燃烧反应后生成二氧化碳和水的有机物D.烃是指含有碳和氢两种元素的化合物2.下列关于有机高分子化合物的说法不正确的是( )A.有机高分子化合物称为聚合物,是因为它们大部分是由小分子通过聚合反应制得的B.有机高分子化合物的相对分子质量很大,但其结构是若干链节的重复C.对于一种高分子材料,n是一个整数值,因而它的相对分子质量是确定的D.高分子材料可分为天然高分子材料和合成高分子材料两大类3.PVC是聚氯乙烯的英文缩写,为保证PVC塑料制品的性能,通常需要加入多种有机助剂。
下列选项中的事实均能支持“PVC保鲜膜对人体健康带来危害”的是( )①PVC塑料属于高分子材料②使用的有机助剂有毒③含氯的化合物不一定有毒④在高温下会分解出有害物质A.①② B.③④C.②④ D.①③4.(双选)科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。
下列关于碳氢化合物的叙述正确的是( ) A.碳氢化合物的通式为C n H2n+2B.燃烧产物为二氧化碳和水的化合物可能是碳氢化合物C.有些烷烃在光照下不能与氯气发生取代反应D.碳氢化合物分子的相对分子质量一定是偶数5.烃在自然界中广泛存在。
下列对烃的分类不正确的是( )A.CH4、CH2===CH2、CH2===CHCH===CH2均属于饱和烃B.CH3CH2CH3、CH3CH===CH2、CH3CH===CHCH2CH===CH2均属于链状烃C.CH3CH3、、C18H38均属于饱和烃D.均属于芳香烃6.(双选)物质的构成有很多奥秘,人们用不同的化学用语来表示物质的构成。
下列化学用语错误的是( )A.四氯化碳的电子式:B.丙炔的分子式:C3H4C.乙烯的结构简式:CH2===CH2D.丙烷分子的充填模型:7.有关“苯宝宝”的表情包非常流行,如图:下列有关苯的说法错误的是( )A.苯分子结构中对位上的4个原子在一条直线上B.苯的结构简式可用表示,说明含有3个碳碳双键C.苯的一氯代物有1种D.苯是一种碳原子的价键远没有饱和的烃8.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1∶2,则( ) A.分子中C、H、O原子的个数比为1∶2∶3B.分子中C、H原子的个数比为1∶2C.分子中可能含有氧原子D.此有机物的最简式为CH49.(双选)有机高分子材料在现实生活中有广泛应用。
第二章 烷烃

-CH2CH2CHCH3 异戊基 i-Pent CH3 CH3 -CH2-C-CH3 新戊基 neo-Pent CH3
仲丁基 s-Bu
CH3 -C-CH2CH3 CH3
叔戊基 t-Pent
英文命名中,n(正), i(异), sec(二级), tert(三级)
烷烃分子从形式上去掉两个氢原子所剩下的基团叫做 亚烷基。
构造式 名称 构造式 名称
-CH3
甲基
Me Et
-CH2CH3
-CH2CH2CH3 CH3-CH-CH3 -CH2(CH2)2 CH3 -CH2-CH-CH3 CH3 -CH-CH2CH3 CH3
乙基
正丙基 n-Pr 异丙基 i-Pr
CH3 -C-CH3 CH3
叔丁基
t-Bu
正丁基 n-Bu 异丁基 i-Bu
2、构造异构的书写规则
先直后支、先边后心、先少后多、先简后繁
请大家书写庚烷的同分异构体
先直后支
先 简 后 繁
先边后心
先 少 后 多
三、烷烃分子中碳、氢类型
1、碳的类型
季碳 4oC 仲碳 2oC
叔碳 3oC 伯碳 1oC 2、氢的类型 根据与其相结合的碳原子, 分别称为伯、仲、叔氢。
1oH 2oH 1oC 2 oC
H H
m.p -138 C b.p
¡ ¡ -0.5 C
m.p -159 C b.p 11.7 C
¡ ¡
分子式相同,结构式不同的化合物--同分异构体;
分子式相同,结构式不同的现象--同分异构现象。
对烷烃这种同分异构是由于分子中碳原子排列方式不同引起的, 称为构造异构。
C4H10有2个异构体;C10H22有75个异构体;C20H42有366319 个异构体。 随着碳原子数增加,同分异构体迅速增加。
化学单元测试题-有机化学基础-认识有机化合物-烃-B卷-附答案

1单元训练金卷·高三·化学卷(B )第十五单元 认识有机化合物 烃注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置.2.选择题的作答:每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效.3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内.写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
一、选择题(每小题3分,共48分)1.下列物质的分类中,所属关系不符合“X 包含Y 、Y 包含Z”的是选项 X YZA 芳香族化合物 芳香烃的衍生物B 脂肪族化合物 链状烃的衍生物 CH 3COOH(乙酸)C 环状化合物 芳香族化合物 苯的同系物D不饱和烃芳香烃2.只含有C 、H 、O 、N 的某有机物的简易球棍模型如图所示,下列关于该有机物的说法不正确的是A .该有机物属于氨基酸此卷只装订不密封班级 姓名 准考证号 考场号 座位号B.该有机物的分子式为C3H7NO2C.该有机物与CH3CH2CH2NO2互为同系物D.该有机物的一氯代物有2种3.(2018·辽宁师大附中月考)下列鉴别方法不可行的是A.用水鉴别乙醇、甲苯和溴苯B.用燃烧法鉴别乙醇、苯和四氯化碳C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯D.用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷4.(2018·贵州遵义航天中学期末)下列物质的类别与所含官能团都正确的是A .酚—OHB .羧酸-COOHC .醛-CHO D.CH3—O—CH3酮5.烷烃的命名正确的是A.4甲基3丙基戊烷B.3异丙基己烷C.2甲基3丙基戊烷D.2甲基3乙基己烷6.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2∶1的有A.乙酸甲酯B.对苯二酚C.2甲基丙烷D.邻苯二甲酸7.下列各有机化合物的命名正确的是28.(2018·长沙市明德中学月考)已知阿魏酸的结构简式为,则同时符合下列条件的阿魏酸的同分异构体的数目为①苯环上有两个取代基,且苯环上的一溴代物只有2种;②能发生银镜反应;③与碳酸氢钠溶液反应可生成使澄清石灰水变浑浊的气体;④与FeCl3溶液发生显色反应A.2 B.3 C.4 D.59.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。
有机化合物知识点总结三

有机化合物知识点总结(三)绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:1.氧化反应 I .燃烧C 2H 4+3O 2点燃> 2CO 2+2H 2O (火焰明亮,伴有黑烟)II .能被酸性KMnO4溶液氧化为CO 2,使酸性KMnO 4溶液褪色。
2.加成反应CH 2=CH 2+Br 2 ------->CH 2Br-CH 2Br (能使滨水或澳的四氯化碳溶液褪色)在一定条件下,乙烯还可以与H 2、Cl 2、HCl 、H 2O 等发生加成反应CH2=CH2+H2 催化剂,CH3cH3CH 2=CH 2+HCl 催化剂"CH 3cH 2cl (氯乙烷:一氯乙烷的简称) CH, = CH,+H,O —催化剂尸 CH.CH.OH (工业制乙醇) 22 2高温高压 3 23 .加聚反应nCH =CH 一催化剂一^一匚三一匚三二一:,(聚乙烯)22△注意:①乙烯能使酸性KMnO 4溶液、滨水或澳的四氯化碳溶液褪色。
常利用该反应鉴别烷烃 和烯烃,如鉴别甲烷和乙烯。
②常用澳水或澳的四氯化碳溶液来除去烷烃中的烯烃,但是不 能用酸性KMnO 4溶液,因为会有二氧化碳生成引入新的杂质。
1 .不能使酸性高镒酸钾褪色,也不能是澳水发生化学反应褪色,说明苯的化学性质比较稳定。
但可以通过萃取作用使滨水颜色变浅,液体分层,上层呈橙红色。
2 .氧化反应(燃烧) 2C 6H 6+15O 2点燃> 12CO 2+6H .O (现象:火焰明亮,伴有浓烟,说明含碳量高)3 .取代反应 (1)苯的漠代:。
+ Br 2*BrR0]- Br (溴苯)+HBr (只发生单取代反应,取代一个H )①反应条件:液澳(纯澳);FeBr 3、FeCl 3或铁单质做催化剂②反应物必须是液澳,不能是滨水。
成都中医药大学药学院

丁烷
通式
CnH2n+ 2
相邻碳原子的烷烃分子式相差一个CH2
一 烷烃的结构
碳原子采取SP3的杂化方式成键 四个SP3杂化轨道夹角109.50 如甲烷
109.50
H
C
正四面体
H
H
H
甲烷的球棍模型
甲烷的斯陶特模型
其他的烷烃分子中的碳原子也是四面体结构 除乙烷外,烷烃分子中的碳原子并不排布在一条直线上 而是以锯齿形或其他可能的形式存在
3 书写 把取代基的位次和名称写在母体之前
(1)位次用阿拉伯数字表示,阿拉伯数字与阿拉伯数字之间 用“,”隔开,阿 拉伯数字与中文字之间用短横“-”隔开
(2)相同取代基合并在一起,用中文字二、三、四……表示, 但位次不能合并
(3)有不同取代基时,取代基在名称中的位置按“顺序规 则”排列,优先的在后
12
•
7、
。202 0年11 月上午7 时36分 20.11.4 07:36Novembe r 4, 2020
•
8、业余生活要有意义,不要越轨。20 20年11 月4日 星期三7 时36分 8秒07: 36:084 November 2020
我们必须在失败中寻找胜利,在绝望中寻求希望
•
9、
。上 午7时36 分8秒 上午7时 36分07: 36:082 0.11.4
C OH
>
O CH
常见的取代原子或原子团的顺序见教材P44
(二)系统命名
1 选择母体
选择最长的支链最多的碳链作为主链,根据主 链的碳原子总数称为“某烷”,作为母体名称
12
34 5
7
6
3 , 4 - i e t h y l - h e p t a n e
有机化学分类

一、范德华力是存在于分子间的一种吸引力,它比化学键弱得多。
一般来说,某物质的范德华力越大,则它的熔点、沸点就越高。
对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增强。
范德华力之二范德华力也叫分子间力。
分子型物质能由气态转变为液态,由液态转变为固态,这说明分子间存在着相互作用力,这种作用力称为分子间力或范德华力。
分子间力有三种来源,即色散力、诱导力和取向力。
色散力是分子的瞬时偶极间的作用力,它的大小与分子的变形性等因素有关。
一般分子量愈大,分子内所含的电子数愈多,分子的变形性愈大,色散力亦愈大。
诱导力是分子的固有偶极与诱导偶极间的作用力,它的大小与分子的极性和变形性等有关。
取向力是分子的固有偶极间的作用力,它的大小与分子的极性和温度有关。
极性分子的偶极矩愈大,取向力愈大;温度愈高,取向力愈小。
无机化合物——无机物有机化合物——有机物烃类——碳氢化合物烷烃——饱和烃,例如甲烷、乙烷等芳烃——芳香烃,例如苯、甲苯等羧酸——有机酸,例如甲酸、醋酸等酚类——苯酚类有机高分子化合物——高分子化合物、高分子化学中,同样含义的化学用语很多,甚至许多化合物都有学名(化学用语)和若干个俗名,一般情况下没有区别,严格地说,学名指的是纯净物,而俗名则可以含有杂质。
二、有机物和有机化学有机物,最早认为只是在动植物体内存在,例如尿素等,没有人工合成的先例。
1828年,德国化学家维勒利用两种无机物为原料,人工合成了尿素,开启了人类认识有机物的先河。
有机化学,就是研究有机物的组成、结构、性质、制备方法和用途的科学。
研究有机化学,是为了人类的健康,是为了人类生活的环境更美好,为了生产、制造出更多有益于人类、有利于环境的物质。
一句话,学习有机物是为了美化人类的生活。
三、碳元素是构成有机物的基础说碳元素是构成有机物的基础,毫不为过。
化合物中含有碳元素,才可以称之为有机物。
碳元素,在人体中的含量比较多,仅次于氧元素,占第二位,氧、碳、氢、氮、钙。
烷烃

H H
CH 3 H · H CH3
(ac)
H H
H3C CH3
全重叠式(sp)
稳定性次序:ap > sc > ac > sp。
sp
E
ac 14.6kJ· mol-1
18.4~25.5kJ· mol-1 ac
sc
sc
·
ap
ap
·
60º
·
120º
·
180º
·
240º
·
300º
·
360º
0º
3.3~3.7kJ· mol-1
CH3CH2CH2CH2CH3
CH3CHCH2CH3
C5H12
CH3CH2CHCH3 CH3
CH3 CH3CCH3 CH3
CH3
同一物质
同分异构分为构造异构、构型异构和构象异构
构造:分子中原子互相连结的方式和次序。 碳架异构 官能团位置异构 官能团异构 互变异构 构型:在构造式的基础上,分子中原子的空间排列方式。
比直链异构体低,支链越多,沸点越低。
CH3
CH3CH2CH2CH2CH3 CH3CHCH2CH3 CH3CCH3
CH3
bp./ ℃ 36.1 27.9
CH3
9.5
原因:色散力只有在近距离内才能有效地作用。支链多 的分子接近球形,分子的接触面积小,而使分子间的引
力小于直链烷烃。
3
熔点mp.
直链烷烃的熔点随分子量的增加而升高,在含相同碳原 子数的烷烃异构体中,支链异构体的熔点比直链异构体低
C(sp3) H(1s) σ(sp3-1s)
+
C(sp3) C(sp3) σ(sp3-sp3)
有机溶剂分类

有机溶剂分类一、烃类溶剂1.烃只含有碳氢两种元素的有机化合物叫烃。
根据结构将烃类分为脂肪烃和芳香烃。
脂肪烃包括脂肪链烃和脂环烃。
开链结构的脂肪烃根据结构的饱和程度分为饱和链烃(烷烃)和不饱和链烃(烯烃和炔烃)。
芳香烃是含有苯环特殊结构的烃类。
根据具体结构分为单环芳烃、多环芳烃和稠环芳烃。
烃类溶剂根据来源分为两类:由石油分馏得到的烃类混合物溶剂叫石油溶剂油,简称溶剂油;由化工原料合成或精制得到的成分单一烃类溶剂是烃的纯溶剂。
纯溶剂价格较高,通常只用于一些特殊用途中。
2.溶剂油石油是由多种烃类组成的混合物,经过分馏处理得到不同沸点范围的产品。
根据沸,抿范围通常把石油产品分为石油醚、汽油、煤油、柴油、润滑油、石蜡和沥青。
其中沸点范围在30~90℃以戊烷和己烷为主要成分的石油醚和沸点范围在40~200℃烃分子含碳数在4~12的汽油,有很好的溶解性能。
在工业生产中常做溶剂使用,称为溶剂油或溶剂汽油。
近年来还开发出相当于煤油乃至轻柴油馏分做高沸点溶剂油,拓宽了溶剂油的概念。
煤油是石油分馏时,沸点在175~325℃范围的馏分,由于馏程长所包含的烃类成分复杂。
在一定情况下也可以做溶剂使用,如美国干洗业使用的干洗溶剂汽油(stoddard solvent)实际上是一种不易燃的煤油溶剂。
因此广义上溶剂油包括多种沸程范围的烃类混合物以及己烷、苯、甲苯、二甲苯纯烃类溶剂。
为了叙述上的方便,本书介绍的溶剂油是指由石油分馏得到的烃类混合物溶剂。
(1)溶剂油按沸程分类根据分馏过程的沸程,溶剂油大致分为三类:把沸程在100℃凋以下的称为低沸点溶剂油,如工业上的6号抽提溶剂油,沸程为60~90℃;把沸程在100~150℃的称为中沸点溶剂油,如橡胶溶剂油,沸程在80~120℃;把沸程高于150℃的称为高调沸点溶剂油,如油漆溶剂油,沸程为140—200℃,油墨溶剂油干点达360℃都属于高沸点溶剂油。
从沸程范围看,溶剂油大多数属于汽油馏分。
烃类化合物的定义和分类

烃类化合物的定义和分类烃类化合物定义:烃类化合物也就是烃,亦称碳氢化合物,是指只含碳氢两种元素的有机化合物,具体的物质例如甲烷、乙烷、乙烯、乙炔等。
烃类化合物的种类繁多,结构已知的有2000多种,主要包含烷烃、环烷烃、烯烃、炔烃、芳香烃。
按碳键连接方式分为链烃和环烃两类,前者碳原子连成链状。
按价键被氢原子饱和的程度又可分为饱和烃及不饱和烃两类。
饱和烃即烷烃,如甲烷、乙烷等;不饱和烃有烯烃及炔烃,典型的代表物是乙烯及乙炔。
环烃分子中碳键连成闭合的环,它包括脂环烃及芳香烃两种。
脂环烃与链烃有许多相似之处,一般环烷烃像烷烃,环烯烃、环炔烃分别像烯烃和炔烃。
芳香烃主要是指含有苯环结构的烃。
常见的烃有甲烷(沼气),丙烷和丁烷(打火机油),异辛烷,石蜡。
高级汽油常夸耀异辛烷值,此值与汽油在内燃机内燃烧时引起的震荡成反比。
聚乙烯的名字要注意,乙烯聚合后生成的是高分子烷(末端可能有其他基团)。
很多植物精油是烯类化合物所组成,如苎(limonene)是橙,柚等果皮挤出的油之主要成分,由松树压出的油含有两种异构蒎烯(pinene)与少量的他种单化合物,动物肝脏有制造鲨烯(squalene)的功能,它是胆固醇及一些性激素的中间体。
烃类化合物分类:烃类化合物的种类繁多,结构已知的有2000多种,主要包含烷烃、环烷烃、烯烃、炔烃、芳香烃。
按碳键连接方式分为链烃和环烃两类,前者碳原子连成链状。
按价键被氢原子饱和的程度又可分为饱和烃及不饱和烃两类。
饱和烃即烷烃,如甲烷、乙烷等;不饱和烃有烯烃及炔烃,典型的代表物是乙烯及乙炔。
环烃分子中碳键连成闭合的环,它包括脂环烃及芳香烃两种。
脂环烃与链烃有许多相似之处,一般环烷烃像烷烃,环烯烃、环炔烃分别像烯烃和炔烃。
芳香烃主要是指含有苯环结构的烃。
有机化学第2章烷烃

5 6 1 2 3 4
A B
2
甲基
4
乙基 戊烷
2, 4
二甲基己烷
最近原则:起点离支链最近 CH3—CH—CH2—CH2—CH2—CH3 CH3
1 2 3 4 5 6
A 5
甲基己烷
B 2
甲基己烷
最小原则:支链(取代基)所在位置的
数值之和要最小。即当两个 相同支链距离相等时,以支链多的一端开始
从一个交叉式变为另一个交叉式,分子必须克服12.6kJmol-1的能垒, 所以σ键的旋转并不是完全自由的,但常温下分子的动能已足使乙烷分 子的C-C键迅速旋转,由一个交叉式变为另一个交叉式,这种转变每秒 发生的次数高达1011次。温度越高,旋转越快,由于交叉式最稳定,所 以大部分时间以交叉式为主。接近绝对零度时乙烷为晶体,以交叉式为 基本存在形式
三、熔点
除甲烷外,熔点也随分子量的增加而又规律的增加。 含奇数碳原子和偶数碳原子的烷烃分别构成两条熔 点曲线,前上后下,随分子量的增加,逐渐趋近。 在晶体中,分子间的作用力不仅取决于分子的大小, 而且与分子在晶格中的排列情况有关,排列越紧密, 熔点越高,已证明,直链烷烃的碳链在晶体中的排 列状态为锯齿形,但偶数碳原子烷烃中两端的甲基 处于相反的位置,对称性好,排列紧密,色散力就 大,熔点也较高。
⊙思考:若出现同分异构体该怎样命名? 例如:戊烷的三种同分异构体
CH3–CH2–CH2 –CH2– CH3 CH3 CH3–CH–CH2 –CH3 CH3 CH3–C–CH3 CH3
正戊烷
异戊烷
新戊烷
⑶对于有同分异构体烷烃的命名: 通常以“正”、“异”、“新”表示。 ⊙思考:若同分异构体种类较多时该怎样命名?
大学基础化学知识点总结

大学基础化学知识点总结化学是一门研究物质的性质、组成、结构、变化规律以及与能量的关系的自然科学。
它是物理学的姊妹科学,而与生物学、地质学、环境科学等学科也有着密切的联系。
在大学化学教育中,我们将学习并掌握一系列的基础化学知识,这些知识将成为我们理解并解释自然界现象的基础。
因此,在本文中,我们将对一些大学基础化学知识点进行总结和概述,以便加深对这些知识点的理解和记忆。
一、化学元素与周期表1. 化学元素化学元素是构成物质的基本单位,是由相同类型的原子组成的。
每个元素都具有独特的原子序数和化学性质。
目前已知的元素共118种,其中92种是自然发现的,其他的是人工合成。
2. 周期表周期表是按照元素的原子序数排列的一张表格,它按照元素的化学性质将元素分类,从而便于人们理解和记忆。
周期表的布置是根据元素的原子序数、原子量以及其他一些性质进行的分类。
周期表的主要分区有主族元素、次族元素、过渡金属元素和稀土元素。
二、化学键1. 原子间相互作用原子间的相互作用是化学反应的基础。
原子之间通过化学键结合在一起,从而形成分子和化合物。
在化学键中,原子通过共价键、离子键或金属键相互结合。
2. 共价键共价键是一种通过原子间共享电子而形成的化学键。
通常,元素的原子通过共价键结合在一起形成分子,分子是化学反应的基本单位之一。
共价键的性质取决于原子间的电负性差异,电子的共享方式和键的长度。
3. 离子键离子键是一种通过正负离子间的静电作用而形成的化学键。
通常,金属原子会失去电子成为正离子,而非金属原子会得到电子成为负离子。
正负离子间的静电作用将它们结合在一起形成离子晶体。
4. 金属键金属键是一种通过自由电子在金属原子之间的弥散而形成的化学键。
金属原子之间的电子高度流动和活动,形成了一种自由电子气态,使金属具有典型的导电、热导和延展性等性质。
三、酸碱反应和溶液1. 酸碱理论酸碱理论是描述溶液中酸碱反应的理论。
按照质子转移的方式,酸碱理论包括了布朗斯特-劳里理论(质子转移)和刘易斯理论(电子对转移)。
有机物的分类

酚
-COOH
芳香烃
羧酸
练习 1.将下列化合物分别根据碳链和官能 团的不同进行分类。 OH H COOH
COOH
CH3OCH3 CH4
CH3 OH
2 、下列化合物不属于烃类的是 AB
A.NH4HCO3 C.C4H10 B.C2H4O2 D.C20H40
3.根据官能团的不同对下列有机物进行分类 CH3CH=CH2
CH 3 CH 2 CH 2 CH 3
CH 3 CH 2 CH 2 CH 2OH
正丁烷
正丁醇
2.环状化合物:这类化合物分子中含有 由碳原子组成的环状结构。它又可分为 三 类:
(1)脂环化合物:是一类性质和脂肪族 化合物相似的碳环化合物。如:
OH
环戊烷
环己醇
(2)芳香化合物:是分子中含有苯环的 化合物。如:
如:含羧基 -COOH的为羧酸, 含氰基-CN的为腈, 含氨基-NH2的为胺,……
例如: CH3 CH3 CH3 CH2 Cl
C2H5OH
CH3COOH CH3Cl、C2H5OH、CH3COOH 以上三者衍生物的性质各不相同 的原因是什么呢? —官能团不同
常见官能团
类别 饱和烃
烃 不饱和烃 烷烃 环烷烃 烯烃 炔烃 芳香烃 CH2=CH2 CH≡CH
—NO2
2 .下列有机物中,含有两种官能团的是:( C ) A、CH3—CH2—Cl B、 —Cl C、CH2===CHBr D、 H3C—
—NO2
【迁移.应用】
[问题7]判断下列两种有机物各有哪些官能团 并书写名称
(酚)羟基 氯原子 酯基
H
C
CH
CH
Cl CH
2020高考化学一轮复习学案(一)有机化合物的分类

2020高考化学一轮复习学案(一)有机化合物的分类一、按碳的骨架分:链状化合物(即脂肪烃):CH3CH2CH2CH31.有机化合物脂环化合物Eg:环状化合物芳香化合物Eg2.烃:链烃(脂肪烃),环烃(脂环烃),芳香烃。
饱和烃,不饱和烃。
饱和链烃(烷烃、石蜡烃),不饱和链烃。
单环芳烃,多环芳烃,稠环芳烃。
基:烃基,烷基(甲基、乙基、正丙基、异丙基),苯基;羟基、硝基、磺酸基。
同系物,同系列,系差。
原油,蒸馏,分馏,干馏,裂化,裂解,催化重整;馏分,直馏汽油,裂化汽油,裂化气;辛烷值。
磺化剂,芳香性。
一种命名法:系统命名法。
二种求气态有机物分子量的方法:密度法、相对密度法。
三大资源:石油、天然气、煤。
三种工业生产方法的演示:石油分馏、裂化、煤干馏。
三种同分异构:碳链异构、位置异构、种类异构。
四种代表物质:甲烷、乙烯、乙炔、苯。
五类有机反应:取代(卤代、硝化、磺化)、加成、氧化(氧化剂氧化、燃烧)、高温分解(裂化、裂解)、加聚。
五种表示有机物的化学式:分子式、最简式、结构式、结构简式、电子式。
五种物质的制备:甲烷、乙烯、乙炔、溴苯、硝基苯。
五种求气态有机物的分子式:分子组成法、最简式法、燃烧方程式法、通式法、试探法。
六种烃:烷烃、烯烃、炔烃、苯系芳烃、二烯烃、环烷烃。
3、烃分子的空间构型(1).基本模型:甲烷(CH4)分子的正四面体结构:与中心碳原子相连的4个氢原子中,只能有2个氢原子与碳原子共面。
乙烯(CH2=CH2)分子的6个原子和苯(C6H6)分子的12个原子共平面结构。
乙炔(CH≡CH)分子的直线型结构,4个原子在一条直线上(如下图)。
(2)、基本方法:烃分子里,碳碳单键可以旋转。
形成双键和三键的原子不能绕轴旋转。
苯分子中苯环可以绕任一碳氢键为轴旋转,每个苯分子有三个旋转轴,轴上有四个原子共直线。
稠环芳香烃由于共用碳碳键,所以原子共平面。
二、按光能团分类。
类别通式官能团代表物分子结构结点主要化学性质烷烃C n H2n+2(n≥1)————CH4(Mr:16)由C、H构成,成SP3杂化。
氢和碳形成的化合物

氢和碳形成的化合物
氢和碳是一种常见的元素,它们之间可以形成许多特殊的化合物。
氢和碳的结合称为烷基化合物。
烷基化合物的化学特征由氢原子和碳原子构成的共价键中的极性确定,这种极性是一种衡量氢原子中有电荷且带有疏水性的方法。
由于氢原子存在有电荷,它周围容易形成一层氢键。
这导致氢原子和碳原子间的共价键变得疏松,助长了烷基化合物溶液笨油的形成。
烷基化合物具有独特的电路特性,并衍生出许多化学反应,这些反应引发了许多实用的产物,其中包括医药,润滑剂,塑料等。
烷基化合物的另一个特殊的性质是它们的共价碳链可以导致多种类型的环状结构,这些环状结构可以有助于重要的生化反应和物质的转化。
烷基化合物因其以上的特性和合成的多样性而为化学研究及其应用做出了非常重要的贡献,因此在探索化学反应及其作用机制方面,研究烷基化合物将给我们带来益处。
分子中只含有碳和氢两种元素的有机化合物汇总

CH3 CH2CH2CH2CH3 正戊烷
H3C H C CH3 CH2CH3
CH3 CH2CH2CH3
3 H3C 2 H C 1 CH3
C-1或C-3上H被 –CH3取代
异戊烷
CH3
C-2上H被 –CH3取代
CH3
H3C
C CH3
CH3
新戊烷
烷烃分子中,随着碳原子数的增加,构造异构体数目增多。
构造异构体的物理性质都不同。一般,直链烷烃的沸点要比
烷基的类型:
1)正烷基(n-):通式 CH3( CH2)nCH2-,如CH3CH2-,CH3CH2CH2-
2)仲烷基(sec-) :通式 CH3(CH2)n CH
H3C
3)叔烷基(t-或tert-):通式
CH3(CH2)n
C CH3
CH3
4)异烷基(iso-) :通式 CH3CH(CH2)n
中文名称中用得不多
H C CH3
被-CH3取 代
中间碳上氢原子 被-CH3取 代
H3C
CH3
异丁烷 (b.p. :-11.7oC; m.p. :-159.43oC)
——分子式相同,因分子中各原子的连接次序不同, 即构造不同而形成的同分异构体,又互为构造异构体。
(2)烷烃的构造异构
4 3 2 1
C-1或C-4上H被 –CH3取代 C-2或C-3上H被 –CH3取代
(B)编号——从最接近取代基的一端开始,将主链碳原 子用阿拉伯数字编号。
2 1 7 8
CH2CH3 CH3 CHCH2CHCH2CH3 CH2CH2CH3
6 7 8
CH2CH3
5
6 5 4
3
4
CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章只含有碳氢两种元素的化合物,称为碳氢化合物,简称烃。
烃是一类非常重要的有机化合物,广泛存在于自然界中,如石油和煤中就存有大量的烃类物质。
烃是有机化合物的“母体”其它各类有机化合物可视为它的衍生物。
根据烃分子中的碳架呈链状或环状,可以把烃分为链烃和环烃表9 - 1 烃的分类第一节甲烷。
r 饱和烃(烷烃)例如:H3C-CH2-CH3J烯烃例如:HH3C—C=CH2 1不饱和烃h炔烃例如: HC 三CH ”脂环烃例如:0 0芳香烃例如:0 00链烃环烃两大类。
链烃又叫脂肪烃,它又分为饱和烃和不饱和烃。
分子中碳原子间都以单键相连结,碳原子的其余价键都与氢原子结合,这样的开链烃称为饱和链烃,简称烷烃。
最简单的烷烃是一、甲烷的分子结构甲烷由一个碳原子和四个氢原子组成,分子式为CH 4,甲烷的电子式和结构式为:H * ■+ H 丨 C i HH上述甲烷分子的结构式并不能反映出甲烷分子的立体构型。
经物理实验方法证明,甲烷的四个C — H 键键长相等,都是1.09 X 10-10 m,四个键角相同,都是109。
28 '。
据此甲烷应是一个正四面体结构 的分子,碳原子位于正四面体的中心,四个价键伸向正四面体的四 个顶角,与四个氢原子结合。
(见图怎样解释甲烷分子的立体结构呢?(一) 碳原子的sp 3杂化H ——C —H(a )正四面体模型 (b) 凯库勒模型(c )斯陶特模型甲烷的空间结构模型图9 — 1鲍林等人提出了原子轨道杂化理论,该理论认为,形成甲烷分 子时,碳原子的一个2s 电子吸收能量激发到2p z 轨道上,形成四个 单电子轨道,碳原子从基态变为激发态,激发后,碳原子就可以形 成四个共价键,但实验证明,甲烷分子的四个碳氢键是完全相同的。
为了解决这一矛盾,鲍林等人进一步提出了原子轨道的杂化,即碳 原子的1个2s 轨道、3个2p 轨道重新组合形成四个能量相等的新 轨道,这个过程叫做原子轨道的杂化。
这种由1s 轨道和3个P 轨道 参加的杂化,叫sp 3杂化,形成的新轨道叫sp 3杂化轨道。
每个sp 3 杂化轨道均含有1/4S 轨道成分和3/4p 轨道成分,sp 3杂化轨道的形 状既不是S 轨道的球形,也不是P 轨道的哑铃形,而是一头大一头 小的不对称的葫芦形,这样更有利于形成共价键时的轨道最大重叠(图9 — 2 )。
四个sp 3杂化轨道以碳原子为中心,大头伸向正四面体 的四个顶点,四个sp 3杂化轨道之间夹角为109。
28 ‘ ,这样排布使 四个sp 3杂化轨道尽可能彼此远离,电子云之间相互斥力最小,体 系最稳定,因此甲烷具有正四面体的空间结构。
曲LLlIUd 苗11山11朶化.帀寸币1(二) 键甲烷分子中的C — H 键是由氢原子的1s 轨道,沿着碳原子sp 3图9 一 2 碳原子的sp3杂化子价层电子坦恋)(i )(4 tsp-fr ft轨诅)闿iEt 护ilM 卵愉杂化轨道对称轴方向正面重叠“头碰头”重叠)而成,这种共价键 的成键电子云围绕两个成键原子的键轴对称分布,称为e 键。
e 键 的特点是电子云对键轴呈圆柱形对称分布,成键两原子可以围绕键 轴相对旋转而不影响电子云的分布和改变键的强度。
所以,e 键是 种比较稳定的共价键。
其它烷烃分子中所有的碳原子都是以sp 3杂化轨道形成C — C e 键和C — H c 键(图9 — 3),例如乙烷分子中有六个C — H e 键和一个 C — C e 键,彼此键角均为109。
28图9 — 3 烷烃分子中的e 键由于烷烃分子的键角基本保持109。
28 ',因此碳链的立体形状不是直线型,而呈锯齿状。
例如已烷的碳链可表示为:二、烷烃的同系列和同分异构现象(一)同系列烷烃中最简单的是甲烷,分子式是CH ,随碳原子数逐渐递增, 可以得到一系列的烷烃:CH 3CH 2CH 2CH 3CH 2CH 2C —Ho 熠C —丁烷 C 4H I 0:CH 3CH 2CH 2CH 3CH 3以上的一系列烷烃中,相邻的两个化合物之间的组成差CH , 称为同系差。
在有机化合物中,把结构相似、在分子组成上相差1 个或几个CH 原子团的一系列化合物称为同系列。
同系列中的化合 物互称为同系物。
烷烃分子随着碳原子数的增加,碳链增长,氢原子数也随之增 多。
如果碳原子数目是n ,则氢原子数目是2n+2,所以烷烃的组成通 式可用C n H 2n + 2表示。
有了通式,只要知道烷烃分子中所含碳原子的 数目,就能写出它的分子式。
(二)烷烃的同分异构现象有机物的同分异构现象非常普遍,烷烃的同分异构现象主要有 碳链异构和构象异构,本章只讨论碳链异构。
碳链异构是指由于碳 原子结合的顺序不同,从而产生直链的和带支链的异构体的异构现 象。
烷烃中除甲烷、乙烷、丙烷没有碳链异构现象外,其余烷烃都 有碳链异构,例如丁烷有两种,戊烷有三种异构体。
CH 3一CH ——CHs分子式:甲烷 乙烷 CH 4 C 2H 6 丙烷 C 3H 8 丁烷 戊烷C 4 H l 0C 5 H I 2正丁烷 异丁烷随着烷烃分子碳原子数的增加,异构体的数目迅速增多。
例如已烷有5种,庚烷有9种,辛烷有18种,癸烷有75种之多。
(三)碳原子的类型观察烷烃异构体的结构式,可以发现碳原子在碳链中所处的地 位并不相同,为加以识别,通常把碳原子分为四类:伯碳原子:只与一个碳原子直接相连的碳原子,又称一级碳原 子,用1表示。
仲碳原子:与两个碳原子直接相连的碳原子,又称二级碳原子, 用2表示。
戊烷C 5H 12:CH 3CH 3CH 2CH 2CH 2CH 3CH 3CHCH 2CH 3CH 3C ——CH 3正戊烷CH 3CH 3异戊烷新戊烷叔碳原子:与三个碳原子直接相连的碳原子,又称三级碳原子,3表示。
季碳原子:与四个碳原子直接相连的碳原子,又称四级碳原子,4。
表示。
例如下列烷烃结构中的各类碳原子:1 ° CH 31 ° 4° CH3—C — C H2 4°CH 3 1° CHCH 33°连接在伯、仲、叔碳上的氢原子分别叫做伯(1。
)、仲(2。
)、 (3。
)氢原子。
四种碳和三种氢原子所处的环境不同,反应性能也有差异。
三、烷烃的命名有机化合物的种类繁多,掌握有机化合物的命名法是学习有机 化学的一项基本任务。
正确的名称不仅能反映出有机物的组成,还能反映出其分子结构。
烷烃的命名法有两种,即普通命名法和系统 命名法。
(一)普通命名法普通命名法又称习惯命名法,只适用于结构比较简单的烷烃,命名原则如下:1、按分子中碳原子数目称为“某烷”,对含有1〜10个碳原子的烷烃,采用天干(甲乙、丙、丁、戊、己、庚、辛、壬、癸)命名,从含有11个碳原子以上的烷烃,用中文数字命名。
例如:CH4甲烷C4H10 丁烷C10H22 癸烷C13H28 十三烷2、为区别异构体,常用“正”、“异”、“新”来区别,不含支链的烷烃叫“正”某烷,若在碳链一端含有特定结构(异丙基)的烷烃叫“异”某烷,若在碳链一端含有特定结构(叔丁基)的烷烃叫“新”某烷。
例如:戊烷的三个异构体的习惯命名法。
CH3 CH 3CH 2CH 2CH 2CH 3 CH 3CHCH 2CH 3 CH 3——C ——CH3CH3 CH3正戊烷异戊烷新戊烷(二)系统命名法系统命名法是根据国际纯粹与应用化学联合会(IUP AC)制定的命名原则,结合我国文字特点而制定的。
要学习系统命名法,首先要了解烷基的概念,烷烃分子去掉个氢原子剩余的部分称为烷基,通式为C n H2n+1 -,常用R—表示。
常见的烷基有:CH 3 — 甲基 CHCH — 乙基 CH 3CH 2CI4 —正丙基3H C — C — CCH 3CH —CH 2CH 3CH 3H 3C — g —CH 3CH 31、选择最长的碳链作为主链,按主链所含碳原子数称为“某烷”;2、把支链作为取代基,从靠近取代基的一端开始用阿拉伯数 字给主链碳原子编号,确定取代基的位置;3、把取代基的名称写在“某烷”之前,把取代基的位置写在取代基的名称和数目的前面,中间用短线隔开;如果有相同的取代 基则合并写,并在取代基前用二、三、四等注明相同取代基的数目;CH 3CH 3CH 2CH 2CH 2—正丁基CH 3CH 2CHCH 3仲丁基H s C、CH —H 3C 一 异丙基CH 3CH 2CHCH 2CH 2CH 3CH 2CH 3出“卡―CH 2CH 3CH 3CH 3CHCH 2CHCH 2CH 3CH 3 CH 33 —乙基已烷2, 2 —二甲基丁烷2, 4 —二甲基已烷5、若主链上有几个不同的取代基,应把小的基团写在前面,把 大的基团写在后面;所谓大小“顺序规则”主要是比较原子序数, 原子序数大的原子叫较大基团,例如:—I > — Br > — Cl > — SH > — OH > — NH 3 > — CH 3 > — H烷基的优先顺序:异丙基>异丁基>丁基>丙基>乙基>甲基例如:CH 2CH 3 I HH 3C —CH —C —C -------- C —CH 3H 2 I ICH 3 CH 32, 3,5 —三甲基一3 —乙基已烷四、烷烃的性质(一)物理性质物理性质主要是指化合物存在的状态、颜色、气味、密度、溶解度、熔点、沸点和折光率等。
纯净的物质在一定条件下有固定的 密度、溶解度、熔2,2,3 —三甲基戊烷 2,2 —二甲基丙烷CH 3CH3 —甲基CHCH —乙基CH3CH2CI4 —正丙基点、沸点和折光率等物理性质,称为物理常数,物理常数对有机化合物的鉴定、分离、纯化具有重要意义。
例如戊3 烷在常温常压下沸点为36.1 r、熔点—129 r、密度0.6264g cm ,折光率(n D20)1.3575 o在常温常压下,C1〜C4的直链烷烃是气体;C5~C6是液体;C17以上是固体。
它们的沸点和熔点随碳原子数目的增加而升高,同系物之间,每增加一个CH2,沸点约升高20〜30 r 0例如戊烷C5H12在同分异构体中沸点随支链的增多而降低。
原因是分子中的支链,阻碍分子之间的紧密排列,减弱分子间的引力,从而降低了沸点。
例如:正戊烷沸36.1 r沸点36.1 C ,已烷C6H14沸点68.7 C。
此外,异戊烷沸点25 r,新戊烷沸点9 r 0烷烃的密度都小于1g cm-3,因此比水轻,属非极性化合物,不溶于极性的水,而溶于有机溶剂,服从“相似相溶”规贝Uo(二)化学性质1、稳定性由于烷烃的结构都与甲烷相似,分子中各个原子间都以C键相结合,C键比较牢固,因而烷烃的化学性质比较稳定,通常不与强酸、强碱、强氧化剂作用。
