以物质的量为中心的计算共26页文档
高中化学 以物质的量为中心的化学计算

专题2以物质的量为中心的化学计算考点一阿伏加德罗常数及其应用【考必备·清单】1.明确以物质的量为核心的各个化学计量之间的关系2.突破阿伏加德罗常数命题的“五大陷阱”陷阱一:注意“标准状况”“常温常压”等外界条件(1)在标准状况下非气态物质如H2O、SO3、戊烷、CHCl3、HF、NO2、苯等;(2)物质的质量、摩尔质量、微粒个数不受外界条件的影响。
陷阱二:注意物质的组成和结构(1)特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、H37Cl;(2)物质中所含化学键的数目,如CO2、C n H2n+2等;(3)最简式相同的物质中的微粒数目,如NO2和N2O4、乙烯和丙烯、O2和O3等;(4)摩尔质量相同的物质中的微粒数目,如N2、CO、C2H4等。
陷阱三:注意氧化还原反应中电子转移数目的判断(1)同一种物质在不同反应中氧化剂、还原剂的判断;如Cl2和Fe、Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂。
Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2或NO等反应,Na2O2只作氧化剂。
(2)量不同,所表现的化合价不同。
如Fe和HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+。
(3)氧化剂或还原剂不同,所表现的化合价不同。
如Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。
(4)注意氧化还原的顺序。
如向FeI 2溶液中通入Cl 2,Cl 2首先氧化I -,再氧化Fe 2+。
陷阱四:注意电解质溶液中粒子数目的判断(1)是否存在弱电解质的电离或盐类的水解。
(2)已知浓度,是否指明体积,用好公式n =cV 。
(3)在判断溶液中微粒总数时,是否忽视溶剂水。
陷阱五:注意一些可逆反应、特殊反应(1)2SO 2+O 2催化剂△2SO 3,2NO 2N 2O 4,N 2+3H 2高温、高压催化剂2NH 3。
有关物质的量计算
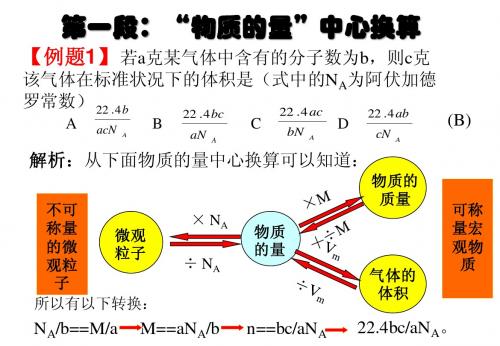
【例题2】在25OC时,硫酸铜的溶解度为 g,把S g无水硫 例题 】 时 硫酸铜的溶解度为S 把 无水硫 硫酸铜的溶解度为
酸铜加入到(100+S)g饱和硫酸铜溶液中 得到一定量的蓝色 饱和硫酸铜溶液中,得到一定量的蓝色 酸铜加入到 饱和硫酸铜溶液中 晶体.若将这些蓝色晶体溶于水制成饱和溶液 需要加水的 晶体 若将这些蓝色晶体溶于水制成饱和溶液,需要加水的 若将这些蓝色晶体溶于水制成饱和溶液 质量是 A. (100-9/25S)g B. (100-16/25S)g C. (100+S) g D. 100 g
问题阶梯
问题1:浓度为25%的1g氨水 (ρ=0.91g·cm-1 )与1g纯水混合后,所 得溶液的质量分数为 A.等于12.5% B.大于 12.5% C.小于 12.5% D.无法确定 问题3:把 70% HNO3(密度为 1.40 g·cm-3)加到等质量的水中,稀释后 HNO3溶液的质量分数是 A.0.35 B.<0.35 C.>0.35 D.≤0.35
的稀硫酸慢慢加入一定量的BaCl2溶 【例题3】 将PH=1的稀硫酸慢慢加入一定量的 例题 】 的稀硫酸慢慢加入一定量的
的饱和溶液VmL,密度为 g/cm-3, 密度为d 【例题4】物质 2SO4的饱和溶液 例题 】物质A 密度为
C(A+)=Pmol/L,溶液的溶质质量分数为 溶液的溶质质量分数为a%,溶质的式量为 溶液的溶质质量分数为 溶质的式量为 M,溶解度为 g,下列表示式正确的是 溶解度为S 下列表示式正确的是 溶解度为 A. P=2000da/M B. d/(100+S)=PM/2000 C. d×a%=PM/1000 D. a%=PM/2000d ×
【例题2】三个容器中分别盛有 2、CH4、O2,已知三 例题 】三个容器中分别盛有H
2013-2014学年高中化学《第二节 化学计量在实验中的应用》 以物质的量为中心的计算知识总结 新人教版必修1
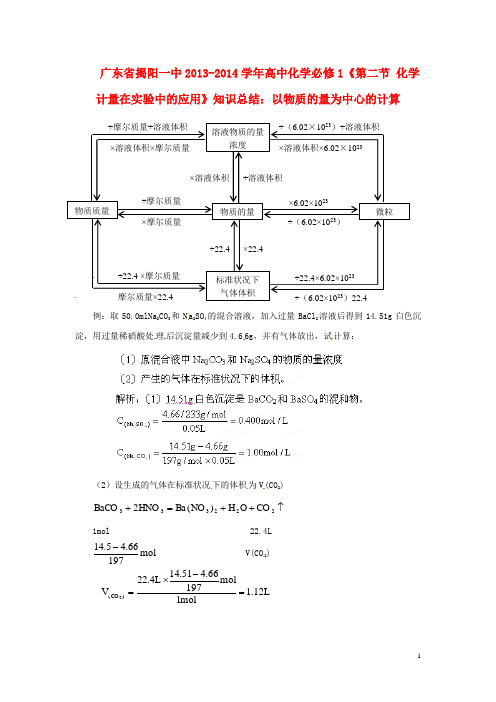
(2)设生成的气体在标准状况 下的体积 为 V (CO2)
BaCO3 2HNO3 Ba(NO3 ) 2 H 2 O CO 2
1mol 22.4L V(CO 2)
14 .5 4.66 mol 197
V( CO 2 )
22.4L
14.51 4.66 mol 197 1.12L 1mol
1
答案: ( 1)原混合液中 Na2CO3、Na2CO3 的物质的量浓度为 0. 400mo l/L,1.00mol/L; (2) 产生气体为 1.12L。
2
物质质量
物质的量 × 摩尔质量 ÷ 22.4 ÷ 22.4 × 摩尔质量 摩尔质量× 22.4 × 22.4
微粒
标准状况下 气体体积
÷ 22.4× 6.02× 1023 ÷ (6.02× 1023)22.4
例:取 50.0mlNa2CO3 和 N a2SO4 的混合溶液,加入过量 BaCl2 溶液后得到 14.51g 白色沉 淀,用过量稀硝酸处 理 后沉淀量减少到 4.6 6g,并有气体放出,试 计算:
广东省揭阳一中 2013-2014 学年高中化学必修 1《第二节 化学 计量在实验中的应用》知识总结:以物质的量为中心的计算
÷ 摩尔质量÷ 溶液体积 × 溶液体积× 摩尔质量 溶液物质的量 浓度 ÷ (6.02×1023)÷ 溶液体积 × 溶液体积× 6.02×1023
× 溶液体积 ÷ 摩尔质量 Nhomakorabea÷ 溶液体积 × 6.02× 1023 ÷ (6.02× 1023)
微题型10 以物质的量为中心的计算(解析版)

微题型10 以物质的量为中心的计算时间:30分钟 1.下列各组物质中含氧原子的物质的量相同的是A .9.6 g O 2和5.4 g H 2OB .0.1 mol H 2SO 4和3.6 g H 2OC .0.1 mol MgSO 4·7H 2O 和0.1 mol C 12H 22O 11(蔗糖)D .6.02×1023个CO 2与0.1 mol KMnO 4【答案】C【详解】A .n(O)分别为0.6 mol 和0.3 mol ,错误;B .0.1 mol H 2SO 4中,n(O)=0.4 mol ,3.6 g H 2O 中n(O)= 3.6g 18g/mol×1=0.2 mol ,错误; C .0.1 mol MgSO 4·7H 2O 中,n(O)为1.1 mol ,0.1 mol C 12H 22O 11中,n(O)也为1.1 mol ,正确;D .6.02×1023个CO 2中,n(O)=23A 6.0210N ×2=2 mol , 0.1 mol KMnO 4中n(O)=0.4 mol ,D 错误。
故选C 。
2.下列说法正确的是A .同温同压下,N 2和CO 2的密度相同B .质量相同的H 2O 和CO 2所含的原子数相同C .物质的量相同的CH 3CH 2OH 和CH 3CHO 所含共价键数相同D .室温下,pH 相同的盐酸和硝酸中,溶质的物质的量浓度相同【答案】D【详解】A .同温同压下,N 2和CO 2的体积相同时,物质的量相同,其质量之比为28∶44,则密度之比为28∶44,不相同,A 说法错误;B .质量相同的H 2O 和CO 2的物质的量之比为44∶18,分子中均含有3个原子,则所含的原子数之比为44∶18,不相同,B 说法错误;C .CH 3CH 2OH 分子中含共价键数为8条,CH 3CHO 分子中含共价键数为7条,则物质的量相同的CH 3CH 2OH 和CH 3CHO 所含共价键数不相同,C 说法错误;D .室温下,pH 相同的盐酸和硝酸中,氢离子的浓度相等,硝酸和盐酸均是一元强酸,能完全电离出一个H +,故pH 相同的盐酸和硝酸的物质的量浓度相同,D 说法正确; 故答案选D 。
专题4 以物质的量为中心的化学计算的解题方法(专题突破)化学高一上学期人教版(2019)必修第一册

专题4 以物质的量为中心的化学计算的解题方法第一部分知识梳理一、物质的量的单位——摩尔1.物质的量(1)概念:表示含有一定数目粒子的集合体的基本物理量。
(2)符号及单位:符号为n,单位为摩尔。
2.摩尔3.阿伏加德罗常数二、摩尔质量【点拨提升】物质的量——“四化”1.(2021·江苏·涟水县第一中学高一月考)下列说法中正确的是 A .摩尔是表示物质质量的单位B .物质的量适用于计量分子、原子、离子等粒子的集合体C .摩尔是表示物质所含微粒个数的物理量D .物质的量就是指物质的质量 【答案】B 【详解】A .摩尔是物质的量的单位,A 错误;B .物质的量是表示一定数目粒子的集合体的物理量,适用于计量分子、原子、离子等粒子的集合体,B 正确;C .摩尔是物质的量的单位,不是物理量,C 错误;D .物质的量是表示一定数目粒子的集合体的物理量,不是物质的质量,D 错误; 选B 。
2.(2021·黑龙江·佳木斯一中高一期中)下列关于摩尔质量的说法正确的是 A .2mol 2CO 的摩尔质是1mol 2CO 摩尔质量的2倍B .任何物质的摩尔质量都等于它的相对分子质或相对原子质量C .某1个原子的质量是a g ,则该原子的摩尔质量是a A N g/molD .硫酸的摩尔质量是98g 【答案】C 【详解】A .摩尔质量和物质的量无关,故A 错误;B .摩尔质量和相对分子质量或相对原子质量在数值上相同,而不是相等,故B 错误;C .1个原子的物质的量A AN 1n=mol N N ,摩尔质量A Am agM===aN g/mol 1n mol N ,故C 正确; D .摩尔质量的单位为g/mol ,硫酸的摩尔质量是98g/mol ,故D 错误; 故选C 。
【变式训练】1.(2021·山东·鄄城县实验中学高一月考)下列叙述错误的是 ①摩尔是国际单位制中的七个基本物理量之一 ②1 mol 任何物质都含有约6.02×1023个粒子 ③6.02×1023就是阿伏伽德罗常数 ④1 mol 氢原子就是一个氢原子 ⑤1 mol CO 2中含1 mol 碳和2 mol 氧 A .①②③ B .②③④C .②③④⑤D .①②③④⑤【答案】D 【详解】①摩尔是物质的量的单位,不是基本物理量,①错误;②1 mol 任何物质都含有约6.02×1023个组成物质的基本粒子,由于未指明是组成物质的基本微粒,因此该说法不合理,②错误;③6.02×1023是阿伏伽德罗常数的数值,阿伏伽德罗常数为6.02×1023mol -1,③错误; ④1 mol 氢原子是阿伏伽德罗常数个氢原子,④错误;⑤1 mol CO 2分子中含1 mol 碳和2 mol 氧原子,未指明是O 元素的原子,因此该说法不合理,⑤错误;综上所述可知:上述五种说法均错误; 故合理选项是D 。
以物质的量为中心的计算

《以物质的量为中心的有关计算》学案【学习目标】1.了解物质的量的单位——摩尔(mol )、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。
2.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.掌握有关溶液中溶质的物质的量浓度,质量百分比浓度,溶解度的计算,以及它们之间的联系。
一、基础知识回顾1.注意:(1)“一个中心”:必须以物质的量为中心; (2)“两个前提”:在应用Vm=22.4L/mol 时,一定要以“标准状况”和“气体状态”为两个前提条件(混合气体也适用)。
2.阿伏伽德罗定律:同温同压下,相同体积的任何气体具有相同的粒子数。
万能公式:PV=nRT 【例一】铅笔芯的主要成分是石墨和黏土。
如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1 mg 。
那么一个铅笔字含有的碳原子数约为_________________个。
变式1:若50滴水正好是m mL ,则1滴水所含的分子数是_____________。
【例二】已知a g 某气体所含分子数为b ,则该气体的摩尔质量为_______,c g 该气体在标准状况下的体积为___________。
变式2: 有一真空瓶质量为m 1,该瓶充入空气后的质量为m 2,在相同状况下,若改为充入某气体A 时,总质量为m 3。
则A 的相对分子质量是__________。
(已知空气的相对分子质量是29)【例三】根据阿伏伽德罗定律,可以得出:(1)同温同压下两种气体的体积之比与摩尔质量之比成____比;(正/反,下同)(2)同温同压下两种气体的物质的量之比与密度之比成____比;(3)同温同压下两种气体的摩尔质量之比与密度之比成____比;变式3:在标准状况下,m g 气体A 与n g 气体B 的分子数相同,下列说法中不正确的是( )A.气体A 与气体B 的相对分子质量之比为m :nB.等质量气体A 与气体B 的分子数之比为n :mC.同温同压下,气体A 与气体B 的密度之比为n :mD.相同状况下,等体积的气体A 与气体B 的质量之比为m :n练习:1、同温同压下,等质量的CO 2和SO 2两种气体相比较,下列叙述正确的是( )A.密度比: 11:16B.体积比: 16 :11C.体积比: 1 :1 D 密度比: 16:112、在标准状况下,112ml 某气体体的质量为0.17g ,该气体可能是 ( )A. O 2B. N 2C. H 2SD. CO 23、标准状况下有①6.72LCH 4②3.01×1023个HCl ③13.6gH 2S ④0.2molNH 3,下列对四种气体的关系从小到大表示不正确的是 ( )A.体积 ④<①<②<③B.密度 ①<④<③<②×V m ÷V m ÷N A ×N A ×M ÷M ×V ÷V 物质的量 n (mol ) 物质的质量m(g) 物质的粒子数N (分子、原子、离子、电子等) 气体体积(标况)V (L ) 物质的量浓度C (mol/L)C.质量 ④<①<③<②D.氢原子数 ④<②<③<①4、标准状况下mg 气体A 和ngB 气体的分子数相同,下列说法不正确的 ( )A.A 与B 的相对分子质量之比为m:nB.同温同压下,两气体A 与B 的密度之比为n:mC.同质量的A 与B 分子个数之比为n:mD.相同状况下,同体积的气体A 与B 质量比为m:n5、同一状态下,20molA 2气体与30molB 2气体恰好完全反应生成20mol 某气体X,则可推出X 的化学式为 ( )A.AB 2B.AB 3C.A 2B 3D.A 3B 2二、一定物质的量浓度溶液的配制1、实验仪器2、实验步骤3、误差分析三、有关溶液的计算1、基本公式的相互转化2、稀释定律3、离子浓度的相关计算例1、500mL 0.2mol/L 的Ba(NO 3)2溶液中:Ba 2+的浓度为 ;NO 3-离子的浓度为 ;溶液中阴阳离子总数为 .变式1、下列各溶液中,Cl —浓度最大的是:( )A.3mol/L 的NaClB.2mol/L 的CaCl 2C.1mol/L 的FeCl 3D.1.5mol/L 的AlCl 3变式2、下列溶液中Na +的物质的量浓度最大的是( )A 、100mL 1mol/L 的NaCl 溶液B 、100mL 1mol/L 的Na 2SO 4溶液C 、100mL 0.5mol/L 的Na 3PO 4溶液D 、400mL 0.5mol/L 的Na 2SO 4溶液4、溶解度、质量分数、物质的量浓度的相互换算例2、某市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm 3。
第2讲物质的量及化学基本计算
D项,
正确。
m (a b) g 1 000 ( a b) g/L ,因此只有选项C 3 V V 10 L V
答案 C
考点四
一定物质的量浓度的溶液的配制及误差 分析
【例4】 实验室配制500 mL 0.5 mol/L的NaCl溶 ①把称量的NaCl晶体放入小烧杯中, ②把①所得溶液小心转入500 mL容 ③继续向容量瓶中加蒸馏水至液面距刻度2~3 cm 处,改用胶头滴管小心滴加蒸馏水至溶液凹液面
(填“偏高”、“偏低”或
(5)若实验过程中出现如下情况应如何处理?加蒸
馏水时不慎超过了刻度 面 取。(3)根据c=
n ,V偏小,c V
。向容量 。
瓶中转移溶液时(操作步骤②)溶液流到容量瓶外
解析 (2)为防止仪器的遗漏,可根据步骤进行选
(4)加蒸馏水超过刻度,V偏大,c偏低这种情况
下配制的溶液浓度不是0.5 mol/L,因此要重配。 答案 (1)①②④③⑤ (2)500 mL容量瓶、托盘天
有关阿伏加德罗常数的应用问题,实质上是以 物质的量为中心的各物理量间的换算,需要特别注 1.状态问题,如标准状况下SO3为固态,戊烷为
液态。标准状况下的气体适用气体摩尔体积
(22.4 L/mol),相同状况下的气体适用阿伏加德罗 2.特殊物质的摩尔质量,如D2O、18O2 3.物质分子中的原子个数,如O3、白磷、稀有气 4.某些物质中的化学键,如SiO2、P4、CO2等。
24
如加入足量强碱并加热可得到c mol NH3,则原溶液
中的Al3+离子浓度(mol/L)为
2b c A. 2a
(
D. 2b c
6a
)
B. 2b c
2019-2020版高考化学二轮教师用书第1部分 专题1 第2讲 阿伏加德罗常数 Word版含答案

第2讲 阿伏加德罗常数(对应学生用书第5页)■储知识——剖解重点难点备考·1.四个关键问题六大突破点阿伏加德罗常数应用的2. 求算N (微粒数)的基本思路:气体摩尔体积的适用条件1突破点 (1)角度:从V m =22.4 L·mol -1的适用条件和物质的状态突破。
(2)突破方法:一看气体是否处在“标准状况(0 ℃、101 kPa)”;二看标准状况下,物质是否为气态(如CCl 4、CHCl 3、CH 2Cl 2、H 2O 、溴、SO 3、己烷、HF 、苯、乙醇等在标准状况下均不为气态)。
与物质所处状况)或质量(物质的量 2突破点 (1)角度:设置与计算无关的一些干扰条件,给出非标准状况下气体的物质的量或质量,干扰正确判断。
(2)突破方法:排“干扰”,明确物质的量或质量与物质所处状况无关,物质的量或质量确定时,物质所含的粒子数与温度、压强等外界条件无关。
物质的组成与结构3突破点 (1)角度:从特殊物质的组成与结构特点突破。
(2)突破方法:①熟记特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目,常考查的特殊物质(如Ne 、D 2O 、18O 2、O 3、P 4、H 37Cl 、—OH 、OH -等)。
②记住最简式相同的物质,明确微粒数目特点(如NO 2和N 2O 4、乙烯和丙烯、O 2和O 3等)。
③记住物质中所含化学键的数目(如1 mol 硅中含Si —Si 键的数目为2N A,1 mol SiO 2中含Si —O 键的数目为4N A ,再如H 2O 2、C n H 2n +2中化学键的数目分别为3、3n +1等)。
④记住摩尔质量相同的物质(如N 2、CO 、C 2H 4等)。
电解质溶液中粒子数目4突破点 (1)角度:难电离、易水解的粒子的数目计算以及电解质组成、溶液体积等因素上突破。
(2)突破方法:细审题、抓“三看”:一看是否指明溶液的体积;二看是否有弱电解质或可水解的弱酸根离子(或弱碱阳离子),如1 L 0.1 mol·L -1的乙酸溶液和1 L 0.1 mol·L -1的乙酸钠溶液中含CH 3COO -的数目不相等且都小于0.1N A ;三看所给条件是否与电解质的组成有关,如pH =1的H 2SO 4溶液中c (H +)=0.1 mol·L -1(与电解质的组成无关),0.05 mol·L -1的Ba(OH)2溶液中c (OH -)=0.1 mol·L -1(与电解质的组成有关),不要忽略溶剂水中的H 、O 原子数目。
考点07 以物质的量为中心的多角度计算-高考化学二轮复习专题练(通用版) (解析版)

考点07 以物质的量为中心的多角度计算1.以物质的量为中心的各物理量的换算关系2.与物质的量浓度有关的五个公式c=nV,n=mM=VV m,ρ=m溶液V溶液,w=m溶质m溶液×100%,c=1 000ρwM。
每个公式中均可“知二求一”。
3.三个守恒应用考点导航一轮回顾:强基固本专题二化学常用计量1.必须掌握的“四”个定义式c =n /V ,n =m /M =V /V m ,ρ=m (溶液)/V (溶液),w =m (溶质)m (溶液)×100%。
每个公式中均可“知二求一”。
2.熟练推导“三”种换算关系(1)物质的量浓度与溶质质量分数之间的换算 c =n V =m /M V =m (aq)w MV =1 000ρw M ,w =cM 1 000ρ 。
(ρ:g·cm -3) (2)物质的量浓度与溶解度(S )的换算(饱和溶液) c =n V =S /M 100+S 1 000ρ= 1 000ρS M (100+S ),S =100cM 1 000ρ-cM 。
(ρ:g·cm -3) (3)气体溶质溶于水中制得溶液,其物质的量浓度和质量分数的计算 在标准状况下,1 L 水中溶解某气体V L ,所得溶液密度为ρ,则:c =nV=V /22.41 000×1+V22.4×M1 000ρ= 1 000ρV 22 400+MV (ρ:g·cm -3),w =m (溶质)m (溶液)×100%=V 22.4×M 1 000×1+V 22.4×M=MV 22 400+MV×100%。
3.灵活利用“三”个守恒关系(1)稀释前后“溶质的物质的量守恒”:c (浓溶液)·V (浓溶液)=c (稀溶液)·V (稀溶液)。
(2)溶液中“粒子之间电荷守恒”(溶液呈电中性)。
(3)质量守恒:反应前后同种原子的质量相等。
以物质的量为中心的计算

以物质的量为中心的计算(一)刘桥中学学习目标:掌握..物质的量、摩尔质量的涵义,理解阿伏加德罗常数的涵义;掌握..物质的量与微粒(原子、分子、离子等)数目、物质的质量之间的相互关系。
典型例题:例1.(2000年广东高考题)在1.00L1.00mol·L-1NaOH溶液中通入16.8L标准状况下的CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量。
解析:通入CO2的物质的量=16.8L/22.4L·mol-1=0.750mol溶液中NaOH物质的量=1.00L×1.00mol·L-1=1.00mol根据2 NaOH+CO2=Na2CO3+H2O该反应中CO2过量:0.750mol-1.00mol/2=0.250mol生成的Na2CO3为1.00mol/2=0.5molNa2CO3+CO2+H2O=2 NaHCO3反应中Na2CO3过量,生成的NaHCO3为n(反应的CO2)×2=0.500mol溶液中剩余的Na2CO3为0.500mol-0.250mol=0.250mol 答案:Na2CO3:0.250mol NaHCO3:0.500mol例2.现有Na2SO4和H2SO4的混合溶液100 mL,其中Na2SO4的浓度为0.5 mol/L ,H2 SO4的浓度为1 mol/L。
现要将上述混合溶液中Na2SO4的浓度改为0.2 mol/L,H2SO4的浓度改为2 mol/L,应加入98%(密度为1.84 g/cm3)的浓H2SO4多少毫升?然后加水稀释到多少毫升?解析:加98%H2SO4溶液和水稀释前后,溶质Na2SO4量不变则设加水稀释到V mL有关系:0.5×100=0.2×V V=250 mL需加纯硫酸n(H2SO4)=0.25×2-0.1×1=0.4 mol折算成98%(密度1.84 g/cm3)的硫酸体积为V=最后加水稀释至250 mL。
以物质的量为中心的计算

【背记】 32g/mol O2的摩尔质量 44g/mol CO2的摩尔质量 H2SO4 的摩尔质量 98g/mol
1、谁的单位是:mol/L 、谁的单位是:
2、谁的单位是:L/mol 、谁的单位是:
试计算将6克 溶于水配成500ml 例1: 试计算将 克NaOH溶于水配成 溶于水配成 溶液,求该溶液的物质的量浓度 溶液 求该溶液的物质的量浓度. 求该溶液的物质的量浓度
学考复习之 以物质的量为中心的计算
1、下列物质中,物质的量最大的是 、下列物质中, A ,含分子数最多的是______, ______,含分子数最多的是 A , 含原子数最多的是______, 含原子数最多的是 E ,质量最大 的是______ 的是 D A.6gH2 B.0.5molCO2 . . C.1.204×1024个H2 . × D.147gH2SO4 E.92gC2H5OH .43;的数目。 、 中含有Na 的数目。 1NA 常温常压下, ②常温常压下,48gO2的物质的量
1.5mol
③标准状况下,3.36L H2的物质的量 标准状况下, 0.15mol
学后考: 学后考:抄题
中含有Cu 的数目。 ① 0.5molCuCl2中含有 2+的数目。 ②常温常压下,48gO3的物质的量 常温常压下, 所占的体积。 ③标准状况下,0.6mol H2所占的体积。 标准状况下,
100mL, 例2:18 mol/L 浓H2SO4100mL,可配 mol/L的稀 的稀H 多少毫升? 制6 mol/L的稀H2SO4多少毫升?
已知有一未知浓度的NaCl溶液 溶液50ml, 例3. 已知有一未知浓度的 溶液 现往其中加入浓度为0.2mol/L的AgNO3溶 现往其中加入浓度为 的 两溶液恰好反应完全,求 液100ml,两溶液恰好反应完全 求NaCl溶液 两溶液恰好反应完全 溶液 的物质的量浓度? 的物质的量浓度
物质的量及化学计算

第七节 物质的量及其化学计算(过量、差量、混合物计算)一、物质的量及其单位1.国际单位制的基本物理量及其单位 在国际单位制(SI 制),只有7个基本物理量,它们有我们学过的质量、时间、长度、电流强度,还有为学习过的热力学温度和物质的量等。
其他的物理量如:密度、速度等全是导出物理量。
2.物质的量及其单位物质的量(n )是国际单位制7个基本物理量之一,表示物质含有一定数目粒子的集体。
单位为摩尔(mol )。
摩尔是物质的量的单位。
1 mol 物质含有阿伏伽德罗常数(N A )个基本粒子。
3.1 mol 的标准和阿伏伽德罗常数(N A )1 mol 的标准:国际单位制规定,1 mol 物质含有阿伏伽德罗常数(N A )个基本粒子。
阿伏伽德罗常数(N A ):0.012 kg 12C 所含碳原子数目定义为阿伏伽德罗常数(N A )。
23260.012 6.021101.99310A kgN kg-==⨯⨯ 为了使阿伏伽德罗常数(N A )更好地服务于物质的量及其单位,阿伏伽德罗常数(N A )可定义其单位为“1mol -个”,简写为“1mol -”。
所以在高中2316.0210A N mol -≈⨯。
【练习】完成下列填空:①1 mol H 2O 约含 个H 2O 分子,约含 个H 原子,约含 个电子,约含 个质子。
②1 mol H 2SO 4约含 个H 2SO 4分子,约含 个H 原子,约含 个个O 原子,约含 个电子,约含 个质子。
③约含233.0110⨯个H 2SO 4分子其物质的量为 。
二、摩尔质量1.摩尔质量:单位物质的量的物质所占的质量称为摩尔质量,用M 表示,单位为1g mol - 。
A N n N = m n M =1.下列关于物质的量的说法正确的是A.物质的量就是物质的质量B.物质的量就是物质的数量C.物质的量可以改为物质量D.物质的量是一物理量,所表示的意义是含有一定数目粒子的集体2.下列关于阿伏加德罗常数的书法正确的是A.阿伏加德罗常数是一个纯数,没有单位B.阿伏加德罗常数就是6.02×1023C.阿伏加德罗常数是指1mol的任何粒子的粒子数D.阿伏加德罗常数的近似值为6.02×1023mol-13.下列关于摩尔的说法正确的是A.摩尔是一物理量,是6.02×1023个粒子B.摩尔是物质质量的单位C.摩尔是表示物质的量的单位D.1mol的标准是0.012kg 12C中所含的原子数目4.0.5mol氧气中含有A.1个氧原子B.约6.02×1023个氧原子C.1mol氧原子D.0.5个氧分子5.下列叙述正确的是A.1molKClO3中含有3mol氧元素B.1molKClO3中含有3mol氧原子C.1molKClO3中含有1.5molO2 D.1molKClO3中含有1molCl-6.3.01×1024个H2SO4分子中氢原子的物质的量为A.0.5mol B. 1mol C. 5mol D. 10mol7.0.5mol H2O与0.5mol NH3中含有相同的A.质子数 B. 中子数 C. 分子数 D. 氢原子数8.下列数值等于阿伏加德罗常数的数值的是A.1mol Fe2+ 还原成单质需要结合的电子数B.1mol He 含有的原子数C.1mol H+含有的电子数D.1mol H2含有的质子数9.在MgCl2、KCl、K2SO4三种盐的混合液,若K+、Cl- 各0.5mol,Mg2+为0.5mol,则SO42-的物质的量为A.0.1mol B. 0.5mol C. 0.15mol D.0.25mol10.在一定条件下Cl2与NH3反应生成NH4Cl 和N2,反应中转移1.2 mol电子时,被氧化的还原剂为A.0.4 mol B. 1.6 mol C. 0.6 mol D. 以上都不是11.多少摩尔CaCl2溶解在1mol H2O 中,才能使Cl-与H2O 分子的物质的量之比为1:10 A.0.1mol B. 10mol C. 0.5mol D. 0.05mol二、填空题12.2 mol CO(NH2)2 中含有mol碳原子,mol氮原子,氢原子,所含的氧原子数与mol H2O 所含氧原子数相等。
2022年高考化学总复习:以物质的量为中心的计算

2022年高考化学总复习:以物质的量为中心的计算复习目标1.掌握物质的量浓度的有关计算。
2.学会常用的化学计算方法与技巧。
3.能熟练运用物质的量与相关物理量的关系进行有关计算。
考点一有关物质的量浓度的综合计算1.物质的量浓度、质量分数、溶解度间的换算由定义出发,运用公式:c =nV 、质量分数=溶质的质量溶液的质量×100%进行推理,注意密度的桥梁作用,不要死记公式。
(1)物质的量浓度(c )与溶质质量分数(w )的换算体积为V ,密度为ρg·cm -3的溶液,含有摩尔质量为M g·mol -1的溶质m g ,溶质的质量分数为w ,则溶质的物质的量浓度c 与溶质的质量分数w 的关系是:c =n V =mM V =m MV =1000ρw VMV =1000ρw M ,反之,w =cM1000ρ。
(2)物质的量浓度(c )与溶解度(S )的换算若某饱和溶液的密度为ρg·cm -3,溶质的摩尔质量为M g·mol -1,溶解度为S g ,则溶解度与物质的量浓度的表达式分别为:S =100cM 1000ρ-cM,c =n V =SM100+S 1000ρ=1000ρS M (100+S )。
2.溶液稀释和混合的计算(1)溶液稀释定律(守恒观点)①溶质的质量在稀释前后保持不变,即m 1w 1=m 2w 2。
②溶质的物质的量在稀释前后保持不变,即c 1V 1=c 2V 2。
③溶液质量守恒,m (稀)=m (浓)+m (水)(体积一般不守恒)。
(2)同溶质不同物质的量浓度的溶液的混合计算①混合后溶液体积保持不变时,c 1V 1+c 2V 2=c 混×(V 1+V 2)。
②混合后溶液体积发生改变时,c 1V 2+c 2V 2=c 混V 混,其中V 混=m 混ρ混。
(3)溶质相同、质量分数不同的两溶液混合定律(教师用书独具)①等质量混合两溶液等质量混合时(无论ρ>1g·cm -3还是ρ<1g·cm -3),混合后溶液中溶质的质量分数w =12(a %+b %)。
备战2024年高考化学考点微专题04-以物质的量为中心的计算

固体质量 24 g
差量Δm=24 g
物质的量 2 mol 1 mol 2 mol 差量Δn=1 mol
气体体积
1
2
差量ΔV=1
(2)解题步骤
4.平均值法 (1)依据 若 XA>XB,则 XA> X >XB, X 代表平均相对原子(分子)质量、平均浓度、平均含量、平均生成量、平均 消耗量等。 (2)应用 已知 X 可以确定 XA、XB 的范围;若已知 XA、XB 可以确定 X 的范围。 解题的关键是要通过平均值确定范围,很多问题的平均值需根据条件先确定下来再作出判断。实际上,它 是极值法的延伸。
B.Al3+在溶液中会发生水解生成 Al(OH)3,因此 2.0L 1.0 mol/L 的 AlCl3 溶液中 Al3+数目小于 2.0NA,故 B 错误;
C.苯甲酸燃烧的化学方程式为
C6H5COOH+125
点燃 O2
7CO2
+3H2O,1mol
苯甲酸燃烧生成
7molCO2,则
0.2mol 苯甲酸完全燃烧生成 1.4molCO2,数目为 1.4NA,故 C 正确;
同温、同压下,气体的体积与其物质的量成正比
同温、同体积下,气体的压强与其物质的量成正比 同温、同压下,气体的密度与其摩尔质量(或相对分子质量)成 正比
3.解题要点
(1)对气体来说,在解题时要特别注意气体所处的外界条件,因温度、压强不同,气体体积不同,注意运
用阿伏加德罗定律的推论。当涉及 NO2 气体时,还要考虑 2NO2 N2O4 的转化。
高温
1.(2022·浙江·统考高考真题)关于反应 4CO2+SiH4
4CO+2H2O+SiO2,下列说法正确的是
第2讲 化学常用计量ppt

(3)物质结构和晶体结构 考查一定物质的量的物质中含有多 物质结构和晶体结构:考查一定物质的量的物质中含有多 物质结构和晶体结构 少微粒(分子、原子、电子、质子、中子等 时常涉及稀有气体 少微粒 分子、原子、电子、质子、中子等)时常涉及稀有气体 分子 为单原子分子,Cl 为双原子分子等。 为单原子分子 2、N2、O2、H2为双原子分子等。晶体结构中 常考的有P 金刚石、石墨、二氧化硅等。 常考的有 4、金刚石、石墨、二氧化硅等。 (4)氧化还原反应 考查指定物质参加氧化还原反应时 常设置 氧化还原反应:考查指定物质参加氧化还原反应时 氧化还原反应 考查指定物质参加氧化还原反应时,常设置 氧化还原反应中氧化剂、还原剂、氧化产物、还原产物、 氧化还原反应中氧化剂、还原剂、氧化产物、还原产物、被氧 得失)数目方面的陷阱 化、被还原、电子转移(得失 数目方面的陷阱。要关注 2O2 被还原、电子转移 得失 数目方面的陷阱。要关注Na 等反应中电子转移数目的判断。 和H2O、CO2等反应中电子转移数目的判断。 、
结论 公式 语言叙述 同温、同压下 气体 同温、同压下,气体 的体积与物质的量 成正比 温度、 温度、体积相同的 气体,压强与物质 气体 压强与物质 的量成正比 物质的量相等、压 物质的量相等、 强相同的气体,其 强相同的气体 其 体积与温度成正比
T、p相同 、 相同
n1 V1 = n2 V2
p1 n1 = p2 n2 V1 T1 = V2 T2
2 = 14
选项C求解的关键是正确书写氧化还原反应方程式 该反应的 选项 求解的关键是正确书写氧化还原反应方程式,该反应的 求解的关键是正确书写氧化还原反应方程式 化学方程式为Cl 化学方程式为 2+2NaOH=NaCl+NaClO+H2O,在标准状 = 在标准状 况下当有1 参与反应时,转移的电子总数为 转移的电子总数为n 正 况下当有 mol Cl2参与反应时 转移的电子总数为 A,C正 中应注意到Fe 是弱碱阳离子,在水中易水解 在水中易水解,因 确。选项D中应注意到 3+是弱碱阳离子 在水中易水解 因 选项 中应注意到 此在溶液里含有Fe3+的数目小于 的数目小于0.1 nA,D错。 此在溶液里含有 错 [答案 C 答案] 答案
人教版高一化学必修1第一章以物质的量为中心的化学计算讲义

人教版高一化学必修1第一章以物质的量为中心的化学计算讲义第一章以物质的量为中心的化学计算一、化学计算的基本概念量是用来描述物质的特征,而物质的量则是描述物质数量的一个基本概念。
在化学中,物质的量常用摩尔(mol)来表示。
摩尔是国际计量单位制中的一个基本单位,其定义为一些物质所包含的基本粒子(如原子、分子)的数量,其中1摩尔等于6.02×1023个基本粒子。
化学计算就是利用物质的物质的量来进行计算,以解决化学问题。
化学计算主要包括以下几个方面:物质的摩尔计算、质量的摩尔计算、体积的摩尔计算和分子式计算。
二、物质的摩尔计算物质的摩尔计算是通过已知物质的质量或者体积,求出其摩尔数,进而求解其他相关的问题。
物质的摩尔计算主要涉及到的公式有以下几个:1.n=m/M公式中,n代表摩尔数,m代表质量,M代表物质的相对分子质量。
2.N=nN0公式中,N代表基本粒子的数量,N0代表一个摩尔包含的基本粒子的数量。
在应用这些公式时,需要注意一些基本的规则:1. 在用质量来计算摩尔数时,首先需要将质量化为相对分子质量的单位(g/mol)。
2.在用体积来计算摩尔数时,需要将体积化为升(L)的单位。
3.在计算过程中,需要特别注意数据的精度和四舍五入的问题。
三、质量的摩尔计算质量的摩尔计算是指通过已知物质的摩尔数,求出其质量。
质量的摩尔计算主要涉及以下几个公式:1.m=nM公式中,m代表质量,n代表摩尔数,M代表物质的相对分子质量。
2.M=m/n公式中,M代表物质的相对分子质量,m代表质量,n代表摩尔数。
在质量的摩尔计算中,需要注意以下几个方面:1. 在用摩尔数来计算质量时,需要注意摩尔数的单位是摩尔(mol)。
2.在计算过程中,需要特别注意数据的精度和四舍五入的问题。
3.在计算质量时,要考虑物质的纯度问题,纯度不同,计算出来的质量也不同。
四、体积的摩尔计算体积的摩尔计算是指通过已知物质的摩尔数,求出其体积。
体积的摩尔计算主要涉及以下几个公式:1.V=nV0公式中,V代表体积,n代表摩尔数,V0代表一个摩尔的物质所占据的体积。
以物质的量为中心的计算

以物质的量为中心的计算1. 基本概念和重要定律[⑴物质的量:物质的量实际上表示含有一定数目粒子的集体.物质的量的符号为n ,其单位是摩尔,简称摩,符号为mol.1mol 任何粒子的粒子数与0.012kg 12C 中所含的碳原子数相同.这里的粒子指分子,原子,离子,电子,质子,中子以及它们的特定组合(2)阿伏加德罗常数:1mol 任何粒子的粒子数叫做阿伏加德罗常数,其符号为N ,最A 新测定数据为6.0221367义1023mol -1,通常使用6.02义1023mol -1这个近似值(3)气体摩尔体积:单位物质的量气体所占的体积叫做气体摩尔体积,其符号为V .m单位为L •mol -1,m 3•mol -1(4)摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量,其符号为M ,单位为g •mol -1或kg •mol -1.摩尔质量以克为单位时,在数值上与该粒子相对原子质量或相对分子质量相等 (5)物质的量浓度:以单位体积溶液里所含溶质B 的物质的量来表示溶液组成的物理量,叫做溶质B 的物质的量浓度,其符号为c (B ),常用的单位为mol •L -1或mol •m -3重[阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子.要注意⑴使用范围:气体;(2)使用条件:同温洞压洞体积;(3)特例:气体摩尔体积、<、一一定质量守恒定律:参加反应的各物质质量总和等于反应后生成物的质量总和(或反应刖后律〔各种原子的种类及个数相同).此定律是书写化学方程式及进行计算的依据物.质的量和其它物理量之间的关系:(1) 一定质量的物质中所含原子数、电子数,其中考查较多的是H 2O 、N 2、O 2、H 2、NH 3、P 4等。
(2) 一定体积的物质中所含原子数、分子数,曾考过的物质有Cl 2、NH 3、CH 4、02、N 2、CCl 4、C 8H 10等(3) 一定量的物质在化学反应中的电子转移数目,曾考过的有Na 、Mg 、Cu 等。
以物质的量为中心的计算

能力突破点二 以物质的量为中心的计算1、物质的量计算中的万能恒等式 n=M m =Vm g V )(=NA N =∆HQ =cV(aq) 2、物质的量浓度与溶质质量分数之间的换算c B =V n =V M m /=MV aq m ω)(=Mρω1000,ρ单位:g/cm 33、化学计算中常用的方法(1)守恒法守恒法是中学化学计算中的一种常用方法,守恒法中的三把金钥匙——质量守恒、电荷守恒、电子得失守恒,都是抓住有关变化的始态和终态,淡化中间过程,利用某种不变量(a 、某原子、离子或原子团不变,b 、溶液中阴阳离子所带电荷数相等,c 、氧化还原反应中得失电子相等)建立关系式,从而达到简化过程,快速解题的目的。
(2)极值法对混合体系或反应物可能发生几种反应生成多种产物的计算,我们可假设混合体系中全部是一种物质,或只发生一种反应,求出最大值、最小值,然后进行解答,此类题一般为选择题。
(3)设未知数法对混合体系的计算,我们一般设两个未知数,然后依据题意列两个方程,进行求解。
例题一:下列溶液中,溶质的物质的量浓度为1mol/L的是()A、将40gNaOH溶于1L水所得的溶液B、将22.4LHCl溶于水配成1L溶液C、在标况下,将22.4LNH3溶于1L水中D、K+的物质的量为2mol的K2SO4溶液1L例题二:下列说法中错误的是()A、0.5L 2mol/L BaCl2溶液中,Ba2+和Cl-总数为3x6.02x1023B、制成0.5L 10mol/L的盐酸,需要氯化氢气体112L(标况下)C、从1L 1mol/L的NaCl溶液中取出10mL,其浓度仍是1mol/LD、10g 98%的硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的例题三:2013四川理综1.52g铜镁合金完全溶解于50mL密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标况),向反应中的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
