《氧化反应》PPT课件
合集下载
氧化反应课件-经典

重铬酸钠
Na2Cr2O7,H2SO4 Na2Cr2O7,H2SO4 CH3CH2CH2OH CH3CH2CHO CH3CH2COOH 0C HO,75
重铬酸钾
R R' CHOH
K2Cr2O7/CrO3
R R'
C=O
Sarrett试剂
CrO3+2 N
25° CH2Cl2 C
(C5H5N)2 CrO3
引发剂作用是缩短诱导期,是易产生自由基的物质, 一般是带有弱键、易分解成活性种的化合物,其中 共价键有均裂和异裂两种形式
(CH3)2C-N=N-C(CH3)2 CN CN
2CH3-C-CH3+N2 CN
R-H+CH3-C-CH3 CN
R +CH3-CH-CH3 CN
(1)引发剂和催化剂的影响
催化剂常采用过渡金属离子,常用的有Co和Mn,此外 还有Cr、Mo、Fe、Ni、V等。过渡金属离子并不参加 反应,而且可以通过空气氧化再生,可以保持持续的 催化作用:
R
H
3+ +Co
R
++Co2+ +H
Co2+
O2
Co3+
引发剂不能再生,其用量应为参与反应的剂 量。变价金属催化剂可被空气中氧氧化为高 价态,从而重复利用 但以有机过氧化氢物为产物时,不能采用催 化剂,只能采用引发剂来加速反应。
(2)被氧化物的结构的影响
叔碳上的氢最易被氧化,仲碳上的氢次之,伯碳上的 氢最难;
链引发
在能量、催化剂或引发剂的作用下
R
——
e
09第九章氧化反应

常用共氧化试剂——催化量OsO4与H2O2或氯酸盐等 氧化试剂共同使用:
OsO4首先进攻位阻小的碳中心,随后其他氧化剂将生成 的Os2+离子氧化为OsO4 ,反应循环进行
原因:毒性和价格因素
三、碳碳双键臭氧化反应:
臭氧能氧化碳碳双键得臭氧化产物,产物加入 锌粉还原可得醛或酮,强还原剂则得醇
9.1 醇的氧化
负载下的氧化剂氧化:
负载氧化是工业上最常用的氧化方法,好处有:
操作简单,反应快速、完全,环境友好 相对于普通氧化,氧化活性和选择性更高
负载氧化一般将氧化剂(常用高价金属阳离子) 附着于具有大表面积的支撑物(如硅胶和树脂 等)上,实现氧化和再生
9.2 碳碳双键的氧化
9.1 醇的氧化
针对铬酸缺陷的解决方案:
换用溶剂体系:
Jones(琼斯)试剂(铬酐-硫酸-丙酮),使用时将 醇的丙酮溶液滴入配好的铬酐-硫酸中
PCC(吡啶-氯铬酸盐,Corey氧化法),铬酐的盐 酸溶液中加吡啶得到的结晶。该试剂仍具有一定酸 性,使用范围小
Sarett(萨雷特)试剂(铬酐-双吡啶配合物),将 铬酐加入吡啶中,是最常使用的铬酸氧化剂
PDC(吡啶-双铬酸盐),将吡啶加入中性的铬酐水 溶液得到的吡啶双铬酸盐(Sarett试剂区别?), 中性试剂,可替代PCC。
9.1 醇的氧化
改善氧化条件:
在醛刚生成时利用蒸馏等手段加以分离,使其脱离 氧化剂的接触,从而避免进一步氧化
Sarett(萨雷特)试剂:
特别适用于分子中含有对酸敏感的基团(如缩 醛)或易氧化基团(如碳碳双键)的醇类
无水条件得到反式,有水条件得到顺式
五、双键的催化氧化:
第九章_氧化反应-课件

R CO2Et
69%~98%
CH2OH
O CH
RO OO
O
Ph
O
RO OO
IBX, DMSO, r.t.
O
Ph
O
NH2 O
NHAC
NH2 O
NHAC
AcO
OAc OAc
AcO
OAc OAc
BF4-
NO Re PPh3 R
R HO
IBX, DMSO, 20 oC, 3-4h
BF4NO Re PPh3 R
O OH OH
Ag2CO3, 硅藻土
O
HO O
80%
(4)亚硝酸钠-醋酸酐氧化法
2000年,Babasaheb P B等发现NaNO2-Ac2O新氧化体系 在无溶剂和温和条件下能够对各种伯醇、苄醇、烯丙醇进行快 速和选择性氧化,得到相应的醛类化合物,产率60~97%。
RC 2O HHN 25a℃ 2 N -,<A 1m O 2O iC n
9.1 醇羟基和酚羟基的氧化反应
9. 1. 1 醇羟基的氧化反应
醇羟基氧化方法很多,本节只介绍一些具有选择性的实用 氧化方法。
①.氧化剂直接氧化法
(1)三氧化铬—吡啶络合物氧化法
将三氧化铬加入吡啶中可以得到该络合物,性质温和、 易吸湿。制备时不能将吡啶加到三氧化铬上,易着火。
2
N+ Cr3O
(
_ O
8 0 %
C3H
C3H
HO
Al(OC4H9-n)3 C3H CO3CH
O
机理:烷氧基铝使醇成为醇铝,醇铝再与过量丙酮作用,通过 形成环状过渡态被氧化。
◆ 四醋酸铅Pb(OAc)4氧化法:用四醋酸铅在吡啶溶液中能将 伯醇、仲醇和烯丙醇氧化为相应的羰基化合物。
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
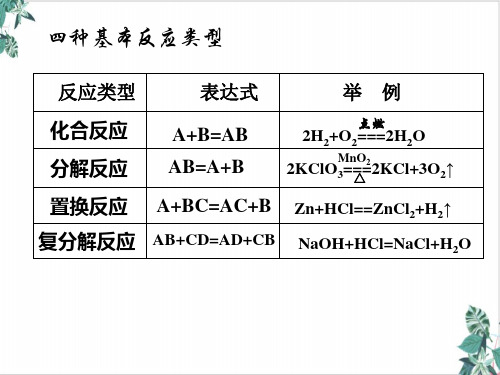
氧化反应ppt课件

COOH
C
H C
K Mn 4,二 O环 已 基 -18-冠 -6
2
H
苯 , 250C
97%
O
OO
OO
O
K M4n /P h O H 200C
O
OO
K
OO
O
M O 4n -
R R 'C = C H 2H K + M H n O 2 O 4 R R 'C = O + C O 2
R R 'C = C H R K M n O 4R R 'C = O + O = C H R
O
m-ClC6H4CO3H CHCl3
C 2 P H h 5CC C C 3 3H H C 6 H 0 5 0 C C ,3 3 H 0 m O E i t n 2 O / C 2 P H h 5C O C C C 3 3H H
C 6 H 5 C H C H 2C 6 H 0 5 0 C C O ,3 H 2 4 / C h H C l 3 C 6 H 5 C HC H 2 O
O
RC + H O 2 O 2OH R O C O H + H 2 O
C 6 H 5 CO 2 O 2 O H c o r O H 3 S C A 3 H O H C 6 + H 5 C 3 H O H 2 O +
C 3 C HOO 2 O 乙 H H 酸 2 S 乙 4 酯 O C +3 C H 3 H H O2 O +
C 3 (2 C ) H 7 C H = H (C 2 C ) 7 C H H H K 室 M O 温 , 4 1 / 2 h 2 O H C O n 3 (O 2 C ) H 7 C O H - O H ( C H 2 C ) 7 C H O H O H H
氧化还原反应ppt课件

化合价降低,被还原,发生还原反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
氧化还原反应(最新版)PPT

知识铺垫
新知预习
自主测试
一、从不同角度分析氧化还原反应1.从得氧、失氧的角度认识氧化还原反应反应:2CuO+C 2Cu+CO2↑(1)CuO失氧,发生了还原反应,该物质是氧化剂。(2)C得氧,发生了氧化反应,该物质是还原剂。结论:从得氧、失氧的角度看,一种物质得到氧被氧化,另一种物质失去氧被还原的反应叫做氧化还原反应。
探究一
探究二
素养脉络
随堂检测
D项,HgS中汞元素由+2价降到0价,转移2e-,O2中氧元素由0价降到-2价,转移2×2e-,且均为得电子,而HgS中硫元素化合价由-2价升高到+4价,失6e-,正确的表示方法为
探究一
探究二
素养脉络
随堂检测
探究一
探究二
素养脉络
随堂检测
1.古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )A.野火烧不尽,春风吹又生B.春蚕到死丝方尽,蜡炬成灰泪始干C.粉身碎骨浑不怕,要留清白在人间D.爆竹声中一岁除,春风送暖入屠苏答案C解析A 、B两项中均涉及物质燃烧,D项中有火药爆炸,都属于氧化还原反应;C项中反应为CaCO3 CaO+CO2↑,无元素化合价升降,属于非氧化还原反应。
探究一
探究二
素养脉络
随堂检测
探究一
探究二
素养脉络
随堂检测
深化拓展1.双线桥法和单线桥法的书写步骤(1)双线桥法的书写步骤:
探究一
探究二
素养脉络
随堂检测
(2)单线桥法的书写步骤:
探究一
探究二
素养脉络
随堂检测
2.用双线桥法表示电子转移的方向和数目时的注意事项(1)箭头必须由反应物指向生成物,且两端对准同种元素。(2)在“线桥”上标明电子“得到”或“失去”,且得到与失去的电子总数必须相等,电子对的偏移也按得失处理。(3)电子转移数以a×be-形式表示,a表示发生氧化还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略。(4)箭头方向不代表电子转移的方向,仅表示电子转移前后粒子的变化。3.用单线桥法表示电子转移的方向和数目时的注意事项(1)单线桥必须画在反应物中。(2)箭头指向得电子原子,箭尾指向失电子原子。(3)“线桥”上只标电子转移的数目,不标“得”“失”字样。
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT

还原剂:反应中失电子的物质,表现还原性,具 有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
O
CH3CCH2CH2CH2CH2CCH3
CH3
CH3
+
OH
2 H3C C=O
OH
H3C
(2) OsO4
应用OsO4的氧化谓Cringes氧化法。该法反应条 件温和,一般在室温下进行且反应定量发生,收率很高. 用 以氧 化烯烃所得的顺式二醇的选择性高于KMnO4氧化法, 常用 于1,2—二醇的制备和甾类结构的测定. 但价格昂贵且有 剧毒, 一般只应用于小量的精细有机合成中.为减少其用 量 (用催化量即可),氧化时常与其它氧化剂(如H2O2, NaClO3, NaIO4)共用, 这时氧化效果与其单独使用时相仿. 其氧化 机 理为: OsO4与双键经顺式加成生成五员环的锇酸酯,然后经 水解得到顺式二醇和锇酸:
第三章
氧化反应
一、教学目的与基本要求
1.掌握锰化合物中KMnO4,MnO2对烯烃、芳烃侧链的氧化。 2.掌握CrO3对芳烃铡链、多环芳烃、醇的氧化, CrO3 -吡
啶络合物对有机化合物的氧化反应。 3.掌握SeO2、HIO4、过氧化物氧化剂、Pb(AcO)4、二甲亚
砜、催化氧化等在有机合成中的应用。
O
3.2.4 Collins试剂氧化
Collins试剂 10份吡啶,在一面搅拌下一面徐徐加入l份铬酐(加料次序
不能颠倒,否则将引起燃烧), 缓缓升温至300C便可得到黄色的沉淀络合物 CrO3C5H5N,将该络合物分离出来溶于CH2Cl2中所得试剂称谓Collins试剂。
CH=CHCH2OH CrO3-Py 室温
H2/Pd-C
R CH R'
OH
+
HO-H2CR
LiAlH4 or NaBH4
R CH OH + R'
HO-H2CR
H2O2/H2O R C O + HOOCR R'
烯烃的臭氧化反应可以用于(1)烯烃双键结构的鉴定。 (2)用于醛、酮、酸的合成。
思考题 1.试设计戊二醛的合成路线。
2.用环戊二烯和C2以下的有机物为原料合成
RC N+ O OH
CC
C C + R C NH2
O
O
H2O2/K2CO3/MeOH
CH2 + PhCN
450C
O
O
CH2 + Ph C NH2
CH C CN H2O2
NaOH
HH
CO O
CC
NH
O
Ph C C C NH2 H O Ph
(2)在酸性介质 中,H2O2与有机酸作用,使有机酸氧化 成有机过酸,这也是有机过酸的制备方法 。
2.以甲苯为原料合成
OO CC
3.2醇的氧化
3.2.1KMnO4氧化
伯醇:
RCH2CH2CH2OH
KMnO4/HOH 室温,12h
RCH2CH2COOH
84%
仲醇:
RC H2CHCH2R' KMnO4/OH- RC H2CCH 2R'
OH
O
RCH2COOH +R 'COO H RCOOH + R'CH 2COO H
3.以H2C=CHCH3为原料合成H2C=CHCH2CH2COOH (提示:用MnO2氧化剂氧化)
3.2.3.叔丁基铬酸酯氧化
于冰浴中置无水叔丁醇,边搅拌边分批加入铬酐
即得到叔丁基铬酸酯[Me3COCrO2(OH)]。进行氧化 时多以石油醚为溶剂。它可将羟基氧化为碳基。例如:
OH Me3COCrO2(OH) 石油醚
3.用C2以下的有机物为原料合成 4.用C4以下的有机特为 原料合成
CH3CH CHCHO
O
HO
COOH
HO
COOH
3.1.4铬酰氯氧化(Etard's剂)
制备: 将CrO3溶解在水中,在00C下加入一定量的浓HCl ,并在100C左右滴加硫酸,分层、分离、分馏。收集沸点 1170C馏分即为Etard’s试剂。
二、作业 1(1、3、5、6、8~16),2(1、2、3、4、5)
概念
氧化可以看作为被氧化的物质失去电子或发生部 分电 子转移的过程。对于以共价键结合的有机化合物,可将氧 化视为碳原子周围的电子云密度降低的过程。
氧化(Oxidation)是一类最普遍、最常用的有机化学 反应。 通过氧化可以合成出如醇、醛、酮、羧酸、酸酐、 酚、醌等含氧化合物。乙烯经催化氧化制备乙醛,丙烯经 氨氧化制备丙烯醛均为氧化反应的结果,被誉为近代石油 化工中突出成就之一。
回流
CH3 H3C CCOOC2H5
O
RCO3H
OH
OH
反应
O
发生 在位
O C O C H3
RCO3H
O C O C H3
阻小 的一 边
O
思考题
1.用C3以下的有机物为原料合成 2.以苯和C2以下的有机物为原料合成
O
CH3
O H3C CCOOC2H5
O
O
Ph C C C NH2 H O Ph
(提示:参见在碱性条件下用H2O2氧化烯烃来制备该化合物。)
OH MnO2 / 石油醚
250C,1h
CH3 CH3 CH3 CHO
HO
HO HO
OH
MnO2 / CHCl3
400C 2h O
OH
82%
OH HO
MnO2 / CHCl3
O
OH
62%
H3C
C H3
C=C
H
C HC H3
OH
MnO2 戊烷 250C,12h
CH3
C H=C HC =C HC H2O H
O
m-ClC6H4CO3H
CHCl3
Ph
C2H5 C
C H3
C CH3
C6H5CO3H/Et2O 00C , 30min
Ph
C H3
C2H5 C O C CH3
C6H5CH
CH2
C6H5CO3H/CHCl3
00C, 24h
C6H5CH
CH2
O
CH2
CH3 C C O O C2H5F3CCO3H/Na2HPO4/CHCl3
氧化方法
1.无机与有机氧化剂氧化 氧气(空气),臭氧,含高价原子的无机化合物等为无
机氧 化剂;硝基苯 ,有机过氧化物, 四 醋 酸铅, 叔丁醇铝, 二甲亚砜 等为有机氧化剂。最易获得且最 价廉的氧化剂为空气,在催化剂作用下的催化空气氧化 广泛应用于化工生产。
2.气相氧化和液相氧化。
3.在操作方式上, 又可分为应用化学试剂的化学氧化,应用电解
用作氧化剂的MnO2有两种,一种为 MnO2与硫酸的混合物,一种为活性的MnO2。
3.2.2 活性MnO2氧化
CH=CHCH2OH MnO2, 室温
CH=CHCHO
活性MnO2是一种温和的选择性高的氧化剂,可以用来 氧化α,β-不饱和醇成相应的醛或酮,收率高,且不饱和
的双键、叁键不受影响。例如
CH3 CH3 CH3
(1)在碱性介质中,以HOO-的形式进行氧化反应。
O
H2O2/NaOH/MeOH 15~200C
O
O
过氧亚酰胺酸
RC N HOO-
RC N OOH
H2O R C N OOH
R C N + HO-O H O OH
R C NH2 + O2 + H2O O
过氧亚酰胺酸本身是一种很好的氧化 剂,能使烯烃氧化成 环氧化合物。
2KMnO4 + H2O 碱性或中性介质 2MnO2 + 2KOH + 3[O] 2KMnO4 + 3H2SO4酸性介质 2MnSO4 + K2SO4 + 3H2O + 5[O]
KMnO4氧化通常在水溶液中进行,对于难溶于水的反应 物,可选择适当的有机溶剂如丙酮、冰醋酸、吡啶等溶解。
有时还可将反应物溶解于有机溶剂中,与KMnO4水溶液形成两 相,加入少许相转移催化剂(如PhCH2N+Et3Cl-)进行氧化反应。 KMnO4与冠醚形成的络合物可增加在非极性有机溶剂中的溶解 度从而增强其氧化能力。
3.1.1烯烃与KMnO4、 OsO4 氧化
R C
H
O H-
RO
O-
C + Mn
HO O
R
R
CC
H
H
OH OH
顺式加成
HR CO
O-
Mn
CO
O
HR
(1)KMnO4
KMnO4是应用范围最广的氧化剂,几乎可氧化一切能 被氧化的基团,并且在酸性、碱性及中性介质中均能实施 其氧化过程。氧化能力依介质而异,在碱性与中性介质中 七价锰被还原为四价锰(MnO2),在酸性介质中被还原为二 价锰(MnSO4)。
MnO2 戊烷 250C,72h
H3C
C H3
C=C
H
C C H3
O
CH3 CH=CHC=CHCHO
H3C O H3C O
OH CHCH2CH2O H
MnO2 250C 丙酮
H3C O H3C O
O CHCH2CH2O H
思考题
1.用C2以下的有机物为原料合成CH3CH2CH2COOH
2.以甲苯和C2以下有机物为原料合成3-苯基丙烯酸
RCOOH + H2O2
O
RC O O H + H2O
C6H5COOH + H2O2 HOAc or CH3SO3H C6H5CO3H + H2O
CH3COOH + H2O H2SO4
乙酸乙酯
