实验二-电离平衡与沉淀反应精品PPT课件
合集下载
《高二化学电离平衡》课件

酸雨主要是由工业排放以及车 辆尾气中的氮氧化物和硫氧化 物与大气中的水分反应形成酸 性物质导致的。
酸雨对环境的影响
酸性物质处理方法的介绍
酸雨对环境造成了严重的污染, 对土壤、水源和植被等都会产 生不可逆转的损害。
酸性物质处理方法包括中和、 吸附等,通过将酸性物质处理 成中性或碱性来减少对环境的 危害。
浓度对电离平衡的影响可以通过计算反应物和生成物的浓度来观察。
2
Le Chatelier定理
Le Chatelier定理描述了当外界条件改变时,电离平衡会产生的相应变化,例如 浓度的改变。
3
酸碱中和反应的判断条件
酸碱中和反应达到平衡的判断条件包括酸和碱浓度的比例,以及酸和碱的中和反 应方程式。
盐的酸碱性
1 盐的离子化程度与
酸碱性
盐的离子化程度决定了 盐的酸碱性,一些盐是 酸性的,一些盐是碱性 的。
2 盐对酸碱性的影响
盐在溶液中可以影响其 他物质的酸碱性,调节 溶液的pH值。
3 盐水的pH计算
盐在溶液中可以影响pH 值,通过计算盐水的浓 度和离子浓度可以得到 溶液的pH值。
电离平衡在生活中的应用
酸雨产生的原因
电离平衡基础知识
1 电离反应与离子积
电离反应是物质在溶液中分解成离子的过程,离子积是反应物浓度与生成物浓度之积。
2 平衡常数与离解常数
平衡常数描述了电离反应达到平衡时反应物和生成物浓度之间的关系,离解常数描述的 是溶液平衡的条件包括酸碱离解平衡常数与酸碱强度的关系,以及溶液中酸 和碱浓度之间的关系。
《高二化学电离平衡》PPT课件
# 高二化学电离平衡 PPT课件大纲 ## 一、电离平衡基础知识 - 电离反应与离子积 - 平衡常数与离解常数 - 酸碱离解平衡的判断条件 ## 二、弱酸弱碱的电离平衡 - 弱酸的电离平衡 * 平衡常数的计算 * 酸性度的计算 - 弱碱的电离平衡 * 平衡常数的计算 * 碱度的计算 ## 三、浓度对电离平衡的影响 - 利用浓度计算反应物与生成物的浓度 - Le Chatelier定理 - 酸碱中和反应的判断条件
酸雨对环境的影响
酸性物质处理方法的介绍
酸雨对环境造成了严重的污染, 对土壤、水源和植被等都会产 生不可逆转的损害。
酸性物质处理方法包括中和、 吸附等,通过将酸性物质处理 成中性或碱性来减少对环境的 危害。
浓度对电离平衡的影响可以通过计算反应物和生成物的浓度来观察。
2
Le Chatelier定理
Le Chatelier定理描述了当外界条件改变时,电离平衡会产生的相应变化,例如 浓度的改变。
3
酸碱中和反应的判断条件
酸碱中和反应达到平衡的判断条件包括酸和碱浓度的比例,以及酸和碱的中和反 应方程式。
盐的酸碱性
1 盐的离子化程度与
酸碱性
盐的离子化程度决定了 盐的酸碱性,一些盐是 酸性的,一些盐是碱性 的。
2 盐对酸碱性的影响
盐在溶液中可以影响其 他物质的酸碱性,调节 溶液的pH值。
3 盐水的pH计算
盐在溶液中可以影响pH 值,通过计算盐水的浓 度和离子浓度可以得到 溶液的pH值。
电离平衡在生活中的应用
酸雨产生的原因
电离平衡基础知识
1 电离反应与离子积
电离反应是物质在溶液中分解成离子的过程,离子积是反应物浓度与生成物浓度之积。
2 平衡常数与离解常数
平衡常数描述了电离反应达到平衡时反应物和生成物浓度之间的关系,离解常数描述的 是溶液平衡的条件包括酸碱离解平衡常数与酸碱强度的关系,以及溶液中酸 和碱浓度之间的关系。
《高二化学电离平衡》PPT课件
# 高二化学电离平衡 PPT课件大纲 ## 一、电离平衡基础知识 - 电离反应与离子积 - 平衡常数与离解常数 - 酸碱离解平衡的判断条件 ## 二、弱酸弱碱的电离平衡 - 弱酸的电离平衡 * 平衡常数的计算 * 酸性度的计算 - 弱碱的电离平衡 * 平衡常数的计算 * 碱度的计算 ## 三、浓度对电离平衡的影响 - 利用浓度计算反应物与生成物的浓度 - Le Chatelier定理 - 酸碱中和反应的判断条件
化学课件《电离平衡》优秀ppt10 人教课标版

126.在寒冷中颤抖过的人倍觉太阳的温暖,经历过各种人生烦恼的人,才懂得生命的珍贵。――[怀特曼] 127.一般的伟人总是让身边的人感到渺小;但真正的伟人却能让身边的人认为自己很伟大。――[G.K.Chesteron]
128.医生知道的事如此的少,他们的收费却是如此的高。――[马克吐温] 129.问题不在于:一个人能够轻蔑、藐视或批评什么,而是在于:他能够喜爱、看重以及欣赏什么。――[约翰·鲁斯金]
水解
强酸弱碱盐 水解
溶液酸 碱性
酸性
强碱弱酸盐 水解 碱性
强酸强碱盐 不水解 中性
实例
氯化铵 醋酸钠 氯化钠
五.酸碱中和滴定
1.原理: 酸中含的H+的物质的量等于碱中
含的OH-的物质的量
2.所用仪器:酸式滴定管、碱式滴定管、 锥形瓶、铁架台、滴定管夹
练习:某学生中和滴定实验过程如下,指出实
验过程中的错误之处:⑴取一支滴定管;⑵用蒸 馏水洗净;⑶立即加入待测氢氧化钠溶液;⑷记 录液面刻度;⑸用酸式滴定管精确放出一定量的 标准酸溶液;⑹置于未经标准液润洗的洁净锥形 瓶中;⑺加入适量蒸馏水;⑻加入酚酞试液2滴; ⑼滴定时,边滴边振荡,眼睛注视滴定管内液面 的变化;⑽当小心滴到溶液由无色变成粉红色时, 即停止滴定;⑾记录液面刻度读数;⑿根据滴定 管的两次读数得出氢氧化钠溶液体积为22mL. 上述实验过程中的错误之处(填编号)
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
128.医生知道的事如此的少,他们的收费却是如此的高。――[马克吐温] 129.问题不在于:一个人能够轻蔑、藐视或批评什么,而是在于:他能够喜爱、看重以及欣赏什么。――[约翰·鲁斯金]
水解
强酸弱碱盐 水解
溶液酸 碱性
酸性
强碱弱酸盐 水解 碱性
强酸强碱盐 不水解 中性
实例
氯化铵 醋酸钠 氯化钠
五.酸碱中和滴定
1.原理: 酸中含的H+的物质的量等于碱中
含的OH-的物质的量
2.所用仪器:酸式滴定管、碱式滴定管、 锥形瓶、铁架台、滴定管夹
练习:某学生中和滴定实验过程如下,指出实
验过程中的错误之处:⑴取一支滴定管;⑵用蒸 馏水洗净;⑶立即加入待测氢氧化钠溶液;⑷记 录液面刻度;⑸用酸式滴定管精确放出一定量的 标准酸溶液;⑹置于未经标准液润洗的洁净锥形 瓶中;⑺加入适量蒸馏水;⑻加入酚酞试液2滴; ⑼滴定时,边滴边振荡,眼睛注视滴定管内液面 的变化;⑽当小心滴到溶液由无色变成粉红色时, 即停止滴定;⑾记录液面刻度读数;⑿根据滴定 管的两次读数得出氢氧化钠溶液体积为22mL. 上述实验过程中的错误之处(填编号)
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
《电离平衡》PPT课件

● 液氨----HCl、HNO3、HAc的拉平溶剂
液氨碱性比水强!!!
7.2.2 水的电离与溶液的酸度
1.水的电离
水分子电离程度较小:
H2O(l)+ H2O(l)= H3O++ OHH2O(l)= H++ OH-
295K: KӨ=KW=[H+][ OH-]=1.0× 10-14 Kw称水的离子积常数
NH +4
H+ + NH3
H2PO-4
H+ + HPO42-
H2SO4 H+ + HSO-4
HSO-4
H+ + SO24-
● 共轭关系,互为共轭酸碱对。 酸越强,它的共轭碱越弱;酸越弱它的共轭碱越强
◆ 有的离子可以是碱,也可以是酸,如HSO4-等 ◆ 没有盐的概念。盐在在质子论中都是离子酸或离子碱。
[In]/[HIn]≤1/10时----HIn的颜色 [In]/[HIn]≥10/1时----In的颜色 [In]/[HIn]=1时 ----理论变色点
pKHIn± 1的pH范围称为指示剂的变色pH范围
甲基橙 ( Methyl Orange, MO)
(CH3)2N—
—N=N—
—SO3-
4.4 黄
OH- H+ pKa=3.4
Kw意义----一定温度时水溶液中[H+]和[OH-]之积为一常
数
温度升高,KW增大
2.溶液的pH值
● 水溶液中氢离子的浓度称为溶液的酸度 ----溶液酸碱性的定
量标度
● 在[H+]<1mol·L-1时,pH值表示溶液的酸度 pH =-lg[H+] pOH=- lg
液氨碱性比水强!!!
7.2.2 水的电离与溶液的酸度
1.水的电离
水分子电离程度较小:
H2O(l)+ H2O(l)= H3O++ OHH2O(l)= H++ OH-
295K: KӨ=KW=[H+][ OH-]=1.0× 10-14 Kw称水的离子积常数
NH +4
H+ + NH3
H2PO-4
H+ + HPO42-
H2SO4 H+ + HSO-4
HSO-4
H+ + SO24-
● 共轭关系,互为共轭酸碱对。 酸越强,它的共轭碱越弱;酸越弱它的共轭碱越强
◆ 有的离子可以是碱,也可以是酸,如HSO4-等 ◆ 没有盐的概念。盐在在质子论中都是离子酸或离子碱。
[In]/[HIn]≤1/10时----HIn的颜色 [In]/[HIn]≥10/1时----In的颜色 [In]/[HIn]=1时 ----理论变色点
pKHIn± 1的pH范围称为指示剂的变色pH范围
甲基橙 ( Methyl Orange, MO)
(CH3)2N—
—N=N—
—SO3-
4.4 黄
OH- H+ pKa=3.4
Kw意义----一定温度时水溶液中[H+]和[OH-]之积为一常
数
温度升高,KW增大
2.溶液的pH值
● 水溶液中氢离子的浓度称为溶液的酸度 ----溶液酸碱性的定
量标度
● 在[H+]<1mol·L-1时,pH值表示溶液的酸度 pH =-lg[H+] pOH=- lg
化学课件《电离平衡》优秀ppt12 苏教版

87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
[例3]现有NH4Cl和氨水组成的混合溶液 C(填“>”、“<”或“=”)
①若溶液的pH=7,则该溶液中 C(NH4+) = C(Cl-)
②若溶液的pH>7,则C(NH4+) > C(Cl-) ③若C(NH4+)< C(Cl-),则pH < 7
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
CD
例6]一种一元强酸HA溶液中加入一种碱MOH反应 后,溶液呈中性,下列判断正确的是 ( )
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
[例3]现有NH4Cl和氨水组成的混合溶液 C(填“>”、“<”或“=”)
①若溶液的pH=7,则该溶液中 C(NH4+) = C(Cl-)
②若溶液的pH>7,则C(NH4+) > C(Cl-) ③若C(NH4+)< C(Cl-),则pH < 7
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
CD
例6]一种一元强酸HA溶液中加入一种碱MOH反应 后,溶液呈中性,下列判断正确的是 ( )
人教版《沉淀溶解平衡》优秀课件PPT

Q=Ksp,沉淀与溶解处于平衡状态;
Q<Ksp,溶液中无沉淀析出;
二、知识讲解——沉淀溶解平衡的应用
1、沉淀的生成 古之立大事者,不惟有超世之材,亦必有坚忍不拨之志。
大丈夫处世,不能立功建业,几与草木同腐乎?
母鸡的理想不过是一把糠。 追踪着鹿的猎人是看不见山的。 人之所以异于禽者,唯志而已矣!
药剂设备
调节pH法:如工业原料氯化铵中含杂质沉氯化淀铁,使其溶解于水,再加入氨水调节pH至7~8,可使Fe3+转变为Fe(OH)3沉淀而除去。
离子方程式:I-(aq)+AgCl(s) AgI(s)+Cl-(aq)
CKs.p再=加c相(A入g难+等)·溶c(电C时l解-) 质,,溶即液中建各离立子的动浓度态不变平衡,称为沉淀溶解平衡。
混合
反应沉淀
并非神仙才能烧陶器,有志的人总可以学得精手艺。
寄言燕雀莫相唣,自有云霄万里高。
鸟不展翅膀难高飞。
顶天立地奇男子,要把乾坤扭转来。
治天下者必先立其志。 少年心事当拿云。
部分回流
鱼跳龙门往上游。 少年心事当拿云。
沉淀物
石看纹理山看脉,人看志气树看材。 胸有凌云志,无高不可攀。
处理设备
追踪着鹿的猎人是看不见山的。
二、知识讲解——沉淀溶解平衡的应用 3、沉淀的转化
【实验3-4】 (1)向盛有2 mL 0.1 mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶
液,观察并记录现象。 (2)振荡试管,然后向其中滴加4滴0.1 mol/L KI溶液,观察并记录现象。 (3)振荡试管,然后再向其中滴加8滴0.1 mol/L Na2S溶液,观察并记录
(1)如果要除去某溶液中的SO42-,你选择加入钙盐还是钡盐?为什么?
离解平衡和沉淀-溶解平衡

2.盐类水解 盐类水解 (1) 配制试剂及初步实验: ) 配制试剂及初步实验: 配制100ml0.1mol/L的 NaCl 、 NaAc、 NH4Cl 、 配制 的 、 NH4Ac溶液、用pH试纸和 计测定其 、一 溶液、 试纸和pH计测定其 溶液 试纸和 计测定其pH、 并测出蒸馏水的pH。 并测出蒸馏水的 。 在两支试管中各加入3mL蒸馏水、然后分别加入少 蒸馏水、 在两支试管中各加入 蒸馏水 量固体Fe(NO3)•9H2O和BiCl3、振荡、观察现 振荡、 量固体 和 测其pH值 解释之。 象、测其 值、解释之。 溶液、 (2)取上面制得的 )取上面制得的NaAc溶液、加1滴酚酞指示 溶液 滴酚酞指示 加热、观察溶液颜色变化、并解释之。 剂、加热、观察溶液颜色变化、并解释之。
KI(0.1mol / L、 0. 001mol / L)、 AgNO3 、 、 (0.1mol / L )、 K2CrO4 (0.1mol/ L) 、 MgCl2 (0.1mol /L)、 、 、 Na2SO4 (0.5mol/ L)、 Pb(NO3 )2 (0.001mol / L、 、 、 0. 1mol/ L)、 NH4Cl (1 mol /L)、 ZnCl2 (0.1 mol / L)、 、 、 、 NaF (0.1 mol / L)、 NaAc (0.1 mol /L)、 CaCl2(0.1 mol / 、 、 L、 0.5 mol / L)、 Na2CO3(饱和 、PbCl2(饱和)、 饱和) 饱和)、 、 、 饱和 饱和 NaCl(饱和)、( 饱和)、( 饱和) 饱和)、(NH4)2C2O4(饱和) 指示剂:酚酞、 指示剂:酚酞、甲基橙 材料: 试纸 材料:pH试纸
6.分步沉淀 分步沉淀 溶液和2滴 (1)在试管中加入 滴0.1 mol/L Pb(NO3)2溶液和 滴 )在试管中加入1滴 滴逐滴加入0.1 mol/L KI溶液, 溶液, 0.1 mol/L AgNO3,再加入 滴逐滴加入 溶液 ,再加入1滴逐滴加入 观察沉淀的颜色和形状、 观察沉淀的颜色和形状、根据沉淀颜色的变化和溶度 积规则,判断哪一种难溶物先沉淀? 积规则,判断哪一种难溶物先沉淀?
电离平衡PPT下载2

3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
2、在0.1mol/L醋酸溶液分别:加热、加入少 量盐酸、加入少量氢氧化钠、加入醋酸铵晶体,
电离平衡会怎样移动?溶液中c(H+)怎样变化?
3、强电解质溶液中有无可能存在电离平衡?
问题:怎样定量的比较弱电解质的相
对强弱?电离程度相对大小怎么比较?
三、电离平衡常数(K)
看课本自学相关内容并思考: (1)什么叫电离平衡常数? (2)电离平衡常数的化学含义是什么? (3)怎样用电离平衡常数比较弱电解质的相 对强弱? (4)影响电离平衡常数的因素是什么?
就电离本身而言,你推测每一步的电离程
度如何变化,为什么?
电离平衡及沉淀溶解平衡

Al(H2O)63++H2O
④非水溶剂中的酸碱反应是质子传递反应. H+
HCl(g)+NH3 (g)=====NH4Cl(s)
H+ CH3CH2OH2+ + HSO4H2SO4 + CH3CH2OH 1923年,美国化学家Lewis提出 ,用来 解释配合物的形成, 1-3、Lewis酸碱电子对理论 大部分阳离子,Mn2+、Al3+、Fe3+、 H+还有一些缺电子化合物(BF3) 一. 含义 酸是电子对的接受体,碱是电子对的 给予体,酸碱反应的实质就是形成配位 由于在配合物中,配位键普遍存在, lewis 酸:凡是可以接受电子对的分子、 键——形成无机化学上的另一类物质,酸 Lewis酸碱电子对理论的范围很广,凡是 碱化合物 金属阳离子皆为Lewis酸,与金属离子结 离子或原子,如Fe3+ , Fe2+, Ag+, BF3等 合的不管是阴离子或中性分子,均为碱.
配位平衡 Kf°
§4-1 酸碱理论概述
1、 1884年,瑞典化学家Arrhenius电离理论
2、1923年,丹麦化学家 Bronsted-Lowry 酸碱质子理论 3、1923年,美国化学家 Lewis 酸碱电子对理论 4、1963年,美国化学家Pearson 软硬酸碱理论(HSABT)
1-1、Arrhenius酸碱电离理论
四. 酸碱反应的实质 ——两个酸碱共轭对之间的质子传递
如HF在水溶液中的 ① 酸碱电离反应是质子传递反应 电离反应是由给出质 子的半反应和接受质 子的半反应组成的 HF(aq) H+ + F-(aq)
H+ + H2O(l) HF(aq) + H2O(l)
电离平衡课件

电离平衡ppt课件
目录
• 电离平衡的基本概念 • 电离平衡的表示方法 • 电离平衡的实验研究 • 电离平衡的应用 • 电离平衡的发展前景
CHAPTER 01
电离平衡的基本概念
电离平衡的定义
电离平衡是指在一定条件下,弱电解 质在水溶液中达到动态平衡的状态, 此时正、逆向电离速率相等,溶液中 离子浓度保持不变。
土壤改良
利用电离平衡原理,通过调节土壤的pH值和离子组成,改善土壤 的结构和肥力,提高农作物的产量和质量。
空气净化
在空气净化过程中,电离平衡理论有助于去除空气中的有害气体和 颗粒物,提高空气质量。
在生命科学中的应用
生物体内的酸碱平衡
电离平衡理论对于维持生物体内的酸碱平衡具有重要意义,对于生 物体的正常生理功能至关重要。
离子交换技术
利用电离平衡原理,通过离子交换剂将溶液中的 离子与其他离子进行交换,从而达到分离、纯化 和浓缩的目的。
药物合成与分离
在药物合成过程中,电离平衡理论对于药物的分 离和纯化具有重要意义,有助于提高药物的纯度 和收率。
在环境科学中的应用
污水处理
电离平衡理论在污水处理中发挥着重要作用,通过调节污水的pH 值和离子组成,实现污水中污染物的去除和分离。
度之比。
计算步骤
首先确定弱电解质和溶剂的种类 ,然后计算出溶液中离子浓度的 变化,最后根据离子浓度变化计
算出电离平衡常数。
注意事项
在计算电离平衡常数时,应注意 离子浓度的单位和比例尺的选择
。
CHAPTER 03
电离平衡的实验研究
实验目的和实验原理
实验目的 探究电离平衡的形成机制。
验证电离平衡的原理及其影响因素。
与环境科学的交叉
目录
• 电离平衡的基本概念 • 电离平衡的表示方法 • 电离平衡的实验研究 • 电离平衡的应用 • 电离平衡的发展前景
CHAPTER 01
电离平衡的基本概念
电离平衡的定义
电离平衡是指在一定条件下,弱电解 质在水溶液中达到动态平衡的状态, 此时正、逆向电离速率相等,溶液中 离子浓度保持不变。
土壤改良
利用电离平衡原理,通过调节土壤的pH值和离子组成,改善土壤 的结构和肥力,提高农作物的产量和质量。
空气净化
在空气净化过程中,电离平衡理论有助于去除空气中的有害气体和 颗粒物,提高空气质量。
在生命科学中的应用
生物体内的酸碱平衡
电离平衡理论对于维持生物体内的酸碱平衡具有重要意义,对于生 物体的正常生理功能至关重要。
离子交换技术
利用电离平衡原理,通过离子交换剂将溶液中的 离子与其他离子进行交换,从而达到分离、纯化 和浓缩的目的。
药物合成与分离
在药物合成过程中,电离平衡理论对于药物的分 离和纯化具有重要意义,有助于提高药物的纯度 和收率。
在环境科学中的应用
污水处理
电离平衡理论在污水处理中发挥着重要作用,通过调节污水的pH 值和离子组成,实现污水中污染物的去除和分离。
度之比。
计算步骤
首先确定弱电解质和溶剂的种类 ,然后计算出溶液中离子浓度的 变化,最后根据离子浓度变化计
算出电离平衡常数。
注意事项
在计算电离平衡常数时,应注意 离子浓度的单位和比例尺的选择
。
CHAPTER 03
电离平衡的实验研究
实验目的和实验原理
实验目的 探究电离平衡的形成机制。
验证电离平衡的原理及其影响因素。
与环境科学的交叉
酸碱平衡和沉淀平衡 ppt课件

有机化合物如乙醇CH3CH2OH可看作是(酸)和 OH-碱以配位键结合而成的酸碱配合物C2H5←OH
酸碱电子理论对酸碱的定义,摆脱了体系必须具 有某种离子或元素也不受溶剂的限制,以电子的给出 和接受来说明酸碱的反应,故它更能体现物质的本质 属性,较前面几个酸碱理论更为全面和广泛。但是由 其对酸碱的认识过于笼统,因而不易掌握酸碱的特征。
强碱具有高度接受质子的能力。如OH-、PO43离子等。
酸碱平衡和沉淀平衡
酸及其共轭碱
酸
共轭碱
名称
化学式
化学式
名称
高氯酸 硫酸
硫酸氢根 水合氢离子
水 铵离子
氨 氢溴酸
HClO4
ClO4-
H2SO4
HSO4-
HSO4-
SO42-
H3O+
H2O
H2O
OH-
NH4+
NH3
NH3
NH2-
HBr酸碱平衡和沉淀平衡Br -
酸1 碱2
酸2 碱1
弱酸给出质子的能力很弱,其共轭碱则较强, 因此反应程度很小,为可逆反应(相当于电离理论的 部分电离)。
HAc + H2O H3O++Ac-
酸1 碱2
酸2 碱1 酸碱平衡和沉淀平衡
氨和水的反应,H2O给出质子,由于H2O是弱 酸所以反应程度也很小,是可逆反应(相当于NH3在 水中的电离过程)。
(1)电离作用: 根据酸碱质子理论的观点,电离作用就是水与 分子酸碱的质子传递反应。 在水溶液中,酸电离时放出质子给水,并产生 共轭碱。
酸碱平衡和沉淀平衡
强酸给出质子的能力很强,其共轭碱则较弱, 几乎不能结合质子,因此反应几乎完全进行(相当于 电离理论的全部电离)。
酸碱电子理论对酸碱的定义,摆脱了体系必须具 有某种离子或元素也不受溶剂的限制,以电子的给出 和接受来说明酸碱的反应,故它更能体现物质的本质 属性,较前面几个酸碱理论更为全面和广泛。但是由 其对酸碱的认识过于笼统,因而不易掌握酸碱的特征。
强碱具有高度接受质子的能力。如OH-、PO43离子等。
酸碱平衡和沉淀平衡
酸及其共轭碱
酸
共轭碱
名称
化学式
化学式
名称
高氯酸 硫酸
硫酸氢根 水合氢离子
水 铵离子
氨 氢溴酸
HClO4
ClO4-
H2SO4
HSO4-
HSO4-
SO42-
H3O+
H2O
H2O
OH-
NH4+
NH3
NH3
NH2-
HBr酸碱平衡和沉淀平衡Br -
酸1 碱2
酸2 碱1
弱酸给出质子的能力很弱,其共轭碱则较强, 因此反应程度很小,为可逆反应(相当于电离理论的 部分电离)。
HAc + H2O H3O++Ac-
酸1 碱2
酸2 碱1 酸碱平衡和沉淀平衡
氨和水的反应,H2O给出质子,由于H2O是弱 酸所以反应程度也很小,是可逆反应(相当于NH3在 水中的电离过程)。
(1)电离作用: 根据酸碱质子理论的观点,电离作用就是水与 分子酸碱的质子传递反应。 在水溶液中,酸电离时放出质子给水,并产生 共轭碱。
酸碱平衡和沉淀平衡
强酸给出质子的能力很强,其共轭碱则较弱, 几乎不能结合质子,因此反应几乎完全进行(相当于 电离理论的全部电离)。
电离平衡和沉淀反应(1).ppt

pH试纸
pH=8~9 pH=11~12
固体NH4Ac一小匙 2 ml去离子水配成溶液
pH试纸
固体Al2(SO4)3一小匙
2 ml去离子水配成溶液 pH试纸
pH=6~7 pH=3~4
(2)温度对水解平衡的影响
3
固体NaAc一小匙
ml去离子水配成溶液
溶液无色
加热沸腾
溶液微红
加数滴酚酞 透明
色透明
加热沸腾
解释现象
(2)同离子效应:
3d甲基橙
2 ml 0.10mol/L HAc
溶液变红色少量NH4Ac固体溶液变橙黄色
3d甲基橙
2 ml 0.10mol/L NH3H2O
溶液变红色少量NH4Ac固体溶液变无色
解释现象
(3)缓冲溶液:
3 ml 0.10mol/L HAc百里酚蓝 溶液呈橙色 混合
3 ml 0.10mol/L NaAc 百里酚蓝 溶液呈黄色
稀释到2ml
5d 0.10mol/L K2CrO4
搅拌均匀
离心后底部有白色沉淀
去上层清液
砖红色沉淀生成
清液中加 0.10mol/L AgNO3数滴
(4)沉淀的转化:
加0.10mol/L NaCl 至
A 砖红色 AgCrO4 沉淀
砖红色沉淀全部转化为
白色 AgCl 沉淀
B 黑色 PbS 沉淀
加5%H2O2 1ml 震荡
思考题
1. 能否用酚酞指示剂验证HAc-NaAc的同离子效应 而用甲基橙来验证NH3·H2O-NH4Cl的同离子效应? 为什么? 2. 缓冲溶液为何具有抗酸和抗碱的能力?这种能力 是否无限限制的?
J Ksp , 不饱和状态,无沉淀析出
pH=8~9 pH=11~12
固体NH4Ac一小匙 2 ml去离子水配成溶液
pH试纸
固体Al2(SO4)3一小匙
2 ml去离子水配成溶液 pH试纸
pH=6~7 pH=3~4
(2)温度对水解平衡的影响
3
固体NaAc一小匙
ml去离子水配成溶液
溶液无色
加热沸腾
溶液微红
加数滴酚酞 透明
色透明
加热沸腾
解释现象
(2)同离子效应:
3d甲基橙
2 ml 0.10mol/L HAc
溶液变红色少量NH4Ac固体溶液变橙黄色
3d甲基橙
2 ml 0.10mol/L NH3H2O
溶液变红色少量NH4Ac固体溶液变无色
解释现象
(3)缓冲溶液:
3 ml 0.10mol/L HAc百里酚蓝 溶液呈橙色 混合
3 ml 0.10mol/L NaAc 百里酚蓝 溶液呈黄色
稀释到2ml
5d 0.10mol/L K2CrO4
搅拌均匀
离心后底部有白色沉淀
去上层清液
砖红色沉淀生成
清液中加 0.10mol/L AgNO3数滴
(4)沉淀的转化:
加0.10mol/L NaCl 至
A 砖红色 AgCrO4 沉淀
砖红色沉淀全部转化为
白色 AgCl 沉淀
B 黑色 PbS 沉淀
加5%H2O2 1ml 震荡
思考题
1. 能否用酚酞指示剂验证HAc-NaAc的同离子效应 而用甲基橙来验证NH3·H2O-NH4Cl的同离子效应? 为什么? 2. 缓冲溶液为何具有抗酸和抗碱的能力?这种能力 是否无限限制的?
J Ksp , 不饱和状态,无沉淀析出
酸碱电离及沉淀平衡.pptx
K1θ
H+ +
〔ce
S2-
q(H ) cθ〕〔 ceq( HS〔ceq(H2S) cθ〕
)
cθ〕 1.3107
Kθ2
〔ce
q(H ) cθ〕〔 ceq(S2- ) 〔ceq( HS- ) cθ〕
cθ〕 7.11015
●KӨ1 、 KӨ2分别为H2S的第一级和第二级电离常数。
● KӨ1 >> KӨ2 ,ceq(H+)的计算只考虑其第一级离解,
实验值 i 计算值
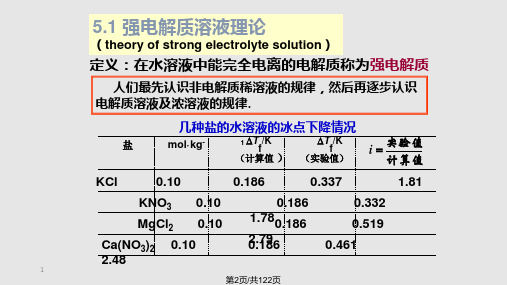
KCl
0.10
0.186
0.337
1.81
KNO3 0.10
0.186
0.332
MgCl2 0.10 1.780.186
0.519
Ca(NO3)2 0.10
02..17896
0.461
2.48
1
第2页/共122页
1887年,Arrhenius 电离理论中解释: ●电解质在水溶液中是电离的. ●电离“似乎”又是不完全的.
18
第19页/共122页
【解】: HAc是一元弱酸,
ca/ KӨa = 0.1/1.76×10-5 >>500 其c (H+) 计算可以简化
c[ H ] cθ
K
θ a
c
cθ
=1moldm3 1.76105 0.1moldm3 / 1moldm3
=1.33103 moldm3
pH=p2H.881 2
5
第6页/共122页
6
Example
求下列1溶液的离子强度.
(1) 0.01 mol·dm-3的BaCl2的溶液. (2) 0. 1 mol·dm-3盐酸和0. 1 mol·dm-3CaCl2溶液等体积 混合 后形成的溶液.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在一定条件下,如果溶液中含有多种离子,且都能 与所加沉淀剂反应生成沉淀,形成沉淀物的溶解度又相 差较大,在这种情况下向溶液中缓缓加入沉淀剂,Q先 达到Ksp的化合物首先析出,这种先后沉淀的过程称为分 步沉淀,在实际工作中常利用分步沉淀进行离子间的分 析和分离。
在含有沉淀的溶液中,加入适当的试剂,使之与某 一离子结合生成另一种更难溶的沉淀,这一过程称为沉 淀的转化。
实验五 电离平衡与沉淀反应
实验目的:
1、通过实验,理解电离平衡、水解平衡、 沉淀平衡和同离子效应的基本原理;
2、学习缓冲溶液的配制方法; 3、掌握沉淀的生成、溶解和转化的条件; 4、掌握离心机的使用方法。
实验原理:
1. 电离平衡
弱电解质在水溶液中仅部分电离,它们的电离 过程是可逆的,存在着未电离的分子与电离出来的 离子间的电离平衡,例如醋酸(HAc):
实验注意事项:
1、取用试剂要看清标签,滴头与滴瓶一一对应, 不要放错。 2、仔细观察实验现象。 3、少量溶液与沉淀的分离用离心分离法,注意离 心试管的对称放置。
思 考 题:
1、NaHCO3溶液是否具有缓冲能力? 答:NaHCO3溶液具有缓冲能力。 HCO3- H++CO32加H+时,H++CO32- HCO3加OH-时,H+减少,HCO3-解离出H+来补充。
1mL 0.1mol·L-1 HAc+1滴甲基橙+ 少量NaAc(s)
实验 现象
解释和结论
2. 5滴 0.1mol·L-1 MgCl2 +5滴2mol·L-1 NH3·H2O
5滴0.1mol·L-1 MgCl2 +5滴 饱和NH4Cl + 5滴 2mol·L-1 NH3·H2O 二.缓冲溶液的配制和
5mL蒸馏水 +1滴 1mol·L-1NaOH,测其 pH值
三.盐的水解
1. 用pH试纸试验0.1mol·L-1 Na2CO3, NaCl, Al2(SO4)3溶液的酸碱性
2. 测定0.1mol·L-1 Na3PO4, Na2HPO4, NaH2PO4溶液的pH值
3. BiCl3(s)+1mL蒸馏水, 现象?酸碱性?加 6mol·L-1HCl, 现象?再稀释,现象?
四. 溶度积原理的应用
(1) 沉淀的生成
1mL 0.1mol·L-1 Pb(N03)2 +1mL 0.1mol·L-1KI, 有无沉淀? 1mL 0.001mol·L-1 Pb(N03)2+1mL0.001mol·L-1 KI,有无沉淀?
(2)沉淀的溶解 自行设计方案制取: CaC2O4、AgCl、CuS
Ksp(AmBn) = [An+]m[ Bm-]n Ksp(AmBn)称为溶度积,在一定温度下,AmBn饱和溶 液中,Ksp(AmBn)为一常数。 [An+],[ Bm-]分别表示达到平衡时两种离子的浓度。
将任意溶液中实际离子浓度的幂次方乘积定义为 离子积,用Q表示
Q = [An+]m[ Bm-]n 那么离子积Q与溶度积Ksp之间有以下关系,称溶 度积规则: Q>Ksp 过饱和溶液,可能析出沉淀; Q=Ksp 饱和溶液,处于沉淀溶解平衡; Q<Ksp 不饱和溶液,沉淀溶解。 所以,增加沉淀剂离子浓度,使Q>Ksp即可析出沉淀; 减少溶液中离子的浓度,使其Q<Ksp即可使沉淀溶解。
(1)用生成弱电解质的 方法溶解CaC2O4沉淀 (2)生成配离子的方法 溶解 AgCl沉淀 (3)用氧化还原的方法 溶解CuS
(3)分步沉淀
0.5mL0.1mol·L-1 NaCl,
+ 0.5mL0.05mol·L-1
K2CrO4,逐滴加入 0.1mol·L-1AgNO3,现 象?解释
(4)沉淀的转化 5滴0.1mol·L-1AgNO3 +6滴0.1mol·L-1 NaCl, 何颜色的沉淀?取沉 淀+0.1mol·L-1 Na2S, 现象?
pK
θ a
lg
c(HAc) c(Ac )
4. 水解平衡
盐的离子与溶液中水电离出的H+离子或OH-离子 作用产生弱电解质的反应,叫做盐的水解。
5. 沉淀溶解平衡
沉液中相应的离子之间建立了多相离子 平衡。
AmBn(s)
溶解 沉淀
mAn+(aq) + nBm-
H A C H + + A c -
2. 同离子效应
弱电解质溶液中,加入含有与弱电解质相同离子的 另一强电解质时,使弱电解质的电离程度减小,这种 效应为同离子效应。
3. 缓冲溶液
弱酸(碱)及其盐的混合液在一定的程度上可抵 抗外来的少量的酸、碱或稀释作用,使溶液的pH值 改变很小,这种溶液叫缓冲溶液。
2、试解释为什么NaHCO3水溶液呈碱性, 而NaHSO4水溶液呈酸性?
答:NaHCO3水溶液以水解为主: HCO3-+H2O H2CO3+OHNaHSO4水溶液以电离为主: HSO4- SO42-+H+
下次实验项目
滴定操作练习 请预习:P107-110
P25-26 41-44
实验内容:
实验步骤
离心机
使用时,将装试样的离心管放在 离心机的套管中,几个离心管放在对 称的位置上,如果是单数个试样,则 在对称的位置上放一支离心管,管内 装等量的水。放好离心管后,应盖好 盖子。先慢速后加速,停止时应逐步 减速,最后任其自行停下,决不能用 手强制它停止。
实验内容:
实验步骤
一.同离子效应
1. 1mL 0.1mol·L-1 HAc+1滴甲基橙
性质
1. 8.5mL 1mol·L-1HAc
+1.5mL 1mol·L-1 NaAc
组成缓冲溶液,用pH
试纸测其pH值。
2. 5mL缓冲溶液+1滴1 mol·L-1HCl,测其pH 值。
5mL缓冲溶液+1滴 1mol·L-1NaOH,测其 pH值。
3. 测蒸馏水的pH值; 5mL蒸馏水 +1滴
1mol·L-1HCl,测其pH 值;
弱酸及其盐(如HAc-NaAc、H2CO3-NaHCO3)、 多元弱酸酸式盐及其次级盐(NaH2PO4-Na2HPO4、 NaHCO3-Na2CO3)、弱碱及其盐(NH3·H2O-NH4Cl) 都有缓冲作用。
缓冲溶液的pH值(以HAc和NaAc为例)可用下式计算:
pH
pK
θ a
lg
c(酸) c(盐)
