2020年高考化学难点专练8 晶胞的相关计算{带解析}
2022年高考化学晶胞的相关计算专项训练与热点解答题组合练及解析

2022年高考化学晶胞的相关计算专项训练与热点解答题组合练及解析一、晶胞的相关计算1.2020年,自修复材料、自适应材料、新型传感材料等智能材料技术将大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)我国科研工作者基于丁二酮肟氨酯基团的多重反应性,研制了一种强韧、自愈的超级防护材料,其中的分子机制如图所示。
Cu在元素周期表中位于_____区,M层中核外电子能量最高的电子云在空间有_____个伸展方向。
C、N、O第一电离能由大到小的顺序为_____________(2)氧化石墨烯基水凝胶是一类新型复合材料,对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:还原石墨烯中碳原子的杂化形式是______,上图中氧化石墨烯转化为还原石墨烯时,1号C 与其相邻 C原子间键能的变化是_____________(填“变大”、“变小”或“不变”),二者当中在水溶液中溶解度更大的是____________ (填物质名称),原因为__________________(3)砷化硼是近期受到广泛关注一种III—V半导体材料。
砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:B:(0,0,0);(,,0);(,0,);(0,,);……As:(,,);(,,);(,,);(,,)请在图中画出砷化硼晶胞的俯视图...........___________,已知晶体密度为dg/cm3,As半径为a pm,假设As、B原子相切,则B原子的半径为_________pm(写计算表达式)。
2.浙江师范大学的研究团队研究获得了一类具有高活性和选择性的钙钛矿光催化剂(3CsPbBr Ni(tpy)-),这一成果发表在2020年1月Chem . Mater .上。
带有负电荷的CsPbBr 3将带正电的Ni(tpy)固定在其表面,用于可见光驱动CO 2还原。
(1)写出Ni 基态原子的价电子排布图(轨道表达式)___________________。
高考化学晶胞的相关计算专项训练与热点解答题组合练附解析

高考化学晶胞的相关计算专项训练与热点解答题组合练附解析一、晶胞的相关计算1.2Mg Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。
下列叙述错误的是()A.Si的配位数为8B.紧邻的两个Mg原子的距离为0.635 2nmC.紧邻的两个Si原子间的距离为20.6352⨯nmD.2Mg Si的密度计算式为()337A76g cm0.63510N--⋅⨯2.Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为________。
(2)配合物K4Fe(CN)6的中心离子的价电子排布图为______,该中心离子的配位数是_______。
(3)1mol HCN分子中含有σ键的数目为_______,HCN分子中碳原子轨道杂化类型是_______,与CN-互为等电子体的阴离子是_______。
(4)K2CO3中阴离子的空间构型为_________,其中碳原子的价层电子对数为____________。
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞中有________个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为_______ (用N A表示阿伏加德罗常数的值)。
3.据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。
请回答下列问题:(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
2020年高考化学模拟试题(八)含答案及解析

2020年高考化学模拟试题(八)满分100分。
考试时间50分钟★祝考试顺利★注意事项:1.答题前,请考生认真阅读答题卡上的注意事项。
务必将自己的姓名、考号填写在答题卡上指定位置,贴好考号条形码或将考号对应数字涂黑。
用2B铅笔将试卷类型A填涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B铅笔把对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
答在试题卷、草稿纸上无效。
3.非选择答题用0.5毫米黑色墨水签字笔直接答在答题卡上每题对应的答题区域内,答在试题卷、草稿纸上无效。
4.考生必须保持答题卡的清洁。
考试结束后,监考人员将答题卡和试卷一并收回。
可能用到的相对原子质量(相对原子量):H-1 C-12 N-14 O-16 Na-23 Ca-40 P-31 Zn-65第Ⅰ卷(选择题共42分)一、选择题(本卷共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)7.下列对生活中的一些问题的论述,符合科学实际的是()A.大米中的淀粉经水解和分解后,可酿造成米酒B.麦芽糖、纤维素和油脂均能在人体中发生水解C.乙醇、乙酸均属于食物中的两种基本营养物质D.用加洗衣粉洗涤真丝织品,可使真丝蛋白质变性8.用来减轻感冒症状的布洛芬的结构简式如下图所示,下列有关说法正确的是()A.布洛芬与苯甲酸甲酯是同系物B.布洛芬的分子式为C13H20O2C.布洛芬苯环上的二溴代物有2种不含立体异构D.1mol布洛芬能与足量NaHCO3溶液反应最多生成1mol CO29.N A为阿伏加德罗常数的值,下列说法不正确的是()A.标准状况下,2.24L三氯甲烷中所含分子数为N AB.2.8g乙烯与聚乙烯的混合物中含有的极性键为0.4N AC.将1mol NH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH+4的数目为N AD.162g淀粉完全水解后产生的葡萄糖分子数目为N A10.短周期主族元素R、X、Y、Z的原子序数依次增大,化合物M、N均由这四种元素组成,且M的相对分子质量比N小16。
高考化学晶胞的相关计算专项训练知识点及练习题附解析

高考化学晶胞的相关计算专项训练知识点及练习题附解析一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg、Ni、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、“等于”或“小于”),理由是_____________________。
化学晶胞的相关计算专项训练试题含答案

化学晶胞的相关计算专项训练试题含答案一、晶胞的相关计算1.已知某离子晶体的晶胞示意图如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数的值为N A,晶体的密度为dg/cm3下列说法中正确的是A.晶体晶胞中阴、阳离子的个数都为1B.晶体中阴、阳离子的配位数都是4C.该晶胞可能是NaCl的晶胞D.该晶体中两个距离最近的阳离子的核间距为4M/(N A d)cm2.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
3.氮及其化合物有许多用途。
回答下列问题:(1)基态Mn 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
高考化学的晶胞的相关计算专项训练及答案

高考化学的晶胞的相关计算专项训练及答案一、晶胞的相关计算1.Mg 、Ni 、Cu 、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg 、Ni 、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu 、Zn 的原子结构比较第一电离能:I 1(Cu)_________ I 1(Zn)(填“大于”、 “等于”或“小于”),理由是_____________________。
(3)[Ni(NH 3)6](NO 3)2 中不存在的化学键为___________(填序号)。
a .离子键b .金属键c .配位键d .氢键(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
该合金储氢后,H 2 与 Ni 的物质的量之比为___________。
②Mg 2NiH 4 是一种储氢的金属氢化物。
在 Mg 2NiH 4 晶胞中,Ni 原子占据如图乙的顶点和面心,Mg 2+处于乙图八个小立方体的体心。
Mg 2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。
晶体的密度为ρg·cm -3,N A 表示阿伏加德罗常数,Mg 2+和 Ni 原子的最短距离为__________cm(用含ρ和 N A 的代数式表示)。
2.氮及其化合物有许多用途。
回答下列问题:(1)基态Mn 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)3NCl 的沸点(71℃)比HCN 的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,3NCl 、2NH -、2NO -三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
高考化学晶胞的相关计算专项训练知识点-+典型题及答案

高考化学晶胞的相关计算专项训练知识点-+典型题及答案一、晶胞的相关计算1.已知某离子晶体的晶胞示意图如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数的值为N A,晶体的密度为dg/cm3下列说法中正确的是A.晶体晶胞中阴、阳离子的个数都为1B.晶体中阴、阳离子的配位数都是4C.该晶胞可能是NaCl的晶胞D.该晶体中两个距离最近的阳离子的核间距为4M/(N A d)cm2.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
3.物质的组成与结构决定了物质的性质与变化。
回答下列问题:(1)基态铁原子简化的电子排布式为[Ar]___。
高中化学晶胞的相关计算专项训练专题复习含解析
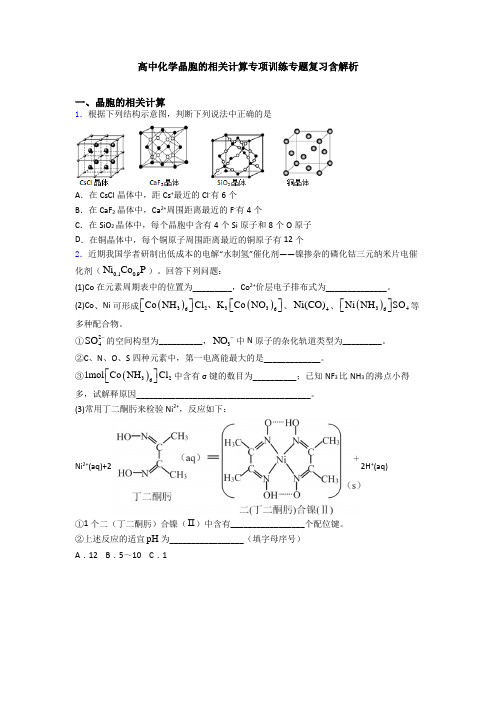
高中化学晶胞的相关计算专项训练专题复习含解析一、晶胞的相关计算1.根据下列结构示意图,判断下列说法中正确的是A .在CsCl 晶体中,距Cs +最近的Cl -有6个B .在CaF 2晶体中,Ca 2+周围距离最近的F -有4个C .在SiO 2晶体中,每个晶胞中含有4个Si 原子和8个O 原子D .在铜晶体中,每个铜原子周围距离最近的铜原子有12个2.近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(0.10.9Ni Co P )。
回答下列问题:(1)Co 在元素周期表中的位置为_________,Co 2+价层电子排布式为______________。
(2)Co 、Ni 可形成()()323366Co NH Cl K Co NO ⎡⎤⎡⎤⎣⎦⎣⎦、、4Ni(CO)、()346Ni NH SO ⎡⎤⎣⎦等多种配合物。
①24SO -的空间构型为__________,3NO -中N 原子的杂化轨道类型为_________。
②C 、N 、O 、S 四种元素中,第一电离能最大的是_____________。
③()3261mol Co NH Cl ⎡⎤⎣⎦中含有σ键的数目为__________;已知NF 3比NH 3的沸点小得多,试解释原因________________________________________。
(3)常用丁二酮肟来检验Ni 2+,反应如下: Ni 2+(aq)+2 2H +(aq) ①1个二(丁二酮肟)合镍(Ⅱ)中含有_________________个配位键。
②上述反应的适宜pH 为_________________(填字母序号)A .12B .5~10C .1(4)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。
已知磷化硼晶体密度为-3ρ g cm ,计算晶体中硼原子和磷原子的最近核间距为___________cm 。
化学化学晶胞的相关计算专项训练试题及答案

化学化学晶胞的相关计算专项训练试题及答案一、晶胞的相关计算1.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。
制备石墨烯方法有石墨剥离法、化学气相沉积法等。
石墨烯的球棍模型及分子结构示意图如下:(1)下列有关石墨烯说法正确的是_____。
A 石墨烯的结构与金刚石相似B 石墨烯分子中所有原子可以处于同一平面C 12g 石墨烯含σ键数为 N AD 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:_____。
②乙醇沸点比氯乙烷高,主要原因是___________________。
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:_______ 。
④含碳源中属于非极性分子的是______________(填序号)a 甲烷b 乙炔c 苯d 乙醇⑤酞菁与酞菁铜染料分子结构如下图,组成酞菁铜染料分子的元素,酞菁变成酞菁铜,分子中多了什么作用力_____,酞菁铜分子中设计到的元素,电负性由小到大依次为_____2.Ⅰ.过渡金属元素性质研究在无机化学中所占的比重越来越大。
(1)铜元素在周期表的位置是______。
(2)比较NH3和[Cu(NH3)2]2+中H-N-H键角的大小:NH3______[Cu(NH3)2]2+(填“>”或“<”),并说明理由______。
(3)铜金合金是一种储氢材料,晶胞参数anm,面心立方堆积,铜原子在晶胞的面心位置,金原子在晶胞的顶点位置。
已知阿伏加德罗常数的数值为N A,铜、金的摩尔质量分别为M(Cu)、M(Au),该晶体的密度为______g/cm3;氢原子可以进入到铜原子和金原子构成的四面体的空隙中,该材料储满氢后的化学式为______。
(4)研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1,在图中画出由钒离子形成的配合物中的配位键______。
2024年高考化学一轮考点热点专攻8 晶胞参数和坐标参数的分析及应用

1
3×8×2=12。
(2)由晶胞结构可知,1 个晶胞中含 1 个 CaTiO3,晶胞的质量为
体积 V=a pm =a ×10
3
1.36
NA= 3 ×1032
3
3
mol-1。-30ຫໍສະໝຸດ 3cm ,根据晶胞密度
136
m=
A
ρ= ,则阿伏加德罗常数
g,晶胞的
热点探究
出计算式)。
mol-1(列
答案
1 1
(1)( , ,0)
2 2
解析 (1)1、3
1 1
(0, , )
2 2
12
1.36
(2) 3 ×1032
1 1
1 1
号氧原子的坐标为(2 , 2,0)、(0,2 , 2);与晶胞顶点
Ca 距离最近的
O 位于与该顶点相交的 8 个晶胞的 3 个面上,因每个面被 2 个晶胞共用,则与
2 2 2
pm,则B点原子的分数坐标为
答案 (1)2
(2)(0,0, )
1 2
2
;晶胞中A、B间距离d=
Xe—F 键长为 r
pm。
+ ( -)2
2
解析 (1)题图中大球的个数为
1
8×8+1=2,小球的个数为
1
8×4+2=4,根据
XeF2 的
原子个数比推知,大球代表 Xe 原子,小球代表 F 原子,该晶胞中有 2 个 XeF2
2.48×10
a3×10-30 cm3,则晶体密度= 3
A
g·cm-3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
难点8 晶胞的相关计算【命题规律】本专题是选作题,物质结构与性质部分的考查内容,通常是根据晶体晶胞的结构特点和有关数据,确定晶体的化学、求算晶体的密度或晶体晶胞的体积,题型是填空题,难度中等。
考查的核心素养以宏观辨识与微观探析为主。
【备考建议】2020年高考备考要切实地回归课本,狠抓知识要点,强化主干知识的巩固和运用。
【限时检测】(建议用时:30分钟)1.(2019·安徽省六安市第一中学高考模拟)B、N、Co均为新型材料的重要组成元素。
请回答下列问题。
(1)基态氮原子的价电子排布图为________________。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ 键的数目为_____________。
②与CNO—互为等电子体的分子为_____________。
(任写一种,填化学式)(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子,已知NF3和NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配合离子,其原因是_______。
(4)分子中的大π键可用符合πm n 表示,其中m表示形成大π 键的原子数,n表示参与形成大π 键的电子数(如苯分子中的大π键可表示为π66)。
则NO3-中的大π键应表示为________________。
(5)多硼酸根的结构之一为链状(如图),其化学式为____________。
(6)氮化硼晶体有多种结构,其中立方氮化硼具有金刚石的结构(如图)。
若晶胞边长为a nm,晶胞中N原子位于B原子所形成的正四面体的体心,则B—N键的键长为____nm,这种氮化硼晶体的密度为______g/cm3 。
(用含有a 和N A的代数式表示)【答案】(1)(2)18N A CO2或N2O(3)电负性F>N>H,NH3中氮原子显-3价,而在NF3中氮原子显+3价,高度缺电子,不易提供孤电子对给Cu2+的空轨道形成配位键(4)64π(5)BO 2- (6)3•a 4233110A a N ⨯ 【详解】(1)N 是7号元素,根据原子构造原理可知N 核外电子排布式是1s 22s 22p 3,价电子排布式是2s 22p 3,所以基态氮原子的价电子排布图为;(2)①1个Co 3+与6个CNO-形成6个配位键,属于σ键,1个CNO -含有2个σ键,故1个[Co(CNO)6]3-含有18个σ键,所以1mol 该离子中含有σ 键的数目为18N A ;②与CNO -互为等电子体的分子可以用O 原子替换N 原子与1个单位负电荷,其电子体为CO 2或N 2O ;(3)往CuSO 4溶液中加入过量氨水,可生成[Cu(NH 3)4]2+ 配离子,是由于中心离子Cu 2+有空轨道,NH 3分子中N 原子由孤对电子,N —H 偏向N 原子一方,N 原子周围相对来说电子多,而NF 3和NH 3的空间构型尽管都是三角锥型,但电负性F>N>H ,在NH 3中氮原子显-3价,而在NF 3中氮原子显+3价,高度缺电子,不易提供孤电子对给Cu 2+的空轨道形成配位键,所以NF 3不易与Cu 2+形成配合离子;(4)中NO 3-中的大 π键是每个O 原子提供1个电子,每个N 原子提供3个电子形成,所以成键原子数是4,成键电子数是6,故NO 3-中的大 π键表示为64π;(5)由均摊法,可知每个B 原子独自占有2个O 原子,B 元素化合价为+2,O 元素化合价为-2,多硼酸根的化合价代数和为3n+2×n(-2)=-n ,故多硼酸根组成可表示为:(BO 2)n n-,也可写为BO 2 -; (6)晶胞边长为anm ,则立方氮化硼的结构可知晶胞中N 原子位于B 原子所形成的正四面体的体心,可看作是将晶胞均分为8个小立方体,B —N 键的键长为晶胞体对角线的14,由于晶胞边长为anm ,3,所以B —N 键的键长3•a 4nm ; 一个晶胞中含有B 原子数目为:4;含有N 原子数目为118682⨯+⨯=4,即一个晶胞中含有4个BN ,所以晶胞的密度为()()3741114ρ10A g N m V a cm -+==⨯=233110A a N ⨯g/cm 3。
2.(2019·湖北省黄冈中学高考模拟)镍及其化合物是重要的合金材料和催化剂。
请回答下列问题:(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH 3)6]2+等。
下列说法正确的有___。
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-B.NH3的空间构型为平面三角形C.Ni2+在形成配合物时,其配位数只能为4D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。
该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“•••”分别表示出配位键和氢键。
_____(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。
属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“”)和四面体空隙(“”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNi x H y。
①LaNi x合金中x的值为_____;②晶胞中和“”同类的八面体空隙有___个,和“”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,N A=6.0×1023,=1.7)【答案】(1)3d84s2 5(2)A(3)(4)6 离子所带电荷数越高,离子半径越小,则晶格能越大,熔点越高(5)5 3 6 0.18【解析】【分析】(1)依据Ni的最外层电子排布式作答;(2)A. CO与N2互为等电子体,互为等电子体的两种物质结构相似;B. 依据价层电子对互斥理论和杂化轨道理论作答;C. 找出[Ni(CN)4]2-和[Ni(NH3)6]2+两种配合物的配体个数;D. 依据杂化轨道理论分析其杂化类型;(3)依据配位键与氢键的存在原子种类分析;(4)NiO的晶体结构类型与氯化钠相同;从离子晶体的晶格能角度分析熔点高低;(5)①利用均摊法求出晶胞中La与Ni的原子个数比,进而得出化学式;②根据空间构型分析作答;③结合几何关系,找出六方晶胞的体积,再依据密度公式作答。
【详解】(1)Ni为28号元素,价电子排布式为3d84s2,排布时能量最高的电子所占的能级为3d,3d轨道有5个伸展方向,故答案为:3d84s2;5;(2)A. CO、CN-与N2互为等电子体,N2分子内含1个σ键和2个π键,A项正确;B. NH3中N原子为sp3杂化方式,VSEPR模型为四面体形,空间构型为三角锥形,B项错误;C. [Ni(CN)4]2-和[Ni(NH3)6]2+中的Ni的化合价为+2价,其配位数分别是4和6,C项错误;D. [Ni(CN)4]2-为正四面体,采用sp3杂化,而[Ni(NH3)6]2+是正方形,不是sp3杂化方式,D项错误;故答案选A;(3)中心原子提供空轨道,配体提供孤电子对形成配位键;氢键存在于已经与N、O和F等电负性很强原子形成的共价键的H与另外的N、O和F等电负性很大的原子之间,则可以为:;(4)氯化钠中钠离子和氯离子的配位数分别是6,NiO 的晶体结构类型与氯化钠相同,NiO 晶胞中Ni 和O 的配位数分别6,影响离子晶体熔点的因素有离子半径和电荷,所带电荷数越高,离子半径越小,则晶格能越大,熔点越高;(5)①该晶体的晶胞不是六棱柱,而是实线部分表示的平行六面体,各原子在晶胞中的位置可参照图a 和b ,如果将平行六面体抽取出来,晶胞如下图所示,,La 在顶点,Ni 在面心有4个(其中顶层和底层各2个,均摊后各1个,前后左右4个面各1个,均摊后共2个)和体心(1个),所以晶体化学式为LaNi 5,x=5,②其正八面体空隙和四面体型空隙的位置如下图所示:,(若以空心球表示原子,实心球表示空隙的中心,则正八面体结构为,四面体结构为:;③六方晶胞体积V=a 2csinθ=(500×10-10)2×400×10-10×sin60°=8.5×10-23 cm 3,2332391m 610ρ=0.18g/cm V 8.510-⨯⨯==⨯。
3.(2019·东北育才学校科学高中部高考模拟)钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的钴、硅、锰、磷、硫等元素。
请回答下列有关问题:(1)基态Mn 原子的价电子排布式为___________。
Mn 2+与Fe 2+中,第一电离能较大的是__________,判断的理由是_____________________________________。
(2)碳元素除可形成常见的氧化物CO 、CO 2外,还可形成C 2O 3(结构式为)。
C 2O 3中碳原子的杂化轨道类型为___________,CO 2分子的立体构型为___________。
(3)酞菁钴分子的结构简式如图所示,分子中与钴原子通过配位键结合的氮原子的编号是______(填“1” “2” “3”或“4”)其中C 、H 、O 元素电负性由大到小的顺序是_________________________(4)碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,是碳酸根分解为CO 2分子的结果。
MgCO 3分解温度低于CaCO 3,请解释原因_________________________。
(5)氧化亚铁晶胞与NaCl 的相似,NaCl 的晶胞如图所示。
由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe 0.9O ,其中包含有Fe 2+和Fe 3+,晶胞边长为apm ,该晶体的密度为ρg·cm -3,则a=___________(列出计算式即可,用N A 表示阿伏加德罗常数的值)。
【答案】(1)3d 54s 2 Mn 2+ Mn 2+价层电子排布为3d 5,3d 能级半充满,更稳定(2)sp 2 直线型(3)2,4 O>C>H(4)半径Mg 2+<Ca 2+,MgO 晶格能大于CaO , Mg 2+更易结合碳酸根中的氧离子,故MgCO 3更易分解(51033.65641610AN ρ⨯+⨯ 【详解】(1)Mn 位于第四周期ⅦB ,其价电子包括最外层电子和次外层的d 能级,即Mn 的价电子排布式为3d 54s 2;Mn 2+价电子排布式为3d 5,Fe 2+价电子排布式为3d 6,Mn 2+价层电子排布中3d 能级半充满,更稳定,因此第一电离能较大的是Mn 2+;(2)根据C 2O 3的结构式,C 有3个σ键,无孤电子对,因此C 的杂化类型为sp 2;CO 2中C 有2个σ键,孤电子对数为(4-2×2)/2=0,即CO 2杂化类型为sp ,CO 2空间构型为直线型; (3)N 形成3个共价键达到饱和,若N 有4个化学键,其中有一个是配位键,根据结构简式,2,4含有配位键,非金属性O>C>H ,则C 、H 、O 的电负性大小顺序是O>C>H ;(4)MgCO 3和CaCO 3都属于离子晶体,受热分解后生成MgO 和CaO ,也都属于离子晶体,MgCO 3分解温度低于CaCO 3,应从晶格能的角度分析,原因是半径Mg 2+<Ca 2+,MgO 晶格能大于CaO , Mg 2+更易结合碳酸根中的氧离子,故MgCO 3更易分解;(5)根据氯化钠晶胞,NaCl 的晶胞中有4个“NaCl”,Fe 0.9O 晶胞与NaCl 晶胞的相似,因此该晶体中有4个“Fe 0.9O”,晶胞的质量为A 4g N ⨯⨯(560.9+16),晶胞的体积(a×10-10)cm 3,根据密度的定义,ρ=A 4(560.916N a ⨯⨯+⨯-103)(10),得出a=103A3.65641610ρN ⨯+⨯⨯。
