混合气体的爆炸极限怎么计算
常见气体的爆炸极限及爆炸极限计算公式

爆炸极限计算方法:比较认可的计算方法有两种:莱·夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理·查特里公式理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.369德迈数据计算:废气风量:19000Nm3/h废气中可燃性成分:戊烷7kg/h;甲醛29kg/h,其它约5kg/h(当甲醛计算)戊烷体积=7000/72*22.4/1000=2.178 Nm3/h 体积分数=2.178/19000=0.012% 甲醛体积分数=25.39 Nm3/h 体积分数=25.39/19000=0.134% 混合气体中可燃气体的总体积分数=0.146%由公式:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)得:混合气体的爆炸下限=0.146%/(0.012/1.7+0.134/7)=5.57%结论:混合气体中可燃气体的总体积分数为0.146%,混合气体的爆炸下限为5.57%,可燃气体浓度是爆炸下限浓度的1/38,放心烧吧!。
可燃气体混合物爆炸极限计算

可燃气体混合物爆炸极限计算
可燃气体混合物爆炸极限计算分为上爆极限和下爆极限两种。
上爆极限计算:
上爆极限是指混合气体中可燃气体浓度达到一定值时,引起爆炸的最高界限,也称上限浓度。
当混合气体中可燃气体浓度高于上爆极限时,气体混合物不会发生燃烧反应。
上爆极限的计算公式为:
LFL = (Vg / Vm) * 100%
其中,LFL为可燃气体混合物的下爆极限(Lower Explosion Limit),Vg为混合气体中可燃气体的体积,Vm为混合气体的总体积。
下爆极限计算:
下爆极限是指混合气体中可燃气体浓度达到一定值时,引起爆炸的最低界限,也称下限浓度。
当混合气体中可燃气体浓度低于下爆极限时,气体混合物也不会发生燃烧反应。
下爆极限的计算公式为:
UFL = (Vk / Vm) * 100%
其中,UFL为可燃气体混合物的上爆极限(Upper Explosion Limit),Vk为混合气体中空气的体积,Vm为混合气体的总体积。
在一定的压力、温度和混合气
体成分的情况下,可燃气体混合物的爆炸极限是固定的。
爆炸极限的计算方法

爆炸极限的计算方法1 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中 0.55——常数;c0——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按20.9%计,c0可用下式确定c0=20.9/(0.209+n0)式中 n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为CH4+2O2→CO2+2H2O此时n0=2则L下=0.55×20.9/(0.209+2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:2.1 莱•夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱•夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理•查特里公式理•查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.3693 可燃粉尘许多工业可燃粉尘的爆炸下限在20-60g/m3之间,爆炸上限在2-6kg/m3之间。
爆炸极限计算

爆炸极限计算爆炸反应当量浓度、爆炸下限和上限、多种可燃气体混合物的爆炸极限计算方法如下:(1)爆炸反应当量浓度。
爆炸性混合物中的可燃物质和助燃物质的浓度比例,在恰好能发生完全的化合反应时,则爆炸所析出的热量最多,所产生的压力也最大。
实际的反应当量浓度稍高于计算的反应当量浓度,这是因为爆炸性混合物通常含有杂质。
可燃气体或蒸气分子式一般用CαHβOγ表示,设燃烧1mol气体所必需的氧摩尔数为n,则燃烧反应式可写成:C αHβOγ+nO2→生成气体按照标准空气中氧气浓度为20.9%,则可燃气体在空气中的化学当量浓度X(%),可用下式表示:可燃气体在氧气中的化学当量浓度为Xo(%),可用下式表示:也可根据完全燃烧所需的氧原子数2n的数值,从表1中直接查出可燃气体或蒸气在空气(或氧气)中的化学当量浓度。
其中。
可燃气体(蒸气)在空气中和氧气中的化学当量浓度(2)爆炸下限和爆炸上限。
各种可燃气体和燃性液体蒸气的爆炸极限,可用专门仪器测定出来,或用经验公式估算。
爆炸极限的估算值与实验值一般有些出入,其原因是在计算式中只考虑到混合物的组成,而无法考虑其他一系列因素的影响,但仍不失去参考价值。
1)根据完全燃烧反应所需的氧原子数估算有机物的爆炸下限和上限,其经验公式如下。
爆炸下限公式:(体积)爆炸上限公式:(体积)式中 L下——可燃性混合物爆炸下限;L上——可燃性混合物爆炸上限;n——1mol可燃气体完全燃烧所需的氧原子数。
某些有机物爆炸上限和下限估算值与实验值比较如表2:表2 石蜡烃的化学计量浓度及其爆炸极限计算值与实验值的比较从表中所列数值可以看出,实验所得与计算的值有一定差别,但采用安全系数后,在实际生产工作中仍可供参考。
2)根据化学当量浓度计算爆炸极限和爆炸性混合气完全燃烧时的化学当量浓度,可以估算有机物的爆炸下限和上限。
计算公式如下:此计算公式用于链烷烃类,其计算值与实验值比较,误差不超过10%。
例如甲烷爆炸极限的实验值为5%~15%,与计算值非常接近。
常见气体的爆炸极限及爆炸极限计算公式

常见气体的爆炸极限及爆炸极限计算公式气体的爆炸极限是指气体混合物中可燃气体的浓度范围,在这个浓度范围内,混合物可以发生自燃或爆炸。
爆炸极限通常分为上爆炸极限和下爆炸极限。
下面将介绍一些常见气体的爆炸极限及其计算公式。
1.甲烷(CH4)甲烷是最常见的天然气成分之一,它在空气中的爆炸极限为5%~15%。
甲烷的爆炸极限可以通过LFL(Lower Flammability Limit)和UFL (Upper Flammability Limit)来计算。
公式如下:LFL=0.0416×M/VcUFL=0.1621×M/Vc其中,M表示混合物中甲烷的质量分数,Vc表示燃烧容积。
2.乙炔(C2H2)乙炔是一种常用的工业气体,它在空气中的爆炸极限为 2.5%~93.3%。
乙炔的爆炸极限计算公式如下:LFL=4.57×(Vg)^0.63UFL=38×(Vg)^0.63其中,Vg表示乙炔的体积分数。
3.氢气(H2)氢气是一种轻便的气体,在空气中的爆炸极限为4%~75%。
氢气的爆炸极限可以通过下面的公式进行计算:LFL=4.1×(Pg)^0.82UFL=77.7×(Pg)^0.82其中,Pg表示氢气的压力。
4.二氧化碳(CO2)二氧化碳是一种非常稳定的气体,不易燃烧。
它的下爆炸极限为34%~74%。
在常规条件下,二氧化碳不会引发自燃或爆炸反应。
5.氧气(O2)氧气是一种强氧化剂,它本身不可燃。
然而,许多物质在氧气的存在下能够更容易燃烧。
氧气在空气中的爆炸极限为24%~95%。
需要注意的是,不同气体具有不同的爆炸极限计算公式,而且这些公式仅适用于特定条件下的混合气体。
你在实际情况中应该使用与你的气体和条件相匹配的正确公式。
此外,爆炸极限受到许多因素的影响,例如温度、压力、湿度和空气中其他物质的存在等。
这些因素可能会使爆炸极限的数值发生变化。
因此,在实际操作中,我们需要进行实验或模拟来确定具体气体在特定条件下的爆炸极限值。
爆炸极限计算

爆炸极限计算爆炸反应当量浓度、爆炸下限和上限、多种可燃气体混合物的爆炸极限计算方法如下: (1)爆炸反应当量浓度。
爆炸性混合物中的可燃物质和助燃物质的浓度比例,在恰好能发生完全的化合反应时,则爆炸所析出的热量最多,所产生的压力也最大。
实际的反应当量浓度稍高于计算的反应当量浓度,这是因为爆炸性混合物通常含有杂质。
可燃气体或蒸气分子式一般用C αH βO γ表示,设燃烧1mol 气体所必需的氧摩尔数为n ,则燃烧反应式可写成:C αH βO γ+nO 2→生成气体按照标准空气中氧气浓度为20.9%,则可燃气体在空气中的化学当量浓度X(%),可用下式表示:可燃气体在氧气中的化学当量浓度为Xo(%),可用下式表示:也可根据完全燃烧所需的氧原子数2n 的数值,从表1中直接查出可燃气体或蒸气在空气(或氧气)中的化学当量浓度。
其中。
可燃气体(蒸气)在空气中和氧气中的化学当量浓度(2)爆炸下限和爆炸上限。
各种可燃气体和燃性液体蒸气的爆炸极限,可用专门仪器测定出来,或用经验公式估算。
爆炸极限的估算值与实验值一般有些出入,其原因是在计算式中只考虑到混合物的组成,而无法考虑其他一系列因素的影.响,但仍不失去参考价值。
1)根据完全燃烧反应所需的氧原子数估算有机物的爆炸下限和上限,其经验公式如下。
爆炸下限公式:(体积)爆炸上限公式:(体积)式中 L——可燃性混合物爆炸下限;下L——可燃性混合物爆炸上限;上n——1mol可燃气体完全燃烧所需的氧原子数。
某些有机物爆炸上限和下限估算值与实验值比较如表2:表2 石蜡烃的化学计量浓度及其爆炸极限计算值与实验值的比较从表中所列数值可以看出,实验所得与计算的值有一定差别,但采用安全系数后,在实际生产工作中仍可供参考。
2)根据化学当量浓度计算爆炸极限和爆炸性混合气完全燃烧时的化学当量浓度,可以估算有机物的爆炸下限和上限。
计算公式如下:此计算公式用于链烷烃类,其计算值与实验值比较,误差不超过10%。
混合气体地爆炸极限怎么计算

爆炸极限L=1/(Y1/L1 + Y2/L2 + Y3/L3)其中:Y1、Y2、Y3代表混合物中组成L1、L2、L3代有混合气体各组份相应的爆炸极限求混合物爆炸下限(或上限)时,L1、L2、L3分别为各纯组份的爆炸下限(或下限);爆炸极限的计算1 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中0.55——常数;c0——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按20.9%计,c0可用下式确定c0=20.9/(0.209 n0)式中n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为CH4 2O2→CO2 2H2O此时n0=2则L下=0.55×20.9/(0.209 2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:2.1 莱?夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱?夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1 P2 P3)/(P1/LEL1 P2/LEL2 P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1 P2 P3)/(P1/UEL1 P2/UEL2 P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理?查特里公式理?查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1 V2/L2 …… Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
常见气体的爆炸极限及爆炸极限计算公式精修订

常见气体的爆炸极限及爆炸极限计算公式标准化管理部编码-[99968T-6889628-J68568-1689N]爆炸极限计算方法:比较认可的计算方法有两种:莱·夏特尔定律?对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)此定律一直被证明是有效的。
2.2理·查特里公式理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.369德迈数据计算:废气风量:19000Nm3/h废气中可燃性成分:戊烷7kg/h;甲醛29kg/h,其它约5kg/h(当甲醛计算)戊烷体积=7000/72*22.4/1000=2.178Nm3/h体积分数=2.178/19000=0.012%甲醛体积分数=25.39Nm3/h体积分数=25.39/19000=0.134%混合气体中可燃气体的总体积分数=0.146%由公式:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)得:混合气体的爆炸下限=0.146%/(0.012/1.7+0.134/7)=5.57%结论:混合气体中可燃气体的总体积分数为0.146%,混合气体的爆炸下限为5.57%,可燃气体浓度是爆炸下限浓度的1/38,放心烧吧!。
常见气体的爆炸极限及爆炸极限计算公式
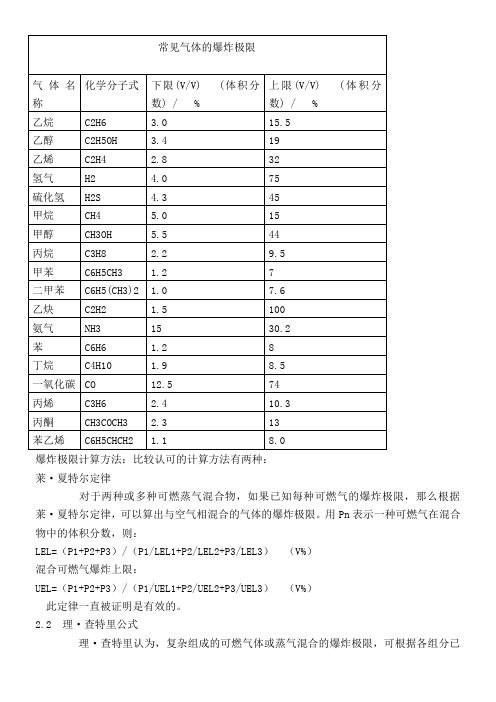
爆炸极限计算方法:比较认可的计算方法有两种:
莱·夏特尔定律
对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:
LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)
混合可燃气爆炸上限:
UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)
此定律一直被证明是有效的。
2.2 理·查特里公式
理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已
知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)
式中Lm——混合气体爆炸极限,%;
L1、L2、L3——混合气体中各组分的爆炸极限,%;
V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.369。
爆炸极限的计算方法

爆炸极限的计算方法1 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中 0.55——常数;c0——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按20.9%计,c0可用下式确定c0=20.9/(0.209+n0)式中 n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为CH4+2O2→CO2+2H2O此时n0=2则L下=0.55×20.9/(0.209+2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:2.1 莱•夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱•夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理•查特里公式理•查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.3693 可燃粉尘许多工业可燃粉尘的爆炸下限在20-60g/m3之间,爆炸上限在2-6kg/m3之间。
混合气体的爆炸极限及计算公式

混合气体的爆炸极限及计算公式燃烧技术是当下处理VOCs的主流技术,其中包含催化燃烧、热力燃烧、蓄热催化燃烧、蓄热热力燃烧、浓缩催化燃烧等。
燃烧技术的基理是VOCs在高温下发生氧化反应,氧化反应的本质就是燃烧反应,是一种放热反应,VOCs在燃烧过程的放热量与VOCs的种类和浓度有关。
因而,从安全方面考虑,VOCs燃烧的安全使用浓度显得尤为重要。
了解VOCs燃烧过程的温升和可燃气体爆炸下限,有利于提高RTO、RCO设备技术的安全性能。
1、VOCs的爆炸下限是什么?可燃气体在空气中遇明火火种爆炸的最低浓度,称之为爆炸下限,亦称燃烧下限,英文名称Lower Explosion Limited,即%LEL。
空气中可燃气体浓度达到其爆炸下限值时,这个场所可燃气环境爆炸危险度就达到了百分之百,即100%LEL;如果可燃气体含量只达到其爆炸下限的百分之十,那这个场所此时的可燃气环境爆炸危险度为10%LEL。
下表是常见VOCs在标准状态下爆炸下限值。
为了确保VOCs处理设备的安全运行,VOCs废气的浓度必须控制在对应有机物爆炸极限的25%以下。
为什么要控制在25%LEL以下呢?首先,可燃气体的爆炸下限浓度与可燃气体的初始温度有关:以正己烷为例,下图是温度对于正己烷爆炸下限浓度的影响(姚洁等,工业安全与环保,2012,38(2):48),可见当可燃气体初始温度提高,相应爆炸下限浓度下降。
当气体温度达到600K(327°C)时,爆炸下限浓度达到室温的75%,所以提高温度会导致爆炸下限浓度明显下降。
而且实际工况中大多数是混合VOCs,混合VOCs的爆炸下限浓度具有不确定性。
所以,实际操作中要控制在LEL浓度的25%内。
2、VOCs燃烧过程中的绝热温升什么是绝热温升?绝热温升指放热反应物完全转化时所放出的热量可以使物料升高的温度。
其表达式为:式中分子为反应热(J/mol)与物料摩尔浓度(mol/L)的乘积;分母为物料平均密度(kg/L)与物料平均比热容(J/kg*K)的乘积。
混合气体的爆炸极限怎么计算

混合气体的爆炸极限怎么计算混合气体的爆炸极限怎么计算爆炸极限L=1/(Y1/L1 Y2/L2 Y3/L3)其中:Y1、Y2、Y3代表混合物中组成、L2、L3代有混合气体各组份相应的爆炸极限求混合物爆炸下限(或上限)时,L1、L2、L3分别为各纯组份的爆炸下限(或下限);爆炸极限的计算根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:下≈0.55c0式中 0.55——常数;——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按20.9%计,c0可用下式确定=20.9/(0.209 n0)式中 n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为2O2→CO2 2H2O此时n0=2则L下=0.55×20.9/(0.209 2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:.1 莱?夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱?夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:=(P1 P2 P3)/(P1/LEL1 P2/LEL2 P3/LEL3)(V%)混合可燃气爆炸上限:=(P1 P2 P3)/(P1/UEL1 P2/UEL2 P3/UEL3)(V%)此定律一直被证明是有效的。
.2 理?查特里公式理?查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
=100/(V1/L1 V2/L2 …… Vn/Ln):x式中Lm——混合气体爆炸极限,%;、L2、L3——混合气体中各组分的爆炸极限,%;、V2、V3——各组分在混合气体中的体积分数,%。
常见气体的爆炸极限及爆炸极限计算公式
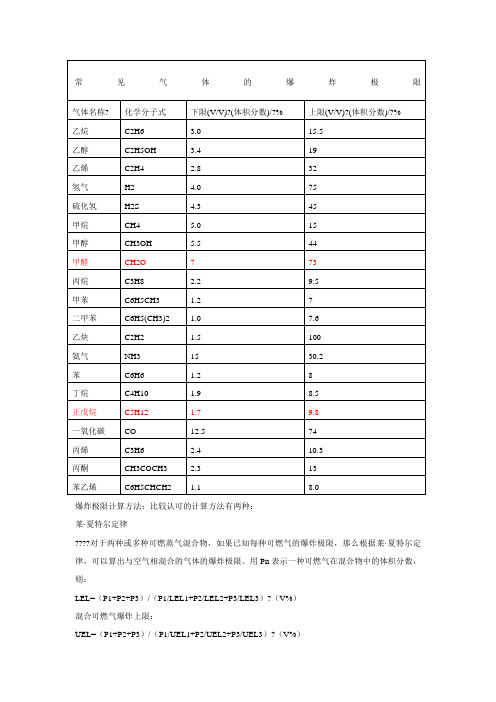
爆炸极限计算方法:比较认可的计算方法有两种:莱·夏特尔定律????对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)?(V%)混合可燃气爆炸上限:UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)?(V%)?此定律一直被证明是有效的。
2.2?理·查特里公式????理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)????式中Lm——混合气体爆炸极限,%;????L1、L2、L3——混合气体中各组分的爆炸极限,%;????V1、V2、V3——各组分在混合气体中的体积分数,%。
????例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
????Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.369德迈数据计算:废气风量:19000Nm3/h废气中可燃性成分:戊烷7kg/h;甲醛29kg/h,其它约5kg/h(当甲醛计算)戊烷体积=7000/72*22.4/1000=2.178Nm3/h体积分数=2.178/19000=0.012%甲醛体积分数=25.39Nm3/h体积分数=25.39/19000=0.134%混合气体中可燃气体的总体积分数=0.146%由公式:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)?(V%)得:混合气体的爆炸下限=0.146%/(0.012/1.7+0.134/7)=5.57%结论:混合气体中可燃气体的总体积分数为0.146%,混合气体的爆炸下限为5.57%,可燃气体浓度是爆炸下限浓度的1/38,放心烧吧!。
常见气体的爆炸极限及爆炸极限计算公式

常见气体的爆炸极限及爆炸极限计算公式
The final revision was on November 23, 2020
爆炸极限计算方法:比较认可的计算方法有两种:
莱·夏特尔定律?对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:
LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)
混合可燃气爆炸上限:
UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)
此定律一直被证明是有效的。
理·查特里公式
理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)式中Lm——混合气体爆炸极
限,%; L1、L2、L3——混合气体中各组分的爆炸极限,%; V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=%)、乙烷15%(L下=%)、丙烷4%(L下=%)、丁烷1%(L下=%)求爆炸下限。
Lm=100/(80/5+15/+4/+1/)=。
混合气体的爆炸极限怎么计算

爆炸极限L=1/(Y1/L1 + Y2/L2 + Y3/L3)其中:Y1、Y2、Y3代表混合物中组成L1、L2、L3代有混合气体各组份相应的爆炸极限求混合物爆炸下限(或上限)时,L1、L2、L3分别为各纯组份的爆炸下限(或下限);爆炸极限的计算1 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中 0.55——常数;c0——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按20.9%计,c0可用下式确定c0=20.9/(0.209 n0)式中 n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为CH4 2O2→CO2 2H2O此时n0=2则L下=0.55×20.9/(0.209 2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:2.1 莱?夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱?夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1 P2 P3)/(P1/LEL1 P2/LEL2 P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1 P2 P3)/(P1/UEL1 P2/UEL2 P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理?查特里公式理?查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1 V2/L2 …… Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
爆炸极限的计算方法

爆炸极限的计算方法1 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中 0.55——常数;c0——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按20.9%计,c0可用下式确定c0=20.9/(0.209+n0)式中 n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为CH4+2O2→CO2+2H2O此时n0=2则L下=0.55×20.9/(0.209+2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:2.1 莱•夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱•夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理•查特里公式理•查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.3693 可燃粉尘许多工业可燃粉尘的爆炸下限在20-60g/m3之间,爆炸上限在2-6kg/m3之间。
混合气体的爆炸极限怎么计算

爆炸极限L=1/(Y1/L1+Y2/L2+Y3/L3)其中:Y1、Y2、Y3代表混合物中组成L1、L2、L3代有混合气体各组份相应的爆炸极限求混合物爆炸下限(或上限)时,L1、L2、L3分别为各纯组份的爆炸下限(或下限);爆炸极限的计算1 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中0.55——常数;c0——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按20.9%计,c0可用下式确定c0=20.9/(0.209 n0)式中n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为CH4 2O2→CO2 2H2O此时n0=2则L下=0.55×20.9/(0.209 2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:2.1 莱?夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱?夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1 P2 P3)/(P1/LEL1 P2/LEL2 P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1 P2 P3)/(P1/UEL1 P2/UEL2 P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理?查特里公式理?查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1 V2/L2 …… Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L 下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
爆炸极限的计算1 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中——常数;c0——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按%计,c0可用下式确定c0=( n0)式中 n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为CH4 2O2→CO2 2H2O此时n0=2则L下=×( 2)=由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:莱?夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱?夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1 P2 P3)/(P1/LEL1 P2/LEL2 P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1 P2 P3)/(P1/UEL1 P2/UEL2 P3/UEL3)(V%)此定律一直被证明是有效的。
理?查特里公式理?查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1 V2/L2 …… Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=%)、乙烷15%(L下=%)、丙烷4%(L下=%)、丁烷1%(L下=%)求爆炸下限。
Lm=100/(80/5 15/ 4/ 1/)=3 可燃粉尘许多工业可燃粉尘的爆炸下限在20-60g/m3之间,爆炸上限在2-6kg/m3之间。
碳氢化合物一类粉尘如能完全气化燃尽,则爆炸下限可由布尔格斯-维勒关系式计算:c×Q=k式中c——爆炸下限浓度;Q——该物质每靡尔的燃烧热或每克的燃烧热;k——常数第五节爆炸极限理论与计算一、爆炸极限理论可燃气体或蒸气与空气的混合物,并不是在任何组成下都可以燃烧或爆炸,而且燃烧(或爆炸)的速率也随组成而变。
实验发现,当混合物中可燃气体浓度接近化学反应式的化学计量比时,燃烧最快、最剧烈。
若浓度减小或增加,火焰蔓延速率则降低。
当浓度低于或高于某个极限值,火焰便不再蔓延。
可燃气体或蒸气与空气的混合物能使火焰蔓延的最低浓度,称为该气体或蒸气的爆炸下限;反之,能使火焰蔓延的最高浓度则称为爆炸上限。
可燃气体或蒸气与空气的混合物,若其浓度在爆炸下限以下或爆炸上限以上,便不会着火或爆炸。
爆炸极限一般用可燃气体或蒸气在混合气体中的体积百分数表示,有时也用单位体积可燃气体的质量(kg·m—3)表示。
混合气体浓度在爆炸下限以下时含有过量空气,由于空气的冷却作用,活化中心的消失数大于产生数,阻止了火焰的蔓延。
若浓度在爆炸上限以上,含有过量的可燃气体,助燃气体不足,火焰也不能蔓延。
但此时若补充空气,仍有火灾和爆炸的危险。
所以浓度在爆炸上限以上的混合气体不能认为是安全的。
燃烧和爆炸从化学反应的角度看并无本质区别。
当混合气体燃烧时,燃烧波面上的化学反应可表示为A+B→C+D+Q (4—1)式中 A、B为反应物;C、D为产物;Q为燃烧热。
A、B、C、D不一定是稳定分子,也可以是原子或自由基。
化学反应前后的能量变化可用图4—4表示。
初始状态Ⅰ的反应物(A+B)吸收活化能正达到活化状态Ⅱ,即可进行反应生成终止状态Ⅲ的产物(C+D),并释放出能量W,W=Q+E。
图4-4 反应过程能量变化假定反应系统在受能源激发后,燃烧波的基本反应浓度,即反应系统单位体积的反应数为n,则单位体积放出的能量为nW。
如果燃烧波连续不断,放出的能量将成为新反应的活化能。
设活化概率为α(α≤1),则第二批单位体积内得到活化的基本反应数为anW/E,放出的能量为。
αnW2/E。
后批分子与前批分子反应时放出的能量比β定义为燃烧波传播系数,为现在讨论β的数值。
当β<1时,表示反应系统受能源激发后,放出的热量越来越少,因而引起反应的分子数也越来越少,最后反应会终止,不能形成燃烧或爆炸。
当β=1时,表示反应系统受能源激发后均衡放热,有一定数量的分子持续反应。
这是决定爆炸极限的条件(严格说卢值略微超过1时才能形成爆炸)。
当β>1时,表示放出的热量越来越多,引起反应的分子数也越来越多,从而形成爆炸。
在爆炸极限时,β=1,即假设爆炸下限L下(体积分数)与活化概率α成正比,则有α=KL下,其中K为比例常数。
因此当Q与正相比很大时,式(4—4)可以近似写成上式近似地表示出爆炸下限L下与燃烧热Q和活化能正之间的关系。
如果各可燃气体的活化能接近于某一常数,则可大体得出L下Q=常数 (4—6)这说明爆炸下限与燃烧热近于成反比,即是说可燃气体分子燃烧热越大,其爆炸下限就越低。
各同系物的L下Q都近于一个常数表明上述结论是正确的。
表4—7列出了一些可燃物质的燃烧热和爆炸极限,以及燃烧热和爆炸下限的乘积。
利用爆炸下限与燃烧热的乘积成常数的关系,可以推算同系物的爆炸下限。
但此法不适用于氢、乙炔、二硫化碳等少数可燃气体爆炸下限的推算。
式(4—6)中的L下是体积分数,文献数据大都为20℃的测定数据;Q则为摩尔燃烧热。
对于烃类化合物,单位质量(每克)的燃烧热q大致相同。
如果以mg·L—1为单位表示爆炸下限,则记为L′下,有L下=100L′下×,于是式中 M为可燃气体的相对分子质量。
把式(4—7)代人式(4—6),并考虑到Q=Mq,则可得到2.4qL′下=常数(4—8)可见对于烃类化合物,其L′下近于相同。
二、影响爆炸极限的因素爆炸极限不是一个固定值,它受各种外界因素的影响而变化。
如果掌握了外界条件变化对爆炸极限的影响,在一定条件下测得的爆炸极限值,就有着重要的参考价值。
影响爆炸极限的因素主要有以下几种。
1.初始温度爆炸性混合物的初始温度越高,混合物分子内能增大,燃烧反应更容易进行,则爆炸极限范围就越宽。
所以,温度升高使爆炸性混合物的危险性增加。
表4—8列出了初始温度对丙酮和煤气爆炸极限的影响。
表4—8 初始温度对混合物爆炸极限的影响2.初始压力爆炸性混合物初始压力对爆炸极限影响很大。
一般爆炸性混合物初始压力在增压的情况下,爆炸极限范围扩大。
这是因为压力增加,分子间更为接近,碰撞几率增加,燃烧反应更容易进行,爆炸极限范围扩大。
表4—9列出了初始压力对甲烷爆炸极限的影响。
在一般情况下,随着初始压力增大,爆炸上限明显提高。
在已知可燃气体中,只有一氧化碳随着初始压力的增加,爆炸极限范围缩小。
表4—9 初始压力对甲烷爆炸极限的影响初始压力降低,爆炸极限范围缩小。
当初始压力降至某个定值时,爆炸上、下限重合,此时的压力称为爆炸临界压力。
低于爆炸临界压力的系统不爆炸。
因此在密闭容器内进行减压操作对安全有利。
3.惰性介质或杂质爆炸性混合物中惰性气体含量增加,其爆炸极限范围缩小。
当惰性气体含量增加到某一值时,混合物不再发生爆炸。
惰性气体的种类不同对爆炸极限的影响亦不相同。
如甲烷,氩、氦、氮、水蒸气、二氧化碳、四氯化碳对其爆炸极限的影响依次增大。
再如汽油,氮气、燃烧废气、二氧化碳、氟里昂-21、氟里昂-12、氟里昂-11,对其爆炸极限的影响则依次减小。
在一般情况下,爆炸性混合物中惰性气体含量增加,对其爆炸上限的影响比对爆炸下限的影响更为显著。
这是因为在爆炸性混合物中,随着惰性气体含量的增加氧的含量相对减少,而在爆炸上限浓度下氧的含量本来已经很小,故惰性气体含量稍微增加一点,即产生很大影响,使爆炸上限剧烈下降。
对于爆炸性气体,水等杂质对其反应影响很大。
如果无水,干燥的氯没有氧化功能;干燥的空气不能氧化钠或磷;干燥的氢氧混合物在1000℃下也不会产生爆炸。
痕量的水会急剧加速臭氧、氯氧化物等物质的分解。
少量的硫化氢会大大降低水煤气及其混合物的燃点,加速其爆炸。
4.容器的材质和尺寸实验表明,容器管道直径越小,爆炸极限范围越小。
对于同一可燃物质,管径越小,火焰蔓延速度越小。
当管径(或火焰通道)小到一定程度时,火焰便不能通过。
这一间距称作最大灭火间距,亦称作临界直径。
当管径小于最大灭火间距时,火焰便不能通过而被熄灭。
容器大小对爆炸极限的影响也可以从器壁效应得到解释。
燃烧是自由基进行一系列连锁反应的结果。
只有自由基的产生数大于消失数时,燃烧才能继续进行。
随着管道直径的减小,自由基与器壁碰撞的几率增加,有碍于新自由基的产生。
当管道直径小到一定程度时,自由基消失数大于产生数,燃烧便不能继续进行。
容器材质对爆炸极限也有很大影响。
如氢和氟在玻璃器皿中混合,即使在液态空气温度下,置于黑暗中也会产生爆炸。
而在银制器皿中,在一般温度下才会发生反应。
5.能源火花能量、热表面面积、火源与混合物的接触时间等,对爆炸极限均有影响。
如甲烷在电压100 V、电流强度1 A的电火花作用下,无论浓度如何都不会引起爆炸。
但当电流强度增加至2 A时,其爆炸极限为5.9%~13.6%;3A时为5.85%~14.8%。
对于一定浓度的爆炸性混合物,都有一个引起该混合物爆炸的最低能量。
浓度不同,引爆的最低能量也不同。
对于给定的爆炸性物质,各种浓度下引爆的最低能量中的最小值,称为最小引爆能量,或最小引燃能量。
表4—10列出了部分气体的最小引爆能量。
表4—10 部分气体的最小引爆能量另外,光对爆炸极限也有影响。
在黑暗中,氢与氯的反应十分缓慢,在光照下则会发生连锁反应引起爆炸。
甲烷与氯的混合物,在黑暗中长时间内没有反应,但在日光照射下会发生激烈反应,两种气体比例适当则会引起爆炸。
表面活性物质对某些介质也有影响。
如在球形器皿中530℃时,氢与氧无反应,但在器皿中插入石英、玻璃、铜或铁棒,则会发生爆炸。
三、爆炸极限的计算1.根据化学计量浓度近似计算爆炸性气体完全燃烧时的化学计量浓度可以用来确定链烷烃的爆炸下限,计算公式为L下=0.55C0(4—9)式中 C0为爆炸性气体完全燃烧时的化学计量浓度;0.55为常数。
如果空气中氧的含量按照20.9%计算,C0的计算式则为式中 n0为1分子可燃气体完全燃烧时所需的氧分子数。
如甲烷完全燃烧时的反应式为CH4+2O2→CO2+2H2O,这里n0=2,代入式(4—10),并应用式(4—9),可得L下=5.2,即甲烷爆炸下限的计算值为5.2%,与实验值5.0%相差不超过10%。
此法除用于链烷烃以外,也可用来估算其他有机可燃气体的爆炸下限,但当应用于氢、乙炔,以及含有氮、氯、硫等的有机气体时,偏差较大,不宜应用。
