生化类体外诊断试剂开瓶稳定性研究
体外诊断试剂运输稳定性研究方案

体外诊断试剂运输稳定性研究方案体外诊断试剂是一种用于检测人体样本中生化指标、疾病标志物等的试剂,其质量和稳定性对于检测结果的准确性至关重要。
而试剂在运输过程中受到温度、湿度、震动等不利环境因素的影响,可能导致试剂的降解和失效。
因此,需要进行体外诊断试剂运输稳定性的研究,以保证试剂在运输过程中的稳定性和可靠性。
本研究旨在评估体外诊断试剂在运输过程中的稳定性,具体方案如下:1.样品选择从市场上随机选取一批体外诊断试剂,包括不同制造商和不同类型的试剂。
确保选取的试剂能够涵盖常见的体外诊断试剂。
2.环境条件设置模拟实际运输环境,设置不同的温度、湿度和震动条件。
可以参考国内外相关标准和规范,确定合适的环境参数。
例如,可设置不同温度(常温、低温、高温)、湿度(相对湿度20%-80%)、震动(低频、中频、高频)条件。
3.运输箱选择选择合适的运输箱,确保能够满足运输过程中的要求。
运输箱的选取应考虑到绝缘性、隔热性、防潮性和防震性等因素。
4.试剂包装将选取的试剂进行适当的包装,以保护其在运输过程中不受到外界环境的影响。
包装材料可以使用常见的防潮、防震材料,如聚乙烯泡沫、吸湿剂等。
确保包装材料不会对试剂产生污染或化学反应。
5.试剂运输将包装好的试剂放入运输箱中,根据预设的环境条件,进行试剂的运输。
运输过程中,需保证运输箱的密封性和稳定性,避免温度、湿度和震动的剧烈变化。
6.试剂检测在运输过程结束后,对试剂进行检测,评估其稳定性。
检测指标可以包括试剂的活性、纯度、保存条件等。
对于常见的体外诊断试剂,可以通过比较运输前后的检测结果,评估试剂在运输过程中的稳定性。
7.数据分析和结果评估根据试剂检测结果,进行数据分析和结果评估。
参考相关标准和规范,对运输过程中的试剂稳定性进行评价,确定是否满足要求。
8.结论和建议根据研究结果,给出相应的结论和建议。
如果试剂在运输过程中的稳定性较好,可以提出合理的运输条件和建议;如果试剂的稳定性存在问题,可以提出相应的改进措施,如调整包装材料、改善运输环境等。
浅议生化类体外诊断试剂开瓶稳定性

浅议生化类体外诊断试剂开瓶稳定性张力心【摘要】目的:探讨对检测结果的影响,为生化试剂的临床使用提供必要的参考。
方法选取3种生化试剂盒,以朗道质控品为检测样本,用深圳迈瑞BS-800全自动生化分析仪进行检测,观察开瓶时间对检测结果的影响。
结果开瓶时间对总蛋白和肌酐的正确度影响较大。
结论试剂开瓶后应密闭低温储存,尽快使用,且每次检测前应重新校准。
%Objective By studying on the influence of decapping time on results,this paper offers a guidance on clinical application of biochemical diagnostic kits.Methods With the Randox control serum as the sample,correctness of decapping time on results is tested by mindray’s BS-800 automatic biochemical analyzer.ResultsDecapping time of total protein and creatinine reagent greatly affect the testing results.Conclusion Having been decapped,the reagent should be stored in low temperature,and a calibration test should be run.【期刊名称】《中国卫生标准管理》【年(卷),期】2016(000)001【总页数】2页(P135-136)【关键词】开瓶稳定性;体外诊断试剂;正确度【作者】张力心【作者单位】401147 重庆医疗器械质量检验中心; 重庆市医疗器械质量与安全控制工程技术研究中心【正文语种】中文【中图分类】R97【关健词】开瓶稳定性;体外诊断试剂;正确度作者单位:401147 重庆医疗器械质量检验中心;重庆市医疗器械质量与安全控制工程技术研究中心随着我国检验技术的发展,生化试剂已成为化学试剂的一大类。
体外诊断试剂产品稳定性研究
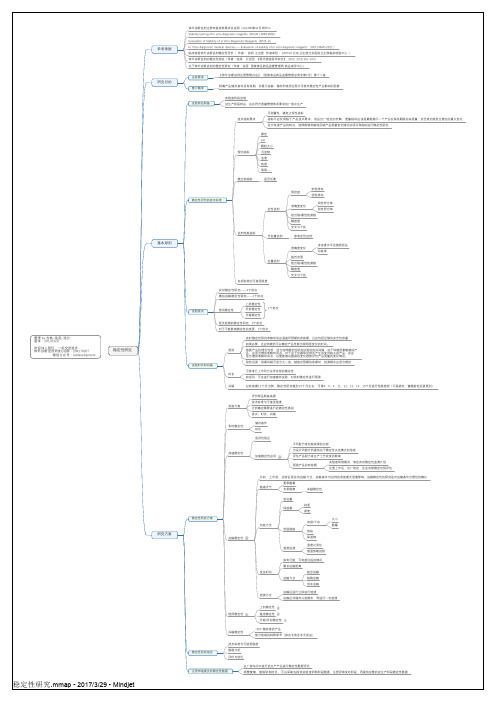
使用稳定性
上机稳定性 复溶稳定性 开瓶/开封稳定性
冻融稳定性
-20℃储存类的产品 部分地域的特殊季节(如东北地区冬天发运)
稳定性研究报告
技术标准与可接受限度 数据分析 评价与结论
注册申报提交的稳定性数据
以厂房车间中进行试生产产品进行稳定性数据评估 调整策略,缩短研制时长,可以采取先提供实验室研制阶段数据,注册评审发补阶段,再提供完整的试生产阶段稳定性数据
理化指标
颜色 pH 颗粒大小 沉淀物 浊度 纯度 等等·评价的技术标准
试剂性能指标
定性试剂 半定量试剂
质控盘
阳性样本 阴性样本
准确度变化
阴性符合率 阳性符合率
检出限/最低检测限
精密度
交叉与干扰
参考定性试剂
定量试剂 各项标准的可接受限度
准确度变化
多浓度水平定值质控品 回收率
可参考已上市同方法学试剂的稳定性 如适用,可先进行加速破坏试验,对实时稳定性进行预测
间隔
以有效期12个月为例,稳定性研究做到15个月左右,可第3、6、9、11、12、13、14、15个月进行性能检测(不是绝对,遵循前松后紧原则)
实施方案
评价样品制备来源 技术标准与可接受限度 分析确定需要进行的稳定性类别 批次、时长、间隔
线性范围
检出限/最低检测限
精密度
交叉与干扰
试验批次
实时稳定性研究——3个批次 模拟运输稳定性研究——1个批次
使用稳定性
上机稳定性 开封稳定性 开瓶稳定性
1个批次
延长效期的稳定性研究,3个批次 对于可能影响稳定性的变更,1个批次
试验时长和间隔
原则 时长
实时稳定性研究考察时间应涵盖所预期的有效期,且应包括足够的安全性余量 如果必要,还应持续到可以确定产品性能出现明显变化的时间。 根据产品的理化性质,适当选择稳定性研究试验的时间间隔,对于环境因素敏感的产 品,应适当增加考察时间点。对于由于仪器和试剂而产生的变异较大的产品,亦应 适当增加考察时间点,以便能够从数据的变化趋势评价产品质量的变化情况。 前松后紧:前期间隔可适当大一些,越接近预期的效期时,检测频次应适当增加
生化分析仪稳定性实验及容量仪器的校准

容量仪器的校准
一、用称重法校正原理:
以天枰称出量器在某刻度时所容纳蒸馏水 或水银的质量,在根据蒸馏水或水银密度推算出 量器的实际容量。 V20 = Wt/Υ t
Υ t = dt[1+(t—20)×0.000026]
容许误差 = V20 — 理论值
容量仪器的校准
二、材料与试剂
1.器材:刻度吸管、吸耳球、加样枪和温度计、 锥形瓶、电子天平。 2.试剂:蒸馏水。
相关知识背景
E:量入式容器,用于测定注入容器内的液体 量 (0 —x ) A:量出式容器,用于测定从容器中倾出的液 体 量(x——0) 3、校准前的准备
器材的清洗、干燥
一、容量仪器的校准
1、用称重法校正移液管
2、用称重法校正5—25µl的加样器 3、用比对的方法校准50—250的加样器
量取Υ t 值 20℃蒸馏水的体 积 理论体积
容量仪器的校准
校准容器 50—250µl的加样器 量取 空瓶重量 空瓶重量+蒸馏水重 量 蒸馏水重量Wt 查表Υ t 值 20 ℃蒸馏水的体积 µl蒸馏水 量取 编号: µl蒸馏水
理论体积
误差
注意:选择校准体积:⑴ 拟校准体积;⑵加样器标定体积的中间体积; ⑶最小可调体积(不小于拟校准体积的1%)在操作时首先应进行润化
实验一、移液器的校准 及分光光度计稳定性实验
实验内容
1、容量仪器的校准 2、生化分析仪稳定性实验
相关知识背景
1、容量仪器:容量瓶、滴定管、吸量管、微量吸 管,加样枪
2、容量仪器的标识: TD: to deliver,泄出量移液管,液 体自然泻出不需吹出最后余滴 TC: to contain,包含量移液管,使 用时需吹出最后余滴
体外诊断试剂样本标本稳定性研究资料

体外诊断试剂样本/标本稳定性研究资料(适用于血液、血清、血浆、尿液等各类型样本)目录一、研究方法的确定依据 (1)二、试验用仪器及材料 (1)2.1试验用试剂 (1)2.2样本 (2)2.3试验用仪器 (2)三、试验方法 (2)四、检测指标及其检定标准 (2)五、稳定性试验结果 (3)六、试验结论 (4)七、参考文献 (4)八、附件 (4)附件1全血EDTA-Na抗凝样本稳定性研究数据 (4)附件2全血EDTA-K抗凝样本稳定性研究数据 (4)附件3全血枸橼酸钠抗凝样本稳定性研究数据 (4)附件4全血草酸钠抗凝样本稳定性研究数据 (4)概述稳定性是体外诊断试剂必须具有的基本属性、是确保产品在使用过程中安全有效的重要指标。
稳定性研究是根据产品的理化性质,设计合理的稳定性研究试验项目,以考察不同条件下产品的主要质量指标随时间的变化情况,为产品的保存条件和有效期的确定提供依据。
我公司参考《ICH药物稳定性研究指导原则》、《体外诊断试剂分析性能指导原则》、张丽的《关于体外诊断试剂的稳定性研究》以及张妍和王治国的《体外诊断试剂的稳定性测试》的指导方法,设计了血红蛋白检测试剂盒(SLS-Hb法)样本的稳定性试验,以考察该产品所使用的样本的稳定性。
一、研究方法的确定依据根据中国药典附录《9012生物样品定量分析方法验证指导原则》:必须在分析方法的每一步骤确保稳定性,用于检査稳定性的条件,例如样品基质、抗凝剂、容器材料、储存和分析条件,都应该与实际试验样品的条件相似。
用文献报道的数据证明稳定性是不够的。
采用低和高浓度质控样品(空白基质加入分析物至定量下限浓度3倍以内以及接近定量上限),在预处理后以及在所评价的条件储存后立即分析。
由新鲜制备的校正标样获得标准曲线,根据标准曲线分析质控样品,将测得浓度与标示浓度相比较,每一浓度的均值与标示浓度的偏差应在±15%范围内。
因此,在满足上述两个浓度要求的前提下,我们对5个浓度进行稳定性考察。
浅析体外诊断试剂稳定性研究

.30中国医疗器械信息 | China Medical Device Information标准检测Standard and T esting体外诊断试剂稳定性的定义在GB/T 29791.1-2013中有明确描述:体外诊断医疗器械在制造商规定界限内保持其性能特性的能力[1]。
该标准中明确了稳定性适用的三种情形:一是适用于当体外诊断试剂、校准物或控制物在制造商规定的条件下储存、运输和使用时;二是按照制造商使用说明制备、使用和贮存的复溶后冻干材料、工作液和从密闭容器中取出的材料;三是校准后的测量仪器或测量系统,对体外诊断试剂而言,测量系统的稳定性通常用时间来量化。
稳定性作为体外诊断试剂保持产品安全有效的重要指标,对产品的生产、运输、保存和使用等环节具有重要的指导意义。
美国临床和实验室标准协会(Clinical and Laboratory Standards Institute ,CLSI )在其指南EP25-A 中,对体外诊断试剂稳定性研究的目标、稳定性研究计划、稳定性研究过程路径,以及实时稳定性、加速稳定性研究方法等都作了详细的描述[2]。
在附录中,还结合具体实例分析了测量漂移(Measure and Drift )、将加速稳定性实验数据用阿伦尼乌斯方程(Arrhenius Equation )推导产品保存期限,以及基于线性回归分析来确定稳定性研究中的时间点设置等。
该指南为体外诊断试剂的稳定性研究提供了重要的技术参考。
国家食品药品监督管理总局(CFDA )在2014年9月5日发布的《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2014年第44号)》中,对体外诊断试剂的稳定性研究提出了明确要求:包括至少三批样品在实际储存条件下保存至成品有效期后的实时稳定性研究资料,并应当充分考虑产品在储存、运输和使用过程中的不利条件,进行相应的稳定性研究;应当详细说明稳定性研究方法的确定依据及具体试验方法、过程[3]。
体外诊断试剂注册申报资料模板-稳定性研究资料

体外诊断试剂注册申报资料模板-稳定性研究资料稳定性研究旨在评估体外诊断试剂的稳定性和持久性,确保试剂在储存和使用期间能够保持其功能和性能。
以下是本试剂的稳定性研究结果:1.储存温度稳定性研究对本试剂进行了不同储存温度下的稳定性研究。
选择常见的储存温度,如4℃、25℃和37℃,并使用适当的质控样品进行测试。
每隔一定时间间隔,使用稳定性指标,如活性、灵敏度和特异性等来衡量试剂的稳定性。
实验结果显示,在4℃、25℃和37℃下,本试剂在12个月的储存期间保持了稳定性。
活性损失在可接受范围内,灵敏度和特异性保持在目标范围内,未发现任何异常结果。
2.冻存稳定性研究本试剂在冻存状态下的稳定性也是一个关键指标。
为了评估试剂在冻结和自然解冻过程中的稳定性,选择了常见的冻存温度,如-20℃和-80℃,并使用稳定性指标进行测试。
实验结果显示,在-20℃和-80℃的冻存条件下,本试剂在6个月的冻存期间保持了稳定性。
冻存过程中,试剂的活性、灵敏度和特异性没有明显的降低,未发现任何异常结果。
在自然解冻后,试剂恢复了其功能和性能,没有发现冻结和解冻对试剂产生负面影响。
3.运输稳定性研究运输过程中的妥善包装和适当的运输条件对试剂的稳定性也至关重要。
为了评估试剂在运输过程中的稳定性,选择了不同的运输条件,如运输时间、温度和湿度,并使用稳定性指标进行测试。
实验结果显示,在不同的运输条件下,本试剂在规定的运输时间内保持了稳定性。
运输过程中,试剂的活性、灵敏度和特异性未发生明显的损失,没有发现任何异常结果。
适当的包装和运输条件确保了试剂的稳定性和持久性。
总结通过以上的稳定性研究,我们得出结论,本试剂在储存、冻存和运输过程中表现出良好的稳定性和持久性。
试剂的活性、灵敏度和特异性均在规定的范围内,并未观察到任何异常结果。
这些稳定性研究结果表明,本试剂在储存和使用期间能够保持其功能和性能。
以上是体外诊断试剂注册申报资料模板中稳定性研究资料部分的示例。
体外诊断试剂稳定性研究的影响因素和评价要求

体外诊断试剂稳定性研究的影响因素和评价要求摘要:体外诊断试剂是指在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品,可单独使用,也可与仪器、器具、设备或系统组合使用。
其中,用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂按照药品进行管理,其他体外诊断试剂按照医疗器械进行管理。
体外诊断试剂稳定性是指产品在生产企业规定的条件下储存,在规定的时间内保持其性能特性的能力,主要包括实时稳定性、运输稳定性、开瓶稳定性、冻融稳定性、机载稳定性、复溶稳定性(冻干产品)等。
稳定性作为评价体外诊断试剂保持产品性能的重要指标,对产品的研发、生产、运输、保存和使用等环节具有重要意义,通过稳定性研究可以评价和调整产品组方、工艺、包装材料等,确定产品的保存期限和开封后保存期限,明确产品的运输、储存和开封后的保存条件,并可在产品保存期限和储存条件等发生变更时,验证变更后的产品稳定性。
关键词:体外诊断试剂稳定性;影响因素;评价要求引言GB/T29791.1-2013明确定义了体外诊断试剂的稳定性:体外诊断医疗器械将性能特性保持在制造商规定的限度内的能力。
该标准规定了三种适用稳定性的情况:第一种情况涉及按照制造商规定的条件储存、运输和使用体外诊断试剂、校准器或调节器;二是按照制造商的指示从封闭容器中提取、配制、使用和储存的溶解干燥材料、工作液和材料;第三,这些是校准仪器或测量系统,其稳定性通常是在体外诊断试剂时测量的。
稳定性是保持产品作为体外诊断试剂的安全性和有效性的重要指标,也是指导产品生产、运输、保存和使用的重要指标。
1开展体外诊断试剂稳定性研究的目的体外诊断试剂可根据成分结构和反应原理分为不同类别,不同产品的成分比较复杂,许多体外诊断试剂本身就是生物制剂。
一些活性体外诊断试剂基质具有不同的化学不稳定性趋势,易发生水解、酶解和氧化等反应,影响试剂的质量和稳定性。
体外诊断试剂的稳定性分析如何去做?

体外诊断试剂的稳定性分析如何去做?稳定性是体外诊断试剂随时间推移保持特性一致性的能力,是试剂必须具有的基本属性,是确保试剂使用过程中有效性的重要指标,也是生产商的职责。
在2014年9月5日,国家食品药品监督管理总局发布了《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2014年第44号)》,公告的附件3中规定“稳定性研究资料包括至少三批样品在实际储存条件下保存至成品有效期后的实时稳定性研究资料,并应当充分考虑产品在储存、运输和使用过程中的不利条件,进行相应的稳定性研究。
应当详细说明稳定性研究方法的确定依据及具体试验方法、过程”。
上述规定是体外诊断试剂产品注册资料中稳定性研究部分的审评依据,规定了稳定性研究的要求、批次和条件等,但对具体的研究方法及内容并未进行详细规定,现参考《生物制品稳定性研究技术指导原则(试行)》和美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)发布的指南性文件EP25-A,介绍体外诊断试剂产品稳定性研究的基本内容及注意事项。
1. 国内体外诊断试剂稳定性研究现状目前大部分企业在研发过程中已开始重视稳定性研究内容,但有些企业在产品注册过程中提交的稳定性研究资料中仍然存在许多问题。
如:①企业将研究重点放在效期稳定性和加速稳定性研究上,忽视了产品开封稳定性、运输稳定性和试剂中所含质控品、校准品稳定性的研究;②企业对产品稳定性考察项目不同,有的企业只考察试剂最后的化学、生物性能是否符合要求,而有的企业则增加了对试剂物理性能的考察,如外观、装量、移行速度等;③效期稳定性研究中,有的企业是研究在规定储存条件下保存至有效期末的产品,有的企业是研究在规定储存条件下保存至有效期后1、2个月乃至半年的产品;④在对产品运输稳定性项目的研究中,相同品种在不同生产企业的研究项目中模拟运输条件差别很大;⑤产品含校准品、质控品的稳定性研究中,有的企业只考察了校准品、质控品的“准确度”项目,而忽视了“均一性”等项目的考察;⑥在制定产品有效期时,大部分企业依据的是产品效期稳定性研究资料,少部分企业依据的是产品加速稳定性研究资料;⑦仅进行了一批产品的稳定性研究工作,未按法规要求进行三批产品的稳定性实验;⑧部分企业因实际生产样品在注册申报时留样时限较短,故采用前期实验室研发过程中的样品代替实际生产样品来考察产品稳定性;⑨稳定性研究实验结果的描述过于笼统,如使用“CV值小于10%”“符合产品技术要求规定”等语句表示,应根据实测结果提供具体检测数据;⑩只提供稳定性考察期末的研究数据,未提供稳定性考察过程中不同时间段的稳定性研究数据;⑪不同企业对同一类产品的有效期要求不一致,如糖化血红蛋白检测类产品的有效期6~36个月不等。
生化试剂性能评估及稳定性测试流程和方法-1026

分析干扰-干扰物测试的浓度
为确定在最坏情况下一种物质是否存在干扰,应当在 实验室分析的患者样本中期望观察到的最高浓度处进 行全面的干扰筛选 。
药物和代谢物:报告的治疗剂量最高浓度的2倍处测试 ; 内源性物质:确定预期的患者群体期望的最高浓度 ; 抗凝血剂和防腐剂:5倍推荐的添加浓度 ; 进食的物质:测试2倍的期望的最大浓度 ; 注:部分干扰物浓度可参照EP7附录推荐浓度。
生化试剂性能评估及稳定 性测试流程和方法
高开显 生化试剂研发部
2009.10.26
内 测试简介 容 测试主要内容 提 分析性能测试 要 稳定性测试
测试简介
定义:是对事物进行评价的过程,是为 确定某种事物存在特性或真实性而采取 的方法和手段。
目的和意义
保证设计开发质量 保证产品质量 确认产品规格符合规格需求
举例:利用Trinder反应为原理的检测试剂会因 含酚类物质被氧化为醌而变为红色。
试剂空白吸光度-测试方法
测定待检试剂在测定波长、37 ℃1℃条 件下检测蒸馏水的吸光度A;
将试剂更换成蒸馏水,再测定吸光度B; 试剂空白吸光度值=A-B。
分析灵敏度
定义:检测系统可检测的样本中最低分 析物浓度;
测试主要内容-测试方案内容
该项测试的任务及目的; 测试所需的资源; 测试所使用的样品信息; 样品的预处理过程,测试的环境条件; 需要进行的测试项目; 测试所需要达到的标准; 其他需要说明的内容。
测试主要内容-测试报告内容
测试所依据的方案; 测试涉及到的样品; 所有得到的测试结果; 由测试得到的结论。
分析干扰-常分析干扰物
生化类体外诊断试剂开瓶稳定性研究

生化类体外诊断试剂开瓶稳定性研究摘要】分析生化类体外诊断试剂的开瓶稳定性。
方法:以朗道质控品为检测样本,利用全自动生化分析仪对总蛋白试剂盒、丙氨酸氨基转移酶检验试剂盒和肌酐检测试剂盒进行检测,分析开瓶时间对检测结果的影响。
结果:在开瓶时间不断增加的情况下,总蛋白(TP)、肌酐(Cre)与谷丙转氨酶(ALT)的误差指标的相对偏差均呈现出上升趋势。
结论:不同类型的生化类体外诊断试剂的开瓶稳定性存在差异。
生化类体外诊断试剂开瓶以后需要尽快使用,在每次检测实施前都需要重新校准。
【关键词】生化类体外诊断试剂;总蛋白;肌酐;谷丙转氨酶随着临床检验技术的不断发展,生化试剂在临床检验领域的作用日渐突出。
医疗设备产业的发展进步,让生化试剂的产品类型呈现出了多样化的特点[1]。
受生产规模、技术水平及产品质量等因素的影响,来自不同厂家的生化类体外试剂的产品质量存在一定的差异[2]。
在临床检验领域,生化试剂中的部分组分在受热、受潮及受光以后出现的分解、失活现象也会给临床诊断结果的准确性带来不利的影响。
受业务量的影响,一些医院在试剂开瓶以后,往往需要利用很长的时间消耗试剂,试剂开瓶后放置时间对临床诊断结果的影响是一些研究者所关注的内容。
本次研究旨在分析生化类体外诊断试剂的开瓶稳定性。
1.资料及方法1.1一般资料本次研究以朗道质控品为检测样本,利用全自动生化分析仪开展开瓶稳定性实验,对总蛋白试剂盒、丙氨酸氨基转移酶检验试剂盒和肌酐检测试剂盒进行检测。
应用于本次研究的朗道质控品中包含有TP、Cre与ALT等物质,参考值分别为45.0g/L、138U/L与366μmol/L。
总蛋白试剂盒的组成成分以硫酸铜、铝氧化钠、酒石酸钾钠与碘化钾为主。
丙氨酸氨基转移酶检测试剂盒中包含有Tris-HCl、L-丙氨酸、α-酮戊二酸、NADH、乙二醇和L-乳酸脱氢酶。
肌酐检测试剂盒的组成成分以苦味酸及氢氧化钠为主。
应用于本次研究的实验设备为DS-800全自动生化分析仪。
体外诊断试剂稳定性研究资料模板

体外诊断试剂稳定性研究资料模板文件编号:___________________文件版本:__________________编制人员:__________________编制时间:__________________审核人员:__________________审核时间:__________________批准人员:__________________批准时间:__________________前言稳定性是体外诊断试剂随着时间推移保持一致性的能力,是试剂必须具备的基本属性,是确保试剂使用过程中有效的重要指标,是根据产品的理化性质,设计合理的稳定性试验研究项目,以考察不同条件下产品的主要质量指标随时间的变化情况,为产品的保存条件和有效期的确定以及使用方法中有关注意事项提供依据。
产品的稳定性研究包括:1、实时稳定性:通过实时稳定性确定产品的保存期限;2、加速稳定性:通过加速破坏试验初步预估产品使用稳定性;3、运输稳定性:模拟试剂的运输及保存条件,考察运输过程中试剂质量的变化情况;4、样本稳定性:试剂的试用样本在不同的存储条件下保存时,其检测结果的稳定性,从而确定样本的保存期限。
5、开封稳定性:检测试剂对环境的敏感度,因此需要确定第一次打开包装后的稳定性。
本产品的稳定性研究资料基于国家食品药品监督管理局《体外诊断试剂注册申报资料要求及说明》的有关要求,主要参考《化学药品稳定性研究指导原则》、YY/T1579-2018/ISO 23640:2011《体外诊断医疗器械-体外诊断试剂稳定性评价》、中国药品生物制品检定所王春仁的《医疗器械加速老化试验确定的有效期的基本原理和方法》等文献,作为研究方法的确定依据。
第一章实时稳定性研究1.1.实时稳定性研究方法的确定依据实时稳定性是指将体外诊断试剂置于制造商规定的条件下建立或验证试剂性能的试验,其影响条件可能包括温度、运输条件、振动、光、湿度。
实时稳定性将模拟试剂的保存条件,在一定的时间间隔后,对试剂性能的主要指标进行检测,记录并分析检测数据,确认试剂盒的有效期限。
IVD试剂性能评估-稳定性

稳定性是体外诊断试剂随时间推移保持特性一致性的能力,是试剂必须具有的基本属性,是确保试剂使用过程中有效性的重要指标,也是生产商的职责。
在2014年9月5日,国家食品药品监督管理总局发布了《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2014年第44号)》,公告的附件3中规定“稳定性研究资料包括至少三批样品在实际储存条件下保存至成品有效期后的实时稳定性研究资料,并应当充分考虑产品在储存、运输和使用过程中的不利条件,进行相应的稳定性研究。
应当详细说明稳定性研究方法的确定依据及具体试验方法、过程”。
上述规定是体外诊断试剂产品注册资料中稳定性研究部分的审评依据,规定了稳定性研究的要求、批次和条件等,但对具体的研究方法及内容并未进行详细规定,现参考《生物制品稳定性研究技术指导原则(试行)》和美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)发布的指南性文件EP25-A,介绍体外诊断试剂产品稳定性研究的基本内容及注意事项。
1.目前大部分企业在研发过程中已开始重视稳定性研究内容,但有些企业在产品注册过程中提交的稳定性研究资料中仍然存在许多问题。
如:①企业将研究重点放在效期稳定性和加速稳定性研究上,忽视了产品开封稳定性、运输稳定性和试剂中所含质控品、校准品稳定性的研究②企业对产品稳定性考察项目不同,有的企业只考察试剂最后的化学、生物性能是否符合要求,而有的企业则增加了对试剂物理性能的考察,如外观、装量、移行速度等;③效期稳定性研究中,有的企业是研究在规定储存条件下保存至有效期末的产品,有的企业是研究在规定储存条件下保存至有效期后1、2个月乃至半年的产品;④在对产品运输稳定性项目的研究中,相同品种在不同生产企业的研究项目中模拟运输条件差别很大;⑤产品含校准品、质控品的稳定性研究中,有的企业只考察了校准品、质控品的“准确度”项目,而忽视了“均一性”等项目的考察;⑥在制定产品有效期时,大部分企业依据的是产品效期稳定性研究资料,少部分企业依据的是产品加速稳定性研究资料;⑦仅进行了一批产品的稳定性研究工作,未按法规要求进行三批产品的稳定性实验;⑧部分企业因实际生产样品在注册申报时留样时限较短,故采用前期实验室研发过程中的样品代替实际生产样品来考察产品稳定性;⑨稳定性研究实验结果的描述过于笼统,如使用“CV值小于10%”“符合产品技术要求规定”等语句表示,应根据实测结果提供具体检测数据;⑩只提供稳定性考察期末的研究数据,未提供稳定性考察过程中不同时间段的稳定性研究数据;⑪不同企业对同一类产品的有效期要求不一致,如糖化血红蛋白检测类产品的有效期6~36个月不等。
体外诊断试剂稳定性研究概述

综述Review体外诊断试剂稳定性研究是制定体外诊断试剂产品储存条件和有效期的重要依据,它影响了体外诊断试剂产品组成、生产工艺和产品外包装材料的选择等环节,同时也影响了体外诊断试剂产品技术要求中各性能指标的确定。
2014年9月5日,国家食品药品监督管理总局发布了《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2014年第44号)》,公告的附件3中规定“稳定性研究资料包括至少三批样品在实际储存条件下保存至成品有效期后的实时稳定性研究资料,并应当充分考虑产品在储存、运输和使用过程中的不利条件,进行相应的稳定性研究。
应当详细说明稳定性研究方法的确定依据及具体试验方法、过程”。
上述规定作为体外诊断试剂产品注册资料中稳定性研究部分的审评依据,规定了稳定性研究的类型、批次和研究条件等,但并未就具体研究内容进行详细规定,现参考《生物制品稳定性研究技术指导原则(试行)》和美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute ,CLSI )发布的指南性文件EP25-A ,介绍体外诊断试剂产品稳定性研究的基本内容及注意事项。
1.开展体外诊断试剂稳定性研究的目的体外诊断试剂根据组成结构和反应原理等可分为不同类别,各类别产品组成成分也比较复杂,许多体外诊断试剂本身就是生物试剂。
一些体外诊断试剂组成成分的活性基团会有不同的化学不稳定性趋向,容易发生水解、酶解和氧化等反应,从而影响到试剂的质量和稳定性。
如含有多肽类的冻干粉试剂,其储存环境中的含水量和含氧量对试剂稳定性的影响非常大。
因此体外诊断试剂稳定性研究的目的是为了了解体外诊断试剂成品在各种因素影响下质量变化情况。
影响体外诊断试剂质量的因素包括温度、湿度、振动、氧化和光照等[1]。
根据稳定性研究结果,企业可以确定体外诊断试剂产品的储存条件、检验周期和产品有效期等。
2.国内体外诊断试剂稳定性研究现状目前大部分企业在研发过程中已开始重视稳定性研究内容,但有些企业在产品注册过程中提交的稳定性研究资料中仍然存在许多问题。
体外诊断试剂稳定性问题理解

关于体外诊断试剂稳定性研究问题理解稳定性研究是贯穿整个IVD产品研发阶段和支持IVD产品上市后研究的重要内容,是产品有效期的设定依据,可以用于对产品生产工艺、配方选择、包装材料选择合理性的判断,同时也是制定产品质量标准的基础,因此稳定性研究作为一项独立的注册资料是非常值得我们重视的,在稳定性研究过程中应该考虑到哪些方面,应该遵循什么样的基本原则需要我们深入的探讨,因为绝大部分IVD产品均含有生物活性成分,因此本文参考了生物制品稳定性研究技术指导原则(试行)的相关要求,分八个方面阐述了对产品稳定性研究一些浅显的理解。
方案在开展稳定性研究之前,首先需要制定稳定性研究的方案,包括确定研究用的样品、研究设定的条件、具体的研究项目、持续的研究时间、如何进行运输研究以及最后对研究结果的分析等。
对于我们常见的IVD产品一般包括三个方面的稳定性研究:长期(实时)稳定性研究、加速稳定性研究、强制条件稳定性研究,长期稳定性研究是制定产品保存条件及有效期主要依据,加速和强制稳定性研究是用于了解产品在短期偏离正常保存条件或极端条件下的稳定性情况,当然也可以作为确定保存条件和有效期的参考数据。
无论做哪一种稳定性研究,都需要对所选用的试验方法进行验证,确保其不会因为人员、时间、环境等外部因素带来不可接受的试验误差、对于长期稳定性研究尤其应注意其选用的试验方法应与产品出厂放行时所用的检验方法一致。
样本在稳定性研究过程中一般应至少选用三个批次的样品进行试验,各个阶段稳定性研究样品的生产工艺与质量要求均应保持一致,每批产品的数量应至少满足稳定性研究的需要,但如果产品的生产批量大小可能会对产品的实际性能造成影响的话,在成本可控的前提下建议可以采用强制条件稳定性研究,例如:满负荷批量生产三批产品进行产品稳定性研究。
产品的包装材料应保持与实际储存采用的包装材料相同,以验证包装材料是否对产品的稳定性会造成影响。
条件稳定性研究应根据研究目的和产品的本身特点对研究条件进行摸索和优化,不应千篇一律的套用其他产品的验证方式。
生化试剂性能评估及稳定性测试流程和方法-20091026

国标与行标,如:WS/T 124-1999临床化学体外诊断试剂盒质量检验 总则、GB临床化学体外诊断试剂(盒)通用技术要求(报批稿) 企业标准 临床试验、注册检验、现场质量体系审核
CE认证 认证
IVD指令:98/79 EC 协调标准 质量体系,自我测试,自我宣称,现场质量体系审核
FDA注册 注册
分析干扰-干扰原液的制备
抗坏血酸、黄疸、脂血:分别称取一定量的抗坏血酸 纯品、胆红素纯品和内源性酯纯品溶于纯水(胆红素 溶于0.1 mol/L的NaOH溶液中 )中,充分混匀后得到 干扰原液; 溶血:以新鲜全血自制溶血干扰物;收集普通全血标 本,充分离心;吸走上清液,加入5~10 mL的生理盐 水,适度摇动混匀清洗沉积细胞,离心,吸走上清液; 重复三次上述过程后离心收集沉淀,加入与沉淀等体 积的去离子水,混匀,室温静置10 min后置冰箱-20 ℃ 冷冻过夜,复融后充分离心,收集上清液,在血液细 胞分析仪上测试血红蛋白浓度,血红蛋白浓度应加去 离子水调整至100 g/L。
精密度-基本要求
样品一定要稳定,且应与新鲜的临床病人标本性能接 近,稳定的冷冻混合血清是首选; 样本中的分析物含量应在该项目的医学决定水平处, 尽可能做两个水平的精密度实验; 采用冷冻保存的样品一定要注意内含分析物的稳定, 要严格控制冻融、混匀的操作; 一个分析系统上的检测数据只能反应该系统的精密度 性能,不能代表该项目在所有机型上的性能,亦不能 代表该检测系统对所有项目检测的性能。
测试主要内容-测试方案内容
该项测试的任务及目的; 测试所需的资源; 测试所使用的样品信息; 样品的预处理过程,测试的环境条件; 需要进行的测试项目; 测试所需要达到的标准; 其他需要说明的内容。
测试主要内容-测试报告内容
体外诊断试剂稳定性问题理解

体外诊断试剂稳定性问题理解标准化管理部编码-[99968T-6889628-J68568-1689N]关于体外诊断试剂稳定性研究问题理解稳定性研究是贯穿整个IVD产品研发阶段和支持IVD产品上市后研究的重要内容,是产品有效期的设定依据,可以用于对产品生产工艺、配方选择、包装材料选择合理性的判断,同时也是制定产品质量标准的基础,因此稳定性研究作为一项独立的注册资料是非常值得我们重视的,在稳定性研究过程中应该考虑到哪些方面,应该遵循什么样的基本原则需要我们深入的探讨,因为绝大部分IVD产品均含有生物活性成分,因此本文参考了生物制品稳定性研究技术指导原则(试行)的相关要求,分八个方面阐述了对产品稳定性研究一些浅显的理解。
方案在开展稳定性研究之前,首先需要制定稳定性研究的方案,包括确定研究用的样品、研究设定的条件、具体的研究项目、持续的研究时间、如何进行运输研究以及最后对研究结果的分析等。
对于我们常见的IVD产品一般包括三个方面的稳定性研究:长期(实时)稳定性研究、加速稳定性研究、强制条件稳定性研究,长期稳定性研究是制定产品保存条件及有效期主要依据,加速和强制稳定性研究是用于了解产品在短期偏离正常保存条件或极端条件下的稳定性情况,当然也可以作为确定保存条件和有效期的参考数据。
无论做哪一种稳定性研究,都需要对所选用的试验方法进行验证,确保其不会因为人员、时间、环境等外部因素带来不可接受的试验误差、对于长期稳定性研究尤其应注意其选用的试验方法应与产品出厂放行时所用的检验方法一致。
样本在稳定性研究过程中一般应至少选用三个批次的样品进行试验,各个阶段稳定性研究样品的生产工艺与质量要求均应保持一致,每批产品的数量应至少满足稳定性研究的需要,但如果产品的生产批量大小可能会对产品的实际性能造成影响的话,在成本可控的前提下建议可以采用强制条件稳定性研究,例如:满负荷批量生产三批产品进行产品稳定性研究。
产品的包装材料应保持与实际储存采用的包装材料相同,以验证包装材料是否对产品的稳定性会造成影响。
体外诊断试剂的稳定性试验

体外诊断试剂的稳定性试验欧洲标准(EN1364:2002)与英国标准具有同等效力(CEN——欧洲标准委员会)序言此英国标准为EN13640:2002文件官方英文版本英国制定的这个文件是在技术委员会CH/69授权下制定的。
在体外诊断这块,它负责:——帮助查询者理解文件内容——向欧洲委员会上报查询者对该文件的解释,修改建议,并保持该文件的权威。
——关注国际和欧洲的进展并在该文件中颁布。
可以技术委员会秘书处申请获得委员会列出的组织名单参考英国标准所参考的资料部分可在BSI标准的目录“国际统一标准索引”找到,或在BSI标准电子目录软件中点击“Find”就可找到。
该标准主旨不是要包揽一项合同的所有条款,使用者要正确使用该标准。
体外诊断试剂的稳定性试验此欧洲标准是欧洲委员会(CEN)2001年12月27日制定并实施的:CEN成员国必须遵守CEN内部规则,在此规则的制约下,CEN各成员国采用此欧洲标准作为本国标准,但不能对该标准作任何改动。
最新条款和参考文件可向管理中心或CEN成员国申请获得。
该标准有三种官方版本(英语、法语、德语)。
CEN成员国可以把它翻译成本国语言版本,并上报管理中心以获得认可作为本国的官方版本。
CEN成员国是执行该标准的主体,它们是:澳大利亚、比利时、捷克、丹麦、芬兰、法国、德国、希腊、冰岛、爱尔兰、意大利、卢森堡、荷兰、马尔他、葡萄牙齿、西班牙、瑞典、瑞士和英国。
前言该文件(EN13640:2002)由技术委员会(简写TC)制定。
“体外诊断医用设备”部分由DIN 主持的秘书处负责。
通过出版同一文本或签注,各国可采用欧洲标准作为本国的标准。
在2002年9月前,那些标准相违反的款项必须取消。
此文件在欧洲委员会和欧洲自由贸易组织批令下由CEN制定,该文件支持欧盟指令。
与欧盟批令的关系见附见ZA附件A和ZA只具告知性,不作要求。
此标准包括一个参考资料根据CEN内部规定,下列国家的国标准机构必须实施欧洲标准:澳大利亚、比利时等(与上页所列相同)1、适用范围该欧洲标准适用于体外诊断药品,包括试剂产品,校准仪器、标准品和试剂盒,下面简称IVD 药品。
IVD试剂性能评估-稳定性

IVD试剂性能评估-稳定性稳定性是指IVD(体外诊断)试剂在一定的储存条件下,能够保持其主要性能指标不变的能力。
为了确保诊断试剂的准确性和可靠性,稳定性是评估IVD试剂品质的重要指标之一、本文将重点探讨IVD试剂稳定性评估的相关内容。
IVD试剂的稳定性评估是一个系统工程,包含试剂储存稳定性、运输稳定性和使用稳定性等环节。
其中,试剂储存稳定性是指试剂在特定的储存条件下,保存一定时间后依然能保持其主要性能指标不变。
试剂的储存条件一般包括温度、湿度以及光照等因素。
试剂储存条件的稳定性评估需要通过设计一系列的实验来模拟实际使用情况,比如设定不同的温度和湿度条件,并在不同时点对试剂进行测试,比较测试结果来评估试剂的稳定性。
为了确保试剂在运输过程中也能保持其稳定性,运输稳定性也是评估的重要内容。
运输稳定性评估常常需要对试剂进行模拟性运输,主要包括模拟不同气候条件下的运输过程,比如高温、低温、高湿度、低气压等,采用合适的测试方法来评估试剂的性能变化情况。
使用稳定性是指试剂在实际使用条件下,能够保持其主要性能指标不变的能力。
实际使用条件包括试剂的保存和操作环境等因素。
比如,试剂在高温环境下是否会分解,或者在特定的PH值下是否会发生变化。
使用稳定性评估需要模拟实际使用情况,并在一定时间内对试剂进行测试,以判断其是否具备足够的使用稳定性。
在IVD试剂稳定性评估过程中,为了确保试剂的稳定性,通常会涉及到一系列实验室测试。
比如,可以通过测定试剂的活性、灵敏度、特异性等指标来评估其稳定性。
同时也可以通过测定试剂液体的物理性质变化,比如颜色、浓度、pH值等来评估试剂的稳定性。
还可以利用稳定性福尔达图等方法,建立试剂稳定性数据的统计模型,从而更好地评估试剂的稳定性。
除了实验室测试,试剂的稳定性评估也需要结合市场反馈和用户体验等信息,比如市场上已经有关于试剂的应用反馈、产品投诉、不良事件等,这些信息也会对试剂的稳定性评估起到一定的参考作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生化类体外诊断试剂开瓶稳定性研究
摘要】分析生化类体外诊断试剂的开瓶稳定性。
方法:以朗道质控品为检测样本,利用全自动生化分析仪对总蛋白试剂盒、丙氨酸氨基转移酶检验试剂盒和肌酐检测试剂盒进行检测,分析开瓶时间对检测结果的影响。
结果:在开瓶时间不断增加的情况下,总蛋白(TP)、肌酐(Cre)与谷丙转氨酶(ALT)的误差指标的相对偏差均呈现出上升趋势。
结论:不同类型的生化类体外诊断试剂的开瓶稳定性存在差异。
生化类体外诊断试剂开瓶以后需要尽快使用,在每次检测实施前都需要重新校准。
【关键词】生化类体外诊断试剂;总蛋白;肌酐;谷丙转氨酶
随着临床检验技术的不断发展,生化试剂在临床检验领域的作用日渐突出。
医疗设备产业的发展进步,让生化试剂的产品类型呈现出了多样化的特点[1]。
受生产规模、技术水平及产品质量等因素的影响,来自不同厂家的生化类体外试剂的产品质量存在一定的差异[2]。
在临床检验领域,生化试剂中的部分组分在受热、受潮及受光以后出现的分解、失活现象也会给临床诊断结果的准确性带来不利的影响。
受业务量的影响,一些医院在试剂开瓶以后,往往需要利用很长的时间消耗试剂,试剂开瓶后放置时间对临床诊断结果的影响是一些研究者所关注的内容。
本次研究旨在分析生化类体外诊断试剂的开瓶稳定性。
1.资料及方法
1.1一般资料
本次研究以朗道质控品为检测样本,利用全自动生化分析仪开展开瓶稳定性实验,对总蛋白试剂盒、丙氨酸氨基转移酶检验试剂盒和肌酐检测试剂盒进行检测。
应用于本次研究的朗道质控品中包含有TP、Cre与ALT等物质,参考值分别为45.0g/L、138U/L与366μmol/L。
总蛋白试剂盒的组成成分以硫酸铜、铝氧化钠、酒石酸钾钠与碘化钾为主。
丙氨酸氨基转移酶检测试剂盒中包含有Tris-HCl、L-丙氨酸、α-酮戊二酸、NADH、乙二醇和L-乳酸脱氢酶。
肌酐检测试剂盒的组成成分以苦味酸及氢氧化钠为主。
应用于本次研究的实验设备为DS-800全自动生化分析仪。
1.2方法
总蛋白试剂盒的方法学以双缩脲法为主,丙氨酸氨基转移酶检测试剂盒的方法学以丙氨酸底物法为主;肌酐检测试剂盒的方法学以苦味酸法为主。
研究期间朗道质控品试剂放入生化分析仪,仪器处于开机状态,研究人员每日完成3次质控品测定,以三次检测的平均值作为当日的检测结果,计算试剂检测结果的变化情况,在试剂相对偏差超出10%的情况下判定试剂失控。
1.3观察指标
试剂开瓶以后的误差指标。
1.4统计学处理
利用SPSS18.0软件进行统计学处理,计数资料的表述方式为数(n)或率(%)。
2.结果
根据开瓶后连续21日的测定结果。
TP与Cre的误差指标的相对偏差均呈现出上升趋势,ALT的指标波动较为平缓,见表1。
3.讨论
根据试剂盒开瓶后的稳定性检验解雇,试剂在前7日的检测结果并没有出现明显波动。
根据检测结果的变化情况,TP的相对偏差变化表明此种物质在开瓶后21d达到临界点,
ALT在开瓶后21d内并未达到临界值,肌酐检测试剂在开瓶后15日内达到临界点,开瓶后15d的检测结果表明此种物质已经出现变质现象。
上述结果表明TP试剂开瓶以后的有效期为21d,ALT开瓶后的有效期在21d以上,肌酐检测试剂开瓶后的有效期为15d。
上述三种体外诊断试剂的开瓶后有效期的差异与三者之间的方法学差异存在一定的联系。
在碱性条件下,肌酐与苦味酸之间的化学反应会生成橘红色的苦味酸-肌酐复合物,氢氧化钠可以为此种物质提供碱性环境,故而在肌酐检测试剂应用于临床诊断以后,研究者可以根据以下因素完成肌酐的测定:一是,肌酐与其他干扰物质之间的反应速度;二是,肌酐与苦味酸之间的反应速度。
试剂开瓶以后,氢氧化钠与二氧化碳之间的化学反应会让试剂的抗干扰能力有所降低,进而导致相对偏差的变化[3]。
TP体外诊断试剂与双缩脲反应原理之间具有一定的联系。
在碱性条件下,双缩脲可以与铜离子之间生成紫色络合物,在试剂开瓶以后,氢氧化钠与二氧化碳之间的反应会对实际中的氢氧化钠进行中和,进而在降低试剂PH值有所降低。
试剂PH值的变化可以被看作是总蛋白试剂盒的检测结果变化的主要影响因素[4]。
就本次研究而言,试剂开瓶后的使用效果的影响因素具有多样化的特点。
综上所述,不同类型的生化类体外诊断试剂的有效期存在差异。
在临床诊断领域,临床工作者在试剂开瓶以后需尽快使用试剂,并要在每次检测实施前进行重新校准。
参考文献:
[1]许翔.体外诊断试剂物流质量控制[J].中国卫生产业,2019,16(03):85-87.
[2]张洁英.体外诊断试剂有效管理与质量安全控制的探讨[J].临床医药文献电子杂
志,2019,6(07):181.
[3]石红.体外诊断试剂规范化管理的实践与探索[J].江苏卫生事业管理,2018,29(11):1275-1278.
[4]邢菁华,张洵君.当代体外诊断行业问题及风险防范[J].医学争鸣,2018,9(05):63-66.。
