物化实验-溶液偏摩尔体积的测定
溶液偏摩尔体积的测定实验报告

溶液偏摩尔体积的测定实验报告
实验目的:
测定溶液的偏摩尔体积。
实验原理:
溶液的偏摩尔体积是指在一个特定温度下,溶质在溶液中单位摩尔体积的变化量。
偏摩尔体积可以通过对溶液稀释的实验来测定,根据实验数据可以绘制出摩尔体积随溶液浓度变化的曲线。
实验步骤:
1. 准备一定浓度的溶液A,并称取一定体积的溶液A。
2. 先称取一定体积的纯溶剂B,随后将溶液A定量加入纯溶剂B中,制备一系列不同浓度的溶液。
3. 分别测量不同浓度的溶液的摩尔体积,记录浓度和对应的摩尔体积数据。
4. 根据实验数据绘制摩尔体积随浓度变化的曲线。
实验数据:
溶液浓度 / mol/L 摩尔体积 / mL
0.1 50
0.2 48
0.3 45
0.4 42
0.5 40
实验结果:
根据实验数据绘制的摩尔体积随浓度变化的曲线如下:
实验讨论:
根据曲线可以看出,随着溶液浓度的增加,摩尔体积逐渐减小,这说明溶质在溶液中占据的体积随着浓度的增加而减小。
这可能是由于溶质分子在溶液中的相互作用力导致的。
结论:
本实验测定了溶液的偏摩尔体积,实验结果显示溶质在溶液中占据的体积随着溶液浓度的增加而减小。
物化实验偏摩尔体积测定
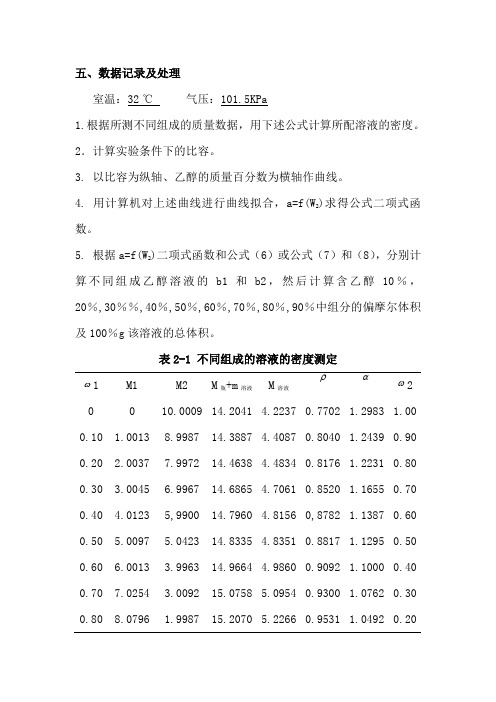
五、数据记录及处理室温:32℃气压:101.5KPa1.根据所测不同组成的质量数据,用下述公式计算所配溶液的密度。
2.计算实验条件下的比容。
3. 以比容为纵轴、乙醇的质量百分数为横轴作曲线。
4. 用计算机对上述曲线进行曲线拟合,a=f(W2)求得公式二项式函数。
5. 根据a=f(W2)二项式函数和公式(6)或公式(7)和(8),分别计算不同组成乙醇溶液的b1和b2,然后计算含乙醇10%,20%,30%%,40%,50%,60%,70%,80%,90%中组分的偏摩尔体积及100%g该溶液的总体积。
表2-1 不同组成的溶液的密度测定ω1 M1 M2 M瓶+m溶液M溶液ραω20 0 10.0009 14.2041 4.2237 0.7702 1.2983 1.00 0.10 1.0013 8.9987 14.3887 4.4087 0.8040 1.2439 0.90 0.20 2.0037 7.9972 14.4638 4.4834 0.8176 1.2231 0.80 0.30 3.0045 6.9967 14.6865 4.7061 0.8520 1.1655 0.70 0.40 4.0123 5,9900 14.7960 4.8156 0,8782 1.1387 0.60 0.50 5.0097 5.0423 14.8335 4.8351 0.8817 1.1295 0.50 0.60 6.0013 3.9963 14.9664 4.9860 0.9092 1.1000 0.40 0.70 7.0254 3.0092 15.0758 5.0954 0.9300 1.0762 0.30 0.80 8.0796 1.9987 15.2070 5.2266 0.9531 1.0492 0.200.90 9.0142 1.10129 15.3134 5.3330 0.9725 1.0283 0.10 1.00 10.0012 015.4641 5.4837 1.0000 1.0000图1 溶液的比容—质量百分数关系Y=1.0097+0.1713X+0.1098Xαω21β2βk 1.0000 0 1.0000 1.2056 0.1713 1.0283 0.10 1.0108 1.2500 0.1933 1.0492 0.20 1.0074 1.2656 0.2152 1.0762 0.30 1.0047 1.2893 0.2372 1.1000 0.40 0.9987 1.3096 0.2591 1.12950.500.99091.32820.28111.1387 0.60 0.9578 1.3215 0.30311.1655 0.70 0.9393 1.3557 0.32501.2231 0.80 0.9469 1.3663 0.34701.2439 0.90 0.9114 1.3540 0.36891.2983 1.00 0.9083 1.2983 0.3909六、注意事项1.实际需配制9份溶液,可用移液管加液,但乙醇含量根据称重算得。
物化实验——溶液偏摩尔体积的测定

溶液偏摩尔体积的测定一、实验目的1.掌握用比重瓶测定溶液密度的方法。
2.测定指定组成的乙醇—水溶液中各组分的偏摩尔体积。
二、实验原理在多组分体系中,某组分i 的偏摩尔体积定义为,,,()j i m i T p n i j V V n ≠⎛⎫∂= ⎪∂⎝⎭ (1) 若是二组分体系,则有21,1,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (2) 12,2,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (3) 体系总体积V=n1V1,m +n2V2。
m (4)将(4)式两边同除以溶液质量W1,2,1212m mV V W W V W M W M W=+g g (5) 令 1,2,12,,m m V V VW W Wααα=== (6) 式中α是溶液的比容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代入(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)将(7)式对W2%微分:122122,%%W W αααααα∂∂=-+=+∂∂即 (8)将(8)代回(7),整理得121%%W W ααα∂=-∂g(9) 和 212%%W W ααα∂=+∂g (10)所以,实验求出不同浓度溶液的比容α,作α—W2%关系图,得曲线CC′(见图。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为α1和α2,再由关系式(6)就可求出V1,m 和V2,m 。
三、仪器与药品1.仪器恒温设备1套;分析天平(公用);比重瓶(10mL)2个;工业天平(公用);磨口三角瓶(50mL)4个。
2.药品95%乙醇(分析纯),纯水。
四、实验步骤1.调节恒温槽温度为±℃。
2.以95%乙醇(A)及纯水(B)为原液,在磨口三角瓶中用工业天平称重,配制含A质量百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总体积控制在40mL 左右。
实验四-溶液偏摩尔体积的测定

lnK p
T
V RT
你知道 么?
溶液偏摩尔体积
乙醇与汽油相溶后会导 致体积下降
一.目的要求
1
理解偏摩尔量 的物理意义
2
比重瓶测定溶液 密度的方法
测定指定组成的乙
3 醇-水溶液中各组 分的偏摩尔体积
二.实验原理
在多组分体系中, 某组分i的偏摩尔体积定义为
二组分
Z B,m
定义 溶液偏摩尔体积
偏摩尔体积就是一定量溶质溶在 一摩尔溶液中所应起的体积变化, 它是溶液浓度函数
往无限大的体系中加入 1mol 其它组分,体系体积的变化量
或往有限的体系中加入微量的 其它组分而引起该体系体积的 变化
重要性 溶液偏摩尔体积
热力学中的一个重要基本概念
重要基础数据(化学、 化工、 医药)
你知道 需要计算所配溶液中 么? 乙醇的准确质量分数
0% 20% 40% 60% 80%
100%
四.实验步骤
3 .比重瓶体积的测定
用电子天平精确称量洁净、干燥的比重瓶
四.实验步骤
3 .比重瓶体积的测定
然后用电子天平精确称量盛满蒸馏水的比重瓶重量
四.实验步骤
3 .比重瓶体积的测定
然后用电子天平精确称量盛满蒸馏水的比重瓶重量
下列说法正确的是:
A 拿比重瓶时应手持其颈部
比重瓶加满溶液后,瓶内及塞子上的毛
B
细管可以有气泡
C
比重瓶加满溶液后,瓶内及塞子上的毛细管要 不能有气泡产生
称量前必须用滤纸把比重瓶的外表面擦
D
干净
提交
多选题 50分
为提高溶液密度测量精度,可作哪些改进?
A 准确称量以计算溶液的质量分数 多次测量同一组成溶液的质量,结果取
2021年实验二溶液偏摩尔体积的测定实验报告思考题绘图

试验二 溶液偏摩尔体积测定一、试验目偏摩尔量是溶液中一个关键参数, 有很多性质都与偏摩尔数量相关。
本试验是测定溶液偏摩尔体积。
1. 掌握用比重瓶测定溶液密度方法;2. 利用密度法测定指定组成乙醇—水溶液中各组分偏摩尔体积;3. 学会恒温槽使用。
4. 了解偏摩尔量物理意义。
二、 预习要求1.复习课堂讲授内容, 真正了解偏摩尔量物理意义。
2.了解摩尔体积—摩尔分数图与比容—质量百分数图之间关系。
三、 试验原理在多组分体系中, 某组分i 偏摩尔体积定义为,,,()j i m i T p n i j V V n ≠⎛⎫∂= ⎪∂⎝⎭ (1) 若是二组分体系, 则有21,1,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (2) 12,2,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (3) 体系总体积V=n1V1, m +n2V2。
m (4)将(4)式两边同除以溶液质量W1,2,1212m mV V W W V W M W M W=+(5) 令 1,2,12,,m m V V V W W Wααα=== (6) 式中α是溶液比容; α1, α2分别为组分1、 2偏质量体积。
将(6)式代入(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)将(7)式对W2%微分:122122,%%W W αααααα∂∂=-+=+∂∂即 (8) 将(8)代回(7), 整理得121%%W W ααα∂=-∂ (9) 和 212%%W W ααα∂=+∂ (10)所以, 试验求出不一样浓度溶液比容α, 作α—W2%关系图, 得曲线CC′(见图15.1)。
如欲求M浓度溶液中各组分偏摩尔体积, 可在M点作切线, 此切线在两边截距AB和A′B′即为α1和α2, 再由关系式(6)就可求出V1,m 和V2,m 。
四、 仪器与药品1.仪器恒温设备1套; 分析天平(公用); 比重瓶(10mL)2个; 工业天平(公用); 磨口三角瓶(50mL)4个。
乙醇—水溶液偏摩尔体积的测定

⼄醇—⽔溶液偏摩尔体积的测定溶液偏摩尔体积的测定【⽬的要求】1. 掌握⽤⽐重瓶测定溶液密度的⽅法。
2. 测定指定组成的⼄醇-⽔溶液中各组分的偏摩尔体积。
3. 理解偏摩尔量的物理意义。
【实验原理】略【仪器药品】恒温设备1套;电⼦天平1台;分析天平;⽐重瓶(5 mL或10mL,1只);磨⼝三⾓瓶(50mL,4只)。
⽆⽔⼄醇(A.R.),蒸馏⽔。
【实验步骤】1. 调节恒温槽温度为(25.0±0.1)℃。
2. 配制溶液以⽆⽔⼄醇及蒸馏⽔为原液,在磨⼝三⾓瓶中⽤电⼦天平称重,配制含⼄醇质量百分数为0%,20%,40%,60%,80%,100%的⼄醇⽔溶液,每份溶液的总重量控制在15g(10 mL⽐重瓶可配制25g)左右。
配好后盖紧塞⼦,以防挥发。
3. ⽐重瓶体积的标定⽤电⼦天平精确称量洁净、⼲燥的⽐重瓶,然后盛满蒸馏⽔置于恒温槽中恒温10min。
⽤滤纸迅速擦去⽑细管膨胀出来的⽔。
取出⽐重瓶,擦⼲外壁,迅速称重。
平⾏测量两次。
4. 溶液⽐容的测定按上法测定每份⼄醇-⽔溶液的⽐容。
【数据处理】1. 根据25℃时⽔的密度和称重结果,求出⽐重瓶的容积。
2. 计算所配溶液中⼄醇的准确质量百分⽐。
3. 计算实验条件下各溶液的⽐容。
4. 以⽐容为纵轴、⼄醇的质量百分浓度为横轴作曲线,并在30%⼄醇处作切线与两侧纵轴相交,即可求得α1和α2。
5. 求算含⼄醇30%的溶液中各组分的偏摩尔体积及100g该溶液的总体积。
五、数据记录与处理室温:25℃压强:100.6Kpa1、根据25℃时⽔的密度和称重结果,求出⽐重瓶的容积。
⽐重瓶容积的测定记录表温度:25℃纯⽔密度:0.9707*103Kg/m32.根据所测不同组成溶液的质量数据,算出所配溶液的密度,并计算实验条件下各溶液的⽐容。
不同组成溶液的密度、⽐容测定记录表3、以⽐容为纵轴、⼄醇的质量百分浓度为横轴作曲线。
图1 溶液的⽐容—⼄醇质量分数关系图对曲线进⾏拟合,求的α=f(w2)⼆项式函数:α=f(w2)=2.46x-1.2x^2+1.0055.计算含⼄醇20%,40%,60%的溶液中各组分的偏摩尔体积及100克该溶液的总体积。
物理化学实验报告 偏摩尔体积

物理化学实验报告偏摩尔体积的测定1.实验目的及要求:(1)配制不同浓度的NaCI水溶液,测定各溶液的密度(2)计算溶液中各组分的偏摩尔体积(3)学习用密度瓶测定液体的密度2.实验原理:根据热力学概念,体系的体积V为广度性质,其偏摩尔量则为强度性质。
设体系有两组分A,B,体系的总体积V是温度,压力n A和n B的函数,即:V=f(n A, n B,T,P)组分A,B的偏摩尔体积定义为:V A=(∂V∂n A )T,P,nBV B=(∂V∂n B)T,P,nA在恒定温度和压力下:dV=(∂V∂n A )T,P,nBd n A+(∂V∂n B)T,P,nAd n BdV=V A d n A+ V B d n B偏摩尔量是强度性质,与体系浓度有关,而与体系总量无关。
体系总体积可积分得到:V=n A V A+n B V B恒温条件下在进行微分:dV=n A dV A+V A d n A+n B dV B+ V B d n B得吉布斯—杜亥姆方程:n A dV A+n B dV B=0在B为溶质,A 为溶剂的溶液中,设V A∗为纯溶剂的摩尔体积;V∅,B定义为溶质B的表观摩尔体积,则:V∅,B=V−n A V A∗n BV=n A V A∗+n B V∅,B 在恒定T,P及n A条件下,将上式对n B偏微分,可得:V B=(∂V∂n B)T,P,nA=V∅,B+n B(∂V∅,B∂n B)T,P,nAV A=1n A(n A V A∗+n B V∅,B−n B V B)结合以上两式得:V A=V A∗−n B2n A(∂V∅,B∂n B)T,P,n Ab B为B的质量摩尔浓度(b B=n B/(n A M A); V∅,B为B的表观摩尔体积;ρ,ρA∗为溶液及纯溶剂A的密度;M A,M B为A.B两组份的摩尔质量。
可得:V∅,B=1b B(1+b B M Bρ−1ρA∗)V∅,B=ρA∗−ρb BρρA∗+M Bρ本实验测定NaCI水溶液中NaCI和水的偏摩尔体积,根据德拜—休克尔理论,NaCI水溶液中NaCI的表观偏摩尔体积V∅,B随√b B变化呈线性变化关系,因此作如下变换:(∂V∅,B∂n B)T,P,nA=1n A M A(∂V∅,B∂b B)T.P,nA =1n A M A(∂V∅,B∂√b B∗∂√b B∂b B) T.P,n A最终得到:V A=V A∗−M A bB322(∂√b B)T,P,nAV B=V∅,B+√b B2(∂V∂√b B)T,P,nA配制不同浓度的溶液,测定纯溶剂与溶液的密度,做出V∅,B—√b B图,可得到一直线,求出直线斜率。
实验二溶液偏摩尔体积的测定实验报告思考题绘图

实验二 溶液偏摩尔体积的测定一、实验目的偏摩尔量是溶液中一个重要参数,有许多性质都与偏摩尔数量有关。
本实验是测定溶液的偏摩尔体积。
1. 掌握用比重瓶测定溶液密度的方法;2. 运用密度法测定指定组成的乙醇—水溶液中各组分的偏摩尔体积;3. 学会恒温槽的使用。
4. 理解偏摩尔量的物理意义。
二、预习要求1.复习课堂讲授内容,真正理解偏摩尔量的物理意义。
2.理解摩尔体积—摩尔分数图与比容—质量百分数图之间的关系。
三、实验原理在多组分体系中,某组分i 的偏摩尔体积定义为,,,()j i m i T p n i j V V n ≠⎛⎫∂= ⎪∂⎝⎭ (1) 若是二组分体系,则有21,1,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (2) 12,2,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (3) 体系总体积V=n1V1,m +n2V2。
m (4)将(4)式两边同除以溶液质量W1,2,1212m mV V W W V W M W M W=+g g (5) 令 1,2,12,,m m V V V W W Wααα=== (6) 式中α是溶液的比容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代入(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)将(7)式对W2%微分:122122,%%W W αααααα∂∂=-+=+∂∂即 (8)将(8)代回(7),整理得121%%W W ααα∂=-∂g (9)和 212%%W W ααα∂=+∂g (10)所以,实验求出不同浓度溶液的比容α,作α—W2%关系图,得曲线CC′(见图15.1)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为α1和α2,再由关系式(6)就可求出V1,m 和V2,m 。
四、仪器与药品1.仪器恒温设备1套;分析天平(公用);比重瓶(10mL)2个;工业天平(公用);磨口三角瓶(50mL)4个。
物理化学实验4 偏摩尔体积的测定(大三物化实验)

偏摩尔体积测定1 实验目的及要求1) 配制不同浓度的NaCl 水溶液,测定各溶液的密度。
2) 计算溶液中各组分的偏摩尔体积。
3) 学习用比重管测定液体的密度。
2 原理根据热力学概念,体系的体积V 为广度性质,其偏摩尔量则为强度性质。
设体系有二组分A,B,体系的总体积V 是n A , n B 、温度、压力的函数,即V=f(n A ,n B ,T ,P ) (C9.1)组分A 、B 的偏摩尔体积定义为B n P T A A n V V ,,)(∂∂= An P T BB n V V ,,)(∂∂= (C9.2)在恒定温度和压力下B n P T BAn P T Adn n V dnn V dV A B ,,,,)()(∂∂+∂∂=(C9.3)dV=V A dn A + V B dn B(C9.4)偏摩尔量是强度性质,与体系浓度有关,而与体系总量无关。
体系总体积由式C9.4积分而得V = n A V A +n B V B (C9.5)在恒温恒压条件下对式C9.5微分dV=n A dV A +V A dn A 十n B dV B +V B dn B与式C9.4比较,可得吉布斯-杜亥姆(Gibbs-Duhem )方程n A dV A +n B dV B =0 (C9.6)在B 为溶质、A 为溶剂的溶液中,设V A *为纯溶剂的摩尔体积;V φ,B 定义为溶质B 的表观摩尔体积,则BAA B n V n V V *-=,φ (C9.7)V= n A V A *+n B V φ,B (C9.8)在恒定T 、P 及n A 条件下,将式C9.8对n B 偏微分,可得AAn P T BB B B n P T B B n V n V n V V ,,,,,,)()(∂∂+=∂∂=φφ (C9.9)由式C9.5、C9.8得()B B B B A AAA V n V n V nn V -+=*,1φ(C9.10)将式C9.9代入式C9.10An P T BB AB A A n V n n V V ,,,2)(∂∂-=*φ (C9.11)b B 为B 的质量摩尔浓度(b B =n B /(n A M A );V φ,B 为B 的表观摩尔体积;ρ、ρA *为溶液及纯溶剂A 的密度;M A 、M B 为A 、B 二组分的摩尔质量。
实验二溶液偏摩尔体积的测定实验报告思考题绘图

实验二 溶液偏摩尔体积的测定一、 实验目的偏摩尔戢是溶液中一个重要参数,有许多性质都与偏摩尔数量有关。
本实验是测左溶液的 偏摩尔体积。
1. 掌握用比重瓶测泄溶液密度的方法;2. 运用密度法测立指左组成的乙醇一水溶液中各组分的偏摩尔体积:3. 学会恒温槽的使用。
4. 理解偏摩尔虽的物理意义。
二、 预习要求1•复习课堂讲授内容,真正理解偏摩尔量的物理意义。
2•理解摩尔体积一摩尔分数图与比容一质量百分数图之间的关系。
三、实验原理在多组分体系中,某组分i 的偏摩尔体积左义为(1)若是二组分体系,则有oVT.p.nydV体系总体积V= n i V\. m + 门 2 #2・ m将⑷式两边同除以溶液质量“v V v一 =a s = a 2,11 = a W ' W P IV 2式中a 是溶液的比容;au 4分别为组分1、2的偏质量体积。
将⑹式代入⑸式可得:a= ”i%ai+ W z 2%a2=(l- ^2%)ai+ ^2%a?0V(7)将(7)式对W?%微分:将(8)代回(7),整理得所以,实验求岀不同浓度溶液的比容*作(X — “2%关系图,得曲线CCX 见图15」)。
如欲求N4浓度溶液 中各组分的偏摩尔体积,可在M 点作切线,此切线在两边的截距A B 和A W 即为⑴和(12,再由关系式(6)就可求岀Am 和r 2.mo四. 仪器与药品1•仪器恒温设备1套:分析天平(公用):比重瓶(10mL)2个:工业天平(公用):磨口三角瓶(50mL)4 个。
2 •药品95%乙醇(分析纯),纯水。
五、实验步骤调节恒温槽温度为(25.0±0.irc o以95%乙醇(A)及纯水(B)为原液,任磨口锥形瓶瓶中用分析天平称重,配制含A 体积 百分数为0%, 20%, 40%, 60%, 80%, 100%的乙醇水溶液,每份溶液的总体积为20ml 。
配好后盖紧塞子,以防挥发。
摇匀后测左每份溶液的密度,其方法如下:用分析天平精确称量一个预先洗净烘干的比重瓶,然后盛满纯水(注意不得存留气泡), 用滤纸迅速擦去毛细管膨胀出来的水。
偏摩尔体积的测定

溶液偏摩尔体积的测定一、实验目的1. 测定指定组成的乙醇-水溶液中各组分的偏摩尔体积。
2.掌握测定体积密度的比重瓶法。
二、实验原理在多组分体系中,某组分i的偏摩尔体积定义(1)若是二组分体系,则有(2)(3)体系总体积:V总=n1V1.m+n2V2.m (4)将(4)式两边同除以溶液质量W(5)令(6)式中α是溶液的比容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代入(5)式可得α=W 1%α1+W 2%α2=(1-W 2%)α1+W 2%α 2 (7) 将(7)式对W 2%微分:即(8)将(8)代回(7),整理得 (9)和(10)所以,实验求出不同浓度溶液的比容α(即密度的倒数),作α—W 2%关系图,得曲线CC’ (见图2-13-1)。
如欲求M 浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB 和A ′B′即为α1和α2,再由关系式(6)就可求出V 1,m 和V 2,m 。
三、仪器药品图2-13-1 比容-质量百分比浓度关系图恒温设备1套;电子天平1台;分析天平;比重瓶(5 mL或10mL,1只);磨口三角瓶(50mL,4只)。
无水乙醇(A.R.),蒸馏水。
四、实验步骤1. 调节恒温槽温度为(25.0±0.1)℃。
2. 配制溶液以无水乙醇及蒸馏水为原液,在磨口三角瓶中用电子天平称重,配制含乙醇质量百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总重量控制在15g(10 mL比重瓶可配制25g)左右。
配好后盖紧塞子,以防挥发。
3. 比重瓶体积的标定用电子天平精确称量洁净、干燥的比重瓶,然后盛满蒸馏水置于恒温槽中恒温10min。
用滤纸迅速擦去毛细管膨胀出来的水。
取出比重瓶,擦干外壁,迅速称重。
平行测量两次。
4. 溶液比容的测定按上法测定每份乙醇-水溶液的比容。
五、数据处理1. 根据25℃时水的密度和称重结果,求出比重瓶的容积。
2. 计算所配溶液中乙醇的准确质量百分比。
溶液偏摩尔体积的测定实验报告思考题

溶液偏摩尔体积的测定实验报告思考题下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!一、引言溶液偏摩尔体积是溶质占据单位物质的体积,是一个描述溶液浓度的重要参数。
乙醇-水溶液偏摩尔体积的测定

物理化学实验报告姓名:戴超华学号:14101700599序号:16任课老师:张建策系别:化工学院班级:10级化学班同组者:第4组乙醇-水溶液偏摩尔体积的测定乙醇-水溶液偏摩尔体积的测定一.实验目的1.掌握用比重瓶测定溶液密度的方法。
2.测定指定组成的乙醇—水溶液中各组分的偏摩尔体积。
3.加深理解偏摩尔量的物理意义二、实验原理在多组分体系中,某组分i的偏摩尔体积定义为(1)若是二组分体系,则有(2)(3)体系总体积V=n1V1,m+n2V2。
m (4)将(4)式两边同除以溶液质量W(5)令 (6)式中α是溶液的比容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代入(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α 2 (7) 将(7)式对W2%微分:(8)将(8)代回(7),整理得(9)和 (10)图Ⅲ-12-1 比容-质量百分比浓度关系所以,实验求出不同浓度溶液的比容α,作α—W2%关系图,得曲线CC′(见图Ⅲ-12-1)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为α1和α2,再由关系式(6)就可求出V1,m和V2,m。
三.仪器与药品1.仪器分析天平(公用); 比重瓶(10mL)1个; 工业天平(公用); 磨口三角瓶(50mL)4个。
2.药品无水乙醇(分析纯),纯水。
四.实验步骤以无水乙醇(A)及纯水(B)为原液,在磨口三角瓶中用工业天平称重,配制含A质量百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总体积控制在40mL 左右。
配好后盖紧塞子,以防挥发。
摇匀后测定每份溶液的密度,其方法如下:用分析天平精确称量二个预先洗净烘干的比重瓶,然后盛满纯水(注意不得存留气泡)置于恒温槽中恒温10min 。
用滤纸迅速擦去毛细管膨胀出来的水。
取出比重瓶,擦干外壁,迅速称重。
同法测定每份乙醇—水溶液的密度。
实验四-偏摩尔体积的测定

实验四-偏摩尔体积的测定实验四、偏摩尔体积的测定专业:11化学姓名:赖煊荣座号:32 同组人:池雅君时间:2013.10. 29Ⅰ、实验目的1.掌握偏摩尔量的概念。
2.了解密度的测定并掌握用比重法测偏摩尔量的方法。
Ⅱ、实验原理在T、p不变的A、B两组分溶液中,如A组分的物质的量为n A,B组分的物质的量为n B,则溶液的任何广度性质(Y)可表示为:(1)积分上式,得Y = n A Y A + n B Y B(2)定义表观摩尔体积ΦV为式中:V为溶液体积,V A*为T、p不变下,纯A的摩尔体积。
方程(3)式可变为V = n BΦV+ n A V A* (4)(4)式对n B偏微商,得以V B,V A,V代替(2)式中的Y B,Y A,Y,则结合(4),(5),(6)三式,得在已知n A、n B和摩尔质量M A、M B及溶液密度ρ的情况下,由(7)式可计算V A,因为将(8)式代入(3),得采用质量摩尔浓度m B,令式中n B = m B,n A= 1000/ M A,则(9)式变为在T、p不变时,纯A的密度ρA* = M A/ V A*则(10)式最后可表示为由(7)式求V A时,其中(〆ΦV/〆n B)要通过ΦV--- n B 作图求微商而得,但ΦV--- n B并非线性关系,德拜-休克尔证明,对于强电解质的稀水溶液,ΦV随√m B有线性关系,故可作如下变换可作ΦV ----√m B图,该图为直线,其直线斜率为(〆Φ/〆√m B)。
V因此,不仅可用(7)式求V A,还可通过(5)式求V B。
在计算过程中应注意:n B=m B,n A= 1000/ M A(M A 为A的摩尔质量)。
Ⅲ、实验仪器与药品超级恒温槽,磨口锥形瓶(100ml)5个,50ml比重管5个,电子分析天平,移液管,量筒(50ml)NaCl(AR),蒸馏水,滤纸Ⅳ、实验步骤1.比重瓶体积的校正比重瓶洗净、烘干、冷却到常温。
比重瓶空瓶称重,加满蒸馏水恒温(设定25 ℃)10分钟,擦干再称重。
偏摩尔体积的测定

实验五 溶液偏摩尔体积的测定一、实验目的1.测定指定组成的乙醇—水溶液中各组分的偏摩尔体积。
2.掌握用比重瓶测定溶液密度的方法。
二、实验原理在多组分体系中,某组分i 的偏摩尔体积定义为⎪⎭⎫ ⎝⎛∂∂=i i n V V niP T ,, (1) 若是二组分体系,则有()ABn V V n P T A ∂∂=,, ()BAn V V n P T B∂∂=,,体系总体积=V A A V n +B B V n (2)将(2)式两边同除以溶液质量m V M m m V A A A ⨯=+m V M m BBB ⨯ (3) 令,α=m V,αA M V A A = αB BB M V = (4) 式中α是溶液的比容;αA ,αB 分别为组分A 、B 的偏质量体积。
将(4)式代入(3)式可得: α=WA %αA+WB %αB=(1-WB %)αA+WB %αB (5)将(5)式对WB%微分:αααB A B W +-=∂∂%, 即 αααAB B W +∂∂=% (6)将(6)代回(5),整理得 %%W W B B A ∂∂⨯+=ααα (7)和 %%W W B B A ∂∂=⨯-ααα (8)图16 比重瓶所以,实验求出不同浓度溶液的比容α,作α—WB%关系图,得曲线CC′(见图15)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为αA和αB,再由关系式(4)就可求出VA和VB。
三、仪器药品恒温槽1台;电子天平1台;50ml磨口锥形瓶4只;10ml比重瓶1只;无水乙醇(AR);蒸馏水。
四、实验步骤1、调节恒温槽温度为(25.0±0.1)℃。
2、溶液配制以95%乙醇(A)及纯水(B)为原液,在磨口锥形瓶瓶中用分析天平称重,配制含A体积百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总体积为20ml。
配好后盖紧塞子,以防挥发。
山大物化偏摩尔体积

实验十三 溶液偏摩尔体积的测定【目的要求】1. 掌握用比重瓶测定溶液密度的方法。
2. 测定指定组成的乙醇-水溶液中各组分的偏摩尔体积。
3. 理解偏摩尔量的物理意义。
【实验原理】在多组分体系中,某组分i 的偏摩尔体积定义(1)若是二组分体系,则有(2)(3)体系总体积:V 总=n 1V 1.m +n 2V 2.m (4)将(4)式两边同除以溶液质量W(5)令(6)式中α是溶液的比容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代入(5)式可得α=W1%α1+W2%α2=(1-W2%)α1+W2%α 2 (7)将(7)式对W2%微分:即(8)将(8)代回(7),整理得(9) 和(10)所以,实验求出不同浓度溶液的比容α(即密度的倒数),作α—W2%关系图,得曲线CC’ (见图2-13-1)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为α1和α2,再由关系式(6)就可求出V1,m和V2,m。
【仪器药品】恒温设备1套;电子天平1台;比重瓶(5 mL或10mL,1只);磨口三角瓶(50mL,4只)。
无水乙醇(A.R.),蒸馏水。
【实验步骤】图2-13-1 比容-质量百分比浓度关系图1. 调节恒温槽温度为(25.0±0.1)℃。
2. 配制溶液以无水乙醇及蒸馏水为原液,在磨口三角瓶中用电子天平称重,配制含乙醇质量百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总重量控制在15g(10 mL比重瓶可配制25g)左右。
配好后盖紧塞子,以防挥发。
3. 比重瓶体积的标定用电子天平精确称量洁净、干燥的比重瓶,然后盛满蒸馏水置于恒温槽中恒温10min。
用滤纸迅速擦去毛细管膨胀出来的水。
取出比重瓶,擦干外壁,迅速称重。
平行测量两次。
4. 溶液比容的测定按上法测定每份乙醇-水溶液的比容。
【注意事项】—恒温过程应密切注意毛细管出口液面,如因挥发液滴消失,可滴加少许被测溶液以防挥发之误。
物理化学实验报告 偏摩尔体积

物理化学实验报告偏摩尔体积的测定1.实验目的及要求:(1)配制不同浓度的NaCI水溶液,测定各溶液的密度(2)计算溶液中各组分的偏摩尔体积(3)学习用密度瓶测定液体的密度2.实验原理:根据热力学概念,体系的体积V为广度性质,其偏摩尔量则为强度性质。
设体系有两组分A,B,体系的总体积V是温度,压力n A和n B的函数,即:V=f(n A, n B,T,P)组分A,B的偏摩尔体积定义为:V A=(∂V∂n A )T,P,nBV B=(∂V∂n B)T,P,nA在恒定温度和压力下:dV=(∂V∂n A )T,P,nBd n A+(∂V∂n B)T,P,nAd n BdV=V A d n A+ V B d n B偏摩尔量是强度性质,与体系浓度有关,而与体系总量无关。
体系总体积可积分得到:V=n A V A+n B V B恒温条件下在进行微分:dV=n A dV A+V A d n A+n B dV B+ V B d n B得吉布斯—杜亥姆方程:n A dV A+n B dV B=0在B为溶质,A 为溶剂的溶液中,设V A∗为纯溶剂的摩尔体积;V∅,B定义为溶质B的表观摩尔体积,则:V∅,B=V−n A V A∗n BV=n A V A∗+n B V∅,B 在恒定T,P及n A条件下,将上式对n B偏微分,可得:V B=(∂V∂n B)T,P,nA=V∅,B+n B(∂V∅,B∂n B)T,P,nAV A=1n A(n A V A∗+n B V∅,B−n B V B)结合以上两式得:V A=V A∗−n B2n A(∂V∅,B∂n B)T,P,n Ab B为B的质量摩尔浓度(b B=n B/(n A M A); V∅,B为B的表观摩尔体积;ρ,ρA∗为溶液及纯溶剂A的密度;M A,M B为A.B两组份的摩尔质量。
可得:V∅,B=1b B(1+b B M Bρ−1ρA∗)V∅,B=ρA∗−ρb BρρA∗+M Bρ本实验测定NaCI水溶液中NaCI和水的偏摩尔体积,根据德拜—休克尔理论,NaCI水溶液中NaCI的表观偏摩尔体积V∅,B随√b B变化呈线性变化关系,因此作如下变换:(∂V∅,B∂n B)T,P,nA=1n A M A(∂V∅,B∂b B)T.P,nA =1n A M A(∂V∅,B∂√b B∗∂√b B∂b B) T.P,n A最终得到:V A=V A∗−M A bB322(∂√b B)T,P,nAV B=V∅,B+√b B2(∂V∂√b B)T,P,nA配制不同浓度的溶液,测定纯溶剂与溶液的密度,做出V∅,B—√b B图,可得到一直线,求出直线斜率。
实验30 溶液偏摩尔体积的测定

体系总体积: 体系总体积: V=w1/m1·V1,m + w2/m2·V2,m=(1-w2/m2)·V1,m + w2/m2·V2,m (4) 将式( 将式(4)两边同除以溶液质量 m V/m=w1/m1·V1,m/m + w2/m2·V2,m/m 式中, 分别为组分1 的质量分数, 式中,w1,w2分别为组分1、2的质量分数,令 V/m=α , V1,m/m1 = α1 , V2,m/m2= α2 (6) (5)
(3)实验过程中毛细管里始终要充满液体,注意不得存 实验过程中毛细管里始终要充满液体, 留气泡。 留气泡。
溶 液 偏 摩 尔 体 积 的 测 定
在线答疑:bypmu@ Zhaln@ lyl1300@ 在线答疑:
30. 30.5 数据处理
(1)根据25℃时水的密度和称重结果,求出比重瓶的容 根据25℃时水的密度和称重结果, 25 积。 (2)计算所配溶液中乙醇的准确质量百分比。 计算所配溶液中乙醇的准确质量百分比。
大 学 通 用 化 学 实 验 技 术
8/11
(3)计算实验条件下各溶液的比体积。 计算实验条件下各溶液的比体积。 体积 (4)以比体积为纵轴、乙醇的质量百分浓度为横轴作曲 以比体积为纵轴、 体积为纵轴
溶 液 偏 摩 尔
线,并在30%乙醇处作切线与两侧纵轴相交,即可 并在30%乙醇处作切线与两侧纵轴相交, 30 求得α1和α2。
大 学 通 用 化 学 实 验 技 术
6/11
(3)比重瓶体积的标定
溶 液
用电子天平精确称量洁净、干燥的比重瓶, 用电子天平精确称量洁净 、 干燥的比重瓶, 然后盛满蒸馏水
偏 摩
置于恒温槽中恒温10min。用滤纸迅速擦去毛细管膨胀出来的水。 置于恒温槽中恒温10min。用滤纸迅速擦去毛细管膨胀出来的水。 10min
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液偏摩尔体积的测定
一、实验目的
1.掌握用比重瓶测定溶液密度的方法。
2.测定指定组成的乙醇—水溶液中各组分的偏摩尔体积。
二、实验原理
在多组分体系中,某组分i 的偏摩尔体积定义为
,,,()
j i m i T p n i j V V n ≠⎛⎫∂= ⎪
∂⎝⎭ (1) 若是二组分体系,则有
21,1,,m T p n V V n ⎛⎫
∂= ⎪
∂⎝⎭ (2) 1
2,2,,m
T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (3) 体系总体积
V=n1V1,m +n2V2。
m (4)
将(4)式两边同除以溶液质量W
1,2,1212m m
V V W W V W M W M W
=+ (5) 令 1,2,12,,m m V V V
W W W
ααα=== (6) 式中α是溶液的比容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代入(5)式可得:
α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)
将(7)式对W2%微分:
122122,%%
W W αα
αααα∂∂=-+=+∂∂即
(8)
将(8)代回(7),整理得
a
M
B ′
C ′
121%
%
W W α
αα∂=-∂ (9) 和 212%
%
W W α
αα∂=+∂ (10)
所以,实验求出不同浓度溶液的比容α,作α—W2%关系图,得曲线CC′(见图15.1)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为α1和α2,再由关系式(6)就可求出V1,m 和V2,m 。
三、仪器与药品
1.仪器
恒温设备1套;分析天平(公用);比重瓶(10mL)2个;工业天平(公用);磨口三角瓶(50mL)4个。
2.药品
95%乙醇(分析纯),纯水。
四、实验步骤
1.调节恒温槽温度为(25.0±0.1)℃。
2.以95%乙醇(A)及纯水(B)为原液,在磨口三角瓶中用工业天平称重,配制含A质量百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总体积控制在40mL 左右。
配好后盖紧塞子,以防挥发。
3.摇匀后测定每份溶液的密度,其方法如下:
用分析天平精确称量二个预先洗净烘干的比重瓶,然后盛满纯水(注意不得存留气泡)置于恒温槽中恒温10min 。
用滤纸迅速擦去毛细管膨胀出来的水。
取出比重瓶,擦干外壁,迅速称重。
同法测定每份乙醇—水溶液的密度。
恒温过程应密切注意毛细管出口液面,如因挥发液滴消失,可滴加少许被测溶液以防挥发之误。
五、数据处理
1、根据(实验温度19℃)时水的密度和称重结果,计算比重瓶的体积。
干燥的比重瓶质量:9.7783g ; 加入蒸馏水的比重瓶的质量:20.3031g ; 19℃时水的密度为0.9984g/mL; 计算出比重瓶的体积:10.5416mL 。
2、计算各溶液中乙醇的准确质量分数。
原始数据 :
3、计算实验条件下各溶液的比容。
4、以比容为纵坐标,乙醇的质量百分数为横坐标作曲线,并在30%乙醇处作切线于两侧纵轴相交,即可求得A α和B α。
根据图像中可知A α=0.9852,B α=1.1533。
5、求算含乙醇30%的溶液中各组分的偏摩尔体积及100g 该溶液的总体积。
根据1,2,12,,m m V V V
W W W
ααα===, 可以计算出A V =17.75,B V =53.13. 100g 该溶液的总体积为:102.85mL 。
五、注意事项
1.实际仅需配制四份溶液,可用移液管加液,但乙醇含量根据称重算得。
2.为减少挥发误差,动作要敏捷。
每份溶液用两比重瓶进行平行测定或每份样品重复测定二次,结果取其平均值。
六、思考题
1.影响实验结果精度的主要因素是什么?
在试验中并没有严格控制其温度,可能使计算出的结果与标准值出现偏差;乙醇有挥 发性,在配制溶液过程中可能会挥发掉一部分乙醇,会对实验结果造成误差。
2.偏摩尔体积有可能小于零吗?
有可能。
在特定的体积、温度条件下,有可能出现体积减小的情况。
但是在实际情况中很难出现这种情况。
(注:文档可能无法思考全面,请浏览后下载,供参考。
可复制、编制,期待你的好评与关注)。
