习题第四章滴定分析法
酸碱滴定法课后习题和答案解析

第四章酸碱滴定法习题4-1下列各种弱酸的p K a已在括号内注明,求它们的共轭碱的pK b;(1)HCN;(2)HCOOH;(3)苯酚;(4)苯甲酸。
已知H3PO4的p K a=,p K a=,p K a=。
求其共轭碱PO43-的pK b1,HPO42-的pK b2.和H2PO4-的p K b3。
已知琥珀酸(CH2COOH)2(以H2A表示)的p K al=,p K b1=。
试计算在和时H2A、HA--1,求pH=时的三种形式的平和A2-的分布系数δ2、δ1和δ0。
若该酸的总浓度为·L衡浓度。
分别计算H2CO3(p K a1=,pK a2=在pH=,及时,H2CO3,HCO3-和CO32-的分布系数δ2` δ1和δ0。
已知HOAc的p Ka = ,NH3·H2O的pKb=。
计算下列各溶液的pH值:(1) mol·L-1HOAc ;(2) mol·L-1 NH3·H2O;(3) mol·L-1 NH4Cl;(4) mol·L-1 NaOAc。
计算浓度为mol·L-1的下列物质水溶液的pH(括号内为p Ka)。
(1)苯酚;(2)丙烯酸;(3)吡啶的硝酸盐(C5H5NHNO3)。
解:(1) 苯酚计算浓度为mol·L-1的下列物质水溶液的pH(p Ka:见上题)。
(1)苯酚钠;(2)丙烯酸钠;(3)吡啶。
计算下列溶液的pH:(1)·L-1NaH2PO4;(2) mol·L-1K2HPO4。
计算下列水溶液的pH(括号内为p K a)。
(1)·L-1乳酸和·L-1乳酸钠;(2) mol·L-1邻硝基酚和·L-1邻硝基酚的钠盐(3)·L-1氯化三乙基胺和mol·L-1三乙基胺;(4)·L-1氯化丁基胺和·L-1丁基胺。
一溶液含1.28 g·L-1苯甲酸和gl·L-1苯甲酸钠,求其pH值。
第四章 沉淀滴定法

第四章沉淀滴定法§4-1沉淀溶解平衡以沉淀反应为基础的滴定分析方法称为沉淀滴定法。
沉淀滴定法除必须符合滴定分析的基本要求外,还应满足:1.沉淀反应形成的沉淀的溶解度必须很小.2.沉淀的吸附现象应不妨碍滴定终点的确定。
沉淀滴定法主要用于水中Cl-离子、Ag+离子等的测定一、溶度积常数1 溶解度和溶度积微溶化合物MA在饱和溶液中的平衡可表示为MA(s)→M+ (L)+A-(L)式中MA s、M L、A L,中下角码(S)和(L)分别表示固态和液态.在一定温度下当微溶化合物MA沉淀溶解平衡时,其溶度积为一常数KΘsp=αM+.αA-例如AgCl(s)→ Ag+(aq) + Cl- (aq)当溶解与结晶速度相等时,达到平衡状态K AgCl为一常数:K AgCl = [Ag+][ Cl-]该常数称为溶度积常数,用Ksp表示。
AnBm(s)→nA m+ (aq) + mB n- (aq)则Ksp AnBm= [A m+]n[B n-]m同一类型的电解质,可以用Ksp直接比较溶解度的大小,不同类型的难溶电解质,不能用Ksp比较。
对MmAn型沉淀.溶度积的计算式为令该沉淀的溶解度为S,即平衡时每升溶液中有Smol的MmAn溶解,此时必同时产生mSmol的M n+和nS mol的A m-.即其中m,n是离子前的系数例如F e(OH)3是1-3型沉淀2.条件溶度积在一定温度下,微溶电解质MA在纯水个其溶度积Ksp是一定的,它的大小是由微溶电解质本身的性质决定的。
外界条件变化,如pH值变化、络合剂的存在,也会使沉淀溶解平衡中除主反应外,还有副反应发生。
考虑这些影响时的溶度积常数称为条件溶度积常数、简称条件溶度积。
用K'sp表示。
Ksp与K'sp 的关系是式中 K'sp一一条件溶度积,Ksp——微溶化合物的溶度积为微溶化合物水溶液中M和A的副反应系数。
与络合平衡中算法相同。
当pH值、温度、离子强度、络合剂浓度等一定时.K'sp是—常数。
第4章2滴定分析计算

2、分析氢氧化钠的纯度时,如果欲使 0.1500mol/LHCl标准溶液的体积(以ml为单位)乘 以2等于试样中NaOH的百分含量,问分析时应称取 试样的质量为多少克?
S=(0.1500×4.00g)/2
=0.3000g 答: 应称取试样的质量为0.3000g
约为37%。计算(1)每升浓盐酸中所含HCl的物质
的量浓度;(2)欲配制浓度为0.10mol/L的稀盐酸
500ml,需量取上述浓盐酸多少毫升?
解:(1) nHCll=(m/M)HCl=1.19×1000×0.37/36.46 =12 mol
cHCl=nHCl/VHCl=(m/M)HCl/ VHCl =(1.19×1000×0.37/36.46)/1.0=12 mol/L
=0.6740 g
第十四讲
第四章 滴定分析法概论
14-5
(二) 标定溶液浓度的有关计算
基本公式 mA / M A (a / b)cBVB
例3 用Na2B4O7·10H2O标定HCl溶液的 浓度,称取0.4806g硼砂,滴定至终点时消耗 HCl溶液25.20ml,计算HCl溶液的浓度。
解:Na2B4O7+2HCl +5H2O = 4H3BO3 +2NaCl n(Na2B4O7)=(1/2)n(HCl)
=0.006702 g/ml
同理可得:
c(K2Cr2O7)/1000=(1/3)T K2Cr2O7/Fe2O3/MFe2O3 T K2Cr2O7/Fe2O3= c(K2Cr2O7)×MFe2O3×3/1000
=0.009581 g/ml
高教分析化学第四章酸碱滴定-1

H3PO4为分布曲线的讨论: 为分布曲线的讨论 讨论:
( pKa1=2.12;pKa2=7.20;pKa3=12.36) ; ; )
(1)三个 a相差较大, )三个pK 相差较大, 现象不明显; 共存 现象不明显; (2)pH=4.7时, ) 时 δ2 =0.994 δ3 =δ1 = 0.003 (3)pH=9.8时, ) 时 δ1=0.994 δ0 =δ2 = 0.003
2,用途:根据质子条件,可得到溶液中浓 , 根据质子条件, 度与有关组分浓度的关系式,即计算公式. 度与有关组分浓度的关系式,即计算公式. 3,方法:根据参考水平来写质子平衡方程. ,方法:根据参考水平来写质子平衡方程. 参考水平:选择一些酸碱组分做参考, 参考水平:选择一些酸碱组分做参考,以他 们作为水准来考虑质子的得失. 们作为水准来考虑质子的得失.通常是原始 的酸碱组分, 的酸碱组分,大量存在并与质子转移直接有 关的酸碱组分. 关的酸碱组分. 如原始酸碱组分本身及溶剂水等. 如原始酸碱组分本身及溶剂水等.
3,酸在水中溶解 ,
由于质子半径极小,电荷密度极高, 由于质子半径极小,电荷密度极高,它不可能在水溶 液中独立存在. 液中独立存在. HAC H++AcH2O+H+ H3O+ + HAc+H2O H3O++Ac+
酸1 碱2 酸2 碱1
4,碱在水中溶解 ,
NH3+H2O
碱1 酸
OH-+NH4
碱2 酸1
第四章 酸碱滴定 分析法
以酸碱反应为基 础的滴定方法
1,酸碱平衡的理论 , 基础 2,酸碱存在形式与 , 分布曲线 3,酸碱溶液 的计 ,酸碱溶液pH的计 算 4,酸碱滴定终点的 , 确定方法
第4章 滴定分析概论(课后习题及答案)

第四章 滴定分析概论思考题与习题1. 什么是滴定分析?它的主要分析方法有哪些?答:滴定分析法又称容量分析法,是经典的化学分析法。
将一种已知准确浓度的试剂溶液滴加到被测物质溶液中,直到所加的试剂溶液与被测组分按化学反应式计量关系恰好反应完全为止,根据试剂溶液的浓度和体积,计算被测组分含量的一类方法称为滴定分析法。
滴定分析法主要的分析方法有:酸碱滴定法,配位滴定法,沉淀滴定法及氧化还原滴定法等。
2. 能用于滴定分析的化学反应应具备什么条件?答:(1)反应必须定量完成;(2)反应速度要快;(3)有简便可靠的方法确定滴定终点。
3. 什么是基准物质?基准物质应具备哪些条件?答:用来直接配制标准溶液或标定标准溶液的物质称为基准物质。
基准物质必须具备下列条件:(1)应具有足够的纯度;(2)物质的组成要与化学式完全符合;(3)性质稳定;(4)具有较大的摩尔质量。
4. 下列物质中哪些可以直接法配制标准溶液?哪些只能用间接法配制?NaOH 、H 2SO 4、HCl 、KMnO 4、NaCO 3、AgNO 3、NaCl 、K 2Cr 2O 7。
答:直接法配制:NaCO 3、NaCl 、K 2Cr 2O 7;间接法配制:NaOH 、H 2SO 4、HCl 、KMnO 4、AgNO 3。
5. 以HCl 溶液为滴定剂测定样品中K 2CO 3的含量,若其中含有少量Na 2CO 3,测定结果将偏高还是偏低?答:偏高。
6. 已知浓硫酸的相对密度为1.84,其中含H 2SO 4约为96%,求其量浓度为多少?如欲配制1L 0.1mol/L 的H 2SO 4溶液,应取这种浓硫酸多少毫升?解:浓硫酸的物质的量的浓度为242424H SO H SO H SO 1.8496%1000mol /L 18mol /L 98.01c M ρω⨯==⨯= 配制浓度为0.10mol/L 溶液1L 需要浓硫酸体积为ml 6.5mol/L18mol/L 10.0ml 100042SO H =⨯==浓稀c Vc V 7. 中和下列酸溶液,需要多少毫升0.2150mol/L NaOH 溶液?①22.53ml 0.1250mol/L 的H 2SO 4溶液;②20.52ml 0.2040mol/L 的HCl 溶液。
分析化学酸碱滴定法课后答案.doc

(2)Na2CO3⑶(NH4)2HPO4(4)(NHQ3PO4 NH4H2PO4 第四章酸碱滴定法思考题1.从质子理论来看下面各物质对分别是什么?哪个是最强酸?哪个是最强碱?试按强弱顺序把他们排列起来答:HAc (Ac) Ka=1.75X10-5;NH3 (NH4+)Ka=5.7XW10;HF (F) Ka=6.8X IO:HCO「(CO「)Ka2=5.61X10-11酸的强弱顺序:H3PO4(H2PO4-) Kai=7.52X10-3;HCN (CN「)Ka=6.2X W10(CH2) 6N ((CH2) 6NH+) Ka=1.4X10-9H3PO4 >HF> HAc> (CH2)6N4H+ > HCN > NH4+ > HCO3- 碱的强弱顺序:CO3- > NH3 >CN > (CH2) 6N4>A C >F > H2PO4-2.写出下列物质在水溶液中的质子条件式答:(1 )NH4CN [HCN] + [H3O+] = [NH3] + [OH ]2[H2CO3] + [HCOj] + [H3O+] = [OH ]2 旧3PO4] + [H2PO4] + fH3O+] = [NH3] + [OH]+[PO431 3[H3PO4] + 2[H2PO4]+[HPO42]+[H3O+] = [NH3] + [OH] [H3PO4] + [H3O+] = [NH3] + [HPO42]+2[PO43]+[OH]3.欲配制pH为3的缓冲溶液,应选下列何种酸及其共猊碱二氯乙酸(1.30)二氯乙酸(2.86)甲酸(3.74)乙酸(4.76)苯酚(9.95) 答:选二氯乙酸(缓冲溶液pHepKa=2.86)5.NaOH标准溶液吸收了空气中的CO2,当用于滴定(1)强酸;(2)弱酸时,对滴定的准确度各有何影响?答:滴定强酸时:(1)若用甲基橙为指示剂,终点pH@4,消耗2mol强酸,即2molNaOH 与CO2反应生成1 molNaCO3仍消耗2mol强酸,基本无影响;(2) 若用酚猷作指示剂,终点pH^9,生成NaHCO3,即2molNaOH与CO2反应生成1 molNaCCh只消耗Imol 强酸,有显著影响。
4第四章 酸碱滴定法
NH3CH 2COOH的K a1 4.5 103 ; K a 2 2.5 1010 ;
NH 4 a
解:(1) [H ] K a K
Kw Ka Kb
1.8 104 1.0 1014 3.2 107 (mol L1 ) 1.8 105 pH 6.50
•
•
强酸强碱溶液pH值的计算 弱酸弱碱溶液pH值的计算 两性物质溶液(C ) 缓冲溶液pH值的计算
水溶液中[H+]的计算方法: 1. 列出PBE式; 2. 代入有关常数和浓度数据; 3. 计算出[H+]。 注:在计算中可以进行合理的近似处理, 最后用近似式或最简式进行计算。
一、一元酸(碱)溶液的氢离子浓度计算
[ NH ] 4
精确式
[H ] K a1 ( K a 2 K
NH 4 Na H2PO4 Na2HPO4
H
K a1 K a 2 K a1 K a 2
H
H
Ka 2 Ka 3
练习题: (1)计算0.10mol HCOONH4溶液的pH值。 L-1 (2)计算0.10mol L-1氨基乙酸(NH2CH2COOH)溶液的pH 值。 HCOOH的K a 1.8 104 ; NH3的Kb 1.8 105
23 3
2
NH 4 a
[ NH ] 4 [H ] 2- 2[H ] [CO 3 ] 1 1 Ka2 K a1 Kw K
NH 4 a
精确式
[H ] 2 K a 2 K
NH 4 a
最简式***
2. 酸式盐:NH4HCO3
2 [H ] [OH ] [CO3 ] - [H2CO3 ] [NH3 ]
4 滴定分析法

2I S4O6
2
指示剂:淀粉指示剂,且需在近终点时加入。原因:当溶液 中有大量碘时,易被淀粉表面吸附,影响滴定终点的判断。
3.置换碘量法(司可巴比妥钠的含量测定)
Байду номын сангаас凡标准电极电位高于
-还原,定量置换出I
0 I I 2 /2I的电对,其氧化态可用
2,置换出的I2用Na2S2O3标准溶液
[H ] K aca 1.7 10 5 0.1000 1.3 103 (mol/L)
pH=2.88 缓
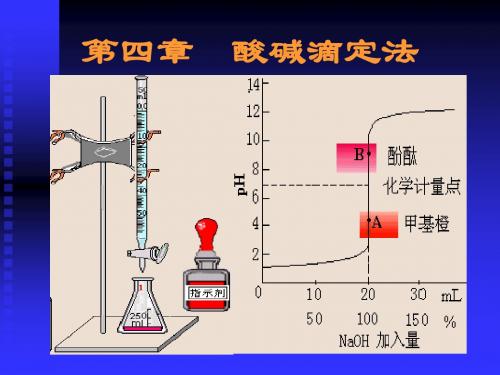
滴定开始至化学计量点前:溶液组成:HAc+NaAc (Va>Vb)
冲液
[Ac ] pH pK a lg [HAc]
化学计量点时: 溶液组成:NaAc ,(Va=Vb) pH取决Ac-的离解
0 I 2 /2I的电对,其还原
态可用碘标准溶液直接滴定,此方法称为直接碘量法。 直接碘量法基本反应: I2(s) + 2e 2I-
2.直接碘量法滴定条件:只能在酸性、中性或弱碱性溶
液中进行。因pH>9,碘分子会发生歧化反应
3I2 +6OH-
5I-+IO- 3+3H2O
3.指示剂:
• 淀粉指示剂→蓝色
Kw 1.0 10 14 [OH ] Kbcb cb 5.00 10 2 5.4 10 6 (mol/L) 5 Ka 1.7 10
-
pH=8.72
化学计量点后: 溶液组成:NaAc+NaOH (Vb>Va)
pOH=4.30 pH=9.70
滴定曲线变化
非水溶液滴定法
氧化还原滴定法
在非水溶液中进行的酸碱滴定法 非水溶剂:与不含水的无机溶剂指的是有机溶剂与不 含水的无机溶剂 特点:增大有机化合物的溶解度;改变物质的酸碱性; 扩大酸碱滴定应用范围。
(完整版)第四章酸碱滴定法课后习题和答案解析

第四章酸碱滴定法习题4-14.1 下列各种弱酸的p K a已在括号内注明,求它们的共轭碱的pK b;(1)HCN(9.21);(2)HCOOH(3.74);(3)苯酚(9.95);(4)苯甲酸(4.21)。
4.2 已知H3PO4的p K a=2.12,p K a=7.20,p K a=12.36。
求其共轭碱PO43-的pK b1,HPO42-的pKb2.和H2PO4-的p Kb3。
4.3 已知琥珀酸(CH2COOH)2(以H2A表示)的p K al=4.19,p K b1=5.57。
试计算在pH4.88和5.0时H2A、HA-和A2-的分布系数δ2、δ1和δ。
若该酸的总浓度为0.01mol·L-1,求pH=4.88时的三种形式的平衡浓度。
4.4 分别计算H2CO3(p K a1=6.38,pK a2=10.25)在pH=7.10,8.32及9.50时,H2CO3,HCO3-和CO32-的分布系数δ2`δ1和δ。
4.5 已知HOAc的p Ka = 4.74,NH3·H2O的pKb=4.74。
计算下列各溶液的pH值:(1) 0.10 mol·L-1 HOAc ; (2) 0.10 mol·L-1 NH3·H2O;(3) 0.15 mol·L-1 NH4Cl; (4) 0.15 mol·L-1 NaOAc。
4.6计算浓度为0.12 mol·L-1的下列物质水溶液的pH(括号内为p Ka)。
(1)苯酚(9.95);(2)丙烯酸(4.25);(3)吡啶的硝酸盐(C5H5NHNO3)(5.23)。
解:(1) 苯酚(9.95)4.7 计算浓度为0.12 mol·L-1的下列物质水溶液的pH(p Ka:见上题)。
(1)苯酚钠;(2)丙烯酸钠;(3)吡啶。
4.8 计算下列溶液的pH:(1)0.1mol·L-1NaH2PO4;(2)0.05 mol·L-1K2HPO4。
分析化学习题(第4章滴定分析法)

习题 1(酸碱滴定一)1.用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1的甲酸溶液,化学计量点pH是多少?计算用酚酞做指示剂(pH=9.0)时的终点误差。
(参考答案)答:2.用mol·L-1的HCl溶液滴定20.00 mL mol·L-1的,化学计量点前后0.1%的pH是多少?若用酚酞做指示剂(PT为9.0)计算终点误差。
(参考答案)答:化学计量点前0.1%:3.用0.1000 mol·L-1 HCl溶液滴定20.00 mL0.1000 mol·L-1的NaOH,若NaOH溶液中同时含有0.1000 mol·L-1的NaAc。
计算化学计量点以及化学计量点前后0.1%时的pH。
若滴定到pH7.0,终点误差有多大?(参考答案)答:(1) 化学计量点时,体系中有0.0500 mol·L-1 NaAc。
4.用0.2000 mol·L-1HCl溶液滴定0.2000 mol·L-1一元弱碱B(p K b=6.0),计算化学计量点的pH和化学计量点前后0.1%的pH。
若所用溶液的浓度都是0.0200 mol·L-1,结果又如何?(参考答案)答:(1)化学计量点时(2)当浓度为0.0200 mol·L-1时5.计算0.1000 mol·L-1NaOH滴定0.1000 mol·L-1至pH=5.0和pH=10.0时的终点误差。
(参考答案)答:滴定至pH=5.0,相当于滴定至6.用克氏定氮法测定试样含氮量时,用过量的100 mL0.3 mol·L-1HCl吸收氮,然后用0.2 mol·L-1NaOH 标准溶液返滴。
若吸收液中氨的总浓度为0.2 mol·L-1,计算化学计量点pH和返滴到pH为4.0及7.0时的终点误差。
分析化学:第4章课后习题答案

第四章思考题与习题1. 解释以下名词术语:滴定分析法,滴定,标准溶液(滴定剂),标定,化学计量点,滴定终点,滴定误差,指示剂,基准物质。
答:滴定分析法:将一种已知准确浓度的试剂溶液(即标准溶液)由滴定管滴加到被测物质的溶液中,直到两者按照一定的化学方程式所表示的计量关系完全反应为止,然后根据滴定反应的化学计量关系,标定溶液的浓度和体积用量,计算出被测组分的含量,这种定量分析的方法称为滴定分析法。
滴定:在用滴定分析法进行定量分析时,先将被测定物质的溶液置于一定的容器中(通常为锥形瓶),在适宜的条件,再用一种标准溶液通过滴定管逐滴地加到容器里,直到两者完全反应为止。
这样的操作过程称为滴定。
标准溶液(滴定剂):已知准确浓度的试剂溶液。
标定:将不具备基准物质条件的这类物质配制成近似于所需浓度的溶液,然后利用该物质与某基准物质或另一种标准之间的反应来确定其准确浓度,这一操作过程称为标化学计量点:当滴入的标准溶液与被测定的物质按照一定的化学计量关系完全反为止,称反应达到了化学计量点。
滴定终点:滴定进行至指示剂的颜色发生突变时而终,此时称为滴定终点。
滴定误差:滴定终点与化学计量点往往并不相同,由此引起测定结果的误差称为终点误差,又称滴定误差。
指示剂:为了便于观察滴定终点而加入的化学试剂。
基准物质:能用于直接配制标准溶液的化学试剂称为基准物质。
2. 滴定度的表示方法T B/A和T B/A%各自的意义如何?答:T B A表示每毫升标准溶液相当于被测物质的质量(g或mg)。
T B A%表示每毫升标准溶液相当于被测物质的质量分数。
3. 基准试剂(1)H2C2O4 2出0因保存不当而部分分化;(2)Na2CO3因吸潮带有少量湿存水。
用(1)标定NaOH[或用(2)标定HC1]溶液的浓度时,结果是偏高还是偏低?用此NaOH (HC1)溶液测定某有机酸(有机碱)的摩尔质量时结果偏高还是偏低?答:用(1)标定NaOH溶液的浓度时,结果偏低,用(2)标定HCI溶液的浓度时,结果偏高;用此NaOH溶液测定有机酸时结果偏低,用此HCI溶液测定有机碱时结果偏高。
分析化学 第四章 滴定分析(习题)

第四章 滴定分析概述一、选择题1、欲配制草酸钠溶液以标定0.0400 mol .L -1KMnO 4溶液,如要使标定时两种溶液消耗的体积相等,则草酸钠应配制的浓度为A 、0.1000 mol .L -1B 、0.04000 mol .L -1C 、0.05000 mol .L -1D 、0.08000 mol .L -1 答案:A解:16H ++2 MnO 4-+5C 2O 42-=Mn 2++5CO 2+8H 2O11000.0250400.0-⋅=⨯=L mol x 2、今有0.400 mol .L -1HCl 溶液1L ;欲将其配制成浓度为0.500 mol .L -1溶液,需加入1.00 mol .L -1HCl 多少毫升?A 、200.0mLB 、400.0mLC 、100.0mLD 、300.0mL 答案:A解:0.400×1+1.00x=0.500(1+x)x=0.2L=200.0mL3、在1L0.200 mol .L -1HCl 溶液中,需加入多少毫升水,才能使稀释后的HCl 溶液对CaO 的滴定度T HCl/CaO =0.00500g .mL -1。
[Mr(CaO)=56.08]A 、60.8mLB 、182.4mLC 、121.6mLD 、243.2mL 答案:C解: T HCl/CaO =0.00500g .mL -1,Mr(CaO)=56.081108916.008.561000005.0--⋅=⋅⨯=L mol L mol c CaO 1 CaO~ 1HClc HCl =2c CaO =2×0.08916=0.1783 mol .L -11783.012000.01=+⨯xx=0.1216L=121.6mL 4、以下试剂能作为基准物质的是A 、优级纯的NaOHB 、光谱纯的Co 2O 3C 、100℃干燥过的CaOD 、99.99%纯锌答案:D (A 、B 、C 三者能吸收空气中的水份,会导致称量误差)5、称取纯As 2O 30.1978g ,溶解后在酸性介质中用KMnO 4溶液滴定至计量点时,耗去40.00mL ,则KMnO 4溶液的浓度为A 、0.02000 mol .L -1B 、0.01500 mol .L -1C 、0.03000 mol .L -1D 、0.04000 mol .L -1 答案:A解: 4 KMnO 4 ~ 5 As 2O 3x 04000.0 84.1971978.01978.084.197504000.04⨯=x x =0.02000 mol .L -1 6、 称取铁矿试样0.4000g ,以K 2Cr 2O 7溶液测定铁的含量,若欲使滴定时所消耗K 2Cr 2O 7溶液的体积(以mL 为单位)恰好等于铁的质量分数以百分数表示的数值。
【执业药师 药分】习题第四章 滴定分析法

1、溴百里酚蓝的pK In为7.3,其变色范围是A、4.4~6.4B、6.3~8.3C、7.6~8.8D、8.1~10.1E、9.5~10.7【正确答案】B【答案解析】考查重点是酸碱指示剂的变色范围:pH=pK In±1。
【该题针对“酸碱滴定法”知识点进行考核】2、弱酸需符合下列哪个条件才能被强碱直接滴定A、C*Ka≤10-8B、C*Ka≥10-8C、Ka≥10-8D、Ka≤10-8E、C*Ka≤10-10【正确答案】B【答案解析】当溶液浓度一定时,Ka愈小,滴定突跃范围愈小;当Ka<10-8时,已没有明显突跃,即使弱酸的浓度为1mol/L,也无明显的突跃,此时很难用指示剂来确定终点。
当弱酸的K一定时,溶液的浓度愈大,滴定突跃范围也愈大。
反之1根据滴定误差应<0.1%的要求,若以强碱直接滴定弱酸,只有当C*Ka≥10-8时,才能用强碱准确滴定。
【该题针对“酸碱滴定法”知识点进行考核】3、用盐酸滴定液滴定氨水时,使用的指示剂是A、甲基橙B、铬黑TC、酚酞D、淀粉E、硫酸铁铵【正确答案】A【答案解析】解析:基橙是在酸性区域变色,酚酞是在碱性区域变色;淀粉是氧化还原滴定中常用的指示剂;铬黑T是配位滴定法中常用的指示剂;硫酸铁铵是沉淀滴定法中常用的指示剂。
建议考生掌握常用指示剂的用途。
【该题针对“酸碱滴定法”知识点进行考核】4、用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH值是A、1.00—3.00B、3.00~4.30C、8.00~9.70D、4.30~9.702E、9.70~10.00【正确答案】D【答案解析】解析:本题考查对酸碱滴定中滴定突越及突越范围的概念和计算。
根据强酸(碱)的滴定曲线四个阶段(滴定开始前、滴定至化学计量点前、化学计量点时和化学计量点后)不同的计算公式,可求得化学计量点±0.1%的范围内,溶液pH 由4.30增大到9.70,即可确定此滴定的突越范围。
《分析化学》第4章》酸碱滴定复习题及答案

一、判断题1、(酸碱的概念)水是一种酸碱两性溶剂。
(√)2、(酸碱强弱的判断) 甲酸的pKa=3.74,乙酸的pKa=4.74,所以乙酸的酸强度比甲酸高。
(×)3、(酸碱强弱的判断) 硼酸的pKa=9.24,氢氟酸的pKa=3.20,所以硼酸的酸强度比氢氟酸高。
(×)4、(共轭酸碱的强弱关系) 某酸的酸强度越弱,则其共轭碱的碱强度越强。
(√)5、(指示剂的加入量) 滴定分析中多加指示剂可使滴定终点变色更明显,故应多加指示剂。
(×)6、(混合指示剂) 混合指示剂的变色范围常比单一指示剂变色范围窄,故用正确的混合指示剂可使终点误差变小。
(√)7、酸碱滴定突跃是指滴定体系在计量点附近误差允许范围内的pH值急骤变化。
(√)8、强酸滴定弱碱的计量点的pH值大于7。
(×)9、可依据滴定曲线获得滴定突跃范围,进而选择合适的指示剂。
(√)10、一般不可以利用盐酸标准溶液滴定醋酸钠而获得醋酸钠的浓度,因为醋酸根的碱性不够强。
(√)11、用NaOH滴定HCl,用酚酞作指示剂优于甲基橙。
(√)12、HCl滴定NaOH时,用酚酞作指示剂优于甲基橙。
(×)13、用NaOH滴定酸时,都可选酚酞作指示剂。
(×)14、NH3质子条件式为[H+]+[NH4+] = [OH-]。
(√)15、NaHCO3质子条件式为[H+]+[H2CO3] = [CO32-]+[OH-]。
(√)16、Na2CO3质子条件式为[HCO3-]+[H+]+[H2CO3] = [OH-]。
(×)17、NH4HCO3质子条件式为[H+]+[H2CO3] = [NH3]+[CO32-]+[OH-]。
(√)18、酸碱滴定中指示剂的变色范围最好完全处于滴定的pH突跃范围内。
(√)19、苯胺的pK b=9.34,其碱性太弱,不能用酸碱滴定法直接测定。
(√)20、醋酸钠NaOAc呈碱性,可用强酸直接滴定法测定其含量。
分析化学第四章思考题答案

分析化学第四章《滴定分析法概论》思考问题1、什么是滴定分析法?答:滴定分析法,又叫容量分析法,将已知准确浓度的标准溶液,滴加到被测溶液中(或者将被测溶液滴加到标准溶液中),直到所加的标准溶液与被测物质按化学计量关系定量反应为止,然后测量标准溶液消耗的体积,根据标准溶液的浓度和所消耗的体积,算出待测物质的含量。
这种定量分析的方法称为滴定分析法,它是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
1.1、滴定分析的特点:1. 加入标准溶液物质的量与被测物质的量恰好是化学计量关系;2. 此法适于组分含量在1%以上各种物质的测定;3. 该法快速、准确、仪器设备简单、操作简便;4.用途广泛。
1.2、什么时候进行一滴半滴操作:加入半滴的操作是将酸式滴定管的旋塞稍稍转动或碱式滴定管的乳胶管稍微松动,使半滴悬于管口,将锥形瓶内壁与管口接触,使液滴流出,并用洗瓶以纯水冲下。
1.3、分析实验中仪器的注意事项:移液管(一直二靠三斜四停)、酸(碱)式滴定管1、使用时先检查是否漏液。
2、用滴定管取滴液体时必须洗涤、润洗。
3、读数前要将管内的气泡赶尽、尖嘴内充满液体4、读数需有两次,第一次读数时必须先调整液面在0刻度或0刻度以下。
5、读数时,视线、刻度、液面的凹面最低点在同一水平线上。
6、量取或滴定液体的体积==第二次的读数-第一次读数。
2、什么是标准溶液、滴定剂?答:标准溶液是指含有某一特定浓度的参数的溶液,比如Cl或Fe的标准溶液。
当用标准溶液代替样品进行测试时,得到的结果应该与已知标准溶液的浓度相符。
如果得到相符的结果,则说明测试操作正确。
2.1、标准溶液的用途:标准溶液还可用来校准仪器,比如色度计和分光光度计,以及pH计和pH/ISE 计等电化学仪器。
不同浓度的标准溶液可以用来绘制校准曲线,从而可以用得到的校准曲线反查测试样品的浓度,这个在学校学习的时候,经常会用到用标准溶液校准仪器,并和样品溶液一起进行测试物性2.2、容量瓶操作有哪些步骤:计算、称量(量取)、溶解、冷却、转移、洗涤、定容、摇匀\装瓶3、滴定分析法是根据什么进行分类的?分类结果怎样?答:根据标准溶液和待测组分间的反应类型的不同,分为四类1. 酸碱滴定法——以质子传递反应为基础的一种滴定分析方法,可用于测定酸、碱和两性物质。
第四章_滴定分析法概论

NaOH溶液 溶液? 问:如何配制1000 mL,0.1mol/L NaOH溶液? 如何配制1000
mNaOH = 0.1mol/L×1.000L×40.00g/mol=4g 0.1mol/L×1.000L×
台秤上称取4.0g 台秤上称取4.0gNaOH 标定 溶解 稀释至1000mL 稀释至1000mL
例: TH2SO4 / NaOH% = 2.69% ,
表示固定试样质量时, 每消耗1 表示固定试样质量时 , 每消耗 1.00 mLH2SO4 标准溶 NaOH。 液,就可以中和试样中2.69% 的NaOH。 就可以中和试样中2 69% 溶液,则试样中NaOH NaOH的质 问:如果用去10.50mL H2SO4溶液,则试样中NaOH的质 如果用去10.50mL 量分数为多少? 量分数为多少? 答: 2.69% mL-1 × 10.50 mL = 28.24%
第 四 章 滴定分析法概论
第一节
滴定分析法简介
一、滴定分析法的过 程及特点 二、滴定分析对化学 反应的要求 三、滴定分析分类
一.滴定分析法的过程和特点
过程: 滴定分析也称容量分析 容量分析, 过程 滴定分析也称容量分析,该法使用滴定管 将一种已知准确浓度的试剂溶液(标准溶液)滴加 将一种已知准确浓度的试剂溶液(标准溶液) 到待测物质的溶液中, 到待测物质的溶液中,直到所加试剂与被测组分按 化学计量关系完全反应为止, 化学计量关系完全反应为止,然后根据标准溶液的 浓度和用去的体积计算被测物质的含量。 浓度和用去的体积计算被测物质的含量。 标准溶液(又称滴定剂) 标准溶液(又称滴定剂):已知准确浓 度的试剂溶液。 度的试剂溶液。 指示剂: 指示剂:在反应的计量点附近能发生颜色 突变,从而确定滴定进行程度的试剂。 突变,从而确定滴定进行程度的试剂。
高等教育版《分析化学》 第四章 酸碱滴定法

☺
酸碱反应的平衡常数
☺
☺ ☺ ☺ ☺ ☺
共轭酸碱对K
酸碱的强弱
a
K b、
的关系
酸碱得失质子的能力
Ka 酸的强度 Kb 碱的强度
酸越强,其共轭碱越弱。
第四章
酸碱滴定法
分析化学
Analytical Chemistry
☺
在水溶液中,HClO4、H2SO4、HCl和HNO3都是很强的 酸,如果浓度不是太大,它们与水分子之间的质子转 移反应都进行的十分完全,因而不能显示出它们之间
的MBE。
第四章
酸碱滴定法
分析化学
Analytical Chemistry
☺
电荷平衡CBE(电中性规则)(Charge Balance Equation) 在电解质溶液中,处于平衡状态时,各种阳离子所带正电 荷的总浓度等于各种阴离子所带负电荷的总浓度。此电中
性原则称为电荷平衡。其数学表达式称为电荷平衡方程,
第四章
酸碱滴定法
分析化学
Analytical Chemistry
二、一元弱酸(碱)溶液中H+浓度的计算
一元弱酸
[H
]
K a [ HA ] K W
( 精确式)
简化(基本原则为计算误差不超过± 5%):
使用条件
cK a 20 K w
c K
a
公式
[H ]
K a
K a 4cK a
酸度:溶液中[H+]的浓度,pH=-lg[H+]。
碱度:溶液中[OH-]的浓度。
第四章
酸碱滴定法
分析化学
Analytical Chemistry
分析化学 第四章 酸碱滴定法(课后习题答案)

KW Ka
c sp
1.0 10-14 1.7 10-5
0.05
5.4 10-6
mol
/
L
pOH 5.27
pH=8.73
②林邦误差公式
H 6.31010mol / L, OH 1.6105mol / L, csp 0.05mol / L
2
pH 9.20 8.73 0.47
TE% 10pH 10-pH 100%
第二计量点时,酚羟基被中和,消耗标准溶液:5.19-3.58=1.61(ml)
0.1790 5.19 3.58 188.0
1-羟基-α-萘酸%=
1000 100% 38.64%
0.1402
0.1790 3.58 1.61 172.0
α-萘酸%=
1000 100% 43.26%
0.1402
9. 解:
pH 2.00
pOH 14.00 2.00 12.00
HClO4 在乙醇中:
C2
H5OH
2
0.0100mol
/
L
pC2H5OH2 2.00
pC2H5O 19.10 2.00 17.10 5. 解: ①
W
c V NaOH NaOH
M HA 1000
M HA
W 1000 c V NaOH NaOH
3
第四章 酸碱滴定法(答案) 1. 答: ①滴定强酸,可以完全反应,对结果没有影响。 ②滴定弱酸,NaOH 能中和弱酸,Na2CO3 不能中和弱酸,需要消耗更多的标准 溶液,将带来正误差,导致分析结果偏高。 2. 答:硼砂(Na2B4O7·10H2O)为 H3BO3 和 H2BO3 的混合物,硼酸的 pKa1 9.27 ,
分析化学第四章 滴定分析概论

m Fe = T Fe / KMnO4 V KMnO4
通式: TA/B= (a / b ) · B · A · -3 c M 10
4-3 标准溶液的配制与标定
• 二、标准溶液的配制 • 1、直接法 • 配制方法:用分析天平准确称取一定量的 基 准物质,溶解后,转移到容量瓶中定容,然后算 出该溶液的准确浓度。 • 2、间接法 • 配制方法:粗略称取一定量的物质或量取一定 体积的溶液配制成接近于所需浓度的溶液,利用 基准物质确定溶液准确浓度或用一种已知浓度的 标液来确定另一 种溶液的浓度方法
0.1200 200 0.1000 (200 V )
(0.1200 0.1000 ) 200 V 40(mL ) 0.1000
续滴定分析计算
例2:将0.2500 g Na2CO3基准物溶于适量水中后,用 0.2 mol/L的HCL滴定至终点,问大约消耗此HCL 溶液多少毫升? 解: n HCL nNa 2CO3 2
C HCL VHCL 2 n Na2CO3
VHCL
2 mNa2CO3 1000 M Na2CO3
2 0.2500 1000 24(ml ) 0.2 106 .0
续滴定分析计算
例2:将0.2500 g Na2CO3基准物溶于适量水中后,用 0.2 mol/L的HCL滴定至终点,问大约消耗此HCL 溶液多少毫升? 解: n HCL nNa 2CO3 2
一、基本概念
1、滴定分析法:根据化学反应进行滴定的方法。 2、滴定(titration):准确取一定量的一种物质
放在锥形瓶中,把装在滴
定管中的另一种溶液逐滴
加入到锥形瓶中的操作。
3、滴定液(标准溶液,titrant): 已知准确浓度的溶液。 4、被滴定液(titrand): 被测定的溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
、A1、溴百里酚蓝的pK In 为7.3,其变色范围是A、4.4 〜6.4B、6.3〜8.3C、7.6〜8.8D、8.1〜10.1E、9.5〜10.7正确答案】B答案解析】考查重点是酸碱指示剂的变色范围:pH=pK In±1 。
该题针对“酸碱滴定法”知识点进行考核】2、弱酸需符合下列哪个条件才能被强碱直接滴定-8A、C*Ka< 10B、C*Ka> 1O8C、Ka> 108D、Ka< 1O8E、C*Ka< W10正确答案】B【答案解析】当溶液浓度一定时,Ka愈小,滴定突跃范围愈小;当Ka v 10-8时,已没有明显突跃,即使弱酸的浓度为1mol/L ,也无明显的突跃,此时很难用指示剂来确定终点。
当弱酸的K 一定时,溶液的浓度愈大,滴定突跃范围也愈大。
反之则小。
根据滴定误差应V 0.1%的要求,若以强碱直接滴定弱酸,只有当C*Ka> 10-8时,才能用强碱准确滴定。
该题针对“酸碱滴定法”知识点进行考核】3、用盐酸滴定液滴定氨水时,使用的指示剂是A、甲基橙B、铬黑TC、酚酞D、淀粉E、硫酸铁铵正确答案】A答案解析】解析:基橙是在酸性区域变色,酚酞是在碱性区域变色;淀粉是氧化还原滴定中常用的指示剂;铬黑T 是配位滴定法中常用的指示剂;硫酸铁铵是沉淀滴定法中常用的指示剂。
建议考生掌握常用指示剂的用途。
该题针对“酸碱滴定法”知识点进行考核】4、用氢氧化钠滴定液(O.IOOOmol /L)滴定20.00ml盐酸溶液(O.IOOOmol /L),滴定突跃范围的pH 值是A、 1.OO—3.OOB、3.OO 〜4.3OC、8.OO〜9.7OD、4.3O〜9.7OE、9.7O〜1O.OO正确答案】D答案解析】解析:本题考查对酸碱滴定中滴定突越及突越范围的概念和计算。
根据强酸(碱)的滴定曲线四个阶段(滴定开始前、滴定至化学计量点前、化学计量点时和化学计量点后)不同的计算公式,可求得化学计量点±).1 %的范围内,溶液pH由4.3O增大到9.7O,即可确定此滴定的突越范围。
另外,此题是典型的强酸(碱)滴定例题,考生亦应熟记此类数据,考试时略加验证即可节约答题时间。
建议考生掌握典型酸碱滴定法中有关滴定曲线、滴定突跃等概念及计算。
该题针对“酸碱滴定法”知识点进行考核】5、酸碱滴定法所选用指示剂的变色范围为A、pH=pKIn±1B、pH=pKIn ±2C、pH=pKIn±3D、pH=pKIn±4E 、 pH=pKIn ±5 【正确答案】 A答案解析】 酸碱滴定法所选用指示剂的变色范围为 pH=pKIn ± 1该题针对 “酸碱滴定法 ”知识点进行考核】6、标定滴定液的准确浓度时,需用A 、对照品B 、标准品C 、纯净物质D 、基准物质E 、化学物质正确答案】 D答案解析】 基准物质用来直接配制基本标准溶液, 但在较多情况下, 它常用来校准或标定某 未知溶液的浓度。
该题针对 “酸碱滴定法 ”知识点进行考核】以目视法能观察到酸碱指示剂颜色变化时,其酸式体与碱式体的浓度比应是正确答案】答案解析】 溶液中指示剂颜色是两种不同颜色的混合色。
当两种颜色的浓度之比是 10 倍或 10 倍以上时,我们只能看到浓度较大的那种颜色。
一般认为,能够看到颜色变 化的指示剂浓度比[In-]/[HIn]的范围是1/10〜10。
【该题针对 “酸碱滴定法 ”知识点进行考核】8、5.00 Xl0"5mol /L 的氢氧化钠溶液的pH 值应是7、 A 、 2:1或 1:2B 、 5:1或 1:5C 、 10 :1 或 1:10D 、 15:1或 1:15E 、 20:1 或 1:20pH 计算公式:PH=14-[-Ig ( 5*10"5) ]=14-4.3=9.7【该题针对 酸碱滴定法”知识点进行考核】9、0.1000mol/LHAc 溶液的 pH 值应是(Ka=1.76 XlO-5)A 、4.30B 、2.8C 、2.88D 、2.9E 、3【正确答案】C【答案解析】[H*] = 707^ /L76 xlO'^ x0\ 1 =L36xlO-^ (mol/L)pH M 2. 88【该题针对 酸碱滴定法”知识点进行考核】10、用非水滴定法测定杂环类药物氢卤酸盐时,须加入醋酸汞,其目的是增加酸性除去杂质干扰增加碱性【正确答案】C【答案解析】解析:本题考查对非水滴定法注意事项的熟悉程度。
当以高氯酸为滴定剂滴定有A 、 9.70B 、 4.30C 、 7.75D 、 8.72E 、 5.27【正确答案】【答案解析】 A C 、 消除氢卤酸根影响D 、消除微量水分影响机碱的氢卤酸盐时,滴定过程中被置换出的氢卤酸酸性较强,反应将不能进行到底,影响滴定终点,故加入一定量的醋酸汞冰醋酸溶液,使生成在醋酸中难以解离的卤化汞,以消除氢卤酸对滴定的干扰。
建议考生熟悉各类滴定法测定时的注意事项。
该题针对“非水溶液滴定法”知识点进行考核】11、非水滴定法测定有机酸的碱金属盐时,应选用何种指示剂A、甲基橙B、酚酞C、结晶紫D、偶氮紫E、百里酚蓝正确答案】C答案解析】非水碱量法可用指示剂或电位法指示终点。
常用的指示剂是结晶紫,结晶紫分子中的氮原子能结合多个质子而表现为多元碱。
该题针对“非水溶液滴定法”知识点进行考核】12、非水碱量法测定有机碱的氢卤酸盐时,应加入何种试剂消除干扰A、醋酸铵B、硝酸银C、醋酸汞D、硝酸E、溴化钾正确答案】C答案解析】例如用非水溶液滴定法测定盐酸利多卡因,由于盐酸利多卡因系盐酸盐,用高氯酸滴定时游离出的盐酸对滴定有干扰。
故在滴定前加入醋酸汞,使与盐酸生成醋酸及难电离的氯化汞,以排除干扰。
13、标定甲醇钠的基准物为A、苯甲酸B、邻苯二甲酸氢钾C、硼砂D、枸橼酸E、重铬酸钾正确答案】A答案解析】标定甲醇钠滴定液使用苯甲酸为基准物质,麝香草酚蓝为指示剂。
该题针对“第四章滴定分析法,非水溶液滴定法”知识点进行考核】14、要想增加弱酸的酸性,应将其A、溶解在强酸性溶液中B 、溶于弱酸溶液中C、溶于强碱溶液中D、溶于弱碱溶液中E 、溶于偶极亲质子溶剂中正确答案】D答案解析】溶剂酸的滴定宜选择碱性溶剂,碱性溶剂是指接受质子能力较强的溶剂,它能增强弱酸性物质的酸性,使滴定突跃范围明显。
该题针对“非水溶液滴定法”知识点进行考核】15、《中国药典》规定亚硝酸钠滴定法采用哪种方法指示终点A、电位法B 、外指示剂C、自身指示剂D、永停滴定法法E 、氧化还原指示剂正确答案】D答案解析】考查重点是亚硝酸钠滴定法,《中国药典》采用永停滴定法指示终点。
该题针对“氧化还原滴定法”知识点进行考核】16、《中国药典》硫代硫酸钠滴定液的标定采用A、重铬酸钾为基准物,直接碘量法B、重铬酸钾为基准物,剩余碘量法C、重铬酸钾为基准物,置换碘量法D、三氧化二砷为基准物,置换碘量法E、三氧化二砷为基准物,剩余碘量法正确答案】C答案解析】中国药典》采用置换碘量法标定硫代硫酸钠。
以重铬酸钾为基准物,加入碘化钾置换出定量的碘,碘再用硫代硫酸钠滴定液滴定。
该题针对“氧化还原滴定法”知识点进行考核】17、亚硝酸钠滴定法测定具芳伯氨基药物时,加入溴化钾固体可加速重氮化反应速度的原因在于A、生成HNO2B、生成NOClC、生成NOBrD、生成HBrE、NOBr 重氮化反应的速度比NOCl 快300 倍正确答案】D答案解析】加入溴化钾的作用:由于重氮化反应在氢溴酸(HBr)中反应速度更快。
若在滴定时向供试溶液中加入适量溴化钾(规定加入2g),可与盐酸作用生成HBr,而使重氮化反应速度加快。
该题针对“氧化还原滴定法”知识点进行考核】18、直接碘量法测定的药物应是A、氧化性药物B、还原性药物C、中性药物D、无机药物E、有机药物正确答案】B答案解析】直接碘量法:直接碘量法是用碘滴定液直接滴定还原性物质的方法。
该题针对“氧化还原滴定法”知识点进行考核】二、B1、A. 邻苯二甲酸氢钾B.无水碳酸钠C.对氨基苯磺酸D .三氧化二砷E.氯化钠<1> 、标定氢氧化钠滴定液的基准物正确答案】A答案解析】该题针对“酸碱滴定法”知识点进行考核】<2> 、标定盐酸滴定液的基准物正确答案】B答案解析】该题针对“酸碱滴定法”知识点进行考核】<3> 、标定硫酸铈滴定液的基准物正确答案】D答案解析】该题针对“酸碱滴定法”知识点进行考核】<4> 、标定硝酸银的基准物正确答案】E答案解析】A B C D E该题针对“酸碱滴定法”知识点进行考核】2、A.酚酞B.淀粉C.荧光黄D.邻二氮菲E.铬黑T以下滴定方法使用的指示剂是<1> 、酸碱滴定法正确答案】A答案解析】该题针对“酸碱滴定法”知识点进行考核】<2> 、碘量法正确答案】B答案解析】该题针对“酸碱滴定法”知识点进行考核】<3> 、铈量法正确答案】D答案解析】解析:本组题考查对容量分析法中常见滴定方法所用到的指示剂的熟悉程度。
酚酞是一种常用的酸碱滴定指示剂,根据其在酸性条件下无色,碱性条件下为红色来指示滴定终点。
淀粉是碘量法(氧化还原滴定)中应用最多的指示剂,有I 副离子存在时,淀粉遇碘显深蓝色,反应可逆且灵敏。
荧光黄是一种酸性染料,通常在以吸附剂为指示剂的银量法(沉淀滴定法)中作为吸附指示剂。
邻二氮菲常用于铈量法(氧化还原滴定)中作为外指示剂来提高检测的灵敏度。
铬黑T是一种有机染料,在配位滴定法中常作为金属指示剂。
建议考生熟悉各类指示剂的使用。
该题针对“酸碱滴定法”知识点进行考核】3、A.盐酸麻黄碱B.乙琥胺C.醋酸D.碳酸钠E.苯甲酸钠<1> 、非水酸量法正确答案】B答案解析】非水酸量法主要用于极弱的酸如酚类、酰亚胺类药物的含量测定。
如乙琥胺的含量测定。
该题针对“非水溶液滴定法”知识点进行考核】<2> 、非水碱量法正确答案】A答案解析】非水碱量法主要用于含氮碱性有机药物及其氢卤酸盐、磷酸盐、硫酸盐或有机酸盐的测定。
盐酸麻黄碱属于含氮碱性有机药物。
该题针对“非水溶液滴定法”知识点进行考核】4、A. 碘滴定液B.高氯酸滴定液C.硝酸银滴定液D.硫酸铈滴定液E.亚硝酸钠滴定液<1> 、磺胺嘧啶含量测定选用的滴定液是正确答案】E答案解析】A B C D E该题针对“氧化还原滴定法”知识点进行考核】<2> 、硝苯地平含量测定选用的滴定液是正确答案】D答案解析】该题针对“氧化还原滴定法”知识点进行考核】<3> 、盐酸麻黄碱含量测定选用的滴定液是正确答案】B答案解析】考查重点是各类滴定分析方法在药物含量测定中的应用同时也考查对各类滴定分析方法所用滴定液的掌握情况。
