新药审批意见汇总表
新特药申请表&评审表

新特药申请表商品名剂型规格医保类型甲类招标类型中标品种中标价格乙类非中标品种非中标价自费中标编码:生产企业业务联系人联系电话主要用途与适应症与本院同类药品比较情况建议淘汰品种药物性价比申请人(临床医师)签名:年月日临床科室意见临床科室主任签字:年月日药剂科意见科室主任签字:年月日医院药事管理委员会意见业务院长签字:年月日集团药管部意见集团主管领导审批填表要求:字迹工整清楚,填写完整,对填写不完整的不予以受理。
备注:申请人申购产品,如在三个月发生产品滞销等现象,所剩产品直接由申请人负责清货,无法清货的直接扣除申请人绩效。
新药、特药形式筛查(评审)1.合法经营:□营业执照□许可证□委托书□身份证□GMP(GSP)证2.报备文件合法:□新药证书□生产批件□批准文号□注册商标批件□包装□标签说明书□价格批准文件(□企业□国家零售价:实价:扣率%:)3.质量文件齐全:□《药品质量保证书》、□法定质量标准、□法定检验报告4.是否有失效的证书、批件等文件:□有□无;与年月日补其。
5.品种费别等:□自费、□甲类、□乙类、□()线抗菌药物、□招标品种6.查HIS系统同类品种名称与规格:结论:□符合要求□资料不齐全□不能提供有效资料签名:年月日优选品种:①医保品种;②质优价廉;③仿制药质量标准有提高;④优选国家批准的新药,“增加规格的品种”次选;⑤与医院有长期合作且未发生过任何不良事件的。
严控品种:①质量标准有缺项的。
②药名、外观与医院的同类品种极其相似,易混淆的;③辅助药品、同类品种多的。
④严格管理的二~三线抗菌药物。
不采用品种:①曾发生过严重质量事件的厂商生产的品种;②疗效不确切,作用机理不清楚的;③国家通报有严重不良反应;④外国禁用的;⑤厂家、业务人员或供应商在我院有不良记录。
结论:□是优选品种第项;□是严控品种第项;□是不采用品种第项签名:年月日。
医院新药采用审批程序

医院新药采用审批程序1. 申请1.1 新药申请需副主任医师以上职称者负责填写《医院新药采用申请表》,科室的正主任签字同意。
专科用药需相应的专科申请,中成药一般应有中医科提出申请,西医科室申请中成药须经医院药事管理委员会的中医药专业委员就方解、功能主治等签署意见。
1.2申请表内容包括:药品基本信息、申购理由等。
1.3申请表交药学部药品供应室主任。
1.4药品供应室主任确认表格填写无误、内容完整之后,在表格上标注申请编号和受理日期。
2形式审查2.1药品采购员凭《医院新药采用申请表》对已受理的申请进行形式审查。
2.2药品采购员按《医院新药采用申请表》上记录的药品申请商和销售商的联系方式与其联系,索取资料。
2.2.1一般化学药品应采取下列资料:药品生产企业许可证和经营执照,药品生产批文或试生产批件,新药证书、注册商品批件,物价批文、GMP证书、法定质量标准、药品出厂检验报告书,包装、标签和说明书实样、药品的药学(药学、药理、毒理)资料和临床(临床、不良反应)资料、药品经营企业许可证和营业执照、GSP证书、《药品生产企业质量保证情况调查表》。
2.2.2进口药品还应索取进口药品注册证、中文说明书、进口药品通关单、进口药品检验报告书。
2.2.3进口生物制品还应索取生物制品进口批件或生物制品进口批签发证。
2.2.4麻醉药品、医用毒性药品、精神药品、医用放射性药品应按有关规章制度索取资料。
2.2.5中药成药设计保护品种的还应索取中药保护品种证书。
2.2.6无知识产权纠纷的保证书。
2.2.7以上文件可为复印件,所有文件均须加盖该企业的原印章。
2.3形式审查应关注以下方面2.3.1证书、批件应注意颁发机关、编号和有效期。
2.3.2国家定价品种应有发改委文件,企业自定价品种应有所在地的物价备案文件。
2.3.3GMP证书应注意其批准内容(全厂认证或生产线认证)。
2.3.4质量标准为国家标准或地标升国标。
2.3.5检验报告书是否与拟进行临床验证的药品同批号。
医院药事管理与药物治疗学委员会制度及章程

ⅩⅩ医院药事管理与药物治疗学委员会制度及章程药事管理与药物治疗制度第一部分医院药事管理与药物治疗学委员会制度 (3)一、药事管理与药物治疗学委员会章程 (3)二、药事管理与药物治疗学委员会会议制度 (6)附表1:医院药事管理与药物治疗工作意见/建议征集表附表2:医院药事管理与药物治疗学委员会第×届×次会议议案附表3:医院药事管理与药物治疗学委员会第×届×次会议议案简报附表4:医院药事管理与药物治疗学委员会会第×届×次会议决议三、药品筛查引进及淘汰制度 (12)附表1:新药引进申请表附表2:新药信息表附表3:拟引进新药评估表附表4:新药临床使用评价表附表5:临时用药申请表附表6:待批准新药汇总表附表7:新药审批意见汇总表附表8:拟淘汰药品汇总表第二部分医院药品质量监督管理制度 (24)一、药品质量监督领导小组工作制度与职责 (24)二、临床科室备用药品管理制度 (24)附表1:临床科室备用药品检查评分表三、退药管理制度 (26)四、住院患者自带药品使用管理制度 (27)附表1:住院患者自带药品使用申请表第三部分医院安全用药监督管理制度 (29)一、安全用药监督指导小组工作制度与职责 (29)二、安全用药管理制度 (29)三、药品不良反应监测小组工作制度与职责 (32)附表1:药品不良反应/事件报告表四、特殊药品管理制度 (34)五、麻醉药品、精神药品管理小组工作制度与职责 (35)六、麻醉药品、精神药品管理制度 (36)附件1:麻醉药品、第一类精神药品使用知情同意书附表2:科室备用麻醉精神药品申请表附表3:科室备用麻醉精神药品退库申请表附表4:麻醉药品、精神药品销毁记录表附表5:意外损耗麻醉药品、精神药品证明书附表6:过期、损坏麻醉药品精神药品退库记录表七、高危药品管理制度 (46)附件1:高危药品目录八、重点药品观察制度 (47)附件1:重点药品观察程序附件2:重点药品的目录九、输注药品安全管理制度 (49)十、用药后观察制度 (51)十一、输注药品配伍禁忌管理制度 (52)十二、医疗用毒性药品管理制度 (53)第四部分医院合理用药与处方点评监督管理制度 (54)一、合理用药监督指导与处方点评小组工作制度与职责 (54)二、抗菌药物临床应用指导原则实施细则 (55)附表1:感染性疾病经验治疗选用药物参考表附表2:针对不同病原体的抗菌药物选择参考表附表3:非手术感染的预防用药附表4:I 类切口延长使用抗菌药物申请单附表5:常见手术预防用抗菌药物表附表6:肝功能减退感染患者抗菌药物的应用附表7:肾功能减退感染患者抗菌药物的应用附表8:抗微生物药在妊娠期应用时的危险性分类附表9:新生儿应用抗菌药物后可能发生的不良反应附表10:医院常用抗菌药物分级表三、中药注射剂临床使用管理制度 (97)附件1:ⅩⅩ医院中药注射剂外配知情同意书四、处方管理办法实施细则 (99)附件1:处方标准五、处方点评管理制度 (106)附表1:处方点评工作表附表2:ⅩⅩ医院住院病历用药情况检查评分表附表3:ⅩⅩ医院住院病历抗菌药物使用检查评分表(手术)附表4:ⅩⅩ医院住院病历抗菌药物使用检查评分表(非手术)六、不合理用药登记及通报公示制度 (115)七、药品动态监测及超常预警通报制度 (116)八、外配处方管理制度 (118)第一部分医院药事管理与药物治疗学委员会制度一、药事管理与药物治疗学委员会章程第一节总则第一条根据《药品管理法》和《医疗机构药事管理规定》等药政法规和管理条例的有关规定,医院成立药事管理与药物治疗学委员会,以下简称药事会。
新药引进遴选原则及审批制度

平昌县第二人民医院医院新药引进遴选原则及审批制度一、新药遴选原则(一)本院未使用过的药品,或本院已使用过的药品改变给药途径、剂型、规格、品牌,或因不良事件停用一年以上的药品均按新药引进管理。
(二)医院选用药品原则上选用省招标范围内的药品,特殊情况除外。
(三)同一通用名称药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1~2种。
因特殊诊疗需要使用其他剂型和剂量规格药品的情况除外。
(四)在引进医院已有两种同一通用名称、同一给药途径的品种时,申请科室和药学部在经过调研后,认为新的品种较在用品种在临床疗效、毒副作用、经济适用等方面确实存在明显优势,可以提交药事管理与药物治疗学委员会审议替换。
(五)优先考虑疗效可靠、毒副作用小、经济适用的品种。
(六)优先考虑品牌、原研、专利的品种。
(七)优先考虑基本医疗保险目录内的药品。
(八)优先考虑国家基本药物。
(九)优先考虑与医院有长期良好合作关系且未发生过任何不良事件的生产厂商的品种。
(十)存在以下问题的品种不予引进:1、曾发生过严重质量事件的生产商生产的品种。
2、疗效不确切、作用机理不清楚。
3、被北美、欧盟、日本、英国、澳大利亚等国家或地区禁用的。
4、生产商、销售商的医药代表在医院药品营销活动中有不良记录的。
5、被药事管理与药物治疗学委员会否决过的品种,半年内不再接受该品种的申请。
二、新药引进程序(一)新药由申请科室集体讨论后,填写《蚌埠三院新药申请表》,科室行政主任在表上签字同意后提交药学部。
(二)药学部组成新药审查小组,对科室申请的新药进行形式审查和技术审查。
1、形式审查的内容有:药品生产企业的许可证和营业执照、生产批件、新药证书、注册商标批件、物价批文、GMP证书、法定质量标准、药品出厂检验报告单、包装、标签和说明书实样、药品的药学、药理、毒理资料和临床验证资料、专利证书、中药保护品种证书、药品经营企业许可证和营业执照、GSP证书等。
进口药品还需索要进口药品注册证等。
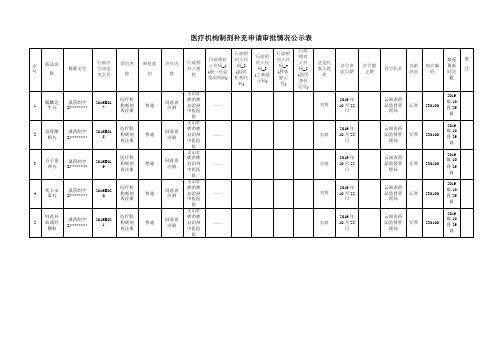
医疗机构制剂补充申请审批情况公示表【模板】
许可机关
当前状态
地方编码
数据更新时间戳
备注
1
毓麟达生丸
滇药制字Z********
2019B017
医疗机构制剂再注册
普通
同意再注册
文山壮族苗族自治州中医医院
ห้องสมุดไป่ตู้——
刘琼
2019年10月22日
云南省药品监督管理局
正常
530100
2019年10月29日
2
益肾醒精丸
滇药制字Z********
2019B018
医疗机构制剂补充申请审批情况公示表
序号
药品名称
批准文号
行政许可决定书文号
项目名称
审批类别
许可内容
行政相对人名称
行政相对人代码_1
(统一社会信用代码)
行政相对人代码_2
(组织机构代码)
行政相对人代码_3
(工商登记码)
行政相对人代码_4
(税务登记号)
行政相对人代码_5
(居民身份证号)
法定代表人姓名
许可决定日期
医疗机构制剂再注册
普通
同意再注册
文山壮族苗族自治州中医医院
——
刘琼
2019年10月22日
云南省药品监督管理局
正常
530100
2019年10月29日
3
五子益冲丸
滇药制字Z********
2019B019
医疗机构制剂再注册
普通
同意再注册
文山壮族苗族自治州中医医院
——
刘琼
2019年10月22日
云南省药品监督管理局
普通
同意再注册
文山壮族苗族自治州中医医院
——
新药申报审批(药品注册流程)之总结版--新药申报审批一般程序图
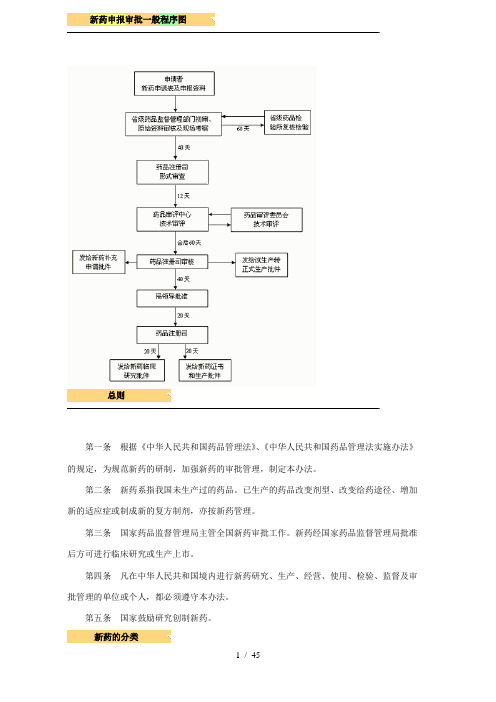
新药申报审批一般程序图总则第一条根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施办法》的规定,为规范新药的研制,加强新药的审批管理,制定本办法。
第二条新药系指我国未生产过的药品。
已生产的药品改变剂型、改变给药途径、增加新的适应症或制成新的复方制剂,亦按新药管理。
第三条国家药品监督管理局主管全国新药审批工作。
新药经国家药品监督管理局批准后方可进行临床研究或生产上市。
第四条凡在中华人民共和国境内进行新药研究、生产、经营、使用、检验、监督及审批管理的单位或个人,都必须遵守本办法。
第五条国家鼓励研究创制新药。
新药的分类第六条新药按审批管理的要求分以下几类:一、中药第一类:1. 中药材的人工制成品。
2. 新发现的中药材及其制剂。
3. 中药材中提取的有效成分及其制剂。
4. 复方中提取的有效成分。
第二类:1. 中药注射剂。
2. 中药材新的药用部位及其制剂。
3. 中药材、天然药物中提取的有效部位及其制剂。
4. 中药材以人工方法在动物体内的制取物及其制剂。
5. 复方中提取的有效部位群。
第三类:1. 新的中药复方制剂。
2. 以中药疗效为主的中药和化学药品的复方制剂。
3. 从国外引种或引进养殖的习用进口药材及其制剂。
第四类:1. 改变剂型或改变给药途径的制剂。
2. 国内异地引种或野生变家养的动植物药材。
第五类:增加新主治病证的药品。
二、化学药品第一类:首创的原料药及其制剂。
1. 通过合成或半合成的方法制成的原料药及其制剂。
2. 天然物质中提取的或通过发酵提取的有效单体及其制剂。
3. 国外已有药用研究报道,尚未获一国药品管理当局批准上市的化合物。
第二类:1. 已在国外获准生产上市,但未载入药典,我国也未进口的药品。
2. 用拆分、合成的方法首次制得的某一已知药物中的光学异构体及其制剂。
3. 国外尚未上市的由口服、外用或其他途径改变为注射途径给药者,或由局部用药改为全身给药者(如口服、吸入等制剂)。
第三类:1. 由化学药品新组成的复方制剂。
药物临床试验申请审批表

3.申办者对试验过程质量保证的能力:强□,一般□,弱□
评估意见:同意□ →主要研究者:研究者:
不同意□
机构办主任签字:
日期:年月日
3.是否具备相应的仪器设备和其他技术条件:是□,否□
4.目前科室承担的与试验药物疾病相同的在研项目:无□,1项□,2项□,2项以上□
5.主要研究者在研科研课题:无□,1项□,2项□,3项□,3项以上□
6.主要研究者:
评估意见:同意□,不同意□
主要评估者签字:
日期:年月日
机构办公室评估、立项备案:
1.临床前研究资料是否齐全:是□,否□
药物临床试验申请审批表
项目名称
试验类型
Ⅱ期□,Ⅲ期□,IV期□,其他□
承担科室
临床试验项目主要研究者PI联系电话临床试验专业负责人联系电话
申办者/CRO
申办者/CRO项目经理
联系电话
申办者/CRO监察员CRA
联系电话
专业科室评估:
1.是否能保证招募足够的受试人群:是□,否□
2.研究者是否具备足够的试验时间:是□,否□
2.药品采购与审批制度

主题内容药品采购与审批制度生效日期:2023-04-11第 1 页共 4 页药品采购与审批制度一、新药评审、遴选与采购审批流程(一)新药的定义:是指未在我院常规采购、使用过的未纳入医院药品供应目录的药品,以药品通用名为准(经药品监督管理部门批准并公布的药品通用名称)。
凡是临床科室提出的新药需求须开药事委员会同意后方可实施采购。
临床科室对已有药品的不同规格、生产企业、制备工艺等不同需求,也参照新药进行评审、遴选后方可实施采购。
(二)临床科室因诊疗工作需要,申请采购新药应填写《新药申请表》,申请表需填写药品通用名(含剂型)、规格和申请理由等。
经科组长及医师签名(其中必须有组长签名)后提交药械科。
(三)药械科根据该通用名及规格的新药市场情况(与挂网同一通用名药品比较)、是否适合医院药品配置现状(医院已有同类药品配置情况)、规格等是否临床诊疗需要、是否满足“一品双规”及抗菌药物管理的相关规定等情况做出审批意见。
审批环节需有临床药师参与,审批结果需注明“建议引入”或“不建议引入”,并由药械科负责人签字确认。
(四)由药械科汇总形成《新药评审、遴选投票表》(附件2),提交药事会讨论、评审、遴选,参会人数应达到药事会成员主题内容药品采购与审批制度生效日期:2023-04-11第 2 页共 4 页总数的2/3及以上,通过投票决定是否同意申请的药品,药械科、申请科室负责人均可在会上介绍该新药基本情况,包括院内有无同类药品、药品价格及其他属性等,同意引入的票数达到总票数的2/3及以上视为通过该评审环节。
二、日常用药采购与审批流程药械科负责药品采购的工作人员依据药房申领药品的需求量、已核准的新药需求情况,同时兼顾保持必要的药库药品储备,制定采购计划。
药品采购计划提交分管院领导审批,提交药事委员会讨论通过后药品采购人员方可实施采购。
三、临时用药采购与审批流程(一)临时用药采购适用于我院《药品供应目录》以外的急诊抢救病人用药、突发公共卫生事件用药或备药、医疗保障用药、部分药品供应中断而临床工作急需使用替代药品、临床科室认为急需用药但尚不能及时召开药事会进行评审和遴选及品规更替的情况、上级卫生行政部门要求配备而供应目录内药品不能满足等情况。
新药引进遴选原则及审批制度

xx第二人民医院医院新药引进遴选原则及审批制度一、新药遴选原则(一)本院未使用过的药品,或本院已使用过的药品改变给药途径、剂型、规格、品牌,或因不良事件停用一年以上的药品均按新药引进管理。
(二)医院选用药品原则上选用省招标范围内的药品,特殊情况除外。
(三)同一通用名称药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1~2种。
因特殊诊疗需要使用其他剂型和剂量规格药品的情况除外。
(四)在引进医院已有两种同一通用名称、同一给药途径的品种时,申请科室和药学部在经过调研后,认为新的品种较在用品种在临床疗效、毒副作用、经济适用等方面确实存在明显优势,可以提交药事管理与药物治疗学委员会审议替换。
(五)优先考虑疗效可靠、毒副作用小、经济适用的品种。
(六)优先考虑品牌、原研、专利的品种。
(七)优先考虑基本医疗保险目录内的药品。
(八)优先考虑国家基本药物。
(九)优先考虑与医院有长期良好合作关系且未发生过任何不良事件的生产厂商的品种。
(十)存在以下问题的品种不予引进:1、曾发生过严重质量事件的生产商生产的品种。
2、疗效不确切、作用机理不清楚。
13、被北美、欧盟、日本、英国、澳大利亚等国家或地区禁用的。
4、生产商、销售商的医药代表在医院药品营销活动中有不良记录的。
5、被药事管理与药物治疗学委员会否决过的品种,半年内不再接受该品种的申请。
二、新药引进程序(一)新药由申请科室集体讨论后,填写《蚌埠三院新药申请表》,科室行政主任在表上签字同意后提交药学部。
(二)药学部组成新药审查小组,对科室申请的新药进行形式审查和技术审查。
1、形式审查的内容有:药品生产企业的许可证和营业执照、生产批件、新药证书、注册商标批件、物价批文、GMP证书、法定质量标准、药品出厂检验报告单、包装、标签和说明书实样、药品的药学、药理、毒理资料和临床验证资料、专利证书、中药保护品种证书、药品经营企业许可证和营业执照、GSP证书等。
进口药品还需索要进口药品注册证等。
新药临床申请审批流程图

现在有三种申报方法一.申报1.1类药进口(进口药)(1)方法:a.等药品在国外上市后,不在国内生产。
申请分包进口(类似于代理)。
b.等药品在国外上市后,完善国内厂房技术,在国内生产。
(2)费用:临床实验37.6万,生产59.39万。
(3)难点:a.需要等药物在国外上市后才可以进行,延长周期。
b.如果在国内生产,需要完善国内厂房技术,延长周期、增加费用。
c.如果国外生产,分包进入国内时可以申请免除临床实验,但是不能确定可以申请成 功。
d.需要所有的临床资料,包括所有的实验数据。
二.申报1.1类新药临床试验(国产药)(1)方法:直接在国内申报1类新药,相关药理毒理研究资料由国外进行,提供相关证明,然后工艺研究、质量研究跟稳定性研究在国内进行,等国内药厂达到生产要求后,将药品在国内生产,按照国内药来报。
(2).费用:申请临床实验19.2万,申请生产43.2万。
(3)难点:a.需要等国内工厂具备相关生产条件后才可以进行申报。
b.无法申请避免临床。
三.申报国际多中心临床试验(1)基本流程+费用+时间:主要临床基地伦理委员会审(费用...,时间...)+临床审批(费用37.6万,时间205天)+药品清关(费用...+时间...)(时间相对较短)(2)方法:申报程序与国内1.1类化学新药临床试验申报大致相同,但是需要更多的临床资料和证明性文件。
(3)申请地点:国家药监局 北京市西城区宣武门西大街28号大成广场3门一层(总局办公大楼 西侧),邮编100053(4)流程图:注:斜线前为一般审批时限,斜线后为特殊审批时限,均为工作日。
(5)申报资料列表:(一)概要部分1. 药品名称通用名:替拉扎明汉语拼音:Ti La Zha Ming英文名:Tirapazamine (TPZ)化学名:3-amino-1,2,4-benzotriazine 1,4-di-N-oxide)化学结构式:分子式:C 7H 6N 4O 2分子量:178.14812. 证明性文件 已有资料已整理至“申报资料2_证明性文件_20161203”,其余需根据实际情况请申办人提供国家局药审中心接受审查意见、核查报告、申报资料 药检所检验样品,复核标准(60/30/90日) 药审中心技术审评(90/80) 申请人在4个月内1次性补充资料 药审中心对补充资料的审评(30/20日) 国家局审批(20日) 不批准或退审,发给《审批意见通知件》(10日) 批准进行药物临床试验,发给《药物临床试验批件》(205/195) 临床试验方案及参加单位报国家局、省局备案 实施药物临床试验•申请国际多中心临床试验的,应提供其临床试验用药物在符合药品生产质量管理规范的条件下制备的情况说明。
国家食品药品监督管理总局关于鼓励药品创新实行优先审评审批的意见

国家食品药品监督管理总局关于鼓励药品创新实行优先审评审批的意见文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2017.12.21•【文号】食药监药化管〔2017〕126号•【施行日期】2017.12.21•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文总局关于鼓励药品创新实行优先审评审批的意见食药监药化管〔2017〕126号各省、自治区、直辖市食品药品监督管理局、新疆生产建设兵团食品药品监督管理局:为加强药品注册管理,加快具有临床价值的新药和临床急需仿制药的研发上市,解决药品注册申请积压的矛盾,现提出以下意见。
一、优先审评审批的范围(一)具有明显临床价值,符合下列情形之一的药品注册申请:1.未在中国境内外上市销售的创新药注册申请。
2.转移到中国境内生产的创新药注册申请。
3.使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请。
4.专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。
5.申请人在美国、欧盟同步申请并获准开展药物临床试验的新药临床试验申请;在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请。
6.在重大疾病防治中具有清晰的临床定位的中药(含民族药)注册申请。
7.列入国家科技重大专项、国家重点研发计划,以及由国家临床医学研究中心开展临床试验并经中心管理部门认可的新药注册申请。
(二)防治下列疾病且具有明显临床优势的药品注册申请:1.艾滋病;2.肺结核;3.病毒性肝炎;4.罕见病;5.恶性肿瘤;6.儿童用药品;7.老年人特有和多发的疾病。
(三)其他1.在仿制药质量一致性评价中,需改变已批准工艺重新申报的补充申请;2.列入《关于开展药物临床试验数据自查核查工作的公告》(国家食品药品监督管理总局公告2015年第117号)的自查核查项目,申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请;3.临床急需、市场短缺的药品注册申请。
临床新药申请表全部

新药申请规程为加强对新药申请的管理,规范新药申请行为,保障军地患者用药安全、有效,根据《医院药材采购管理办法(试行)》第一条、第二十二条、第二十三条,第三十一条规定,制定《新药申请规程》如下:1、填写《新药申请查询单》(表1)。
药剂科新药初审小组根据对医院现有药品情况的检索,判断申请引进药品是“新药品种”、“相似品种”、“相同品种”或“恢复品种”。
2、药剂科新药初审小组填写《新药查询登记表》(表2),对提出申请引进的药品按顺序编号。
3、由各科室行政主任填写《医院使用新药申请表》(表3,简称为《新药申请表》),根据《新药申请查询单》查询结论和临床需要,填写申请理由。
4、由药品供货公司填写《申请新药引进形式审查表》(表4),由药剂科新药初审小组进行形式审查,审查通过后,申请资料上交医院药事管理委员会。
5、根据上报资料,简明、扼要填写各申请引进药品的《新药申请汇报表》(表5)。
6、药事委员会例会前,将《参评新药汇总明细表》(表6)和《参评新药投票汇总》(表7)送药事会负责人审核;申请引进药品的药品说明书提前送达各委员预览。
7、药事委员会例会,各委员在《参评新药投票汇总》(表7)投票。
8、根据投票结果,作出《药事委员会新药审评意见》(表8)。
9、根据《药事委员会新药审评意见》,药剂科向申请新药引进公司发出《新药品种报价表》(表9),申请公司填写后送交药库。
由医院组织,随机抽选专家评审,产生中选公司。
药品的引进工作由药剂科按规定具体实施。
10、新药引进3个月在院内未使用,药剂科根据规定退药;对保留药品,药事委员会向申请科室和其他科室发出《新药引进使用反馈调查表》(表10),对该药有效性、安全性、经济性进行综合评价。
表1 新药申请查询单送达地点:药库(表1)新药申请查询单填写说明1.新药申请查询单用于新药申请初筛,为医院、药事会、临床、医药公司、药厂、药库所进行的新药申请评审提供参考。
2.处方成份填写药品活性成份,根据药品说明书填写。
