盐酸当量浓度
浓度及浓度单位换算

浓度及浓度单位换算0.1N的HCl(read:Zero point one normal Hydrochloric Acid)中“N”是什么意思当量浓度(N,Normality)——现在基本不用了,淘汰单位,但是在50年代的书里面还是很多的。
现在一律用摩尔浓度(Molar concentration or Molarity. Unit:mol/L; molar, M)表示。
对酸而言1N=1 mol/l H+1、对于一元酸来说,1N=1 mol/L,如1N HCl=1mol/L HCl,2、对于n元酸来说,1N=1/n mol/L,如。
一当量就是得失一个电子的意思.如果是盐酸,放出一个氢离子,则当量浓度和摩尔浓度是一样的.如果是硫酸,则一当量浓度只等于二分之一的摩尔浓度.对于HCL,0.1N就是0.1MOL/L。
浓度及浓度单位换算(一)、溶液的浓度溶液浓度可分为质量浓度(如质量百分浓度)和体积浓度(如摩尔浓度、当量浓度)和体积浓度三类。
1、质量百分浓度溶液的浓度用溶质的质量占全部溶液质量的百分率表示的叫质量百分浓度,用符号%表示。
例如,25%的葡萄糖注射液就是指100可注射液中含葡萄糖25克。
质量百分浓度(%)=溶质质量/溶液质量100%2、体积浓度(1)、摩尔浓度溶液的浓度用1升溶液中所含溶质的摩尔数来表示的叫摩尔浓度,用符号mol表示,例如1升浓硫酸中含18.4摩尔的硫酸,则浓度为18.4mol。
摩尔浓度(mol)=溶质摩尔数/溶液体积(升)(2)、当量浓度(N)溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
当量浓度是水溶液浓度的一表示法,以N为符号,为化学领域所常用。
物质的克分子量或克原子量,除以其价数可得到克当量。
例如硫酸之克分子量是98克,根价为2价,故其克当量为49克。
铜的克原子量为63.54xx,价数为2价,故其xx当量为31.77克。
凡1公升水溶液中含有49克纯硫酸者,称为1N浓度的硫酸(就2价的硫酸而言,其摩尔浓度即为当量浓度的2倍,即1M=2N,故1N硫酸也就等于0.5M的硫酸)。
1N盐酸的配制

1N盐酸的配制(2009-10-25 21:36:18)转载标签:1N盐酸:量取10mL盐酸加水稀释至120mL。
??1、当量浓度(N):表示1L的溶液中含有溶质的克当量数2、摩尔浓度(mol/L,M):表示1L溶液中含有溶质的摩尔数3、容量百分比浓度(%,V/V):指100ml溶液中含有的溶质的毫升数(溶质为液体)4、质量的容量百分比浓度(%,m/V):指100ml溶液中含有溶质的克数(溶质为固体)5、溶液的比例浓度:指液体溶质与溶剂的体积之比。
例1:4硫酸,是指1个体积硫酸与4个体积水混合而成的溶液。
??浓盐酸是12N对于盐酸,1N=1mol/l;对于硫酸,2N=1mol/l;对于磷酸,3N=1mol/l;与价态有关的!!!?37%的盐酸指的是质量百分浓度,37克盐酸与63克水的混合。
一般浓盐酸的浓度为35%——37%,密度为,知道了密度就可以算出物质的量浓度为12MOL/L。
?比如说1mol/L的H2SO4,如果换成当量浓度就应该是2N H2SO4,大概的意思就是1mol的H2SO4会有2mol的氢离子,类似的1mol/L的HCL就是1N,1mol/L 的NAOH就是1N,1mol/L的CA(OH)2就是2N,这是酸碱的。
如果是氧化物或是还原物就看能得失的电子数,比如说1mol/L的K2Cr2O7的当量浓度就应该是6N,1mol/L的KMnO4的当量浓度是5N。
如果是盐类,就看能与酸或碱结合所要的H+或OH-数量,比如说NA2CO3的就是2,NAHCO3是1克当量,如氧的克当量是8,氢的是1?浓度及浓度单位换算??(一)、溶液的浓度??溶液浓度可分为质量浓度(如质量百分浓度)和体积浓度(如摩尔浓度、当量浓度)和体积浓度三类。
??1、质量百分浓度??溶液的浓度用溶质的质量占全部溶液质量的百分率表示的叫质量百分浓度,用符号%表示。
例如,25%的葡萄糖注射液就是指100可注射液中含葡萄糖25克。
当量浓度与摩尔浓度的换算完整版

当量浓度与摩尔浓度的换算Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】请问各位高手,当量浓度具体是一个怎样的定义,它的符号是否为N;1N转化为mol/l(分别以盐酸和硫酸为例如何转换);还有就是以溶液中的钠、钾离子为例,1毫克当量/升转化为毫克/升如何转换先道声谢谢!答:现在国家标准规定不使用当量浓度,过去的定义:酸(硷)当量数=酸(硷)摩尔数×一分子酸(硷)可完全解离的氢离子(氢氧根)数当量浓度(N) ——这个东西现在基本不用了,淘汰单位,但是在50年代那会的书里面还是很多的。
溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
例如,1升浓盐酸中含克当量的盐酸(HCl),则浓度为。
当量浓度=溶质的克当量数/溶液体积(升1N绝对不是1mol,特殊情况才是以符号N表示,定义为每升溶液中所含溶质的克当量数,或每毫升溶液中所含溶质的毫克当量数。
由当量浓度的定义可知,NV(L)=克当量数;NV(mL)=毫克当量数,即任何溶液中所含溶质的克当量数等于该溶液的当量浓度乘以溶液的体积(L)。
将N2V1=N2V2称为当量定律。
但是以上概念现已不能使用,而用物质的量n和含有物质的量的导出量;摩尔质量M,物质的量浓度c等法定的量和单位代替。
不知道你到底想换算什么。
但我所以知道的就是,比如说1mol/L的H2SO4,如果换成当量浓度就应该是2N H2SO4,大概的意思就是1mol的H2SO4会有2mol的氢离子,类似的1mol/L的HCL就是1N,1mol/L的NAOH就是1N,1mol/L的CA(OH)2就是2N,这是酸碱的。
如果是氧化物或是还原物就看能得失的电子数,比如说1mol/L的K2Cr2O7的当量浓度就应该是6N,1mol/L的KMnO4的当量浓度是5N。
如果是盐类,就看能与酸或碱结合所要的H+或OH-数量,比如说NA2CO3的就是2,NAHCO3是1克当量,如氧的克当量是8,氢的是1当量浓度(N)溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
浓度及浓度单位换算

浓度及浓度单位换算0.1N的HCl(read: Zero point one normal Hydrochloric Acid)中“N”是什么意思当量浓度(N,Normality) ——现在基本不用了,淘汰单位,但是在50年代的书里面还是很多的。
现在一律用摩尔浓度(Molar concentration or Molarity. Unit: mol/L; molar, M)表示。
对酸而言1N=1 mol/l H+1、对于一元酸来说,1N=1 mol/L,如1N HCl=1mol/L HCl,2、对于n元酸来说,1N=1/n mol/L,如1N H2SO4=1/2 mol/L H2SO41N H3PO4=1/3 mol/L H3PO4。
一当量就是得失一个电子的意思.如果是盐酸,放出一个氢离子,则当量浓度和摩尔浓度是一样的.如果是硫酸,则一当量浓度只等于二分之一的摩尔浓度.对于HCL,0.1N就是0.1MOL/L。
浓度及浓度单位换算(一)、溶液的浓度溶液浓度可分为质量浓度(如质量百分浓度)和体积浓度(如摩尔浓度、当量浓度)和体积浓度三类。
1、质量百分浓度溶液的浓度用溶质的质量占全部溶液质量的百分率表示的叫质量百分浓度,用符号%表示。
例如,25%的葡萄糖注射液就是指100可注射液中含葡萄糖25克。
质量百分浓度(%)=溶质质量/溶液质量100%2、体积浓度(1)、摩尔浓度溶液的浓度用1升溶液中所含溶质的摩尔数来表示的叫摩尔浓度,用符号mol表示,例如1升浓硫酸中含18.4摩尔的硫酸,则浓度为18.4mol。
摩尔浓度(mol)=溶质摩尔数/溶液体积(升)(2)、当量浓度(N)溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
当量浓度是水溶液浓度的一表示法,以N为符号,为化学领域所常用。
物质的克分子量或克原子量,除以其价数可得到克当量。
例如硫酸之克分子量是98克,根价为2价,故其克当量为49克。
摩尔浓度和百分比浓度换算

摩尔浓度和百分比浓度换算
摩尔浓度和百分比浓度换算,如下:
当量浓度(N) 溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
例如,1升浓盐酸中含12.0克当量的盐酸(HCl),则浓度为12.0N。
当量浓度=溶质的克当量数/溶液体积(升)mol/L叫摩尔浓度,即溶液的浓度用1升溶液中所含溶质的摩尔数来表示. 例如1升浓硫酸中含18.4摩尔的硫酸,则浓度为18.4mol。
摩尔浓度(mol)=溶质摩尔数/溶液体积(升)浓度单位的换算公式:1)当量浓度=1000.d.质量百分浓度/E 2)质量百分浓度=当量浓度E/1000.d 3)摩尔浓度=1000.d质量百分浓度/M 4)质量百分浓度=质量-体积浓度(毫克/升)/104。
当量浓度与摩尔浓度的换算

请问各位高手,当量浓度具体是一个怎样的定义,它的符号是否为N;1N转化为mol/l(分别以盐酸和硫酸为例如何转换);还有就是以溶液中的钠、钾离子为例,1毫克当量/升转化为毫克/升如何转换先道声谢谢!答:现在国家标准规定不使用当量浓度,过去的定义:酸(鹼)當量數=酸(鹼)摩尔數×一分子酸(鹼)可完全解離的氫離子(氫氧根)數当量浓度(N) ——这个东西现在基本不用了,淘汰单位,但是在50年代那会的书里面还是很多的。
溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
例如,1升浓盐酸中含克当量的盐酸(HCl),则浓度为。
当量浓度=溶质的克当量数/溶液体积(升1N绝对不是1mol,特殊情况才是以符号N表示,定义为每升溶液中所含溶质的克当量数,或每毫升溶液中所含溶质的毫克当量数。
由当量浓度的定义可知,NV(L)=克当量数;NV(mL)=毫克当量数,即任何溶液中所含溶质的克当量数等于该溶液的当量浓度乘以溶液的体积(L)。
将N2V1=N2V2称为当量定律。
但是以上概念现已不能使用,而用物质的量n和含有物质的量的导出量;摩尔质量M,物质的量浓度c等法定的量和单位代替。
不知道你到底想换算什么。
但我所以知道的就是,比如说1mol/L的H2SO4,如果换成当量浓度就应该是2N H2SO4,大概的意思就是1mol的H2SO4会有2mol的氢离子,类似的1mol/L的HCL就是1N,1mol/L的NAOH就是1N,1mol/L 的CA(OH)2就是2N,这是酸碱的。
如果是氧化物或是还原物就看能得失的电子数,比如说1mol/L的K2Cr2O7的当量浓度就应该是6N,1mol/L的KMnO4的当量浓度是5N。
如果是盐类,就看能与酸或碱结合所要的H+或OH-数量,比如说NA2CO3的就是2,NAHCO3是1克当量,如氧的克当量是8,氢的是1当量浓度(N)溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
当量浓度的计算

当量浓度(N) 溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N 表示。
一当量就是得失一个电子的意思.如果是盐酸,放出一个氢离子,则当量浓度和摩尔浓度是一样的.如果是硫酸,则一当量浓度等于二分之一的摩尔浓度。
.在一般的氧化还原反应中,就要复杂一些了,例如高锰酸钾氧化草酸钠,2摩尔高锰酸钾和5摩尔草酸钠刚好反应,则高锰酸钾的当量浓度=5倍的摩尔浓度.当量浓度的定义是1L水溶液中溶解的溶质用氢的当量除摩尔质量,常用于表示酸溶液的质量(1)对于元素,当量=原子量/化合价:钠的当量=23/1=23;铁的当量=55.9/3=18.6;氧的当量是8;氢的是1。
(2)酸的当量=酸的分子量/酸分子中被金属置换的氢原子数。
即1N=1 mol/L H+ :对于一元酸来说,1N=1 mol/L,如1N HCl=1mol/L HCl;对于n元酸来说,1N=1/n mol/L,如1N H2SO4=1/2 mol/L H2SO4;1N H3PO4=1/3 mol/L H3PO4。
(3)碱的当量=碱的分子量/碱分子中所含氢氧根数。
即1N=1 mol/L OH- :1mol/L的NaOH 就是1N,1mol/L的Ca(OH)2就是1/2N(4)盐的当量=盐的分子量/盐分子中金属原子数×金属价数:如果是氧化物或是还原物就看能得失的电子数,比如说1mol/L的K2Cr2O7的当量浓度就应该是1/6N(每个重铬酸钾分子中有两个铬离子,每个铬离子的价态由6+到3+得到3个电子),1mol/L的KMnO4的当量浓度是1/5N。
如果是盐类,就看能与酸或碱结合所要的H+或OH-数量,比如说Na2CO3的就是1/2,NaHCO3是1。
根据上面的描述,0.4 N 硫酸亚铁铵(Fe(NH4)2(SO4)26H2O)的摩尔浓度是0.1mol/L,0.6N 硫氰酸铵(NH4SCN)浓度是0.6mol/L。
1N盐酸

1N盐酸:量取10mL盐酸加水稀释至120mL。
1、当量浓度(N):表示1L的溶液中含有溶质的克当量数
2、摩尔浓度(mol/L,M):表示1L溶液中含有溶质的摩尔数
3、容量百分比浓度(%,V/V):指100ml溶液中含有的溶质的毫升数(溶质为液体)
4、质量的容量百分比浓度(%,m/V):指100ml溶液中含有溶质的克数(溶质为固体)
5、溶液的比例浓度:指液体溶质与溶剂的体积之比。
例1:4硫酸,是指1个体积硫酸与4个体积水混合而成的溶液。
浓盐酸是12N
对于盐酸,1N=1mol/l;对于硫酸,2N=1mol/l;对于磷酸,3N=1mol/l;与价态有关的!!!37%的盐酸指的是质量百分浓度,37克盐酸与63克水的混合。
一般浓盐酸的浓度为35%——37%,密度为1.19,知道了密度就可以算出物质的量浓度为12MOL/L。
比如说1mol/L的H2SO4,如果换成当量浓度就应该是2N H2SO4,大概的意思就是1mol的H2SO4会有2mol的氢离子,类似的1mol/L的HCL就是1N,1mol/L的NAOH就是1N,1mol/L的CA(OH)2就是2N,这是酸碱的。
如果是氧化物或是还原物就看能得失的电子数,比如说1mol/L的K2Cr2O7的当量浓度就应该是6N,1mol/L的KMnO4的当量浓度是5N。
如果是盐类,就看能与酸或碱结合所要的H+或OH-数量,比如说NA2CO3的就是2,NAHCO3是1克当量,如氧的克当量是8,氢的是1。
当量浓度与摩尔浓度的换算2

当前,国家法定的液体浓度计量单位为摩尔/升(mol/L)。废除了原有的当量浓度计量单位,但现有许多化验教材都仍然是以当量浓度为单位,给化验工作带来很大不便,要使化验顺利。就需要将当量浓度换算为摩尔浓度。
当量浓度是用1L溶液中含有溶质的克当量数来表示的浓度,通常用N表示。当量浓度(N) =溶质的克当量数/溶液的体积(L)
当量浓度=溶质的克当量数/溶液体积(升)
克当量数=质量/克当量
克当量(gram-equivalent weight)实际上是指物质的基本摩尔单元的摩尔质量。
当量=原子量/化合价,若原子量采用克原子量时,则当量就成为克当量。克原子量就是现在常说的原子量。
N(当量浓度)=M(摩尔浓度)×m(摩尔质量)×V/克当量/V
假如1L溶液中含有6克当量的溶质,这种溶液的浓度就是6当量浓度,即为6N。含有0.1克当量溶质,就是0.1当最浓度,即为0.1N。
摩尔浓度是用1L溶液中含有多少摩尔溶质来表示的浓度,通常用M表示。摩尔浓度(M ) =溶质的量(mol) /溶液的体积(L)
如果1L溶液中含有1mol溶质,这个溶液就是1个摩尔浓度(lmol/L ) ,含有0.5摩尔的溶质就是0.5个摩尔浓度(0.5mol/L),摩尔是国际单位制的基本单位。它的符号为“ mol ”。摩尔质量以克为单位,其数值等于它的分子量。
反之,数值上摩浓度是当量浓度的l/2或l/2以下(如0.2N H2SO4,为0.1M;0.1 N FeCl3,则为0.3M )。
又例:0.04 00N H2SO4溶液的摩尔浓度为多少?
解:根据M=N/n= 0.0400/2 = 0.0200
则:0.0400N H2SO4摩尔浓度为0.0200。
克当量=m(摩尔质量) ×n
盐酸标准溶液当量浓度

盐酸标准溶液当量浓度
1N盐酸标准溶液:取83mL(相对密度1.19)浓盐酸以蒸馏水稀释至1000mL.按下述方法标定其当量浓度后备用.
称取约1.5-2g(准确至0.0002g)已在180℃烘干2h的碳酸钠,置于250mL三角瓶中,加100mL水使其完全溶解,然后加入2-3滴0.1%甲基橙指示剂,用待标定的盐酸标准溶液滴定,至碳酸钠溶液由黄色变为橙红色;将溶液加热至沸,并保持微沸3min,然后放在冷水中冷却至室温,如此时橙红色变为黄色,则再用盐酸标准溶液滴定,至溶液出现稳定橙红色时为止.
盐酸标准溶液当量浓度按下式计算:
Q
N= 0.053
V
式中:N-盐酸标准溶液当量浓度;
Q-称取碳酸钠的质量,g;
V-滴定是消耗盐酸标准溶液的体积,mL.。
1N盐酸的配制

1N盐酸的配制(2009-10-25 21:36:18)标签:1N盐酸:量取10mL盐酸加水稀释至120mL。
1、当量浓度(N):表示1L的溶液中含有溶质的克当量数2、摩尔浓度(mol/L,M):表示1L溶液中含有溶质的摩尔数3、容量百分比浓度(%,V/V):指100ml溶液中含有的溶质的毫升数(溶质为液体)4、质量的容量百分比浓度(%,m/V):指100ml溶液中含有溶质的克数(溶质为固体)5、溶液的比例浓度:指液体溶质与溶剂的体积之比。
例1:4硫酸,是指1个体积硫酸与4个体积水混合而成的溶液。
浓盐酸是12N对于盐酸,1N=1mol/l;对于硫酸,2N=1mol/l;对于磷酸,3N=1mol/l;与价态有关的!!!37%的盐酸指的是质量百分浓度,37克盐酸与63克水的混合。
一般浓盐酸的浓度为35%——37%,密度为,知道了密度就可以算出物质的量浓度为12MOL/L。
比如说1mol/L的H2SO4,如果换成当量浓度就应该是2N H2SO4,大概的意思就是1mol的H2SO4会有2mol的氢离子,类似的1mol/L的HCL就是1N,1mol/L 的NAOH就是1N,1mol/L的CA(OH)2就是2N,这是酸碱的。
如果是氧化物或是还原物就看能得失的电子数,比如说1mol/L的K2Cr2O7的当量浓度就应该是6N,1mol/L的KMnO4的当量浓度是5N。
如果是盐类,就看能与酸或碱结合所要的H+或OH-数量,比如说NA2CO3的就是2,NAHCO3是1克当量,如氧的克当量是8,氢的是1浓度及浓度单位换算(一)、溶液的浓度溶液浓度可分为质量浓度(如质量百分浓度)和体积浓度(如摩尔浓度、当量浓度)和体积浓度三类。
1、质量百分浓度溶液的浓度用溶质的质量占全部溶液质量的百分率表示的叫质量百分浓度,用符号%表示。
例如,25%的葡萄糖注射液就是指100可注射液中含葡萄糖25克。
质量百分浓度(%)=溶质质量/溶液质量100% 2、体积浓度(1)、摩尔浓度溶液的浓度用1升溶液中所含溶质的摩尔数来表示的叫摩尔浓度,用符号mol表示,例如1升浓硫酸中含摩尔的硫酸,则浓度为。
常用物质物性数据表
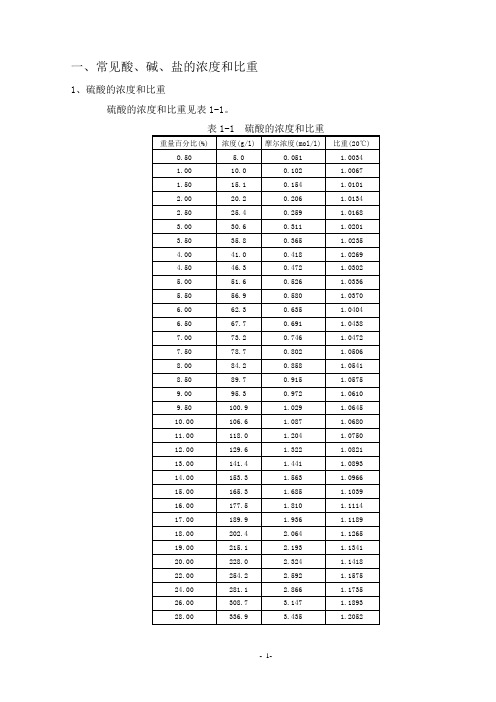
一、常见酸、碱、盐的浓度和比重1、硫酸的浓度和比重硫酸的浓度和比重见表1-1。
硝酸的浓度和比重见表1-2。
波美度定义:°Beˊ=145-145/比重(比水重时)°Beˊ=140/比重 -130(比水轻时) API=145.1/比重-1314.5盐酸的浓度和比重见表1-3。
氢氧化钠溶液的浓度与密度的关系见表1-4。
氢氧化钠溶液的当量浓度与比重见表1-5。
6、盐酸的当量浓度与比重盐酸的当量浓度与比重见表1-6。
7、氯化钠溶液的当量浓度与比重氯化钠的当量浓度与比重见表1-7。
二、常见酸、碱、盐水溶液的浓度和凝点1、硫酸水溶液凝点见表2-12、盐酸水溶液凝点见表2-23、硝酸水溶液凝点见表2-34、磷酸水溶液凝点见表2-45、甲酸水溶液凝点见表2-56、醋酸水溶液凝点见表2-67、氨水溶液凝点见表2-78、氢氧化铵溶液凝点见表2-89、硫酸盐水溶液凝点见表2-910、氯化钠水溶液凝点见表2-1011、氯化钾水溶液凝点见表2-1112、氯化钙水溶液凝点见表2-1213、氯化镁水溶液凝点见表2-1314、碳酸钠水溶液凝点见表2-1415、碳酸氢钠水溶液凝点见表2-1516、甘油水溶液凝点见表2-1617、甲醇水溶液凝点见表2-1718、乙醇水溶液凝点见表2-1819、乙二醇水溶液凝点见表2-1920、二乙二醇醚水溶液凝点见表2-2021、丙二醇水溶液凝点见表2-2122、环丁砜水溶液凝点见表2-22三、氢氟酸物性数据表氢氟酸的特性和性质这里所列出的是氢氟酸的重要的物理常数。
一些常数的详细说明和更多的工程数据以曲线、图示出。
此资料由斯多福化学公司制订。
外观:一种易流动的、无色的液体,在空气中冒烟。
熔点:-83.1℃。
沸点:760mmHg(水银柱)下19.54℃。
溶解热:在-83.1℃下1094卡/摩尔或54.7卡/克。
汽化热:在19.4℃和741mmHg下89.45±0.02卡/克。
当量浓度与摩尔浓度的换算

请问各位高手,当量浓度具体是一个怎样的定义,它的符号是否为N;1N转化为mol/l(分别以盐酸和硫酸为例如何转换);还有就是以溶液中的钠、钾离子为例,1毫克当量/升转化为毫克/升如何转换先道声谢谢!答:现在国家标准规定不使用当量浓度,过去的定义: 酸(硷)当量数=酸(硷)摩尔数×一分子酸(硷)可完全解离的氢离子(氢氧根)数当量浓度(N) ——这个东西现在基本不用了,淘汰单位,但是在50年代那会的书里面还是很多的。
溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
例如,1升浓盐酸中含克当量的盐酸(H C l),则浓度为。
当量浓度=溶质的克当量数/溶液体积(升1N绝对不是1mol,特殊情况才是以符号N表示,定义为每升溶液中所含溶质的克当量数,或每毫升溶液中所含溶质的毫克当量数。
由当量浓度的定义可知,NV(L)=克当量数;NV(mL)=毫克当量数,即任何溶液中所含溶质的克当量数等于该溶液的当量浓度乘以溶液的体积(L)。
将N2V1=N2V2称为当量定律。
但是以上概念现已不能使用,而用物质的量n和含有物质的量的导出量;摩尔质量M,物质的量浓度c等法定的量和单位代替。
不知道你到底想换算什么。
但我所以知道的就是,比如说1mol/L的H2SO4,如果换成当量浓度就应该是2NH2SO4,大概的意思就是1mol的H2SO4会有2mol的氢离子,类似的1mol/L的HCL 就是1N,1mol/L的NAOH就是1N,1mol/L的CA(OH)2就是2N,这是酸碱的。
如果是氧化物或是还原物就看能得失的电子数,比如说1mol/L的K2Cr2O7的当量浓度就应该是6N,1mol/L的KMnO4的当量浓度是5N。
如果是盐类,就看能与酸或碱结合所要的H+或OH-数量,比如说NA2CO3的就是2,NAHCO3是1克当量,如氧的克当量是8,氢的是1当量浓度(N)溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
标准盐酸的配制及标定

标准盐酸的配制及标定一、配制:0.02mol/LHCl溶液:量取1.8毫升盐酸,缓慢注入1000ml水。
0.1mol/LHCl溶液:量取9毫升盐酸,缓慢注入1000ml水。
0.2mol/LHCl溶液:量取18毫升盐酸,缓慢注入1000ml水。
0.5mol/LHCl溶液:量取45毫升盐酸,缓慢注入1000ml水。
1.0mol/LHCl溶液:量取90毫升盐酸,缓慢注入1000ml水。
二、标定:1、反应原理: Na2CO3-+2HCl→2NaCl+CO2++H2O为缩小批示剂的变色范围,用溴甲酚绿-甲基红混合指示剂,使颜色变化更加明显,该混合指示剂的碱色为暗绿,它的变色点PH值为5.1,其酸色为暗红色很好判断。
2、仪器:滴定管50ml;三角烧瓶250ml;135ml;瓷坩埚;称量瓶。
3、标定过程:基准物处理:取预先在玛瑙研钵中研细之无水碳酸钠适量,置入洁净的瓷坩埚中,在沙浴上加热,注意使运动坩埚中的无水碳酸钠面低于沙浴面,坩埚用瓷盖半掩之,沙浴中插一支360℃温度计,温度计的水银球与坩埚底平,开始加热,保持270-300℃1小时,加热期间缓缓加以搅拌,防止无水碳酸钠结块,加热完毕后,稍冷,将碳酸钠移入干燥好的称量瓶中,于干燥器中冷却后称量。
称取上述处理后的无水碳酸钠(标定0.02mol/L称取0.02-0.03克;0.1mol/L称取0.1-0.12克;0.2mol/L 称取0.2-0.4;0.5mol/L 称取0.5-0.6克;1mol/L称取1.0-1.2克称准至0.0002克)置于250ml锥形瓶中,加入新煮沸冷却后的蒸馏水(0.02mol/L加20ml;0.1mol/L加20ml;0.2mol/L加50;0.5mol/L加50ml;1mol/L加100ml水)定溶,加10滴溴甲酚绿-甲基红混合指示剂,用待标定溶液滴定至溶液成暗红色,煮沸2分钟,冷却后继续滴定至溶液呈暗红色。
同时做空白4、计算:C(HCl)——盐酸标准溶液量浓度 mol/Lm——无水碳酸钠的质量(克)V1——滴定消耗HCl ml数V2——滴定消耗HCl ml数0.05299--与1.000盐酸标准溶液相当的以克表示的无水碳酸钠的质量。
标准溶液浓度的表示方法有

标准溶液浓度的表示方法有标准溶液是化学实验中常用的一种溶液类型,其浓度的表示方法有多种,下面将详细介绍几种常见的表示方法。
1. 质量分数。
质量分数是指溶质的质量与溶液总质量之比,通常用百分数表示。
在化学实验中,常用质量分数表示标准溶液的浓度,例如10%的盐酸溶液表示其中盐酸的质量占溶液总质量的10%。
2. 摩尔浓度。
摩尔浓度是指溶质的摩尔数与溶液体积的比值,单位为mol/L。
在化学计量中,摩尔浓度是表示溶液中溶质浓度的重要参数,常用M表示,例如1M的硫酸溶液表示其中硫酸的摩尔浓度为1mol/L。
3. 当量浓度。
当量浓度是指溶质的当量数与溶液体积的比值,单位为当量/L。
在酸碱中和反应中,常用当量浓度表示酸碱溶液的浓度,例如0.1mol/L的盐酸溶液表示其中盐酸的当量浓度为0.1mol/L。
4. 百分浓度。
百分浓度是指溶质的质量与溶液体积的百分比,通常用百分数表示。
在某些特定的化学实验中,会用百分浓度表示标准溶液的浓度,例如20%的双氧水溶液表示其中双氧水的质量占溶液总质量的20%。
5. 比例浓度。
比例浓度是指溶质的数量与溶液总量的比值,通常用比值表示。
在一些特殊的化学实验中,会用比例浓度表示标准溶液的浓度,例如1:100的稀释比例表示将浓溶液与溶剂按照1:100的比例稀释后得到的标准溶液。
总结。
标准溶液的浓度可以用多种方法表示,包括质量分数、摩尔浓度、当量浓度、百分浓度和比例浓度等。
在实际化学实验中,根据不同的实验要求和计量方法,选择合适的浓度表示方法非常重要。
希望本文介绍的几种表示方法能够对大家有所帮助,更好地理解和应用标准溶液的浓度表示方法。
hcl的当量浓度

hcl的当量浓度
HCl的当量浓度是表示溶液中HCl含量的重要参数。
当量浓度是指每升溶液中所含溶质的克当量数,用符号N表示。
对于HCl来说,当量浓度可以用以下公式计算:
当量浓度(N)= 溶质的克当量数/ 溶液体积(升)
对于HCl来说,其克当量数等于HCl的分子量(36.45g/mol)除以1,即36.45g/mol。
因此,当量浓度(N)可以通过以下公式计算:
当量浓度(N)= 36.45g/mol / 1升= 36.45N
需要注意的是,当量浓度是一种体积浓度,表示每升溶液中所含溶质的克当量数。
与其他单位如摩尔浓度、质量浓度等不同,当量浓度是表示溶液中溶质含量的另一种方式。
当量浓度与摩尔浓度的换算

For personal use only in study and research; not for commercial use请问各位高手,当量浓度具体是一个怎样的定义,它的符号是否为N;1N转化为mol/l(分别以盐酸和硫酸为例如何转换);还有就是以溶液中的钠、钾离子为例,1毫克当量/升转化为毫克/升如何转换?先道声谢谢!答:现在国家标准规定不使用当量浓度,过去的定义:酸(鹼)當量數=酸(鹼)摩尔數×一分子酸(鹼)可完全解離的氫離子(氫氧根)數当量浓度(N) ——这个东西现在基本不用了,淘汰单位,但是在50年代那会的书里面还是很多的。
溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
例如,1升浓盐酸中含12.0克当量的盐酸(HCl),则浓度为12.0N。
当量浓度=溶质的克当量数/溶液体积(升1N绝对不是1mol,特殊情况才是以符号N表示,定义为每升溶液中所含溶质的克当量数,或每毫升溶液中所含溶质的毫克当量数。
由当量浓度的定义可知,NV(L)=克当量数;NV(mL)=毫克当量数,即任何溶液中所含溶质的克当量数等于该溶液的当量浓度乘以溶液的体积(L)。
将N2V1=N2V2称为当量定律。
但是以上概念现已不能使用,而用物质的量n和含有物质的量的导出量;摩尔质量M,物质的量浓度c等法定的量和单位代替。
不知道你到底想换算什么。
但我所以知道的就是,比如说1mol/L的H2SO4,如果换成当量浓度就应该是2N H2SO4,大概的意思就是1mol的H2SO4会有2mol的氢离子,类似的1mol/L的HCL就是1N,1mol/L的NAOH就是1N,1mol/L 的CA(OH)2就是2N,这是酸碱的。
如果是氧化物或是还原物就看能得失的电子数,比如说1mol/L的K2Cr2O7的当量浓度就应该是6N,1mol/L的KMnO4的当量浓度是5N。
如果是盐类,就看能与酸或碱结合所要的H+或OH-数量,比如说NA2CO3的就是2,NAHCO3是1克当量,如氧的克当量是8,氢的是1当量浓度(N)溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示。
