微分脉冲极谱法测定果汁中维生素C的含量
橙汁饮料中Vc含量的测定
1 . 3 实验 用 品
仪器 : U V 3 0 1 0紫 外 分 光 光 度 计 (日本 日立 公 司 ) 、 F A 1 0 0 4电子天平 ( 上海 越平 科学 仪器 公 司 ) 、 S Y C一1 5 B超 级恒温水浴 ( 南京桑立电设备厂 ) 、 l O O m l 容 量瓶 2个 、 l O m l 量筒 2个 、 5 0 0 m l 容量瓶 1 个5 0 m l 容量瓶 5个 、 移 液管 5 0 ml
溶解 氧对 还原 型 V c的 氧化 J 。对 紫 外分 光光 度法 测 定橙 汁中 V c含量的方 法进行 研 究 和探 索 , 旨在 为 V c的科学 测
定 提 供 参 考
1 实 验部 分
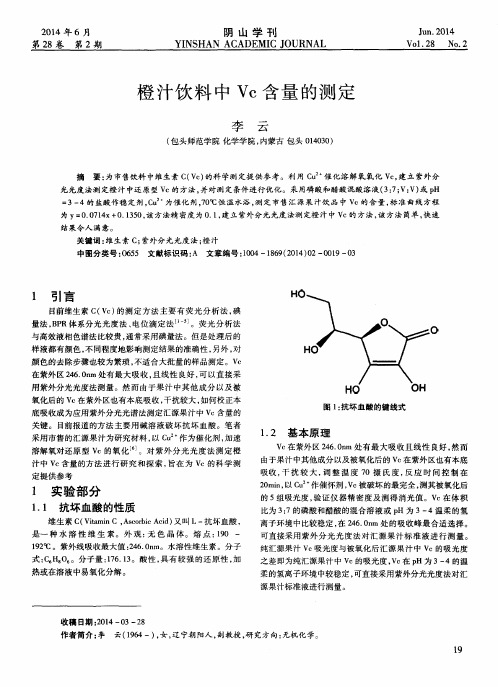
1 . 1 抗坏血酸的性质
维 生素 C ( V i t a m i n C, A s c o r b i c A c i d ) 又叫 L一 抗坏 血酸 , 是一 种 水 溶 性 维 生 素。外 观 : 无 色 晶 体 。熔 点 : 1 9 0 — 1 9 2 ℃ 。紫外线吸收最大值 : 2 4 6 . 0 n m。水溶性维生素 。分子 式: C H。 0 。分子量 : 1 7 6 . 1 3 。酸性 , 具有 较强 的还 原性 , 加
的 5组 吸光度 , 验证 仪器 精密 度及测 得 消光值 。V c在体 积
比为 3 : 7的磷酸 和醋酸 的混 合溶液 或 p H为 3— 4温柔 的氢
离子环境 中比较稳定 , 在2 4 6 . 0 n m处 的吸 收峰最合适 选择 。
可直接采用紫外 分光 光 度法 对汇 源果 汁标 准液 进行 测量 。 纯 汇源果 汁 V c 吸光度与被氧化后 汇源果 汁 中 V c的吸光 度 之 差即为纯汇源果汁 中 V c的吸光度 , V c在 p H为 3— 4的温
果汁中维生素C含量测定法

果汁中維生素C 測定
• 樣品試液製備
– – – – 果汁混勻 濾紙過濾 取適量果汁濾液加等量HPO3-HOAc溶液 (假設取15 mL 果汁,則加入15mL HPO3-HOAc溶液) 混勻備用
(空白組取 10 mL 的蒸餾水) 在三角瓶內加入10 mL樣品試液 加 5 mL HPO3-HOAc 溶液 以 2,6-二氯靛酚滴至玫瑰紅色 搖晃30秒不腿色為止 紀錄 2,6-二氯靛酚用量(樣品組為A mL) (空白組為B mL)
4
生理功能2
(二)提高免疫力 人體內的白血球是維生素C 需求量最高的細胞,若供應量 不足則白血球無法發揮正常的免疫功能。 (三)維持正常生長 維生素C 不足而使某些代謝循環中斷,最先反應出的是生 理異常,若發生在生長階段會造成成長受阻,尤其在年齡 愈小的個體,維生素C 需求量愈大(代謝率較快)。
5
6
生理功能4
(七)活化葉酸,Folice→Folinic acid。 (RDA): 每日建議攝取量
18-30歲男性及女性: 100 mg/per day
(八)阻斷亞硝胺在體內合成
(九)與鈣磷的吸收利用有關 每日上限攝取量(UL): • 維持牙齒、骨骼、血壓的正常功能 • 以鰻魚為例:長期維生素 C 的不足會導致血中含鈣量不足 2000 mg/per day 時,鈣自骨骼移出以維持平衡,造成脊椎彎曲。
14
•
樣品測定 (需做樣品組與空白組)
維生素C 含量計算
• 公式
Vit C (mg/mL) = (A-B) mL x D x T / 樣品液(mL)
• • • • A = 樣品組(果汁) 2,6-二氯靛酚滴定量 B = 空白組(蒸餾水) 2,6-二氯靛酚滴定量 D = 樣品溶液稀釋倍數(2) T = 1 mL 之 2,6-二氯靛酚等於多少 mg 的維生素C
果汁中Vc含量的测定

研究性学习成果关于果汁中VC的含量浙江澄潭中学高一(x)班指导教师: xxx组长: xxx小组成员: xxx xxx xxx xxxxxx xxx xxx xxx课题研究的时间:2008年12月到2009年4月关于果汁中Vc含量的研究新昌澄潭中学xxx xxx xxx xxx xxx xxx xxx xxx xxx摘要:随着人们生活水平的提高。
人们对营养摄取的要求也越来越高。
水果中富含Vc。
但也有一些同学影响着水果中Vc的含量。
比如,一些水果为了防虫害日晒。
在生长过程中常用纸袋包裹起来,结果造成维生素C含量减少;夏季水果丰收,储藏于冷库,冬天出售时,水果的维生素C含量也会减少;现代家庭一般都有冰箱,许多人喜欢买大量水果放入。
但水果存放的时间越长,维生素C损失就越多。
关键词:Vc含量果汁一:研究背景随着人们的生活水平提高,有些同学养成了天天吃水果的习惯,但同学们对于哪些水果营养丰富,Vc含量较多还不是很清楚。
因此我们想测出各种水果及果汁饮料中Vc含量,知道较好的水果品种和果汁饮料品牌。
二:研究过程从2008年12月起,到2009年4为止,历时5个月,我们利用研究性学习时间和其他课余时间对果汁中Vc含量进行了初步研究。
除采用文献研究法和访谈法以外,我们还进行了实验法。
实验1:实验目的:测量果汁中Vc的含量。
实验器材:碘滴定液(0.05mol/L),淀粉指试液。
实验原理:将样品加冷水与稀醋酸使溶解,加淀粉指示液,立即用碘滴定液(0.05mol/L)滴定,至溶液显蓝色并在30秒内不褪色,读出碘滴定液使用量,计算Vc的含量。
实验步骤:取样品20g精密称量,加冷水100ml与稀醋酸10ml使其溶解,加淀粉指试液1ml,立即用碘滴定液(0.05mol/L)滴定,至溶液显蓝色并在30秒内不褪色,并将滴定结果用空白试验校正,记录消耗的碘滴定液的体积数(ml),每1ml碘滴定液(0.05mol/L)相当于8.806mg的C6H8O6。
果汁中维生素C的测定

1.标准样品待测液制备:
精密称取0.050g维生素C标准品,用偏磷酸-乙酸溶液A溶解并定容至50mL,再准确吸取10.0mL该溶液用偏磷酸-乙酸溶液A稀释并定容至100mL,配制成100μg/mL的标准溶液。
准确吸取经过处理的VC标准溶液(10μg/mL)0.5mL、1.0mL、1.5mL、2.0mL分别置于10mL 试管中,补水至2.0mL,配制成VC标准样品工作液。
再分别加入5mL邻苯二胺(OPDA)溶液,摇匀避光静置60min,即配制成VC标准样品待测液。
2.具体步骤如图
3.数据处理
式中:
X——试样中维生素C的含量,单位为毫克每百克(mg/100g);
V——试样的定容体积,单位为毫升(mL);
c——由标准曲线查得的试样测定液中维生素C的质量浓度,单位为微克每毫升(μg/mL);
m——试样的质量,单位为克(g);
f——试样稀释倍数。
浓缩果汁中维生素C含量的测定实验

蔬菜、水果中维生素c的测定方法有很多,如间接原子吸收分光光度法、分光光度法、高效液相色谱法等,各种方法各有特点。文章对近年来有关维生索C的测定方法进行了综述。
维生素C又叫抗坏血酸(Ascorbicid),广泛存在于植物组织中新鲜的水果、蔬菜中含量较多。是一种水溶性小分子生物活性物质,也是人体需要量最大的一种维生素。维生素C具有还原性(其结构式如图1),可以与许多氧化剂发生氧化还原反应,因此可以利用其还原性测定维生素C的含量。目前食品中测定维生素C含量的方法主要有碘量法,是利用维生素C的氧化还原性为基础的一种氧化还原方法。冈其酸度不易把握,碘需要标定且易挥发,而Vc不易稳定保存,使测定结果易出现偏差,且这种方法不适合微量分析;国标GB/T6195-1986是采用2,6一二氯靛酚滴定法。利用样品溶液由蓝色转变为粉红色来辨别其滴定终点的到达。但是多数水果、蔬菜样品其提取液都具有一定的色泽而导致滴定终点不明显,使测定准确度降低。另外还有荧光光谱分析法 J、紫外一可见分光度法、色谱法、电化学法等,这些方法都存在着一定的局限性,如操作过程复杂,所用试剂不稳定,速度慢、背景¨干扰大。近年来,建立的测定Vc的其他方法还有催化动力学和光度法相结合的方法,及VC传感器测定方法,固定pH滴定法等。
该论文将对蔬菜、水果常用的维生素C含量的检测方法进行综述、比较。
果汁中维生素c含量的测定

果汁中维生素c含量的测定
维生素C是一种水溶性维生素,人类不能自己合成。
因此,我们需要通过日常饮食来摄取足够的维生素C。
果汁是一种含有丰富维生素C的食品,其含量的测定具有重要意义。
果汁中维生素C含量的测定可以通过多种方法进行,其中常用的有滴定法、光度法和荧光法等。
其中光度法是一种比较简单、快速、准确的测定方法。
通过光度法测定果汁中维生素C含量,需要用到一种叫做2,6-dichlorophenolindophenol(简称DCPIP)的化学试剂,它的化学性质是蓝色的。
试剂的颜色会因为与果汁中的维生素C反应而改变,其反应程度和果汁中维生素C的含量成正比。
因此,我们可以通过测定试剂的颜色变化来确定果汁中维生素C的含量。
当进行果汁中维生素C含量的测定时,需要注意以下要点:
1. 选择合适的果汁:果汁中维生素C的含量与果汁种类有关,柑橘类水果和草莓等含有更多的维生素C。
因此,在测定果汁中维生素C 的含量时,最好选择这些含量更高的果汁。
2. 仔细测量:在添加试剂之前,需要先量取一定量的果汁,并将其注入试剂槽里。
在加入试剂之前,需要确认所加入的果汁量是否准确。
3. 记录实验结果:在测量果汁中维生素C的含量后,需要记录测
量结果,并进行分析和解释。
通过上述方法对果汁中维生素C含量进行测定,不仅可以帮助我
们更好的了解果汁的营养价值,同时也可以指导我们日常饮食的选择。
在日常生活中,我们可以多食用富含维生素C的食物,以维护身体健康。
橙汁中维生素C含量的测定

橙汁中维生素C含量的测定第5组成员:甘汉麟,李子宜指导教师:汤又文一、实验概述:目前维生素C(Vc)的测定方法有荧光分析法、碘量法、2,4-二硝基苯肼法、高效液相色谱法、铁(Ⅱ)-邻菲罗啉-BPR体系分光光度法、电位滴定法。
荧光分析法与高效液相色谱法的仪器比较昂贵,通常采用碘量法和2,6-二氯酚靛酚法。
但是一般样品处理后的样液都有颜色,不同程度地影响测定结果的准确性,另外,对颜色的去除步骤也较为繁琐,不适合大批量样品的测定。
二、实验原理:维生素C分子中含有还原性的烯二醇基,能被I2定量氧化为二酮基。
反应式如下:C6H8O6+I2=C6H6O6+2HIE (C6H6O6/ C6H8O6)=0.18V E(I2/I-)=0.535V该反应在弱酸性环境下反应快速完全,同时弱酸环境降低了维生素C的还原性,有利于避免其他氧化性物质的干扰,弱酸环境也避免了I2的歧化反应。
由于反应速率较快,可以直接用I2标准溶液滴定。
通过消耗I2溶液的体积及其浓度可以计算试样中维生素C的含量。
由于维生素C具有较强的还原性,在空气极易被氧化而变成黄色,尤其在碱性介质中更甚,测定时加入HAc使溶液呈弱酸性,减少维生素C 副反应。
由于I2的挥发性及对天平的腐蚀性,不宜在分析天平上称重,故应先配制一个近似浓度的溶液,然后再进行标定。
配制I2溶液时加入过量KI(I2与KI形成I3-使溶解度增加,挥发性大大降低)。
溶液保存在棕色瓶中放在暗处,避免见光而使浓度发生改变,还应避免与橡皮等有机物接触。
I2可以用已标定好的Na2S2O3标准溶液来标定I2溶液浓度。
淀粉指示剂要在接近终点时加入。
淀粉吸附大量I3-后,过早的形成蓝色化合物,由于较多的I2被淀粉的胶粒包住,影响其与Na2S2O3的反应,使终点拖长,且吸附后颜色变为深灰色,终点不好观察。
所以用Na2S2O3溶液滴定I2时应该在大部分的I2已被还原,溶液呈现淡黄色时才加入淀粉溶液。
+I2反应式如下:2Na2S2O3 + I2 = Na2S4O6 + 2NaINa2S2O3中一般含有S、NaCl等杂质,Na2S2O3不稳定,易分解,不能直接配制为标准溶液。
橙汁中维生素C含量的测定

橙汁中维生素C含量的测定第5组成员:甘汉麟,李子宜指导教师:汤又文一、实验概述:目前维生素C(Vc)的测定方法有荧光分析法、碘量法、2,4-二硝基苯肼法、高效液相色谱法、铁(Ⅱ)-邻菲罗啉-BPR体系分光光度法、电位滴定法。
荧光分析法与高效液相色谱法的仪器比较昂贵,通常采用碘量法和2,6-二氯酚靛酚法。
但是一般样品处理后的样液都有颜色,不同程度地影响测定结果的准确性,另外,对颜色的去除步骤也较为繁琐,不适合大批量样品的测定。
二、实验原理:维生素C分子中含有还原性的烯二醇基,能被I2定量氧化为二酮基。
反应式如下:C6H8O6+I2=C6H6O6+2HIE (C6H6O6/ C6H8O6)=0.18V E(I2/I-)=0.535V该反应在弱酸性环境下反应快速完全,同时弱酸环境降低了维生素C的还原性,有利于避免其他氧化性物质的干扰,弱酸环境也避免了I2的歧化反应。
由于反应速率较快,可以直接用I2标准溶液滴定。
通过消耗I2溶液的体积及其浓度可以计算试样中维生素C的含量。
由于维生素C具有较强的还原性,在空气极易被氧化而变成黄色,尤其在碱性介质中更甚,测定时加入HAc使溶液呈弱酸性,减少维生素C 副反应。
由于I2的挥发性及对天平的腐蚀性,不宜在分析天平上称重,故应先配制一个近似浓度的溶液,然后再进行标定。
配制I2溶液时加入过量KI(I2与KI形成I3-使溶解度增加,挥发性大大降低)。
溶液保存在棕色瓶中放在暗处,避免见光而使浓度发生改变,还应避免与橡皮等有机物接触。
I2可以用已标定好的Na2S2O3标准溶液来标定I2溶液浓度。
淀粉指示剂要在接近终点时加入。
淀粉吸附大量I3-后,过早的形成蓝色化合物,由于较多的I2被淀粉的胶粒包住,影响其与Na2S2O3的反应,使终点拖长,且吸附后颜色变为深灰色,终点不好观察。
所以用Na2S2O3溶液滴定I2时应该在大部分的I2已被还原,溶液呈现淡黄色时才加入淀粉溶液。
+I2反应式如下:2Na2S2O3 + I2 = Na2S4O6 + 2NaINa2S2O3中一般含有S、NaCl等杂质,Na2S2O3不稳定,易分解,不能直接配制为标准溶液。
微分脉冲极法测定果汁中维生素c的含量

微分脉冲极法测定果汁中维生素c的含量微分脉冲极法是一种用于测定果汁中维生素C含量的分析方法。
该方法使用电化学技术,通过对果汁样品的氧化还原反应进行定量分析。
下面将详细介绍微分脉冲极法的原理和测定果汁中维生素C含量的步骤。
1. 原理微分脉冲极法是通过测量氧化还原电流的变化来确定维生素C的含量。
维生素C是一种具有还原性的物质,它可以在电极表面发生氧化反应。
在测定中,维生素C被氧化成还原剂,并在电极表面形成一个电化学反应。
通过测量生成的电流,可以确定维生素C的含量。
由于该方法具有灵敏度高、准确度高以及操作简便等特点,因此广泛应用于果汁中维生素C含量的测定。
2. 测定步骤2.1 准备样品:首先,需要准备果汁样品。
可以选择市售的果汁产品或自己鲜榨的果汁作为测定样品。
确保样品中没有其他干扰物质。
2.2 样品预处理:将所选的果汁样品过滤以去除固体颗粒,并用透明的聚丙烯膜进行过滤以去除悬浮物。
2.3 氧化反应:将过滤后的果汁样品加入电化学池中。
在电化学池中加入适量的电解液和缓冲溶液,以促进氧化还原反应的进行。
然后,将阳极和阴极插入电化学池中并连接到电流计。
2.4 电流测量:在电化学池中施加一定的电位差,以引发维生素C的氧化反应。
通过电流计测量在反应过程中产生的电流。
电流的变化与维生素C的浓度成正比。
2.5 构建标准曲线:为了确定果汁样品中维生素C的含量,需要先构建一个标准曲线。
为此,制备一系列不同浓度的维生素C溶液,并进行相同的测量步骤。
绘制维生素C浓度与电流之间的标准曲线,并确定其线性范围和相关系数。
2.6 维生素C含量的计算:根据所测得的电流值以及标准曲线,可以计算果汁样品中维生素C的含量。
通过比较样品的电流值与标准曲线上的对应点,可以确定维生素C的浓度。
3. 注意事项在进行微分脉冲极法测定果汁中维生素C含量时,需要注意以下事项:3.1 样品处理:样品应该经过适当的处理,以去除可能干扰测定的固体颗粒和悬浮物。
果汁饮料中维生素C含量的测定

一个探究性实验教学课题的拓展———果汁饮料中维生素C含量的测定唐立锋(绍兴鲁迅中学, 浙江绍兴 312000)文章编号: 1005- 6629 (2008) 02- 0037- 02 中图分类号: G633.8 文献标识码: B苏教版高中化学选修教材《实验化学》专题《物质的定量分析》中有《水果中维生素C 含量的测定》的定量分析实验, 该实验提供了具体的实验原理与实验过程, 要求定量的测定水果中的Vc含量。
所以, 我们以此为根据进行拓展设计《果汁类饮料中维生素C含量的测定》的探究性实验活动。
同时, 果汁类饮料是中学生非常喜爱的饮料之一,市售各种果汁饮品中绝大多数含有维生素C成分,了解这些饮料的主要成分及其含量, 学生肯定是感兴趣的。
1 课题实施(1) 分组活动组1: 调查本班同学中常饮用和市场上在售的果汁类饮料品牌, 了解它们的主要成分及价格。
本文所选取的试样1为某品牌白葡萄汁饮品,净含量500mL, 2.5元/瓶, 生产日期为2006年5月20日; 试样2为某品牌水晶葡萄汁饮品 , 净含量310mL, 2.0元/瓶, 生产日期为2006年6月2日; 试样3为某品牌橙汁饮品, 净含量335mL, 3.0元/瓶,生产日期为2006年7月15日。
组2: 查阅文献或网络以获取维生素C的化学组成, 主要理化性质等。
维生素C又叫抗坏血酸,是一种水溶性维生素。
分子式: C6H8O6; 结构简式: 。
广泛存在于新鲜水果于蔬菜中。
人体不能合成维生素C, 必须从食物中获取。
当人体缺乏维生素C时易患坏血病。
适量饮用饮料可以补充维生素C。
表1 各年龄段每日摄入维生素C参考量滴定法测定维生素C原理:维生素C具有较强的还原性, 可以与一些氧化剂反应 , 如 : 酸性 KMnO4溶液、浓HNO3、浓H2SO4、溴水、碘单质等。
当维生素C溶液中滴加I2水溶液, 同时用淀粉做指示剂, 当维生素C被I2氧化完时, 再滴加I2, 则溶液变蓝, 由此可以判断滴定终点。
果汁中维生素C含量的测定

诚信声明本人重声明:所呈交的毕业项目报告/论文《果汁饮料中维生素C含量的测定》是本人在指导老师的指导下,独立研究、写作的成果。
论文中所引用是他人的无论以何种方式发布的文字、研究成果,均在论文中以明确方式标明。
本声明的法律结果由本人独自承担。
作者签名:年月日摘要:果汁饮料的主要原料就是水果,其中的主要营养成分是维生素C。
维生素C又称为抗坏血酸,属于水溶性维生素,在水溶液中易被空气和其他氧化剂氧化,但在弱酸性条件下较稳定,所以本次用碘量法测定果汁中的维生素C的含量。
本次方法简单,可靠,准确度较高,在实验室得到广泛应用。
关键词:果汁饮料;维生素C;碘量法果汁饮料中维生素C含量的测定1 绪论1.1 果汁饮料的概念果汁饮料是一种以水果为主要原料,经过如压榨、离心、萃取等得到的汁液产品。
果汁(浆)及果汁饮料(品)类也可以细分为果汁、果浆、浓缩果浆、果肉饮料、果汁饮料、果粒果汁饮料、水果饮料浓浆、水果饮料等9种类型,其大都采用打浆工艺将水果或水果的可食部分加工制成未发酵但能发酵的浆液或在浓缩果浆中加入果浆在浓缩时失去的天然水分等量的水,制成的具有原水果果肉的色泽、风味和可溶性固形物含量的制品。
各种不同水果的果汁含有不同的维生素等营养,而被视为是一种对健康有益的饮料,但其缺乏水果所有的纤维素和过高的糖分有时被视为其缺点。
1.2 果汁饮料的发展我国的果汁饮料发展始于上世纪70年代,在80年代处于缓步发展时期,进入90年代有了较快发展,在果汁饮料的品种上,打破了传统的单一桔子型格局,向着品种多样化的方向发展。
诸如苹果汁,椰子汁,鲜橙汁等;在品种结构方面有浓缩汁、100%纯果汁、混合汁等;在果汁包装方面,也日趋多样化,有玻璃瓶包装、纸塑复合软包装、金属易拉罐包装等。
随着人们生活水平的不断提高,果汁饮料在人们生活中越来越受到青睐,2007年,销售总量首次超越碳酸饮料,仅次于纯净水。
从现在看,果汁饮料发展前景非常广阔,具备了非常好的投资优势。
果汁中vc含量的测定

果汁中VC含量的测定(HPLC法)1.原理:果汁中的VC在ODS柱上可以得到分离,并且在206NM波长下,VC 有吸收,本方法对于测定果汁中添加VC的样品有较好的结果。
2.试剂2.1 溶剂:水,过滤后的二次蒸馏水2.2 流动相:0.01M HCI溶液2.3 维生素C 标准品:纯度95%2.4 维生素C标准溶液:称取VC标准品0.25g,精确至0.0001g,用流动相溶解,转移,并定容标准品于50ml容量瓶中,混匀,作为贮备液。
2.5 VC标准工作液:准确吸取5.0ml贮备液于50ml容量瓶中,用流动相定容,即可得到10倍的稀释液,其浓度为0.5mg/ml。
2.6 VC标准液的保存期不应超过半个月。
3. 仪器3.1 高效液相色谱仪:单元泵,可变波长紫外检测器,数据分析系统。
3.2 色谱柱:150mm*4.6mm ,5ul颗粒的键合ODS柱。
3.3 进样器:25ul微量进样针3.4 色谱条件:流动相:0.01M HCI溶液流量:1.0ml/min柱温:40℃检测波长:206nm保留时间:3.2min以上操作条件是典型条件,可根据仪器情况和分离情况加以适当的调整,以期获得最佳定量效果。
4. 测定步骤4.1 样品的制备:称取浓缩汁样品4.0g(清汁10ml或浓缩浊汁6ml左右),精确至0.01g,用流动相溶解于50ml容量瓶中,并定容至刻度,摇匀,用带有0.45um水系滤膜的过滤器过滤样品至样品瓶中,作为试样溶液。
4.2 在上述操作条件下,等待仪器运行稳定后,按照标准溶液、试样溶液的顺序交叉进样进行测定。
4.3 定量计算以现配置的VC标准工作液做标准曲线,同时注射5针,从而确定响应系数,对于样品的面积积分结果采用外标法即可得到样品中VC的量。
4.4 Vc(mg/100g)按下式计算:AiXCsXVX100Vc(mg/100g)=----------------AsXm式中,Ai、As-----分别为样品与标样中Vc的峰面积;Cs-----标样中Vc和浓度,mg/ml;V------标样定容体积,ml;m------称取的试样量,g。
微分脉冲极谱法测定果汁中维生素C的含量(精)

实验报告课程名称仪器分析实验实验项目微分脉冲极谱法测定果汁中维生素C的含量实验类型□验证□设计□综合实验时间 2010 年 4 月 7 日实验指导老师实验评分一、实验目的1.掌握微分脉冲极谱法的基本原理2.掌握伏安极谱仪的操作方法3.学会使用微分脉冲极谱法测定果汁中的维生素C二、实验原理脉冲极谱法不仅适用于无机物的定量测定,而且适用于有机物的定量测定。
能否可以用记谱法测定水溶性介质中的有机物,与有机物功能团的氧化还原特性有关。
功能团很大程度上决定在汞滴电极的电位窗口是否可发生氧化还原反应,是否可通过物质的还原或氧化定量测定。
脉冲极谱法测定果汁中维生素C(抗坏血酸)的含量是基于抗坏血酸氧化为脱氧抗坏血酸:(C6H8O6→C6H6O6+2e+2H+)该反应的氧化还原电位与pH有关:如果缓冲效果不适宜的话,抗坏血酸的氧化会是电极表面的pH移动,从而导致峰形变宽。
在实验中选用乙酸缓冲液可以避免此类情况。
三、仪器与试剂1.仪器: Metrohm 797伏安极谱仪2.试剂: 1g/L新配的抗坏血酸标准溶液乙酸缓冲溶液待测果汁溶液四、实验内容与步骤1.接通电源,预热伏安极谱仪。
(上一组刚做完,因此不用做此步骤)2.设置相关参数,将Electrode设为DME(动态滴汞),其它参数因为上一组已经设置好,因此其它参数不用再次设置。
3.取10mL乙酸缓冲液,加入100μL果汁样品溶液,记录样品的测定曲线后,依序两次加入100μL抗坏血酸标准溶液,分别测定峰电流值,利用标准加入发自动计算果汁中维生素C的含量。
五、实验记录与结果处理见下页即求得待测果汁溶液中的维生素C含量为142.458mg/L六、总结与讨论1. 实验中使用缓冲溶液作用:本实验的实验原理是,待测物质在外加电压的情况下,在滴汞电极上发生氧化还原反应,并产生相应的电流。
根据测量出的信号峰高与待测物的浓度成正比,从而计算得出待测物质的浓度。
因此,待测物质维生素C在测定过程中,要切实保证其本身的性质,尽量避免被空气等氧化。
果汁中维生素C含量的测定

果汁中维生素C含量的测定杜格林(华南师范大学化学与环境学院 2010级化学一班 20102401029)【一、实验目的】1、掌握分析化学设计实验思路;2、熟悉掌握滴定操作;3、掌握果汁中维生素C含量测定的方法。
【二、实验原理】1、维生素C维生素C是人体重要的维生素之一,缺乏时会产生坏血病,故维生素C又称抗坏血酸,属水溶性维生素。
维生素C纯品为白色无臭结晶,熔点在190—192℃,易溶于水,微溶于丙酮,在乙醇中溶解度更低,不溶于油剂。
结晶抗坏血酸在空气中稳定,但它在水溶液中易被空气和其他氧化剂氧化,生成脱氢抗坏血酸;在碱性条件下易分解,见光加速分解;在弱酸条件中较稳定。
2、滴定原理维生素C(C6H8O6, E=0.18),分子结构中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,抗坏血酸分子中的二烯醇基被I2完全氧化后,则I2与淀粉指示剂作用而使溶液变蓝,所以当滴定到溶液出现蓝色时即为终点。
由于维生素C的还原性很强,即使在弱酸性条件下,上述反应也进行得相当完全。
维生素C在空气中极易被氧化,尤其在碱性介质中更甚,故该滴定反应在稀HAc中进行,以减少维生素C的副反应。
使用淀粉作为指示剂,用直接碘量法可测定药片、注射液、蔬菜、水果中维生素C的含量。
I2标准溶液采用间接配制法获得,用Na2S2O3标准溶液标定,反应如下:2S2O32-+I2=S4O62-+2I-【三、仪器和试剂】1、器材:天平(0.1mg),碱式滴定管(50 mL)、酸式滴定管(50mL),碘量瓶(250mL),移液管(20mL)锥形瓶(250ml)、量筒、棕色瓶(250mL)。
2、试剂:果汁、K2Cr2O7(基准试剂),Na2S2O3(0.02mol·L-1),I2(0.01 mol·L-1),KI(20%)、HCl,(6mol·L-1),HAc(2mol·L-1),淀粉指示剂(0.5%),Na2CO3固体。
仪器分析实验的课后习题答案及讨论

高效液相色谱1.高效液相色谱法的特点特点:检测的分辨率和灵敏度高,分析速度快,重复性好,定量准确度高,应用围广。
适用于分析高沸点、大分子、强极性、热不稳定有机及生化试样的高效别离分析方法。
2.高效液相色谱与气相色谱的主要区别可归结于以下几点:(1)进样方式的不同:高效液相色谱只要将样品制成溶液,而气相色谱需加热气化或裂解;(2)流动相不同,在被测组分与流动相之间、流动相与固定相之间都存在着一定的相互作用力;(3)由于液体的粘度较气体大两个数量级,使被测组分在液体流动相中的扩散系数比在气体流动相中约小4~5个数量级;(4)由于流动相的化学成分可进展广泛选择,并可配置成二元或多元体系,满足梯度洗脱的需要,因而提高了高效液相色谱的分辨率〔柱效能〕;(5)高效液相色谱采用5~10Lm细颗粒固定相,使流体相在色谱柱上渗透性大大缩小,流动阻力增大,必须借助高压泵输送流动相;(6)高效液相色谱是在液相中进展,对被测组分的检测,通常采用灵敏的湿法光度检测器,例如,紫外光度检测器、示差折光检测器、荧光光度检测器等。
3.高效液相色谱的定性和定量分析的方法定性:〔1〕利用纯物质定性的方法利用保存值定性:通过比照试样中具有与纯物质一样保存值的色谱峰,来确定试样中是否含有该物质及在色谱图中位置。
不适用于不同仪器上获得的数据之间的比照。
利用参加法定性:将纯物质参加到试样中,观察各组分色谱峰的相对变化。
〔2〕利用文献保存值定性相对保存值r21:相对保存值r21仅与柱温和固定液性质有关。
在色谱手册中都列有各种物质在不同固定液上的保存数据,可以用来进展定性鉴定。
定量:有归一法、标法、外标法在定量分析中,采用测量峰面积的归一化法、标法或外标法等,但高效液相色谱在别离复杂组分式样时,有些组分常不能出峰,因此归一化法定量受到限制,而标法定量则被广泛使用。
4.高效液相色谱实验时,选择流动相时应注意的几个问题〔1〕尽量使用高纯度试剂作流动相,防止微量杂质长期累积损坏色谱柱和使检测器噪声增加。
用脉冲极谱法测定饮料中的维生素C

用脉冲极谱法测定饮料中的维生素C
陈建军
【期刊名称】《浙江预防医学》
【年(卷),期】1999(000)012
【摘要】为了适应饮料等样品中维生素C快速、准确的测定需要,我们利用PS2.0微机极谱仪,对维生素C在NaAc-HAc(pH=4.3)介质中的极谱行为进行实验探索,实验结果:在经选择的最佳实验条件下,在0.21mV(vs.SCE)左右处得一还原峰,当维生素C浓度在0.50~20.00mg/L范围内,峰高与其浓度成正比,其线性方程为y=0.012+4.98×10^2X,相关系数0.9991;回收率97.9%~
【总页数】1页(P60)
【作者】陈建军
【作者单位】宁波市江东区卫生防疫站;宁波市江东区卫生防疫站
【正文语种】中文
【中图分类】R151.3
【相关文献】
1.极谱法测定树莓中的维生素C [J], 郭鑫;汤敏顺
2.蒸馏分离极谱法测定矿石及选冶复杂物料中的锗 [J], 崔庆雄;毛禹平
3.微分脉冲极谱法测定天然还原糖的研究:Ⅰ.葡萄糖,果糖的测定 [J], 屠一锋;周文
4.维生素C及其制剂的一阶导数差示脉冲极谱法测定 [J], 梁云爱;丁元晶;范立昌;
韩启峰;马来华;孙金辉
5.饮料中还原型维生素C与总维生素C测定方法的研究 [J], 邵丽华;李静涛;郭帅;王淑娥;郭冬梅
因版权原因,仅展示原文概要,查看原文内容请购买。
橙汁饮料中维生素C含量的测定操作指南

橙汁饮料中维生素C含量的测定操作指南(90min内完成所有考核内容)实验原理:还原型抗坏血酸还原染料2,6-二氯酚靛酚后,本身被氧化成脱氢抗坏血酸。
染料2,6-二氯酚靛酚在酸性溶液中呈红色,还原后变为无色。
因此,当用此染料滴定含有维生素C的酸性溶液时,维生素C尚未全部被氧化前,则滴下的染料立即被还原成无色。
一旦溶液中的维生素C已全部被氧化时,则滴下的染料立即使溶液变成粉红色。
所以,当溶液从无色转变成微红色时,即表示溶液中的维生素C刚刚全部被氧化,此时即为滴定终点。
如没有杂质干扰时,一定量的样品提取液还原标准2,6-二氯酚靛酚的量与样品中所含的还原型抗坏血酸成正比。
1、准备要求:(1)仪器的准备:分析天平(在分析天平室),容量瓶(100ml),烧杯(100ml),移液管(1ml、2 ml、5 ml),三角瓶(250ml),碱式滴定管(25ml),移液管架,洗耳球,洗瓶,玻璃棒,滴管,(2)试剂的准备1). 1%草酸溶液【实验中心提供】2). 1%淀粉溶液【实验中心提供】3). 6%(m/V)碘化钾溶液【实验中心提供】4). 0.000167mol/L碘酸钾标准溶液:精确取干燥的碘酸钾0.3567g,水稀释至100mL,取出1mL,用水稀释至100mL,此溶液1mL相当于抗坏血酸0.088mg;5)抗坏血酸标准溶液:准确称取20mg抗坏血酸(应为洁白色,如变为黄色则不能使用),溶于1%草酸溶液中,并用1%草酸溶液定容至100mL。
临用前新鲜配制。
标定:吸取标准使用液5mL于三角烧瓶中,加入6%碘化钾溶液0.5mL,1%淀粉溶液3滴,再以碘酸钾标准溶液滴定,终点为淡蓝色。
(碘酸钾在酸性条件下与碘化钾反应放出单质碘,放出的单质碘与抗坏血酸作用,将之氧化成脱氢型抗坏血酸,多余的碘能使淀粉变为蓝色)计算公式:抗坏血酸浓度(mg/mL)= ( V1×0.088)/V2V1:滴定时所耗碘酸钾标准溶液的量(mL)V2:所取抗坏血酸的量(mL)0.088:lmL碘酸钾标准溶液相当于抗坏血酸的量(mg/mL)6)2,6-二氯酚靛酚溶液:【由实验中心配制,使用前,选手进行标定】称取碳酸氢钠52mg,溶于200mL沸水中,然后称取2,6-二氯酚靛酚250mg,溶解在上述碳酸氢钠的溶液中,待冷,置于冰箱中过夜,次日过滤置于250mL量瓶中,用水稀释至刻度,摇匀。
果汁中维c含量的测定

一、实验题目: 果汁中Vc的测定二、目前有关该元素常量测定方法的概述1、直接碘量法I2是弱氧化剂, E I2/I=0.535,电位比E I2/I小的还原性物质,可直接用I2标准溶液滴定,这种方法叫做直接碘量法,可用I2标准溶液直接滴定的是强还原剂,如S2O32-、As(Ⅲ)、Sn(Ⅱ)、维生素C等。
2、近红外分光光度法测定水果中Vc的含量目前提出了一种测定Vc的新方法,它是基于Folin B试剂与抗坏血酸在pH3的三氯乙酸酸性介质中反应生成脱氢抗坏血酸,反应产物在920nm波长处有最大吸光度进行定量分析.该方法的线性范围为0~10.0μg/mL,相关系数r=-0.99955,回收率为89.4%~102.1%.3、2,6 -二氯靛酚滴定法1)适用范围本标准适用于果品、蔬菜及其加工制品中还原型抗坏血酸的测定( 不含二价铁、二价锡、一价铜、二氧化硫、亚硫酸盐或硫代硫酸盐), 不适用于深色样品。
2)测定原理靛酚的颜色反应表现两种特性, 一是取决于其氧化还原状态, 氧化态为深蓝色, 还原态变为无色; 二是受其介质的酸度影响, 在碱性溶液中呈深蓝色, 在酸性介质中呈浅红色。
用蓝色的碱性染料标准溶液, 对含维生素 C 的酸性浸出液进行氧化还原滴定, 染料被还原为无色, 当到达滴定终点时, 多余的染料在酸性介质中则表现为浅红色, 由染料用量计算样品中还原型抗坏血酸的含量。
4、电位滴定法测定深色蔬菜和水果中的维生素C电位滴定法是根据维生素C与2, 6-DCIP具有不同的电位,通过记录仪的电位变化曲线确定滴定终点,无需观察滴定液的颜色变化,从而显著提高测定的准确度和精密度。
5.紫外分光光度快速测定法紫外分光光度快速测定法是根据维生素C具有对紫外产生吸收和对碱不稳定的特性,于波长243nm处测定样品溶液与碱处理样品两者吸光度之差,通过查校准曲线,即可计算样品中维生素C的含量。
此法操作简单、快速准确、重现性好,结果令人满意。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实 验 报 告
课程名称 仪器分析实验 实验项目微分脉冲极谱法测定果汁中维生素C 的含量 实验类型 □验证 □设计 □综合 实验时间 2010 年 4 月 7 日 实验指导老师 实验评分
一、实验目的
1.掌握微分脉冲极谱法的基本原理
2.掌握伏安极谱仪的操作方法
3.学会使用微分脉冲极谱法测定果汁中的维生素C
二、实验原理
脉冲极谱法不仅适用于无机物的定量测定,而且适用于有机物的定量测定。
能否可以用记谱法测定水溶性介质中的有机物,与有机物功能团的氧化还原特性有关。
功能团很大程度上决定在汞滴电极的电位窗口是否可发生氧化还原反应,是否可通过物质的还原或氧化定量测定。
脉冲极谱法测定果汁中维生素C (抗坏血酸)的含量是基于抗坏血酸氧化为脱氧抗坏血酸:
C CH CH C C H 2O O H O H O
H OH H O
H -2H +
-2e
C C C C C H 2O O
O O
O
H OH H H
(C 6H 8O 6→C 6H 6O 6+2e+2H +)
该反应的氧化还原电位与pH 有关:
2O H 3lgC 2
059
.0E +
∝
如果缓冲效果不适宜的话,抗坏血酸的氧化会是电极表面的pH 移动,从而导致峰形变宽。
在实验中选用乙酸缓冲液可以避免此类情况。
三、仪器与试剂
1.仪器:Metrohm 797伏安极谱仪
2.试剂:1g/L新配的抗坏血酸标准溶液
乙酸缓冲溶液
待测果汁溶液
四、实验内容与步骤
1.接通电源,预热伏安极谱仪。
(上一组刚做完,因此不用做此步骤)
2.设置相关参数,将Electrode设为DME(动态滴汞),其它参数因为上一组已经设置好,因此其它参数不用再次设置。
3.取10mL乙酸缓冲液,加入100μL果汁样品溶液,记录样品的测定曲线后,依序两次加入100μL抗坏血酸标准溶液,分别测定峰电流值,利用标准加入发自动计算果汁中维生素C的含量。
五、实验记录与结果处理
见下页
即求得待测果汁溶液中的维生素C含量为142.458mg/L
六、总结与讨论
1. 实验中使用缓冲溶液作用:
本实验的实验原理是,待测物质在外加电压的情况下,在滴汞电极上发生氧化还原反应,并产生相应的电流。
根据测量出的信号峰高与待测物的浓度成正比,从而计算得出待测物质的浓度。
因此,待测物质维生素C在测定过程中,要切实保证其本身的性质,尽量避免被空气等氧化。
就是这个原因,在实验过程中,要加入缓冲溶剂,调节溶液的pH值,尽量降低待测物质的氧化进程。
使测定结果更准确。
如果缓冲效果不适宜,抗坏血酸的氧化会是电极表面的pH移动,从而导致峰形变宽。
2.该实验选择微分脉冲法定量分析标准加入法的原因和优缺点:
本实验采用的是标准加入法。
之所以选用这种方法是鉴于待测试样是“果粒橙”橙汁,其中的待测物质维生素C的含量被视为一个未知值,且维生素C
容易被氧化,若采用标准曲线法,在配制标准溶液时,维生素C容易被氧化,会影响最终结果。
因为果汁的成分复杂,很难找一种合适的内标物。
而标准加入法可以测定组分复杂且未知的样品;同时,加入的标准溶液体积很小,避免了底液不同所引起的误差,消除背景干扰,准确度较高。
最后测定实验采用了这种方法。
标准加入法也有缺点。
其缺点为,由于进样多次,进样误差加倍。
而且标准溶液的加入量多少对测定结果的影响程度较大。
如果加入的标准溶液太少,波高增加的值很小,则测量误差大;若加入的量太大,则引起底液组成的变化。
此方法不宜标准化操作。
因此,使用这一方法,加入标准溶液的量要适当。
此外,还要注意的是,只有波高与浓度成正比关系时才能使用标准加入法。
3.脉冲极谱分析方法的总结:
脉冲极谱分析方法是极谱分析方法中的一种。
极谱分析方法是一种特殊条件下进行的,以滴汞电极作工作电极电解被分析物质的稀溶液,根据电流-电压曲
线进行分析的方法。
而脉冲极谱法是为克服普通极谱法中充电电流和毛细管噪声电流的影响而建立的一种新极谱技术,它是极谱法中灵敏度较高的方法之一。
在这种脉冲极谱法中,还具体分有常规脉冲极谱法和微分脉冲极谱法两种。
本次实验所用的是微分脉冲极谱法。
由于可有效减少充电电流及毛细管的噪声电流,所以灵敏度高。
由于微分脉冲极谱波呈峰状,所以分辨力强。
微分脉冲极谱改变了普通极谱法中电压连续扫描的方式,代之以在每一滴汞滴增长到一定的时间时,在直流线形扫描电压上叠加一个小振幅的周期性的脉冲电压,并在脉冲电压的末期再测量电解电流,以扣除背景电流的干扰。
