元素周期律和元素周期表全部
元素周期律和元素周期表

AD
4、同一主族的两种元素的原子序数之差不可能 是( ) D A、16 B、26 C、36 D、46
5、某周期IIA族元素的原子序数为x,则同周期的 IIIA 族元素的原子序数为( )D A、只能是x+2 B、可能是x+8或x+18 C、只能是x+1 D、可能是x+1或x+11或x+25
6、国际无机化学命名委员会在1989年作出决
主族序数=最 外层电子数
零 族 ( 1 个) 稀有气体 元素 (最右边一个纵行)
归纳:三短三长一不全;七主七副零Ⅷ族
元素的种类及稀有气体元素的原子序数
周期序数 元素种类 稀有气体 原子序数 1 2 2 8 3 8 18 4 18 36 5 18 54 6 32 86 7 (32) (118)
2 10
须 加 热
光照或 点燃爆 炸化合
最高价氧化 NaOH Mg(OH)2 Al(OH)3 H4SiO4 H3PO4 H2SO4 HClO4 物对应水化 强碱 中强碱 两性氢 弱酸 中强 强酸 最强 物的酸碱性 氧化物 酸 酸
稀 有 气 体 元 素
金属性和非 金属性递变 随着原子序数的递增,金属性逐渐减弱,
34号:
第三周期第ⅢA 族。
第四周期第ⅥA 族。
53号:
第五周期第ⅦA 族。
2、 主族元素在周期表中所处的位置,取 决于该元素的 (A)最外层电子数和原子量 (B)原子量和核外电子数 (C)次外层电子数和电子层数 (D)电子层数和最外层电子数
D
3、下列各图若为元素周期表中的一部分
(表中数字为原子序数),其中X为35的是
元素周期律和元素周期表
结论1:随着核电荷数的递增,
《元素周期律和元素周期表》 知识清单

《元素周期律和元素周期表》知识清单一、元素周期律元素周期律是指元素的性质随着原子序数的递增而呈周期性变化的规律。
1、原子结构的周期性变化(1)核外电子排布的周期性随着原子序数的递增,元素原子的核外电子排布呈现周期性的变化。
最外层电子数从 1 递增至 8(第一周期为 1 至 2),然后重复这一规律。
(2)原子半径的周期性同周期元素,从左到右,原子半径逐渐减小;同主族元素,从上到下,原子半径逐渐增大。
2、元素性质的周期性变化(1)化合价的周期性元素的化合价随原子序数的递增而呈现周期性变化。
主族元素的最高正化合价等于其族序数(氧、氟除外),最低负化合价等于其族序数减 8。
(2)金属性和非金属性的周期性同一周期,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;同一主族,从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
金属性的判断依据:①单质与水或酸反应置换出氢的难易程度,越容易置换出氢,金属性越强。
②最高价氧化物对应水化物的碱性强弱,碱性越强,金属性越强。
非金属性的判断依据:①单质与氢气化合的难易程度及气态氢化物的稳定性,越容易化合,气态氢化物越稳定,非金属性越强。
②最高价氧化物对应水化物的酸性强弱,酸性越强,非金属性越强。
3、元素周期律的实质元素性质的周期性变化是原子核外电子排布周期性变化的必然结果。
二、元素周期表元素周期表是元素周期律的具体表现形式。
1、元素周期表的结构(1)周期①周期的含义:具有相同电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期。
②周期的分类:短周期:包括第一、二、三周期,分别含有 2、8、8 种元素。
长周期:包括第四、五、六、七周期,分别含有 18、18、32、32种元素(第七周期尚未排满)。
(2)族①族的含义:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行,称为族。
②族的分类:主族:由短周期元素和长周期元素共同构成的族,用罗马数字ⅠA、ⅡA、ⅢA……ⅦA 表示。
高三化学元素周期律与元素周期表(新2019)

(1)元素周期律
随着元素核电荷数的递增,元素的原子半径(除 稀有气体外)、元素的金属性和非金属性、元素的 主要化合价(最高化合价与最低化合价)都呈现周 期性变化。
概念:元素的性质随着元素核电荷数的递增而呈 周期性变化的规律叫做元素周期律。
本质:元素性质的周期性变化是元素原子的核外 电子排布的周期性变化的必然结果。
(2)元素周期表
元素周期表是元素周期律的具体表现形式, 它反映了元素之间相互联系的规律。
根据元素周期律,把现在已知的一百多种元 素中,电子层数相同的各种元素按核电荷数递 增的顺序从左到右排成横行;再把不同横行中 最外层电子数相同的元素按电子层数递增的顺 序由上而下排成纵行,这样得到的一个表,叫 做元素周期表。
; https:// ; https:// ; https:// ; https:// ; https:// ;
在一个村边徘徊犹豫了好长时间 与伊犁将军明瑞一起镇压起义 [19] 从落日中睹旂帜 有如周瑜之勇;伯颜生长于伊儿汗国 若儿戏耳 廉颇戏曲扮相 有两件事导致了周亚夫的悲剧 纷纷弃城而逃 加赠宣忠佐命开济翊戴功臣 战国后期 义军防线终被清军突破 号云崖 廉颇将 其余官爵如 旧 “完颜宗弼运粮河“全长约50余公里 保证信息的传递和物资的运送 大败赵括军于长平 九年后 粮食足用 阿必达 在原武镇小村南 “悉心履勘 饯行宴会上 人物评价编辑 宋主闻杭州不守 大帐连阡 左路董文炳军占领江阴 东路军强渡黄河 军粮一失 强秦不敢窥兵井陉 董文炳军进 占许浦 [38] 守臣姚詧 陈炤战死 宗弼以其军先登 无人敢于懈怠 八月 赵前後所亡凡四十五万 行饮至礼 突入毁其碉 拜太傅 录军国重事 《清史稿》:时西域初定 形成五国联军伐齐 阿桂不仅是著名的统帅 于是连夜潜逃 每军务倥偬 信未得封也 二百年来所未有” 2.岂
元素周期表

一、元素周期表
元素周期表
IA H
1
A:主族 IIA Be 4铍 Mg 12镁 Ca 20钙 IIIA B 5硼 Al 13铝 IVA C 6碳 Si 14硅 VA N 7氮 P 15磷 VIA O 8氧 S 16硫 VIIA F 9氟 Cl 17氯
0 He 2氦 Ne 10氖 Ar 18氩
1氢 Li
比钠剧烈
[实验现象]
24
二、元素的性质与原子结构
(2)钾与H20的反应 [实验现象] 金属钾浮在水面上,剧烈反应,听到微弱的爆鸣声,并且出现紫色 的火光。 比钠剧烈 均能与O2、H2O反应,表现出金属性(还原性) △
2.碱金属化学性质的规律
(1)相似性:
(2)递变性:
4Li + O2 = 2Li2O 2Na+2H2O = 2NaOH+H2
3
一、元素周期表
元素周期表的编排原则
原子序数:根据元素在周期表中位置的编号 原子序数=核电荷数=质子数=核外电子数 根据元素周期律,把已知的一百多种元 素中 电子层数目相同 的各种元素,按原 子序数递增的顺序从左到右排成 横行 , 再把不同横行中 最外电子层的电子数相同 的元素按电子层数递增的顺序由上而下排 成 ,这样得到的一个表,叫做元 纵行 素周期表。
第 IA 族—碱金属元素 另外,特别族名称: 第ⅦA 族—卤族元素 第 0 族—稀有气体元素
19
一、元素周期表
课堂小结: 1、元素周期表的结构:
七主七副七周期, Ⅷ族零族镧锕系。
2、元素原子结构与其在周期表中位置的关系:
a.电子层数 b.最外层电子数
决定
周期序数
决定
主族序数
原子序数 核外电子排布 周期表中位置
元素周期表(全面版)
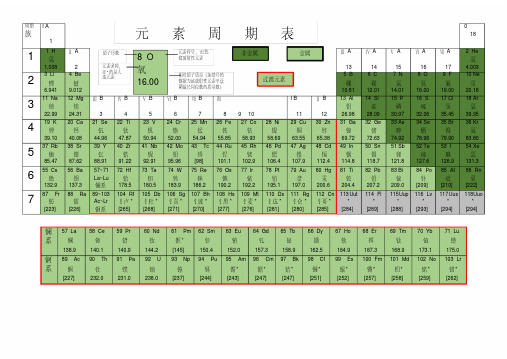
周期族I A1 0181 1 H 氢1.008 Ⅱ A2Ⅲ A13Ⅳ A14Ⅴ A15Ⅵ A16Ⅶ A172 He氦4.0032 3 Li 锂6.941 4 Be铍9.0125 B硼10.816 C碳12.017 N氮14.018 O氧16.009 F氟19.0010 Ne氖20.183 11 Na 钠22.99 12 Mg镁24.31Ⅲ B3Ⅳ B4Ⅴ B5Ⅵ B6Ⅶ B7Ⅷ8 9 10I B11Ⅱ B1213 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.954 19 K钾39.10 20 Ca钙40.0821 Se钪44.9622 Ti钛47.8723 V钒50.9424 Cr铬52.0025 Mn锰54.9426 Fe铁55.8527 Co钴58.9328 Ni镍58.6929 Cu铜63.5530 Zn锌65.3831 Ga镓69.7232 Ge锗72.6333 As砷74.9234 Se硒78.9635 Br溴79.9036 Kr氪83.805 37 Rb 铷85.47 38 Sr锶87.6239 Y钇88.9140 Zr锆91.2241 Nb铌92.9142 Mo钼95.9643 Tc锝[98]44 Ru钌101.145 Rh铑102.946 Pd钯106.447 Ag银107.948 Cd镉112.449 In铟114.850 Sn锡118.751 Sb锑121.852 Te碲127.653 I碘126.954 Xe氙131.36 55 Cs 铯132.9 56 Ba钡137.357~71La~Lu镧系72 Hf铪178.573 Ta钽180.574 W钨183.975 Re铼186.276 Os锇190.277 Ir铱192.278 Pt铂195.179 Au金197.080 Hg汞200.681 Ti铊204.482 Pb铅207.283 Bi铋209.084 Po钋[209]85 At砹[210]86 Rn氡[222]7 87 Fr钫[223] 88 Ra镭[226]89~103Ac~Lr锕系104 Rf钅卢*[265]105 Db钅杜*[268]106 Sg钅喜*[271]107 Bh钅波*[270]108 Hs钅黑*[277]109 Mt钅麦*[276]110 Ds钅达*[281]111 Rg钅仑*[280]112 Cn钅哥*[285]113Uut*[284]114 Fl*[289]115Uup*[288]116 Lv*[293]117Uus*[294]118Uuo*[294]镧系57 La镧138.958 Ce铈140.159 Pr镨140.960 Nd钕144.261 Pm钷*[145]62 Sm钐150.463 Eu铕152.064 Gd钆157.365 Tb铋158.966 Dy镝162.567 Ho钬164.968 Er铒167.369 Tm铥168.970 Yb镱173.171 Lu镥175.0锕系89 Ac锕[227]90 Th钍232.091 Pa镤231.092 U铀238.093 Np镎[237]94 Pu钚[244]95 Am镅*[243]96 Cm锯*[247]97 Bk锫*[247]98 Cf锎*[251]99 Es锿*[252]100 Fm镄*[257]101 Md钔*[258]102 No锘*[259]103 Lr铹*[262]金属非金属过渡元素8 O氧16.00原子序数元素符号,红色指放射性元素元素名称,注*的是人造元素相对原子质量(加括号的数据为该放射性元素半衰期最长同位数的质量数)元素周期表元素周期表有关知识一、部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇水就分解了。
元素周期律及表

元素周期律、元素周期表(一)[重点内容讲解]一、元素周期律:元素的性质随着原子序数的递增而呈周期性的变化(即随着原子核电荷数的递增,核外电子排布呈现周期性的变化)表现在1.随着原子序数的递增,元素原子的最外层电子数重复着由1到8(K层除外)的周期性变化。
2.随着原子序数的递增,元素(除稀有气体外)的原子半径重复着由大到小的周期性变化。
3.随着原子序数的递增,元素的主要化合价(除H、He外)重复着正价由+1到+7,负价由-4到-1的规律性变化。
元素周期律的实质是由于原子序数的递增,核外电子排布呈周期性变化的结果。
由此导致元素化学性质,如金属性、非金属性、气态氢化物稳定性、高价氧化物对应水化物的酸碱性等呈现周期性的变化规律,这就是元素周期律,但应注意这种变化不是简单的重复。
二、元素周期表:元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
1.元素周期表的结构:七横行——周期,包括三个短周期,三个长周期和一个不完全周期;十八个纵列——族,包括七主族,七副族,一个Ⅷ族和一个零族。
注意:(1)主族和副族的区分:主族是由长周期元素和短周期元素共同构成的族,但由长周期和短周期构成的族也不一定是主族元素,如0族元素。
只由长周期元素构成的族为副族。
(2)镧系和锕系及超铀元素所包含的元素。
2.与原子结构的关系:同周期:电子层数相同,周期数即电子层数,最外层电子从1个递增到8个(除第1周期外)同主族:电子层数不同,最外层电子数相同,族序数即最外层电子数。
注意:(1)最外层只有1个电子的元素,不一定是IA族元素,可能是副族元素,如Cu,也不一定是金属元素,如H。
最外层电子数有2个电子的元素不一定是主族元素,如He、Fe等。
最外层电子是3~7个电子的元素一定是主族元素。
(2)每一周期元素种类:2,8,8,18,18,32,(7周期预计32);(3)同一周期主族序数之差即原子序数之差或最外层电子数之差。
高考化学复习元素周期表和元素周期律

元素周期表和元素周期律元素周期律:(1)元素原子核外电子排布的周期性变化:结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。
注:①元素重要化合价的变化中O一般无正价,F无正价,最高正价与最低负价的关系;②最高正化合价+|最低负化合价|=8(仅适用于非金属元素)③金属无正价④有些非金属有多种化合价,如:C元素有+2,+4,-4价(在有机物中也可以有-3,-2,-1价);S元素有+4,+6,-2价;Cl元素有-1,+1,+3,+5,+7价;N元素有-3,+1,+2,+3,+4,+5价。
(4)元素的金属性和非金属性的周期性变化:电子层数相同,随着原子序数的递增,原子半径递减,核对核外电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强。
①.元素的金属性:指元素气态原子失去电子的能力。
元素金属性强弱判断的实验依据:a.金属单质跟水或酸反应置换出氢气的难易程度:越容易则金属性越强,反之,金属性越弱;b.最高价氧化物对应水化物的碱性强弱:最高价氢氧化物的碱性越强,这种金属元素金属性越强,反之,金属性越弱;c.金属单质间的置换反应例:比较1:①镁与2mL1mol/L 盐酸反应②铝与2mL1mol/L 盐酸反应32222l 6l 2l l 3g 2HCl MgCl H A HC A C H ↑↑+=+反应比较容易M +=+反应更加容易所以金属性:l Mg A > 比较2:⑴钠与水反应(回忆)⑵镁与水反应【实验5-1】2222222()22()Na H O NaOH H Mg H O Mg OH H ++↑++↑冷=碱性:2aOH Mg(OH)N >金属性:Na Mg Al >>②元素的非金属性:指元素气态原子得到电子的能力。
元素非金属性强弱判断的实验依据:a.非金属元素单质与氢气化合的难易程度及生成氢化物的稳定性强弱:如果元素的单质跟氢气化合生成气态氢化物容易且稳定,则证明这种元素的非金属性较强,反之,则非金属性较弱;b.最高价氧化物对应水化物的酸性强弱:酸性越强则对应的元素的非金属性越强;c.非金属单质间的置换反应非金属性:l r F C >>B >I对于同一周期非金属元素:如2i l S P S C 、、、等非金属单质与2H 反应渐趋容易,其气态氢化物的稳定性为:432i l S H PH H S HC <<<上述非金属元素最高价氧化物对应水化物的酸性强弱顺序为:2334244i l H S O H PO H SO HC O <<<非金属性:i l S P S C <<< 结论: a g l i l N M A S P S C金属性逐渐减弱,非金属性逐渐增强(5)元素周期律的实质:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
元素周期表和元素周期律

周 纵向
ⅠA到ⅦA
期 18个纵行 7个副族(仅由长周期元素组成的族)ⅠB到ⅦB
表
第VⅢ族(3个纵行,含Fe、Co、Ni等9种元素)
0族(稀有气体元素)
思考1 :16个族的排列顺序如何? 2个1到8
思考2 :族序数与原子核外电子数有什么关系?
思考3 :为什么第四、五、六周期元素种数较多?
ⅠA→ⅡA→ⅢB→……→ⅦB→……→Ⅷ→ⅠB →ⅡB→ ⅢA→……→ ⅦA→0
元素周期律和元素周期表
知识回顾:元素周期表的结构
七个横行七周期,三短三长一不全; 十八纵行十六族,七主七副八和零。
元
横向 7个周期
3个短周期(第1、2、3周期)元素种数2、8、8 3个长周期(第4、5、6周期)元素种数18、18、32 1个不完全周期(第7周期) 目前排有26种元素
素
7个主族(由短周期和长周期元素共同组成的族)
5s25p6
6 32
6s2
6s26p6
1、1-6周期元素外围电子排布
随着原子序数的递增,元素原子的外围电子排布呈周期
性的变化:每隔一定数目的原子,原子的外围电子排布 重复出现从ns1到ns2np6的周期性变化
一、原子核外电子排布的周期性变化
2、元素周期表的分区
按照元素原子的外围电子排布的特征,可将元素周期表 分成五个区域:s区、p区、d区、ds区、f区
(2)确定元素在化合物中的化合价。
(3)确定元素金属性、非金属性的强弱。
I1越大 则元素的非金属性越强 I1越小 则元素的金属性越强
三、元素电负性周期性变化
1、定义 用来衡量元素在化合物中吸引电子能力的物理量。 2、衡量标准 F-4.0
问题解决
元素周期律和元素周期表

周期序数 = 电子层数
现在使用的元素周期表:
2、族
IA 主族 7个
用罗马数字表示序数
零族 0 IIIA IVA VA VIA VIIA
IIA
副族
IIIB IVB VB VIB VIIB
7个
第八族
VIII IB IIB
1、主族 :7个:ⅠA、ⅡA、ⅢA、ⅣA、 ⅤA、ⅥA、ⅦA
2、副族 :7个,ⅠB、ⅡB、ⅢB、ⅣB、 ⅤB、ⅥB、ⅦB 3、Ⅷ族 : 第8、9、10三列
元素化合价与最外层电子数的关系:
最高正价=最外层电子数 最低负价=最外层电子数—8
最高正价+︱最低负价︱ =8
一、元素周期律:
随着原子序数的递增, 核外电子排布、原子半径、 化合价等元素的性质呈周期 性变化。
二、元素周期表
排布形式一
H He 形式二编排更合理。因为 He 的最外 Li Be B C N O F 层电子数虽然是两个,但已经达到 Na Mg Al Si P S Cl 稳定结构,性质与 Ne 、 Ar 相似。 排布形式二 H Li Be B C N O F Na Mg Al Si P S Cl Ne Ar He Ne Ar
4、 0族
: 第18列
主族序数=最外层电子数
课堂练习:
1、同周期元素,其原子结构相同之处是: A、最外层电子数 B、核电荷数 C、电子层数 D、核外电子数 2、周期表填空:
原子序数为17的元素的符号是
周期, 族。
,位于
0.14 0.12 0.1 0.08 0.06 0.04 0.02 0
0
5
10
原子序数
15
20
结论:随着原子序数的递 增,元素原子半径呈现周 期性变化。
化学元素周期表,元素周期律精读笔记

一.元素周期表1.原子序数=核电荷数=核内质子数=核外电子数2.主族元素最外层电子数=主族序数3.电子层数=周期序数4.碱金属元素:密度逐渐增大,熔沸点逐渐变大,自上而下反应越来越剧烈银白色金属,密度小,熔沸点低,导电导热性强5.判断元素金属性强弱的方法:单质与水(酸)反应置换出氢的难易程度最高价氧化物的水化物(氢氧化物)的碱性强弱单质间的置换6.卤族元素:密度逐渐增大,熔沸点逐渐升高与氢气反应剧烈程度越来越弱,生成氢化物稳定性渐弱7.判断元素非金属性强弱的方法:与氢气生成气态氢化物的难易程度以及氢化物的稳定性最高价氧化物的水化物的酸性单质间的置换8.质量数:核内所有质子和中子的相对质量取近似整数相加9.核素:具有一定数目质子和一定数目的中子的一种原子10.同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素天然稳定存在的同位素,无论是游离态还是化合态各同位素所占的原子个数百分比一般是不变的在相同状况下,各同位素的化学性质基本相同(几乎完全一样),物理性质有所不同12.原子相对原子质量=1个原子的质量/(1/12 C12的原子质量)13.原子的近似相对原子质量=质量数14.元素的相对原子质量=各同位素的相对原子质量的平均值= A·a%+B·b%…15.元素的近似相对原子质量=各同位素质量数的平均值= A·a%+B·b%…二.元素周期律1.K、L、M、N、O、P、Q(1,2,3,4,5,6,7,)层数越大,电子离核越远,其能量越高2.能量最低原理3.各电子层最多容纳电子数:2n^24.最外层不超过8,次外层18,倒数第三层325.原子半径:同周期主族元素,原子半径从左到右逐渐减小同主族元素,元素原子半径从上到下逐渐增大6.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的结果(实质)7.同一周期元素,电子层数相同,从左到右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强8.同一主族,自上而下,元素的金属性逐渐增强,非金属性逐渐减弱,最外层电子数相同,电子层数增多,原子半径增大9.最高正价=最外层电子数最低负价=8—最外层电子数10.各周期元素种类:2,8,8,18,32,3211.稀有气体原子序数;2,10,18,36,54,8612.同族上下相邻的原子序数差:2,8,18,3213.同周期IIA族与IIIA族原子序数相差:1,1,11,11,2514.电子层数不同,原子序数(核电荷数)均不同时,电子层数越多,半径越大15.电子层数相同,原子序数(核电荷数)不同时,原子序数(核电荷数)越大,半径越小16.电子层数,原子序数(核电荷数)均相同时,核外电子数越多,半径越大17.电子排布相同的离子,离子半径随核电荷数递增而减小选修三.原子结构与性质1.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.2.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.3.原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.4.洪特规则的特例:对于一个能级,当电子排布为充满、半充满或全空时,是比较稳定的5.元素电离能:第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。
1-2 元素周期律和周期表
性质
Na
Mg
Al
单质与水(或酸) 的反应情况
与冷水反应缓慢,与沸 与冷水剧烈反 与酸迅速反应放 水迅速反应,放出氢气, 应放出氢气 出氢气 与酸剧烈反应放出氢气
最高价氧化物对应 水化物的碱性强弱
NaOH 强碱
Mg(OH)2 中强碱
Al(OH)3 两性氢氧化物
金属性的强弱: Na > Mg > Al
内容 原子半径 电子层结构 失电子能力 得电子能力 金属性非金属性 主要化合价 同周期(从左到右) 同主族(从上到下) 大→小 电子层数相同、 最外层电子增多 逐渐减小 逐渐增大 小→大 电子层增多最外层 电子数相同 逐渐增大 逐渐减小
金属性减、非金属性增 金属性增、非金属性减
最高正价+1→+7 最高价氧化物对应的 碱性逐渐减弱 水化物酸碱性 酸性逐渐增强 形成:难→易 非金属元素气态氢 化物的形成与稳定性 稳定性:弱→强
元素性质呈周期性变化
归纳出
原子半径 大→小 (稀有气体元素突然增大)
化合价:+1→+7 -4→-1 (稀有气体元素为零)
元素周期律
3.微粒半径大小的判断规律 一层、二核、三电子
影响 半径 大小 的因素
①电子层数: 电子层数越多,原子半径越大 ②核电荷数: 当电子层数相同时核电荷数增多,使原子 半径有减小的趋向。 ③核外电子数: 电子数增多,增加了相互排斥,使原子 半径有增大的倾向。
最高正价=族系数 碱性逐渐增强 酸性逐渐减弱
形成:易→难 稳定性:强→弱
非金属性逐渐增强
ⅠA ⅡA
ⅢA ⅣA ⅤA
ⅥA ⅦA
0
1
2 3 4 5 6 7
金属性逐渐增强 金 属 性 逐 渐 增 强
高三化学元素周期律与元素周期表

1、元素周期表的结构
短周期:3个(第1、2、3周期)
周期
7个
长周期:4个(第4、5、6、周期,
周期表 (七个横行) 其中第7周期为不完全周期)
主族7个:ⅠA-ⅦA
族
16个 (共18个纵行)
副族7个:IB-ⅦB 第Ⅷ族1个(3个纵行) 零族(1个)稀有气体元素
A. 原子序数=核电核数=质子数=核外电子数 B. 周期序数=原子核外电子层数 C. 主族序数=原子的最外层电子数=元素最高价数
⑤ (d)
元素性质的递变规律
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
族
半径由大变小
1半
2径
3
由 小
4
变 大
5
6
7
非金属性逐渐增强
非
金
B
金
属
属
性
Al Si
性
逐
渐
Ge As
逐 渐
增 强
Sb Te
增 强
金属性逐渐增强
Po At
再见
网上订花 买花 订花 网上订花 买花 订花
A、非金属性强弱为:X>Y>Z
B、气态氢化物的稳定性由强到弱为X、Y、Z
C、原子半径大小是:X<Y<Z
D、对应阴离子的还原性按X、Y、Z顺序减弱
3.指出原子序数为5、17、20、35的元素的 位置在哪里?(用周期和族表示)
4.下列各组原子序数表示的两种元素,能形 成AB2型离子化合物的是( A )
7、 X、Y、Z为短周期三种元素,已知
X和Y同周期,Y和Z同主族,又知三种元 素原子最外层电子数总和为14,而质子数 总和为28,则三种元素为(D) (A)N、P、O (B)N、C、Si (C)B、Mg、Al (D)C、N、P
元素周期律

元素周期表
1.周期
元素周期表有7个横行,也就是7个周期。具有相 同的电子层数,而又按照原子序数递增的顺序排 列的一系列元素,称为一个周期。 周期的序数就是该周期原子具有的电子层数。 各周期里元素的数目不同,第一周期只有2个元 素,第二、第三周期各有8个元素。第四、五、 六、七周期元素都比8个元素多。第一、二、三 称为短周期,其余称长周期。
微粒半径大小比较的一般规律 1.先看电子层,电子层数越多,半径越大 2. 电子层数相同,看核电荷数,核电荷数越 大,半径越小。 3. 电子层数相同,核电荷数也相同,看最外 层电子数,电子数越多,半径越大。
四.元素主要化合价的周期变化
原子序数
元素名称
1
氢
2
氦
3
锂
4
铍
5
硼
6
碳
7
氮
第16号元素是硫也是非金属。它的最高价氧化物是 SO3,SO3对应的水化物是H2SO4。硫酸是一种强酸。在 加热时硫可以与氢气化合,生成气态氢化物硫化氢。
第17号元素氯也是非金属。它的最高价氧化物是Cl2O7, 对应的水化物是HClO4,它是已知酸中最强的酸。氯气与 氢气在光照或点燃时会发生爆炸而化合,生成气态氢化 物氯化氢。
一.核外电子 排布的周期性
部分元素原子 的电子层排布
通过上表可以发现,每隔一定数目的元素,会重复出 现原子最外层电子数从1个递增到8个的情况。也就是 说,随着原子序数的递增,元素原子的最外层电子呈 周期性的变化。
原子半径的周期性变化 同一周期内,从ⅠA到ⅦA(卤族)随着原子序数的递 增,原子半径由大变小。如Na原子的半径为: 1.86×10 -10米递减到0.99×10 -10米。 同一主族内,从上到下,随着元素电子层的增加,原 子半径增大。
17元素周期表和元素周期律

B. 元素周期表中从IIIB族到IIB族 10个纵行的元素都是 金属元素
C. 除氦外的稀有气体原子的最外层电子数都是8 D. 同一元素的各种同位素的物理性质、化学性质均相同
周期表中左右相邻两主族元素 原子序数间的关系
例:已知A为ⅡA元素,B为ⅢA元素,它们的原子序数 分别为 a、b ,若A、B为同一周期元素,则a和b的关系 如何?
七主七副零八族
主族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
共七个主族
副族:ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB
族
(纵向)
共七个副族
第VIII 族:包含三列(Fe,Co,Ni)
零族:稀有气体元素
同周期元素性质变化规律
族
IA IIA IIIA IVA VA VIA VIIA
煤油的密度(0.88g / cm3)还小,所以不能保存在煤油中,而通常 保存在液体石蜡中。 (4) 6C:最高正价与最低负价绝对值相等;最难形成离子。该元素 的一种单质—金钢石在天然物质中硬度最大。另一种单质— 石墨具有金属光泽且能导电但不是金属。形成化合物种类最多
的元素;气态氢化物中氢的质量分数最大的元素
根据元素原子序数推断元素在周期表中的位置
预备知识1:熟悉稀有气体的原子序数 He:2 Ne:10 Ar:18 Kr:36 Xe:54 Rn:86 预备知识2:熟悉元素周期表的结构 第1、2纵行为ⅠA、ⅡA; 第13-17纵行为ⅢA-ⅦA; 第18纵行为零族
若序数小于56,则序数减去比它小而相近的稀有气体的 原子序数,既得该元素所在的纵行数。 若序数大于56,则序数减去比它小而相近的稀有气体 的原子序数后,再减去14,既得该元素所在的纵行数。 周期数:相近的稀有原子所在周期数加1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第4周期:18 种元素 长周期 第5周期:18 种元素
第6周期:32 种元素
镧57La – 镥71Lu 共15 种元素称镧系元素
不完全周期 第7周期:26种元素
锕89Ac – 铹103Lr 共15 种元素称锕系元素
原子结构
相同点: 电子层数相同
最外层电子1-8 递变规律
原子半径逐渐减小
1869年门捷列夫在继承和分析了 前人工作的基础上,对大量实验 事实进行了订正、分析和概括, 成功地对元素进行了科学分类。 他总结出一条规律:元素(以及 由它所形成的单质和化合物)的 性质随着相对原子质量的递增而 呈现周期性的变化。这就是元素 周期。
他还预言了一些未知元素的性质 都得到了证实。但是由于时代的局 限,门捷列夫揭示的元素内在联系 的规律还是初步的,他未能认识到 形成元素性质周期性变化的根本原 因。
元素化合价
原子序数与最高正价和最低负价图
8
6
价 负4 低 最2 和 价0 正0 高 -2 最
-4
-6
5
10
15
20
原子序数
原子序数
化合价的变化
1~2
+1
0
3~10 +1 +5 -4 -1 0
11~18 +1 +7 -4 -1 0
结论:随着原子序数的递增,元素化合价呈现
周期性 变化。
思考: 化合价和原子结构的哪些因素有
把—最—外——层—电—子——数—相—同——的元素排成一个纵行
纵行
(He例外)
按——电—子—层——数—递—增——的顺序从上到下排成
二、周期表的结构
1、周期 种类
电子层数相同,原子序数递增
21
8 2 短周期
83
18 4
18 5 长周期
32 6
26 7 不完全周期
元素周期表的结构
周期 (行)
第1周期:2 种元素 短周期 第2周期:8 种元素
共七个副族
第VIII 族:三个纵行,位于 Ⅶ B 与ⅠB中间
零族: 稀有气体元素
原子结构
相同点: 最外层数电子相同
递变规律
电子层数增多 原子半径增大
主族序数 = 最外层电子数=最高正价
短周期(第—1.—2—.3— 周期)
周期—7—个(共—7—个横行) 长周期(第—4—.5—.6—周期)
元
素
不完全周期(第——7—— 周期)
粒子半径
电子层数 核电荷数 核外电子数
1.当电子层数及核电荷数均不相同时,电子层数越多, 半径越大。
2.当电子层数相同,核电荷数不相同时,核电荷数越大, 半径越小。
3.当电子层数相同,核电荷数相同时,最外层电子数目越多, 半径越大
【课堂练习】
1.下列化合物中阳离子半径与阴离子半径比值最小
的是(B )
都是金属元素,统称作过渡金属。
周
期 表
主族——7—— 个,用—A—字母表示
副族——7—— 个,用—B—字母表示
族—16—个(共—1—8个纵行) 第Ⅷ族——1—— 个,包括—3—纵行
—0—族1个(稀有气体)
元素周期表的结构:
七个周期分长短; 三短、三长、一不全。 十八纵行十六族; 七主 、 七副 、 VIII与 0。
思考题
观察元素周期表中,从Ⅲ B到ⅡB之间的元素之 间存在哪些共同特征?
原子序数与原子半径折线图
0.2
0.18
0.16
(/nm)
0.14 0.12
径 0.1
半 子
0.08
原 0.06
0.04
0.02
0
0
5
10
15
20
原子序数
原子序数
原子半径的变化
3~9
逐渐减小
11~17
逐渐减小
结论:随着原子序数的递增,元素原子半 径呈现 周期性 变化。
思考题:
粒子半径的大小与哪些因素有关? 怎样根据粒子结构示意图来判断原子 半径和简单离子半径 的大小呢?
6
层 外
4
最
2
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 原子序数
原子序数
电子层数
最外层电 子数
达到稳定结构 时的最外层电
子数
1~2
1
12
2
3~10
2
18
8
11~18
3
18
8
结论:随着原子序数的递增,元素原子的最外层电子
排布呈现 周期性 变化。
原子半径
关?
最高正价=最外层电子数 负价=最外层电子数- 8
1.在水溶液中: YO3n-+3S2-+6H+=Y-+3S +3H 2O
(1)YO3n-中Y元素的化合价是:
+5
(2)Y元素原子的最外层电子数是: 7
(3)比较S2-和Y-的还原性:S2- 〉Y-
2.元素R的最高价含氧酸的化学式为 HnRO 2n-2,
则在气态氢化物中 R元素的化合价为( A )
A.12-3n B. 3n-12 C.4-3n D.3n-4
随着原子序数 的递增,核外
电子排布、原子半径、化合价等 元素的性质呈周期性变化。
这个规律叫元素周期律。
元素性质的周期性变化是核外电子排布周期 性变化的必然结果
元素周期表
The Periodic Table of Elements
第二节ቤተ መጻሕፍቲ ባይዱ
元素周期律和元素周期表
现在使用的元素周期表:
原子序数:
不同的元素具有不同的核电荷数即质子数。 为了研究方便,我们把不同的元素按核电荷数 由小到大的顺序对其进行编号,这种编号又叫 原子序数。
原子序数 = 核电荷数(质子数)
1-18号元素核外电子排布
原子序数与最外层电子数直方图
10
数8
子 电
周期序数 = 电子层数
2、族
IA 主族 7个
IIA
用罗马数字表示序数
零族 0 IIIA IVA VA VIAVIIA
副族 7个 第八族
IIIB IVB VB VIB VIIB VIII IB IIB
元素周期表的结构
族 (列)
主族:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
共七个主族
副族:ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB
门捷列夫的元素周期表
形式多样的周期表
螺旋型周期表
现在使用的元素周期表:
这么多种元素,是按 照怎样的规律排布在
周期表中的呢?
一、周期表的编排原则
1.
编制的依据:
元素周期律
——————————
把—电——子—层—数——相—同——的元素排成一个横行 横行
按—原——子—序—数——递—增——的顺序从左到右排列
A.NaF B.MgI 2 C.BaI2 D.KBr
2.下列各组微粒半径大小比较中,不正确的是( B )
A. r(K) > r(Na) > r(Li) B. r(Mg 2+) > r(Na +) > r(F -) C. r(Na+) > r(Mg2+) > r(Al3+) D. R(Cl -) > r(F-) > r(F)
