纯化水运行确认(OQ)
工艺纯化水验证确认方案

工艺纯化水验证确认方案1. 概述1.1我公司的制水系统由机械过滤器、活性碳过滤器、软化过滤器、反渗透装置、精密过滤器、紫外线灭菌器、微孔过滤器、纯化水箱及不锈钢输水管道等组成,生产能力为1T/h。
1.2 工艺流程图城市自来水→增压泵→机械过滤器→活性炭过滤器→软化过滤器→精密过滤器→一级反渗透泵→一级反渗透膜→→纯化水箱→紫外线灭菌器→纯化水泵→终端微孔过滤器→纯化水使用点EDI超滤→注射用水使用点1.3用途纯化水主要用于器具、工作服、纯化水箱、洁净室、工作台面的清洗及挤出过程的冷却水和配制消毒液,注射用水主要用于末道精洗、试剂配制等。
2. 确认目的为确认我公司工艺用水系统能正常运行, 其生产工艺符合设计要求,设备各项性能指标稳定,不发生漂移,保证能生产出质量合格、稳定的工艺用水,特制订本确认方案,对工艺用水系统进行确认。
确认过程应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应报管理者代表批准。
3. 确认范围本确认方案适用于我公司工艺用水系统的确认。
3.1检查确认本系统设计方案是否符合规定要求。
3.2根据生产要求,确认水处理设备和管道系统安装是否合理,检查仪表校验的情况及操作、维修规程的编写情况。
3.3在所有的水处理设备均开动的情况下,检测系统操作参数,检查确认系统是否能达到设计要求及工艺要求,并预先测试水质(理化指标和微生物指标)。
3.4系统按照设计要求正常运行后,进行周期取样测试水质是否符合中国药典年版规定标准(理化指标和微生物指标)。
4. 确认计划与人员职责公司成立专门确认工作小组,负责该确认项目确认方案的起草、实施、组织与协调,负责确认结果记录与评定,负责完成确认报告。
4.1 确认计划:工艺用水系统计划确认结束。
4.2 确认工作小组人员职责。
纯化水系统运行确认OQ

Table of content:目录1.Purpose/目的2.Scope & Responsibility/范围和职责3.Pre-requirements before starting OQ/条件4.OQprocedure/程序5.Acceptance criteria/接受标准6.Documentation/文件7.Calibration/校验8.List of inspections and tests/检查测试项目表9.Identification of involved personnel/有关人员确定10.Pending list/待处理项目1. 目的OQ计划用于按照确认计划执行验证。
OQ可证明本设备能在预定的运行参数和范围内运行。
2. 责任和范围本验证计划用于纯化水系统(设备编号:)。
生产部负责OQ的执行。
3. 条件∙IQ符合要求,批准进行OQ。
∙OQ计划已批准。
∙OQ方案已批准。
4. 程序按第8条所列的项目检测。
检测须记录并有责任人签名。
5. 接受标准用“是”或“否”判定或根据检测结果的值判定。
如检测的结果不符合要求,须重复验证至符合为止。
6. 文件7. 校验8. 检查测试项目表9. 有关人员的确定所有有关人员应在在下表签名。
10. 待处理项目所有待处理项目和偏差许须在附件1“待处理项目或偏差清单”中记录并归档。
待处理项目或偏差清单1.Approval for carrying out OQ/批准执行OQ2.Documentation/文件3.Calibration/校验4.List of inspections and tests items/检查和测试项目表5.Identification of involved personnel/参与人员确认6.Pending list/待处理项目单1. 批准执行OQ2. 文件3. 校验4. 检查测试项目表5. 有关人员确认6. 待处理项目或偏差清单所有待处理项目和偏差须记录在下表中。
纯化水制备系统运行确认方案

纯化水制备系统运行确认方案纯化水制备系统是实验室中常用的设备,在实验室工作中具有重要作用。
为保证纯化水制备系统的正常运行和安全性,需要进行运行确认方案的制定和实施。
本文将从设备检查、参数调整、性能测试和工作记录等方面介绍纯化水制备系统的运行确认方案。
设备检查1.确保供电正常:检查电源线是否连接稳固,电源插座是否正常工作,避免供电不稳定带来设备故障或损坏。
2.检查设备连接:检查纯化水制备系统的各个组件之间的连接是否牢固,如水管、电缆等,避免因连接不良导致水质受到污染或设备无法正常工作。
3.检查滤芯和耗材:检查滤芯和耗材的使用寿命和状态,确保滤芯和耗材的更换及时,避免因滤材过期或损坏而影响水质净化效果。
4.清洁消毒处理:根据设备的清洁和消毒要求,对设备的各个部件进行清洁和消毒处理,防止细菌、病毒等引起的污染。
参数调整1.设定水质要求:根据实验室工作的需要,设定合适的水质要求,如电阻率、导电率、溶解氧等。
根据要求调整设备的工作参数,确保制备出的纯化水符合要求。
2.控制流量:根据设备的流量要求,调整进水和出水的流量大小,避免因流量过大或过小而导致设备工作不稳定或水质净化效果不理想。
3.控制温度:根据设备的工作温度要求,调整加热或冷却设备的温度,确保设备在适宜的温度范围内工作,避免因温度过高或过低导致设备故障或水质受到污染。
性能测试1.电阻率测试:使用电阻率仪对制备出的纯化水进行测试,确保其电阻率符合设定的要求,验证设备的除盐效果。
2.pH值测试:使用pH计对纯化水的pH值进行测试,确保其酸碱度符合设定的要求,验证设备的酸碱调节效果。
3.溶解氧测试:使用溶解氧测定仪对纯化水中的溶解氧含量进行测试,确保其溶解氧含量符合设定的要求,验证设备的氧气消除效果。
4.细菌培养实验:使用纯化水制备系统制备的纯化水进行细菌培养实验,观察细菌是否能够生长并判断制备出的纯化水是否具有良好的杀菌效果。
工作记录1.运行记录:在每次使用纯化水制备系统之前和之后,记录运行时间、制备水量、水质参数等信息,以便后续的设备运行和质量管理分析。
GMP 制水运行验证方案 -OQ
制水系统验证运行确认OQ本验证方案由下述人员起草:本验证方案由下述人员审核:目录1、验证目的2、验证范围3、设备运行验证的标准4、设备运行确认(OQ)5、偏差分析6、验证结论7、再验证1、验证目的根据工艺需求和用量恒算,并为了确认纯化水系统能够正常运行,设备各项性能指标符合设计要求,纯化水水质符合2010版中国药典及本公司内控质量标准,能保证生产出质量合格、稳定的工艺用水,特制订本确认方案,对纯化水系统进行确认。
只有在顺利地执行安装确认并获得通过后,才能开始进行运行确认。
确认过程应严格按照本方案规定的内容进行,如出现异常情况,应在调查报告中如实体现并有处理措施。
确认该系统的各种仪器仪表是否经过校正,并是否校正合格。
确认该系统的各种控制功能是否符合设计要求。
检查该系统设备的文件资料是否齐全,是否符合GMP要求。
2、验证范围检查系统的试运行情况,确认系统试运行稳定,检查运行数据符合功能设计要求,满足方案规定。
3、设备运行验证的标准3.1所有设备全自动运行;3.2系统运行仪表应包括:一级反渗透电导率仪、二级反渗透电导率仪、纯水温度计、脓水流量计、纯水流量计、原水压力表、保安过滤器压力表、一级反渗透入口压力表、二级反渗透入口压力表、一级反渗透脓水压力表、二级反渗透脓水压力表,各仪表工作状态均正常;3.3各指示灯显示正常;3.4电导率仪、温度表、流量计、压力表均应经过校准,并有校准报告;3.5各仪表性能满足使用要求。
4、设备运行确认(OQ)在通水加压的条件下,检查所有的工艺管道与控制点是否与工艺流程图相符、配置合理;检查各个容器、管道、管件的密封情况与各类泵的运行工况是否符合设计要求,有无泄漏现象:系统的各项功能是否达到采购所确定的技术要求,并符合药品生产质量管理规范(GMP)相关规定。
将所有能证明系统或设备功能的信息、数据记录在案。
(1)系统运行可实现自动控制,各项技术指标符合设计要求。
(2)出水指标符合《中国药典》2010版纯化水质量标准。
纯化水运行确认OQ系统资料汇编

2016年纯化水运行确认OQ系统资料汇编【最新资料,WORD文档,可编辑】目录页码1.简介 (3)2.目的 (4)3.范围 (4)4.文件归档 (4)5.教育培训 (4)6.确认内容/清单 (4)7.运行确认总体评价 (4)8.再确认周期 (5)9.变更清单 (5)10.测试打印文件/乙方测试文件清单 (5)1.1 简介生产服务部动力一车间2号纯化水系统采用二级反渗透制水方式制取纯化水,系统主要由预处理、反渗透和纯化水供水循环系统组成。
设备信息:该系统用于因2015年8月对系统进行检修,对循环系统进行消毒。
为了验证系统能提供合格稳定的纯化水,现对该系统进行运行确认,以检查设备运行参数的波动情况、仪表的可靠性及设备运行的稳定性。
1.2依据法规及标准.《药品生产质量管理规范(2010年修订)》;《药品生产质量管理规范(2010年修订)》附录《确认与验证》(2015年第54号);《药品生产验证指南》(2003)国家食品药品监督管理局药品安全监管司、药品认证管理中心组织编写,化学工业出版社,2003.5;《中国药典》2010版《药品GMP指南》国家食品药品监督管理局药品认证管理中心编写,中国医药科技出版社,2011.8;1.2.2行业标准ISO 316L:国际标准化组织卫生级316L不锈钢标准ISO 304:国际标准化组织卫生级304不锈钢标准TSGR004-2009 固定式压力容器安全技术监察规程CJ/T 168-2002 ?纯水机GB50235-2010工业金属管道工程施工规范国家生活饮用水卫生标准 GB5749-2006该纯化水系统的运行确认是为了确保设备能在要求范围内正确运行并达到规定的技术指标,保证该纯化水系统运行正常,并能提供合格的纯化水。
3.范围本运行确认适用于生产服务部2号纯化水系统。
4.文件归档文件的存档存于生产服务部2号纯化水站运行确认系统资料夹中。
5.教育培训5.1为确保该系统操作运行的正确性,对设备操作人员进行的操作培训。
纯化水系统运行确认方案

Operation QualificationProtocol运行确认方案年月日1.1修订历史:目录1.0 组织----------------------------------------------------------------------------------42.0 目的范围----------------------------------------------------------------------------43.0 职责----------------------------------------------------------------------------------44.0 验证方法----------------------------------------------------------------------------55.0 验证小组表-------------------------------------------------------------------------86.0 运行确认----------------------------------------------------------------------------8 6.1 文件------------------------------------------------------------------------------------------------8 6.2 设备运行确认-----------------------------------------------------------------------------------126.3 运行确认偏差/缺陷-----------------------------------------------------------------------------217.0 验收标准---------------------------------------------------------------------------21 7.1 文件-----------------------------------------------------------------------------------------------21 7.2 设备-----------------------------------------------------------------------------------------------227.3 偏差/缺陷----------------------------------------------------------------------------------------228.0 运行确认偏差/缺陷--------------------------------------------------------------22 1.0 组织:此文件内容主要涉及对纯化水系统运行的描述,定义运行确认的验收标准和其它的要求。
纯化水设备系统4Q验证资料
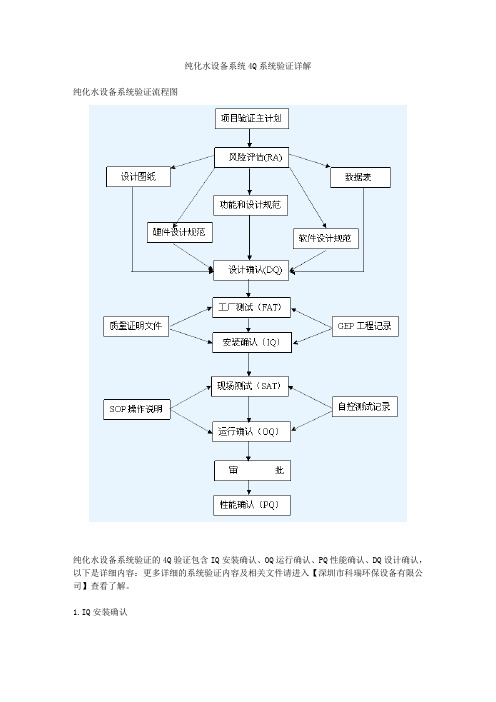
纯化水设备系统4Q系统验证详解纯化水设备系统验证流程图纯化水设备系统验证的4Q验证包含IQ安装确认、OQ运行确认、PQ性能确认、DQ设计确认,以下是详细内容:更多详细的系统验证内容及相关文件请进入【深圳市科瑞环保设备有限公司】查看了解。
1.IQ安装确认安装确认(IQ)主要是通过设备安装后,确认设备安装符合设计要求,文件及附件齐全,通过检验并用文件的形式证明设备的存在。
也就是说,通过检查文件和其它项目,来确认设备和系统是按照设计安装的,并符合设备和系统设计要求和标准,并且已经正确地安装了。
IQ安装确认包括包装确认设备清单安装过程确认材料确认(与产品直接接触的)仪器部分确认润滑剂确认(与产品接触的润滑剂必须是食品级的)各种技术图纸及操作指南确认公用系统确认2.DQ设计确认设计确认(DQ)在《药品生产验证指南》中明确解释为“预确认,即设计确认,通常指对待订购设备技术指标适应性的审查及对供应厂商的选定。
”同时,在《药品生产质量管理规范实施指南》中认为“预确认:是对设备的设计与选型的确认DQ设计确认包括对设备的性能、材质、结构、零件、计量仪表和供应商等的确认PID图确认GAD图确认部件清单电路图3.OQ运行确认运行确认(OQ)是通过空载运行实验,检查和测试设备运行、操作和控制性能通过记录并以文件形式证实制药机械(设备)符合生产工艺的要求。
在安装确认后有设备的制造方和使用方共同根据验证方案进行运行确认,对设备运行性能的符合性、协调性进行确认。
OQ运行确认包括测试仪器校准设备/系统各部分功能测试指示器,互锁装置和安全控制检测报警器检测断电和修复4.PQ性能确认性能确认(PQ)性能确认是对设备实际运行效果的确认,性能确认应在完成运行确认并已得到认可后进行。
是在制药套工艺技术指导下进行工业性负载生产,用模拟生产的方法,通过观察、记录、取样检测等手段,搜集及分析数据证明制药机械(设备)运行的可靠性和对生产的适应性。
纯化水运行确认(OQ)

目录页码1.简介 (3)2.目的 (4)3.范围 (4)4.文件归档 (4)5.教育培训 (4)6.确认内容/清单 (4)7.运行确认总体评价 (4)8.再确认周期 (5)9.变更清单 (5)10.测试打印文件/乙方测试文件清单 (5)1.1 简介生产服务部动力一车间2号纯化水系统采用二级反渗透制水方式制取纯化水,系统主要由预处理、反渗透和纯化水供水循环系统组成。
设备信息:安装位置:该系统用于因2015年8月对系统进行检修,对循环系统进行消毒。
为了验证系统能提供合格稳定的纯化水,现对该系统进行运行确认,以检查设备运行参数的波动情况、仪表的可靠性及设备运行的稳定性。
1.2依据法规及标准.1.2.1法规《药品生产质量管理规范(2010年修订)》;《药品生产质量管理规范(2010年修订)》附录《确认与验证》(2015年第54号);《药品生产验证指南》(2003)国家食品药品监督管理局药品安全监管司、药品认证管理中心组织编写,化学工业出版社,2003.5;《中国药典》2010版《药品GMP指南》国家食品药品监督管理局药品认证管理中心编写,中国医药科技出版社,2011.8;1.2.2行业标准ISO 316L:国际标准化组织卫生级316L不锈钢标准ISO 304:国际标准化组织卫生级304不锈钢标准TSGR004-2009 固定式压力容器安全技术监察规程CJ/T 168-2002 纯水机GB50235-2010工业金属管道工程施工规范国家生活饮用水卫生标准 GB5749-20062.目的该纯化水系统的运行确认是为了确保设备能在要求范围内正确运行并达到规定的技术指标,保证该纯化水系统运行正常,并能提供合格的纯化水。
本运行确认适用于生产服务部2号纯化水系统。
4.文件归档文件的存档存于生产服务部2号纯化水站运行确认系统资料夹中。
5.教育培训5.1为确保该系统操作运行的正确性,对设备操作人员进行的操作培训。
5.2为确保设备维护检查工作的正确性,对专业技术人员进行的培训。
纯化水 性能确认

10T/h纯化水制取系统性能确认(PQ)草案执行前的批准编制签名日期审核签名日期审核签名日期审核签名日期审核签名日期审核签名日期审核签名日期批准签名日期1.目的性能确认的目的是建立和进行备有文件记录的测试,以证明纯化水的水质符合《中国药典》(2010版)和企业标准关于纯化水各项指标的要求。
2.范围本性能确认的范围为水针车间纯化水制备系统。
3.参考文件清单为了编写本方案,使用了下列参考文件:(SFDA) Good Manufacturing Practice, revised in 1998(SFDA) 1998年版GMP(ISPE)新建和改造的工厂医药工程指南,第4卷-水和蒸汽系统欧洲药典6.1版美国药典32版中国药典2010版1. 术语及缩写2. 系统描述水针车间中纯化水使用点共个,清单如下:3. PQ执行的三个阶段纯化水系统性能确认共分三个阶段,第一阶段共两周时间,按照中国药典2010版和企业标准的纯化水项目进行全项检测。
第二阶段共一个月时间,每天取样。
每周一次按照中国药典2010版和企业标准的纯化水项目进行全项检测。
第三阶段共一年时间,所有用水点每周按照中国药典和企业标准的纯化水项目进行全项检测,直至第三阶段完成。
4. 取样程序从微生物学角度来考虑,采样程序应该遵循以下原则:●准备无菌取样瓶,取样瓶须从化验室取得,并经适宜的灭菌处理且运输途中应有保护性包裹确保瓶子不被污染。
●取样阀门全压排放3分半钟。
在取样时,为保证样品不溢出允许使用导流管等辅助材料。
●在充分打开阀门排放约3分半钟之后,调节阀门降低到合理的流速(不少于50%全流速)。
再继续排放约3分钟。
●移开所有导流管等辅助材料。
●打开取样瓶,操作人员必须屏住呼吸、不能说话。
不能触摸盖子里面和取样瓶的瓶口处。
●取完样后,必须马上盖上瓶盖/包扎瓶口。
●样品应贴上标签,采取适当的保护措施,并在尽可能短的时间内送QC实验室,如果可能QC应在3小时内对样品进行检测。
新版纯化水系统安装、运行确认方案

XXX产品纯化水系统安装运行确认方案IQ and OQ Protocol for purified water system of XXX workshop编号(Number):_______________起草(Prepared by Workshop):审核(Reviewed by Workshop):审核(Reviewed by M&UMD):审核(Reviewed by QA):批准(Reviewed by M&UMD):批准(Approved by QA):山东新华制药股份有限公司Shandong Xinhua Pharmaceutical Company Limited目录CONTENTS1、确认目的和范围2、验证组织及职责3、系统概述4、安装确认方案(IQ):5.纯化水系统的运行确认:6、纯化水系统运行确认结论:7、验证用检测仪器8、相关规程及人员培训:l、确认目的和范围为了满足XXX产品的生产需要,在XXX车间XXX需新安装一套纯化水系统,为了确保本纯化水系统的安装、运行符合预期目的,特进行本确认。
本确认适用于XX产品纯化水系统的安装运行确认。
2、验证组织及职责3、系统概述3.1 设计要求,质量标准3.1.1 设计依据:(1). GB12075-1989、GB/ T14976-1994。
(2). 《洁净厂房设计规范》GB50073-2001(3). 建筑专业提供的建筑平面图、剖面图。
工艺专业提供的设备平面布置图及技术要求。
3.1.2 设计标准(1).纯化水罐内外表面要求抛光处理,要求抛光度为:R=0.25~0.65μm,纯化水管安装前做脱脂处理。
(2) .管道内部应做抛光处理,要求抛光度为:R=0.25~0.65μm,纯化水管安装前做脱脂处理。
(3) . 纯化水的输送是采用单泵闭路循环供给,输送管道均选用卫生级薄壁(316L)不锈钢管道。
(4) . 纯化水管选用卫生级薄壁(316L),快装或氩弧焊连接。
3-OQ 设备运行确认方案

TABLE OF CONTENTS目录1.0 SCOPE:范围 (4)2.0Responsibilities 责任 (5)3.0System Description 系统描述 (6)3.1Specifications 说明 (9)3.2Pretreatment System预处理系统 (9)3.3RO Feed Pump原水泵 (9)3.4Multi-meadia Filter多介质过滤器 (9)3.5Carbon Filter活性炭过滤器 (9)3.6 PH Correction Dosing System:PH校正装置 (10)3.7Precise Filter精密过滤器 (10)3.8Reverse Osmosis High Pressure Pump RO高压泵 (10)3.9Reverse Osmosis System(RO):反渗透系统(RO) (11)3.11Control System: 控制系统 (11)4.0Safety Aspects安全方面 (12)5.0 Operation In Hazard Situation紧急状态下的操作 (14)6.0Data Collection For The Qualification:运行确认数据采集 (15)6.1Qualification Protocal Report确认草案报告 (15)6.2Identification Of Persons Performing The OQ 执行OQ人员确认 (15)6.3 Corrections 校正 (15)6.4Appropriate Response适当回复 (15)6.5Completation Of TablesS完成表格 (15)7.0Validation Requirmnets:确认要求 (17)7.1OQ Reqirements OQ要求 (17)7.2Training of Personnel on SOPs SOP人员培训 (18)7.3QualificationTest Sheets:确认测试单 (18)8.0 Operational Qualification Tests 运行确认测试 (20)8.1Standard Operating Procedures标准操作程序 (21)8.2Utilities parameters qualification 仪表参数确认 (23)8.3RO Operating Parameters Vertification RO 操作参数确认 (25)8.4RO Operational Interlocks Verification RO 操作联动装置确认 (29)8.5Verification Of Alarms 报警确认 (29)8.6Power And Communications Failure Recovery Verification电源和通讯故障恢复确认 (30)8.7Emergency Operating Verification紧急操作确认 (36)8.8I/O verification I/O确认 (38)8.9Pressure Hold Test 保压测试 (39)8.10 Functional verification 功能测试 (41)8.11Operational Qualification Tests Status操作确认测试状态 (44)9.0 Change Parts/Auxiliary Equipment 变化部分/附加设备 (46)10.0Modification To Any Items Or Design 设计项目变更 (49)11.0Deviation偏差记录 (50)1.0 SCOPE:范围The purpose of Operational Qualification Protocal is to provide documented evidence that the purified water production plant operates in accordance with functional specifications and to confirm that is meets acceptance criteria for crritical operational parameters.操作确认草案的目的是为生产的纯水做文件证明,生产过程操作符合功能说明并满足严格运行参数的验收标准。
纯化水储存和分配系统运行确认(OQ)方案

验证方案编号:SOP-XXX-XXX 纯化水储存和分配系统OQ验证方案目录1.目的 (4)2.验证范围 (4)3.职责 (4)3.1.供应商的职责 (4)3.2.客户的职责 (4)4.文件管理规范 (4)5.参考文件清单 (5)6.系统描述 (6)7.OQ实施 (8)7.1先决条件 (8)7.2仪器校准确认 (9)7.3人机界面确认 (11)7.4运行功能确认 (13)7.5报警和联锁确认 (17)7.6生产参数确认 (18)7.7峰流量确认 (22)7.8消毒过程确认 (24)8.人员确认 (27)9.偏差处理 (30)10.验证报告 (33)11.再验证周期 (36)12.执行的审核和批准 (36)验证方案的起草与审批验证小组成员组长:设备工程部:组员:验证方案的起草验证方案的审批验证方案的批准1. 目的本运行确认是为了确认XXX制药有限公司新建项目纯化水储存和分配系统的运行是否符合设计标准和用户工艺要求。
本方案规定了运行确认的内容、测试方法和测试表格。
2. 验证范围本运行确认的范围为XXX新建项目纯化水系统分配系统,不包括制备系统。
纯化水储存与分配系统主要由纯化水贮罐、分配泵、分配管道、温度传感器(换热器前后)、换热器、控制阀门、流量计组成。
本文件不适用于年度再验证活动。
3. 职责3.1. 供应商的职责➢OQ方案编写➢OQ实施和数据的收集➢准备偏差报告和解决偏差的建议➢如果出现偏差,与客户某个授权的人员进行协调➢最终报告的编写3.2. 客户的职责➢执行前审核和批准本方案➢针对不符合项界定解决方法➢审核和批准最终报告4. 文件管理规范4.1记录用笔使用蓝色圆珠笔记录。
4.2签名:被授权的人员才能签署文件。
签全名,除非文件另有规定。
签名应始终一致。
4.3填写栏目所有栏目必须填写。
填写内容与上面栏目相同也应重新填写。
填写栏目内容,应按照实际测试情况,对测试结果使用对勾“√”填写,只能选择一种测试结果填写。
纯化水系统操作确认OQ(中英文).doc

EXECUTION APPROVAL SIGNATURES批准执行签名The signatures below indicate approval of this protocol and its attachments and indicate that it is ready for execution. Any changes or modifications to the intent or the acceptance criteria of this protocol, following approval, requires the generation of an amendment which must be approved prior to execution.下面的签名表示批准本文件及其附件,且表明已经为执行作好了准备。
在批准后,对本文件的目的或验收标准目录1.0SCOPE 范围........................................................................................................................... 错误!未定义书签。
2.0PURPOSE 目的...................................................................................................................... 错误!未定义书签。
3.0BACKGROUND 背景 ........................................................................................................... 错误!未定义书签。
制药用纯化水系统水过GMP认证资料要求

制药用纯化水水系统GMP验证资料制药用水系统的验证,是为了证实整个工艺用水系统能够按照设计的目的进行生产和可靠操作的过程。
验证工作需要从设计阶段就开始,通过监按建造、使用过程,收集和组织相关的文件资料,最终形成完善的验证文件。
通常,工艺用水系统的验证程序分为三个方面,即确认系统中采用的所有关键的硬件和软件安装是否符合原定的要求(IQ);确认工艺用水系统中使用的设备或系统的操作是否能够满足原定的要求(OQ);确认工艺用水系统采用的工艺是否能够按照原定的要求正常的运转(PQ)。
1 验证的准备在针对一个指定的工艺用水系统,进行验证以前应该做好验证前的准备工作,包括下述使用文件所规定的有关内容。
使用文件是由建造工艺用水系统的工程公司、设备制造厂、使用者共同制作的。
要求这些文件必须以合适的形式组织起来,更便于接受药政管理部门(SDA、FDA等)的检查和批准。
系统的使用测试和文件将满足多种资格要求。
使用文件包括以下六个方面。
(1)文件清单①系统内设备,包括设备出厂标签号、生产厂商、样品序号和设备尺寸大小;②PC/PLC/DOS/WINDOWS输入,输出和警告;③阀门,包括标签号、位置、类型、尺寸;④关镀的和非关键的设施,包括标签号、位置、类型、作用/目的、范围和测定日期;⑤管道,包括节段号、类型、尺寸和完成情况;⑥滤膜,包括标签号、位置、品种、尺寸、制造用的材料、生产商、型号和孔径大小;⑦工艺过程和配套公用工程,包括系统名、提供压力、温度和所需电力;⑧采购、安装合同中所需的原材料;⑨零部件清单;⑩标准操作程序(适用于系统设备的操作、维护、测定,运行管理)。
(2)工厂测试程序①设备测试程序,测定程序和数据表;②压力测试,PLC/PC测试;③安全检查,制动设备的操作测试步骤。
(3)焊接文件①焊接管道材料的质量保证书,材料成分报告书;②焊工证书确认,焊接质量的检查记录;③焊接设备合格证书,焊接口抽样检查的百分比;④焊接记录,焊接检查百分比;⑤焊接程序,焊接检查证书和仓储。
纯化水运行确认OQ-中文
纯化水机组运行确认方案系统编号:目录文件批准 (1)文件控制 (1)1.目的 (1)2.范围 (1)3.职责 (1)4.法规和指南 (1)5.缩略语 (1)6.系统描述 (2)7. 文件管理规范 (2)8.测试列表 (3)9.人员确认 (3)10.测试程序 (3)10.1先决条件 (3)10.2检查 (4)10.3测试用仪器仪表校验检查 (5)10.4系统访问 (6)10.5断电测试 (7)10.6紧急停机测试 (8)10.7报警测试 (9)11.偏差报告 (10)12.变更控制 (10)1. 目的本运行确认方案的目的是为了确认江苏奥科生物科技有限公司纯化水机组是按照设计运行,稳定可靠,符合GMP要求。
运行确认的测试和检查的结果将按照该验证方案进行记录。
2. 范围本方案确定了江苏奥科生物科技有限公司纯化水机组的运行确认。
3. 职责BYRH的职责:➢编写OQ方案,并根据本OQ方案开展OQ工作;➢收集相关的基础技术资料;➢记录在OQ过程中发生的偏差;➢针对偏差提出解决方案;➢提交OQ测试记录和报告,以供用户进行审核和批准。
江苏奥科生物科技有限公司的职责:➢审核和批准OQ方案和报告;➢提供OQ编写和测试所必须的基础技术文件➢审核OQ过程中发生的偏差,批准偏差的解决方案,以及采取纠正行动。
➢如果需要时,提供必要的人员协助进行系统或设备的运行和测试。
4. 法规和指南本运行运行确认参考了以下标准和指南:➢(SFDA) 2010年版GMP➢EudraLex-卷4 GMP指南➢(ISPE)新建和改造的工厂医药工程指南,第4卷-纯化水系统➢欧盟GMP的附录15-验证和确认➢ISPE指南5“调试和确认” 2001年第一版➢良好的自动化制造规范55. 缩略语6. 系统描述纯化水机组的供水是由生活用水系统提供。
7. 文件管理规范记录用笔:- 使用不消退的墨水笔和记号笔,推荐使用蓝色笔记录、签名:- 被授权的人员才能签署文件- 应签全名,除非文件另有规定- .签名应该是可辨认的- .签名应始终一致填写栏目:- 所有栏目必须填写- 填写内容与上面栏目相同应重新填写- 若有单个栏目不需要填入内容,则在空白处填写英文字母“不适用”的简写“N/A”,以表示无此项内容。
纯化水系统验证方案及报告

甘肃大得利制药厂25m³/h(25℃)医药纯化水处置工程由西安胜泰华工科技设计、制造、安装、调试。
在该系统中,采纳了双级反渗透技术,保证最终出水的水质符合要求。
预处置+双级反渗透原水→原水箱→原水泵→絮凝剂加入系统→多介质过滤器→活性炭过滤器→阻垢剂加入系统→周密过滤器→一级高压泵→一级RO装置→中间水箱→PH调剂→二级高压泵→二级RO装置→紫外杀菌器→周密过滤器→纯水箱→纯水泵2.验证目的检查并确认该纯化水系统设备所用材质、设计、制造均符合工艺生产用水和GMP 要求;检查并确认管路分派系统的安装符合GMP要求;检查并确认设备的安装符合生产工艺要求、公用工程系统配套齐全且符合设计要求;确认该系统设备的各类仪器仪表通过效正且合格;确认该系统设备在稳固的操作范围内能稳固的运行且能达到设计标准,确认系统生产的水质能达到质量标准,为设备维修、改造和再验证提供数据资料。
3.验证范围适用于双极反渗透制水系统的验证,本验证方案包括安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
4.验证职责验证小组职责:制定验证方案;负责验证方案的实施及搜集各项验证、实验记录,对验证结果进行分析、评判并形成验证报告,报验证小组审批;并依照验证情形,拟订纯化水系统日常监测项目及验证周期,报验证委员会审核;发放验证证书。
工程部:负责设备的安装、调试,并做好相应的记录;成立设备档案;负责仪器、仪表的校正;起草纯化水系统的操作、清洁、保护保养的标准操作规程。
质量部:负责验证方案的审核;负责制定纯化水质量标准、查验规程及取样程序;负责完成和核准所有必需的实验并出具查验数据与查验报告书。
生产部:负责纯化水系统的操作、清洗、消毒和保护保养;负责配合验证小组完成验证工作。
5.验证内容预确认(安装前确认)5.1.1资料确认确认支持本验证的相关资料是不是齐全,确认并记录。
5.1.2售后效劳确认检查各要紧设备售后效劳的资料是不是齐全,包括单位名称、地址、联系、保修及维修等详细资料,确认并填写记录。
纯化水分配系统运行性能确认方案

纯化水分配系统运行性能确认方案方案编号:EV P-XXXX-OO版本号:00人员职责 (4)*****************************************************************4确认范围与程度评估 .......................................................... 4 培训 (4)2相关SoP (草案版)培训 ....................................................... 4 确认内容 .................................................................... 5 1 'f 丁石角♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦»♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦♦5 1. ....................................................................................................................................... 1仪器仪表的检定/校准确认 . (5)1.2水质确认 (5)2性能确认 .................................................................... 6 2.1性能确认前检查 ............................................................ 6 2. (2)水质确认 ......................................................................... 6 3微生物鉴定 .................................................................. 7 偏差处理 .................................................................... 7 总结 (7)1 2 3 4 4 4 5 5 5 55555 6 72.确认背景纯化水分配系统安装于制水间,该设备用于将纯化水制备系统产生合格的纯化水通过管道输送到纯化水储罐后经过卫生级离心泵输送到各使用点使用后通过回流管路回流到纯化水储罐完成整个纯化水储存与循环分配流程,纯化水分配系统流程图如下:34.确认范围与程度评估根据风险评估,对纯化水分配系统进行运行确认(仪表确认、水质确认)和性能确认(水质确认)。
六车间纯化水系统再确认方案

验证文件实施部门工程部保管部门QA部执行日期2014年09月××日文件版本变更历史方案审批表目录一、概述 (2)二、目的 (2)三、确认范围 (3)四、参考文件 (3)五、职责 (3)六、验证实施 (4)七、偏差与变更处理 (9)八、验证总结 (9)九、再验证周期 (9)十、附件 (9)附件1 设计确认(DQ) ...................................................................................... 错误!未定义书签。
附件2 安装确认(IQ) ........................................................................................ 错误!未定义书签。
附件3 运行确认(OQ) ...................................................................................... 错误!未定义书签。
附件4 性能确认(PQ)....................................................................................... 错误!未定义书签。
附件5 培训记录 .................................................................................................... 错误!未定义书签。
附件6 纯化水异常情况处理报告 ........................................................................ 错误!未定义书签。
附件7 偏差与变更一览表 .................................................................................... 错误!未定义书签。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目录页码
1.简介 (3)
2.目的 (4)
3.范围 (4)
4.文件归档 (4)
5.教育培训 (4)
6.确认内容/清单 (4)
7.运行确认总体评价 (4)
8.再确认周期 (5)
9.变更清单 (5)
10.测试打印文件/乙方测试文件清单 (5)
1.简介
1.1 简介
生产服务部动力一车间2号纯化水系统采用二级反渗透制水方式制取纯化水,系统主要由预处理、反渗透和纯化水供水循环系统组成。
设备信息:
安装位置:
该系统用于
因2015年8月对系统进行检修,对循环系统进行消毒。
为了验证系统能提供合格稳定的纯化水,现对该系统进行运行确认,以检查设备运行参数的波动情况、仪表的可靠性及设备运行的稳定性。
1.2依据法规及标准.
1.2.1法规
《药品生产质量管理规范(2010年修订)》;
《药品生产质量管理规范(2010年修订)》附录《确认与验证》(2015年第54号);《药品生产验证指南》(2003)国家食品药品监督管理局药品安全监管司、药品认证管理中心组织编写,化学工业出版社,2003.5;
《中国药典》2010版
《药品GMP指南》国家食品药品监督管理局药品认证管理中心编写,中国医药科技出版社,2011.8;
1.2.2行业标准
ISO 316L:国际标准化组织卫生级316L不锈钢标准
ISO 304:国际标准化组织卫生级304不锈钢标准
TSGR004-2009 固定式压力容器安全技术监察规程
CJ/T 168-2002 纯水机
GB50235-2010工业金属管道工程施工规范
国家生活饮用水卫生标准 GB5749-2006
2.目的
该纯化水系统的运行确认是为了确保设备能在要求范围内正确运行并达到规定的技术指标,保证该纯化水系统运行正常,并能提供合格的纯化水。
3.范围
本运行确认适用于生产服务部2号纯化水系统。
4.文件归档
文件的存档存于生产服务部2号纯化水站运行确认系统资料夹中。
5.教育培训
5.1为确保该系统操作运行的正确性,对设备操作人员进行的操作培训。
5.2为确保设备维护检查工作的正确性,对专业技术人员进行的培训。
5.3 培训活动应按照SOP的要求记录存档。
6.确认内容/清单
附件1:纯化水系统运行确认方案
附件2:纯化水系统运行确认未完成项及缺陷项评估表
附件3:纯化水系统运行确认放行表
7.运行确认总体评价
8.再确认周期
一年
9.变更清单
10. 测试打印文件/乙方测试文件清单
纯化水系统运行确认方案
一、条件确认中的文件确认
复核人/日期: QA/日期:二、条件确认中的测试用仪表及其校验确认
复核人/日期: QA/日期:三、设备/系统测量、计量仪表及其校验确认
复核人/日期: QA/日期:四、条件确认中的培训确认
复核人/日期: QA/日期:六、设备/系统运行确认
复核人/日期: QA/日期:
化水系统运行确认未完成项及缺陷项评估表。
