高中化学焰色反应颜色大全
焰色试验口诀李政

焰色试验口诀李政
做焰色反应的实验操作步骤:洗、烧、蘸、烧、看。
洗—用稀盐酸洗涤铂丝或无锈铁丝,烧—将铂丝或无锈铁丝在无色火焰上灼烧至火焰呈无色,蘸—用铂丝或无锈铁丝蘸取试剂,烧—在无色火焰上灼烧蘸有试剂的铂丝或无锈铁丝,
看—观察(看)火焰的颜色。
焰色反应的颜色口诀一
常见焰色反应的火焰颜色铷—紫(透过蓝色钴玻璃),钠—黄,锂—紫红,钙—砖红,锶—洋红,钾—浅紫,钡—黄绿,铜—绿。
由于铷及其化合物不常见,通常所说的火焰颜色为紫色,一般指钾及其化合物记忆口诀:钾紫钠黄(钳子夹)铷紫锂紫红,钙锶砖洋红(盖砖房,思洋房),钡铜黄绿绿(背黄驴)
焰色反应的颜色口诀二
看,那里坐着一个人,带着紫红色的礼(锂)帽,(锂离子焰色反应为紫红色)腰扎黄绿色的钡带,(钡离子焰色反应为黄绿色)坐在含钙的红砖上,(钙离子燃烧砖红色)正用他那刻有紫色金鱼(铷)的绿色铜剪刀,(铷离子焰色反应为紫色;铜离子焰色反应为绿色)修理他那蜡(钠)黄蜡黄的浅指(紫)甲(钾)(钠离子焰色反应为黄色;钾离子焰色反应为浅紫色)还不时鼓起他那洋红色的腮(锶)帮子。
(锶离子焰色反应为洋红色)
焰色反应的颜色口诀三
钾浅紫钙砖红;钠黄镁铝无;钡黄绿铜色绿;铁无锂紫红或者:
钾紫钠黄锂紫红,铷紫铜绿钡黄绿,钙砖红,锶洋红,钴淡蓝,铁无色。
高中化学物质颜色总结

(一)蓝色:Cu(OH)2、CuSO4·5H2O、Cu2+在水溶液中(蓝色);石蕊在碱性溶液中(蓝色);硫、氢气、甲烷、乙醇在空气中燃烧(火焰淡蓝色);一氧化碳在空气中燃烧(蓝色火焰);淀粉遇I2变蓝色;Co2O3(蓝色);O2(液态——淡蓝色);*Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)对水溶液中(绛蓝色);O3(气态——淡蓝色;液态——深蓝色;固体——紫黑色)。
(二)红色:Fe(SCN)3(红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);Cu(紫红色);溴蒸气、NO2(红棕色);品红溶液(红色);在空气中久置的苯酚(粉红);石蕊在酸性溶液中(红色);酚酞在碱性溶液中(红色)。
(三)棕色;FeCl3固体(棕黄色);CuCl2固体(棕色)。
(四)紫色:石蕊在中性溶液中(紫色);Fe3+与苯酚反应产物(紫色);I2(紫黑色);KMnO4固体(紫黑色);MnO4(紫红色);固态O3(紫黑色);钾的焰色反应(紫色);I2蒸气、I2在非极性溶剂中(紫色)。
(五)黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS。
AgCl,AgBr,Agl,AgNO3光照分解变黑。
(六)橙色:溴水;黄色:Agl(黄色);AgBr(淡黄色);Ag3PO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);工业浓盐酸(黄色)(含有Fe3+);FeCl3固体(棕黄色);Fe3+的水溶液(黄色);硝基苯(黄色)(溶有NO2);Na的焰色反应(黄色);TNT(淡黄色针状);I2的水溶液(黄色);久置的KI溶液(黄色)(被氧化为I2);碘酒(黄褐色);久置的浓硝酸(黄色)(溶有分解生成的NO2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色)(七)白色:绝大多数固体物质为白色,AgCl;Ag2CO3;Ag2SO3;BaSO4;BaCO3;Ba3(PO4)2;BaHPO4;CaO;Ca(OH)2;CaCO3;MgO;Mg(OH)2;MgCO3;Fe(OH)2;AgOH;PCl5;三溴苯酚;无水CuSO4;铵盐(白色固体或无色晶体);Fe(OH)2沉淀在空气中的现象;白色→(迅速)灰绿色→(最终)红褐色;pH试纸;干燥时呈黄色;中性时呈淡绿色;酸性时呈红色,酸性越强,红色越深;碱性时呈蓝色,碱性越强,蓝色越深。
常见金属焰色反应颜色

常见金属焰色反应颜色金属焰色反应是一种常见的化学现象,它是由于金属在高温下受热而发生的电子跃迁过程,从而导致金属离子的激发发光。
在实验室或者烟花表演中,我们可以通过观察金属在火焰中的颜色来推测金属的成分。
下面将介绍几种常见金属的焰色反应及其颜色。
1. 钠(Na)的焰色反应颜色为黄色。
钠是一种常见的碱金属,当钠盐溶解在火焰中时,火焰会呈现出明亮的黄色。
这是因为钠离子在高温下受热激发,电子跃迁从高能级到低能级时释放出黄光。
2. 钾(K)的焰色反应颜色为紫色。
钾也是一种碱金属,其焰色反应与钠类似,但颜色稍微偏向紫色。
这是因为钾离子的电子跃迁释放出的光波长较长,呈现出紫色。
3. 铜(Cu)的焰色反应颜色为绿色。
铜是一种过渡金属,其焰色反应较为特殊。
当铜盐溶解在火焰中时,火焰呈现出明亮的绿色。
这是因为铜离子的电子跃迁释放出的光波长对应着绿色。
4. 钙(Ca)的焰色反应颜色为橙色。
钙是一种碱土金属,其焰色反应呈现出橙色。
钙离子的电子跃迁释放出的光波长较长,对应着橙色。
5. 锂(Li)的焰色反应颜色为红色。
锂是一种碱金属,其焰色反应呈现出红色。
锂离子的电子跃迁释放出的光波长较长,对应着红色。
6. 铁(Fe)的焰色反应颜色为金黄色。
铁是一种过渡金属,其焰色反应呈现出金黄色。
这是因为铁离子的电子跃迁释放出的光波长对应着金黄色。
7. 锰(Mn)的焰色反应颜色为粉红色。
锰是一种过渡金属,其焰色反应呈现出粉红色。
锰离子的电子跃迁释放出的光波长较长,对应着粉红色。
8. 铅(Pb)的焰色反应颜色为蓝色。
铅是一种重金属,其焰色反应呈现出蓝色。
铅离子的电子跃迁释放出的光波长较短,对应着蓝色。
9. 锌(Zn)的焰色反应颜色为白色。
锌是一种过渡金属,其焰色反应呈现出白色。
这是因为锌离子的电子跃迁释放出的光波长较宽,覆盖了可见光谱的大部分区域,所以呈现出白色。
除了上述提到的金属,还有许多其他金属在高温下也会发生焰色反应,每种金属的焰色反应都有其独特的颜色。
高中化学物质颜色大全

1.红色:Fe(SCN) 3(红色溶液)Cu2O(红色固体)Fe2O3(红棕色固体)红磷(暗红色固体)液溴(深红棕色)Fe(OH) 3(红褐色固体)Cu(紫红色固体)溴蒸气、 NO 2(红棕色)品红溶液 (红色 ) 在空气中久置的苯酚(粉红)石蕊遇酸性溶液(红色 ) 酚酞遇碱性溶液 (红色 )2.紫色:石蕊在中性溶液中(紫色)Fe 3+与苯酚反应产物(紫色)I2(有金属光泽紫黑色固体)KMnO 4固体(紫黑色)MnO 4 —(紫红色溶液)钾的焰色反应(紫色)I 2蒸气、 I2在非极性溶剂中(紫色)3.橙色:溴水(橙色)K 2Cr2O7溶液(橙色)4.黄色:FeS2(黄色固体)AgI (黄色固体)AgBr (淡黄色固体)Ag 3PO4(黄色固体)Na 2O2(淡黄色固体)S(黄色固体)Au (金属光泽黄色固体)I 2的水溶液(黄色)碘酒(黄褐色)久置的 KI 溶液(黄色)(被氧化为I2)Na 的焰色反应(黄色)TNT (淡黄色针状)工业浓盐酸(黄色)(含有Fe 3+)NaNO 2(无色或浅黄色晶体)Fe3+的水溶液(黄色)硝基苯中溶有浓硝酸分解的NO 2时(黄色)久置的浓硝酸(黄色)(溶有分解生成的NO 2)浓硝酸粘到皮肤上(天然蛋白质)(显黄色)5.绿色:Fe2+的水溶液(浅绿色)Cu 2(OH) 2CO3(绿色固体)FeSO4· 7H2O(绿矾)Cl 2、氯水(黄绿色)F2(淡黄绿色)CuCl 2的浓溶液(蓝绿色)7.棕色:FeCl3固体(棕黄色)CuCl 2固体(棕色)6.蓝色:Cu(OH) 2、 CuSO4· 5H 2O、 Cu2+在水溶液中(蓝色)石蕊遇碱性溶液(蓝色)硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰)一氧化碳在空气中燃烧(蓝色火焰)淀粉遇 I2变蓝色Cu(OH) 2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色)7.黑色:FeO;Fe3O4; FeS;CuO;CuS;Cu 2S;MnO 2; C 粉; Ag 2S;Ag 2O; PbS;AgCl 、AgBr 、AgI 、AgNO 3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
高中化学有颜色变化的反应有哪些

高中化学有颜色变化的反应有哪些颜色反应是利用某些物质经过特定的化学反应的生成物产生特别的颜色,有新物质产生,所以是化学反应。
焰色反应是利用某些元素的原子的电子在激发态跃迁到基态发射出的光谱进行鉴别,没有新物质产生,所以不是化学反应。
颜色反应和焰色反应都会发生颜色变化,掌握这些知识对解化学各类题型都有帮助。
1化学物质燃烧火焰颜色的变化1、氢气在空气中燃烧—-淡蓝色火焰2、氢气在氯气中燃烧---苍白色火焰,瓶口有白雾。
3、甲烷在空气中燃烧---淡蓝色火焰4、酒精在空气中燃烧---淡蓝色火焰5、硫在空气中燃烧---微弱的淡蓝色火焰,生成强烈剌激性气味的气体。
6、硫在纯氧中燃烧---明亮的蓝紫色火焰,生成强烈剌激性气味的气体7、硫化氢在空气中燃烧---淡蓝色火焰,生成强烈剌激性气味的气体。
8、一氧化碳在空气中燃烧---蓝色火焰9、磷在空气中燃烧,白色火焰,有浓厚的白烟10、乙烯在空气中燃烧,火焰明亮,有黑烟11、乙炔在空气中燃烧,火焰很亮,有浓厚黑烟12、镁在空气中燃烧,发出耀眼白光13、钠在空气中燃烧,火焰黄色14、铁在氧气中燃烧,火星四射,(没有火焰)生成的四氧化三铁熔融而滴下。
15.在空气中点燃乙炔:火焰明亮,有浓烟产生,放出热量。
16.苯在空气中燃烧:火焰明亮,并带有黑烟。
17.乙醇在空气中燃烧:火焰呈现淡蓝色。
18.H2和O2的燃烧:发出淡蓝色的火焰.19.CO和O2的燃烧:发出蓝色的火焰.20.CH4和O2的燃烧:发出明亮的蓝色火焰.21.在空气中点燃乙烯:火焰明亮,有黑烟产生,放出热量。
22.木炭在氧气中燃烧:发出白光,放出热量。
23.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
24.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
25.镁条在空气中燃烧:。
各种元素的焰色反应颜色

各种元素的焰色反应颜色咱先说说钠元素吧。
钠元素在焰色反应里那可是出了名的黄澄澄的。
就像小太阳一样,金黄金黄的,特别亮眼。
你想啊,在实验室里,或者是在一些化学表演里,看到那一抹黄色,就知道钠元素来“报到”了。
感觉钠元素就像是个活泼的小娃娃,总是用它那独特的黄色在火焰里蹦跶,特别引人注目呢。
钾元素呢,它的焰色反应颜色是紫色。
不过这个紫色有点小傲娇,有时候会被钠元素那明亮的黄色给掩盖住。
就好像它是个有点害羞的小仙子,躲在后面。
但是当你仔细观察,或者是用蓝色钴玻璃滤去钠元素的黄色干扰的时候,就能看到它那美美的紫色啦。
就像是在黑暗中悄悄绽放的紫花,神秘又迷人。
钙元素的焰色反应颜色是砖红色。
这颜色就很有那种质朴的感觉,像古老的城墙一样,透着一种踏实。
每次看到这个砖红色,就好像能看到钙元素在火焰里像个憨厚的小工匠,勤勤恳恳地展示着自己独特的颜色,给人一种很温暖、很实在的感觉。
铜元素的焰色反应可就厉害了,是绿色的。
这个绿色就像夏天里郁郁葱葱的树叶,充满了生机。
铜元素在火焰里就像是一个绿色的小精灵,欢快地跳跃着。
感觉它像是在和周围的小伙伴们说:“看呀,我这个绿色是不是超级酷!”锂元素的焰色反应颜色是紫红色。
这个颜色就像是傍晚天边那一抹带着神秘的云霞,又有点像娇艳的紫红色花朵。
锂元素在火焰里就像是一个优雅的舞者,用它那独特的紫红色展现着自己的魅力。
钡元素的焰色反应是黄绿色。
这颜色就像是春天里刚冒出头的嫩草和新生的树叶混合在一起的颜色,清新又独特。
钡元素在火焰里就像是一个充满希望的小使者,带着这种独特的颜色给我们带来不一样的视觉享受。
焰色反应里的这些元素就像一个个有性格的小角色,用它们独特的颜色在火焰这个大舞台上表演着呢。
它们的颜色都那么与众不同,就像我们每个人都有自己独特的个性一样。
而且啊,这些颜色组合在一起,就像是一幅五彩斑斓的画,让化学这个世界变得更加奇妙、更加有趣啦。
每次看到这些焰色反应的颜色,就感觉像是走进了一个神奇的魔法世界,里面充满了惊喜和欢乐呢。
高中化学焰色反应颜色大全

高中化学焰色反应颜色大全1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷3、淡黄色固体:S、 Na2O2、 AgBr4、紫黑色固体:KMnO4、5、黄色固体:AgI 、Ag3PO46、绿色固体:Cu2OH2CO37、蓝色晶体:CuSO4?5H2O8、蓝色沉淀:CuOH29、红褐色沉淀:FeOH310、白色固体:MgO、P2O5、CaO、 NaOH、CaOH2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀:BaSO4 、AgCl13、不溶于水的白色沉淀:CaCO3 (溶于酸)、BaCO3(溶于酸)、AlOH3、 MgOH2 等14、气体味道:1具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)2无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)3红棕色气体: Br2(气体) NO24黄绿色气体:Cl25臭鸡蛋气味气体:H2S15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精16、有毒的:气体:CO SO2 H2S 液体:CH3OH 固体:NaNO2CuSO4可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液化学式颜色化学式颜色化学式颜色Cu 紫红 Au 黄 S 黄B 黄或黑 F2 淡黄绿 C石墨黑Cl2 黄 Br2 红棕 C金刚石无Si 灰黑 I2 紫黑 P 白、黄、红棕NO2 棕红 ClO2 黄 Na2O2 浅黄K2O 黄 Pb3O4 红 MnO 绿CuO 黑 MnO2 黑 Ag2O 棕黑FeO 黑 ZnO 白 Fe3O4 黑Hg2O 黑 Fe2O3 红棕 HgO 红或黄FeOH3 红褐 HNO2 亮蓝 CuOH2 蓝CuFeS2 黄 ZnS 白 Ag2S 黑FeS 黑棕 FeS2 黄 Sb2S3 黑或橙红HgS 红 PbS 黑 CuS 黑Cu2S 黑 FeCl3?6H2O 棕黄 FeSO4 9H20 蓝绿 Fe2SO43.9H2O 棕黄 Fe3C 灰 FeCO3 灰Ag2CO3 黄 Ag3PO4 黄 CuCl2 棕黄AgF 黄 CuCl2 7H2O 蓝绿 AgCl 白CuSO4 白 AgBr 浅黄 CuSO4 5H2O 蓝AgI 黄 Cu2OH2CO3 暗绿盐溶液中离子特色化学式颜色化学式颜色化学式颜色Cu2+ 蓝 MnO4- 紫红 [CuCl4]2- 黄Cr2O72- 橙红 Fe2+ 浅绿 Fe3+ 棕黄物质颜色物质颜色物质颜色氯水黄绿溴水黄-橙碘水黄褐溴的有机溶液橙红-红棕 I2的有机溶液紫红其它颜色蛋白质遇浓变黄、遇淀粉变蓝、 TNT 淡黄、遇酚酞溶液变紫黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
高中化学物质颜色大全

AgCl;Ag2CO3;Ag2SO4;Ag2SO3;BaSO4;BaSO3;BaCO3;
Ba3(PO4)2;BaHPO4;CaO;Ca(OH)2;CaCO3;MgO;Mg(OH);
MgCO3;Fe(OH)2;AgOH;PCl5;SO3;三溴苯酚;CuSO4;
高中化学物质颜色大全
1.红色:
Fe(SCN)3(红色溶液)Cu2O(红色固体)Fe2O3(红棕色固体)
红磷(暗红色固体)液溴(深红棕色)Fe(OH)3(红褐色固体)Cu(紫红色固体)溴蒸气、NO2(红棕色)品红溶液(红色)在空气中久置的苯酚(粉红)石蕊遇酸性溶液(红色)酚酞遇碱性溶液(红色)
2Hale Waihona Puke 紫色:铵盐(白色固体或无色晶体);
Fe(OH)2沉淀在空气中的现象:白色→(迅速)灰绿色→(最终)红褐色
pH试纸:干燥时呈黄色;中性时呈淡绿色;酸性时呈红色,酸性越强,红色越深;碱性时呈蓝色,碱性越强,蓝色越深。
红色石蕊试纸:红色(用于检验碱性物质)蓝色石蕊试纸:蓝色(用于检验酸性物质)
淀粉试纸:白色(用于检验碘单质)KI—淀粉试纸:白色(用于检验氧化性物质)
6.蓝色:
Cu(OH)2、CuSO4·5H2O、Cu2+在水溶液中(蓝色)石蕊遇碱性溶液(蓝色)
硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰)一氧化碳在空气中燃烧(蓝色火焰)
淀粉遇I2变蓝色Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色)
7.黑色:
FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS;AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
高中化学物质颜色大全

高中化学物质颜色大全1.红色:Fe(SCN)3(红色溶液)Cu2O(红色固体)Fe2O3(红棕色固体)红磷(暗红色固体)液溴(深红棕色)Fe(OH)3(红褐色固体)Cu(紫红色固体)溴蒸气、NO2(红棕色)品红溶液(红色)在空气中久置的苯酚(粉红)石蕊遇酸性溶液(红色)酚酞遇碱性溶液(红色)2.紫色:石蕊在中性溶液中(紫色)Fe3+与苯酚反应产物(紫色)I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色)MnO4(紫红色溶液)钾的焰色反应(紫色)I2蒸气、I2在非极性溶剂中(紫色)3.橙色:溴水(橙色)4.黄色:K2Cr2O7溶液(橙色)AgI(黄色固体)AgBr(淡黄色固体)Ag3PO4(黄色固体)FeS2(黄色固体)Na2O2(淡黄色固体)S(黄色固体)Au(金属光泽黄色固体)I2的水溶液(黄色)碘酒(黄褐色)久置的KI溶液(黄色)(被氧化为I2)Na的焰色反应(黄色)TNT(淡黄色针状)工业浓盐酸(黄色)(含有Fe3+)NaNO2(无色或浅黄色晶体)Fe3+的水溶液(黄色)硝基苯中溶有浓硝酸分解的NO2时(黄色)久置的浓硝酸(黄色)(溶有分解生成的NO2)浓硝酸粘到皮肤上(天然蛋白质)(显黄色)5.绿色:Cu2(OH)2CO3(绿色固体)Cl2、氯水(黄绿色)Fe2+的水溶液(浅绿色)FeSO4·7H2O(绿矾)F2(淡黄绿色)CuCl2的浓溶液(蓝绿色)6.蓝色:Cu(OH)2、CuSO4·5H2O、Cu2+在水溶液中(蓝色)石蕊遇碱性溶液(蓝色)硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰)一氧化碳在空气中燃烧(蓝色火焰)淀粉遇I2变蓝色Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色)7.黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS;AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
高中化学焰色反应范文

常见的焰色反应含钠元素Na 黄含锂元素Li 紫红含钾元素K 浅紫焰色反应(透过蓝色钴玻璃观察,因为钾里面常混有钠,黄色掩盖了浅紫色)含铷元素Rb 紫含钙元素Ca 砖红色含锶元素Sr 洋红含铜元素Cu 绿含钡元素Ba 黄绿含钴元素Co 淡蓝镁、铝合金Mg+Al 白色(注:含铁元素Fe 无色)精简版钾浅紫钙砖红钠黄镁铝无钡黄绿铜色绿铁无锂紫红钾紫钠黄锂紫红铷紫铜绿钡黄绿钙砖红锶洋红钴淡蓝铁无色检验离子钠离子钠的焰色反应本应不难做,但实际做起来最麻烦。
因为钠的焰色为黄色,而酒精灯的火焰因灯头灯芯不干净、酒精不纯而使火焰大多呈黄色。
即使是近乎无色(浅淡蓝色)的火焰,一根新的铁丝(或镍丝、铂丝)放在外焰上灼烧,开始时火焰也是黄色的,很难说明焰色是钠离子的还是原来酒精灯的焰色。
要明显看到钠的黄色火焰,可用如下方法。
⑴方法一(镊子-棉花-酒精法):用镊子取一小团棉花(脱脂棉,下同)吸少许酒精(95%乙醇,下同),把棉花上的酒精挤干,用该棉花沾一些氯化钠或无水碳酸钠粉末(研细),点燃。
⑵方法二(铁丝法):①取一条细铁丝,一端用砂纸擦净,再在酒精灯外焰上灼烧至无黄色火焰,②用该端铁丝沾一下水,再沾一些氯化钠或无水碳酸钠粉末,③点燃一盏新的酒精灯(灯头灯芯干净、酒精纯),④把沾有钠盐粉末的铁丝放在外焰尖上灼烧,这时外焰尖上有一个小的黄色火焰,那就是钠焰。
以上做法教师演示实验较易做到,但学生实验因大多数酒精灯都不干净而很难看到焰尖,可改为以下做法:沾有钠盐的铁丝放在外焰中任一有蓝色火焰的部位灼烧,黄色火焰覆盖蓝色火焰,就可认为黄色火焰就是钠焰。
钾离子⑴方法一(烧杯-酒精法):取一小药匙无水焰色反应碳酸钾粉末(充分研细)放在一倒置的小烧杯上,滴加5~6滴酒精,点燃,可看到明显的浅紫色火焰,如果隔一钴玻璃片观察,则更明显看到紫色火焰。
⑵方法二(蒸发皿-•酒精法):取一药匙无水碳酸钾粉末放在一个小发皿内,加入1毫升酒精,点燃,燃烧时用玻棒不断搅动,可看到紫色火焰,透过钴玻璃片观察效果更好,到酒精快烧完时现象更明显。
高中化学常见物质颜色、反应火焰规律总结

高中化学常见物质颜色、反应火焰规律总结以红色为基色的物质红色:难溶于水的Cu,Cu2O,Fe2O3,HgO等。
碱液中的酚酞、酸液中甲基橙、石蕊及pH试纸遇到较强酸时及品红溶液。
橙红色:浓溴水、甲基橙溶液、氧化汞等。
棕红色:Fe(OH)3固体、Fe(OH)3水溶胶体等。
②以黄色为基色的物质黄色:难溶于水的金、碘化银、磷酸银、硫磺、黄铁矿、黄铜矿(CuFeS2)等。
溶于水的FeCl3、甲基橙在碱液中、钠离子焰色及TNT等。
浅黄色:溴化银、碳酦银、硫沉淀、硫在CS2中的溶液,还有黄磷、Na2O2、氟气。
棕黄色:铜在氯气中燃烧生成CuCl2的烟。
③以棕或褐色为基色的物质碘水浅棕色、碘酒棕褐色、铁在氯气中燃烧生成FeCl3的烟等④以蓝色为基色的物质蓝色:新制Cu(OH)2固体、胆矾、硝酸铜、溶液中淀粉与碘变蓝、石蕊试液碱变蓝、pH试纸与弱碱变蓝等。
浅蓝色:臭氧、液氧等蓝色火焰:硫、硫化氢、一氧化碳的火焰。
甲烷、氢气火焰(蓝色易受干扰)。
⑤以绿色为色的物质浅绿色:Cu2(OH)2CO3,FeCl2,FeSO4•7H2O。
绿色:浓CuCl2溶液、pH试纸在约pH=8时的颜色。
深黑绿色:K2MnO4。
黄绿色:Cl2及其CCl4的萃取液。
⑥以紫色为基色的物质KMnO4为深紫色、其溶液为红紫色、碘在CCl4萃取液、碘蒸气、中性pH试纸的颜色、K+离子的焰色等。
⑦以黑色为基色的物质黑色:碳粉、活性碳、木碳、烟怠、氧化铜、四氧化三铁、硫化亚铜(Cu2S)、硫化铅、硫化汞、硫化银、硫化亚铁、氧化银(Ag2O)。
浅黑色:铁粉。
棕黑色:二氧化锰。
⑧白色物质无色晶体的粉末或烟尘;与水强烈反应的P2O5;难溶于水和稀酸的:AgCl,BaSO3,PbSO4;难溶于水的但易溶于稀酸:BaSO3,Ba3(PO4)2,BaCO3,CaCO3,Ca3(PO4)2,CaHPO4,Al(OH)3,Al2O3,ZnO,Zn(OH)2,ZnS,Fe(OH)2,Ag2SO3,CaSO3等;微溶于水的:CaSO4,Ca(OH)2,PbCl2,MgCO3,Ag2SO4;与水反应的氧化物:完全反应的:BaO,CaO,Na2O;不完全反应的:MgO。
金属的焰色反应的颜色

金属的焰色反应的颜色
金属的焰色反应,是指将金属样品放入火焰中加热,观察其放出的颜色。
这种反应可以用于鉴定金属元素的存在和浓度,也被广泛应用于化学分析、冶金工业、矿物勘探等领域。
金属的焰色反应的颜色主要来自于电子跃迁所产生的能量差。
当金属样品被加热时,其原子吸收了足够的能量,使得其中一些电子跃迁到较高能级。
当这些电子重新回到低能级时,会放出一定能量的光子,形成特定的颜色。
不同金属元素产生的焰色反应颜色是不同的。
下面分别介绍几种常见金属元素的焰色反应颜色:
钠(Na):产生黄色火苗
钾(K):产生紫色火苗
锂(Li):产生红色火苗
铁(Fe):产生橙黄色火苗
铜(Cu):产生蓝绿色火苗
镁(Mg):产生亮白色火苗
除了上述常见金属元素外,还有许多其他元素也具有独特的焰色反应颜色,如锶(Sr)产生红色火苗、钡(Ba)产生黄绿色火苗等。
需要注意的是,金属的焰色反应颜色不仅与元素种类相关,还与其浓度、加热温度等因素有关。
因此,在进行金属的焰色反应时,需要控制好样品的浓度和加热条件,以保证结果的准确性。
总之,金属的焰色反应是一种简单而有效的分析方法,可以用于鉴定金属元素的存在和浓度。
通过观察不同金属元素产生的颜色,我们可以更深入地了解元素之间的相互作用和化学特性。
高中化学物质颜色大全

====Word行业资料分享--可编辑版本--双击可删====1.红色:Fe(SCN)3(红色溶液)Cu2O(红色固体)Fe2O3(红棕色固体)红磷(暗红色固体)液溴(深红棕色)Fe(OH)3(红褐色固体)Cu(紫红色固体)溴蒸气、NO2(红棕色)品红溶液(红色) 在空气中久置的苯酚(粉红)石蕊遇酸性溶液(红色) 酚酞遇碱性溶液(红色)2.紫色:石蕊在中性溶液中(紫色)Fe3+与苯酚反应产物(紫色)I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色)MnO4—(紫红色溶液)钾的焰色反应(紫色)I2蒸气、I2在非极性溶剂中(紫色)3.橙色:溴水(橙色)K2Cr2O7溶液(橙色)4.黄色:AgI(黄色固体)AgBr(淡黄色固体)Ag3PO4(黄色固体)FeS2(黄色固体)Na2O2(淡黄色固体)S(黄色固体)Au(金属光泽黄色固体)I2的水溶液(黄色)碘酒(黄褐色)久置的KI溶液(黄色)(被氧化为I2)Na的焰色反应(黄色)TNT(淡黄色针状)工业浓盐酸(黄色)(含有Fe3+)NaNO2(无色或浅黄色晶体)Fe3+的水溶液(黄色)硝基苯中溶有浓硝酸分解的NO2时(黄色)久置的浓硝酸(黄色)(溶有分解生成的NO2)浓硝酸粘到皮肤上(天然蛋白质)(显黄色)5.绿色:Cu2(OH)2CO3(绿色固体)Fe2+的水溶液(浅绿色)FeSO4·7H2O(绿矾)Cl2、氯水(黄绿色)F2(淡黄绿色)CuCl2的浓溶液(蓝绿色)7.棕色:FeCl3固体(棕黄色)CuCl2固体(棕色)6.蓝色:Cu(OH)2、CuSO4·5H2O、Cu2+在水溶液中(蓝色)石蕊遇碱性溶液(蓝色)硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰)一氧化碳在空气中燃烧(蓝色火焰)淀粉遇I2变蓝色Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色)7.黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS;AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
高中化学常见物质反应焰色分类

1.基态:Fe2O3(红褐色)、Fe(OH)3(棕红色)、[Fe(SCN)]2+(血红色)、Cu(紫红色)、Cu2O(砖红色)、NO2(棕红色)、P(红磷,暗红色)、Br2(深红棕色)、红色石蕊试纸、品红溶液。
2.激发态:充氦气(He)的灯光成红色、充氖气(Ne)的灯光呈红色。
3.化学变化:1)紫色石蕊在酸性溶液(pH<5.0)中变红;2)湿润的蓝色石蕊试纸遇酸性(CO2、SO2、H2S、HCl)变红;3)酚酞在碱性容写中呈浅红色(8.2<pH<10.0)或红色(pH>10);4)甲基橙在酸性溶液中(pH<3.1)中呈红色;5)已经被二氧化硫(SO2)褪色的品红溶液在加热时会出现红色。
橙色世界1.基态:浓溴水、甲基橙试剂,Br2(CCl4)呈橙红色。
黄色世界1.基态:工业盐酸(含有Fe3+)、Au、S、Na2O2(淡黄色)、AgBr(淡黄色)、AgI、Ag3PO4。
2.激发态:钠元素焰色反应成黄色。
3.化学变化:久置的浓硝酸因溶解自身分解产生的二氧化氮而变黄。
绿色世界1.基态:F2(浅黄绿色)、Cl2(黄绿色)、Cu2(OH)2CO3(绿色)、CuCl2(浓溶液呈绿色)、FeSO4(浅绿色)。
2.化学变化:Fe(OH)2(白色)→灰绿色→Fe(OH)3(红棕色)。
青色世界(黑色)1.基态:铁粉、银粉以及大多数金属粉末、石墨、CuO、CuS、Cu2S、FeO、Fe3O4、MnO2、FeS。
2.化学变化:1)蔗糖率浓硫酸被炭化变黑;2)湿润的白色醋酸铅试纸遇H2S变黑;3)硫磺粉与白色的水银反应生成黑红色的HgS。
蓝色世界1.基态:CuSO4(溶液)、CuSO4·5H2O(晶体)、液氧、臭氧。
2.化学变化:1)紫色石蕊在碱性溶液(pH>8)中变蓝;2)湿润的红色石蕊试纸遇碱性气体变蓝;3)无水CuSO4(白色粉末)遇水变蓝;4)H2、H2S、CH4、C2H5OH燃烧火焰呈淡蓝色,CO燃烧火焰呈蓝色;5)S在空气中燃烧呈蓝色火焰,在纯氧中燃烧呈明亮的蓝紫色火焰;6)淀粉遇I2(aq)变蓝;7)Cl2、Br2、NO2、O3遇湿润的淀粉-碘化钾试纸变蓝。
高一化学必修一和必修二物质颜色和焰色反应总结

高一化学必修一和必修二物质颜色和焰色反应总结:必修物质颜色高一化学高一化学必修一目录高一化学必修一教科书高一化学必修1视频讲解篇一:高中化学物质颜色总结高中化学物质颜色总结1、红色世界(1)基态:Fe2O3 (红褐色)、Fe (OH)3 (红棕色)、[Fe (SCN)]2+ (血红色)、Cu (紫红色)、Cu2O (砖红色)、NO2 (红棕色)、P(红磷、暗红色)、Br2 (深红棕色)、红色石蕊试纸、品红溶液。
(2)激发态:充氦气的灯光呈粉红色,充氖气的灯光呈红色,钙元素的焰色呈砖红色。
(3)化学变化:①紫色石蕊在酸性溶液(pH5.0)中变红,②润湿的蓝色石蕊试纸遇酸性(CO2、SO2 、H2S 、HCl)变红,③酚酞在碱性溶液中呈浅红色(8.2pH10.0)或红色(pH10),④甲基橙在酸性溶液(pH3.1)中呈红色,⑤甲基红在酸性溶液(pH4.4)中呈红色,⑥pH试纸(黄色)遇酸性溶液(pH2)变红,⑦已经被二氧化硫褪色的品红溶液在加热时会出现红色,⑧C(NaHSO4)0.001mol/L时遇甲基橙变红。
2、橙色世界(1)基态:浓溴水、甲基橙试剂、Br2 (CCl4)呈橙红色。
(2)化学变化:甲基橙在酸性溶液(3.1pH 4.4)中呈橙色,甲基红在酸性溶液(4.4pH 6.0)中呈橙色。
3、黄色世界(1)基态:工业盐酸(含有Fe3+)、Au 、S8 、Na2O2 (淡黄色)、AgBr(淡黄色)、AgI、Ag3PO4(2)激发态:钠元素焰色呈黄色(3)化学变化:①甲基橙在(pH4.4)溶液中呈黄色,②久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄4、绿色世界A(1)基态:F2 (浅黄绿色)、Cl2 (黄绿色)、Cu 2(OH)2CO3 (绿色)CuCl2(浓溶液呈绿色)、FeSO4(浅绿色)(2)激发态:铜元素的焰色呈绿色(3)化学变化:Fe (OH)2 (白色)——灰绿色——Fe (OH)3(红棕色)5、青色世界(1)基态:铁粉、银粉及大多数金属粉末、石墨、CuO 、CuS 、Cu2S FeO 、Fe3O4 、MnO2(2)化学变化:①蔗糖遇浓硫酸被炭化变黑,②润湿的白色醋酸铅试纸遇H2S变黑,③硫磺粉与白色的水银反应生成黑红色的HgS,④H2S通入Pb(NO3)2 、AgNO3 、CuSO4溶液产生不溶于水也不溶于稀盐酸和稀硫酸的黑色沉淀。
常见焰色反应
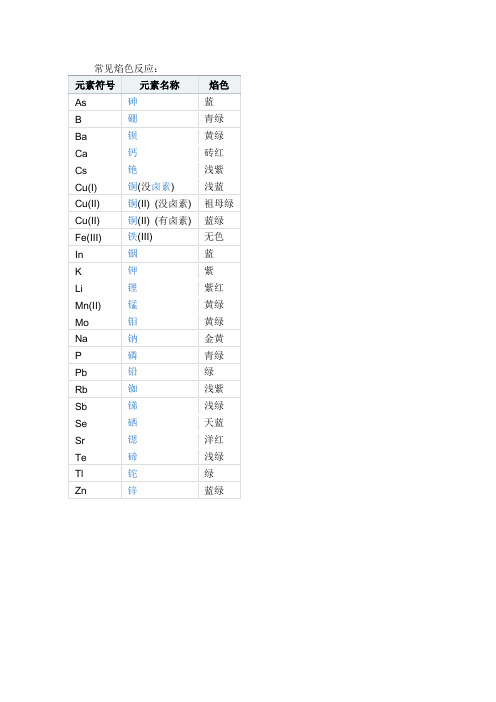
锶
洋红
Te
碲
浅绿
Tl
铊
绿
Zn
锌
蓝绿
元素符号元素名称焰色as砷蓝b硼青绿ba钡黄绿ca钙砖红cs铯浅紫cui铜没卤素浅蓝cuii铜ii没卤素祖母绿cuii铜ii有卤素蓝绿feiii铁iii无色in铟蓝k钾紫li锂紫红mnii锰黄绿mo钼黄绿na钠金黄p磷青绿pb铅绿rb铷浅紫sb锑浅绿se硒天蓝sr锶洋红te碲浅绿tl铊绿zn锌蓝绿
常见焰色反应:
元素符号
元素名称
焰色
As
砷
蓝
B
硼
青绿
Ba
钡
黄绿
Ca
钙
砖红
Cs
铯
浅紫
Cu(I)
铜(没卤素)
浅蓝
Cu(II)
铜(II) (没卤素)
祖母绿
Cu(II)
铜(II) (有卤素)
蓝绿
Fe(III)
铁(III)
无色
In
铟
蓝
K
钾
紫
Li
锂
紫红
Mn(II)
锰
黄绿
Mo
钼
黄绿
Na
钠
金黄
P
磷
青绿
Pb
铅
绿
Rb
铷
浅紫
Sb
锑
浅绿
Se
高中化学焰色反应颜色大全

高中化学焰色反应颜色大全(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如小学资料、初中资料、高中资料、大学资料、文言文、中考资料、高考资料、近义词、反义词、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this store provides you with various types of practical materials, such as primary school materials, junior high school materials, senior high school materials, university materials, classical Chinese, senior high school examination materials, college entrance examination materials, synonyms, antonyms, other materials, etc. If you want to know different data formats and writing methods, please pay attention!高中化学焰色反应颜色大全有许多的同学是非常想了解,高中化学颜色反应是什么,本店铺整理了相关信息,期待会对大伙有所帮助!高中化学颜色反应有什么1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷3、淡黄色固体:S、 Na2O2、 AgBr4、紫黑色固体:KMnO4、5、黄色固体:AgI 、Ag3PO46、绿色固体:Cu2(OH)2CO37、蓝色晶体:CuSO4?5H2O8、蓝色沉淀:Cu(OH)29、红褐色沉淀:Fe(OH)310、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
高中焰色反应口诀

金属焰色反应:钾紫钠黄钙砖红,钡显黄绿锶洋红,唯独有锂显紫红。
酸碱盐溶水性:钾钠硝盐溶水快,硫酸盐不溶钡铅钙,氯盐除去亚汞银,酸除硅外水中迈,钾钠钡钙胺五碱,见水立即溶起来。
焰色反应化学顺口溜1、黄钠紫铷钾,钠在焰色反应呈现黄色;铷、钾呈现紫色。
2、砖洋紫三红,钙锶锂分明;钙是砖红色;锶是洋红色;锂是紫红色。
3、黄绿钡绿铜。
钡是黄绿色;铜是绿色。
紫红浅紫锂钾呈,铷呈紫色锶洋红,砖红黄色钙和钠,钡色黄色绿色铜。
化学焰色反应口诀看,那里坐着一个人带着紫红色的礼(锂)帽(锂离子焰色反应为紫红色)腰扎黄绿色的钡带(钡离子焰色反应为黄绿色)坐在含钙的红砖上(钙离子燃烧砖红色)正用他那刻有紫色金鱼(铷)的绿色铜剪刀(铷离子焰色反应为紫色;铜离子焰色反应为绿色)修理他那蜡(钠)黄蜡黄的浅指(紫)甲(钾)(钠离子焰色反应为黄色;钾离子焰色反应为浅紫色)还不时鼓起他那洋红色的腮(锶)帮子(锶离子焰色反应为洋红色)酸碱指示剂变色口诀高中化学常用的酸碱指示剂有甲基橙、石蕊和酚酞。
甲基橙的变色范围为3点1~4点4,小于3点1为红色,在3点1到4点4之间为橙色,大于4点4为黄色。
石蕊溶液变色范围为5到8.小于5为红色,位于5到8之间为紫色,大于8为蓝色。
酚酞试液变色范围为8点2到10.小于8点2为无色,位于8点2到10之间为浅红色,大于10为红色。
将它们变成口诀有助于记忆.如:甲基橙:甲基橙色三四点(3.1-4.4为橙色)酚酞:太太八十红颜在(8.2-10显红色)石蕊:十女舞罢(五八)紫花开(5-8为紫色)酸碱指示剂一般是有机弱酸或弱碱,它们的共轭酸碱对具有不同结构而呈现不同颜色。
当溶液的pH改变时,指示剂得到质子,由碱式转变为共轭酸式,或失去质子,由酸式转变为共轭碱式,由于其结构的转变而发生颜色的变化。
金属焰色反应颜色

金属焰色反应颜色
常见的焰色反应的金属有:钠Na(黄色)、锂Li(紫红)、钾K(浅紫)、铷Rb(紫色)、钙Ca(砖红色)、锶Sr(洋红)、铜Cu(绿色)、钡Ba(黄绿)、铯Cs(紫红)。
焰色反应,也称作焰色测试或焰色试验,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应。
它的原理是每种元素都有其特别的光谱。
样本通常使用的是粉或小块的形式。
用一根清洁且较不活泼的金属丝(例如铂或镍铬合金)盛载样本,再放到无光焰(蓝色火焰)中。
在化学上,经常用来测试某种金属是否存在于化合物。
利用焰色反应,人们在烟花中特意加入特定的金属元素,使烟花看起来更加绚丽多彩。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学焰色反应颜色大全
有很多的同学是非常想知道,高中化学颜色反应是什幺,小编整理了相关信息,希望会对大家有所帮助!
1 高中化学颜色反应有什幺1、黑色固体:石墨、炭粉、铁粉、
FeS、CuS、CuO、MnO2、Fe3O4
2、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷
3、淡黄色固体:S、Na2O2、AgBr
4、紫黑色固体:KMnO4、
5、黄色固体:AgI 、Ag3PO4
6、绿色固体:Cu2(OH)2CO3
7、蓝色晶体:CuSO4?5H2O
8、蓝色沉淀:Cu(OH)2
9、红褐色沉淀:Fe(OH)3
10、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)
2、KClO
3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银
白色液态)
11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;
凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀:BaSO4 、AgCl
13、不溶于水的白色沉淀:CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)
3、Mg(OH)2 等
14、气体味道:。
