第04章 结晶分离及升华技术PPT课件
合集下载
【正式版】结晶技术PPT文档

溶剂蒸发至亚稳定区,冷却,进入不稳定区,形成一定量的晶核,此时溶液的浓度会有所降低,进入并稳定在亚稳定的养晶区,使晶 体生长 结晶(Cystallization):是固体物质呈晶体态从液相、气相、熔融物质中析出的过程。 上述三个区域,稳定区内,溶液不饱和状态,没有结晶; 这种方法容易控制、所得晶体形状大小均比较理想。 不稳区:是自发成核区域,溶液不稳定,瞬时出现大量微小晶核,发生晶核泛滥
方法二、蒸发结晶法
蒸发结晶法是在常压沸点条件下,使溶剂中的溶剂部分气化(蒸发),使 溶液获得过饱和度。蒸发结晶法适用于溶解度随温度变化不大的物系
方法三、真空冷却结晶法
真空冷却结晶法是在减压、低于正常沸点条件下,使溶液中溶剂部分气化并 使溶液获得过饱和度。此法兼有蒸发结晶法和冷却结晶法特点。适用于热稳 定性差及中等溶解度的物系。
四、结晶的基本原理
基本原理:当溶液处于过饱和状态时,分子间的分散或排斥作用小 于分子间的相互吸引力,便开始形成沉淀或者晶体。
饱和溶液:当溶液中溶质浓度等于该溶质在同等条件下的饱和溶
解度时,该溶液称为饱和溶液
过饱和溶液:溶质浓度超过饱和溶解度时,该溶液称之为过饱
和溶液
饱和曲线与过饱和曲线
饱和曲线:溶解度曲线
上述三个区域,稳定区内,溶液不饱和状态,没有结晶;不稳区内,晶核形成的速度较大, 因此产生的结晶量大,晶粒小,质量难以控制;介稳区内,晶核的形成速率较慢,生产中 常采用加入晶种的方法,并把溶液浓度控制在介稳区内的养晶区,让晶体慢慢长大
五.结晶方法
方法一、冷却结晶法
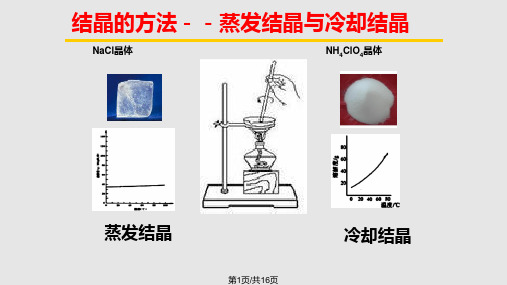
主要通过冷却使溶液获得过饱和度。冷却结晶法适用于溶解度随温度降温 而显著下降的物系。
质中析出的过程。工业结晶过程是一个复杂的多项传热、传质过程,是一
方法二、蒸发结晶法
蒸发结晶法是在常压沸点条件下,使溶剂中的溶剂部分气化(蒸发),使 溶液获得过饱和度。蒸发结晶法适用于溶解度随温度变化不大的物系
方法三、真空冷却结晶法
真空冷却结晶法是在减压、低于正常沸点条件下,使溶液中溶剂部分气化并 使溶液获得过饱和度。此法兼有蒸发结晶法和冷却结晶法特点。适用于热稳 定性差及中等溶解度的物系。
四、结晶的基本原理
基本原理:当溶液处于过饱和状态时,分子间的分散或排斥作用小 于分子间的相互吸引力,便开始形成沉淀或者晶体。
饱和溶液:当溶液中溶质浓度等于该溶质在同等条件下的饱和溶
解度时,该溶液称为饱和溶液
过饱和溶液:溶质浓度超过饱和溶解度时,该溶液称之为过饱
和溶液
饱和曲线与过饱和曲线
饱和曲线:溶解度曲线
上述三个区域,稳定区内,溶液不饱和状态,没有结晶;不稳区内,晶核形成的速度较大, 因此产生的结晶量大,晶粒小,质量难以控制;介稳区内,晶核的形成速率较慢,生产中 常采用加入晶种的方法,并把溶液浓度控制在介稳区内的养晶区,让晶体慢慢长大
五.结晶方法
方法一、冷却结晶法
主要通过冷却使溶液获得过饱和度。冷却结晶法适用于溶解度随温度降温 而显著下降的物系。
质中析出的过程。工业结晶过程是一个复杂的多项传热、传质过程,是一
结晶和重结晶分解课件

将析出的晶体用适当的方法干燥,得到纯净的重结晶产品。
安全注意事项
操作规范
进行实验时要佩戴实验服和护目镜,确保 操作规范、准确。
有毒有害物质
部分结晶和重结晶过程中可能使用有毒有 害的溶剂或试剂,要在通风橱中进行操作
,并避免接触皮肤和吸入气体。
防火防爆
结晶和重结晶过程中可能涉及易燃、易爆 的溶剂,要确保远离火源,并备好灭火器 材。
过形成固体晶体降低污染物浓度,实现废水的净化处理。
大气污染治理
02
结晶技术可应用于大气污染治理中,将气态污染物转化为固态
晶体,便于后续处理和处置。
环境监测
03
结晶现象可作为环境监测的指标之一,通过观察和分析环境中
某些物质的结晶行为,评估环境质量及污染程度。
05 实验操作与注意事项
结晶实验操作
溶解固体样品
应用
结晶与重结晶广泛应用于化学、化工、医药、冶金等领域。例如,在药物研发过程中,通过结晶和重结晶技术可 以获得高纯度的药物成分,提高药物的疗效和安全性;在冶金领域,利用结晶和重结晶技术可以提取和纯化金属 矿物中的目标元素。
02 结晶的过程与控制
结晶的过程分析
01
02
03
晶核形成
在过饱和溶液中,分子或 离子聚集形成稳定的晶核 。
产物品质提升
通过结晶操作,可以获得高纯度的晶体产品,提高产品的品质和市 场竞争力。
资源回收利用
结晶技术可用于废水处理中的资源回收,将废水中的有价值物质通 过结晶方式回收再利用,降低生产成本。
重结晶在药物提纯中的应用
1 2 3
药物纯化
重结晶技术可将粗品药物进行多次结晶操作,以 获取更高纯度的药物产品,满足药品生产和临床 用药的需求。
安全注意事项
操作规范
进行实验时要佩戴实验服和护目镜,确保 操作规范、准确。
有毒有害物质
部分结晶和重结晶过程中可能使用有毒有 害的溶剂或试剂,要在通风橱中进行操作
,并避免接触皮肤和吸入气体。
防火防爆
结晶和重结晶过程中可能涉及易燃、易爆 的溶剂,要确保远离火源,并备好灭火器 材。
过形成固体晶体降低污染物浓度,实现废水的净化处理。
大气污染治理
02
结晶技术可应用于大气污染治理中,将气态污染物转化为固态
晶体,便于后续处理和处置。
环境监测
03
结晶现象可作为环境监测的指标之一,通过观察和分析环境中
某些物质的结晶行为,评估环境质量及污染程度。
05 实验操作与注意事项
结晶实验操作
溶解固体样品
应用
结晶与重结晶广泛应用于化学、化工、医药、冶金等领域。例如,在药物研发过程中,通过结晶和重结晶技术可 以获得高纯度的药物成分,提高药物的疗效和安全性;在冶金领域,利用结晶和重结晶技术可以提取和纯化金属 矿物中的目标元素。
02 结晶的过程与控制
结晶的过程分析
01
02
03
晶核形成
在过饱和溶液中,分子或 离子聚集形成稳定的晶核 。
产物品质提升
通过结晶操作,可以获得高纯度的晶体产品,提高产品的品质和市 场竞争力。
资源回收利用
结晶技术可用于废水处理中的资源回收,将废水中的有价值物质通 过结晶方式回收再利用,降低生产成本。
重结晶在药物提纯中的应用
1 2 3
药物纯化
重结晶技术可将粗品药物进行多次结晶操作,以 获取更高纯度的药物产品,满足药品生产和临床 用药的需求。
物质的分离与提纯结晶法PPT课件
第15页/共16页
感谢您的观看!
第16页/共16页
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。 ③[Cu(NH3)4]SO4·H2O在乙醇·水混合溶剂 中的溶解度随乙醇体积分数的变化曲线示
意图如右:
第8页/共16页
反馈练习
2.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,设计方案从氯化铵与硫酸 钠的混合溶液分离出氯化铵与硫酸钠?
、干燥。
蒸发浓缩、趁热过滤、冷却结晶、抽滤、洗涤
分离粗产品NaCl时承接滤液的烧杯中应加入少量蒸馏水,目的
是
防。止NaCl冷却结晶析出
第7页/共16页
反馈练习
1.一水硫酸四氨合铜(Ⅱ)[Cu(NH3)4]SO4·H2O],制备路线为:
相关信息如下:
①[Cu(NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:
饱和 NH4HCO3溶液与饱和NaCl溶液混合 NH4HCO3+NaCl=NaHCO3↓+NH4Cl 或NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 应用实例:摩尔盐的制备
FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2•6H2O
第5页/共16页
结晶法的应用
例1.某混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解
第9页/共16页
第10页/共16页
阿司匹林的制备
第11页/共16页
感谢您的观看!
第16页/共16页
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。 ③[Cu(NH3)4]SO4·H2O在乙醇·水混合溶剂 中的溶解度随乙醇体积分数的变化曲线示
意图如右:
第8页/共16页
反馈练习
2.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,设计方案从氯化铵与硫酸 钠的混合溶液分离出氯化铵与硫酸钠?
、干燥。
蒸发浓缩、趁热过滤、冷却结晶、抽滤、洗涤
分离粗产品NaCl时承接滤液的烧杯中应加入少量蒸馏水,目的
是
防。止NaCl冷却结晶析出
第7页/共16页
反馈练习
1.一水硫酸四氨合铜(Ⅱ)[Cu(NH3)4]SO4·H2O],制备路线为:
相关信息如下:
①[Cu(NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:
饱和 NH4HCO3溶液与饱和NaCl溶液混合 NH4HCO3+NaCl=NaHCO3↓+NH4Cl 或NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 应用实例:摩尔盐的制备
FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2•6H2O
第5页/共16页
结晶法的应用
例1.某混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解
第9页/共16页
第10页/共16页
阿司匹林的制备
第11页/共16页
结晶技术PPT

过饱溶液
让我们再以谷氨酸一钠过饱和 溶解度曲线为例说明过饱和溶 液现象。 对处于60℃、70℃、80℃时, 对几种浓度谷氨酸钠饱和溶液 进行降温,使之进入过饱和状 态,仔细观察(借助放大镜) 降温过程中溶液微观变化(测 定结果见表1)。 用曲线把这些初始结晶和瞬间 微晶大量生成的温度各点连接 起来,便可得到图7的曲线α1 和α2(α2称过饱和溶解度曲 线)。 曲线α0是谷氨酸一钠饱和溶解 度曲线。曲线α0、α1、α2相 互大致平行。
这层境界膜就阻碍了 其他不稳定质点向晶 核靠近,不稳定的质 点只好通过扩散作用 来穿越界膜,而溶质 在溶液中的扩散作用 是由溶液间的浓度差 所决定。
可见晶体的生长是由溶液中溶质的
扩散和溶质在晶核晶格上排列2个 阶段组成,若溶质的扩散速度与溶 质排列的表面结晶速度相等,则结 晶的长大速度可用下式进行计算
晶体质点排列的三种位置
晶体长大时,溶液中质点的晶 核排列的位臵有三种,如图8所 示,①是对着三面凹角,该处 受三个最近的质点吸引,引力 最大。②对着两面凹角,该处 受两个最近质点的吸引,引力 较小。③对着一个面,仅受这 一质点的吸引,引力最小因此, 靠近晶核的不稳定点必然首先 排列于引力最大的(1)位臵上, 一个接一个,直至这一行列排 完,再排相邻一行的(2)位臵, 一个接一个,最后排完这一层 面网,再由(3)位臵排起另一 层面网,这样晶面就平行向外 推移长大。
不饱和区(溶解区) 曲线α0下方为不饱和溶液,无晶体析出 现象,外加晶体溶解 亚稳区 曲线α0和α2之间为略过饱和溶液,晶核 不会自动形成,但诱导可以产生,若有晶 体存在可以长大 过饱和区曲线 α2上方为过饱和溶液可以自然产生大量晶 核,晶体也可长大
第四章 相平衡

温度/℃
① 面:固相区、液相区、气相区,f = 1 - 1 + 2 = 2 ② 线:固-气平衡线、固-液平衡线、 液-气平衡线、过冷水-气平衡线 f = 1 - 2 + 2 = 1 ③ A:三相点,273.16 K,0.611 kPa 固-水(纯)-气(水蒸汽)三相平衡共存, f = 1 - 3 + 2 = 0 热力学温标:0和A之间分为273.16格,每一格为1 K, 1 K(Kelvin) = 1/273.16 冰点:101.325 kPa、273.15 K(0℃) 固-液(饱和空气的水溶液)-气(潮湿空气)三相平衡共存。 凝固点:一定外压下,固-液两相平衡时的温度。 B:临界点,647 K,2.2 × 104 kPa
蒸气压-组成图 沸点-组成图 熔点-组成图
一、单组分系统的相图 K = 1,f = 1 - Φ + 2 = 3 – Φ f = 0,Φ = 3;f = 2,Φ = 1
第二节 单组分系统
0.6106
0.6106
0.6106
0.0098
2.338
20
101.325
若B为易挥发组分: (1) B在气相中的浓度大于它在液相中的浓度。 (2) A在液相中的浓度大于它在气相中的浓度。
二、杠杆规则 物系点:表示系统状态的点。 相点:表示平衡系统中某一相状态的点。 (1) 单相区,物系点与相点重合;两相区,物系点与 相点分离。 (2) 自物系点做水平线与 气、液相线的交点为 相点。物系点垂直组 成轴变化,相点则沿 相线变化。
水的相图应用: 冷冻干燥:通过升华从冻结的样品中去除水分或溶剂。 优点:① 在较低温度下进行。 ② 可保留样品的化学结构、 营养成分、生物活性。 ③ 产品的复水性和速溶性好。 ④ 脱水彻底,利于长时间保 存和运输。 设备:生化用冷冻干燥设备。
① 面:固相区、液相区、气相区,f = 1 - 1 + 2 = 2 ② 线:固-气平衡线、固-液平衡线、 液-气平衡线、过冷水-气平衡线 f = 1 - 2 + 2 = 1 ③ A:三相点,273.16 K,0.611 kPa 固-水(纯)-气(水蒸汽)三相平衡共存, f = 1 - 3 + 2 = 0 热力学温标:0和A之间分为273.16格,每一格为1 K, 1 K(Kelvin) = 1/273.16 冰点:101.325 kPa、273.15 K(0℃) 固-液(饱和空气的水溶液)-气(潮湿空气)三相平衡共存。 凝固点:一定外压下,固-液两相平衡时的温度。 B:临界点,647 K,2.2 × 104 kPa
蒸气压-组成图 沸点-组成图 熔点-组成图
一、单组分系统的相图 K = 1,f = 1 - Φ + 2 = 3 – Φ f = 0,Φ = 3;f = 2,Φ = 1
第二节 单组分系统
0.6106
0.6106
0.6106
0.0098
2.338
20
101.325
若B为易挥发组分: (1) B在气相中的浓度大于它在液相中的浓度。 (2) A在液相中的浓度大于它在气相中的浓度。
二、杠杆规则 物系点:表示系统状态的点。 相点:表示平衡系统中某一相状态的点。 (1) 单相区,物系点与相点重合;两相区,物系点与 相点分离。 (2) 自物系点做水平线与 气、液相线的交点为 相点。物系点垂直组 成轴变化,相点则沿 相线变化。
水的相图应用: 冷冻干燥:通过升华从冻结的样品中去除水分或溶剂。 优点:① 在较低温度下进行。 ② 可保留样品的化学结构、 营养成分、生物活性。 ③ 产品的复水性和速溶性好。 ④ 脱水彻底,利于长时间保 存和运输。 设备:生化用冷冻干燥设备。
结晶与分离技术54页PPT

结晶与分离技术
11、获得的成功越大,就越令人高兴 。野心 是使人 勤奋的 原因, 节制使 人枯萎 。 12、不问收获,只问耕耘。如同种树 ,先有 根茎, 再有枝 叶,尔 后花实 ,好好 劳动, 不要想 太多, 那样只 会使人 胆孝懒 惰,因 为不实 践,甚 至不接 触社会 ,难道 你是野 人。(名 言网) 13、不怕,不悔(虽然只有四个字,但 常看常 新。 14、我在心里默默地为每一个人祝福 。我爱 自己, 我用清 洁与节 制来珍 惜我的 身体, 我用智 慧和知 识充实 我的头 脑。 15、这世上的一切都借希望而完成。 农夫不 会播下 一粒玉 米,如 果他不 曾希望 它长成 种籽; 单身汉 不会娶 妻,如 果他不 曾希望 有小孩 ;商人 或手艺 人不会 工作, 如果他 不曾希 望因此 而有收 益。-- 马钉路 德。
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
25、学习是劳动,是充
11、获得的成功越大,就越令人高兴 。野心 是使人 勤奋的 原因, 节制使 人枯萎 。 12、不问收获,只问耕耘。如同种树 ,先有 根茎, 再有枝 叶,尔 后花实 ,好好 劳动, 不要想 太多, 那样只 会使人 胆孝懒 惰,因 为不实 践,甚 至不接 触社会 ,难道 你是野 人。(名 言网) 13、不怕,不悔(虽然只有四个字,但 常看常 新。 14、我在心里默默地为每一个人祝福 。我爱 自己, 我用清 洁与节 制来珍 惜我的 身体, 我用智 慧和知 识充实 我的头 脑。 15、这世上的一切都借希望而完成。 农夫不 会播下 一粒玉 米,如 果他不 曾希望 它长成 种籽; 单身汉 不会娶 妻,如 果他不 曾希望 有小孩 ;商人 或手艺 人不会 工作, 如果他 不曾希 望因此 而有收 益。-- 马钉路 德。
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
25、学习是劳动,是充
2020届高考考点---结晶 课件 10张PPT

加热
3.冷却结晶
优点:工作效率 高,所得晶体比 较干燥
4.过滤:将析出
的晶体与母液分 离,可采取普通 过滤或抽滤。
4.观察溶解度曲线,溶解度随温度升高而 升高得很明显时,这个溶质叫陡升型 ( KNO3 ),反之叫缓升型( NaCl )。 当陡升型溶液中混有缓升型时,若要分 离出陡升型,蒸发浓缩,冷却结晶;若 要分离出缓升型的溶质,可以用蒸发结 晶、趁热过滤。
工艺流程分离提纯之结晶
1.蒸发结晶:通过加热蒸发溶剂,使溶液由不饱和变为过饱和溶液,
继续加热使溶质析出。蒸发结晶一般适用于溶解度受温度影响不大的 物质,常见的是NaCl。 工具原料铁架台、蒸发皿、玻璃棒、酒精灯、坩埚钳、石棉网
方法/步骤
步骤1:安装 好装置。
注意:调节蒸 发皿高度,以 便利用酒精灯 外焰加热。
多种溶质:目标溶质陡升型
目标物中含有少量杂质(一 加水溶解、蒸发浓缩、趁热过滤、
般至少结晶过一次)
冷却结晶再过滤或蒸发浓缩,冷却
结晶、过滤
1.【2017新课标3卷】 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁 矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备 流程如图所示:
(4)有关物质的溶解度如图所示。向“滤液 3”中加入适量KCl,蒸发浓缩,冷却结晶,
例如:当NaCl和KNO3的混合物中KNO3多而NaCl少时, 蒸发浓缩,冷却结晶,先分离出KNO3,氯化钠残留在 母液中。
例如:当NaCl和KNO3的混合物中NaCl多而KNO3少时,蒸发 结晶、趁热过滤。 ,先分离出NaCl,KNO3残留在母液中。
小结:以上四种操作经过一次结晶可能还混有杂质,多次操 作可进一步净化,这样的操作称之为重结晶,例如NaCl和 KNO3的分离提纯,苯甲酸的分离提纯
物质的分离与提纯(结晶) ppt课件

PPT课件
3
例1:KNO3、NaCl的溶解度随温度变化如图所示,思考 从混合溶液中提取KNO3晶体,需经历哪些步骤?
蒸发浓缩 趁热过滤 冷却结晶
溶
目的?
解
度
S
不纯? 重结晶
KNO3 NaCl
过滤
温度T
注意事项
①要使晶体洁净,应对晶体进行洗涤。
②要得到高纯度的晶体,可进行重结晶操作。即把晶
体用溶剂重新溶解,经过滤、蒸发、冷却等操作步骤后
(2)降温结晶(冷却结晶): 先将溶液蒸发浓缩后,再降低温度(冷却结晶)使溶液冷
却达到过饱和状态而使晶体析出。 适用于随温度变化溶解度P变PT课化件 大的物质,如KNO3等。2
方法 适用范围
蒸发 结晶
分离溶于 溶剂中的
溶质
装置
注意事项 ①玻璃棒的作用: 搅拌,防止液体局部过 ; 热而飞溅
②当有大量晶体析出时, 停止加热,利用_余__热_蒸 干而不能直接蒸干
PPT课件
6
问题3: 如何从硫酸铜溶液中得到硫酸铜晶体?
得到结晶水合物的方法:
蒸发溶液直至有晶膜出现→停止加热→降温结晶→过滤
PPT课件
7
归纳:结晶法制备物质的一般流程:
反应器中 合成制备 反应实验
结晶
分离
洗涤
干燥
从溶液中分离晶体的方法: 过滤、抽滤、倾析法等。
PPT课件
8
例2、以下是工业上用软锰矿制备高锰酸钾的一种工艺流
9
例3.下表是四种盐在不同温度下的溶解度(g/100g水)
10℃ 100℃
NaNO3 80.5 175
KNO3 21.2 246
NaCl 35.7 39.1
结晶技术原理PPT课件

影响接触成核的因素
• (1)过饱和度的影响 • (2)碰撞能量E的影响:碰撞的能量E越大产生的晶粒数越多。 • (3)螺旋桨的影响:螺旋浆对接触成核的影响最大,主要体现在
它的转速和桨叶端速度上。为了避免产生过量的晶核,螺旋桨总是 在适宜的低转速下运行。另外螺旋桨的材质对成核也有一定的影响。 软的桨叶吸收了大部分的碰撞能量,使晶核生成量大幅度减小(聚 乙烯桨叶与不锈钢桨叶相比,晶核的生成量相差4倍以上,也有晶 核的生成与材质无关的报道)。一般情况下,低转速时,桨叶材质 的影响要突出些。 • (4)晶体粒度的影响:同一温度下,小粒子较大粒子具有更大表 面能,这一差别使得微小晶体的溶解度高于粒度大的晶体。如果溶 液中大小晶粒同时存在,则微小晶粒溶解而大晶粒生长,直至小晶 粒完全消失。因此存在一个临界粒度值。晶体的粒度只有大于此临 界值,才能成为可以继续长大的稳定的晶核。 • 接触成核中晶核生成量与晶体粒度有着密切的关系。粒度小于某最 小值的晶体,其单个晶体的成核速率接近于零。粒度增大,接触的 频率和碰撞的能量增大,单个晶体的成核速率增大。超过某一最大 值后,接触的频率降低,成核的速率下降。当晶粒大于某一界限时, 晶粒不再参与循环而沉降在结晶器的底部。
与溶液之间的界面上液层的特性,影响溶质长入晶面。 • (2)杂质本身在晶面上吸附,产生阻挡作用。 • (3)如晶格有相似之处,杂质有可能长入晶体内。
第26页/共42页
七、结晶操作
• 连续结晶 • 分批结晶 • 但我国目前仍以分批为主
第27页/共42页
1、分批结晶的步骤
• ①结晶器的清洁 • ②加料到结晶器中 • ③产生过饱和度 • ④成核与晶体生长 • ⑤晶体的排除
结晶理论是通过无机盐的结晶现象研究发展起来的,但其 基本原理也适用于生物产物的结晶。但生物产物结晶的研 究历史较短,基础数据的积累较少,目前仍是重要的研究 课题。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
再分离、分解/还原。
6
4.1.3 盐析法
(1) 原理:在有机物的水溶液中加入大量的无机盐, 会使有机物溶解度减小而沉淀出来。
(2) 特点:不会破坏蛋白质、肽、酶等生物活性, 处理量大,操作方便。
(3) 盐的种类: ①盐析性盐:能使蛋白质水溶性减小的盐。 常用的有:Na2SO4、KH2PO4、Na2HPO4、(NH4)2SO4、
疏水基团(-ph,-CH3,-CHn,C=C)之间疏 水力增加,即蛋白质之间疏水力增大。
8
盐浓度(离子强度)与蛋白质溶解度的关系怎样衡量?
蛋白质溶解度与离子强度的关系: lgs=lgso - ks·I
式中:s为某离子强度下蛋白质的溶解度; so为I=0时蛋白质的溶解度;
pH值ks及是温盐度析有系关数;,它与蛋白质有关,还与盐的种类、
KOAC、NaOAc、NaCl
②盐溶性盐 :使蛋白质的溶解度反而增大。 常用的有:盐酸胍、脲、硫氰酸盐等(它们的加入
还会破坏蛋白质的活性)。
7
(4) 盐析性盐加入蛋白质水溶液中会产生两种影响
①使蛋白质溶解度增大。 因为:盐的离子与蛋白质的亲水基团(-OH,
COOH,-NH2)作用,降低蛋白质的活度系数。 ②使蛋白质溶解度减小。 因为:盐会破坏蛋白质表面水化膜,使蛋白质的
(1)理想的溶剂应符合下列条件: ① 不与被提纯物质起反应。 ② 样品中被提纯的组分在该溶剂中加热时溶解度
大而常温下溶解度小,这两者之差越大越好。 ③ 杂质在溶剂中溶解度大,可以留在母液中,不
会结晶出来;或者溶解度极小,很难溶于热溶 剂中而过滤除去。 ④ 溶剂容易挥发,使结晶容易干燥。 ⑤ 被重结晶的有机物可以得到好的晶体。
条件:①有机溶剂B与A必须有互溶性。 ②样品在有机溶剂B中微溶或不溶。
(2)溶剂的选择: ①溶质在水(A)中溶解度大,在有机溶剂(B)中不溶。 ②溶剂(B)与水(A)互溶。 ③溶剂与提取物无化学作用。 ④无毒性、价廉。
10
(3)应用
例子:高分子材料中“高聚物”与“添加剂”分 离。
高分子材料+溶剂 浓溶液不+ 断沉 搅淀 拌溶 ,剂 逐滴
样 品 溶 解 溶 液 趁 热 过 滤
固 体 杂 质
固 体
滤 液 冷 却固 体 + 液 体 过 滤( 纯 的 样 品 )
液 体
洗 涤干 燥测 熔 点产 品
( 含 杂 质 )
注意:①杂质溶解度越大②被提纯物在加热和常温下 溶解度差别越大 则重结晶的回收率越高。
12
4.2.2 溶剂的选择 (重结晶的关键)
I是离子强度。I=∑(MZ2)/ 2,M是离子摩尔数,Z
是对应离子的价数。
例如:提取麻黄碱、苦参碱。 向其中加入NaCl溶液,让其溶解度减小。 以提高有机溶剂萃取率。
9
4.1.4 有机溶剂沉淀法
(1)原理:样品为少量的浓溶液,溶剂为A,加入 大量与A相溶而与溶质不溶或微溶的有机溶剂B, 溶质的溶解度在有机溶剂A 中减小而析出。
2
4.1.1 重金属盐沉淀法(铅盐沉淀法)
(1) 原理:利用中性醋酸铅或碱式醋酸铅 在水或稀的醇溶液中能与许多物质生成 难溶的铅盐或络盐而得到分离。
①中性醋酸铅可以沉淀:有机酸、蛋白质、 氨基酸、鞣质、酸性皂甙、树脂及部分 黄酮甙等酸性或酚类物质。
②碱式醋酸铅沉淀:上述所有、甙类、糖 类及一些生物碱等碱性物质。
中 性 试 液 Pb(O AC)2
沉 淀水 洗 沉 淀 (Ⅰ )
洗 液
沉 淀水 洗
滤 液 (Ⅰ )碱 式 醋 酸 铅
沉 淀 (Ⅱ ) 洗 液
(3) 脱铅方法 :
滤 液 (Ⅱ )
①通H2S气体。(使沉淀转化为溶解度更小的PbS↓) ②加入强酸性阳离子交换树脂。(使铅离子转移到
树脂上)
③加入磷酸或稀硫酸。(使沉淀转化为Ksp小的
3
例如:具有二羟基结构的黄酮利用铅盐沉淀分离。
OH
O
OH
O
在中药的乙醇或甲醇提取液中加入饱和的中性 乙酸铅水溶液,可使具有邻二酚羟基或羧基的黄酮 类化合物沉淀析出。此↓悬浮于乙醇中,通入H2S 进行复分解,滤除硫化铅沉淀,滤液中可得黄酮类 化合物。
4
(2) 一个试样可以依次用中性醋酸铅、碱性醋酸 铅将试液的组分分成三部分:
添加剂+溶剂 +沉淀剂
高聚物 洗涤 纯品高聚物
丙酮 or 二甲亚砜 or N,N-二甲基甲酰胺
条件:与高聚物不溶解 用量:
且与前溶剂相溶 10倍以上高
性极好
分子溶液量
例:甲醇、乙醇
(4)缺点:①选择性不强 ②消耗大量溶剂。
11
4.2 重结晶
目的:纯化固体目标物
4.2.1 基本原理:
利用在一定溶剂中各种组分溶解度的不同和有机 物在加热、冷却时溶解度大、小不同的性质来除去少 量杂质的方法。即:
PbSO4↓orPb3(PO4)↓) 5
4.1.2 试剂沉淀法
加入某些特殊的试剂使目标物质沉淀出来
有机物中含: 鞣质—用明胶或蛋白质将其沉淀出来。 胰岛素—用Zn离子将其沉淀出来(二者形成复合物↓)。 生物碱—用某些沉淀试剂,使其生成不溶性复盐而↓出来。 蛋白质—调节pH=PI(等电点)使其↓出来。 橙皮甙、芦丁、黄苓甙、甘草皂甙—加酸可以使其↓出来 。 洋地黄皂甙—加甾体皂甙形成难溶的分子复合物→
13
(2)溶剂的选择 粗选:经验和“相似相溶”规则
表4-1 重结晶常用溶剂
溶剂名称
沸点℃
密度
溶剂名称
沸点℃
密度
水
100.0
1.00
乙酸乙酯
77.1
0.90
甲醇
64.7
0.79
二氧六环
101.3
1.03
乙醇
78.0
0.79
二氯甲烷
40.8
1.34丙酮56.1来自0.79二氯乙烷
83.8
1.24
乙醚
34.6
0.71
三氯甲烷
61.2
1.49
石油醚
30—60 60—90
0.68—0.72
四氯甲烷 硝基甲烷
76.8 120.0
1.58 1.14
环己烷
80.8
0.78
甲乙酮
第四章 结晶分离及升华技术
4.1 沉淀法及盐析法 4.2 重结晶 4.3 多步结晶 4.4 升华
1
4.1 沉淀分离法及盐析法
沉淀法:在试样中加入沉淀剂或改变pH值, 使所需的组分溶解度减小或者与沉淀剂形 成不溶物而沉淀出来的办法。
•沉淀过程 从任何均相流体中析出固体物质的过程。 •沉淀过程发生的必要条件 溶液体系对某种溶质是 过饱和的。 •使溶质达到过饱和的方法 ①冷却法。②蒸发法。 ③溶剂转化法。④盐析法。⑤反应沉淀分离法。
6
4.1.3 盐析法
(1) 原理:在有机物的水溶液中加入大量的无机盐, 会使有机物溶解度减小而沉淀出来。
(2) 特点:不会破坏蛋白质、肽、酶等生物活性, 处理量大,操作方便。
(3) 盐的种类: ①盐析性盐:能使蛋白质水溶性减小的盐。 常用的有:Na2SO4、KH2PO4、Na2HPO4、(NH4)2SO4、
疏水基团(-ph,-CH3,-CHn,C=C)之间疏 水力增加,即蛋白质之间疏水力增大。
8
盐浓度(离子强度)与蛋白质溶解度的关系怎样衡量?
蛋白质溶解度与离子强度的关系: lgs=lgso - ks·I
式中:s为某离子强度下蛋白质的溶解度; so为I=0时蛋白质的溶解度;
pH值ks及是温盐度析有系关数;,它与蛋白质有关,还与盐的种类、
KOAC、NaOAc、NaCl
②盐溶性盐 :使蛋白质的溶解度反而增大。 常用的有:盐酸胍、脲、硫氰酸盐等(它们的加入
还会破坏蛋白质的活性)。
7
(4) 盐析性盐加入蛋白质水溶液中会产生两种影响
①使蛋白质溶解度增大。 因为:盐的离子与蛋白质的亲水基团(-OH,
COOH,-NH2)作用,降低蛋白质的活度系数。 ②使蛋白质溶解度减小。 因为:盐会破坏蛋白质表面水化膜,使蛋白质的
(1)理想的溶剂应符合下列条件: ① 不与被提纯物质起反应。 ② 样品中被提纯的组分在该溶剂中加热时溶解度
大而常温下溶解度小,这两者之差越大越好。 ③ 杂质在溶剂中溶解度大,可以留在母液中,不
会结晶出来;或者溶解度极小,很难溶于热溶 剂中而过滤除去。 ④ 溶剂容易挥发,使结晶容易干燥。 ⑤ 被重结晶的有机物可以得到好的晶体。
条件:①有机溶剂B与A必须有互溶性。 ②样品在有机溶剂B中微溶或不溶。
(2)溶剂的选择: ①溶质在水(A)中溶解度大,在有机溶剂(B)中不溶。 ②溶剂(B)与水(A)互溶。 ③溶剂与提取物无化学作用。 ④无毒性、价廉。
10
(3)应用
例子:高分子材料中“高聚物”与“添加剂”分 离。
高分子材料+溶剂 浓溶液不+ 断沉 搅淀 拌溶 ,剂 逐滴
样 品 溶 解 溶 液 趁 热 过 滤
固 体 杂 质
固 体
滤 液 冷 却固 体 + 液 体 过 滤( 纯 的 样 品 )
液 体
洗 涤干 燥测 熔 点产 品
( 含 杂 质 )
注意:①杂质溶解度越大②被提纯物在加热和常温下 溶解度差别越大 则重结晶的回收率越高。
12
4.2.2 溶剂的选择 (重结晶的关键)
I是离子强度。I=∑(MZ2)/ 2,M是离子摩尔数,Z
是对应离子的价数。
例如:提取麻黄碱、苦参碱。 向其中加入NaCl溶液,让其溶解度减小。 以提高有机溶剂萃取率。
9
4.1.4 有机溶剂沉淀法
(1)原理:样品为少量的浓溶液,溶剂为A,加入 大量与A相溶而与溶质不溶或微溶的有机溶剂B, 溶质的溶解度在有机溶剂A 中减小而析出。
2
4.1.1 重金属盐沉淀法(铅盐沉淀法)
(1) 原理:利用中性醋酸铅或碱式醋酸铅 在水或稀的醇溶液中能与许多物质生成 难溶的铅盐或络盐而得到分离。
①中性醋酸铅可以沉淀:有机酸、蛋白质、 氨基酸、鞣质、酸性皂甙、树脂及部分 黄酮甙等酸性或酚类物质。
②碱式醋酸铅沉淀:上述所有、甙类、糖 类及一些生物碱等碱性物质。
中 性 试 液 Pb(O AC)2
沉 淀水 洗 沉 淀 (Ⅰ )
洗 液
沉 淀水 洗
滤 液 (Ⅰ )碱 式 醋 酸 铅
沉 淀 (Ⅱ ) 洗 液
(3) 脱铅方法 :
滤 液 (Ⅱ )
①通H2S气体。(使沉淀转化为溶解度更小的PbS↓) ②加入强酸性阳离子交换树脂。(使铅离子转移到
树脂上)
③加入磷酸或稀硫酸。(使沉淀转化为Ksp小的
3
例如:具有二羟基结构的黄酮利用铅盐沉淀分离。
OH
O
OH
O
在中药的乙醇或甲醇提取液中加入饱和的中性 乙酸铅水溶液,可使具有邻二酚羟基或羧基的黄酮 类化合物沉淀析出。此↓悬浮于乙醇中,通入H2S 进行复分解,滤除硫化铅沉淀,滤液中可得黄酮类 化合物。
4
(2) 一个试样可以依次用中性醋酸铅、碱性醋酸 铅将试液的组分分成三部分:
添加剂+溶剂 +沉淀剂
高聚物 洗涤 纯品高聚物
丙酮 or 二甲亚砜 or N,N-二甲基甲酰胺
条件:与高聚物不溶解 用量:
且与前溶剂相溶 10倍以上高
性极好
分子溶液量
例:甲醇、乙醇
(4)缺点:①选择性不强 ②消耗大量溶剂。
11
4.2 重结晶
目的:纯化固体目标物
4.2.1 基本原理:
利用在一定溶剂中各种组分溶解度的不同和有机 物在加热、冷却时溶解度大、小不同的性质来除去少 量杂质的方法。即:
PbSO4↓orPb3(PO4)↓) 5
4.1.2 试剂沉淀法
加入某些特殊的试剂使目标物质沉淀出来
有机物中含: 鞣质—用明胶或蛋白质将其沉淀出来。 胰岛素—用Zn离子将其沉淀出来(二者形成复合物↓)。 生物碱—用某些沉淀试剂,使其生成不溶性复盐而↓出来。 蛋白质—调节pH=PI(等电点)使其↓出来。 橙皮甙、芦丁、黄苓甙、甘草皂甙—加酸可以使其↓出来 。 洋地黄皂甙—加甾体皂甙形成难溶的分子复合物→
13
(2)溶剂的选择 粗选:经验和“相似相溶”规则
表4-1 重结晶常用溶剂
溶剂名称
沸点℃
密度
溶剂名称
沸点℃
密度
水
100.0
1.00
乙酸乙酯
77.1
0.90
甲醇
64.7
0.79
二氧六环
101.3
1.03
乙醇
78.0
0.79
二氯甲烷
40.8
1.34丙酮56.1来自0.79二氯乙烷
83.8
1.24
乙醚
34.6
0.71
三氯甲烷
61.2
1.49
石油醚
30—60 60—90
0.68—0.72
四氯甲烷 硝基甲烷
76.8 120.0
1.58 1.14
环己烷
80.8
0.78
甲乙酮
第四章 结晶分离及升华技术
4.1 沉淀法及盐析法 4.2 重结晶 4.3 多步结晶 4.4 升华
1
4.1 沉淀分离法及盐析法
沉淀法:在试样中加入沉淀剂或改变pH值, 使所需的组分溶解度减小或者与沉淀剂形 成不溶物而沉淀出来的办法。
•沉淀过程 从任何均相流体中析出固体物质的过程。 •沉淀过程发生的必要条件 溶液体系对某种溶质是 过饱和的。 •使溶质达到过饱和的方法 ①冷却法。②蒸发法。 ③溶剂转化法。④盐析法。⑤反应沉淀分离法。
