高中化学选修四化学平衡移动习题
高中化学选修4--化学平衡习题及答案解析

高中化学选修4--化学平衡习题及答案解析高中化学选修 4-化学平衡习题及答案解析一、单选题1、可逆反应 N₂(g) + 3H₂(g) ⇌ 2NH₃(g),在容积为 10L 的密闭容器中进行,开始时加入 2mol N₂和 6mol H₂,达平衡时,NH₃的浓度不可能达到()A 01mol/LB 02mol/LC 005mol/LD 015mol/L答案:B解析:假设 2mol N₂和 6mol H₂完全反应,生成 4mol NH₃,则NH₃的浓度为 04mol/L。
但这是一个可逆反应,不可能完全反应,所以 NH₃的浓度一定小于 04mol/L。
而 02mol/L 接近完全反应时的浓度,所以不可能达到。
2、一定条件下,将 NO₂与 SO₂以体积比 1:2 置于密闭容器中发生反应:NO₂(g) + SO₂(g) ⇌ SO₃(g) + NO(g) ,下列能说明反应达到平衡状态的是()A 体系压强保持不变B 混合气体颜色保持不变C SO₃和 NO 的体积比保持不变D 每消耗 1mol SO₃的同时生成 1mol NO₂答案:B解析:A 选项,该反应是一个气体分子总数不变的反应,压强始终不变,所以压强不变不能说明达到平衡状态。
B 选项,混合气体颜色不变,说明 NO₂的浓度不变,反应达到平衡状态。
C 选项,SO₃和 NO 都是生成物,且按照 1:1 生成,无论是否平衡,体积比始终保持不变,不能说明达到平衡。
D 选项,消耗 1mol SO₃的同时生成 1mol NO₂,都表示的是逆反应,不能说明正逆反应速率相等,不是平衡状态。
3、对于可逆反应:2A(g) + B(g) ⇌ 2C(g) △H < 0,下列各图正确的是()答案:A解析:A 选项,温度升高,平衡逆向移动,C 的百分含量降低,图像正确。
B 选项,增大压强,平衡正向移动,A 的转化率应该增大,图像错误。
C 选项,使用催化剂,只能改变反应速率,不能改变平衡状态,平衡时 C 的百分含量不变,图像错误。
高中化学选修4:化学平衡移动-专项练习

高中化学选修4:化学平衡移动-专项练习化学平衡巩固练习一、选择题1 .确认能发生化学平衡移动的是()OA .化学反应速率发生了改变B .有气态物质参加的可逆反应达到平衡后,改变了压强C .由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变D .可逆反应达到平衡后,使用催化剂 2.在一定条件下,下列可逆反应达到化学平衡 H 2 (g)+l 2 (g)^=2HI (g) △H >0,要使混合气体的紫色加深, 可以采取的方法是()OA .降温、减压B .降温、加压C .升温、加压D .升温、减压3 .对于可逆反应 mA (g)+nB • ---------- p C (g)+qD (其中A 和C 都是无色气体))。
A .增大压强,平衡不移动,说明(rn+n ) 一定等于(p+q )B .升高温度,A 的转化率减小,说明正反应是吸热反应C .若增加B 的量,平衡体系颜色加深,说明B 必是气体物质D .若B 是气体,增加 A 的量,A 、B 转化率都一定增大4 .右图是恒温下某化学反应的反应速率随反应时间变化的示意图。
下列叙述与示 意图不相符合的是()OA .反应达到平衡时,正反应速率和逆反应速率相等B .该反应达到平衡态I 后,增大生成物浓度,平衡发生移动,达到平衡态nC .该反应达到平衡态I 后,减小生成物浓度,平衡发生移动,达到平衡态nD .同一种反应物在平衡态I 和平衡态n 时浓度不相等5. 反应NH 4HS (S )^=NH 3 (g)+H 2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是 ()。
A .温度、容积不变时,通入 SO 2气体B .移走一部分 NH 4HS 固体C .容器体积不变,充入氮气D .保持压强不变,充入氮气6.在某温度下,反应:CIF (g)+F 2 (g)^=CIF 3 (g) △ H= — 268 kJ • mo 「1在密闭容器中达到平衡。
人教版高中化学选修四课时训练8化学平衡的移动Word版含解析

人教版高中化学选修四课时训练8化学平衡的移动Word版含解析一、化学平衡移动1.下列化学平衡一定发生移动的是( )A.平衡混合物中各组分的浓度发生改变B.正、逆反应速率发生改变C.组分中某物质的转化率发生改变D.体系的压强增大解析:对于有气体参加的气体体积不变的化学反应,若改变压强,各组分的浓度,正、逆反应速率,体系的压强均发生变化,但平衡并不发生移动,所以A、B、D三项错误。
答案:C2.对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是( )A.加入一种反应物B.升高温度C.对平衡体系增加压强D.使用催化剂解析:化学反应都有能量变化,其ΔH≠0,所以升高温度,化学平衡一定移动。
而加入固体物质、使用催化剂不能使化学平衡移动,对气体体积不变的反应改变压强,平衡不移动,故正确答案为B。
答案:B二、影响化学平衡移动的因素3.0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应FeCl3+3KSCNFe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是( )A.向溶液中加入少量KCl晶体B.向溶液中加入一定量KCl溶液C.向溶液中加少量AgNO3固体D.向溶液中滴加几滴1 mol·L-1 FeCl3溶液解析:FeCl3+3KSCNFe(SCN)3+3KCl反应的实质为Fe3++3SCN-Fe(SCN)3,因此Cl-的浓度对上述化学平衡无影响,A、C两项不符合题意;滴加几滴1 mol·L-1 FeCl3溶液,则c(Fe3+)增大,题述平衡向右移动,溶液颜色变深,D项不符合题意;向溶液中加入一定量KCl溶液,相当于将溶液稀释,Fe3+、SCN-、Fe(SCN)3的浓度均降低,使平衡向左移动,故溶液的颜色变浅,B项符合题意。
答案:B4.对于反应2NO2(g)N2O4(g) ΔH<0,增大压强(体积迅速减小),下列说法正确的是( )A.平衡逆向移动B.混合气体颜色比原来深C.混合气体颜色比原来浅D.混合气体的平均相对分子质量变小解析:对于2NO2(g)N2O4(g),增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动,A项错误;加压瞬间,混合气体的颜色变深,之后平衡正向移动,混合气体的颜色变浅,但比原平衡状态混合气体的颜色深,B项正确,C项错误;混合气体的平均分子量,,混合气体的质量不变,平衡正向移动,混合气体的物质的量减少,所以增大,D项错误。
苏教版高中化学选修4专题2化学平衡移动分类专题练习

化学平衡移动分类专题练习一、等效平衡、等效变换1、在一定温度下,把2 mol SO2和1 mol O2通入一定容积的密闭容器中,发生如下反应,,当此反应进行到一定程度时反应混合物就处于化学平衡状态。
现在该容器中维持温度不变,令a、b、c分别代表初始时加入的的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。
请填空:(1)若a=0,b=0,则c=___________。
(2)若a=0.5,则b=___________,c=___________。
(3)a、b、c的取值必须满足的一般条件是___________,___________。
(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)2、在一固定容积的密闭容器中充入2molX和1molY,发生反应:2X(气)+Y(气)aW(气),达到平衡后,W的体积分数为Φ。
若维持容器体积和温度不变,按0.6molX、0.3molY和1.4molW为起始物质,达到平衡后,W的体积分数仍为Φ,则a值为()A、1 B、4 C、 2 D、33、恒温、恒压下,在一个可变容积的容器中发生发应:A(气)+B(气)C(气)(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C物质的量为mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol 和3a mol,则x=mol,y=mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是。
4、在一个固定体积的密闭容器中,保持一定温度,进行以下反应,H2(气)+Br2(气)2HBr(气),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项),在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号(1)-(3)的状态,填写表中空白:5、在一个盛有催化剂溶剂可变的密闭容器中,保持一定温度和压强进行以下反应N2+3H22NH3。
高中化学苏教选修四同步练习:专题第节化学平衡的移动 含答案

专题二第3节化学平衡的移动(6)1、在其他条件不变的情况下,能使合成氨反应中氢气转化率增大的方法是( )A.升高温度B.减小压强C.使用催化剂D.及时分离出氨气2、下列变化一定会引起平衡移动的是( )①反应速率的变化②浓度的变化③各组分百分含量的变化④平均相对分子质量的变化⑤颜色的变化⑥混合气体密度的变化⑦转化率的变化⑧温度的变化A.①②⑥⑦⑧B.②④⑤⑥⑧C.②④⑤⑥⑦D.③④⑦⑧3、改变化学平衡体系中的一个条件后,某一生成物的浓度增大,则该平衡( )A.—定没有移动B.—定向正反应方向移动C.一定向逆反应方向移动D.移动方向无法确定4、在带活塞的圆筒内装入NO2气体,慢慢压缩,下列叙述正确的是( )A.体积减半,压强为原来的2倍B.体积减半,压强大于原来的2倍C.体积减半,压强增大,但小于原来的2倍D.体积减半,达到平衡后,n(NO2)变为原来的一半5、在一密闭容器中发生反应m A(g)n B(g)+n C(g),反应达到平衡后,保持温度不变,将容器体积压缩到原来的一半,当达到新平衡时,B和C的浓度均是原来的1.8倍,则下列叙述正确的是( )A.平衡向正反应方向移动B.物质A的转化率增大C.物质C的质量分数增加D.m<2n6、在一定条件下,发生反应CO(g)+NO2(g)CO2(g)+NO(g),达到化学平衡后,降低温度,混合物的颜色变浅.下列关于该反应的说法正确的是( )A.该反应为吸热反应B.该反应为放热反应C.降温后一氧化碳的浓度增大D.降温后各物质的浓度不变7、取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)N2O4(g) △H<0,反应相同时间后,分别测定体系中NO2的体积分数,并作出其随反应温度变化的关系图。
下列示意图中,可能与实验结果相符的是( )A. B.C. D.8、下列事实中不能用勒夏特列原理解释的是( )A.光照新制的氯水时,溶液的酸性逐渐增强B.向含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡,溶液颜色变浅或褪去C.加入催化剂有利于氨的氧化反应D.用排饱和食盐水法除去Cl2中的HCl9、下图表示一定条件下N2+3H22NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )A.加压B.升温C.加入催化剂D.增大反应物浓度10、某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)2C(g)达到平衡时,各物质的物质的量之比为n(A):n(B):n(C)=2:2:1。
选修4第二章可逆反应化学平衡移动习题(含答案))【复习准备】

可逆反应化学平衡移动习题1、某温度下,反应N2O4=2NO2 △H>0在密闭容器中达平衡,下列说法不正确的是( )A.体积减小时将使反应速率增大B.体积不变时加入少许NO2,将使正反应速率减小C.体积不变时加入少许N2O4,再度平衡时颜色变深D.体积不变时升高温度,再度平衡时颜色变深2、在A+B(s)=C反应中,若增加压强或降低温度,B的转化率均增大,则体系应是( )A、A是固体,C是气体,正反应吸热B、A是气体,C是液体,正反应放热C、A是气体,C是气体,正反应放热D、A是气体,C是气体,正反应吸热3、在一个固定体积的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:4X(g)+3Y(g) =2Q(g)+nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3,则该反应方程式中的n值是( )A、3B、4C、5D、64、[双选]在密闭容器中进行H2(g)+Br2(g)=2HBr(g)△H<0反应达到平衡后,欲使颜色加深,应采取的措施是( )A、升温B、降温C、增压D、减压5、在N2O4=2NO2平衡体系中,增大N2O4的浓度,则NO2和N2O4的物质的量比值,应( )A、增大B、减小C、不变D、可能减小也可能不变6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确是( )(1)生成物的质量分数一定增加(2)生成物的产量一定增大(3)反应物的转化率一定增大(4)反应物的浓度一定降低(5)正反应速率一定大于逆反应速率(6)使用了合适的催化剂A、(1)(2)B、(2)(5)C、(3)(5)D、(4)(6)7、在容积相同的A、B两密闭容器中,分别充入2molSO2和1molO2,使它们在相同温度下发生反应2SO2+O2=2SO3,并达平衡。
在反应过程中,若A 容器保持体积不变,B容器保持压强不变,当A中的SO2的转化率为25%时,则B容器中SO2的转化率应是( )A、25%B、>25%C、<25%D、12.5%8、在容积相同的两个密闭容器A和B中保持温度为423K,若同时向AB中加入a mol及bmol的HI 气体,且a>b,待反应:2HI(g)=H2(g)+I2(g),达到平衡时,下列说法正确的是( )A、从反应开始到平衡,所需时间t A<t BB、平衡时I2的浓度[I2]A=[I2]BC、平衡时I2蒸气在混合气体中的体积分数A 容器中的大于B容器D、HI的分解速率a A=a B9、一定混合气体在密闭容器中发生下列反应:mA(g)+nB(g)=pC(g),达到平衡后,于温度一定时,将气体体积缩小到原来的1/2,当达到新的平衡时,C 的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法中正确的是( )A、m+n>pB、A的转化率降低C、平衡向正反应方向移动D、C的体积分数增加10、在一个活塞式的反应容器中,通入2molSO2和1molO2,于500℃下发生化合反应并达到平衡,在保持恒温、恒压的条件下,再通入通入2molSO2和1molO2,下列叙述的内容完全正确的是( )A、V正增大,V逆减小,平衡向正反应方向移动,SO3的百分含量增加复习资料复习资料二、非选择题13.在10℃和2×105Pa 的条件下,反应aA(g)dD(g)+eE(g)建立平衡后再逐步增大体系的压强(温度不变)。
高中化学化学平衡、转化率、平衡移动练习题(附答案)

高中化学化学平衡、转化率、平衡移动练习题一、单选题1.一定量的2CO 与足量的碳在体积可变的恒压密闭容器中反应: 2C(s)+CO (g)2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(p 分)=气体总压(p 总)×体积分数。
下列说法正确的是( ) A.550℃时,若充入惰性气体,v 正、v 逆均减小,平衡不移动 B.650℃时,反应达平衡后2CO 的转化率为25.0%C.T ℃时,若充入等体积的2CO 和CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数p 24.0K p =总 2.可逆反应①X(g)+2Y(g)2Z(g)、②2M(g)N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。
反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是( ) A.反应①的正反应是吸热反应B.达平衡(Ⅰ)时体系的压强和反应开始时体系的压强之比为14:15C.达平衡(Ⅰ)时,X 的转化率为511D.在平衡(Ⅰ)和平衡(Ⅱ)中,M 的体积分数相等3.将物质的量均为3.00 mol 的气体A 、B 充入5 L 恒容密闭容器中,发生如下反应3A( g) + B( g)==C(g)他条件一定时,反应过程中C 的物质的量分数ϕ(C)随温度T 的变化曲线如图所示,下列有关说( )A.M点对应反应体系中反应速率v正=v逆B.该反应为放热反应C.X、Y两点对应反应体系中A物质正反应速率v( A)Y =v( A)xD.温度T<T0时,曲线上的点对应的反应未达到平衡4.向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g) c C(g) ΔH<0(有关数据如下表所示)。
测得两容器中c(A)随时间t的变化如图所示:A.x=1B.Q1=2Q2C.根据题中信息无法计算a值D.保持其他条件不变,起始时向乙容器中充入0.2mol A、0.2mol B、0.2mol C,则此时v正>v逆5.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)=SO3(g)+NO(g)达到平衡,在此过程中正反应速率随时间变化的曲线如图所示,由图得出的结论正确的是( )A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.若Δt1=Δt2,则SO2的转化量:a~b段小于b~c段6.在恒温恒容条件下,有反应:2A(g)+2B(g)C(g)+3D(g)。
人教版高中化学选修四图像及平衡移动问题
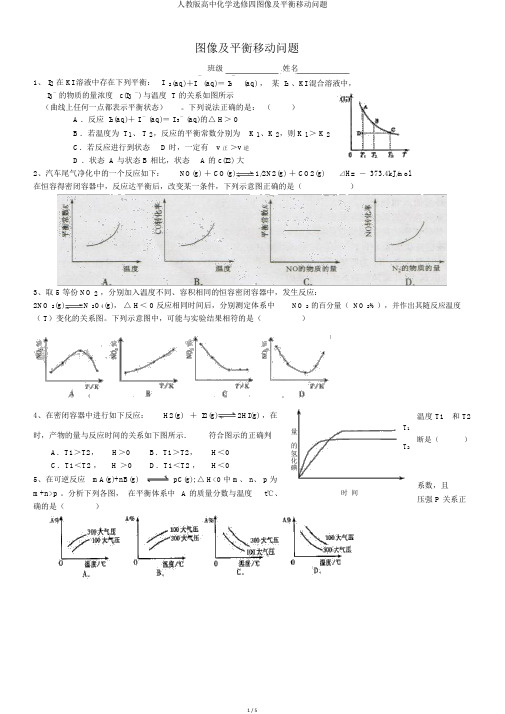
其中表示平衡混合物中
NH3的含量最高的一段时间是
②温度为T℃时,将2amolH2和amolN2放入0 .5L密闭容器中,充分反应后测得
N2的转化率为
50﹪。则反应
的平衡常数为
X+K]
③在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入
1molN2和3molH2,充分反应后,放出的热量
。
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
(1)若曲线A和B表示的是该反应在某不同条件下的反应
状况,则该不
同条件是
A.有、无催化剂
B.温度不同
C.压强不同
D.V值不同
(2)写出该反应的化学平衡常数
K的表达式:
,
并比较K800℃
K850℃(填“>”、“<”或“=”)。
(3)在图上作出在A条件下NO的变化曲线,并求算在
B条件下从反应开始至达到平衡,氧气的反应速率
______(填“<”“>”“=”,)92理由.4kJ是________ _________。&K]
17、在2 L密闭容器内,800℃时反应:2NO(g)+O2(g)
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
高中化学选修四化学平衡移动习题

高中化学选修四化学平衡移动习题The document was prepared on January 2, 2021%B tT 11P 、、T 1P 2、2T 2P 化学平衡移动例4.已知某可逆反应mA(g)+nB(g)pC(g) △H 在密闭容器中进行反应,测得在不同时间t 、温度T 和压强P 与反应物B 在混合气中的百分含量B%的关系曲线如图所示.下列正确的是( ) <T 2,P 1>P 2,m +n >P,△H >0 >T 2,P 2>P 1,m +n <P,△H >0 >T 1,P 2>P 1,m +n <P,△H >0 >T 2,P 2>P 1,m +n >P,△H <0练习4.对于可逆反应:A 2(g )+3B 2(g )2AB 3(g );△H <0下列图象中正确的是()3.某温度下,可逆反应m A(g)+n B(g)p C(g)的平衡常数为K ,下列对K 的说法正确的是( )A .K 值越大,表明该反应越有利于C 的生成,反应物的转化率越大B .若缩小反应器的容积,能使平衡正向移动,则K 增大C .温度越高,K 一定越大D .如果m +n =p ,则K =14将4molSO 2与2molO 2放入4L 的密闭容器中,在一定条件下反应达到平衡:2SO 2+O 22SO 3,测得平衡时SO 3的浓度为·L -1。
则此条件下的平衡常数K 为( ) A .4 B . C . D . 5.在一定温度下,反应H 2(g)+X 2(g)HX(g)的平衡常数为10。
若将的HX(g)通入体积为的密闭容器中,在该温度时HX(g)的最大分解率接近于( ) A .5% B .17% C .25% D .33%6在淀粉-KI 溶液中存在下列平衡:I 2(aq)+I -(aq)I(aq)。
测得不同温度下该反应的平衡常数K 如表所示:t /℃ 5 15 25 35 50 K 1100 841 689 533 409下列说法正确的是 ( )A .反应I 2(aq)+I -(aq)I(aq)的ΔH >0B .其他条件不变,升高温度,溶液中c (I)减小C .该反应的平衡常数表达式为K =D .25℃时,向溶液中加入少量KI 固体,平衡常数K 小于689 7.下列对化学平衡移动的分析中,不正确...的是()①已达平衡的反应C(s)+H2O(g)CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动②已达平衡的反应N2(g)+3H2(g)2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高③有气体参加的反应达平衡时,若减小体积时,平衡一定向气体体积增大的方向移动④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动A.①④B.①②③C.②③④D.①②③④11.在一定温度不同压强(P1<P2)下进行的可逆反应2X(g)2Y(g)+Z(g),生成物Z 在反应混合物中的体积分数(ψ)与反应时间(t)的关系图正确的是()12.对可逆反应N2(g)+3H2(g)2NH 3(g)△H <0,下列图像正确的是()13.反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示。
高中化学平衡移动习题和答案解析

化学平衡移动一、选择题1.压强变化不会使以下化学反响的平衡发生移动的是( )A.H2(g)+Br2(g)2HBr(g)B.N2(g)+3H2(g)2NH3(g)C.2SO2(g)+O2(g)2SO3(g)D.C(s)+CO2(g)2CO(g)【解析】对于气体体积不变的反响,改变压强时化学平衡不移动。
【答案】 A2.对于平衡CO2(g)CO2(aq) ΔH=-19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )A.升温增压 B.降温减压C.升温减压 D.降温增压【解析】正反响放热,要使平衡右移,应该降低温度;另外正反响为气体分子数减少的反响,所以为了增加CO2在水中的溶解度,应该增大压强,应选D。
【答案】 D3.在常温常压下,向5 mL 0.1 mol·L-1FeCl3溶液中滴加0.5 mL 0.01 mol·L-1的NH4S 溶液,发生如下反响:FeCl3+3NH4S Fe(S)3+3NH4Cl,所得溶液呈红色,改变以下条件,能使溶液颜色变浅的是( )A.向溶液中参加少量的NH4Cl晶体B.向溶液中参加少量的水C.向溶液中加少量无水CuSO4,变蓝后立即取出D.向溶液中滴加2滴2 mol·L-1的FeCl3【解析】从反响实质看,溶液中存在的化学平衡是:Fe3++3S-Fe(S)3,Fe(S)3溶液显红色,参加NH4Cl晶体,因为在反响中NH4+、Cl-未参与上述平衡,故对此平衡无影响;加水稀释各微粒浓度都变小,且上述平衡逆向移动,颜色变浅;CuSO4粉末结合水,使各微粒浓度变大,颜色加深;加2滴2 mol·L-1FeCl3,增大c(Fe3+),平衡正向移动,颜色加深(注意,假设参加FeCl3的浓度≤0.1 mol·L-1,则不是增加反响物浓度,相当于稀释)。
【答案】 B4.合成氨工业上采用了循环操作,主要原因是( )A.加快反响速率B.提高NH3的平衡浓度C.降低NH3的沸点 D.提高N2和H2的利用率【解析】合成氨工业上采用循环压缩操作,将N2、H2压缩到合成塔中循环利用于合成氨,提高了N2、H2的利用率。
化学平衡移动练习题(含答案)

第二章第三节化学平衡移动练习题(1)一、选择题1.对已达平衡状态的反应:2X(g)+Y(g)2Z(g),减小压强时,下列说法正确的是()A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动C.正、逆反应速率都减小,平衡向逆反应方向移动D.正、逆反应速率都增大,平衡向正反应方向移动2.在一定条件下,可逆反应:N 2(g)+3H2(g)2NH3(g) △H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是()A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数3.下列说法正确的是() A.可逆反应的特征是正反应速率总是和逆反应速率相等B.其他条件不变时,使用催化剂只改变反应速率,而不能改变化学平衡状态C.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态4.对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是()A.加入一种反应物 B.对平衡体系加压C.升高温度 D.使用催化剂5.对平衡CO 2(g)CO2(aq) △H= -19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()A.升温增压B.降温减压 C.升温减压D.降温增压6.2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。
合成氨反应在铁催化剂表面进行时效率显着提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是()A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动B.将氨气从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动C.升高温度可加快反应速率,且有利于平衡向合成氨的方向移动D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动7.关于催化剂的叙述,正确的是()A.催化剂在化学反应前后性质不变B.催化剂在反应前后质量不变,故催化剂不参加化学反应C.使用催化剂可以改变反应达到平衡的时间D.催化剂可以提高反应物的转化率8.对于可逆反应2A2(g)+B22B(1)(正反应为放热反应)达到平衡,要使正、逆反应的速率都增大,而且平衡向右移动,可以采取的措施是()A.升高温度B.降低温度C.增大压强D.减小压强9.在一容积固定的密闭容器中,反应 2SO2(g)+O2(g) 2SO3(g)达平衡后,再通入18O2气体,重新达平衡。
人教版高中化学选修四化学平衡的移动.docx

高中化学学习材料唐玲出品化学平衡的移动班级学号姓名一、选择题1、已知:H2(g)+I2(g)⇌ 2HI(g);△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。
欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是A.甲、乙提高相同温度B.甲中加入0.1 mol He,乙不变C.甲降低温度,乙不变D.甲增加0.1 mol H2,乙增加0.1 mol I22、下列说法正确的是A.水的三态熵值大小关系为:S(s) > S(l) > S(g)B.一定情况下,温度对反应的方向性起决定性作用C.2Al(S)+Fe2O3(S)==2Fe(S)+Al2O3(S)△S= -39.35 J·mol-1·K-1,可知反应不可能自发D.N2H4(l) + 2H2O2(l) = N2(g) + 2H2O(g)△H= -642.2 kJ·mol-1,可知N2和H2O可以成功制取N2H43、一定条件下存在反应:CO(g)+H 2O(g)CO2(g)+H2(g),其正反应放热。
现有三个相同的2L恒容绝热密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。
达到平衡时,下列说法正确的是A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ中CO 转化率与容器Ⅱ中CO2转化率之和小于1 C.容器Ⅰ、Ⅲ中反应的平衡常数相同D.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多4、温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl 5,反应PCl5(g)PCl3(g)+Cl2(g)经一段时间后达到平衡。
反应过程中测定的部分数据见下表,下列说法正确的是t/s 0 50 150 250 350n(PCl3)/mol 0 0.16 0.19 0.20 0.20A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·S-lB.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<OC.同温度下,起始时充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v(正)>v(逆)D.同温度下,起始时充人2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80% 5、相同温度下,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)2XY3(g)△H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示,下列叙述不正确的是A.容器①、②中反应的平衡常数相等B.容器①、②中达到平衡时各物质的百分含量相同C.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1D.若容器①体积为0.20L.则达平衡时放出的热量大于46.3kJ6、一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是7、在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是A.2NO+O22NO2 B.Br2(g)+H2 2HBrC.N2O42NO2D.6NO+4NH35N2+3H2O8、将3 mol A和1 mol B混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生如下反应:3 A(g)+ B(g) 2C(g)+D(g),达到平衡时C的浓度为w mol·L-1。
高中化学选修4化学反应平衡移动图像题

1、T℃时,A气体与B气体反应生成C气体。
反应过程中A. B. C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是(C)A. 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B. (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动C. T℃时,在相同容器中,若由0.3mol⋅L−1A、0.1 mol⋅L−1B和0.4 mol⋅L−1C反应,达到平衡后,C的浓度仍为0.4 mol⋅L−1D. 其他条件不变,升高温度,正逆反应速率均增大,且A的转化率增大【解答】由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A. B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,则反应的化学方程式为A+3B2C,则A. 在(t1+10)min时,保持其他条件不变,增大压强,平衡向正反应方向移动,故A错误;B. (t1+10)min,容器总压强不变,通稀有气体体积增大气体分压减小,则平衡向逆反应方向移动,故B错C. 从等效平衡角度考虑,T℃时,在相同容器中,若由0.3mol⋅L−1A、0.1 mol⋅L−1B和0.4 mol⋅L−1C反应,等效于0.5mol⋅L−1A、0.7 mol⋅L−1B,则为相同平衡状态,所以达到平衡后,C的浓度仍为0.4 mol⋅L−1,故C对D. 由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明生成温度平衡向逆反应方向移动,则A的转化率减小,故D错误。
2、反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是(D)。
A.10~15 min可能是加入了正催化剂B.10~15 min可能是降低了温度C.20 min时可能是缩小了容器体积D.20 min时可能是增加了B的量【解析】A. 根据图可知:10~15 min反应速率加快,所以可能加入了正催化剂,故A正确;B. 根据图可知:10~15 min反应速率加快,若降低温度,则不论正逆反应速率都要减小,故B错误;C. 若20min时缩小容器体积,物质的量浓度变大,但物质的量不变,但图示B的物质的量变大,故C错D. 20min时,A、C物质的量不变,B的物质的量变大,所以改变条件为:增加了B的量,故D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学选修四化学平
衡移动习题
Corporation standardization office #QS8QHH-HHGX8Q8-GNHHJ8
%
B t
T 11
P 、、T 1P 2、2T 2P 化学平衡移动
例4.已知某可逆反应mA(g)+nB(g)
pC(g) △H 在密闭容器中进行反
应,测得在不同时间t 、温度T 和压强P 与反应物B 在混合气中的百分含量B%
的关系曲线如图所示.下列正确的是( ) <T 2,P 1>P 2,m +n >P,△H >0 >T 2,P 2>P 1,m +n <P,△H >0 >T 1,P 2>P 1,m +n <P,△H >0 >T 2,P 2>P 1,m +n >P,△H <0
练习4.对于可逆反应:A 2(g )+3B 2(g )2AB 3(g );△H <0下列图象中
正确的是()
3.某温度下,可逆反应m A(g)+n B(g)p C(g)的平衡常数为K ,下列对K 的说
法正确的是( )
A .K 值越大,表明该反应越有利于C 的生成,反应物的转化率越大
B .若缩小反应器的容积,能使平衡正向移动,则K 增大
C .温度越高,K 一定越大
D .如果m +n =p ,则K =1
4将4molSO 2与2molO 2放入4L 的密闭容器中,在一定条件下反应达到平衡:2SO 2+
O 22SO 3,测得平衡时SO 3的浓度为·L -1。
则此条件下的平衡常数K 为( ) A .4 B . C . D . 5.在一定温度下,反应H 2(g)+X 2(g)HX(g)的平衡常数为10。
若将的HX(g)通入体积为的密闭容器中,在该温度时HX(g)的最大分解率接近于( ) A .5% B .17% C .25% D .33%
6在淀粉-KI 溶液中存在下列平衡:I 2(aq)+I -
(aq)I(aq)。
测得不同温度下该反应的平衡常数K t /℃ 5 15 25 35 50 K 1100 841 689 533 409
A .反应I 2(aq)+I -
(aq)I(aq)的ΔH >0
B .其他条件不变,升高温度,溶液中c (I)减小
C.该反应的平衡常数表达式为K =
D .25℃时,向溶液中加入少量KI固体,平衡常数K小于689
7.下列对化学平衡移动的分析中,不正确
...的是()
①已达平衡的反应C(s)+H2O(g)CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应达平衡时,若减小体积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
11.在一定温度不同压强(P1<P2)下进行的可逆反应2X(g)2Y(g)+Z(g),生成物Z 在反应混合物中的体积分数(ψ)与反应时间(t)的关系图正确的是()
12.对可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列图像正确的是()
13.反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示。
回答下列问题。
(1)该反应是____________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率______(填增大”“减小”或“不ABCD
变”),原因是。
(3)反应体系中加入催化剂对反应热是否有影响______,原因是
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:
E1_________,E2________(填“增大”“减小”或“不变”)。
14.(创新题)已知反应2CH3OH(g)CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质CH3OH CH3OCH3H2O
浓度/(mol·L-1)
(1)比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
(2)若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=____________;该时间内反应速率v(CH3OH)=____________;CH3OH的转化率为__________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)===CH3OH(g)。
CO在
不同温度下的平衡转化率与压强的关系如下图所示。
该反应ΔH________0(填“>”
或“<”)。
(4)比较实验4和实验1,可推知该反应是_________________反应
(填“吸热”或“放热”)。
11.已知反应①Fe(s)+CO2(g)FeO(s)+CO(g)ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g)ΔH=b kJ·mol-1;反应③Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)ΔH=c kJ·mol-1
温度/℃500 700 900
K
(1)若5002-的平衡浓度为________。
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700℃时反应①达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积B.通入CO2C.升高温度到900℃D.使用合适的催化剂
15、对于反应2SO
2(g)+O
2
(g)==2SO
3
(g),若在一定温度下,将的SO
2
(g)和(g)注入
一体积为2L的密闭容器中,当达到平衡状态时,测得容器中有的SO3(g)试求在该温度下
(1)此反应的平衡常数。
(2)求SO2(g)和O2(g)的平衡转化率
16、工业合成氨的反应为N
2(g)+3H
2
(g)==2NH
3
(g)。
设在容积为的密闭容器中充
入(g)和(g),反应在一定条件下达到平衡时,NH3的物质的量分数为4/7。
计算:①该条件下N2的平衡转化率;
②该条件下反应2NH
3(g)==N
2
(g)+3H
2
(g)的平衡常数
17、高炉炼铁中发生的反应有:FeO(s)+CO(g)==Fe(s)+CO
2
(g)△H<0
(1)该反应的平衡常数表达式K=____________
(2)已知1100℃时,K=温度升高,平衡常数K_______(增大,减少或不变)
(3)1100℃时,测得高炉中c(CO
2
)=L,c(CO)=L,在这种情况下该反应是否处于平衡状态______(填是或否),此时反应速率是v正_____v逆(填>,<,=)
18、反应SO
2(g)+NO
2
(g)==SO
3
(g)+NO(g),若在一定温度下,将物质的量浓度均为
2mol/L的SO
2(g)和NO
2
(g)注入一密闭容器中,当达到平衡状态时,测得容器中
SO
2
(g)的转化率为50%,试求:在该温度下。
(1)此反应的平衡常数。
(2)若SO2(g)的初始浓度增大到3mol/L,NO2(g)的初始浓度仍为2mol/L,则
SO
2(g)、NO
2
(g)的转化率变为多少
19在一定体积的密闭容器中,进行如下反应:
CO
2(g)+H
2
(g)CO(g)+H
2
O(g),其化学平衡常数K和温度t的关系如下表所
示:
⑴该反应化学平衡常数的表达式:K=;
⑵该反应为(填“吸热”或“放热”)反应;
⑶下列说法中能说明该反应达平衡状态的是
A、容器中压强不变
B、混合气体中c(CO)不变
C、混合气体的密度不变
D、c(CO)=c(CO
2
)
E、化学平衡常数K不变
F、单位时间内生成CO的分子数与生成H
2
O的分子数相等
⑷某温度下,各物质的平衡浓度符合下式:c(CO
2)×c(H
2
)=c(CO)×c(H
2
O),试
判此时的温度为。
