物理化学-第4章 相平衡
物理化学:第4章_多组分系统热力学_
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
物理化学-相平衡

= = =
p1 T1 m1 p2 T2 m2
(3) 相平衡:任一物质B各相化学势相等
m相1(B)=m相2(B) = ···=m相P(B) (P–1)等式
S 种物质存在 S(P-1) 关系,应扣 S(P-1)
恒 p 时,知 pA*(T) 和 pB*(T),可算 xB, yB
相平衡
典型相图 与p-x(y)图相比,形状相当于上下倒转
点: 单相区:如点a ,
相点与系统点一致
两相区:如点b,相
点与系统点不一致
线:气相线称露点线 液相线称泡点线
区域: 单相: P=1,F=2 两相: P=2,F=1
t/℃
110 C 100 90
形成固溶体时与液相类似。
注意: 某相存在的量很少可忽略时,则可不算。 如:凝聚系统不考虑气相。
相平衡
5. 相律F=C-P+2中的 2 表示系统T , p 可变
若T 或 p 之一不变时,只有1个强度量 可变,相律式变为
F = C-P + 1
二组分系统相图分析或凝聚系统 压力影响小可略时,常用此式。
相平衡
相平衡
本章要点
掌握:相律,单组分、双组分系统的典型 相图,杠杆规则的应用
相图:会分析,能画(稍难)
应用:多组分系统的分离、提纯 均匀性(多相性) 控制产品的质量
相平衡
5.1 相 律
问题:封闭 系统中影响相态的因素有哪些? 例如:盐与水系统达相平衡时存在多少相?
什么时候出现固相(盐析出)?为什么?
露
t
l+g 泡
点 线
第四章 相平衡热力学第二定律重庆大学物理化学教研室编物理化学答案第四章

第四章 相平衡4-1、指出下列各种体系侧独立组分数、相数和自由度数(1) 解:因为没有化学反应,也没有浓度得限制,所以独立组分数K =2(NaCL 和水);相数Φ=2(固相NaCL 和液相NaCL 溶液);因为是在指定得压力下,所以自由度f =K -Φ+1=2-2+1=1。
(2) 解:因为有化学反应,所以独立组分数K =3-1=2;相数Φ=3(两种固体和气体);自由度f =K -Φ+2=2-3+2=1。
(3) 解:因为有化学反应,而NH 3和H 2S 是任意量的,故没有浓度限制,所以独立组分数K =3-1=2;相数Φ=2(一种固体和气体);自由度f =K -Φ+2=2-2+2=2。
(4) 解:因为有化学反应和浓度限制(NH 4HS 部分分解),所以独立组分数-=3-1-1=1;相数Φ=2(一种固体和气体);自由度f =K -Φ+2=1-2+2=1。
(5) 解:独立组分数K =2;相数Φ=2(两种溶液);因为在指定的压力下,所以自由度f =K -Φ+1=1(6) 解:因为没有化学反应,所以独立组分数K =2;相数Φ=2(一种溶液和一种气体);因为是在指定的温度下,所以独立自由度f =K -Φ+1=14-2、右图为CO 2的平衡相图示意图,试根据该图回答下列问题:解:(1) 从相图可以看出在0℃时液化至少需要加3458 kPa 。
(2)为把汽化热移走,温度必须下降到-56.6℃以下。
(3)78.5℃可使固体CO2不经液化而直接升华。
题4-2图4-3、解:由题中的公式可得d ㏑p/dT =[14.323T -2-0.539/(2.303T)-0.009×10-3]×2.303 (1) 再由公式:2ln RTH dT p d m vap ∆= (2) 由式(1)、(2)可得蒸发热: △vap Hm =[14.323T -2-0.539/(2.303T)-0.009×10-3]×2.303RT 2 (3) 把温度带入公式可得:△vap Hm=106.01KJ/mol根据基尔霍夫定律:︒︒∆=⎥⎥⎦⎤⎢⎢⎣⎡∂∆∂p C T H )( … (4) ∴△C p =(-0.539T/2.303-0.009×10-3×2T)×R … (5) 把温度带入式(5)可得热熔差:△C p =-7.694J.mol -1K -14-4、解:V T H dT dp ∆∆=,两边进行定积分得:△=P VH ∆∆12T T Ln △=P mg/s=4104490-⨯=1.225×106Pa , V H ∆∆ =12311104.334ρρ-⨯=-3.01×1094kJ ·kg -1·m -3T1=273K, ∴T2=272K,温度要低于零下1度4-5、解:由已知条件:T 1=398.15K , P 1=101.325Kpa , P 2=233KPa再由公式: ⎪⎪⎭⎫ ⎝⎛-∆=211211ln T T R H p p m vap 得T 2=399K 此时水得沸点:t=299℃4-6、解:△=P V H ∆∆12T T Ln ,△=P =gh ρ10×9.8×14.6×103=1430.8×103Pa ∴T2=247.32K4-7、解:(2) 从图中作垂线可知泡点温度为110.2℃(3) 从图中作垂线可知露点温度为112.8℃(4) 经过105.0︒C 点作平行线,可知组成为y B =0.417, x B =0.544(5) 此体系中X B =0.769,由杆杆规则可得w (g )×(X B -y B )= w (l )×(x B -X B )而w (g)+w (l)= 39kg ,∴w (g )=12.31kg, w (l )=26.69kg (6) 从理论上说应该降低醋酸溶液得温度4-8解:线abc是三相平衡线,此时的相数为3,独立组分数为2,自由度为0区域1:熔液,此时的相数为2,独立组分数为2,自由度为1区域2:熔液和固体Pb,相数为3,自由度为2区域3:熔液和固体Sb,相数为3,自由度为2区域4:固体Pb和固体Sb,相数为2,自由度为14-9、解:从图中可以知道,这是形成稳定化合物体系。
物理化学相平衡知识点

物理化学相平衡知识点相平衡一、主要概念组分数,自由度,相图,相点,露点,泡点,共熔点,(连)结线,三相线,步冷(冷却)曲线,低共熔混合物(固相完全不互溶)二、重要定律与公式本章主要要求掌握相律的使用条件和应用,单组分和双组分系统的各类典型相图特征、绘制方法和应用,利用杠杆规则进行有关计算。
1、相律: F = C - P + n, 其中:C=S-R-R’(1) 强度因素T,p可变时n=2(2) 对单组分系统:C=1, F=3-P(3) 对双组分系统:C=2,F=4-P;应用于平面相图时恒温或恒压,F=3-P。
2、相图(1)相图:相态与T,p,x的关系图,通常将有关的相变点联结而成。
(2)实验方法:实验主要是测定系统的相变点。
常用如下四种方法得到。
12对于气液平衡系统,常用方法蒸气压法和沸点法;液固(凝聚)系统,通常用热分析法和溶解度法。
3、单组分系统的典型相图对于单组分系统C =1,F =C -P +2=3-P 。
当相数P =1时,自由度数F =2最大,即为双变量系统,通常绘制蒸气压-温度(p-T )相图,见下图。
pTlBC AOsgC 'pTlBCA Os gFGD单斜硫pT液体硫BCAO正交硫硫蒸气(a) 正常相图 (b) 水的相图(c) 硫的相图图6-1 常见的单组分系统相图4、二组分系统的相图类型:恒压的t -x (y )和恒温的p -x (y )相图。
相态:气液相图和液-固(凝聚系统)相图。
(1)气液相图根据液态的互溶性分为完全互溶(细分为形3成理想混合物、最大正偏差和最大负偏差)、部分互溶(细分为有一低共溶点和有一转变温度的系统)和完全不溶(溶液完全分层)的相图。
可以作恒温下的p -x (压力-组成)图或恒压下的t -x (温度-组成)图,见图5-2和图5-3。
t = 常数液相线气相线g + llgB Apx B (y B )t = 常数g + l液相线气相线g + llgB Apx B (y B )g + lg + lt = 常数液相线气相线lgBApx B (y B )(a) 理想混合物 (b) 最大负偏差的混合物 (c) 最大正偏差的混合物 图6-2 二组分系统恒温下的典型气液p -x 相图p = 常数液相线或泡点线气相线或露点线g + llgBAtx B (y B )p = 常数g + l液相线或泡点线气相线或露点线g + llg BAtx B (y B )g + lp = 常数液相线或泡点线气相线或露点线g + llgBAtx B (y B )(a) 理想或偏差不大的混合物 (b) 具有最高恒沸点(大负偏差) (c) 具有最低恒沸点(大正偏差)B在A液层中的溶解度线A在B液层中的溶解度线最高会溶点l 1 + l 2p = 常数lBAtx B最低会溶点B在A液层中的溶解度线A在B液层中的溶解度线最高会溶点l 1 + l 2p = 常数lBAtx B DCGFOgg + l g + ll 1 + l 2p = 常数lBAtx B (y B )(d) 有最高会溶点的部分互溶系统 (e)有最高和最低会溶点的部分互溶系统 (f) 沸点与会溶点分离4x B (y B )三相线COD ( l 1 +g + l 2)l 1DC GFOgg + lg + l l 1 + l 2p = 常数l 2B Atx B (y B )三相线COD ( g + l 1 + l 2)g + l 1l 1DC GFOgg + l 2l 1 + l 2p = 常数l 2BAtg + B(l )三相线COD [ A(l ) +g + B(l ) ]DCGFOgg + A(l )A(l ) + B( l )p = 常数BAtx B (y B )(g) 液相部分互溶的典型系统 (h)液相有转沸点的部分互溶系统 (i) 液相完全不互溶的系统图6-3 二组分系统恒压下的典型气液相图(2)液-固系统相图: 通常忽略压力的影响而只考虑t -x 图。
第4章相平衡复习题

第4章相平衡复习题1.水和盐B可以形成两种水合盐B·H2O和B·2H2O,恒压下与冰和盐水溶液平衡共存的固体水合盐为。
A. B·H2OB. B·2H2OC. B·H2O和B·2H2OD. 无法判定2.H2SO4与H2O 可形成H2SO4·H2O(s)、, H2SO4·2H2O(s)、 H2SO4·4H2O(s)三种水合物,在p0下,能与硫酸水溶液和冰达平衡的硫酸水合物最多可有几种 A. 3 B. 2 C. 1 D.03.25℃,NH4HCO3(s)在恒容真空容器中分解达平衡:NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g),该体系的组分数C = ,F* = 。
4.在描述恒沸混合物时,下列各点中哪一条不正确()A、恒沸点的F=0,是一个无变量点B、不具有确定的组成C、平衡时气相和液相组成相同D、其沸点随外压的改变而改变5. 关于三相点, 下面的说法中正确的是()A. 纯物质和多组分系统均有三相点B. 三相点就是三条两相平衡线的交点C. 三相点的温度可随压力改变D.三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点6. 在一定压力下,在A、B二组分的温度-组成图的最高(或最低)恒沸点处,气-液两相组成的关系为y B()x B,y B和x B分别为气、液两相组分B的摩尔分数。
A.大于B.小于C.等于D.变小二组分气-液平衡体系,若在某溶液中加入组分B,溶液的沸点将下降,则A在气相中的浓度和液相中的浓度谁大__和30℃时有100g由60﹪H2O及40﹪C6H5OH的所组成的体系形成上下两层溶液,在C6H5OH层中含有70﹪的C6H5OH,在H2O层中含有92﹪的H2O,试求两层的质量。
水层为_g,酚层为_____g.系统的相图如图所示。
①Ag3Sn是一种__ __化合物;②E点温度称为__ _,在此温度时对总组成位于EK间的某系统加热,则发生的变化为__③若由一定量的熔液冷却来制取纯Ag3Sn固体,则应使熔液的初始组成处于_ __之间;初始组成越接近__ ____,冷却温度越接近___ ____,可获得的纯Ag3Sn固体就越多。
华东理工大学《物理化学》课件4.1 两组分气液相图

f 22101 (T恒定)
L a LV
x3 x2 x1
y3
y2 y1
bV
xo
A-B二组分液态混合物恒温减压过程的变化
2.理想混合物的恒压相图 液相线(泡点线) 气相线(露点线) 液相面 气相面 气液共存面
C6H5CH3(A)——C6H6(B)
2.理想混合物的恒压相图
液相线(泡点线) 气相线(露点线) 液相面
nV nL
xo xL yV xo
ox yo
m1
m2
L1
L2
m2 L1 m1 L2
(A)甲苯—苯(B)
例 如有200molxB=0.500mol的C6H5CH3(A) —C6H6(B)混合 物,当压力为101.325kPa, 温度为95.3℃时,试计算闪蒸后
气液两相的数量。
解: 总组成点即图4–2的o点,由 图读得yV=0.621,xL=0.400,代入 式(4–1),
液相线:p ~ x,恒 温下蒸气压随液相组 成的变化。对理想溶 液来说是直线。
液相线
C6H5CH3(A)——C6H6(B)
1.理想混合物的恒温相图
pA p(1 yB ) pA* (1 xB )
pB pyB pB* xB
p pA* xA pB* xB
yA
yB
pA* pB* pB* ( pB* pA* ) yB
b
x2
y2 y1
x1
气相面
a
气液共存面
A-B二组分液态混合物恒压升温过程的变化
理想混合物的恒温相图
L+V L
V
恒压相图
C6H5CH3(A)——C6H6(B) C6H5CH3(A)——C6H6(B)
清华大学物理化学B-相平衡-2

在293.15 K、101325 Pa下:
83.6%B A
醇层 水层 B
8.5%B
共轭溶液
共轭溶液:两个平衡共存的液层
15 问:分层后继续加B, 两层的组成如何变化?
在一定的压力下,可测得水-异丁醇共轭溶液的组 成与温度的关系:
T/K 293.15 wB (水层) 8.5 wB (醇层) 83.6 333.15 373.15 393.15 406 9.3 70.2
所以两组分系统的相图通常用 指定温度的p-x 或 指定压力的T-x表示。
2
某一压力p下的组成分析:
p x yB p
* B B
p 指定温度T L
pA*
pB*
* y B pB xB p
g A xB (yB) → B
若pB*>pA* 即B为易挥发组分, pB*>p 可得: yB xB 结论:理想溶液中易挥发组分在气相中的含 量大于它在液相中的含量 p. y p x
6.6
77.2
14.0
61.5
37 37
16
最高临界溶解点(最高临界溶解温度Tc)
T/K
L
406 K
B在A中溶 解度曲线 A
L1+L2
B
A在B中溶 解度曲线
wB% 溶解度法绘制相图!
17 思考题:室温下,向A中逐渐加B,如何变化?
特别提醒:所有两相区平衡--统一!
对于指定的温度T1
两相区: 条件自由度 f*=2-2-0=0
(nl ng)xo nl xB ng yB
A
xB x0 yB
n ( ng ( yB xo ) l xo xB)
物理化学--相平衡状态图

φ =1,f=3 φ =2,f=2 φ =3,f=1 φ =4,f=0
最多3个独立变量(T, p, 该相组成) 最多4个相平衡共存(无变量)
指定温度, 则有压力-组成图 ; f ′ = 3- φ
指定压力, 则有温度-组成图 . f′= 3 - φ
9
二组分系统按液态互溶情况分类:
Hale Waihona Puke g(A+B) l(A+B)
气 O
C' B
0 0.01 100
• H2O的相图
• OA线是冰的熔点随压力变化曲线, 遵守克拉贝龙方程. 注意其斜率为 负值.
• 3个面分别是气, 液, 固单相区.
• 交点O是三相平衡点, 自由度数为0, 其温度比正常熔点高0.01K.
374.2• 从相图分析恒压变温和恒温变压 t/℃ 过程的相变化(见图).
两相平衡
三相平衡
水或冰的饱和蒸汽压/Pa 平衡压力 平衡压力
/MPa
/Pa
水⇔气 冰⇔气 冰⇔水 冰⇔水⇔气
⎯
103.4
199.6
⎯
(190.5)
165.2
161.1
⎯
285.8
295.4
115.0
⎯
421.0
410.3
61.8
⎯
611.0
611.0 611.0×10-6 611.0
2337.8
⎯
⎯
相平衡状态图
表示相平衡系统的性质(如沸点、熔点、蒸汽压、溶 解度)及条件(如温度、压力、组成等) 间函数关系 的图叫相平衡状态图,简称相图
按组分数: 单组分系统,双组分系统,三组分系统 按组分间相互溶解: 完全互溶,部分互溶,完全不互溶 按性质-组成: 蒸汽压-组成图, 沸点-组成图,熔点组成图,
第4章 习题答案(科学出版社)

第四章相平衡思考题1.什么叫自由度?相律的内容是什么?它能够解决什么问题?答:在不引起旧相消失和新相形成的前提下,可以在一定范围内独立变动的强度性质称为系统的自由度。
相律就是在平衡系统中,系统内相数、组分数、自由度数及影响物质性质的外界因素(如温度、压力、重力场、磁场、表面能等)之间关系的规律。
相律是一个定性规律,可以指示相平衡体系中有几个相,可以指导如何去识别由实验绘制的相图。
2.水的三相点与冰点是否相同?答:不相同。
纯水的三相点是气-液-固三相共存,其温度和压力由水本身性质决定,这时的压力为610.62Pa,温度为273.16K。
热力学温标1K就是取水的三相点温度的1/273.16K。
水的冰点是在大气压力下,水的三相共存点的温度。
由于冰点受外界压力影响,在105Pa压力下,温度下降0.00747K,由于水中溶解了空气,温度又下降0.0024K,所以在大气压力为105Pa时,水的冰点为273.15K 。
3.相点与物系点有什么区别?答:相点是相图中表示某平衡相组成的点。
从相点位置可看出该相的状态、组成、温度、压力等。
相点位置可随压力、温度的改变而改变。
在单组分系统的相图上,所有点全部是相点。
物系点是在多组分系统的相图上表示系统总组成的点,在单相区,物系点可与相点重合,而在两相区内只有物系点。
该物系所对应的两个相组成由两个相点表示。
在T-x图上,物系点可沿着与温度坐标平行的直线上下移动;在水盐系统图上,随着水的含量不同,物系点可沿着与组成坐标平行的直线左右移动。
4.单组分系统的三相点与低共熔点有何异同点?答:共同点:都是三相共存。
不同点:单组分系统的三相点是气-液-固三相共存,这时的自由度为零,它的压力、温度由系统自身性质决定,不受外界因素影响。
而二组分系统的低共熔点在等压的条件下自由度为零。
外压改变,低共熔点的温度和组成也会随之而改变。
5.米粉和面粉混合得十分均匀。
再也无法彼此分开,这时混合体系有几相?答:两相6.金粉和银粉混合后加热,使之熔融后冷却,得到的固体是一相还是两相?答:一相7.低共熔物能不能看作是化合物?答:不能。
第四章 相平衡

• 例 :在某温度下 , 体系中 PCl5(g)部分分解产生了一定量的 PCl3(g)
和Cl2(g) 并达到了化学平衡, 体系中独立的化学反应数R为多少?
组分数K是多少?
• 体系中只存在下面一个化学反应:
PCl5(g)= PCl3(g) + Cl2(g) • 该体系中独立的化学反应数R=1
• 该体系中物种数S=3
• 解: 有反应: S=3 R=1 R’= 1 分解反应平衡 [p(NH3)=p(H2S)] NH4HS(s) = NH3(g) + H2S(g)
∴
K=3-1-1=1
f = K- + 2=1-2 + 2=1
• 即此体系的温度和压力两变量中只有一个是独立的 . 体系的温度 固定时, NH4HS的分解压力一定,故体系的压力恒定; 反之,若体系 的压力一定,体系的温度必也被确定.
吉布斯相律
• 相律的物理含义是:
体系的自由度等于体系的独立组分数 K 减去相数 再加上环境变量数2(温度和压力).
• 在某些特殊条件下, 环境变量不仅仅为温度和压力, 可能 存在其它变量, 故相律更一般的可表达为:
f=K– +n
• 式中: f为体系的自由度;
K为组分数;
为相数;
n为环境变量数, 一般情况下n=2(T, p).
• 独立组分数(K), 简称为组分数, 指确定体系组成所必须
的变量数.
• 定义:
K=S-R-R’
• S:物种数, R:独立的化学反应数, R’:浓度限制数
• 独立的化学反应数 (R): 一个多相系统存在多个反应时 ,
• 浓度限制数(R’): 同一相中存在的浓度之间的关系。
独立的化学反应指不能由其他反应组合推导出来的反应.
物理化学(第三版)第4章相平衡

R=1 NH4HCO3(s) ƒ NH3(g) CO2 (g) H2O(g) R'=2 p(NH3)=p(CO2)
p(NH3)=p(H2O) p(CO2)=p(H2O) C=4-1-2=1
练习 : ⑴ 将PCl3(g)和Cl2(g)放在一真空容器中,达平衡后, C=?
答:容器内有PCl5(g)=PCl3(g)+Cl2(g) S=3,R=1,R’=0,C=3– 1– 0=2。
冰水混合物 P=2
PCl5 (g) ƒ PCl3(g) Cl2 (g) P=1
CaCO3(s) ƒ CaO(s) CO2 (g)
P=3
NH4Cl(s) ƒ NH3(g) HCl(g)
P=2
水、冰和水蒸气组成的系统
P=3
2. 物种数(S)和组分数(C)
(1)物种数 系统中所包含的化学物质的种类数。用S表示 例如, 系统中含有PCl3、PCl5、和Cl2三种物质 S=3
均匀混合
P=1
分为两层
P=2
分为三层
P=3
液体:P=1,2, 3 (视其互溶程度而定)
(3)固体 P=1,2,…
固溶体(固体溶液): P =1
铈锆固溶体
碳化钛-碳化钨固溶体粉末
固体:除固溶体之外,有几种物质就有几相 P=1,2…
注意:相数与数量无关,与破碎程度无关。 P =1
相和相数(P)
气体:P=1 无论包括多少中气体都是一相 液体:P=1,2, 3 (视其互溶程度而定) 固体:P=1,2,…,有几种物质就有几相(固溶体除外)
C(s)
1 2
O2
(
g)
ƒ
CO( g )
⑴
C(s) O2 (g) ƒ CO2 (g)
物理化学第四章

• 但碳的相图中最多只能三相共存,不可能四相共存.
一.克-克方程(Clausius-Clapeyron equation)
• 当单组分体系两相共存时,自由度f=3-2=1, 体系只有一个自由度。 • 单组分的相变温度与压力之间存在一定的关 系, 此关系即为克-克方程. • 设一纯物质在T,p下达两相平衡:
相图:表示体系状态变化的图形
•
• 相(phase): 体系内物理性质和化学性质
完全均匀的部分. • 均匀的要求: •
均匀到分子水平
• 一个体系中可以含有多个相,这些相与相 之间一般存在明显的界面,界面处体系的 热力学性质是间断的.
气体:凡气体成一相.
气体体系无论有多少种气体,一般都达到分子水 平的混合,故为一相。
• (3)式称为克拉贝龙方程. • 克拉贝龙方程适用于纯物质任何平衡相变过 程,应用范围很广.
• 1. 气-液,气-固两相平衡:
• 纯物质的两相平衡中有一相为气相,另一相必为 凝聚相. 以气-液平衡为例,有: • dp/dT=Hm/TVm= Hm/T(Vm,g-Vm,l) (4) • ∵ Vm,g>>Vm,l • ∴ Vm,g-Vm,l≈ Vm,g=RT/p • 代入(4)式: • dp/dT= Hm/[T(RT/p)] •
• 体系的独立变量数f(即自由度)应该等于总变量 数减去关系式总数: • 总变量数:S+2 • 关系式数:+S(-1) • •
f = S+2--S+S
f = S- + 2
(1)
• (1)式就是相律的数学表达式. • 相律的物理含义是:
体系的自由度等于体系的物种数S减去相 数再加上环境变量数2(温度和压力).
物理化学课件-相平衡

水的相图
E p B 冰 水
A C D T 气
水的相图
dp/dT=∆fusHm/∆fusVm ∆ ∆ E p
-20oC, 2.×108Pa × 临界点 374oC, × B 2.23×107Pa
冰
水
A C D T1 0.0098oC T 气
水的相图
AB 是气 液两相平衡线,即水的蒸气压曲线。它不能任意 是气-液两相平衡线 即水的蒸气压曲线。 液两相平衡线, 延长,终止于临界点 临界点p=2.2×107Pa,T=647K,这时 临界点。 延长,终止于临界点。临界点 × , , 液界面消失。 气-液界面消失。高于临界温度,不能用加压的方法使气体 液界面消失 高于临界温度, 液化。 液化。
f=K-Φ +2
相律是由吉布斯(Gibbs)1876年得到 1876年得到 相律是由吉布斯 1876 是自然界的普遍规律之一. 的,是自然界的普遍规律之一
相律推导
个组分, 个相.每个相中每种物质都存在 并没有化学反应. 每个相中每种物质都存在,并没有化学反应 设平衡系统中有K个组分 Φ 个相 每个相中每种物质都存在 并没有化学反应
µB(β) =µB θ(β)+ห้องสมุดไป่ตู้Tlna B(β) β β β
f=Φ(K-1)+2-K(Φ-1) 1 = KΦ-Φ+2-KΦ+K=K-Φ+2 Φ Φ
相律
如果指定了温度或压力: 如果指定了温度或压力 f*=K- Φ +1 1 f*称为条件自由度 如果考虑到 个因素的影响 则相 称为条件自由度,如果考虑到 个因素的影响,则相 如果考虑到n个因素的影响 律应写为: 律应写为 f*=K- Φ +n 在上述推导中假设每个组分在每个相中都有分配,如 在上述推导中假设每个组分在每个相中都有分配 如 中不含B 总变量中应减去一个变量,相 果某一相( 中不含 物质,总变量中应减去一个变量 果某一相 α)中不含B物质 总变量中应减去一个变量 相 应的化学势相等的等式中也减少一个,因此 因此,不影响相律的 应的化学势相等的等式中也减少一个 因此 不影响相律的 表达式. 表达式
4陶瓷物化第四章陶瓷相图详解

S% = MEE/SEE ×100% ;L% =MESE/SEE ×100%
(4) 离开TE :L 消逝,晶体A、B 完全析出。
2 生成一个全都熔溶化合物的二元系统相图
全都熔溶化合物是一种稳定的化合物,它与正常的纯物质一样具有 固定熔点,熔融时,所产生的液相组成与化合物组成一样,具有全 都熔融的特点。
冷却时,在E点:LE →A+C 在P点:LP+B →C
特点:转熔点P位于与P点液相平衡的两晶相C和B的组成点D、F的同侧。 化合物C的组成点在其液相线PE组成范围之外,不与液相线直接相交。
熔体2的析晶过程:
〔1〕T>TK: F=2,无新相
〔2〕TK≥T>TP: 析出晶相B,液相点KP,固相点M-F
第四章 陶瓷相图
相平衡:物质在多相体系中的平衡问题。
争论多相系统的状态〔如固态、液态气态等〕随着温度、
压力、组分浓度、电场、磁场等变量变化而变化的规律。一个多相系
统平衡时,自由能处于最低状态。
相图:反映系统在肯定组成、温度、压力的条件下,到达平衡状态时, 相的种类、数量和含量。
陶瓷组分与性能分析、设计,确定材料配方,选择陶瓷烧结温度, 选择烧结助剂等。
L A
L A
L1 [s1,(A)]
L2[s2,A]
p=2 f=1
p=2 f=1
L A+B p=3 f=0
E(液相消逝)[ME,A+B] p=2 f=1
[M3,A+B]
E[sE,A+(B)]
•杠杆规章
TA
M
TB
T1 S1
M1 L1
L
• 当一个旧相分为 两个新相时,各新相的
T2 S2 A+L M2 L2
物理化学(第五版) 演示文稿4-5 理想液态混合物和溶液的相平衡

解: 以100g混合物为计算基准
mFe
xFe
M Fe
mFe M Fe
mMn M Mn
99.00 / 55.85 99.00 1.00 55.85 54.93
0.9898
x(Fe)=0.9898; x(Mn)=0.0102 p(Fe)=p*Fe x(Fe)=133.3Pa 0.99=132Pa p(Mn)=p*Mn x(Mn)=101325Pa0.0102=1033Pa p = p(Fe) + p(Mn)=1165Pa y(Fe)=p(Fe)/p=132Pa/1165Pa=0.113 y(Mn) =1-0.113 = 0.887
T
b
T
b
T
b
T
b
当溶液很稀时, -lnxA= -ln(1-xB) xB ,
而且当 Tb与Tb* 相差不大时, TbTb* Tb* 2
又令 Tb = Tb – Tb* , 则:
xB
vap H m ,A R(Tb* )2
Tb
对于稀溶液:
xB = nB / nA= nBMA / mA = bBMA
RT ln
pA* p
A
A (g) A
RT ln
pA p
* A
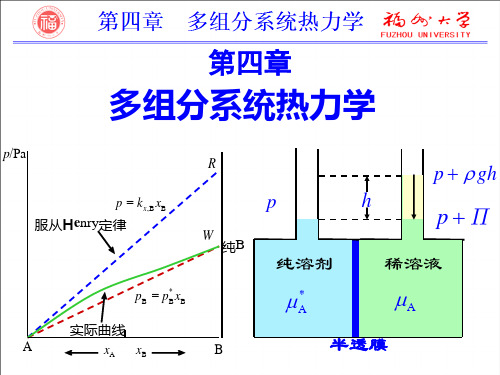
A
半透膜
pA* pA
* A
A
称为渗透压,阻止水分子渗透必须外加的最小压力。
若外加压力大于渗透压,水分子向纯水方渗透,
称为反渗透,可用于海水淡化、污水处理等。
Π cBRT —范特荷夫公式
(仅适用于稀溶液)
诺贝尔化学奖
首位得主
van't Hoff (1852-1911) , 荷兰
A(g, T, p)
物理化学-第四章相平衡

所以 C=1 单组分系统
例2. 碳在氧气中燃烧,有如下方程:
(1) C(s)+O2 (g)=CO2 (g)
(2)
C(s)+
1 2
O2
(g)=CO(g)
因为(3)=(1) - (2) 所以 R=2
1 (3) CO(g)+ 2 O2 (g)=CO2 (g)
S = 4, R’=0, 则 C=4-2=2 二组分系统
面
两相平衡: P=2 f=1 一个独立变量
线
三相平衡: P=3 f=0 无变量
点
p
B
冰
水A
①三条线:OA, OB, OC
D
O气
C
水的局部相图示意
三个区:单相区
三相点(triple point):
T O点:三相共存,f = 0,
0.0099℃, 610.6 Pa 与冰点不同
OA:g-l共存,水的饱和蒸汽压曲线
S = 3, R = 1, R’ = 0,则 C=3 -1=2
注意:对于浓度限制条件,是固定不变的浓度关系。
2. 自由度和自由度数(f) (the number of freedom degree)
如何描述一个相平衡系统的状态(平衡性质)?
p1
p2
H2O(l) T1
H2O(g)
H2O(l) T2
相平衡的一个重要性质是它与各相中物质的量无关。 一个多相系统的相平衡状态是由体系的强度性质决定 的。例如 pv , Tb , Tf , 溶解度等。
d
ln p /[ p] dT
gc d H m RT 2
(1) 条件:纯物质g-l(s) 平衡,
(近似:忽略Vm (cd),理想气体) (2) 若近似gcdHm不随T变化,则
《物理化学》第四章(相平衡)知识点汇总

第四章:相平衡
第四章 相平衡 相律
温度或压力都没有指定时,相律表达式为:
f K 2
如果指定了温度或压力,则相律表达式为:
f K 1
55
克劳修斯-克拉珀龙方程 液-气平衡
ln p Vap H m RT K
p2 Vap H m 1 1 ln ( ) p1 R T1 T2
60
最大负偏差非理想完全互溶双液系统体系
在p-x图上,p与拉乌 等温 尔计算值相比为负, 且在某一组成范围内, p < pA*, p有最小值。
液
p
气
在T-x图,与压力最
小值相对应,出现 了具有最高恒沸点 的最高恒沸物。
Aa
xBbΒιβλιοθήκη B气左侧:yB<xB 右侧:yB>xB
A
T
液
xB
B
A
a x B
b
B
完全不互溶的双液系统
y
z R
冰+(NH4)2SO4
E
H2O
m B%
(NH4)2SO4
二、生成化合物的相图
1.生成稳定化合物的相图 C6H5OH与C6H5NH2 化合物C C6H5OH∙C6H5NH2
C C+L
L(熔化物)
T/k
能生成具有固定熔点
A+L E1
C+L B+L B+C E2 B
C6H5NH2
A+C
A
C6H5OH
最大正偏差非理想完全互溶双液系统体系
在p-x图上,p与拉乌 尔计算值相比为正, 且在某一组成范围内, p >pB*, p有最大值。
物理化学__华东理工大学(6)--单元测试卷

第四章 相平衡单元测试卷一、选择题(每小题1分,共30分)1. 只要知道纯物质的饱和蒸汽压与温度的定量关系,即可得到二元混合物气液平衡相图的是 。
A :实际溶液;B :理想溶液;C :理想稀溶液2. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :液相线示意了溶液的蒸气压随液相组成的变化关系;B :液相线为直线是理想混合物的一个特征;C :液相线为泡点线3. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :气相线示意了溶液的蒸气压随气相组成的变化关系;B :气相线为曲线;C :气相线为露点线4. 对于二元理想混合物的气液平衡相图(恒压),以下说法不正确的是 。
A :液相线为泡点线,气相线为露点线;B :液相线示意了沸点随液相组成的变化;C :液相线为直线5. 如二元混合物气液平衡相图中出现正偏差时,下列正确的说法是 。
A : i i i x p p *<;B :正偏差强烈时,可形成最高恒沸混合物;C :正偏差强烈时,可形成最低恒沸混合物6. 如二元混合物气液平衡相图中出现负偏差时,下列正确的说法是 。
A : *i i i p p x >;B :负偏差强烈时,可形成最低恒沸混合物;C :负偏差强烈时,可形成最高恒沸混合物7. 二元混合物气液平衡相图中出现正偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :第二种物质的加入使分子的缔合程度降低;C :溶液中不同组分分子间的相互吸引比纯物质弱8. 二元混合物气液平衡相图中出现负偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :不同组分间生成氢键而相互缔合;C :溶液中不同组分分子间的相互吸引比纯物质弱9. 关于恒沸混合物,不正确的说法是 。
A :恒沸混合物是一种具有确定组成的化合物;B :恒沸混合物并不是一种具有确定组成的化合物;C :在恒沸点,泡点线与露点线重合10. 二元系的气液平衡相图(恒压)中,恒沸点的自由度为 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上一内容 下一内容 回主目录
返回
5.1 相律——基本概念
相(phase) 体系内部物理和化学性质完全均 匀的部分称为相。相与相之间在指定条件下有明 显的界面,在界面上宏观性质的改变是飞跃式的。
体系中相的总数称为相数,用 F 表示。
气体,不论有多少种气体混合,只有一个气相。
液体,按其互溶程度可以组成一相、两相或三 相共存。有一个液层就有一项。 固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。
三条两相平衡线 F =2, f=1 ,压力与温度只能改
变一个,指定了压力,则温度由体系自定。
上一内容 下一内容 回主目录
返回
水的相图
上一内容 下一内容 回主目录
返回
水的相图
OA 是气-液两相平衡线,即水的饱和蒸气压曲线 (沸点曲线)。
恒温加压 恒压降温 可使水蒸气凝结为水 恒温减压 恒压升温 可使水蒸发为水蒸气
上一内容 下一内容 回主目录
返回
5.1 自由度
自由度(degrees of freedom) 确定平衡体系的
状态所必须的独立强度变量(T、P)的数目称为自
由度,用字母 f 表示。这些强度变量通常是压力、 温度和浓度等。
上一内容 下一内容 回主目录
返回
相律
相律(phase rule)
f=C-F+2
第四章 相平衡
上一内容 下一内容 回主目录
返回
物理化学电子教案
上一内容 下一内容 回主目录
返回
引言
相平衡是热力学在化学领域中的重要应用之一。 研究多相体系的平衡在化学、化工、制药的科研和 生产中有重要的意义,例如:溶解、蒸馏、重结晶、 萃取、提纯等方面都要用到相平衡的知识。
相图(phase diagram) 表达多相体系的状态如何 随温度、压力、组成等强度性质变化而变化的图形, 称为相图。
上一内容 下一内容 回主目录
返回
Clausius-Clapeyron方程
Clapey两相平衡时压力随温度的变化 关系可由Clausius- Clapeyron方程求得。
Vm(g) = RT/p 利用克-克方程可以计算液体在不
dlnp dT
vapHm RT 2
同温度下的蒸气压或不同外压下的 沸点、摩尔汽化热等
定积分
ln p2 p1
ΔvapHm R
1 T2
1 T1
P71 例4
上一内容 下一内容 回主目录
返回
单组分体系——水的相图
水的相图是根据实验绘制的。图上有:
三个单相区 在气、液、固三个
单相区内,F =1, f=2 ,温度和
压力独立地有限度地变化不会引起 相的改变。
上一内容 下一内容 回主目录
返回
物种数和组分数
独立组分数(number of independent component ) 足以表示平衡体系中各相的组成所需要的最少物种数 (S),简称为组分数,用符号C来表示。
应当指出,组分数和物种数是两个不同的概念,在 数值上二者有时相等,有时不相等。
体系中每一种物质都称为一个物种。当体系内 各物质之间不存在相互关系时,体系的物种数和 组分数是相同的。例如:葡萄糖的水溶液中,葡 萄糖和水都是物种,这个体系中S = C = 2。
上一内容 下一内容 回主目录
返回
物种数和组分数
若体系中某些物质间存在着化学反应,则物种数 和组分数就不相同。如N2,H2和NH3三种气体在常温下 混合时,并不发生化学反应,此时体系的组分数和物
种数相同,即S=C=3。 但如果在高温高压并有催化剂
存在的情况下,体系内就要发生下述反应
N2 + 3H2==2NH3间存在关系式Kp=p2NH3/[pN2·p3H2]
即: f + F = C + n
上一内容 下一内容 回主目录
返回
5.2 单组分体系的相平衡
相点
表示某个相状态(如相态、组成、温度
等)的点称为相点。
物系点 相图中代表体系总组成和温度(或压力) 的点,即表示体系总状态的点称为物系点。在T-x图 上,物系点可以沿着与温度坐标平行的垂线上、下 移动。
在单相区,物系点与相点重合;在两相区中, 只有物系点,它对应的两个相的组成由对应的相点 表示。
相律是相平衡体系中揭示相数F ,独立组分数C和
自由度 f 之间关系的规律,可用上式表示。式中2
通常指T,p两个变量。相律最早由Gibbs提出,所 以又称为Gibbs相律。对于指定了T或p一个变量的
体系,f * = C - F + 1, f * 称为条件自由度。
如果除T,p外,还受其它力场影响,则2改用n表示,
S=3, C=3-1-1=1。 综上所述,体系的组分数可用下面的关系式表示
C=S-R-R′
上一内容 下一内容 回主目录
返回
独立组分数
独立组分数(number of independent component)
定义: C S R R'
在平衡体系所处的条件下,能够确保各相组成 所需的最少独立物种数称为独立组分数。它的数值 等于体系中所有物种数 S 减去体系中独立的化学平 衡数R,再减去各物种间的浓度限制条件R'。
它不能任意延长,终止于临界点。临界点 T 647 K , p 2.2107 Pa ,这时气-液界面消失。高于 临界温度,不能用加压的方法使气体液化。
其中任何一种物质在平衡时的含量可由其它两种物质
的含量通过平衡关系式的计算获得,因此S=3,C=2。体
系中每存在一个独立的反应,其组分数就比物种数少
一个,若有R个独立的反应,其组分数C=S-R
上一内容 下一内容 回主目录
返回
物种数和组分数
若体系中存在着浓度限制条件,则每存在一个,组
分数就比物种数少一个。存在着R′个浓度限制条件, 则组分数就应为S-R′个。如在上述的反应体系中,人 为地让N2和H2的起始浓度的比为1∶3,或让体系开始 时只有NH3,然后让其分解达到平衡,则在这个平衡 体系中,N2和H2的浓度有一定的关系(1∶3),R′=1, 独立组分数又减少一个,所以整个体系中
上一内容 下一内容 回主目录
返回
5.2 单组分体系的相图
单组分体系的相数与自由度
C=1 f = C - F + 2 f = 3-F
当 F=1 F=2 F=3
单相 两相平衡 三相共存
f 2 双变量体系 f 1 单变量体系 f 0 无变量体系
单组分体系的自由度最多为2,双变量体系 的相图可用平面图表示。
